Катализатор конверсии оксида углерода водяным паром на основе соединений типа перовскита и шпинели
Курочкин Вадим Юрьевич
«Катализатор конверсии оксида углерода водяным паром на основе соединений типа перовскита и шпинели»
Специальность 05.17.01 – Технология неорганических веществ
Д. 212.063.02
Ивановский государственный химико-технологический университет,
153000, г. Иваново, пр. Ф.Энгельса, 7.
Тел.: (4932) 32-54-33
Email: [email protected]
Предполагаемая дата защиты – 26 января 2009 года.
На правах рукописи
КУРОЧКИН Вадим ЮРЬЕВИЧ
КАТАЛИЗАТОР КОНВЕРСИИ ОКСИДА УГЛЕРОДА ВОДЯНЫМ ПАРОМ НА ОСНОВЕ СОЕДИНЕНИЙ ТИПА ПЕРОВСКИТА И ШПИНЕЛИ
Специальность 05.17.01
Технология неорганических веществ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата технических наук
Иваново 2008
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Ивановский государственный химико-технологический университет» на кафедре Технологии неорганических веществ
Научный руководитель: доктор технических наук, профессор
Ильин Александр Павлович
Официальные оппоненты: доктор технических наук, доцент
Степанов Евгений Геннадьевич
доктор технических наук, ст. научный сотрудник
Кочетков Сергей Павлович
Ведущая организация:: ГОУ ВПО Дзержинский политехнический институт (филиал) Нижегородского государственного технического университета, г. Дзержинск.
Защита состоится «26» января 2009 г. в « » час. на заседании совета по защите докторских и кандидатских диссертаций Д. 212.063.02 при Государственном образовательном учреждении высшего профессионального образования «Ивановский государственный химико-технологический университет» по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 7, ауд. Г-205
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО ИГХТУ по адресу: 153000, г. Иваново, пр. Ф. Энгельса, 10.
Автореферат разослан « » декабря 2008 г.
Ученый секретарь Совета Гришина Е.П.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы диссертации. Технический прогресс химической, нефтехимической и нефтеперерабатывающей промышленности тесно связан с применением катализаторов. В последние годы в связи с возросшим интересом к водородной энергетике особенно велика потребность в катализаторах, применяемых в производстве водорода и водородсодержащих газов методом конверсии углеводородного сырья. В агрегатах производства аммиака на стадии среднетемпературной конверсии оксида углерода водяным паром применяют железохромовые катализаторы, состав и технология которых существенно не изменялись в течение многих лет. Кроме того, недостатком существующих методов приготовления является присутствие значительного количества серы, использование в качестве одного из компонентов токсичного хромового ангидрида, а также недостаточно высокие физико-химические характеристики получаемых контактов. В настоящее время имеется большое количество литературных данных по ферритам со структурой перовскита и шпинели, которые интенсивно исследуются благодаря уникальности их физических и химических свойств. Поиск недефицитного сырья и повышение эффективности его использования в производстве промышленных катализаторов является одним из важнейших направлений в усовершенствовании технологии катализаторов. Оксид железа – основной компонент катализаторов для процесса конверсии монооксида углерода. Наиболее распространенный метод получения активного оксида железа базируется на совместном осаждении из растворов солей нерастворимых в воде соединений железа с последующим термическим разложением этих продуктов. Основным недостатком этого метода является большой расход реагентов, необходимость строгого контроля параметров осаждения, наличие значительного количества сточных вод. Применяя металлические порошки в качестве сырья для приготовления катализаторов, можно избежать загрязнения синтезируемого продукта, сократить число энергоемких стадий, обеспечить высокую экономичность и экологичность технологического процесса.
Диссертационная работа выполнялась в соответствии с научным направлением «Гетерогенные и гетерогенно-каталитические процессы на основе дисперсных металлоксидных систем», а также тематическим планом НИР ИГХТУ.
Цель работы. Разработка научных основ и технологии получения катализатора среднетемпературной конверсии оксида углерода водяным паром в водород на основе ферритов кальция и меди, полученных из металлических порошков путем их механохимического окисления. Для решения поставленной задачи необходимо:
- Изучить физико-химические процессы, протекающие при механохимическом окислении порошков железа и меди и их влияние на субструктурные характеристики получаемых оксидов; а также выяснение механизма взаимодействия активируемого материала с окислителем в процессе механохимической активации (МХА).
- Показать возможность осуществления механохимического синтеза ферритов металлов различной структуры, и выяснить влияние механической активации на каталитические и структурно-механические свойства ферритов со структурой шпинели, перовскита, магнетоплюмбита.
- Установить влияние промоторов на активность и селективность катализаторов процесса конверсии СО водяным паром.
- Исследовать процессы обработки полученных ферритов и катализаторов в восстановительной среде и подобрать оптимальные условия их проведения.
- Исследовать физико-химические характеристики полученных катализаторов.
- Дать рекомендации по составу катализатора и условиям осуществления основных технологических операций его приготовления.
Научная новизна работы. Установлены закономерности процессов механо-химического окисления металлических порошков железа и меди твердыми, жидкими и газообразными окислителями. Показаны преимущества получения оксидов железа и меди в контролируемых газовых средах путем механохимической обработки металлических порошков реакционной паро-кислородной и паро-аммиачно-кислородной смесью. Установлен фазовый состав продуктов на различных стадиях процесса. Впервые получены данные по активности и селективности различных ферритов в реакции конверсии монооксида углерода водяным паром в водород. Впервые исследованы структурно-механические свойства высококонцентрированных суспензий ферритов. Изучен процесс обработки катализаторов в восстановительных средах и установлены его основные закономерности. Синтезированы образцы катализаторов и исследованы их физико-химические характеристики.
Практическая значимость работы. Выполнен комплекс исследований, направленных на разработку физико-химических основ приготовления катализатора на основе соединений со структурами типа перовскита и шпинели для процесса среднетемпературной конверсии оксида углерода в производстве аммиака. Выработаны рекомендации по технологическим параметрам ведения основных технологических стадий процесса. Предложен вариант функциональной технологической схемы приготовления катализатора. Проведены исследования физико-химических свойств катализатора и его основных компонентов. Новизна и практическая значимость предлагаемых технологических решений подтверждена патентом РФ.
На защиту выносятся:
- Результаты МХ окисления металлических порошков железа и меди в контролируемых газовых средах.
- Результаты физико-химических исследований по механохимическому синтезу ферритов металлов с различными структурами.
- Данные по физико-химическим свойствам железооксидных катализаторов на основе трехкомпонентной системы, промотированной лантаноидами.
- Данные по структурно-механическим свойствам паст индивидуальных ферритов и катализаторов на их основе.
- Функциональная технологическая схема приготовления катализатора.
Личный вклад автора заключается в постановке и проведении экспериментальных исследований, расчетов на ПК с применением современного программного обеспечения, а также участие в анализе, обсуждении экспериментальных данных, создании технологических основ приготовления катализатора конверсии СО водяным паром.
Апробация работы. Основные положения и результаты работы были доложены и обсуждены на: VI Всероссийской конференции «Ресурсо- и энергосберегающие технологии в химической и нефтехимической промышленности» Москва, РХТУ 2006; V China-Russia-Korea Symposium «Advances on chemical engineering and new materials science», Russia 2007; III международной конференции молодых ученых по химии и химической технологии «МКХТ-2007», РХТУ 2007; X-ом, XI-ом и XII-ом Всероссийском семинаре «Термодинамика поверхностных явлений и адсорбция», Иваново, Плес 2006-2008 г., VI Российской конференции с участием стран СНГ «Научные основы приготовления и технологии катализаторов» и V Российской конференции с участием стран СНГ «Проблемы дезактивации катализаторов», Новосибирск 2008 г.
Публикации. По теме диссертации опубликовано 12 печатных работ в виде 4 статей, 7 тезисов докладов на конференциях и 1 патента.
Достоверность полученных результатов. Результаты диссертационной работы и ее выводы являются достоверными, т.к. не противоречат фундаментальным представлениям по указанным процессам и получены с применением современных физико-химических методов исследования.
Структура и объем диссертации. Диссертация состоит из введения, пяти глав, выводов и списка цитируемой литературы из 123 наименований. Работа изложена на 177 страницах машинописного текста, содержит 69 рисунков и 26 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Во введении обоснованы актуальность темы, сформулированы цель и задачи исследования, отражена научная новизна и практическая значимость работы.
В первой главе рассмотрены физико-химические основы окисления металлического железа. Приведены основные закономерности получения оксидов и гидроксидов железа, а также технологические схемы их производства. Показано влияние активирующих добавок на активность и селективность железооксидного катализатора. Дан анализ явлений, сопровождающих механическую активацию твердых тел, и рассмотрены основные физико-химические и энергетические особенности механохимических процессов. Рассмотрены ферриты со структурой перовскита, шпинели, магнетоплюмбита. Показано распределение катионов в кристаллической решетке, особенности различных способов получения и механизмы образования ферритов. На основании проведенного анализа литературных данных определены цель и задачи исследования.
Во второй главе приведены характеристики используемых реактивов, методы приготовления образцов, схемы и описания основных экспериментальных установок, механоактивирующего оборудования и методов исследования. Для изучения физико-химических свойств и явлений, сопровождающих процессы механоактивации (МА), использованы рентгенофазовый, рентгеноструктурный, термогравиметрический, химический и лазерный методы анализа, а также ИК-спектроскопия и метод Мессбауэровской спектроскопии. Удельную поверхность образцов оценивали хроматографически по тепловой десорбции аргона. Восстановление водородом проводили в проточном реакторе импульсным методом. Каталитическую активность образцов катализаторов исследовали на установке проточного типа в реакции конверсии монооксида углерода водяным паром. Селективность катализатора определяли хроматографическим методом.
Третья глава посвящена механохимическому синтезу активных оксидов железа и меди из порошков металлов. В качестве исходного материала использовалось пентакарбонильное железо (от 3 до 15 мкм); железо марки ПЖР3.200.28 (от 45 до 200 мкм); ПЖР3.315.26 (от 160 до 315 мкм).
Анализируя рентгенограммы образцов, полученных после МО смеси Fe и Fе2O3 в течение 30, 60, 90, 120, 180, 240 и 330 минут можно сделать вывод, что после 120 минут МА степень окисления Feмет составляет около 56 %, и лишь МО в течение 330 минут приводит к окислению железа на 90 %.
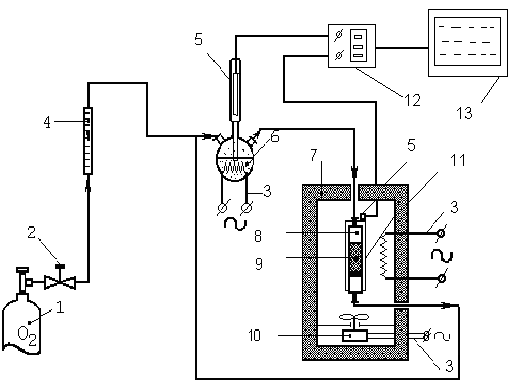 | Рис. 1. Схема установки для механохимического окисления порошков металлов 1.баллон (O2); 2.вентиль; 3.нагревательный элемент; 4.ротаметр; 5. термометры; 6.барботер; 7. вибромельница; 8. реактор; 9. образец; 10. вентилятор; 11 тепловая рубашка; 12. многофункциональный регистратор температур; 13. ПК |
МХ окисление порошка железа в паро-газовых смесях выполнялось на специально разработанной установке (рис. 1). По данным химического анализа, РФА и ИК-спектроскопии была оценена степень окисления железа 3х фракций в токе кислорода. После 120 мин. МА степень окисления составила: для высокодисперсного железа (3–15 мкм) – 100%; для фракции 45-200 мкм–70 %; для фракции 160-315 мкм–61 %.
Наличие в твердофазной системе жидкой фазы представляет особый интерес, т.к. позволяет снизить энергонапряженность оборудования. Методом РФА обнаружено, что в процессе МХ окисления железа в паро-кислородной среде образуется система, состоящая из -Fе, FеО и Fе3О4. Однако метод рентгеновской дифракции не позволяет разделить фазы магнетита Fe3O4 и магемита -Fe2O3, поскольку обе фазы имеют структуру шпинели и близкие параметры решетки. Только с использованием метода мессбауэровской спектроскопии удается однозначно идентифицировать фазы -Fe2O3, Fe3O4 и FeO (рис. 2а, б).
Анализ полученных экспериментальных данных показывает, что Feмет методом МХА окисляется жидкими, твердыми и газообразными окислителями (рис. 3). Однако использование паро-кислородной смеси в качестве окислителя с соотношением ПАР/ГАЗ = 0,45-0,55 позволяет достигать степени окисления порошка Feмет с размером частиц 45:315 мкм до 70–86 % за 120 минут. Очевидно, что образующаяся на поверхности частиц твердой фазы водная пленка с одной стороны препятствует процессу их агрегирования, а с другой – не затрудняет диффузию кислорода к поверхности -Fe.
 | 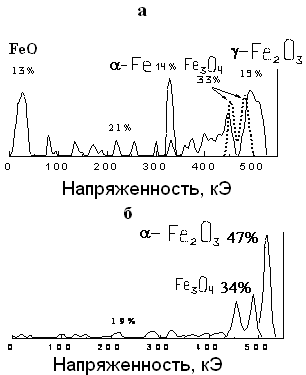 |
Рис. 2. Мессбауэровские спектры порошков железа: а) окисленных паро-
кислородной смесью; б) отожженных. Время МА 120 мин.
Поскольку процесс полного окисления металлического железа требует очень длительной МХА, то полученный продукт целесообразно подвергать термической обработке после 120 мин. МХА. По данным термогравиметрического анализа термическая обработка образцов сопровождается увеличением массы на 30 % (Т=500 °С), а также двумя эндо- (I, III) и одним экзотермическим (II) эффектами (рис. 4).
Полученный предлагаемым способом в паро-кислородной среде и прошедший термообработку оксид железа (смесь Fe3O4 и -Fe2O3) по своим физико-химическим характеристикам не уступает оксидам железа, приготовленным другими способами (табл. 1).
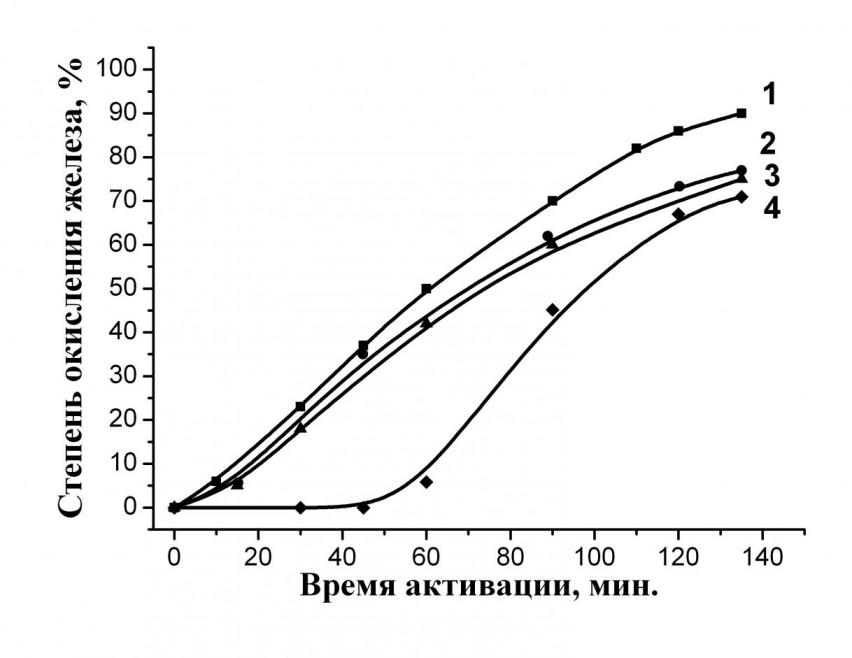 | 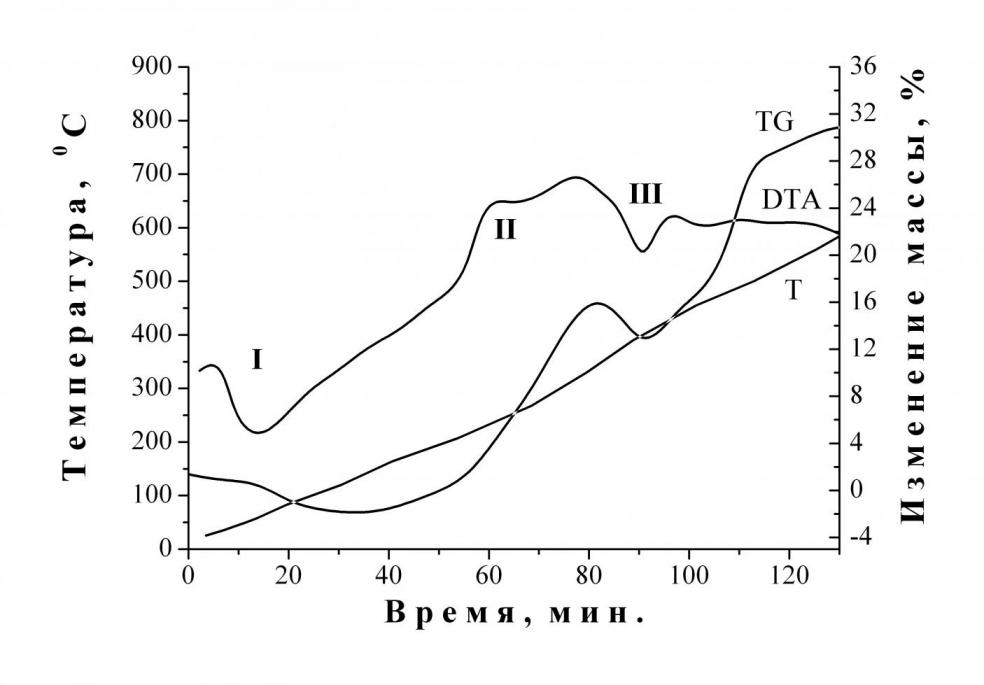 |
| Рис. 3. Зависимость степени превращения порошка металлического железа ПЖР3.200.28 (45 – 200 мкм) от вида окислителя. Среда окисления: 1)Паро-кислородная смесь (ПАР/ГАЗ = 0,455); 2) Вода; 3) Кислород; 4) Гематит (Fe2O3) | Рис. 4. Термограмма продуктов окисления железа, полученных по МХ технологии. Условия опыта: TG 100; DTA 800 мкV |
Вследствие низкой скорости окисления металлической меди кислородом предложено проведение данного процесса в паро-аммиачно-кислородной среде. В водных растворах аммиака в присутствии кислорода медь способна растворяться из–за большой склонности к комплексообразованию. В связи с этим были приготовлены паро-аммиачно-кислородные газовые смеси различного состава. Анализ рентгенограмм показал, что уже в начальный момент механической активации исчезают характерные рефлексы фазы металлической меди и образуется аморфный оксид одновалентной меди Cu2O. Увеличение времени механообработки приводит к практически полному окислению металлической меди, а образующиеся аммиачные комплексы меди при интенсивных механических воздействиях разлагаются с образованием оксидов CuO и Cu2O.
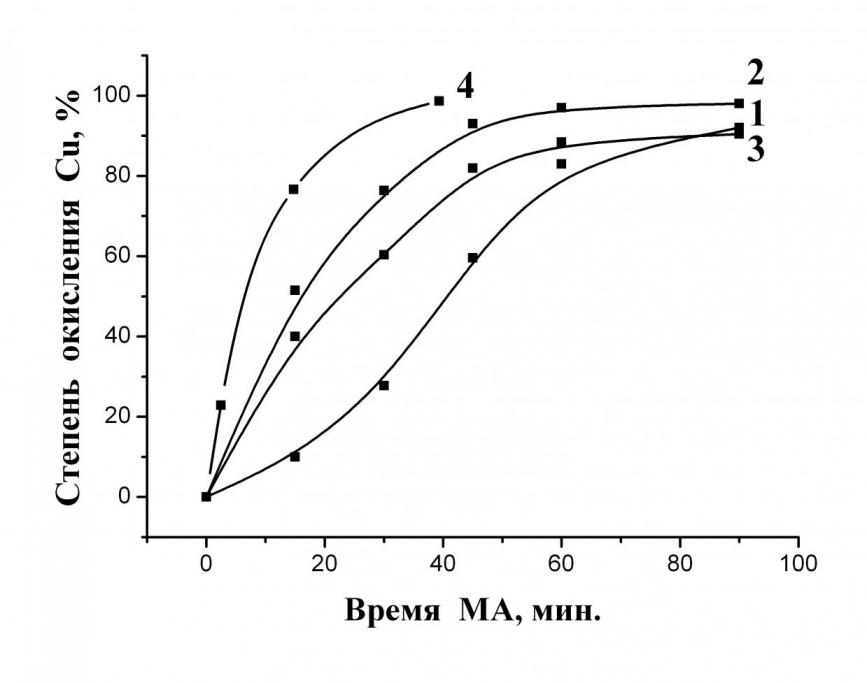 | Рис. 5. Зависимость степени превращения порошка Cuмет от времени МА Состав Паро-Аммиачно-Кислородной смеси: 1)12%–8%–80%; 2)15%–10%–75 %; 3)20%–15%–65%; 4)15%–10%–75 % Температура процесса: 1 – 3) Т=20-66 °С; 4) Т=105 – 115 °С |
Показано, что наиболее высокая степень окисления меди достигается при следующем соотношении компонентов паро-аммиачно-кислородной смеси: 15–10–75 %. Кроме того, было установлено, что при подведении тепла к реактору (Т = 105 – 115 °С) скорость окисления возрастает более чем в 2 раза (рис. 5).
Таблица 1. Физико-химические характеристики оксидов
| Образец | Удельная поверхностьм2/г | Средний размер кристаллитов Dокр, нм | Величина микро- деформаций, E, % | Средний размер частиц, мкм | |
| -Fe2O3 (по нитратной технологии) | 16-18 | 26 | 0,28 | 8-10 | |
| -Fe2O3 (по сульфатной технологии) | 10-12 | 49 | 0,21 | 10-12 | |
| Fe3O4 + -Fe2O3 (МА в среде паро-кислород) | 24 | 20 | 0,3 | 8-10 | |
| CuO (из малахита Тпр=300 °С) | 17 | 34 | 0,12 | 40 | |
| CuO (МА в паро-аммично-кислородной среде) | 30 | 10 | 0,8 | 18-20 | |
Синтезированный предлагаемым способом оксид меди отличают высокие физико-химические характеристики (табл. 1).
В четвертой главе рассмотрен механохимический синтез ферритов с различными структурами (магнетоплюмбита, перовскита, шпинели) и их каталитические свойства. Методом РФА установлено, что в ходе МА смеси -Fe2O3 с оксидами металлов (Ca, Cu, Mg, Mn, Pb, Zn, K), взятых в соответствующих стехиометрических соотношениях, образуются аморфные продукты, термическая обработка которых при различных температурах приводит к появлению хорошо окристализованных фаз того, или иного феррита.
Каталитическая активность ферритов различных металлов оценивалась по их производительности в реакции конверсии оксида углерода водяным паром при различных температурах. Показано, что феррит меди имеет высокую активность 2,49-2,73 [мл (СО)/г(kt)·с] при низких температурах 280-330 °С (табл. 2), а феррит кальция активен при более высоких температурах 330-390 °С – 2,39-2,55 [мл (СО)/г(kt)·с]. Поэтому целесообразно введение небольших количеств феррита меди с целью увеличения активности при низких температурах.
Каталитическая активность различных ферритов в
Таблица 2. реакции конверсии СО водяным паром
| Образец | Производительность (мл (СО)/г (kt)·с) при температуре, °С | ||||
| 280 | 300 | 330 | 360 | 390 | |
| феррит свинца PbO.6Fe2O3 | 1,86 | 1,94 | 2,02 | 1,93 | 1,78 |
| феррит марганца MnFeO3 | 1,98 | 2,15 | 2,24 | 2,19 | 1,96 |
| феррит меди CuFe2O4 | 2,49 | 2,59 | 2,73 | 2,58 | 2,31 |
| феррит цинка ZnFe2O4 | 1,45 | 1,67 | 1,88 | 1,48 | 1,30 |
| феррит калия KFeO2 | 1,37 | 1,61 | 2,00 | 1,64 | 1,40 |
| феррит лантана LaFeO3 | 1,44 | 1,72 | 2,35 | 1,83 | 1,53 |
| феррит магния MgFe2O4 | 1,84 | 2,14 | 2,60 | 2,23 | 1,89 |
| феррит кальция Ca2Fe2O5 | 1,97 | 2,17 | 2,39 | 2,79 | 2,55 |
Следует отметить, что наряду с активностью катализаторов большое значение имеет их селективность. Поскольку паровой конденсат из производства аммиака должен повторно использоваться в производстве. Для этого содержание органических примесей в конденсате не должно превышать 15 мг/л.
Таблица 3. Содержание побочных веществ
| Образец | t,0С | Содержание в конденсате, мг/л | , мг/л | |||
| Метил ацетат | Метанол | 2-про панол | Этанол | |||
| PbO*6Fe2O3,Тпр=600 0С | 340 | 8,87 | 4,23.10-5 | 0,507 | 22,18 | 31,56 |
| CuFe2O4, Тпр=450 0С | 340 | 4,80 | – | – | 0,07 | 4,87 |
| MnFeO3, Тпр=450 0С | 340 | 3,10 | 1,03 10-5 | 1,107 | 2,08 | 6,29 |
| MgFe2O4, Тпр=600 0С | 340 | 4,00 | – | 0,1 | 1,07 | 5,17 |
| КFeO2, Тпр=700 0С | 340 | 20,11 | 1,77.104- | – | 7,99 | 28,10 |
| ZnFe2O4, Тпр=450 0С | 340 | 5,61 | – | 0,5 | 3,47 | 9,58 |
| LaFeO3, Тпр = 450 °С | 340 | 0,254 | – | 0,656 | 1,75 | 2,66 |
Хроматографический анализ продуктов реакции конверсии оксида углерода водяным паром показывает, что наряду с основными продуктами (Н2, СО2) обнаружено присутствие ацетальдегида, метилацетата, бутанола, пропанола, этанола, метанола. Следовательно, в условиях конверсии СО протекают реакции гидрирования оксида углерода, ведущие к образованию нежелательных продуктов и загрязнённого конденсата.
Исследования показали, что на большинстве ферритов образуется значительное количество побочных продуктов. Лучшие показатели по селективности (2,66 мг/л) имеет феррит лантана (табл. 3).
Впервые изучены структурно-механические свойства паст различных ферритов. Показано что суспензия феррита кальция обладает наиболее высокой пластичностью и эластичностью; в ней равномерно развиты все виды деформации, что обеспечивает возможность экструзионного формования в гранулы (табл. 4).
Таким образом, исходя из данных по активности, селективности и реологическим свойствам синтезированных ферритов, рекомендуются к использованию следующие ферриты: феррит кальция – вследствие своей достаточно высокой активности и термостабильности при высоких температурах, а также хорошей формуемости в гранулы; а также феррит меди–по причине высокой каталитической активности при низких температурах; феррит лантана–вследствие своей термостойкости и высокой селективности.
Характеристика ферритов различных металлов
Таблица 4. по структурно-механическим свойствам
| Образец | Структурно-механические характеристики | Доля деформаций в общем балансе | ||||
| Пластичность, Пс·10 -6, с -1 | Эластичность | Период релаксации,, с | Eуп, % | Eэл, % | Eпл, % | |
| Ca2Fe2O5-90% CuFe2O4-10 % | 2,0 | 0,56 | 2237 | 30,0 | 38,8 | 31,2 |
| MgFe2O4-H2O | 1,4 | 0,23 | 3586 | 60,6 | 18,2 | 21,2 |
| CuFe2O4-H2O | 3,0 | 0,17 | 1772 | 54,0 | 11,0 | 35,0 |
| Ca2Fe2O5-H2O | 2,9 | 0,51 | 2315 | 34,0 | 36,0 | 30,0 |
| MnFeO3-H2O | 3,5 | 0,28 | 2237 | 59,6 | 23,5 | 17,5 |
| PbO·6Fe2O3-H2O | 0,4 | 0,23 | 4000 | 73,7 | 17,2 | 9,1 |
В пятой главе был исследован механохимический синтез трехкомпонентной системы: CuO + 2CaO + 2Fe2O3 = Ca2Fe2O5 + CuFe2O4, сопровождающийся протеканием 2х реакций: 2СaO + Fe2O3 = Ca2Fe2O5; CuO + Fe2O3 = CuFe2O4.
Установлено, что содержание СаО в трехкомпонентной системе влияет на каталитическую активность и селективность процесса. Так, если при пятипроцентном (5 %) содержании СаО в системе максимальная степень превращения СО (Т=360 °С) составляет порядка 92 %, то при 15 %-ном содержании СаО эта величина падает до 85 %. Однако после перегрева при Т = 600 °С активность образцов снизилась, причем лучшие данные показал образец с 10 %-ным содержанием СаО. Коэффициент термостабильности образца с 5%-ным содержанием CaO при 360 oC составляет 88%, с 10%-ным СаО –95,6%, а с 15 %-ным содержанием СаО–96,6 %. Это объясняется спеканием активной фазы вследствие уменьшения содержания в системе феррита кальция.
В результате совместной МХ активации оксидов кальция, железа и меди образуется сложная система, состоящая из феррита кальция со структурой перовскита и феррита меди со структурой шпинели, а также свободного -Fe2O3.
Введение в катализатор небольшого количества соединений лантаноидов может существенно увеличить его селективность. В связи с этим, методом прямого механохимического синтеза были синтезированы образцы катализатора на основе трехкомпонентной системы, полученной из CaO, CuO, Fe2O3, промотированные оксидами металлов подгруппы лантаноидов (лантан, церий, самарий, диспрозий). Как показали исследования, изменение содержания оксида церия в катализаторе практически не влияет на степень превращения СО, и все образцы проявляют высокую активность. Однако селективность процесса увеличивается значительно. Так, в образце, в котором оксид церия отсутствует, содержание побочных веществ в конденсате составляет 10,51 мг/л. При введении же даже незначительного количества оксида церия (0,5% Се2О3) их содержание падает до 3,36 мг/л. А увеличение содержания оксида церия в образце до 5 % приводит к еще более существенному снижению выхода побочных продуктов (табл. 5).
Таблица 5. Содержание побочных веществ в конденсате
| Материал | t,0С | Содержание в конденсате, мг/л | Общее содержание, мг/л | ||
| Метил ацетат | Этанол | Ацет- альдегид | |||
| La2O3 - 2%, CaO - 10%, CuO - 2%, Fe2O3 - 86% | 360 | 0,467 | 3,83 | 0,815 | 5,1 |
| La2O3 - 4%, CaO - 10%, CuO - 2%, Fe2O3 - 84% | 360 | 0,254 | 1,75 | 0,654 | 2,7 |
| La2O3 - 6%, CaO - 10%, CuO - 2%, Fe2O3 - 82% | 360 | 0,05 | 0,6 | 0,15 | 0,8 |
| Ce2O3 – 0,5%, CaO - 10%, CuO - 2%, Fe2O3 – 87,5% | 360 | 0,8 | 1,8 | 0,76 | 3,36 |
| Ce2O3 – 2%, CaO - 10%, CuO - 2%, Fe2O3 – 86% | 360 | 0,1 | 1,04 | 0,06 | 1,2 |
| Ce2O3 – 5%, CaO - 10%, CuO - 2%, Fe2O3 – 83% | 360 | 0,08 | 0,5 | 0,02 | 0,6 |
Показано, что образцы, промотированные оксидами других металлов подгруппы лантаноидов (La2О3–2%, Ce2О3–2%, Sm2О3–2%, Dy2О3–2%), носят аналогичный характер по селективности. Суммарное содержание побочных веществ в конденсате для всех образцов катализатора с добавкой лантаноидов очень мало, и с ростом порядкового номера лантаноида количество побочных веществ уменьшается с 5,1 до 0,6 мг/л.
Перед эксплуатацией катализаторы среднетемпературной конверсии монооксида углерода обычно восстанавливают реакционной газовой смесью. Показано, что восстановление железооксидных катализаторов водородом начинается при 150 °С. Скорость процесса резко возрастает в интервале температур 280-350 °С (рис. 6). Установлено, что для промышленных образцов достигается степень восстановленности 21 %, а для опытного образца – 31 %. При этом Fe2O3 (гематит) восстанавливается до магнетита (Fe3O4), а ферриты меди и кальция, сохраняя исходную структуру перовскита и шпинели (рис. 7), постепенно отделяют кислород с образованием дефектных каталитически активных веществ состава CaFeO2 и CuFe2O2,1.
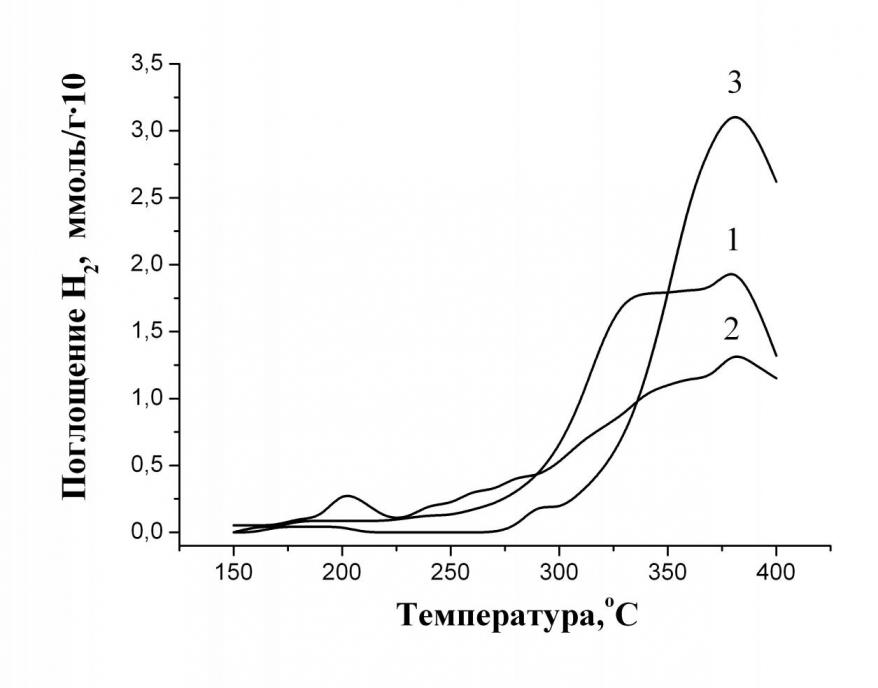 | 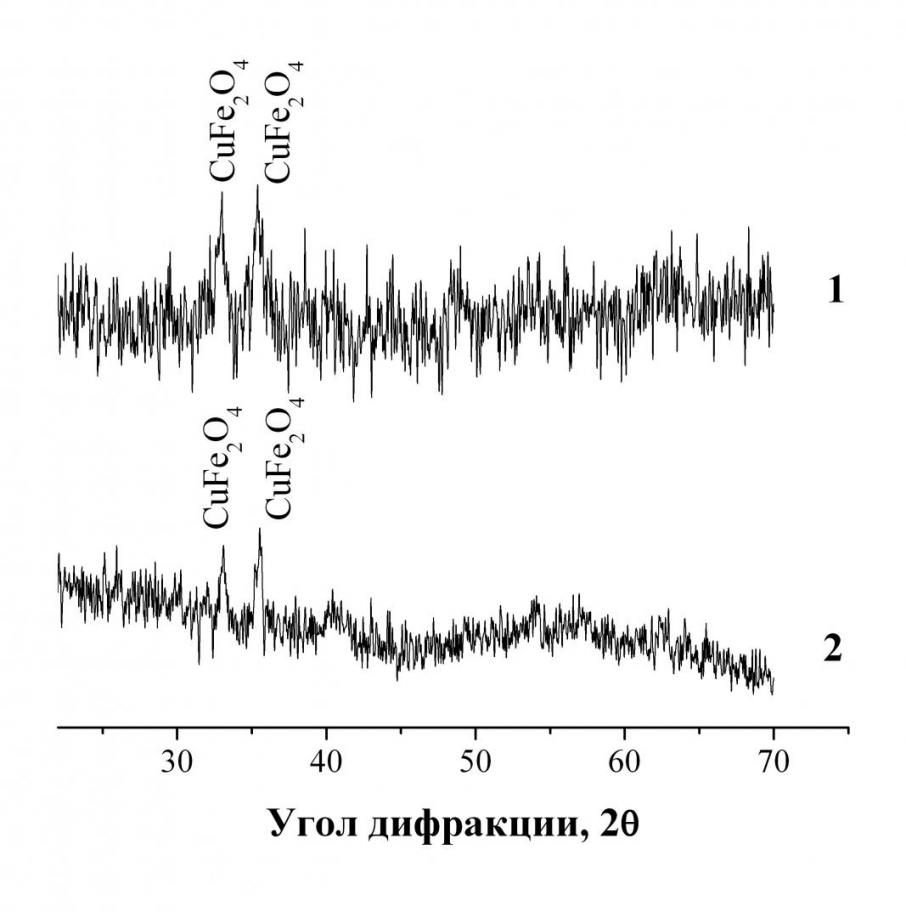 |
| Рис. 6. Кривые ТПВ железооксидных катализаторов и гематита. Состав образцов: 1 – La2O3-2%, CuO-2%, CaO- 10%, Fe2O3-86% 2 – Fe2O3-91%, Cr2O3-7%, CuO-2% 3 – Fe2O3 | Рис. 7. Рентгенограммы феррита меди до и после восстановления водородом 1 – исходный образец; 2 – восстановленный феррит меди |
Таким образом, нами был разработан катализатор реакции конверсии СО водяным паром на основе ферритов кальция и меди со структурами перовскита и шпинели, соответственно, и промотированный лантаноидами. Следует отметить, что полученный катализатор обладает высокой активностью. Так, производительность катализатора составляет 2,58 (мл (СО)/г.с), что сопоставимо с лучшими зарубежными образцами и превосходит железохромовые контакты (1,4 – 2,1 мл (СО)/г.с). Кроме того, образец синтезированного катализатора обладает высоким коэффициентом термостабильности 95,6 % (табл. 6).
Следует отметить, что синтезированный образец отличает высокая селективность. Так, на образце с 0,5 %-ной добавкой Ce2O3 суммарное содержание примесей в конденсате составляет 3,36 мг/л, что значительно ниже значения промышленного железохромового катализатора (12,6 мг/л), и зарубежных аналогов (табл. 6).
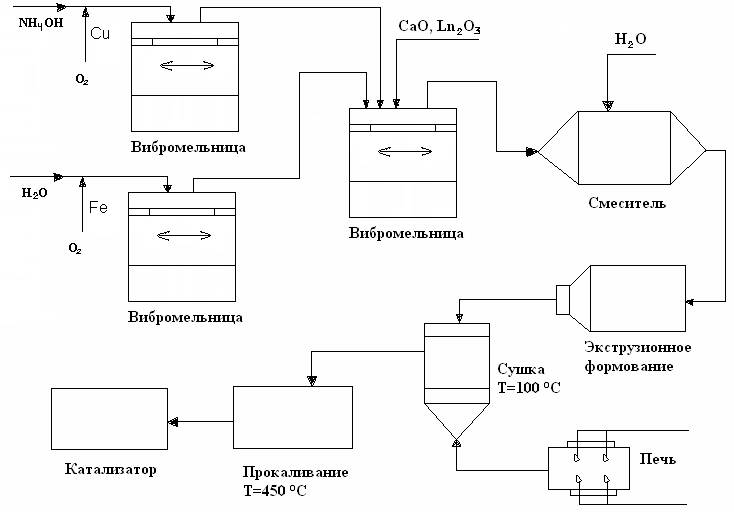
На основании проведенных исследований разработана функциональная технологическая схема приготовления катализатора на основе трехкомпонентной системы, состоящей из оксидов Ca, Fe и Cu, полученных из порошков металлов Fe и Cu, промотированной лантаноидом, исключающая использование токсичных ингредиентов (рис. 8).
Таблица 6. Каталитические и структурно-механич. свойства катализаторов
| Наименование, состав | Механическая прочность, МПа/см2 | Термо-стабильность, % | Выход побочных продуктов при 360 °С, мг/л | Производи- тельность при 360 °С, мл (СО)/г(kt).с |
| Промышленный Fe2O3-93,0%, Cr2O3-7,0% | 6,0 | 95,4 | 12,6 | 1,4 |
| Опытный Fe2O3-91,0%, Cr2O3-7,0%, CuO-2,0%; с исп. дисп. | 5,5 | 95 | 5,11 | 2,1 |
| Опытный CaO - 10 %; CuO-2% (из метал. порошка); Fe2O3-87,5% (из метал. порошка); Ce2O3-0,5% | 14,5 | 95,6 | 3,36 | 2,58 |
Рис. 8. Функциональная блок-схема приготовления катализатора на основе трехкомпонентной системы, состоящей из оксидов Ca, Fe и Cu, полученных из порошков металлов Fe и Cu, и промотированной лантаноидом.
ВЫВОДЫ
Выполнен комплекс исследований, направленный на разработку научных и технологических основ приготовления катализатора для процесса среднетемпературной конверсии монооксида углерода водяным паром на основе ферритов кальция и меди, полученных из порошков металлов железа и меди, и промотированной лантаноидами.
- Разработан эффективный катализатор процесса среднетемпературной конверсии оксида углерода водяным паром в производстве аммиака и определены технологические параметры ведения основных технологических операций его приготовления.
- Исследованы процессы окисления порошков металлических железа и меди методом МА в присутствии твердых, жидких и газообразных окислителей. Установлены основные кинетические закономерности протекания процессов.
- Показаны преимущества получения оксидов железа и меди в контролируемых паро-кислородных и паро-аммиачно-кислородных средах. Установлено, что использование паро-кислородной смеси с соотношением ПАР/ГАЗ = 0,45-0,55 в качестве окислителя металлического железа позволяет достичь 86 % степени его окисления за 120 минут МХА. Выявлены кинетические закономерности МХ окисления металлической меди. Установлены оптимальный состав компонентов паро-аммиачно-кислородной смеси 15 % – 10 % – 75 %, соответственно. Установлено, что синтезированные методом МА в паро-газовых смесях и подвергнутые термолизу оксиды Fe и Cu имеют высокие физико-химические характеристики. Предложена принципиальная технологическая схема получения оксидов железа и меди, состоящая из 2х ступеней: МХ окисления и последующего термолиза.
- Методом механохимического синтеза получены ферриты: Pb, Cu, Mg, Mn, K, Zn, La, Ca. Установлено образование ферритов различной структуры (шпинель, перовскит, магнетоплюмбит). Оптимальным временем получения феррита является 30 минут МА и дальнейшая прокалка при разных температурах.
- Впервые получены данные по селективности индивидуальных ферритов и установлен качественный и количественный состав побочных продуктов.
- Впервые изучены реологические свойства индивидуальных ферритов. Установлено, что феррит кальция обладает равномерно развитыми видами деформаций (Eуп=34 %, Eэл=36 %, Eпл=30 %), что обеспечивает возможность экструзионного формования в гранулы.
- Впервые получены данные о влиянии содержания СаО в системе на активность катализатора, его селективность, термостабильность и степень восстановленности.
- Показано влияние добавок оксидов лантаноидов в железооксидный катализатор на его активность и селективность. Впервые обнаружена высокая селективность катализатора, промотированного 1–5 %-ной добавкой оксида лантаноида (лантан, церий, самарий, диспрозий). Показано, что побочными продуктами в реакции конверсии оксида углерода являются ацетальдегид, метилацетат, метанол, этанол, 2-пропанол. Установлено, что селективность катализатора возрастает с ростом порядкового номера лантаноида.
- Изучены реологические свойства каталитических масс на стадии экструзионного формования. Показано, что синтезированная нами катализаторная масса обладает высокими реологическими характеристиками даже без добавок полимеров. При этом величины быстрых и медленных эластических и пластической деформаций развиты равномерно (Eуп = 43,5%; Eэл = 25,8%; Eпл = 30,7), что обеспечивает возможность экструзионного формования в гранулы. Необходимо отметить также высокую механическую прочность гранул катализатора, полученного экструзией – 14,5 МПа/см2.
- Исследованы физико-химические характеристики различных катализаторов. Исходя из полученных данных по активности и селективности катализатора, а также его термостабильности и степени восстановленности водородом установлены продолжительность активации, состав газовой фазы, состав катализатора, температура прокаливания. Предложен вариант функциональной технологической схемы получения катализатора.
Основные положения диссертации опубликованы в работах:
- Курочкин, В.Ю. Механохимический синтез и каталитические свойства ферритов калия, магния и цинка / В.Ю. Курочкин, А.П. Ильин, Н.Н. Смирнов // Вестник Казанского технологического университета. – 2006. – №3. – С. 75-80.
- Курочкин, В.Ю. Механохимический синтез и каталитические свойства ферритов свинца, меди и марганца / В.Ю. Курочкин, А.А. Ильин, А.П. Ильин, Н.Н. Смирнов // Изв. Вузов. Химия и химическая технология. – 2006. – №5. – С. 42-45.
- Курочкин, В.Ю. Регулирование активности и селективности катализатора среднетемпературной конверсии оксида углерода / В.Ю. Курочкин, А.А. Ильин, А.П. Ильин // Региональное приложение к журналу Современные наукоемкие технологии. – 2007. – № 2-3. – С. 78-82.
- Ильин, А.А. Механохимическое окисление порошка металлического железа / А. А. Ильин, В. Ю. Курочкин, А. П. Ильин, Н. Н. Смирнов, Ю. В. Флегонтова // Изв. Вузов. Химия и химическая технология. – 2008. – Вып. № 3, Т. 51. – С. 33-36.
- Патент № 2320411. Способ приготовления катализатора для среднетемпературной конверсии оксида углерода водяным паром / А.А. Ильин, В.Ю. Курочкин, А.П. Ильин, Н.Н. Смирнов // Заявка № 2007100770/04, 09.01.2007; Опубл. 27.03.2008 Бюл. № 9.
- Ильин, А.А. Низкотемпературное окисление металлов в процессе их механической активации / А.А. Ильин, В.Ю. Курочкин, Н.Н. Смирнов, А.П. Ильин, Н.Е. Гордина // Материалы всероссийского семинара «Термодинамика поверхностных явлений и адсорбция», Иваново, Плес. – 2006. – C. 43-46.
- Курочкин, В.Ю. Механохимический синтез активного оксида железа / В.Ю. Курочкин, А.А. Ильин, Н.Н. Смирнов, А.П. Ильин, Н.Е. Гордина // Тезисы докладов VI Всероссийской конференции «Ресурсо- и энергосберегающие технологии в химической и нефтехимической промышленности, Москва, РХТУ. – 2006. – С. 92-93.
- Kurochkin, V.Yu. Mechanochemical synthesis of catalysts for medium-temperature conversion of monoxide of carbon by water steam / V.Yu. Kurochkin, A.P. Ilyin, N.N. Smirnov // Materials of V symposium Advances on chemical engineering and new materials science, Russia, Ivanovo. – 2007. – P. 42-49.
- Курочкин, В.Ю. Регулирование активности и селективности катализатора среднетемпературной конверсии оксида углерода / В.Ю. Курочкин, О.А. Вшивцева, А.П. Ильин // Материалы всероссийского семинара «Термодинамика поверхностных явлений и адсорбция», Иваново, Плес. – 2007. – С. 35-37.
- Ильин, А.А. Механохимический синтез катализатора для среднетемпературной конверсии монооксида углерода водяным паром / А.А. Ильин, В.Ю. Курочкин, А.П. Ильин, Н.Н. Смирнов // Материалы III международной конференции молодых ученых по химии и химической технологии “МКХТ-2007”, Москва, РХТУ. – 2007. – № 9. – С. 79-84.
- Ильин, А.А. Регулирование активности и селективности катализатора среднетемпературной конверсии монооксида углерода водяным паром / А.А. Ильин, А.П. Ильин, В.Ю. Курочкин, Н.Н. Смирнов // Сборник тезисов докладов VI Российской конференции с участием стран СНГ «Научные основы приготовления и технологии катализаторов» и V Российской конференции с участием стран СНГ «Проблемы дезактивации катализаторов», Новосибирск – 2008. – Том II. – С. 48.
- Курочкин, В.Ю. Разработка катализатора среднетемпературной конверсии монооксида углерода водным паром с использованием соединений типа перовскита и шпинели / В.Ю. Курочкин, А.А. Ильин, А.П. Ильин // Материалы всероссийского семинара «Термодинамика поверхностных явлений и адсорбция», Иваново, Плес. – 2008. – С. 54-62.
Автор выражает глубокую благодарность за ценные советы и консультации при выполнении диссертационной работы к.т.н., доценту кафедры ТНВ ИГХТУ Ильину А.А.
Соискатель (Курочкин В.Ю.)

