Иммунный статус крупного рогатого скота и свиней при наиболее распространённых болезнях и его коррекция
На правах рукописи
МАСЬЯНОВ
Юрий Николаевич
ИММУННЫЙ СТАТУС КРУПНОГО РОГАТОГО СКОТА И СВИНЕЙ
ПРИ НАИБОЛЕЕ РАСПРОСТРАНЁННЫХ БОЛЕЗНЯХ
И ЕГО КОРРЕКЦИЯ
06.02.02 – ветеринарная микробиология, вирусология, эпизоотология,
микология с микотоксикологией и иммунология
06.02.01 – диагностика болезней и терапия животных, патология,
онкология и морфология животных
АВТОРЕФЕРАТ
диссертации на соискание учёной степени
доктора ветеринарных наук
Воронеж – 2010
Работа выполнена в ГНУ Всероссийский научно-исследовательский ветеринарный институт патологии, фармакологии и терапии РАСХН (ГНУ ВНИВИПФиТ), г. Воронеж
Научные консультанты: доктор ветеринарных наук, профессор,
заслуженный деятель науки РФ,
член-корреспондент РАСХН
Шахов Алексей Гаврилович
доктор ветеринарных наук, профессор,
заслуженный деятель науки РФ
Сулейманов Сулейман Мухитдинович
Официальные оппоненты: доктор медицинских наук, профессор,
заслуженный деятель науки РФ
Земсков Андрей Михайлович
доктор ветеринарных наук, профессор
Евглевский Анатолий Алексеевич
доктор ветеринарных наук, профессор
Трояновская Лидия Петровна
Ведущая организация: ФГОУ ВПО «Донской государственный аграрный
университет»
Защита состоится «14» октября 2010 г. в __часов на заседании диссертационного совета ДМ 006.004.02 во Всероссийском научно-исследовательском ветеринарном институте патологии, фармакологии и терапии (394087, г. Воронеж, ул. Ломоносова, 114-б)
С диссертацией можно ознакомиться в библиотеке ГНУ ВНИВИПФиТ
Автореферат разослан «__» ___________ 2010 г.
Учёный секретарь диссертационного совета,
кандидат биологических наук Близнецова Г.Н.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Перевод животноводства на промышленную технологию, особенностью которой является новые методы содержания, кормления и эксплуатации, и связанное с этим увеличение концентрации поголовья, потенциально патогенных микроорганизмов в помещениях, изменение первоначальных их свойств, влияние на организм животных технологических стресс-факторов, экологическое неблагополучие внешней среды, усугубляющееся практически повсеместным дефицитом в кормах микроэлементов, ставит перед ветеринарными специалистами новые сложные задачи по охране здоровья животных (А.Г. Шахов, 2005).
Воздействие этих факторов влияет на приспособительно-адаптационные механизмы у животных, изменяя их, что приводит к снижению неспецифической резистентности и иммунитета или повышению реактивности.
Возникновение нарушений функций иммунной системы является одним из патогенетических механизмов любого патологического процесса (Ю.Н. Фёдоров, 2006).
В связи с этим приобрели широкое распространение так называемые факторные инфекции, проявляющиеся у маточного поголовья нарушениями воспроизводительной функции, эндометритами, маститами, а у молодняка диарейным и респираторным синдромами (В.В. Макаров, 2005; А.Г. Шахов, 2005).
Возникновение этих болезней обусловлено, как правило, ассоциациями микроорганизмов. Вирусы вызывают альтерацию и иммуносупрессию, что является пусковым механизмом для развития вторичной бактериальной инфекции наряду с грибами и простейшими (Е.В. Андреев, 1985; В.А. Мищенко с соавт., 2001; D.G. Bryson, 1996).
При этом в каждом случае среди животных имеются особи, которые не болеют или переболевают в относительно лёгкой форме. Кроме того, в неблагополучных хозяйствах среди больных и здоровых животных регистрируются серопозитивные и серонегативные, контаминированные и свободные от тех или иных патогенов особи. Это, безусловно, свидетельствует о сложном характере взаимоотношения между микроорганизмами и состоянием защитных систем, обусловленных адаптационными возможностями организма животных к воздействию неблагоприятных факторов окружающей среды.
Во многом остаются не до конца решёнными и морфологические аспекты, связанные как с физиологическим состоянием систем органов, так и патологическими изменениями.
Поэтому в настоящее время является актуальной оценка иммунного статуса животных в зависимости от возраста, физиологического состояния, воздействия патогенных факторов, обусловливающих возникновение болезней, и возможность его коррекции препаратами, обладающими антиоксидантным и опосредованно иммуномодулирующим действием.
Цель и задачи исследований. Изучить иммунный статус крупного рогатого скота и свиней при наиболее распространённых болезнях и возможность его коррекции препаратами, обладающими антиоксидантным и иммуномодулирующим действием.
Для достижения цели были поставлены следующие задачи:
1. Изучить влияние нормализации обмена веществ на иммунный статус в системе мать-плод-новорожденный.
2. Изучить иммунный статус в зависимости от возраста маточного поголовья и его влияние на качество приплода.
3. Изучить иммунный статус при послеродовой патологии матки и молочной железы у коров и свиноматок.
4. Изучить иммунный статус у телят и поросят при болезнях, проявляющихся диарейным и респираторным синдромом.
5. Провести сравнительную оценку коррекции иммунного статуса взрослого поголовья и молодняка крупного рогатого скота и свиней лигфолом, селедантом и лигавирином при специфической профилактике болезней молодняка.
6. Разработать и дать оценку информативности методам тестирования системного и локального иммунитета животных.
Научная новизна. Впервые у крупного рогатого скота и свиней разного возраста изучен иммунный статус, уровень факторов неспецифической защиты и морфология локального иммунитета в органах первичного поражения при распространённых факторно-инфекционных болезнях. Изучено модулирующее влияние лигфола, селеданта и лигавирина на иммунный статус и ответ к бактериальным и вирусным антигенам при вакцинации коров, свиноматок и молодняка. Разработаны методы тестирования локального и системного иммунитета, дана оценка их информативности при некоторых болезнях животных послеродового периода.
Научная новизна исследований подтверждена шестью патентами РФ: «Способ профилактики колибактериоза телят» №2275935 от 10.05.2006; «Способ профилактики респираторных болезней телят» №2287986 от 27.11.2006; «Способ профилактики вирусных респираторных болезней телят» №2287992 от 27.11.2006; «Способ профилактики острых респираторных болезней телят» №2292916 от 10.02.2007; «Способ профилактики желудочно-кишечных болезней телят» №2295975 от 27.04.2007; «Способ повышения неспецифической резистентности и иммунологической реактивности свиней при вакцинации» №2321414 от 10.04.2008.
Практическая значимость. Дана доклиническая оценка иммунного статуса взрослого поголовья и молодняка крупного рогатого скота и свиней и при развитии патологии с учётом влияния факторов окружающей среды, этиологической структуры инфекционных болезней и морфологии локального иммунитета в поражённых органах, что позволило установить нарушения, обусловливающие их возникновение, а также статус, характеризующий норму. На этой основе проведена оценка коррекции иммунного статуса животных препаратами, обладающими антиоксидантным и иммуномодулирующим действием, установлена её роль в повышении эффективности специфической профилактики болезней молодняка.
Материалы диссертации вошли в одобренные секцией «Патология, фармакология и терапия» Россельхозакадемии «Методические рекомендации по оценке и коррекции естественной резистентности животных» (Воронеж, 2005), «Методические рекомендации по оценке и коррекции иммунного статуса организма животных» (Воронеж, 2005), «Методические рекомендации по оптимизации формирования колострального иммунитета у новорожденных животных» (Воронеж, 2009), методическое пособие «Методы морфологических исследований» (Воронеж, 2000).
Публикации. По материалам диссертации опубликовано 39 научных работ, из них 16 в рекомендованных ВАК изданиях.
Апробация работы. Основные положения диссертации доложены на Международной научно-практической конференции «Свободные радикалы, антиоксиданты и здоровье животных» 21-23 сентября, Воронеж, 2004; на Международной научно-практической конференции посвящённой 100-летию со дня рождения академика ВАСХНИЛ Я.Р. Коваленко «Актуальные проблемы инфекционной патологии и иммунологии животных» 16-17 мая, Москва, 2006; на Всероссийском ветеринарном конгрессе «XV. Московский ветеринарный конгресс по болезням мелких животных» 21-23 апреля, Москва, 2007.
Объём и структура диссертации. Материал диссертации изложен на 410 страницах текста в компьютерном исполнении, включает обзор литературы, материал и методы исследований, результаты собственных исследований и их анализ, выводы, практические предложения, список литературы, содержащий 478 источников, в том числе 211 зарубежных авторов и приложения. Диссертация содержит 48 таблиц и 81 рисунок.
Основные положения, выносимые на защиту:
- влияние иммунного статуса в системе мать-новорожденный на заболеваемость и продуктивность молодняка крупного рогатого скота и свиней;
- иммунный статус и морфогенез в поражённых органах при массовых болезнях у взрослого поголовья и молодняка крупного рогатого скота и свиней;
- сравнительная оценка влияния коррекции иммунного статуса крупного рогатого скота и свиней лигфолом, селедантом и лигавирином при специфической профилактике желудочно-кишечных и респираторных болезней молодняка.
2. МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена в 1993-2008 гг. в отделе микробиологии, вирусологии и иммунологии и лаборатории патоморфологии ГНУ Всероссийский НИВИ патологии, фармакологии и терапии РАСХН. Экспериментальные исследования проведены в хозяйствах Воронежской, Волгоградской и Орловской областей.
Клинические и лабораторные исследования по теме диссертации проведены в соответствии с планом НИР ГНУ ВНИВИПФиТ по заданию 08.04.02. «Изучить системные иммунодефициты в возникновении массовых желудочно-кишечных и респираторных болезней молодняка сельскохозяйственных животных и разработать средства и способы их коррекции для профилактики и терапии» (№ гос. регистрации 01.200.117019); по заданию 08.04.01. «Разработать методы ранней диагностики, эффективные средства и способы профилактики и лечения массовых незаразных и вызываемых условно-патогенными микроорганизмами заболеваний у молодняка высокопродуктивных животных» (№ гос. регистрации 15070. 3666026906. 06.8.001.2).
Отдельные исследования проведены при участии сотрудников отделов клинической биохимии, патологии органов размножения и молочной железы животных, физико-химических методов исследований ГНУ ВНИВИПФиТ Золотарёва А.И., Близнецовой Г.Н., Нежданова А.Г., Климова Н.Т., Михалёва В.И., Коцарева В.Н., Шушлебина В.И., Чусовой Г.Г. и др., которым автор выражает искреннюю признательность за оказанную помощь и плодотворное сотрудничество.
Иммунный статус и показатели неспецифической резистентности изучали в сравнительном аспекте:
- у коров с нарушенным (n=28) и нормализованным обменом веществ (n=30), и полученных от них телят, соответственно (n=26) и (n=30).
- в период сухостоя и после родов у здоровых коров (n=4) и заболевших эндометритом (n=11), а также у здоровых (n=6) и заболевших субклиническим (n=10) и клиническим маститом (n=6);
- у телят, родившихся как от коров с нарушенным и нормализованным метаболизмом, заболевших омфалитом, соответственно (n=10) и (n=8), диареей (n=11) и (n=8), с респираторной патологией (n=15) и (n=11) и клинически здоровых (n=8). Исследования проведены до клинического проявления патологии и у больных животных;
- у свиноматок в зависимости от возраста, соответственно 1-2 (n=10), 3-6 (n=10) и 7-8 (n=7) опоросов, со сроками супоросности 35 и 100-105 дней, и его влияние на качество приплода, заболеваемость и сохранность поросят;
- до и после опороса у здоровых свиноматок (n=8) и заболевших послеродовым гнойно-катаральным эндометритом (n=19) и маститом (n=7);
- у больных 3-5 дневных поросят при диарейном синдроме - энзоотическом течении трансмиссивного гастроэнтерита (n=7) и здоровых (n=9);
- у 35 дневных поросят перед отъёмом, предрасположенных к респираторной патологии (n=20), 70-дневного возраста, заболевших (n=9) и оставшихся здоровыми (n=11), а также 3-3,5 месячного возраста, больных хронической бронхопневмонией (n=5) и здоровых (n=5).
С целью повышения эффективности специфической профилактики колибактериоза у телят проведена коррекция иммунного статуса у коров при двукратной вакцинации их в сочетании с лигфолом (n=6), лигавирином (n=5) и селедантом (n=8) по сравнению с иммунизированными без применения препарата (n=5) и интактными животными (n=5).
Влияние иммуномодуляторов на формирование у новорожденных телят колострального иммунитета и эффективность специфической профилактики сальмонеллёза, парагриппа-3 и инфекционного ринотрахеита при двукратной вакцинации их в месячном возрасте в сочетании с лигфолом (n=6), лигавирином (n=5) и селедантом (n=8), по сравнению с интактными животными (n=5) и контрольной группы (n=5).
Коррекцию иммунного статуса свиноматок с целью специфической профилактики эшерихиоза и сальмонеллёза у поросят проводили при двукратной вакцинации их в период 1,5 месяцев супоросности в сочетании с применением лигфола (n=6), лигавирина (n=6) и селеданта (n=6) в сравнении с интактными животными (n=6) и контрольной группы (n=6). Исследования проведены также за 1-2 недели до опороса и на 2-4 день после него.
Коррекцию иммунного статуса поросят лигфолом (n=6), лигавирином (n=6) и селедантом (n=6) с целью специфической профилактики эшерихиоза и сальмонеллёза, на фоне животных контрольной (n=6) и интактной групп (n=6). Исследования проведены до и после вакцинации, соответственно в 2-3 недельном, а также 38-43, 48-53 и 79-84 дневном возрасте.
Гематологические показатели определяли общепринятыми методами.
Лимфоциты выделяли из гепаринизированной крови (25 ЕД/мл) на фиколл-верографине (плотность –1,077 г/см3). Количество Т-лимфоцитов в крови определяли у КРС и свиней методом спонтанного розеткообразования с эрироцитами барана (Е-РОК) по M. Jondal et. al. (1972), В-лимфоцитов - методом комплементарного розеткообразования (ЕАС-РОК) с использованием стандартного кроличьего гемолизина и в качестве комплемента - свежей сыворотки, соответственно КРС и свиней, В-лимфоцитов с IgM и IgG-рецепторами (у КРС) - в антииммуноглобулиновом розеткообразующем тесте, Fc+-лимфоциты (у свиней) с помощью ЕА-РОК. О-лимфоциты вычисляли по разнице от общего количества лимфоцитов суммы Е- и ЕАС-РОК, а количество резистентных и чувствительных к теофиллину Т-клеток - согласно методическим указаниям А. М. Земскова с соавт. (1988). Концентрацию иммуноглобулинов G, М и А классов, а также С1q- и С3-компонентов комплемента определяли методом РИД по G. Mancini (1965) (Выражаем иcкреннюю благодарность д.б.н., профессору, член-корр. РАСХН Ю.Н.Фёдорову за предоставление диагностикумов для определения концентраций IgG, IgМ и IgА у свиней). Выделение секреторной формы IgA (SIgA) проводили согласно Г. Фримелю (1987), С1q- и С3-компонентов комплемента КРС, получение к ним кроличьих антисывороток и доведение их до моноспецифичности - с помощью комплекса методов, которые отражены в «Методических рекомендациях по оценке и коррекции иммунного статуса животных» (Воронеж, 2005). Бактерицидную активность сыворотки крови (БАСК) определяли по О.В. Смирновой и Т.А. Кузминой (1966), лизоцимную (ЛАСК) - по К.А. Каграмановой и З.В. Ермольевой (1966), комплементарную (КАСК) – по Г.Ф. Вагнеру (1963), титры нормальных антител – в РГА, фагоцитарную активность лейкоцитов (ФАЛ), индекс и число (ФЧ и ФИ) – по В.С. Гостеву (1950), индекс завершенности фагоцитоза (ИЗФ) – по И.М. Карпутю (1993). Циркулирующие иммунные комплексы (ЦИК) осаждали из сыворотки крови - 3,5% ПЭГ-6000. Наличие вируса ТГС у больных поросят в фекалиях, в содержимом кишечника и составе ЦИК, определяли встречным иммуноэлектрофорезом (ВИЭФ) с полученной на кроликах преципитирующей антисывороткой к культуральному вирусу ТГС, антитела к вирусу ТГС в сыворотке крови поросят - методом задержки ВИЭФ. Диссоциацию ЦИК с последующей идентификацией в их составе антигена ТГС проводили путём восстановительного сульфитолиза по О. Я. Поповой и Л. С. Косицкой (1977). Титры антител в сыворотке крови свиней к вирусу РРСС - в РДП (очистку антигена РРСС проводили гельфильтрацией на сефадексе G-50 живой лиофилизированной вирусвакцины).
Для определения интенсивности абсорбции иммуноглобулинов в кишечнике новорожденных телят учитывали: концентрацию IgG в молозиве и объём его потребления в каждую выпойку (четырёхкратно в течение суток); рассчитывали абсолютное количество IgG (г) поступившего в желудочно-кишечный тракт телёнка после первой выпойки молозива, а также за сутки, как сумму произведений объёма потреблённого телёнком молозива и концентрации в нём IgG (г/л) при каждой выпойке (У). Величину интенсивности всасывания иммуноглобулинов в кровь определяли в процентах абсолютного содержания IgG (г) в общем объёме крови от абсолютного уровня его поступления в желудочно-кишечный тракт телёнка. Для вычисления абсолютного уровня IgG (г) в крови телёнка (Х) использовали следующие показатели: концентрация IgG г/л в сыворотке крови (n); масса телёнка в кг (m); общий объём крови у телёнка (л), исходя из 9% её содержания от массы тела (К=0,09); показатель гематокрита (Нt), и формулу: Х = n (Кm -(Кm Ht)/100). Величину интенсивности всасывания (И) определяли в процентах по формуле: И = (Х·100)/У.
Бактериологические исследования проводили общепринятыми методами, ПЦР определяли геном вируса ЦВС-2, РРСС, хламидий.
Материалом для патоморфологических исследований служили образцы из поражённых органов коров, свиноматок и молодняка животных (матка, молочная железа, тонкий кишечник и лёгкие), которые фиксировали в 10% нейтральном формалине, обезвоживали в спиртах и хлороформе и заключали в парафин. Гистосрезы окрашивали гематоксилином и эозином. Материалом для исследования ультраструктурных особенностей абсорбции в тонкой кишке материнских факторов защиты служили поросята до приёма молозива, 3-6 часов жизни, а также одно- и трёхсуточного возраста, убитые декапитацией, от которых были взяты образцы из разных её отделов. Фиксацию материала для ультраструктурных исследований проводили в 2,5% растворе глютарового альдегида на 0,111М S-коллидиновом буфере (+4°С) с постфиксацией в 1% растворе тетраокиси осмия на том же буфере. Материал обезвоживали в спиртах и заключали в Эпон-812. Срезы приготавливали на ультрамикротоме «LKB-3800», контрастировали цитратом свинца и уранилацетатом и просматривали в электронном микроскопе «Tesla» BS-500.
Полученный цифровой материал подвергали математической обработке с помощью программы ExStat на ЭВМ РС AMD K7-800 AthIon.
3. РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
3.1. Влияние нормализации обмена веществ на иммунный статус коров и полученных от них телят
Изучен иммунный статус в сравнительном аспекте у коров с нарушенным (контроль) и нормализованным метаболизмом (опытная группа). Коррекция рациона, проведённая у коров до запуска, состояла в исключении дачи соломы, её замены сеном, введении жмыха подсолнечного (1,0), муки овсяной (1,0) и увеличении вдвое патоки (1,0). Это позволило снизить в рационе избыток сухого вещества с 19,1 до 6,9%, сырой клетчатки – с 43,4 до 13,1%, устранить дефицит переваримого протеина (+13,3%), сахара (+20,4%), фосфора (+31,1%), меди (+381,2%), несколько снизить дефицит цинка (-13,6%) и кобальта (-57,4%). На основании исследования рациона и биохимических показателей крови животных был разработан и применён в период сухостоя премикс, содержащий недостающее количество микро- и макроэлементов, витаминов, введён трикальцийфосфат и 0,5% раствор селенита натрия в дозе 2мл/100 кг массы тела подкожно, что способствовало нормализации белкового, углеводного, жирового и минерального обменов.
Установлено, что у коров при коррекции рациона за 2-2,5 мес. до отёла, по сравнению с животными контрольной группы, увеличилось относительное количество Т-лимфоцитов на 17,1%, IgМ – на 48,3%, IgG – на 20,7%, титры нормальных гемагглютининов – в 1,4 раза, гуморальные и клеточные факторы естественной резистентности: БАСК – на 23,2%, ЛАСК – в 2,4 и КАСК - в 1,7 раза, ФАЛ – на 57,8%, ФЧ и ФИ – в 2,24 и 1,5 раза. При этом снизилась напряжённость локального иммунитета - уровень IgА в крови (на 18,8%), что обусловлено на фоне более высокой у них естественной резистентности снижением антигенного воздействия на иммунную систему слизистых. По этой же причине усиление антигенного воздействия на периферические органы иммунной системы у коров с нарушенным метаболизмом, по-видимому, индуцировало развитие частичной иммунологической толерантности системного гуморального ответа.
За 2-10 дней до отёла у них отмечали достоверное повышение относительного уровня Т-клеток на 58,5% при снижении (на 7,9%) в контроле, С3-компонента комплемента (на 24,7%), что свидетельствует о нормализации белоксинтезирующей функции печени, относительного количества В-клеток (ЕАС) - на 31,6%, умеренную поглотительную способность нейтрофилов (ФЧ). При закономерном снижении перед родами вследствие транссудации в молочную железу IgG и IgМ, их уровень в крови оставался значительно выше (Р<0,001; Р<0,01), а содержание IgА - ниже (Р<0,05).
На 3-6 день после отёла у коров опытной группы уровни показателей иммунитета и неспецифической резистентности оставались более высокими за исключением – ФЧ. Те же тенденции сохранялись у коров сравниваемых групп и через две недели после родов.
У телят, полученных от коров с нормализованным метаболизмом, до приёма молозива отмечали более высокий относительный уровень Т-клеток (на 17,4%), относительное (Р<0,02) и абсолютное число В-клеток (ЕАС) – на 20,9 и 25,0%, В-RIgM-клеток – в 2,97 и 2,65 раза (Р<0,02), БАСК – на 10,8%, ЛАСК – на 76,8%, КАСК – на 57,5% в сочетании с С1q – на 4,5% и С3 – на 29,6%, при этом более низкий уровень лейкоцитов в крови на 20,2%, ФАЛ (Р<0,05), ФЧ и ФИ – на 30,8 и 15,8%, а также (вдвое) концентрации IgG, IgА (Р<0,05; Р<0,02) и IgМ - в 1,55 раза, что свидетельствует о снижении фетоплацентарной недостаточности.
После приёма молозива у всех телят 2-4 дневного возраста повышались: БАСК, КАСК в сочетании с уровнем С1q и С3, ФАЛ, достоверно - процент Т- и В (ЕАС)-клеток. У молодняка контрольной группы вследствие заболевания омфалитом и диареей отмечали более раннюю В-клеточную дифференцировку – увеличение абсолютного их количества с IgG-рецепторами (Р<0,01), содержания в крови С3 (острофазный белок), ФАЛ и КАСК – на 23,3; 9,0 и 33,1% соответственно.
У телят контрольной группы 2-х недельного возраста, переболевших омфалитом и диареей, отмечали лейкоцитоз и лимфоцитоз (Р<0,001), увеличение концентрации С3 на 12,3%, IgМ – на 9,3% в сочетании с уровнем В-RIgM-клеток, ЛАСК – на 27,2%, но более низкие (на 11,0 и 13,5%) значения – ФЧ и ФИ, а в месячном возрасте – повышенный уровень IgМ в крови - на 23,2% (Р<0,001) и IgG – на 24,4%, то есть активацию первичного и вторичного гуморального иммунитета.
Таким образом, установлено прямое влияние оптимизации обмена веществ на иммунный статус в системе мать-плод-новорожденный, что обусловило умеренную реактивность у них иммунной системы и повышение устойчивости телят к возникновению неонатальных болезней.
3.2. Иммунный статус и морфология локального иммунитета при
болезнях коров в послеродовой период
3.2.1. Иммунный статус коров, заболевших эндометритом
У коров, предрасположенных к заболеванию после родов эндометритом, по сравнению с оставшимися здоровыми, за 2-2,5 мес до отёла отмечали повышенный уровень в крови лейкоцитов на 40,5% и лимфоцитов – на 80,0% (Р<0,05), напряжённость локального иммунитета (уровня IgА) – в 1,74 раза (Р<0,01), ЛАСК – на 27,2%, ФЧ – на 11,4%, ФИ – на 7,8%, но низкую БАСК (Р<0,02). Эти изменения свидетельствуют о мобилизации защитных систем организма, вероятно, на эндогенную интоксикацию. При этом также был выше на 67,8% (Р<0,02) абсолютный уровень Т-клеток за счёт лимфоцитоза.
За 1-2 недели до отёла у заболевших коров наблюдали отрицательную динамику количества лейкоцитов и лимфоцитов в крови, вероятно, вследствие повышенной миграции в стенку матки, снижение КАСК на 32,8% (Р<0,05) в сочетании с уменьшением уровня С1q на 41,3% и С3 – на 26,8% (Р<0,05), ФЧ и ФИ (Р<0,05; Р<0,02). По отношению к контролю, произошло увеличение относительного количества Т-лимфоцитов на 9,9% и абсолютного - на 41,2%, у них были выше также процент и абсолютное число В-клеток с IgG- (Р<0,02; Р<0,01) и IgМ-рецепторами.
На 3-6 день после отёла у больных животных, вследствие мобилизации неспецифических защитных механизмов, отмечали динамическое увеличение до уровня у коров контрольной группы ФЧ и ФИ, КАСК в сочетании с показателями - С1q и С3, числа лимфоцитов, более высокую ЛАСК на 24,6%. При этом заметно ниже концентрация IgМ на 18,6%, исчезал или снижался коэффициент достоверности между уровнями IgА в крови, что обусловлено повышенной транссудацией иммуноглобулинов из сыворотки крови. Однако отрицательная динамика уровня IgG в крови была менее выраженной, что предположительно связано с активацией вторичного гуморального иммунитета. Вследствие нарушения адаптации к родовому стрессу у больных коров значительно уменьшился (на 14,4%) процент Т-лимфоцитов при увеличении (на 16,6%) у здоровых животных.
Через 2 недели после родов у больных, по сравнению со здоровыми, отмечали выраженный лейкоцитоз и лимфоцитоз, соответственно - на 36,2 и 56,3%, в результате чего было стабильно выше абсолютное число Т-клеток (на 44,7%), В-RIgG- и RIgМ-клеток (в 3,36 и 2,4 раза), наблюдали активацию локального иммунитета – увеличение концентрации IgА в крови в 1,76 раза, а также вторичного ответа - уровня IgG на 20,0% (Р<0,05).
Таким образом, у заболевших послеродовым эндометритом коров вследствие повышенного антигенного воздействия, отмечаются значительные изменения (дисбаланс) в иммунном статусе, характеризующиеся напряжённостью защитных систем организма и неустойчивой динамикой показателей.
3.2.2. Локальный иммунитет у коров, больных послеродовым
эндометритом
Через неделю после отёла в маточной слизи у больных эндометритом коров выше, чем у здоровых, концентрация IgG в 4,5 раза, IgМ – в 5,6 раза, а также С1q – в 7,7 раза (Р<0,02) в результате усиления локального его образования макрофагами, и С3 - в 1,55 раза, но ниже уровень IgА – в 2,0 раза, и практически равное соотношение SIgA/cIgA у них – 1:0,47 и у здоровых животных - 1:0,48 (табл. 1).
Таблица 1
Содержание иммуноглобулинов и белков системы комплемента в маточной
слизи у здоровых и больных послеродовым эндометритом коров
| Показатели | здоровые животные | эндометрит | здоровые животные | эндометрит |
| Через неделю после отёла | Через 2 недели после отёла | |||
| IgG, г/л | 0,376±0,17 | 1,690±0,43хх | 0,543±0,20 | 3,690±0,40** |
| IgM, г/л | 0,032±0,01 | 0,180±0,053хх | 0,073±0,016 | 0,410±0,081* |
| IgA (общ.), г/л | 0,562±0,17 | 0,280±0,039 | 0,187±0,019 | 0,420±0,109** |
| SIgA, г/л | 0,378±0,11 | 0,190±0,024 | 0,123±0,01 | 0,260±0,063 |
| сIgA, г/л | 0,183±0,056 | 0,090±0,016 | 0,064±0,004 | 0,160±0,047** |
| SIgA/cIgA | 1:0,48 | 1:0,47 | 1:0,52 | 1:0,62 |
| C1q, ЕД | 11,3±11,3 | 86,7±23,5хх | 6,67±6,67 | 136,0±33,3* |
| C3, ЕД | 3,29±1,39 | 5,09±1,02 | 3,78±0,69 | 13,2±1,94** |
х -Р<0,05; хх-Р<0,02; *-Р<0,01; **-Р<0,001 - по сравнению с контролем
Через две недели после отёла у больных коров, вследствие выраженных гемодинамических расстройств, концентрация IgG увеличилась – в 6,8 раза (Р<0,001), IgМ – в 5,6 раза (Р<0,01). Существенно повысился уровень IgА – в 2,25 раза (Р<0,001) и снизилось соотношение SIgA/cIgA - 1:0,62 против 1:0,52 в норме. Значительно увеличилась концентрация С1q – в 20,4 раза (Р<0,01) и С3 – в 3,5 раза (Р<0,001).
Выраженные нарушения гемодинамики у больных послеродовым эндометритом коров обусловливают транссудацию сывороточных белков и эмиграцию форменных элементов крови в стенку матки, что при морфологическом исследовании подтверждалось наличием отёка, вакуолизации и нейтрофильной инфильтрации эндометрия.
При эндометрите у коров локальный иммунный ответ проявлялся очаговой и диффузной лимфоидно-макрофагальной инфильтрацией, плазмоклеточной реакцией и фагоцитозом микроорганизмов в основной пластинке матки (рис. 1).

Рис.1. Состояние местного иммунитета в матке у коров, больных послеродовым эндометритом: а) миграция нейтрофилов в эпителиальный слой и его разрушение; б) очаговая нейтрофильная инфильтрация и плазматизация эндометрия; в) очаговая лимфоидно-макрофагальная инфильтрация эндометрия; г) очаговая лимфоидная инфильтрация и плазматизация эндометрия; д) активный фагоцитоз кокковой микрофлоры.
3.2.3. Иммунный статус коров при мастите
У коров, предрасположенных к заболеванию субклиническим и клиническим маститом, по сравнению с оставшимися здоровыми, за 2-2,5 месяца до отёла повышены: содержание в крови лейкоцитов, соответственно – на 19,0 и 21,1%, лимфоцитов – на 33,9 и 37,9% (Р<0,05), абсолютное число Т-клеток – на 14,8 (Р<0,05) и 40,0%, В-клеток (ЕАС) – на 83,1 и 37,3%, уровень IgА – в 1,56 (Р<0,05) и 1,55 раза, а клиническим маститом также IgG - на 11,8%.
За 1-2 недели до отёла наблюдали повышение БАСК – на 4,1 и 7,5% (Р<0,05), но снижение КАСК – на 28,4 (Р<0,05) и 30,2% в сочетании с уровнем С1q – на 12,1и 13,6% и С3 – на 14,6 и 15,5%, ЛАСК – на 42,7 и 16,9%, ФЧ – на 16,8 и 31,0% (Р<0,05), ФИ – на 17,5 и 30,6% (Р<0,01), числа лейкоцитов и лимфоцитов в крови до такового у здоровых животных, увеличение относительного количества Т-клеток – на 19,0 и 23,8%, более высокий процент В-RIgG-клеток – в 2,24 и 1,6 раза и абсолютное их число – в 2,36 и 1,5 раза, снижение концентрации IgG в крови – на 21,6 и 21,2% вследствие повышенной транссудации в пораженные доли молочной железы.
На 3-6 день после отёла у больных коров произошло увеличение до уровня у здоровых животных или превышение его показателей: ЛАСК, КАСК, С1q, С3, ФЧ и ФИ, но отмечали дефицит относительного количества Т-клеток – на 22,7 и 13,2%, относительного и абсолютного числа В-RIgG-клеток – на 30,8 и 25,6%, более низкую концентрацию в крови IgG – на 14,1 и 7,7%, IgМ – на 32,8 (Р<0,05) и 9,0%, и выраженную тенденцию снижения уровней IgА.
Через две недели после отёла у больных скрытым и клиническим маститом наблюдали лейкопению (на 10,5 и 21,2%), у последних также - лимфоцитопению (на 18,9%) вследствие усиления миграции клеток в поражённые доли молочной железы в отсутствие своевременного лечения, снижение ФЧ – на 31,1 и 46,4%, ФИ – на 32,9 и 47,0%, повышение: ЛАСК – на 25,0 и 12,3%, содержания IgА в крови – в 2,0 (Р<0,02) и 1,95 раза (Р<0,01), у последних также IgG – на 23,0%.
Таким образом, установлено, что при гнойных инфекциях независимо от локализации (эндометрит, мастит) у коров, находящихся в равных условиях, наблюдаются практически идентичные изменения иммунного статуса в исследуемые периоды.
3.2.4. Локальный иммунитет в молочной железе у коров при мастите
У коров через две недели после отёла при возникновении субклинического мастита защита молочной железы осуществляется за счёт локального иммунитета. В молоке поражённых долей, по сравнению с нормальным, достоверно увеличивается общий уровень IgА на 233% (SIgA – на 194%, сывороточная форма IgA – на 300%), IgМ – на 40,4% при незначительном повышении уровня IgG - на 12,4% (табл. 2).
Развитие воспалительного процесса при скрыто протекающем мастите сопровождалось усилением транссудации белков из сыворотки крови. Концентрации IgG и IgМ в поражённых долях повысились, соответственно – на 91 и 113%, IgА – на 310% (SIgA – на 269%, сIgA – на 371%), соотношение SIgA/сIgA снизилось и составило - 1:0,85 против 1:0,67 в молоке из нормальных долей.
При клиническом мастите, вследствие усиления сосудистых расстройств, в поражённых долях значительно повышается уровень IgG - на 580%, IgМ – на 101%, IgА – на 300% (SIgA – на 167% и сIgA – на 577%), соотношение SIgA/сIgA снижается до 1:1,22 против 1:0,48 в здоровых долях.
При морфологическом исследовании установлено, что субклинический мастит характеризуется очаговым поражением молочной железы, наличием в просвете альвеол небольшого количества полиморфноядерных лейкоцитов, утолщением межальвеолярной соединительной ткани и увеличением числа лимфоидных и плазматических клеток, что подтверждает преимущественно локальный синтез иммуноглобулинов. При клиническом мастите наблюдали обширную внутридольковую и междольковую нейтрофильную инфильтрацию, диффузную межальвеолярную и междольковую лимфоидную инфильтрацию, менее выраженную плазмоклеточную реакцию, деструктивные изменения и снижение секреции в молочной железе (рис. 2).
Таблица 2
Концентрации иммуноглобулинов в секрете молочной железы у здоровых и больных маститом коров
| Группы животных | IgG, г/л | IgM, г/л | IgA, г/л | SIgA, г/л | сIgA, г/л | SIgA/cIgA |
| Клинически здоровые коровы, доли (n=14) | 0,660±0,11 | 0,201±0,041 | 0,115±0,033 | 0,065±0,014 | 0,050±0,018 | 1:0,77 |
| Субклинический мастит (ранняя стадия): | ||||||
| Поражённые доли (n=6) Здоровые доли (n=4) | 0,679±0,087 (+12,4%) | 0,132±0,045 (+40,4%) | 0,180±0,046х (+233,3%) | 0,100±0,023х (+194,4%) | 0,080±0,037х (+300,0%) | 1:0,80 |
| 0,620±0,12 | 0,094±0,031 | 0,054±0,013 | 0,034±0,007 | 0,020±0,006 | 1:0,59 | |
| Субклинический мастит: | ||||||
| Поражённые доли (n=11) Здоровые доли (n=9) | 0,899±0,091** (+91,3%) | 0,226±0,045х (+113,2%) | 0,246±0,045** (+310,0%) | 0,133±0,021 (+269,4%) | 0,113±0,025* (+370,8%) | 1:0,85 |
| 0,470±0,051 | 0,106±0,019 | 0,060±0,008 | 0,036±0,005 | 0,024±0,004 | 1:0,67 | |
| Клинический мастит: | ||||||
| Поражённые доли (n=8) Здоровые доли (n=6) | 3,040±0,37** (+580,1%) | 0,329±0,088 (+100,6%) | 0,320±0,089х (+300,0%) | 0,144±0,032х (+166,7%) | 0,176±0,062х (+576,9%) | 1:1,22 |
| 0,447±0,086 | 0,164±0,048 | 0,080±0,027 | 0,054±0,022 | 0,026±0,007 | 1:0,48 | |
х-Р<0,05; *- Р<0,01; **-Р<0,001 – по сравнению с здоровыми долями; (%) - прирост по отношению к уровню в здоровых долях

Рис.2. Структурные изменения и состояние локального иммунитета в молочной железе у коров: а) норма; б) нейтрофилы в секрете альвеол очага поражения, межальвеолярная лимфоидная инфильтрация; в) интенсивная плазмоклеточная реакция при субклиническом мастите; г) выраженная внутриальвеолярная и межальвеолярная нейтрофильная инфильтрация при клиническом мастите.
3.3. Иммунный статус и морфология локального иммунитета
при болезнях телят
3.3.1. Формирование и причины нарушения колострального
иммунитета у телят, его связь с заболеваемостью колибактериозом
Установлено, что колостральный иммунодефицит у телят при своевременной выпойке молозива (не позднее 1,5 часов после рождения) обусловлен:
- низким содержанием иммуноглобулинов в молозиве первого удоя, индивидуальные концентрации которых у коров 3-5 отёлов, значительно варьировали: IgG - от 29,0 до 177,0 г/л, IgМ – 7,4 - 23,0 г/л и IgА – 1,35 - 14,1 г/л. Выявлена положительная коррелятивная связь между содержанием IgА, IgG и IgМ в молозиве матерей и сыворотке крови у однодневных телят (r=0,591; r=0,543 и r=0,509);
- недостаточным потреблением телятами молозива в первую выпойку (от 0,5 до 2,0 литров), зависящим от выраженности у них сосательного рефлекса в течение первых 1-1,5 ч жизни, который был слабее у телят, полученных при затяжных родах, что связано с наличием у них дыхательного ацидоза.
Так, количество потреблённого телятами с молозивом матери IgG в первую выпойку варьировало от 29 до 177 г, в четвёртую – от 6 до 100 г, а в сумме в первые сутки при 4-кратной выпойке - от 140 до 475 г. При этом не у всех телят количество потреблённого с молозивом IgG при каждой последующей выпойке носит убывающий характер, что отразилось на повышении коэффициента корреляции между уровнем IgG (г/л) в сыворотке крови телят и абсолютным количеством IgG (г), поступившим в желудочно-кишечный тракт с молозивом за сутки (r=0,725), чем с молозивом первого удоя (r=0,683);
- низкой абсорбцией иммуноглобулинов в кишечнике (от 2,44 до 31,9%). При поступлении в пищеварительный тракт телят низкого количества иммуноглобулинов абсорбция снижается. Так, у телят, получивших за сутки в 2 и 1,5 раза меньше количества IgG, чем новорожденные контрольной группы, интенсивность всасывания была ниже (7,44±2,45%), соответственно в 1,91 и 1,76 раза, в итоге содержание IgG в сыворотке крови ниже - в 4,1 и 2,6 раза.
Одновременно с поступлением иммуноглобулинов в систему циркуляции крови, происходит перераспределение их на «отдалённые» слизистые оболочки.
Наряду с IgG, IgМ и сывороточной формой IgА в систему кровообращения телят абсорбировался и SIgА, при этом соотношение SIgА/сIgА индивидуально, и менялось соответствуя содержанию их в молозиве.
Установлено, что в носовом секрете телят до приёма молозива содержание иммуноглобулинов незначительно: IgG - от 0,019 до 0,090 г/л, IgА - 0,006-0,021 г/л при соотношении SIgА/сIgА - 3:1. На 2-е сутки после приёма телятами молозива концентрация IgG в носовом секрете увеличилась в среднем в 8 раз, а общее содержание IgА только в 1,75 раза, причём за счёт сывороточной формы IgА, тогда как уровень SIgА оставался практически неизменным. Следовательно, переход SIgА на поверхность слизистой верхних дыхательных путей не происходит, а местная защита в первые дни жизни телят осуществляется, главным образом, за счёт перехода из сыворотки крови IgG и незначительного поступления сывороточной формы IgА. Однако через две недели общее содержание IgА в носовом секрете у телят значительно возросло – в среднем в 9 раз (SIgА – в 10 раз, сывороточная форма IgА – в 7,7 раза), что при снижении (в 6 раз) уровня IgА в сыворотке крови свидетельствует о локальной их продукции. Содержание IgG повышалось лишь в 1,2 раза.
У телят с колостральным иммунодефицитом (IgG<8 г/л) наблюдали более ранний первичный, вторичный и локальный иммунный ответ: увеличение уровня IgМ в крови - в двухнедельном возрасте, IgG и IgА - в месячном, а у телят с высоким лактогенным иммунитетом (IgG>17 г/л), повышение уровня IgМ и IgА происходило в возрасте 2-х, а IgG - 2,5 месяцев.
Выявлена прямая связь между уровнем противоэшерихиозных антител и IgG в сыворотке крови у однодневных телят, родившихся от привитых коров. Так, при концентрации IgG выше 20 г/л признаки диареи отсутствовали, от 10-17 г/л, отмечали в 54%, а ниже 8 г/л – в 75% случаев.
Нарушение формирования колострального иммунитета повышает риск возникновения у новорожденных неонатальных патологий - омфалита, септицемии, диарейного и респираторного синдромов.
3.3.2. Иммунный статус телят при омфалите
Изучено влияние иммунного статуса на заболеваемость телят омфалитом, родившихся от коров с нарушенным (1-я опытная группа) и нормализованным обменом веществ (2-я опытная группа).
В патогенезе омфалита принимали участие условно патогенные микрорганизмы - Proteus vulgaris, Proteus mirabilis, Str. fаecalis, стрептококки группы С.
У 2-4 дневных телят до проявления клинических признаков как тяжёлого (1-я группа), так и лёгкого течения омфалита (2-я группа), по сравнению с оставшимися здоровыми, отмечали лейкоцитоз (Р<0,01; Р<0,05), лимфоцитоз (Р<0,01), дефицит относительного уровня Т-клеток – на 30,4 (Р<0,01) и 7,4%, в обоих случаях (вдвое) ниже процент и (в 1,31 и 1,36 раза) абсолютное число В-клеток с С3-рецепторами, в 1,81 (Р<0,01) и 1,67 раза – с IgМ-рецепторами. У них был выраженный колостральный иммунодефицит – достоверно (вдвое) ниже уровень IgG в крови, в 3,48 и 2,79 раза - IgМ, в 2,63 и 2,29 раза – IgА, а также показатели естественной резистентности: БАСК – на 4,5 и 8,2%, ЛАСК – в 1,45 и 1,6 раза, С1q – на 28,5% (Р<0,01) и 31,6% (Р<0,001), но более высокие уровни С3 – на 67,0% (Р<0,02) и 45,1% (Р<0,05) и показатели фагоцитоза - ФЧ – в 1,49 (Р<0,01) и 1,48 раза, ФИ – в 1,28 и 1,16 (Р<0,05) раза, что свидетельствуют о возникновении воспалительного процесса.
У больных телят 2-х недельного возраста, особенно 1-й группы, увеличилось содержание лейкоцитов и лимфоцитов в крови, в обоих случаях (в 1,47 раза) – абсолютное число Т-клеток, превысив показатель контроля - в 1,21 и 1,22 раза соответственно. Вследствие активной дифференцировки, у молодняка 1-й группы выше относительный и абсолютный уровень В-RIgG-клеток - на 9,7 и 87,5% (Р<0,05), у телят 2-й группы - на 10,3 и 31,3% соответственно, а также количество В-RIgМ-клеток, что сочеталось с ранней (скрытой) индукцией первичного и вторичного гуморального ответа - менее выраженной отрицательной динамикой уровня IgМ и IgG в крови, чем у здоровых животных. У первых, достоверно снизилась БАСК (Р<0,001), у всех больных оставались ниже: ФАЛ, уровень С1q (Р<0,001; Р<0,001), но повысилась в динамике ЛАСК, и достоверно, уровень С3 (Р<0,001; Р<0,01), у телят с лёгким течением омфалита также ФЧ и ФИ (Р<0,01; Р<0,001).
У переболевших омфалитом телят месячного возраста отмечали дефицит абсолютного количества Т-клеток (на 26,1 и 11,3%), более низкие: БАСК (Р<0,05; Р<0,05), уровень С1q (Р<0,02; Р<0,001), ФАЛ – на 5,1 и 11,9% (Р<0,02), у первых из них – ЛАСК в 1,53 раза, но активацию первичного гуморального ответа – увеличение уровня IgМ в крови на 7,5%, у вторых, менее выраженное его снижение, чем у здоровых, оставался выше уровень С3 – на 35,5 (Р<0,001) и 19,3%, ФЧ и ФИ (Р<0,05-Р<0,01), то есть наблюдался выраженный дисбаланс специфических и естественных факторов защиты.
Заболеваемость омфалитом телят, родившихся от коров с нормализованным обменом веществ, по сравнению с молодняком, полученным от коров с нарушенным метаболизмом, существенно снижалась и составила – 30,8% против 63,3%, а продолжительность болезни – 6,6 против 16,5 дней.
3.3.3. Иммунный статус телят при диарейном синдроме
Изучено влияние иммунного статуса на заболеваемость телят колибактериозом, родившихся от коров с нарушенным (1-я опытная группа) и нормализованным обменом веществ (2-я опытная группа).
Из содержимого кишечника и паренхиматозных органов больных телят выделены культуры E. coli серовариантов: О41, О2, О4, О142 и О103. В пробах фекалий методом ПЦР определено наличие генома вируса ВД-БС в 60%, хламидий - в 40%.
У 2-4 дневных телят 1-й и 2-й групп, которые были предрасположены соответственно к тяжёлому и лёгкому течению диареи, выше, чем у оставшихся здоровыми, количество лейкоцитов в крови – на 27,0 (Р<0,01) и 6,6%, у первых также лимфоцитов - на 36,4% (Р<0,05), но дефицит относительного уровня Т-клеток – на 25,5% (Р<0,05), в обоих случаях кроме того – В-клеток с С3- и IgМ-рецепторами (Р<0,001; Р<0,05), заметно выражен колостральный иммунодефицит – достоверно ниже содержание в крови IgG – на 37,4 и 46,3%, IgМ – на 57,5 и 44,7%, IgА – на 51,3 и 43,6%, титры антител к Е. соli – в 3,75 и 2,0 раза, БАСК – на 13,5 (Р<0,01) и 3,0%, ЛАСК – на 22,2 и 16,7%, С1q – на 29,2 и 25,5% (Р<0,01; Р<0,02). При этом более высокий уровень С3 – на 58,3 (Р<0,01) и 19,7%, а у телят с тяжёлым течением болезни - ФЧ и ФИ (Р<0,05), свидетельствуют о наличии воспалительного процесса.
У больных телят 2-х недельного возраста обеих групп наблюдали тенденцию к снижению абсолютного числа Т-клеток. У молодняка 1-й группы - лейкоцитоз, тенденция уменьшения количества лимфоцитов, увеличение относительного и абсолютного числа В-клеток с С3- и IgМ-рецепторами, что сопровождалось активацией первичного ответа – менее выраженным снижением уровня IgМ в крови - в 2,05 раза против 2,48 раза у здоровых телят, но более интенсивное снижение уровня IgG - в 1,83 раза против 1,4 раза в контроле, что связано с усилением элиминации и выведением белков при диарее. У больных телят 2-й группы - снижение числа лейкоцитов и лимфоцитов в крови, менее выражен первичный ответ. У больных животных обеих групп оставались ниже, чем у здоровых, БАСК (на 10,3 и 10,4%), ЛАСК (на 10,4 и 38,8%), уровень С1q (на 43,5 и 36,0%), ФАЛ – на 8,4% (Р<0,001) и 8,1%, значения - ФЧ и ФИ (Р<0,01-0,05), но заметно выше уровни С3 (на 12,7 и 11,6%), отражающие более высокую активность системы комплемента.
У переболевших диареей телят месячного возраста, по сравнению со здоровыми, отмечали дефицит абсолютного количества Т-клеток (на 20,0 и 12,4%), у телят 1-й группы также относительного (на 29,8%), увеличение уровня IgМ в крови – на 33,8 и 15,0%, у первых положительную динамику уровня IgG (на 7,6%) в сочетании с увеличением процента и абсолютного числа В-RIgG-клеток (Р<0,02; Р<0,02). В обоих случаях, оставались ниже БАСК – на 8,4 (Р<0,001) и 5,2%, у телят 1-й группы - ФАЛ (Р<0,01), уровни С1q – на 35,9% (Р<0,001) и 22,1%, но выше ФЧ – на 76,7 (Р<0,01) и 43,5%, ФИ – на 87,8 (Р<0,001) и 63,0%, у телят 1-й группы также уровень С3 – на 11,0%.
Заболеваемость колибактериозом телят, родившихся от коров с нормализованным метаболизмом, была существенно ниже и составила – 65,4% против 96,7%, а продолжительность болезни – 3,53 против 7,14 дней у молодняка, полученного от коров с нарушенным обменом веществ.
Таким образом, установлено, что одной из основных причин возникновения неонатальных патологий (омфалита и диареи) у телят, родившихся от коров с разным метаболизмом, является дефицитный уровень пассивной колостральной защиты. Заболеваемость последних с более высоким содержанием Т-лимфоцитов в крови снижалась, что, по-видимому, связано не с реализацией Т-клеточного иммунитета, а с морфофункциональным состоянием тимуса, его гормональным статусом, влияющим на синтез Е-рецепторов, и отражающим степень развития всех органов и систем организма новорожденных. Это подтверждалось также наличием у них более высокого, близкого к таковому у здоровых животных, уровня В-клеток в крови, показателей естественной резистентности - БАСК, ЛАСК и С1q-компонента комплемента.
Учитывая то, что С1q вырабатывается наряду с макрофагами также энтероцитами подвздошной и толстой кишки, можно предположить, что интенсивность его биосинтеза у новорожденных отражает степень морфофункционального развития пищеварительного тракта и устойчивость к воздействию патогенов.
При гистологическом исследовании в тонком кишечнике больных колибактериозом телят 4-10 дневного возраста установлены выраженные сосудистые расстройства - гиперемия и стаз. В сосудах подслизистой основы наличие значительного количества лимфоцитов и нейтрофилов, что связано с активной их эмиграцией, сосуды субэпителиальной области ворсинок кровенаполнены, кровоизлияния в строму, инфильтрация её нейтрофилами, впоследствии разрушение эпителия ворсинок, выход нейтрофилов в полость кишечника и скопление их в углублениях крипт, а также клеточного детрита в полости органа. Об активации иммунных механизмов свидетельствует наличие в ворсинках тонкой кишки значительного количества межэпителиальных лимфоцитов, появление плазмоцитов в собственном слое слизистой, а в отдельных лимфоидных фолликулах пейеровых бляшек подвздошной кишки - светлых (реактивных) центров (рис. 3).
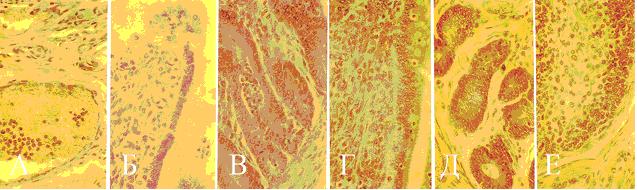
Рис.3. Структурное состояние локального иммунитета при колибактериозе у телят: а) стаз, значительное количество нейтрофилов в сосудах; б) миграция нейтрофилов в эпителиальный слой и его разрушение; в) скопление нейтрофилов в углублениях крипт; г) увеличение числа МЭЛ; д) появление плазмоцитов в lamina propria тонкой кишки; е) появление светлых центров в лимфоидных фолликулах подвздошной кишки.
3.3.3. Иммунный статус телят при респираторном синдроме
Изучен иммунный статус телят, заболевших респираторным синдромом, полученных от коров с нарушенным (1-я опытныя группа) и нормализованным (1-я опытныя группа) обменом веществ. Заболевали телята, переболевшие диареей, что наблюдалось в 70 и 64% соответственно, поэтому иммунный статус телят 2-х недельного возраста соответствовал таковому у больных колибактериозом.
Этиологическая структура респираторных болезней телят при исследовании 6 проб носовой слизи представлена наличием генома вируса ВД-БС в 50,0%, микоплазм - в 100% и хламидий - в 16,7%. В сыворотке крови коров до запуска обнаружены в диагностических титрах антитела к вирусу ПГ-3 (1:320-1:1256) в 100%; ВД-БС (1:16-1:64) в 92,9% и ИРТ (1:16) в 17,9%, что свидетельствует о циркуляции этих возбудителей в хозяйстве.
Из носовой слизи больных телят выделены культуры: Staph. haemolyticus (25%), Staph. aureus (8,3%), Staph. saprophiticus (8,3%), стрептококков группы С, В и Str. faecium (каждый - 16,7%), Str. salivalis (8,3%), E. сoli серогрупп - 08, 0101, (каждый - 8,3%), 026 (16,7%), 01, 04, 0103 (каждый - 25,0%), Enterobacter cloceae (8,3%).
Результаты исследований свидетельствуют о наличии ассоциированной вирусно-бактериальной респираторной патологии у молодняка в хозяйстве.
У телят, родившихся от коров с нарушенным метаболизмом до появления клинических признаков болезни, выше, чем у здоровых животных уровень лейкоцитов в крови на 32,1% (Р<0,01), лимфоцитов – на 14,8%, дефицит относительного количества Т-клеток – на 19,9%, В-клеток с С3-рецепторами – на 34,6%, у них и телят 2-й группы – колостральный иммунодефицит, содержание IgG в крови ниже – на 46,5 и 39,2%, IgМ – на 39,7 и 51,9%, IgА – на 53,6 и 60,0%, а также БАСК – на 10,9 и 12,2% (Р<0,01-0,05), С1q – на 36,5 и 27,2%, ФАЛ – на 6,3 и 7,9%, но выше процент В-RIgG-клеток – в 1,5 и 2,4 раза и абсолютное их число – в 1,77 и 2,0 раза (Р<0,02), уровень С3 – на 34,8% (Р<0,02) и 11,5%, ФЧ – в 1,6 и 1,74 раза, ФИ – в 1,7 и 1,9 раза.
У больных телят месячного возраста 1-й группы увеличилась степень дефицита относительного и абсолютного количества Т-лимфоцитов, повысилось число В-клеток с С3- и IgG-рецепторами в сочетании с уровнем IgG в крови. У больных животных обеих групп наблюдали менее выраженное снижение уровня IgМ - на 4,3 и 16% против 26,3% у здоровых и тенденцию увеличения концентрации IgА, что свидетельствует о более ранней активации первичного и локального иммунитета.
Однако у телят 2-й группы в возрасте 1,5 месяцев после перевода на доращивание в помещения с недостаточной освещенностью, повышенной влажностью, наличием сквозняков, вследствие нарушения адаптации к стресс-воздействию, произошло значительное снижение относительного и абсолютного количества Т-клеток – на 29,8 и 32,3% (Р<0,01; Р<0,01), В-RIgМ-клеток – на 32,2 и 35,4% (Р<0,01; Р<0,05), угнетение синтеза IgG и IgМ. В отличие от них у молодняка 1-й группы количество В-RIgG-клеток увеличилось, и достоверно по отношению к показателю контроля - концентрация IgG в крови (Р<0,01). У больных телят 1-й и 2-й группы, независимо от проявления системного гуморального ответа, отмечали значительное усиление локального иммунитета, концентрации IgА в крови, по отношению к таковой у здоровых телят, в обоих случаях повысились – в 1,4 раза. У них был стабильно ниже уровень С1q в крови (Р<0,01; Р<0,01), формировался дефицит содержания С3 (Р<0,02; Р<0,02), а у телят 2-й группы также снижались - ЛАСК (Р<0,001), ФАЛ (Р<0,001), ФЧ и ФИ.
Иммунный статус больных телят 2,5-3 месячного возраста при хронизации патологического процесса характеризовался повышенным содержанием лейкоцитов и лимфоцитов. У молодняка 2-й группы, несмотря на более высокое содержание В-RIgG-клеток, на фоне Т-дефицита отмечали снижение концентрации IgG в крови на 9,1% при повышении (на 40,4%) у здоровых телят и (на 3,3%) 1-й группы, существенно более низкий уровень IgМ. У здоровых животных в этот период содержание IgА в крови несколько превысило таковое у больных телят обеих групп.
Изменения в иммунном статусе после перевода телят 2-й группы на доращивание были связаны с вспышкой парагриппа-3. Об этом свидетельствует повышение у них в крови в период с 1 до 1,5-2 месяцев титра антител с 1:113 до 1:218, но в возрасте 2,5-3 месяцев произошло значительное снижение - до 1:39, что сочеталось с динамикой уровня иммуноглобулинов в крови. В отличие у молодняка 1-й группы, титр антител к парагриппу-3 вначале снизился с 1:93 до 1:39, а впоследствии увеличился до 1:65.
Таким образом, результаты исследований свидетельствуют о том, что в условиях одного хозяйства у одновозрастных телят при сходной этиологической структуре респираторных болезней, но находящихся в разных условиях содержания, иммунный статус и ответ претерпевают значительные изменения и отражают реакцию организма в зависимости от адаптации к воздействию неблагоприятных факторов окружающей среды.
При гистологическом исследовании в верхних и средних долях лёгких у телят на ранней стадии развития респираторной патологии отмечали венозный застой - в межальвеолярной и междольковой соединительной ткани многочисленные эритроциты, которые заполняли также просвет альвеол, что отражает слабость сердечной деятельности и состояние систем организма в целом. Вначале наблюдали воспаление крупных бронхов – перибронхиты, периваскулиты, впоследствии - распространение патологического процесса по бронхиальному дереву на окружающую легочную ткань. Развитие катарально-гнойной бронхопневмонии сопровождалось скоплением в бронхах и альвеолах клеток респираторного эпителия, в них и интерстициальной ткани - нейтрофилов. Об активном локальном иммунитете свидетельствует наличие в структурах легких значительного количества макрофагов, лимфоцитов и плазмоцитов (рис. 4).

Рис. 4. Структурные изменения и состояние локального иммунитета при респираторном синдроме у телят: а) венозный застой; б) перибронхит; в) лимфоидная и плазмоклеточная реакция по периферии поражённого бронха; г) катарально-гнойная бронхопневмония (нейтрофильная, лимфоидно-макрофагальная инфильтрация и плазмоклеточная реакция); д) продуктивная пневмония – разрастание межальвеолярной соединительной ткани, наличие в ней плазмоцитов.
3.4. Коррекция иммунного статуса крупного рогатого скота
3.4.1. Коррекция иммунного статуса коров лигфолом, лигавирином и селедантом при специфической профилактике эшерихиоза и сальмонеллёза у телят
После двукратной вакцинации сухостойных коров против эшерихиоза и сальмонеллёза в сочетании с применением лигфола в дозе 5 мл внутримышечно, лигавирина – 5 мл подкожно и селеданта – 20 мкг/кг внутримышечно, у них за 1-2 недели до отёла отмечали стабилизацию по сравнению с увеличением у животных контрольной группы уровня лейкоцитов и лимфоцитов в крови, модуляцию показателей - БАСК, ЛАСК, КАСК, ФЧ и ФИ, значительно более высокие, чем у интактных животных, значения - КАСК, С1q и С3.
Применение селеданта и лигавирина способствовало повышению абсолютного числа Т-клеток - на 28,6 и 8,8% при снижении их у интактных животных и контрольной группы (на 8,4 и 17,7%). У коров всех опытных групп наблюдали менее выраженное снижение относительного и абсолютного количества В-(ЕАС)-клеток, соответственно при применении лигфола - на 13,1 и 32,6%; лигавирина - на 14,2 и 38,8%; селеданта - на 26,6 и 38,2%, чем у интактных (на 50,3 и 66,4%) и контрольной группы (на 29,7 и 41,0%).
У них, по отношению к контролю, достоверно (в 1,5-2 раза) повысились в сыворотке крови титры поствакцинальных антител к эшерихиозному и сальмонеллёзному антигенам, что отразилось на более высоком их содержании в молозиве первого удоя, соответственно по группам - к эшерихиозному антигену – в 3,9; 9,6; 14,0, сальмонеллезному - в 2,48; 1,67; 4,42 раза и способствовало повышению эффективности пассивной защиты новорожденных телят в отношении возбудителей желудочно-кишечных болезней.
Таким образом, по-видимому, вследствие снижения свободнорадикального окисления препаратами, обладающими антиоксидантными свойствами, особенно при вакцинации, являющейся дополнительным стрессовым фактором, наблюдали опосредованно модулирующее их действие на иммунный статус и ответ.
3.4.2. Влияние лигфола, лигавирина и селеданта на иммунный
статус телят
Однократное применение телятам, родившимся от коров этих же групп, до приёма молозива лигфола в дозе 2 мл (1-я группа), лигавирина – 1 мл (2-я группа), селеданта – 20 мкг/кг (3-я группа), отразилось на более высоком иммунном статусе и уровне факторов неспецифической резистентности у них через сутки после рождения.
Так, у телят опытных групп, по отношению к контролю, отмечали более высокое содержание лейкоцитов и лимфоцитов в крови, соответственно на - 10,2 и 11,9%; 12,4 и 34,9%; 4,6 и 6,6%. У телят 2-й и 3-й групп повысились: процент Т-клеток (на 11,2 и 11,6%), у животных всех опытных групп - абсолютное их количество, особенно у обработанных лигавирином (Р<0,05), процент В-лимфоцитов с С3-рецепторами - на 8,0; 27,4 и 33,6% и абсолютное их число, процент В-RIgG-клеток - на 44,9; 8,0 и 83,3% и абсолютное их количество - на 61,2; 68,6 и 43,8%, процент, и абсолютное число В-RIgM-клеток - на 15,8; 12,6 и 40,8%.
Через сутки после рождения при незначительной разнице между содержанием IgG в крови, у телят опытных групп, заметно выше уровень IgM, соответственно - на 35,3; 26,7 и 56,9%, а также IgА - на 4,8; 17,1 и 15,3%, что, возможно, обусловлено влиянием иммуномодуляторов на повышение абсорбции высокомолекулярных белков. У них, вдвое и более выше уровень нормальных гемагглютининов, показатели естественной резистентности: БАСК - на 5,9; 12,2 и 16%, С1q - на 10,2; 39,8; 21,8% и С3 - на 9,6; 7,3; 32,8%, ФАЛ - 1,3-4,7%, ФЧ - 4,3-15,6% и ФИ - 3,2-11,1% соответственно.
Применение препаратов способствовало увеличению продолжительности всасывания IgG молозива в течение первых трёх дней жизни телят. Его уровень в сыворотке крови животных опытных (1-3-й) групп выше такового в контроле - на 19,9; 11,9 и 25,8% соответственно более высокими были и титры агглютининов к эшерихиозному антигену - в 1,56; 1,18 и 1,84 раза, и сальмонеллёзному - в 1,51; 1,64 и 1,63 раза.
Таким образом, полученные данные свидетельствуют о том, что препараты обладают иммуномодулирующими свойствами, действуя, по-видимому, трансплацентарно при применении их коровам, а также непосредственно при введении новорожденным, повышают уровень Т- и В-клеток в крови телят суточного возраста, показателей неспецифической защиты, вероятно, вследствие снижения оксидативного стресса, который они испытывают в первые дни жизни.
3.4.3. Коррекция иммунного статуса телят лигфолом, лигавирином и
селедантом при специфической профилактике сальмонеллёза,
парагриппа-3 и инфекционного ринотрахеита
Проведённые до специфической профилактики болезней иммунологические исследования показали, что в 2-х недельном возрасте у телят контрольной группы, которым препараты не вводили, произошло заметное увеличение процента и абсолютного уровня Т-клеток в крови, соответственно - на 14,2 и 64,4%, в меньшей степени снижение количества В-клеток с IgМ- и IgG-рецепторами, свидетельствующее об активации Т- и В-звена иммунитета, вероятно, вследствие повышенного антигенного воздействия, что наблюдалось на фоне более низких показателей неспецифической резистентности - БАСК, ЛАСК, С1q и С3-компонентов комплемента. Отмечен повышенный катаболизм колостральных антител - более выраженное снижение (в 1,88 раза) уровня IgG в крови, чем у телят (1-3-й) опытных групп, соответственно - в 1,44; 1,29 и 1,26 раза, а также IgA - в 13,3 раза против 12,1; 10,3; 8,2 раза.
Однако в месячном возрасте, предшествующая активация у них Т-звена иммунитета, сменилась резко выраженным его угнетением - снижением вдвое процента и абсолютного количества Т-клеток, тогда как применение лигавирина и селеданта способствовало стабилизации их уровня, а введение лигфола - повышению. Напротив, значительно увеличилось содержание в крови лейкоцитов и лимфоцитов (Р<0,05-0,02), процент и абсолютное число В-клеток с IgM- и IgG-рецепторами, абсолютное их количество с С3-рецепторами за счёт лимфоцитоза, что свидетельствуют о повышении общей реакции организма, ранней пролиферации и дифференцировки В-клеток, и миграции незрелых тимоцитов.
На этом фоне телят, полученных от подопытных коров, в месячном возрасте соответственно по группам иммунизировали в сочетании с применением иммуномодуляторов (в тех же дозах, что и при рождении) противосальмонеллёзной вакциной двукратно с интервалом 10 дней в дозе 2,0 мл и вакциной «Бивак» (ПГ-3, ИРТ) двукратно подкожно с интервалом в 1 месяц в объёме 1,0 мл.
Через две недели после двукратной иммунизации против сальмонеллёза и однократно - вакциной «Бивак» у телят опытных групп заметно увеличилось количество лейкоцитов и лимфоцитов в крови, при применении лигфола - на 28,8 и 36,3%, лигавирина - на 23,8 и 37,0%, селеданта - на 10,8 и 16,8% (в контроле - на 4,2 и 8,1%). При этом также процент Т-клеток - на 28,3; 37,7 и 59,0 (Р<0,05) % и абсолютное их число - на 21,5; 33,8 и 29,2% соответственно. У них более выражено увеличение процента и абсолютного количества В-RIgМ-клеток, соответственно - в 1,53 и 1,81; 1,25 и 1,81 и 1,36 и 1,45 раза, чем у телят контрольной группы (в 1,15 и 1,23 раза), а процент и абсолютное число В-RIgG-клеток - у телят 1-й, 2-й и контрольной группы - в 2,67 и 3,17; 3,77 и 2,55; 2,27 и 2,38 раза, чем у телят, обработанных селедантом (в 1,57 и 1,66 раза).
Вакцинация телят в сочетании с лигфолом и лигавирином сопровождалась более выраженным первичным и вторичным ответом. Уровень IgM в крови у них повысился - в 1,98 и 1,91 раза против - 1,77 и 1,66 раза у животных контрольной группы и обработанных селедантом, в меньшей степени снизились концентрации IgG - на 30,9 и 30,3% против 34,9 и 35,9% соответственно. Наибольший уровень В-клеток с IgМ- и IgG-рецепторами в сочетании с первичным и вторичным ответом у телят, вакцинированных в комплексе с лигфолом, отразился на повышении у них (1:11±1,96) титров антител к вирусу ИРТ, а уровень антител к сальмонеллёзному антигену достоверно (вдвое и более) превысил таковой в контроле у животных всех опытных групп.
К 2,5 месяцам, через три недели после повторной вакцинации телят «Бивак» в сочетании с селедантом, отмечали тенденцию к увеличению числа лимфоцитов в крови при заметном снижении у молодняка контрольной и 1-й группы. У них выше процент и абсолютное число Т-клеток, чем при применении лигфола, лигавирина и в контроле, соответственно - на 25,2 и 11,3%; 51,3 и 37,4%; 58,5 и 46,3%.
Применение селеданта и лигавирина способствовало увеличению процента и абсолютного числа В-RIgМ- и В-RIgG-клеток при снижении у телят, обработанных лигфолом и контрольной группы, повышению уровня IgM в крови - на 40,9 и 26,5% против 13,0 и 13,0% соответственно, а также концентрации IgA. Эти изменения сопровождались заметным увеличением у телят обеих опытных групп титров антител к вирусу ИРТ (1:12±5,06 и 1:14,7±4,22) при снижении у молодняка, обработанных лигфолом (до 1:7±1,46) и минимальном уровне в контроле (1:5,6±0,98). При общем снижении титров (колостральных) антител к вирусу ПГ-3, у телят опытных групп они удерживались на достоверно более высоком уровне по отношению к контролю. У всех привитых повысились титры антител к сальмонеллёзному антигену, но у животных опытных групп были достоверно выше, чем в контроле (Р<0,01).
За весь период исследований (70 суток) масса тела телят, обработанных лигфолом, увеличилась на 42,0±2,3, лигавирином - 38,7±2,9; селедантом - 45,9±2,5 кг, что выше по отношению к контролю - на 15,7; 6,6 и 26,4% соответственно.
Таким образом, применение препаратов в сочетании с вакцинацией телят против сальмонеллёза стимулировало антителогенез приблизительно в равной степени, но по-разному, оказывало влияние при введении вакцины «Бивак». Иммуномодулирующее действие лигфола проявлялось выраженным ответом на антиген вируса ИРТ после первой вакцинации, а селеданта и лигавирина - после повторной. При высоком уровне колостральных антител к вирусу ПГ-3, у всех вакцинированных телят до 2,5 месяцев не отмечено их увеличения, но длительная их циркуляция не исключает возможность антителообразования, более выраженного при применении селеданта и лигавирина.
3.5. Иммунный статус и морфология локального иммунитета при
болезнях свиноматок в послеродовой период
3.5.1. Иммунобиологический статус свиноматок в зависимости от возраста, сроков супоросности, его влияние на качество приплода, заболеваемость и сохранность поросят
Иммунный статус свиноматок 1-2 опоросов на 35 день супоросности, по сравнению с животными 3-6 и 7-8 опоросов, характеризовался более низким относительным уровнем Т-клеток – на 14,6 и 27,8%, IgG – на 48,4 и 56,6% (Р<0,05; Р<0,02), по сравнению с последними также IgМ – на 21,2% и IgA – 31,4%, ЦИК – в 2,1 и 1,7 раза, но более высоким содержанием лейкоцитов в крови – на 10,7 и 5,7%, их фагоцитарной ёмкости – на 13,0 и 7,0%, лимфоцитов – на 17,6 и 9,2%, ЛАСК – на 45,6 и 36,0%, а за 10 дней до родов отмечали увеличение абсолютного количества Т-клеток – на 36,1 (Р<0,05) и 29,0% за счёт Fc+-лимфоцитов (с супрессорной активностью). У них и животных 7-8 опоросов, по сравнению со средневозрастными свиноматками, установлено увеличение количества О-лимфоцитов – в 2,42 и 1,22 раза, и снижение абсолютного и относительного числа В-клеток – на 50,5 и 17,4%; 28,2 и 22,1% соответственно, менее выраженное повышение уровня IgA в крови – на 18,6% против 34,8% у свиноматок 3-6 опоросов и 28,3% - 7-8 опоросов.
Среди молодых и старых свиноматок регистрировали наибольшее количество животных с низкими титрами поствакцинальных антител к парвовирусу – 80 и 66,6% против 12,5% у средневозрастных, к артеривирусу – 90 и 33,3% против 12,5% и коронавирусу – 40 и 66,6% при отсутствии таковых среди последних. В их помётах был наиболее высокий процент заболевших поросят – 34,7 и 32,2% против 24,7%, павших – 12,4 и 16,9% против 9,7%, с неудовлетворительной упитанностью – 20,6 и 31,1% против 11,4% и ниже выход поросят при отъёме – 83,0 и 76,3% против 85,7% соответственно.
Таким образом, вследствие физиологической незрелости иммунной системы у молодых свиноматок и дисбаланса иммунного статуса у старых животных, целесообразно иметь наибольшее количество свиноматок 3–6 опоросов.
3.5.2. Иммунный статус свиноматок, заболевших послеродовым
эндометритом
У свиноматок 50-60 дней супоросности, впоследствии заболевших послеродовым эндометритом, по сравнению с животными, оставшимися клинически здоровыми, повышено содержание лейкоцитов в крови (на 5,3%), ФАЛ (на 4,2%) и ИЗФ (на 6,3%), соотношение резистентных и чувствительных к теофиллину Т-клеток – 4,7:1 против 4,1:1. У 36,8% этих животных отмечали нулевой уровень Ттфч-клеток, что могло быть следствием повышенного антигенного воздействия и увеличения медиаторов воспаления, в результате - активация в лимфоцитах аденилатциклазы, повышение уровня внутриклеточного цАМФ и угнетение Е-рецепторов. У них ниже содержание в крови IgG на 5,3%, IgМ - на 17,6% и IgА - на 20,3%.
На 100-105 день супоросности у предрасположенных к заболеванию животных иммунный статус заметно изменился. По отношению к контролю произошло снижение уровня лейкоцитов в крови на 7,3%, лимфоцитов – на 16,0% (Р<0,05), абсолютного числа Т-клеток – на 15,8% (Р<0,05) и Ттфч-клеток (Р<0,05), и увеличение соотношения Ттфр/тфч-клеток, что сочеталось с положительной динамикой уровня IgG и более выраженной активацией локального иммунитета - повышении концентрации IgА в крови на 47,3% против 26,1% у оставшихся здоровыми свиноматок, а также показателей фагоцитоза - ФЧ, ФИ и ИЗФ (Р<0,02).
У больных свиноматок на 2-4 день после опороса отмечали лейкоцитоз – на 19,0% (Р<0,05), повышенные значения - КАСК на 15,2%, ЛАСК – на 22,7%, ИЗФ (Р<0,05), но дефицит содержания в крови лимфоцитов (на 8,6%), Т-клеток (на 17,9%), относительного и абсолютного числа Ттфч-клеток (на 29,4 и 45,1%), тенденцию снижения – ФЧ и ФИ.
В маточном секрете у больных послеродовым эндометритом свиноматок, установлено значительно более высокое, чем у здоровых, содержание IgМ в 7,11 (P<0,001), IgG – в 5,25 (P<0,001) и IgА – в 2,36 (P<0,01) раза (табл. 3).
Таблица 3
Уровень иммуноглобулинов в маточной слизи у здоровых и больных послеродовым эндометритом свиноматок на 2-4 сутки после опороса
| Группы животных | Классы иммуноглобулинов | ||
| IgG, г/л | IgМ, г/л | IgА, г/л | |
| Здоровые (n=8) | 0,480±0,180 | 0,038±0,010 | 0,072±0,028 |
| Больные (n=19) | 2,520±0,390** | 0,270±0,064** | 0,170±0,021* |
Примечание: *-Р<0,01; **-Р<0,001
При морфологическом исследовании в стенке матки у больных свиноматок покровный эпителий был сохранён лишь местами, на большом протяжении - поверхностный некроз, интенсивная инфильтрация нейтрофилами субэпителиальной области слизистой, выход их в полость матки и формирование гнойного экссудата, массовое скопление нейтрофилов в просвете маточных желёз и полное разрушение секреторного эпителия. В сосудах эндометрия - стаз, отмечена отёчность и вакуолизация стромы, диффузная инфильтрация её лимфоцитами, нейтрофилами и макрофагами, в более глубоких слоях она значительно разрыхлена, наблюдалась интенсивная плазмоклеточная реакция (рис. 5).

Рис. 5. Морфогенез и локальный иммунитет при послеродовом эндометрите у свиноматок: а) миграция нейтрофилов и разрушение покровного эпителия; б) сосуды эндометрия кровенаполнены с содержанием нейтрофилов; в) нейтрофилы в маточных железах; г) лимфоидная инфильтрация эндометрия; д) активная плазматизация основной пластинки матки.
3.5.3. Иммунный статус свиноматок при мастите
Иммунный статус у свиноматок в период 50-60 дней супоросности при возникновении мастита, по сравнению у здоровых животных, характеризовался более низким относительным и абсолютным уровнем Т-клеток – на 8,3 и 14,5%, Ттфч-клеток – на 38,1 и 50,7% (Р<0,05), высоким соотношением Ттфр/тфч – 6,6:1 против 4,1:1, напряжённостью системного и, особенно, локального гуморального иммунитета – повышенным содержанием IgА, IgМ и IgG в крови – на 53,6; 26,5 и 10,5% соответственно, значительным снижением уровня ЦИК – в 1,76 раза (Р<0,05), КАСК – на 38,9%, показателей фагоцитоза
– ФАЛ, ФЧ и ФИ, соответственно – на 6,4; 20,0 и 12,0%, что на фоне более высокого содержания лизоцима в крови - в 1,8 раза (Р<0,001), высвобождающегося при дегрануляции нейтрофилов, свидетельствует о напряжённом фагоцитозе in vivo. На 100-105 день супоросности у них отмечали увеличение разницы в соотношении Ттфр/тфч-клеток - 4,3:1 против 2,3:1, мобилизацию неспецифических факторов защиты - повышение БАСК – на 8,5%, ФАЛ, ФЧ и ФИ (Р<0,01; Р<0,01), и преимущественное снижение уровня IgG и IgМ в крови, более выражено - IgА (на 21,7%) при увеличении концентрации IgА (на 26,1%) у здоровых животных, что у заболевших маститом, вероятно, связано с повышенным перераспределением иммуноглобулинов из сыворотки крови в поражённые доли молочной железы.
На 2-4 день после опороса у них отмечали преимущественное снижение количества лейкоцитов в крови, выраженную лимфоцитопению (на 18,9%), дефицит относительного и абсолютного уровня Т-клеток, соответственно – на 16,7 (Р<0,01) и 32,6% (Р<0,05), Ттфр-клеток – на 8,7 и 27,7%, Ттфч-клеток - на 32,2 и 40,6%, более высокое соотношение Ттфр/тфч - 2,62:1 против 1,94:1 у здоровых животных. Низкий уровень Т-супрессоров сочетался с активацией первичного и локального иммунитета. Так, концентрация IgМ у них в крови превысила таковую у здоровых животных на 49,5% (Р<0,05), а IgА – на 12,1%. При этом были выше: БАСК на 4,8% (Р<0,02), ЛАСК – в 2,1 раза (Р<0,05), но снизились - ФЧ и ФИ (на 13,2 и 13,4%) вследствие возросшей антигенной нагрузки на фагоцитарное звено.
При морфологическом исследовании подтверждалось наличие мастита у свиноматок в период супоросности. Вначале поражались выводные протоки, вероятно, вследствие того, что протоковая система молочной железы в период супоросности формируется раньше, чем молочные дольки. В их просвете скопление нейтрофилов, десквамация эпителия, окружающая соединительная ткань значительно утолщена при наличии лимфоидной инфильтрации и плазмоклеточной реакции, альвеолы сдавлены, но активно функционируют. Впоследствии поражалась паренхима молочной железы - наличие в отдельных альвеолах единичных нейтрофилов, но секреторный эпителий сохранён. Затем число поражённых альвеол увеличивалось, а в их просвете количество полиморфноядерных лейкоцитов. Локальный иммунитет характеризовался выраженной лимфоидной инфильтрацией и плазмоклеточной дифференцировкой в
межальвеолярной соединительной ткани (рис. 6).

Рис.6. Структурные изменения и локальный иммунитет в молочной железе у свиноматок на 105-110 день супоросности: а) норма; б) поражение молочных протоков при субклиническом мастите – наличие нейтрофилов в их просвете; в) лимфоидная инфильтрация и плазмоклеточная реакция вокруг поражённых выводных протоков; г) поражение молочных альвеол - появление в их просвете нейтрофилов.
3.6. Иммунный статус и морфология локального иммунитета
при болезнях поросят
3.6.1. Формирование колострального иммунитета у поросят
У новорожденных поросят до сосания молозива отмечена существенная вариабельность концентраций в крови IgG, IgМ и IgА, соответственно от 0,02 до 0,08; 0,22-0,39 и 0,006-0,01 г/л.
Наличие иммуноглобулинов в сыворотке крови поросят при рождении свидетельствует о иммунокомпетентности плодов, а более высокого уровня IgМ – о преимущественно первичном ответе. Иммунореактивность у здоровых (неинфицированных) плодов, вероятнее всего, вызвана воздействием материнских (трансплантационных) антигенов, наряду с возможностью перехода материнских антител через поврежденную плаценту.
После приёма молозива доминирующим классом (более 80%) в сыворотке крови поросят становился IgG, уровень IgА более чем в два раза превышал концентрацию IgМ, что соответствует пропорциональному их содержанию в молозиве. У 2-3 дневных поросят, в том числе и в отдельном помёте, они значительно колебались: IgG - от 8,5 до 30,3; IgМ - 0,4-1,5, IgА – 1,47-2,85 г/л.
C первого дня жизни уровень IgМ и IgА в крови поросят заметно снижался, достигая минимума, соответственно - на 14 и 17-35 сутки, IgG – к 1,5 месяцам, что связано с физиологическим катаболизмом иммуноглобулинов.
Учитывая то, что периоды полураспада IgМ и IgА приблизительно равны (2,5-4 суток), более выраженное снижение на 16-19 дни жизни поросят концентрации IgА в крови (в 20,1 раза), чем IgМ (в 3,0 раза), свидетельствует о синтезе в этот период собственных макроглобулинов.
На 35 день уровень IgА в крови поросят не изменился, а IgМ - повысился в 1,88 раза, то есть наблюдался выраженный первичный гуморальный ответ.
На 45 день произошло снижение до минимума (4,59±0,47 г/л) уровня IgG в крови, повышение на 24,5% - IgМ и значительное увеличение концентрации IgА - в 1,5 раза, что свидетельствует об активации локального иммунитета.
На 70 день содержание IgА и IgG в сыворотке крови поросят увеличилось соответственно в 3,0 и 2,31 раза, IgМ - в 1,48 раза, что отражает активацию наряду с локальным иммунитетом также вторичного, и опосредовано - функциональную активность Т-звена иммунитета.
На 90 день концентрация IgG и IgА повышалась, приближаясь к нижним границам нормальных значений у взрослых животных, и составила соответственно – 11,9±0,58 и 0,61±0,06 г/л, а уровень IgМ - 0,81±0,07 г/л.
Таким образом, возрастная динамика содержания основных классов иммуноглобулинов в сыворотке крови клинически здоровых поросят отражает особенности становления гуморального и опосредованно Т-звена иммунитета, что может служить ориентиром при сравнительной оценке иммунного ответа у больных животных.
3.6.2. Ультраструктурные особенности всасывания иммуноглобулинов
в тонком кишечнике у новорожденных поросят
Абсорбция иммуноглобулинов начинается с момента поступления молозива в тонкий кишечник и обусловлена интенсивным образованием эндоцитозных инвагинаций апикальной мембраны энтероцитов 12-перстной, тощей и подвздошной кишки у основания микроворсинок. Отпочковываясь, мелкие везикулы, содержащие тонкодисперсные вещества низкой электронной плотности, транспортировались к базолатеральной мембране. По ходу мелкие везикулы объединялись в более крупные вакуоли, которые могли заполнять весь энтероцит, имели различную электронную плотность – осмиофильные и светлые, представляющие собой соответственно липидно-белковый комплекс и белковый - в виде структурированной сеточки, что связано с сепарацией компонентов молозива при продвижении в дистальные отделы тонкого кишечника. Далее путём экзоцитоза содержимое везикул выходило через базолатеральную мембрану энтероцита в межклеточное пространство и базальную мембрану эпителиального пласта в собственную пластинку слизистой оболочки (строму ворсинок) и просвет кровеносных фенестрированных капилляров, часто расположенных (на расстоянии 1 мкм) вблизи базальной мембраны эпителиальной выстилки (рис. 7).

Рис. 7. Абсорбция защитных факторов молозива в тонком кишечнике у новорожденных поросят: а) пиноцитоз; б) транспорт везикул (светлые вакуоли); в) осмиофильные вакуоли; г) экзоцитоз; д) фенестрированный капилляр с содержанием иммуноглобулинов; е) фенестры; ж) сосуды у поросёнка до приёма молозива не содержат иммуноглобулины; з) абсорбция энтероцитами нейтрофилов; и) адгезия лимфоцитов на поверхности энтероцита; к) плазмоцит (абсорбция собственно синтезированных иммуноглобулинов в кишечнике).
Кроме всасывания нерасщеплённых белков, установлена возможность проникновения через кишечный барьер новорожденных нейтрофилов, обнаруженных в молозивной вакуоле энтероцита тощей кишки у поросёнка через 6-7 часов после рождения, при этом целостность микроворсинок и апикальной мембраны была сохранена. Возможность проникновения в эпителиальный пласт тонкой кишки клеток (лимфоцитов) молозива на начальном этапе связана с адгезией их на поверхности энтероцита.
Возможность абсорбции в систему кровообращения новорожденных поросят собственно синтезируемых иммуноглобулинов подтверждалась обнаружением единичных плазмоцитов в строме ворсин или располагавшихся непосредственно рядом с капиллярами.
3.6.3. Иммунный статус поросят-сосунов, больных
трансмиссивным гастроэнтеритом
После острой вспышки ТГС через 1-2 месяца отмечали энзоотическое течение инфекции, характеризующееся снижением заболеваемости и летальности до 20-30%. При наличии умеренной диареи поросята выживали, что обусловлено передачей с молозивом свиноматок специфических антител. Однако у больных животных даже при наличии в крови колостральных антител выявляли вирусный антиген ТГС в содержимом кишечника и в составе ЦИК. Переболевшие поросята отставали в росте и развитии.
Иммунный статус больных ТГС 3-5 дневных поросят, по сравнению со здоровыми, характеризовался повышенным уровнем лейкоцитов в крови - на 13,0%, но дефицитом относительного и абсолютного количества Т-клеток – в 2,22 и 2,26 раза (Р<0,001), Ттфр-клеток – на 28,2 (Р<0,01) и 28,6%, нулевым уровнем Ттфч-клеток, низким содержанием В-клеток – на 23,0 и 24,4%, Fc+-лимфоцитов – на 35,6 и 38,2%, а также IgG, IgM (Р<0,05) и IgA в крови соответственно - на 23,3%, 60,7% и 37,8%, что могло быть связано с нарушением их абсорбции вследствие повреждения энтероцитов тонкой кишки, а также повышенной транссудацией из сыворотки крови и выведением из просвета кишечника при диарее. При этом у них значительно выше относительное и абсолютное содержание малодифференцированных О-лимфоцитов - в 6,3 и 4,6 раза (Р<0,001), ЦИК – в 2,65 раза (Р<0,001), а также показатели: БАСК – на 8,8% (Р<0,001), КАСК – в 1,93 раза (Р<0,01), ЛАСК – в 2,03 раза, которые, по-видимому, обусловлены повышением синтеза белков системы комплемента в острую стадию болезни, а также обезвоживанием организма и лимфоконцентрацией.
При острой вспышке ТГС у 1-3-х дневных поросят при гистологическом исследовании регистрировали отслоение покровного эпителия ворсинок серозной жидкостью, и впоследствии полное их разрушение. Слизистая оболочка тонкой кишки была представлена только криптами. В кровеносных сосудах подслизистой основы - стаз. При энзоотическом течении ТГС поражались отдельные участки тонкого кишечника, у выживших поросят на 6-7 день жизни кишечные ворсинки восстанавливались, но были короче нормальных в 2,5-7 раз, сосуды в подслизистом слое кровенаполнены. У переболевших поросят отмечали более ранний локальный иммунный ответ, который характеризовался в местах альтерации активной плазмоклеточной реакцией в собственном слое слизистой оболочки (рис. 8).
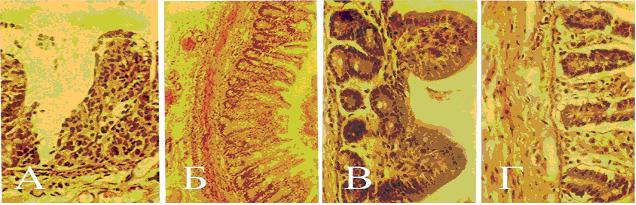
Рис. 8. Морфогенез и местный иммунитет в тонком кишечнике у больных ТГС поросят: при острой вспышке: а) отслоение эпителиального пласта; б) слизистая кишечника представлена криптами (полное разрушение ворсинок); энзоотическом течении: в) восстановленные ворсинки у 7-дневного поросёнка – укорочены; г) активная плазматизация lamina propria тощей кишки.
3.6.4. Иммунный статус поросят при респираторных болезнях
Иммунный статус у 35-дневных поросят, предрасположенных к респираторной патологии, по сравнению с оставшимися клинически здоровыми животными, характеризовался повышенным содержанием в крови лейкоцитов на 12,1%, лимфоцитов – на 21,2%, IgМ – на 28,6% (Р<0,05), более высоким уровнем поглотительной способности нейтрофилов - значений ФЧ и ФИ – на 8,3 и 12,7% соответственно, соотношением Ттфр/тфч-клеток (14,0:1 против 3,6:1), но дефицитом относительного количества Т-клеток – на 10,0% (Р<0,05), В-клеток – на 13,5%, КАСК – на 21,6% и ФАЛ – на 3,5% (Р<0,05).
У заболевших поросят, по сравнению со здоровыми, в 70-дневном возрасте отмечали незначительный лейкоцитоз и лимфоцитоз, увеличение относительного и абсолютного числа Т-клеток – на 17,1% (Р<0,05) и 20,4%, снижение соотношения Ттфр/тфч-клеток (2,3:1 против 5,4:1) за счёт увеличения количества Т-супрессоров, что отразилось на незначительной индукции первичного и вторичного ответа - повышении уровней IgG и IgМ в крови – на 11,3 и 13,3% соответственно, при преимуществе активации локального иммунитета - увеличении концентрации IgА в крови на 22,2%, а также ФАЛ - до уровня у здоровых животных.
Спектр возбудителей респираторных болезней поросят был представлен вирусом РРСС - 42,3%, цирковирусом типа – 61,9%, Mycoplasma hyopneumoniae – 37,5%, Mycoplasma hyorinis – 25%, Pasteurella multocida – 30,7%, Streptococcus pneumoniae – 23,1%, Salmonella cholerae suis – 30,8%.
У поросят 3-3,5 месячного возраста, больных хронической бронхопневмонией, в сыворотке крови выявлены в диагностических титрах антитела к пастереллам, микоплазмам, вирусу РРСС и цирковирусу типа, соответственно – в 20, 60, 20 и 40% против 60 и 20% к пастереллам и микоплазмам, и отсутствие - к вирусу РРСС и ЦВС-2 у клинически здоровых животных.
У этих животных наблюдали выраженные расстройства в иммунном статусе, которые характеризовались лейкопенией и лимфоцитопенией – на 19,7 и 66,7% соответственно, дефицитом абсолютного количества Т-клеток – на 42,6% (Р<0,01), относительного и абсолютного числа В-клеток – на 27,9 и 54,9% (Р<0,01), содержания основных классов иммуноглобулинов в крови: IgG – на 28,6%, IgМ – на 45,4% и IgА – на 39,1%, ЛАСК – на 15,4%, увеличением соотношения Ттфр/тфч-клеток – 4,6:1 против 2,4:1 у здоровых животных, КАСК – на 27,3%, показателей - ФЧ и ФИ (Р<0,05; Р<0,05).
При морфологическом исследовании в лёгких поросят на ранней стадии патологического процесса отмечали венозный застой в верхушечных и средних долях - расширение и кровенаполнение кровеносных сосудов, пропитывание эритроцитами межальвеолярной соединительной ткани, катарально-десквамативный бронхит. При хроническом течении респираторных болезней отмечали венозную гиперемию, выход и заполнение эритроцитами полости альвеол. Структура лёгких была гомогенной, межальвеолярные перегородки плохо различимы, альвеолоциты разрушены. В серых участках лёгких наблюдали инфильтрацию интерстициальной ткани, бронхов и альвеол лимфоцитами, гистиоцитами, нейтрофилами и плазмоцитами, то есть активные иммунологические процессы (рис. 9).

Рис. 9. Структурные изменения и состояние локального иммунитета при респираторном синдроме у поросят: а) венозный застой; б) десквамативный бронхит; в) катарально-гнойная бронхопневмония (нейтрофильная, лимфоидно-макрофагальная инфильтрация и плазмоклеточная реакция); г) плазмоцитарная реакция по периферии поражённого крупного бронха.
3.7. Коррекция иммунного статуса свиней
3.7.1. Коррекция иммунного статуса свиноматок лигфолом,
лигавирином и селедантом при специфической профилактике
эшерихиоза и сальмонеллёза у поросят
Свиноматок на 48-50 дни супоросности двукратно иммунизировали противоэшерихиозной и противосальмонеллёзной вакцинами в сочетании с применением лигфола (5 мл), селеданта (20 мкг/кг) и лигавирина (2,5 мл).
За 2-3 недели до опороса у животных, обработанных селедантом, по отношению к контролю (привитые без препарата), отмечали нормализацию (снижение) уровня лейкоцитов и лимфоцитов в крови и увеличение количества Ттфр-клеток - с хелперной активностью. У животных всех опытных групп, по отношению к интактным, произошла стабилизация процентного содержания Т-клеток, достоверное увеличение уровня IgА в крови и БАСК, у обработанных селедантом – ФАЛ и ИЗФ, у них и при применении лигавирина – ФЧ и ФИ (Р<0,001-0,01).
Коррекция иммунного статуса способствовала увеличению у свиноматок опытных групп, по сравнению с контролем, титра антител к эшерихиозному антигену – в 2,65; 2,65 и 3,4 раза, и сальмонеллёзному – в 2,0; 2,34 и 3,0 раза соответственно.
На 2-4 день после опороса у свиноматок, которым применяли лигавирин и селедант, наряду с более высоким соотношением Ттфр/тфч-клеток, произошло и более выраженное увеличение уровня антител, по отношению к контролю, к эшерихиозному антигену, соответственно - в 4,32 и 3,27 раза, сальмонеллёзному – в 5,0 и 7,5 раза. У животных, обработанных лигфолом, титры агглютининов повысились в 1,52 и 2,78 раза.
Установлена положительная корреляция между высокими титрами антител в сыворотке крови и молозиве свиноматок, обработанных лигавирином, селедантом и лигфолом, которые были выше таковых в контроле к эшерихиозному антигену – в 4,48; 2,69 и 2,73 раза, сальмонеллёзному – в 5,97; 3,43 и 3,24 раза соответственно.
3.7.2. Коррекция иммунного статуса поросят
лигфолом, лигавирином и селедантом при специфической профилактике эшерихиоза и сальмонеллёза
У 38-43 дневных поросят через две недели после двукратной вакцинации против эшерихиоза и сальмонеллёза и применения лигфола в дозе 1 мл, лигавирина – 0,5 мл и селеданта - 20 мкг/кг, по сравнению с вакцинированными без препарата животными, отмечали более высокое содержание лимфоцитов в крови (Р<0,05-0,01), абсолютное количество Т-клеток на 9,6-17,7%, Ттфр-клеток (Т-хелперов) (Р<0,02-0,01), у обработанных селедантом также относительное их число (Р<0,01), и более низкий (Р<0,02-0,05), преимущественно при применении селеданта и лигфола, процент Ттфч-клеток (Т-супрессоров). У них выше соотношение Ттфр/тфч-клеток - 1,37-3,1:1 против 1,15:1 в контроле, у обработанных селедантом и лигавирином - показатели неспецифической резистентности – БАСК и КАСК, а селедантом и лигфолом - ФЧ, ФИ и ИЗФ, что на фоне более низкой ЛАСК, свидетельствует об уменьшении напряжённости фагоцитоза.
Эти изменения у животных опытных групп сопровождались достоверным увеличением (в 2-3 раза) титров поствакцинальных антител в сочетании с уровнем IgМ и IgG в крови, и были наиболее высокие к эшерихиозному антигену – у поросят, обработанных лигавирином и селедантом, сальмонеллёзному – селедантом и лигфолом.
Применение иммуномодуляторов оказало стабилизирующее действие на содержание в крови поросят 48-53 дневного возраста лейкоцитов, лимфоцитов и Т-клеток, более высокий уровень, по отношению к контролю – БАСК, ФЧ, ФИ и ИЗФ.
У 79-84 дневных поросят контрольной группы и обработанных лигавирином, после отъёма и перевода на доращивание, отмечали существенное снижение количества лейкоцитов и лимфоцитов в крови, дефицит абсолютного числа Т-клеток и их субпопуляций, а также В-клеток, тогда как применение селеданта и лигфола оказали стабилизирующее влияние на уровень этих показателей.
У всех подопытных животных произошло многократное увеличение (в 3-4 раза) числа Ттфч-клеток, то есть усиление иммуносупрессии, которое вероятно, связано с изменившимися условиями их содержания и кормления. Однако у всех привитых поросят, соотношение Ттфр/тфч-клеток было заметно выше, чем у интактных животных, что свидетельствует о лучшей их адаптации к воздействию неблагоприятных факторов окружающей среды, в том числе и к инфекционным агентам. Применение лигфола и селеданта способствовало увеличению абсолютного количества В-клеток в крови, соответственно – на 26,0 и 19,3% в сочетании с уровнем IgG в крови – в 3,1 и 3,42 раза при снижении уровня В-клеток - на 23,3 и 18,7% и IgG - в 2,1 - 2,2 раза у животных контрольной группы и обработанных лигавирином. Применение селеданта сопровождалось активацией первичного и локального иммунитета - повышением уровня IgМ и IgА в крови - в 2,56 и 3,44 раза при незначительном увеличении или снижении их у поросят других групп.
Титры антител к эшерихиозному и сальмонеллёзному антигенам при общем снижении в этот период оставались выше в сыворотке крови поросят, вакцинированных в сочетании с селедантом, и заметно уменьшились - при применении лигавирина.
Таким образом, вакцинация поросят против эшерихиоза и сальмонеллёза в сочетании с применением иммуномодуляторов, по сравнению с иммунизацией без препаратов, способствует снижению образования Т-супрессоров, увеличению числа Т-хелперов, фагоцитарной активности, уровня основных классов иммуноглобулинов в сыворотке крови и антител.
Действие иммуномодуляторов, особенно селеданта и лигфола, было преимущественно направлено на антителопродукцию к вакцинным антигенам.
После перевода на доращивание поросята, которым вводили селедант и лигфол, лучше адаптировались к новым условиям, по сравнению с животными обработанными лигавирином и контрольной группы, о чём свидетельствовало наличие у них более высокого уровня лимфоцитов в крови, Т- и В-клеток, поствакцинальных антител в сочетании с активацией первичного и вторичного гуморального иммунитета.
4. ВЫВОДЫ
1. Маточное поголовье и молодняк крупного рогатого скота и свиней в условиях промышленной технологии ведения животноводства испытывают повышенную антигенную нагрузку, что приводит к нарушениям в иммунном статусе и развитию воспалительных процессов, проявляющихся эндометритами и маститами, диарейным и респираторным синдромами.
2. Иммунный статус коров, предрасположенных к заболеванию после родов эндометритом и маститом, за 2-2,5 месяца до отёла характеризуется повышенным содержанием в крови лейкоцитов, лимфоцитов, абсолютного числа Т- и В-клеток, уровня IgА в крови; за 1-2 недели до отёла - тенденцией к снижению числа лейкоцитов, лимфоцитов, вследствие усиления процессов миграции, а также лизоцимной, комплементарной активности сыворотки крови и поглотительной способности нейтрофилов (ФЧ), усилением дифференцировки - процента Т-клеток; на 3-6 день после родов – мобилизацией неспецифических факторов защиты, но снижением процента Т-клеток, обусловленным дезадаптацией их к родовому стрессу; через 2 недели после отёла – активацией вторичного и локального иммунитета, снижением ФЧ, а у больных клиническим маститом при отсутствии лечения, кроме того – лейкопенией и лимфоцитопенией.
3. У больных эндометритом коров через неделю после отёла многократно увеличивается содержание в маточной слизи IgG и IgМ вследствие усиления гемодинамических расстройств; через 2 недели повышается уровень IgА за счёт транссудации из сыворотки крови и местного образования, снижается соотношение SIgA/сIgA – 1:0,62 против 1:0,52 в норме, что морфологически подтверждается стазом в сосудах, отёком и эмиграцией в эндометрий нейтрофилов, и активацией локального иммунитета – диффузной и очаговой лимфоидной инфильтрацией и плазмоклеточной реакцией.
4. У коров на ранней стадии заболевания маститом иммунная защита осуществляется за счёт локального образования IgМ и IgА, что морфологически подтверждается увеличением количества лимфоцитов и плазмоцитов в межальвеолярной соединительной ткани очага поражения. Развитие воспалительного процесса при скрытом, и особенно клиническом мастите, сопровождается усилением транссудации из сыворотки крови в поражённые доли IgG, IgМ и IgА, снижением соотношения SIgA/сIgA – 1:0,85 и 1:1,22 против 1:0,67 и 1:0,48 в здоровых долях соответственно.
При клиническом мастите на фоне интенсивной внутри- и междольковой нейтрофильной инфильтрации и снижении числа плазмоцитов, происходит повышение уровня иммуноглобулинов в секрете наряду с транссудацией, за счёт увеличения объёма поражения молочной железы.
5. Иммунный статус свиноматок, предрасположенных к заболеванию послеродовым эндометритом, на 50-60 дни супоросности характеризуется повышенным уровнем в крови лейкоцитов, В-лимфоцитов, соотношением Ттфр/тфч-клеток, ЛАСК, ФАЛ и дефицитом содержания IgG, IgМ и IgА; на 100-105 день супоросности - увеличением соотношения Ттфр/тфч-клеток, БАСК, поглотительной способности лейкоцитов (ФЧ), а у больных животных на 2-4 день после опороса – лейкоцитозом, активацией локального иммунитета (IgА в крови), лимфоцитопенией, дефицитом уровня Т-клеток.
В маточной слизи у больных свиноматок на 2-4 день после родов многократно повышается содержание IgG, IgМ и IgА вследствие транссудации и локального их синтеза, что морфологически проявляется стазом в сосудах, отёком и инфильтрацией эндометрия нейтрофилами, лимфоцитами и интенсивной плазмоклеточной реакцией.
6. Иммунный статус свиноматок при заболевании в период супоросности маститом, на 50-60 день после оплодотворения, характеризуется лейкоцитозом, высоким соотношением Ттфр/тфч-клеток, содержанием IgG, IgМ и IgА в крови, ЛАСК, пониженным уровнем лимфоцитов, Т-клеток, КАСК, ФАЛ и ФЧ; на 100-105 день - повышением БАСК, ФАЛ и ФЧ, снижением уровня IgА; на 2-4 день после опороса – повышением ЛАСК, уровня IgМ и IgА, лимфоцитопенией, дефицитом количества Т-клеток, угнетением поглотительной способности лейкоцитов (ФЧ).
Возникновение мастита в период супоросности проявляется поражением молочных протоков и альвеол - скоплением в их просвете нейтрофилов, а также повышением локального иммунитета – лимфоидной инфильтрацией и плазмоклеточной реакцией.
7. При своевременной выпойке молозива телятам (не позднее 1,5 часов после рождения) колостральный иммунодефицит у них чаще всего обусловлен низким содержанием иммуноглобулинов в молозиве, недостаточным его потреблением вследствие слабого сосательного рефлекса, низкой абсорбцией иммуноглобулинов в тонком кишечнике.
Приём молозива обеспечивает местную защиту слизистой оболочки верхних дыхательных путей телят в первые дни жизни, которая осуществляется за счёт перехода из сыворотки крови антител G класса, а в 2-х недельном возрасте – вследствие местной продукции IgА.
8. Процесс абсорбции иммуноглобулинов у новорожденных животных универсален и обусловлен интенсивным образованием эндоцитозных инвагинаций апикальной мембраны энтероцитов тонкой кишки. Отпочковываясь, мелкие везикулы, содержащие белки в виде тонкодисперсных веществ низкой электронной плотности, транспортируются к базолатеральной мембране, по ходу объединяясь в более крупные вакуоли различной электронной плотности - осмиофильные и светлые, представляющие собой липидно-белковый комплекс и белковый - в виде структурированной сеточки вследствие сепарации компонентов молозива при продвижении в дистальные отделы тонкого кишечника. Путём экзоцитоза содержимое везикул выходит через базолатеральную мембрану энтероцита в межклеточное пространство, базальную мембрану эпителиального пласта в строму ворсинок и обнаруживаются в просвете фенестрированных кровеносных капилляров.
9. Более тяжёлое течение омфалита и колибактериоза у телят наряду с возбудителями обусловливают нарушения обмена веществ у коров. Иммунный статус 2-4 дневных телят до проявления клинических признаков болезней, особенно при тяжёлом их течении, характеризуется лейкоцитозом, лимфоцитозом, дефицитом относительного числа Т-клеток, относительного и абсолютного уровня В-(ЕАС)- и RIgМ-клеток, IgG, IgМ и IgА в крови, БАСК, ЛАСК и С1q, но более высоким уровнем С3, ФЧ и ФИ; у переболевших телят месячного возраста к тому же - дефицитом абсолютного уровня Т-клеток, более ранним первичным, а при тяжёлом течении болезней – и вторичным гуморальным ответом.
У телят, полученных от коров с нормализованным метаболизмом, заболеваемость омфалитом и диареей снижается соответственно – в 2,1 и 1,48 раза, а средняя продолжительность болезни – в 2,5 и 2,0 раза.
10. Воспалительный процесс при колибактериозе у телят характеризуется кровоизлияниями в строму кишечных ворсинок, наличием нейтрофилов в просвете сосудов и слизистой, разрушением ворсинок, выходом и скоплением нейтрофилов в углублениях крипт, а локальный иммунитет – увеличением количества межэпителиальных лимфоцитов, появлением в собственном слое слизистой плазмоцитов, светлых центров в лимфоидных фолликулах пейеровых бляшек подвздошной кишки.
11. Массовую заболеваемость телят респираторными болезнями наряду с возбудителями обусловливают нарушения метаболического статуса у коров, переболевание молодняка диареей, неудовлетворительные условия содержания животных. У телят 2-х недельного возраста до клинического проявления респираторного синдрома отмечается лейкоцитоз и лимфоцитоз, дефицит относительного количества Т- и В-(ЕАС)-клеток, у них и телят, полученных от коров с оптимальным метаболизмом - колостральный иммунодефицит, низкий уровень БАСК, ФАЛ, С1q и повышенное количество В-RIgG-клеток, ФЧ и ФИ.
Неудовлетворительные условия содержания телят после перевода на доращивание приводят к возникновению у них в возрасте 1,5 месяцев дефицита уровня Т- и В-RIgМ-клеток, снижению синтеза IgG и IgМ при усилении локального иммунитета (уровень IgА в крови), а в возрасте 2,5-3 месяцев - угнетению первичного и вторичного гуморального ответа.
Активация местного иммунитета у больных телят 1,5 месячного возраста проявляется - образованием вокруг крупных бронхов, а при развитии катарально-гнойной бронхопневмонии - во всех структурах лёгких, лимфоидно-макрофагальной инфильтрации и плазмоклеточной реакции.
12. У больных ТГС 3-5 дневных поросят при энзоотическом его течении отмечается лейкоцитоз, выраженный дефицит относительного и абсолютного уровня Т-, Ттфр-, В- и Fc+-лимфоцитов, IgG, IgM и IgA в крови, отсутствие Ттфч-клеток, высокий уровень О-лимфоцитов и ЦИК, содержащих вирус ТГС, и бактерицидной, комплементарной и лизоцимной активности сыворотки крови вследствие лимфоконцентрации.
В отличие от полного разрушения кишечных ворсинок на большом протяжении у 1-3-х дневных поросят при острой вспышке ТГС, при энзоотическом его течении, поражаются отдельные участки тонкой кишки. У переболевших поросят на 6-7 день жизни ворсинки восстанавливаются, но они короче нормальных в 2,5-7 раз, и регистрируется активная плазмоклеточная дифференцировка в собственном слое слизистой оболочки.
13. Иммунный статус 35-дневных поросят, предрасположенных к респираторным болезням, характеризуется повышенным содержанием в крови лейкоцитов, лимфоцитов, IgМ, ФЧ и ФИ, дефицитом относительного количества Т-, Ттфч- и В-клеток, КАСК и ФАЛ; у больных поросят 70-дневного возраста - увеличением числа Т-клеток за счёт Т-супрессоров, уровня IgА, при незначительном повышении - IgМ и IgG; у 3-3,5-месячных поросят, больных хронической бронхопневмонией – лейкопенией, лимфоцитопенией, дефицитом уровней Т-, Ттфч-, В- и Fc+-клеток, IgG, IgМ и IgА в крови, ЛАСК, и повышением КАСК, ФЧ и ФИ.
Локальный иммунный ответ при развитии катарально-гнойной бронхопневмонии проявляется инфильтрацией интерстициальной ткани, просвета бронхов и альвеол лимфоцитами, гистиоцитами, нейтрофилами и интенсивной плазмоклеточной реакцией.
14. Коррекция рациона и применение сухостойным коровам витаминно-минерального премикса способствует нормализации белкового, углеводного, жирового и минерального обмена, повышению дифференцировки Т-клеток, уровня IgМ и IgG, нормальных антител, бактерицидной, лизоцимной и комплементарной активности сыворотки крови, снижению напряжённости локального иммунитета (IgА в крови), а у новорожденных телят до приёма молозива - уровня Т- и В-клеток с С3 и IgМ-рецепторами, БАСК, ЛАСК, КАСК, С1q и С3, снижению числа лейкоцитов, напряжённости фагоцитоза, а также уровней IgG, IgМ и IgА в крови, что отражает уменьшение фетоплацентарной недостаточности.
15. Иммунный статус свиноматок 1-2 опоросов на 35 день супоросности, по сравнению с животными 3-6 и 7-8 опоросов, характеризуется более низким уровнем Т-клеток и гуморального иммунитета, ЦИК, повышенным уровнем лимфоцитов в крови, лейкоцитов и их фагоцитарной ёмкости, ЛАСК; на 100-105 день супоросности - увеличением абсолютного числа Т-клеток за счёт Fc+-лимфоцитов (супрессоров), О-лимфоцитов, более низким синтезом IgA, уменьшением у них и животных 7-8 опороса числа В-клеток. Среди них и свиноматок 7-8 опоросов выявляется наибольшее количество животных с низкими титрами поствакцинальных антител к парво-, артери- и коронавирусу, в их помётах регистрируется наибольшее число заболевших, павших и с низкой упитанностью поросят.
16. Двукратное применение лигфола, лигавирина и селеданта в сочетании с вакцинацией сухостойных коров против эшерихиоза и сальмонеллёза оказывает модулирующее действие на уровень гуморальных и клеточных факторов неспецифической и иммунной защиты, способствуют повышению в 1,5-2 раза титров поствакцинальных антител в сыворотке крови, и особенно в молозиве, а у новорожденных телят - показателей неспецифической резистентности, уровня Т- и В-клеток, пролонгации абсорбции IgG молозива до 3-х суток.
Двукратное применение препаратов заметно стимулирует антителогенез при вакцинации телят в месячном возрасте против сальмонеллёза. При введении вакцины «Бивак» против инфекционного ринотрахеита и парагриппа-3 крупного рогатого скота животным в этом возрасте, иммуномодулирующее действие лигфола на антиген вируса ИРТ проявляется после первой, а селеданта и лигавирина - после второй вакцинации.
17. Двукратное применение лигфола, лигавирина и селеданта при иммунизации свиноматок на 48-50 дни супоросности против эшерихиоза и сальмонеллёза способствует нормализации до и в первые дни после опороса количества лейкоцитов и лимфоцитов в крови, стабилизации относительного уровня Т-клеток, увеличению синтеза IgА, а назначение селеданта и лигавирина - числа Ттфр-клеток, ФЧ и ФИ, титров поствакцинальных антител в сыворотке крови в 2-3 раза, а молозиве – в 2,69-5,97 раза.
Двукратное применение препаратов при вакцинации 20-дневных поросят против эшерихиоза и сальмонеллёза оказывает модулирующее влияние на показатели естественной резистентности, способствует повышению в крови числа лимфоцитов, Т- и Ттфр-клеток (Т-хелперов), снижению процента Ттфч-клеток (Т-супрессоров), а также при назначении селеданта и лигфола - увеличению содержания в крови IgМ и IgG и в 2-3 раза титров поствакцинальных антител.
ПРАКТИЧЕСКИЕ ПРЕДЛОЖЕНИЯ
1. Иммунный статус животных рекомендуем изучать комплексно с учётом индивидуальных, видовых, физиологических, возрастных особенностей, клинического их состояния, метаболического статуса, технологии выращивания с помощью стандартных и унифицированных методов исследования, что позволит наиболее объективно выявить отклонения в различных звеньях иммунной системы.
2. Проводить коррекцию иммунного статуса:
- у коров с целью повышения эффективности специфической профилактики колибактериоза и сальмонеллёза телят - в комплексе с двукратной вакцинацией их за 1-1,5 месяца до отёла - лигфолом в дозе 5 мл внутримышечно, лигавирином в дозе 5 мл подкожно и селедантом в дозе 20 мкг/кг внутримышечно;
- у телят с целью повышения абсорбции колостральных иммуноглобулинов – до приёма молозива однократно указанными препаратами, соответственно в дозах – 2 мл, 1 мл и 20 мкг/кг;
- у телят с целью повышения эффективности специфической профилактики сальмонеллёза, парагриппа-3 и инфекционного ринотрахеита при вакцинации в их месячном возрасте - препаратами в тех же дозах, что и при рождении, двукратно с интервалом 10 дней.
3. Проводить коррекцию иммунного статуса:
- у свиноматок с целью повышения специфической профилактики колибактериоза и сальмонеллёза поросят - в комплексе с двукратной вакцинацией за 1,5 месяца до опороса - лигфолом в дозе 5 мл внутримышечно, лигавирином в дозе 2,5 мл подкожно и селедантом в дозе 20 мкг/кг внутримышечно;
- у поросят с целью повышения специфической профилактики колибактериоза и сальмонеллёза – в комплексе с вакцинацией в возрасте 3-х недель указанными препаратами, соответственно в дозах - 1 мл, 0,5 мл и 20 мкг/кг.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Масьянов Ю.Н., Набоков В.С., Сулейманов С.М., Беляев В.И. Выделение и получение моноспецифической антисыворотки к иммуноглобулинам класса А крупного рогатого скота/Использование новых методов диагностики и фармакологических средств в лечении и профилактике незаразных болезней животных. Сб. науч. трудов. Воронеж, 1993. – С. 46-48.
2. Ануфриев П.А., Масьянов Ю.Н., Ануфриев А.И. Диагностика ТГС в реакции иммуноэлектрофореза (ВИЭФ)/Экологические аспекты эпизоотологии и патологии животных. Межд. науч.-произв. конф. посвящ. 100-летию со дня рожд. член-корр. ВАСХНИЛ Котова В.Т. Воронеж, 1999. - С. 85-86.
3. Эколого-адаптационная стратегия защиты здоровья и продуктивности животных в современных условиях/ Желудочно-кишечные болезни поросят. А.Г. Шахов, А.И. Ануфриев, С.М. Сулейманов, Ю.Н. Масьянов, Н.В. Душенин. Отв. ред. А.Г. Шахов – Воронеж: ВГУ. 2001. – С. 155-176.
* 4. Шахов А.Г., Ануфриев А.И., Масьянов Ю.Н., Першина С.И. Иммунобиологический статус свиноматок в зависимости от возраста и сроков супоросности//Вестник Россельхозакадемии. – 2003. - №2. С. 69-72.
5. Артемьева С.С., Близнецова Г.Н., Зайко А.М., Масьянов Ю.Н., Косматых Н.А., Рецкий М.И. Оксид азота и его взаимосвязь с формированием колострального иммунитета у новорожденных поросят/Свободные радикалы, антиоксиданты и здоровье животных. Мат. межд. науч.-практ. конф. Воронеж, 2004. – С. 14-17.
6. Кардашов А.М., Масьянов Ю.Н., Першина С.И. Влияние вакцинации коров с применением лигфола на иммунный статус телят/Свободные радикалы, антиоксиданты и здоровье животных. Мат. межд. науч.-практ. конф. Воронеж, 2004. – С. 304-306.
7. Мельникова Н.А., Масьянов Ю.Н. Влияние селеноорганического антиоксиданта – селекор на неспецифическую резистентность и иммунологическую реактивность у свиней при вакцинации/Свободные радикалы, антиоксиданты и здоровье животных. Мат. межд. науч.-практ. конф. Воронеж, 2004. – С. 251-258.
8. Петрова М.Г., Сотников А.А., Масьянов Ю.Н. Влияние плодовитости свиноматок на состояние естественной резистентности их организма/ Свободные радикалы, антиоксиданты и здоровье животных. Мат. межд. науч.-практ. конф. Воронеж, 2004. – С. 471-475.
9. Шахов А.Г., Бригадиров Ю.Н., Масьянов Ю.Н., Мельникова Н.А., Зайко А.М. Влияние лигфола и селекора на показатели неспецифической резистентности и формирование иммунитета у свиноматок и поросят/ Свободные радикалы, антиоксиданты и здоровье животных. Мат. межд. науч.-практ. конф. Воронеж, 2004. – С. 309-312.
*10. Мисайлов В.М., Михалёв В.И., Шахов А.Г., Сулейманов С.М., Шумский Н. И., Кочура М.Н., Сергеев Ю.В., Масьянов Ю.Н. Субинволюция матки у коров// Ветеринарная патология. – 2005. - №3 (14). – С. 64-69.
*11. Рецкий М.И., Шахов А.Г., Золотарёв А.И., Масьянов Ю.Н. Роль кислотно-основного состояния в формировании колострального иммунитета у новорожденных телят//Вестник Россельхозакадемии. – 2005. - №3. С. 69-71.
*12. Рецкий М.И., Шахов А.Г., Масьянов Ю.Н., Чудненко О.В., Близнецова Г.Н., Костына М.А., Батищева Е.В., Артемьева С.С. Взаимосвязь некоторых показателей биохимического статуса с интенсивностью всасывания колостральных иммуноглобулинов у новорожденных телят//Доклады РАСХН. – 2005. - №5. – С. 44-46.
*13. Шахов А.Г., Рецкий М.И., Масьянов Ю.Н., Золотарёв А.И., Бригадиров Ю.Н., Близнецова Г.Н., Каверин Н.Н. Повышение эффективности специфической профилактики факторных инфекций путём коррекции антиоксидантного и иммунного статуса коров и телят//Ветеринарная патология. – 2005. - №3 (14). – С. 84-89.
14. Шахов А.Г., Масьянов Ю.Н. Нормализация обмена веществ и иммунный статус крупного рогатого скота//Ветеринарный консультант. – 2006. - №19. – С. 15.
*15. Шахов А.Г., Масьянов Ю.Н., Бригадиров Ю.Н., Першина С.И., Бирюков М.В., Золотарёв А.И., Кардашов А.М., Батищева Е.В. Применение иммуномодуляторов при вакцинации животных против сальмонеллёза //Ветеринария. – 2006. - №6. - С. 21-26.
16. Шахов А.Г., Масьянов Ю.Н., Бригадиров Ю.Н., Батищева Е.В. Причины нарушения формирования куолострального иммунитета у телят и возможность его коррекции/ Мат. межд. науч.-практ. конф. Акт. пробл. инф. патологии и иммунологии животных. М.: «ИзографЪ», 2006. – С. 515-518.
17. Шахов А.Г., Масьянов Ю.Н., Рецкий М.И., Бригадиров Ю.Н., Першина С.И., Лебедев М.И., Батищева Е.В., Золотарёв А.И. Повышение эффективности специфической профилактики парагриппа-3 и инфекционного ринотрахеита крупного рогатого скота иммуномодуляторами и антиоксидантами/ Мат. межд. науч.-практ. конф. Акт. пробл. инф. патологии и иммунологии животных. М.: «ИзографЪ», 2006. – С. 519-521.
18. Шахов А.Г., Рецкий М.И., Масьянов Ю.Н., Бригадиров Ю.Н., Зайко А.М. Использование иммуномодуляторов и антиоксидантов для повышения эффективности иммунизации свиней/ Мат. межд. науч.-практ. конф. Акт. пробл. инф. пат. и иммунолог. животных. М.: «ИзографЪ», 2006. – С. 522-525.
19. Филатов Н.В., Золотарёв А.И., Масьянов Ю.Н., Рецкий М.И. Состояние окислительного метаболизма и иммунный статус у здоровых и заболевших омфалитом новорожденных телят//Акт. пробл. вет. в совр. услов. Краснодар, 2006. – С. 423-427.
20. Масьянов Ю.Н. Модификация метода O. Barta и V. Barta определения гемолитической активности комплемента в сыворотке крови крупного рогатого скота/Новые методы исследований по проблемам ветеринарной медицины. Ч.III, М. – 2007. – С. 296-299.
21. Масьянов Ю.Н. Метод ЕАС-розеток для определения количества В-лимфоцитов в крови крупного рогатого скота/Новые методы исследований по проблемам ветеринарной медицины. Ч.III, М. – 2007. – С. 300-303.
22. Масьянов Ю.Н. Метод количественного определения В-лимфоцитов у крупного рогатого скота, несущих иммуноглобулиновые рецепторы разных классов (розеткообразующий антиглобулиновый тест)/Новые методы исследований по проблемам ветеринарной медицины. Ч.III, М. – 2007. – С. 304-307.
*23. Рецкий М.И., Шахов А.Г., Филатов Н.В., Золотарёв А.И., Близнецова Г.Н., Масьянов Ю.Н., Ермолова Т.Г. Роль метаболического статуса в развитии омфалита у новорожденных телят// Доклады РАСХН. – 2007. - №4. – С. 50-53.
24. Шахов А.Г., Бригадиров Ю.Н., Сашнина Л.Ю., Лебедев М.И., Масьянов Ю.Н. Этиологическая структура массовых болезней поросят в крупных специализированных свиноводческих хозяйствах/Всерос. вет. конгр. ХV. Моск. междунар. вет. конгр. по болезн. мелких животных. Пробл. инф. пат. свиней. М. Россия: Изд. ЗАО «Издательский Дом», 2007. – С. 51-55.
*25. Шахов А.Г., Масьянов Ю.Н. Иммунный статус поросят-сосунов, больных трансмиссивным гастроэнтеритом//Вестник Россельхозакадемии. – 2007. - №2. С. 65-67.
*26. Рецкий М.И., Шахов А.Г., Близнецова Г.Н., Филатов Н.В., Масьянов Ю.Н. Тест для оценки пассивного переноса колостральных иммуноглобулинов//Ветеринария. – 2008. - №6. – С. 48-50.
*27. Шахов А.Г., Масьянов Ю.Н., Золотарёв А.И., Филатов Н.В., Сашнина Л.Ю. Иммунный статус телят при омфалите//Ветеринарная патология. – 2008. -№1 (24). – С. 201-206.
*28. Масьянов Ю.Н., Сулейманов С.М. Ультраструктурные особенности всасывания иммуноглобулинов в тонком кишечнике у новорожденных поросят//Доклады РАСХН. – 2009. - №1. – С. 46-49.
*29. Бригадиров Ю.Н., Артёмов Б.Т., Лаврищев П.Е., Шахов А.Г., Рецкий М.И., Масьянов Ю.Н., Сашнина Л.Ю., Шушлебин В.И. Роль иммунного и метаболического статуса в возникновении желудочно-кишечных заболеваний поросят//Вестник Россельхозакадемии. – 2009. - №4. С. 65-67.
*30. Шахов А.Г., Рецкий М.И., Масьянов Ю.Н., Сашнина Л.Ю., Бригадиров Ю.Н., Лебедев М.И. Влияние состояния иммунного статуса на возникновение и развитие респираторных болезней свиней//Доклады РАСХН. – 2009. - №4. – С. 55-58.
*31. Масьянов Ю.Н., Шахов А.Г., Сулейманов С.М., Толкачёв И.С. Иммунитет и морфологические изменения в молочной железе у коров при мастите//Вестник Россельхозакадемии. – 2009. - №4. С. 69-71.
*32. Рецкий М.И., Близнецова Г.Н., Шахов А.Г., Масьянов Ю.Н. Роль оксида азота в формировании колострального иммунитета у новорожденных поросят// Сибирский вестник сельскохозяйственной науки. – 2009. - №7. – С. 126-130.
*33. Шахов А.Г., Масьянов Ю.Н., Сашнина Л.Ю., Золотарёв А.И. Иммунный статус телят при диарейном синдроме инфекционной этиологии//Ветеринарная патология. – 2010. -№1. – С. 35-39.
Патенты РФ
34. Шахов А.Г., Рецкий М.И., Ануфриев А.И., Бригадиров Ю.Н., Золотарев А.И., Масьянов Ю.Н., Кардашов А.М, Першина С.И., Бирюков М.В. Способ профилактики колибактериоза телят. Патент RU 2275935 С1.- опубл. 10.05.06.- Бюл. №13.
35. Шахов А.Г., Рецкий М.И., Золотарев А.И., Масьянов Ю.Н., Першина С.И., Бригадиров Ю.Н., Кардашов А.М, Бирюков М.В. Способ иммунопрофилактики вирусных респираторных болезней телят. Патент RU 2287992 С1.- опубл. 27.11.06.- Бюл. №33.
36. Шахов А.Г., Рецкий М.И., Золотарев А.И., Беляев В.И., Бригадиров Ю.Н., Масьянов Ю.Н., Першина С.И., Каверин Н.И. Способ профилактики респираторных болезней телят. Патент RU 2287986 С1.- опубл. 27.11.06.- Бюл. №33.
37. Шахов А.Г., Рецкий М.И., Золотарев А.И., Бригадиров Ю.Н., Масьянов Ю.Н., Першина С.И., Бояринцев Л.Е., Бояринцева Т.Л., Клименко В.В. Способ иммунопрофилактики острых респираторных болезней телят. Патент RU 2292916 С1.- опубл. 10.02.07.- Бюл. №4.
38. Шахов А.Г., Рецкий М.И., Золотарев А.И., Бригадиров Ю.Н., Масьянов Ю.Н., Першина С.И., Бояринцев Л.Е., Бояринцева Т.Л., Клименко В.В. Способ профилактики желудочно-кишечных болезней телят. Патент RU 2295975 С1.- опубл. 27.03.07.- Бюл. №9.
39. Беляев В.И., Мельникова Т.Е., Шахов А.Г., Бригадиров Ю.Н., Масьянов Ю.Н., Батищева Е.В., Балым Ю.П. Способ повышения неспецифической резистентности и иммунологической реактивности свиней при вакцинации. Патент RU 2321414 С1.- опубл. 10.04.08.- Бюл. №10.
* издания из Перечня ведущих рецензируемых научных журналов и изданий ВАК РФ

