Синтез, свойства и биологическая активность 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов
На правах рукописи
Михалев Виктор Александрович
Синтез, свойства и биологическая активность
1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов
15.00.02 – Фармацевтическая химия, фармакогнозия
Автореферат
диссертации на соискание ученой степени
кандидата фармацевтических наук
Пермь - 2007
Работа выполнена на кафедре физической и коллоидной химии
Государственного образовательного учреждения высшего
профессионального образования
«Пермская государственная фармацевтическая академия
Федерального агентства по здравоохранению и социальному развитию»
Научный руководитель - доктор химических наук,
профессор Гейн В.Л.
Официальные оппоненты: доктор фармацевтических наук,
профессор Панцуркин В. И.
доктор химических наук,
профессор Масливец А. Н.
Ведущая организация - Башкирский государственный медицинский
университет
Защита диссертационной работы состоится января 2008 г.
в ____ часов на заседании диссертационного совета Д 208.068.01 при
Пермской государственной фармацевтической академии ГСП 277 по адресу
614990, г. Пермь, ул. Ленина, 48; телефакс 212-94-76.
С диссертацией можно ознакомиться в библиотеке Пермской государственной фармацевтической академии
Автореферат разослан «____» _____________ 2007 г.

Ученый секретарь диссертационного совета
кандидат фармацевтических наук, доцент Метелева Е.В.
Общая характеристика работы
Актуальность темы. Поиск новых биологически активных веществ (БАВ) и создание на их основе высокоэффективных и малотоксичных отечественных лекарственных препаратов, является важной задачей фармацевтической науки и практики. В плане поиска новых БАВ значительный интерес представляют производные тетрагидропиррол-2,3-дионов т.к. среди этого класса имеются биологически активные соединения, обладающие высокой противомикробной, противовоспалительной, анальгетической, ноотропной и другими видами активности.
В ранее проведенных исследованиях, на кафедрах органической, физической и коллоидной химии, фармакологии и микробиологии Пермской государственной фармацевтической академии установлено, что на химические свойства и биологическую активность существенное влияние оказывает химическая природа заместителя в положении 1 тетрагидропиррол-2,3-дионов.
В продолжение предыдущих работ и с целью поиска новых биологически активных соединений представляло интерес получить вещества, содержащие в положение 1 гетероцикла 2-метоксиэтильный или 3-изопропоксипропильные остатки, изучить физико-химические свойства данных соединений и провести оценку биологической активности в сравнении с препаратами – эталонами и ранее полученными структурными аналогами. Не менее важным является использование 3-пирролин-2-онов для получения на их основе азотсодержащих гетероциклических систем.
Диссертационная работа выполнена в соответствии с планом научно-ис-следовательских работ ПГФА в комплексной целевой программе МЗ РФ
(номер государственной регистрации 01. 9. 50 007419). Работа выполнена при финансовой поддержке РФФИ грант № 04-03-96042.
Цель работы. Основной целью данного исследования является разработка методов синтеза новых производных 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов, изучение их физико-химических свойств, получение на их основе новых, в том числе и конденсированных гетероциклических соединений, оценка биологической активности целевых продуктов синтеза и выявление взаимосвязи строения с биологической активностью.
Задачи исследования. Для достижения намеченной цели были поставлены следующие задачи :
- Разработать препаративный метод синтеза 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов.
- Исследовать взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов с моно- и бинуклеофилами.
3. Провести анализ данных по биологической активности с целью выявления взаи
мосвязи "структура - биологическое действие" в исследуемых рядах соединений и
отобрать наиболее перспективные вещества для дальнейших углубленных иссле
дований.
Научная новизна. Разработан препаративный метод синтеза ранее неизвестных 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов на основе трехкомпонентной реакции эфиров ацилпировиноградных кислот, со смесью ароматического альдегида и 2-метоксиэтиламина или 3-изопропоксипропиламина.
Изучены химические свойства 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов в реакциях с алифатическими и ароматическими аминами. Установлено, что при взаимодействии 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов с алкил(арил)-аминами подвергается атаке атом углерода ацетильной группы в положении 4 гетероцикла с образованием соответствующих алкил(арил)-аминопроизводных.
Показано, что при взаимодействии 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов с ариламинами нуклеофильное замещение происходит в положении 3 гетероцикла, и образуются 3-ариламинопроизводные 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов.
Выявлено, что реакции 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов с ацетатом аммония приводят к 5-арил-4-(1-аминоэтилиден)тетрагидропиррол-2,3-дионам.
Установлено, что при нагревании 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов с гидразингидратом в концентрированной уксусной кислоте происходит гетероциклизация с образованием 3-ацил-4-арил-5-(2-метоксиэтил)-4,6-дигидропирроло[3,4-с]пиразол-6-онов.
Обнаружено, что взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов с тиосемикарбазидом или гидразидом салициловой кислоты сопровождается образованием 5-арил-4-(1-2-гидроксифенилкарбонил-гидразиноэтилиден)-1-(2-метоксиэтил)тетрагидропиррол-2,3-дионов и 5-арил-4-(1-тиосемикарбазидоэтилиден)-1-(2-метоксиэтил)тетрагидропиррол-2,3-диона.
У ряда соединений имеется противовоспалительная и противомикробная активность. Выявлены некоторые закономерности между структурой и биологическим действием в рядах синтезированных соединений.
Практическая значимость работы. Разработаны препаративные методы синтеза 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов, 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов, 1-(3-изопропоксипропил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов, 4-(1-R-аминоэтилиден)тетрагидропиррол-2,3-дионов, 3-амино-4-бензоил-1-(2-метоксиэтил)-5-фенил-3-пирролин-2-она, 5-арил-4-бензоил-3-ариламино-1-(2-метоксиэтил)-3-пирролин-2-онов, 3-метил-4-арил-5-(2-метоксиэтил)-4,6-дигидропирроло[3,4-с]пиразол-6-онов, 3-ацетил-4-арил-5-(2-метоксиэтил)-1-фенил-4,6-дигидропирроло[3,4-с]пиразол-6-она, 4-арил-3-арил-5-(2-метоксиэтил)-4,6-дигидропирроло[3,4-с]пиразол-6-онов.
Осуществлен синтез 68 соединений, в результате скрининга которых установлено, что среди них имеются вещества с противовоспалительной, анальгетической, противомикробной активностью. Выявлены соединения, перспективные для дальнейшего поиска биологически активных веществ. Полученные данные по зависимости структура-активность среди апробированных соединений могут быть использованы при целенаправленном синтезе новых БАВ производных тетрагидропирол-2,3-дионов.
Апробация работы. Материалы диссертации доложены и обсуждены на научно-практических конференциях профессорско-преподавательского состава Пермской государственной фармацевтической академии 2002, 2005 гг.; Международных конференциях по органическому синтезу, С-Петербург 2002, 2005, 2006 гг.; VIII Молодежной научной школе-конференции по органической химии, Казань, 2005 г.; VI Региональной конференции молодых ученых по органической химии, Днепропетровск, 2005 г.; Региональной конференции «Разработка, исследование и маркетинг новой фармацевтической продукции», ГОУ ВПО Пятигорской государственной фармацевтической академии, Пятигорск, 2007 г.; XIV Российском национальном конгрессе «Человек и лекарство» Москва, 2007 г.
Публикации. По материалам диссертации опубликовано 11 работ: 1 статья в центральной печати и 2 в сборниках, 8 тезисов докладов на конференциях различного уровня.
Объем и структура диссертации. Содержание работы изложено на 165 страницах машинописного текста и состоит из введения, 4 глав, выводов. Библиографический список включает 169 работ отечественных и зарубежных авторов. Диссертационная работа содержит 29 таблиц и 25 рисунков.
Основные положения, выносимые на защиту :
- Синтез 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов.
- Взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов с моно- и бинуклеофильными реагентами.
- Установление структуры полученных соединений на основании данных ИК-
ЯМР 1Н-спектроскопии и масс-спектрометрии.
- Результаты биологических испытаний новых соединений и некоторые закономерности взаимосвязи строения с фармакологическим действием.
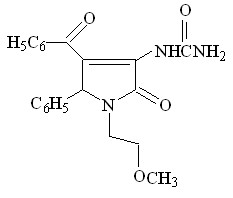
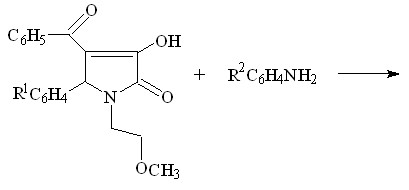
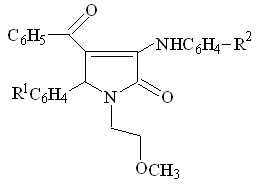
1. Синтез 1-(2-метоксиэтил)-5-арил-4-ацетил- и 1-(2-метоксиэтил)-
5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов
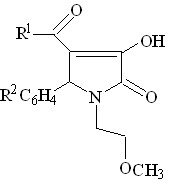
С целью поиска потенциальных биологически активных веществ среди производных пирролидин-2,3-дионов, нами была изучена трехкомпонентная реакция метиловых эфиров ацетил- или ароилпировиноградных кислот со смесью ароматического альдегида и 2-метоксиэтиламина.
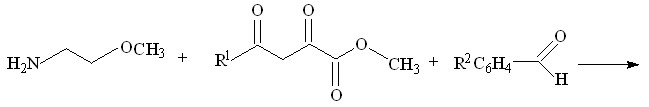
![]()
I а-л (52-82%) ; II а-д (50-89%)
I а-л R1 = CH3 ; R2 = H ( Iа ), 4- CH3O ( Iб ), 3-NO2 ( Iв ), 4-Cl ( Iг ), 4-(CH3)2N (Iд ),
2,4-Cl2 ( Iе ), 2,4-(CH3O)2 ( Iж ), R2C6H4= C6H5CH=CH ( Iз ); 3-HO ( Iи );
2,5-( CH3O)2 ( Iк ); 2- CH3O ( Iл )
II а-д R1 = C6H5 ( II а-г ), 4-ClC6H5 ( II д ) ;
R2 = H ( II а, II д ), 4-CH3O ( II б ), 3-NO2 ( II в ), 4-Cl ( II г )
Установлено, что при кратковременном нагревании смеси эквимолярных исходных веществ в диоксане образуются соответственно 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-оны (I а-л), или 1-(2-метоксиэтил)-5-арил-4-ароил-3-гидрокси-3-пирролин-2-оны (II а-д).
Вероятно, механизм данной реакции протекает через стадии образования основания Шиффа и эфира 4-амино-2-оксобутановой кислоты, который циклизуется с образованием конечного продукта реакции, что не противоречит литературным данным.
Полученные соединения I а-л, II а-д представляют собой бесцветные или бледно-желтые кристаллические вещества, растворимые в большинстве органических растворителях и плохо растворимые в воде.
В ИК – спектрах соединений I и II присутствуют интенсивные полосы поглощения, см-1: обусловленные валентными колебаниями енольной гидроксильной группы при 3100-3280; лактамной карбонильной группы при 1680-1720; кетонной карбонильной группы ацетильного остатка при 1600-1660.
В ЯМР 1Н – спектрах соединений I и II наблюдаются: мультиплет протонов метиленовой группы в положении 1 метоксиэтильного остатка при 2,50-2,90 (C(1)HAHB) и 3,60-4,00 (С(1)НАНВ); мультиплет двух протонов C(2)H2 при 3,30-3,50; синглет метинового протона в положении 5 гетероцикла при 5,00-5,80; группа линий ароматических протонов в области 6,40-8,20; синглет протонов метильной группы в области 2,00-2,30 и протонов метоксигруппы метоксиэтильного заместителя при 3,00-3,30 м.д.
В масс-спектре соединения IIг присутствуют пики молекулярного иона с m/z 371 (23,42%) [M]+ и фрагментных ионов с m/z (%): 311 (7,81) [M - CH3OCH2CH2-Н]+, 270 (39,64) [M - CH3OCH2CH2N=C=O]+, 105 (100,00) [PhCO]+. Такой характер фрагментации подтверждает указанную структуру.
Все синтезированные соединения I и II дают интенсивное вишневое окрашивание со спиртовым раствором хлорида железа (III), что наряду со спектральными данными свидетельствует о том, что эти соединения существуют преимущественно в енольной форме.
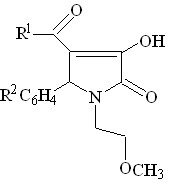
2. Синтез 1-(3-изопропоксипропил)-5-арил-4-ацил- 3-гидрокси-3-пирролин-2-онов
С целью изучения влияния структуры алкоксиалкиламина на протекание трехкомпонентной реакции, а также расширения круга биологически активных веществ, нами был использован в качестве аминокомпоненты 3-изопропоксипропиламин, а в качестве карбонильной-ароматические и гетероциклические альдегиды.
Нами было установлено, что при кратковременном нагревании эквимолярных количеств метиловых эфиров ацилпировиноградных кислот со смесью ароматического или гетероциклического альдегида и 3-изопропоксипропиламина образуются 1-(3-изопропоксипропил)-5-арил(гетерил)-4-ацил-3-гидрокси-3-пирролин-2-оны.

![]()
III а-и (43-91%)
R1 = 2-тиенил ( III а ), 3-CH3OC6H4 ( III б, в ), 4-ClC6H4 ( III г-е ), C6H5 ( III ж-и ) ;
R 2 = C6H5 ( III а ), 2-пиридил ( III б, г, и ), 2-тиенил (III в, д, ж ), 2-фурил ( III е, з )
Синтезированные соединения III а-и представляют собой бесцветные или бледно-желтые кристаллические вещества, растворимые в органических растворителях, таких как диметилформамид (ДМФА), диметилсульфоксид (ДМСО), хлороформе, нерастворимые в воде.
В ИК – спектрах соединений III содержатся интенсивные полосы поглощения, см-1: обусловленные валентными колебаниями енольной гидроксильной группы при 3100-3180; лактамной карбонильной группы при 1680-1700; кетонной карбонильной группы боковой цепи при 1625-1650.
В ЯМР 1Н – спектрах соединений III наблюдаются сигналы протонов, м.д.: мультиплета метиленовой группы в положении 1 3-изопропоксипропильного остатка при 2,70-2,95 (C(1)HAHB) и 3,60-3,70 (С(1)НАНВ); мультиплет двух протонов метиленовой группы в положении 2 при 1,60-1,70; мультиплет С(3)Н2 при 3,22-3,35; синглет метинового протона в положении 5 гетероцикла при 5,50-5,90; мультиплет (CH3)2CHO при 3,40-3,50; дуплет (CH3)2CHO с центром при 1,50; группа линий ароматических протонов в области 6,40-8,10.
Спектральные данные, а так же качественная реакция со спиртовым раствором хлорида железа (III), свидетельствуют о существовании соединений III преимущественно в енольной форме.
3. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-
2-онов с алифатическими аминами, мочевиной и ацетатом аммония
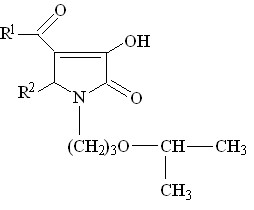
Нами изучено взаимодействие полученных 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов (I) и 1-(2-метоксиэтил)-5-арил-4-ароил-3-гидрокси-3-пирролин-2-онов (II) с мононуклеофильными реагентами. Для этого в реакциях были использованы нуклеофилы с различными значениями их констант основности. Кроме того, ставилась задача расширить круг соединений для поиска потенциально биологически активных соединений.
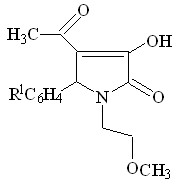
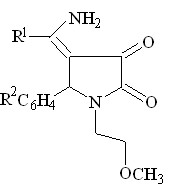
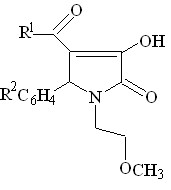
В ходе работы, было установлено, что при кипячении в диоксане в течение 2 часов или сплавлении соединений I а-г с алифатическими аминами, такими как этаноламин, бутиламин происходит нуклеофильное замещение в ацетильном фрагменте в положении 4 гетероцикла в результате чего образуются соответствующие 5-арил-4-(1-R-аминоэтилиден)тетрагидропиррол-2,3-дионы ( соед. IV а-е ).
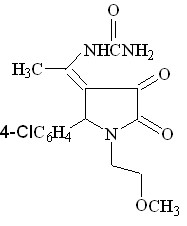
При сплавлении соединений Iа, Iг, IIа с мочевиной реакция протекает с образованием 1-(2-метоксиэтил)-5-фенил-4-(1-аминоэтилиден)тетрагидропиррол-2,3-диона (соед. IV ж), 1-(2-метоксиэтил)-5-4-хлорфенил-4-(1-уреидоэтилиден)тетрагидро пиррол-2,3-диона (соед. IV з) и 3-аминокарбониламино-4-бензоил-5-фенил-3-пирролин-2-она (IV и).
![]()
+ R2 -NH2
I а-г (60-82%) IV а-е (62-84%)
+ H2NC(O)NH2
IV ж (67 %) IV з (81 %) IV и (55 %)
R1 = CH3 ( IV а-е );
R2 = H ( IV а,е ), 4-CH3O ( IV б ), 3-NO2 ( IV в, д ), 4-Cl ( IV г );
R3 = (CH2)3CH3 ( IV а-г ), (CH2)2OH ( IV д, е )
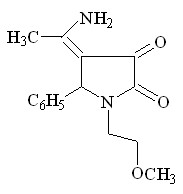
При кипячении 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов ( I а, б, г ) с ацетатом аммония в ледяной уксусной кислоте в течение 5-6 часов образуются тетрагидропиррол-2,3-дионы ( IV к-м ), а в случае использования 5-(4-хлорфенил)-4-бензоил-3-гидрокси-3-пирролин-2-она ( II г ) в реакции с ацетатом аммония был выделен 1-(2-метоксиэтил)-5-(4-хлорфенил)-4-бензоил-3-амино-3-пирролин-2-он соединение IV н.
Реакционная способность енолизованной карбонильной группы в положении С3 гетероцикла, зависит от характера заместителя в положении С4 гетероцикла. При наличии у исходных соединений в положении С4 гетероцикла ацетильной группы ( Iа-г ), реакции с алифатическими и ароматическими аминами протекают по карбонильной группе боковой цепи, а в случае 4-ароилзамещенных соединений ( IIа,г ), атака нуклеофила переносится в положение С3 гетероцикла.
R1 =CH3
+ CH3COONH4
IV к-м (56-71%)

R1 =C6H5
I а, б, г, II г
IV н (90%)
R2 = H ( IVк ), 4-CH3O ( IVл ), 4-Cl ( IV м, н )
Полученные соединения IV а-н представляют собой бесцветные или бледно-желтые кристаллические вещества, растворимые в органических растворителях (ДМФА, ДМСО, хлороформе)и др. и плохо растворимые в воде.
В ИК – спектрах полученных соединений IV, снятых в виде пасты в вазелиновом масле, присутствуют интенсивные полосы поглощения, см-1.: обусловленные валентными колебаниями NH связи при 3100-3500; лактамной карбонильной группы и кетонной карбонильной группы при 1600-1720.
В ЯМР 1Н – спектрах соединений IV содержатся сигналы протонов, м.д.: мультиплета метиленовой группы в положении 1 метоксиэтильного остатка при 2,60-2,90 (C(1)HAHB) и 3,30-4,20 (С(1)НАНВ); мультиплет двух протонов метиленовой группы в положении 2 при 3,30-3,60; синглет метинового протона в положении 5 гетероцикла при 5,20-5,60; группа линий ароматических протонов в области 6,30-8,20; сигналы протонов ацетильного остатка (соединения IVа-з, к-м) в области 1,70-1,90; сигналы протонов метоксигруппы при 3,80.
В масс-спектре соединения IVж присутствуют пики молекулярного с m/z 274 (100,00%) [M]+ и фрагментных ионов с m/z (%): 216 (32,99) [M-CH3O-CH2CH2]+, 231 (14,99) [M - CH3CNH2]+, 197 (4,99) [Ph]+, подтверждающие указанную структуру. У соединения IVл присутствуют пики молекулярного с m/z 304 (73,86%) [M]+ и фрагментных ионов с m/z (%): 83 (3,69) [M -CH3C-NH2CC=O]+, 111 (1,87) [M - CH3OC6H4CHNCH2CH2OCH3]+, 107 (2,27) [PhOCH3]+ подтверждающие указанные структуры.
Данные ИК – и ПМР – спектроскопии, а так же масс-спектрометрии свидетельствуют о существовании соединений IV в енаминной форме.
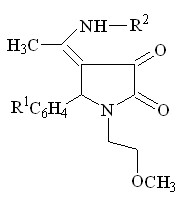
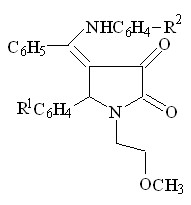
4. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов с ароматическими аминами
Так как 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-оны (I) имеют в своем составе реакционноспособные карбонильные группы было целесообразно изучить их взаимодействие с такими ариламинами, как п-анизидин, п-толуидин, п-броманилин, п-аминофенол, п-аминофенилсульфонилгуанидин.
Было установлено, что при кипячении исходных веществ в ледяной уксусной кислоте в течение 2-8 часов или при сплавлении до температур, превышающих температуры плавления веществ на 5-100 С, в течение получаса, образуются 1-(2-метоксиэтил)-5-арил-4-(1-ариламиноэтилиден)тетрагидропиррол-2,3-дионы (V а-л).
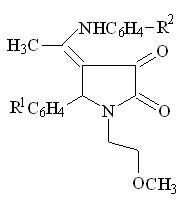

-4
I а-г V а-л (41-85%)
R1 = H ( V а,д,з,к,л ), 4-CH3O ( V б,ж ), 3-NO2 ( V в ), 4-Cl ( V г,е,и ) ;
R2 = CH3O ( V а-г ), CH3 ( V д-ж ), Br ( V з,и ), НO ( V к ),
SO2NHC(NH)NH2 ( V л )
Полученные соединения V а-л представляют собой желтые кристаллические вещества растворимые в большинстве органических растворителях (ДМФА, ДМСО, хлороформе) и нерастворимые в воде.
В ИК – спектрах соединений V, присутствуют интенсивные полосы поглощения, см-1.: обусловленные валентными колебаниями NH связи при 3020-3400; лактамной карбонильной группы при 1690-1710; кетонной карбонильной группы при 1625-1660.
В ЯМР 1Н – спектрах соединений V, в отличие от таковых для исходных соединений I а-г, наблюдаются сигналы протонов, м.д.: NH протона при 12,30-12,60, а сигнал метильной группы этиленового остатка смещается в сильное поле и наблюдается при 1,70-2,30, что свидетельствует о том, что реакция с ариламинами протекает по карбонильной группе боковой цепи.
В масс-спектре соединения V е присутствуют пики молекулярного с m/z 398 (45,00%) [M]+ и фрагментных ионов с m/z (%) : 60 (9,00) [M -CH3OCH2CH2-Н]+, 45 (75,00) [M - CH3OCH2]+, 91 (44,00) [PhCH3]+. У соед. V л присутствуют пики молекулярного с m/z 471 (5,00%) [M]+ и фрагментных ионов с m/z (%): 100 (2,00) [M -CH3OCH2CH2-N=C=O]+, 45 (100,00) [M - CH3OCH2]+, 77 (25,00) [Ph]+, подтверждающие указанные структуры. Отсутствие вишневого окрашивания с хлоридом железа (III), а так же спектральные данные свидетельствуют о существовании соединений V в енаминной форме.
5. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-
3-пирролин-2-онов с ароматическими аминами
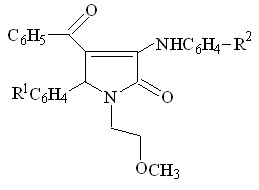
Нами было изучено взаимодействие 1-(2-метоксиэтил)-5-арил-3-гидрокси-3-пирролин-2-онов, содержащих в положении С4 гетероцикла бензоильный остаток, с ариламинами. Установлено, что при кипячении реагентов в уксусной кислоте в течение нескольких часов или при сплавлении в течение получаса образуются 1-(2-метоксиэтил)-5-арил-4-бензоил-3-ариламино-3-пирролин-2-оны (VI а-ж).
-4
4-
II а, в, г VI а-ж (49-90%)
R1 = H ( VI а,в,д,ж ), 3-NO2 ( VI б,е ), 4-Cl ( VI г ) ;
R2 = CH3О ( VI а,б ), CH3 ( VI в,г ), Br ( VI д,е ), HO ( VI ж )
При этом атака нуклеофила направлена на атом углерода карбонильной группы в положении 3 гетероатома и сопровождается образованием соответствующих 3-ариламинопроизводных 3-пирролин-2-онов VI а-ж. Однако, в двух случаях, при взаимодействии соединений II а,г с ароматическими аминами, такими как п-толуидин и п-анизидин, образуются смеси – региоизомеров, по данных ПМР спектроскопии, формы находятся в соотношении 60 % (форма А) и 30 % (форма Б).
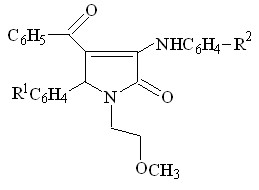
А Б
Полученные соединения VI а-ж представляют собой желтые кристаллические вещества, растворимые в различных органических растворителях, нерастворимые в воде.
В ИК – спектрах соед. VI, присутствуют интенсивные полосы поглощения, см-1: обусловленные валентными колебаниями NH связи при 3250-3400; лактамной карбонильной группы при 1690-1700; кетонной карбонильной группы боковой цепи при 1650-1660.
В ЯМР 1Н – спектрах соединений VI наблюдаются следующие сигналы протонов, м.д.: мультиплета метиленовой группы в положении 1 метоксиэтильного остатка при 2,70-2,80 (C(1)HAHB) и 3,60-4,00 (С(1)НАНВ); мультиплет двух протонов метиленовой группы в положении 2 при 3,30-3,50; синглет метинового протона в положении 5 гетероцикла при 5,20-5,60; группа линий ароматических протонов в области 6,20-8,00; NH протона при 8,45-8,90, а так же синглет протонов метоксигруппы метоксиэтильного заместителя при 3,20-3,30 м.д. Наряду с вышеуказанными сигналами, у соед. VI а, б присутствуют сигналы протонов метоксигрупп заместителя в положении 5 гетероцикла при 3,70, а у соед. VI а, г дополнительный синглет метинового протона при 5,20-5,70 м.д.
Согласно данным ИК – и ПМР – спектроскопии, а так же отсутствием вишневого окрашивания в реакции с хлоридом железа (III) подтверждается, что соеди-нения VI существуют исключительно в енаминной форме.
6. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси- 3-пирролин-2-онов с гидразингидратом и фенилгидразином
С целью изучения химических свойств 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов и синтеза биологически активных соединений нами изучено взаимодействие соединений I с гидразингидратом и фенилгидразином.
Установлено, что при кипячении соединений I в концентрированной уксусной кислоте с гидразингидратом в течение 2 часов происходит образование 3-ацетил-4-арил-5-(2-метоксиэтил)-4,6-дигидропирроло[3,4-с]пиразол-6-онов (VIIа-в), а с фенилгидразином, в тех же условиях, реакция может протекать неоднозначно, в двух направлениях и были выделены 3-ацетил-4-арил-5-(2-метоксиэтил)-1-фенил-4,6-дигидропирроло[3,4-с]пиразол-6-она (VIII) или 5-арил-4-(1-фенилгидразино-
этилиден)-1-(2-метоксиэтил)тетрагидропиррол-2,3-дионы ( IХ а,б ).
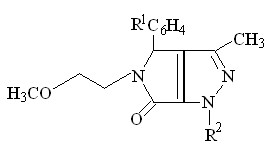
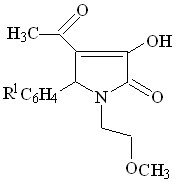
+ R2-NHNH2
VII а-в (55-66%), VIII (55%)
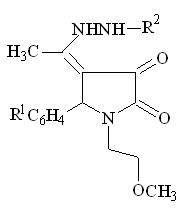
I а-г
IХ а, б (60-69%)
R1 = H ( VII а, VIII ), 4-CH3О ( VII б, IХа ), 3-NO2 ( VII в ), 4-Cl ( IХ б ) ;
R2 = H ( VII а-в ), C6H5 ( VIII, IX а, б )
Полученные соединения VII а-в, VIII, IX а,б представляют собой бесцветные или желтые кристаллические вещества, растворимые в ДМФА, ДМСО, хлороформе, не растворимые в воде.
В ИК – спектрах соед. VII, VIII, IX присутствуют интенсивные полосы поглощения, см-1.: обусловленные валентными колебаниями NH связи при 3020-3220; лактамной карбонильной группы при 1690-1700.
В ЯМР 1Н – спектрах соединений VII, VIII присутствуют характерные сигналы протонов, м.д.: метоксигруппы метоксиэтильного заместителя при 3,30; синглет метинового протона в положении С4 гетероцикла при 5,50-5,80; сигналы протонов метоксигруппы (соед. VIIб ) при 3,80; NH-группы при 12,97-13,10 (соед. VII ).
В спектрах соединений IX присутствуют характерные сигналы протонов, м.д.: метоксигруппы метоксиэтильного заместителя при 3,20-3,30; метильной группы этилиденового остатка при 2,00-2,10; синглет метинового протона в положении С5 гетероцикла при 5,40-5,70; сигналы протонов метоксигруппы (соед. IХа ) при 3,80; сигналы NH-протонов при 8,15-8,30.
По данным ИК – и ПМР – спектроскопии соединения VII а-в, VIII существуют в форме бициклических соединений, а соединения IX а,б в енгидразинной форме.
7. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси- 3-пирролин-2-онов с гидразингидратом
В ходе изучения свойств производных пиррол-2,3-дионов, нами было установлено что 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-оны (II) взаимодействуют с гидразингидратом, в тех же условиях что и соединения 4-ацетил производные ( I ), с образованием 3-бензоил-4-арил-5-(2-метоксиэтил)-4,6-дигидропирроло[3,4-с]пиразол-6-онов X а-г.
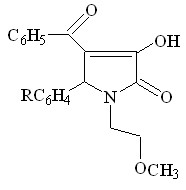
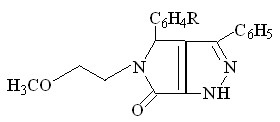
![]()
укс.к-та (конц.)
II а-г X а-г (43-76%)
R = H ( Xа ); 4-ОCH3 ( Xб ); 3-NO2 ( Xв ); 4-Cl ( Xг )
Так как соединения II а-г содержат реакционноспособную карбонильную группу в ароильном заместителе, то можно предположить, что первоначально образующиеся гидразоны по кетонному карбонилу в положении 3 гетероцикла, в более жестких условиях способны циклизоваться с образованием системы пирроло[3,4-с]пиразола. Выделенные соединения X а-г представляют собой бесцветные кристаллические вещества, растворимые в различных органических растворителях, не растворимые в воде.
В ИК – спектрах X присутствуют интенсивные полосы поглощения, см-1.: обусловленные валентными колебаниями NH связи при 3050-3230; лактамной карбонильной группы при 1690-1700.
В ЯМР 1Н – спектрах соединений X наблюдаются характерные сигналы протонов, м.д.: метоксигруппы метоксиэтильного заместителя при 3,20-3,30; мультиплет двух протонов C(2)H2 при 3,40-3,50; синглет метинового протона в положении 4 гетероцикла при 5,70-6,20; сигналы NH-протона при 8,00-14,00. Так же, в спектрах присутствует сигнал протонов метоксигруппы заместителя в положении 4 гетероцикла (соед. X б) при 3,80 м.д.
В масс-спектре соединения Xб присутствуют пики молекулярного с m/z 363 (59,20%) [M]+ и фрагментных ионов с m/z (%): 261 (5,96) [M -CH3OCH2CH2N=C=0]+, 77 (15,06) [Ph]+, подтверждающие указанную структуру.
8. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-
2-онов с тиосемикарбазидом и гидразидом салициловой кислоты
На следующем этапе работы установлено, что в реакциях 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов (I) с тиосемикарбазидом и гидразидом салициловой кислоты образуются соответствующие 4-(1-R-аминоэтилиден)тетрагидропиррол-2,3-дионы (XI а-в).
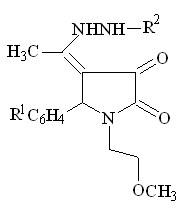
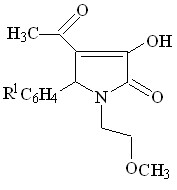
![]()
+ R2-NHNH2
I а, г XI а-в (64-82%)
R1 = H ( XI а ), 4-Cl ( XI б,в ) ;
R2 = 2-HО-C6H4C=O ( XI а,б ); C(S)NH2 ( XI в )
Полученные соединения XI а-в представляют собой бледно-желтые кристаллические вещества, растворимые в большинстве органических растворителях, но не растворимые в воде.
В ИК – спектрах соединений XI присутствуют интенсивные полосы поглощения, см-1: обусловленные валентными колебаниями NH связи при 3100-3400; лактамной карбонильной группы при 1680-1690.
В ЯМР 1Н – спектрах соединений XI наблюдаются сигналы протонов, м.д.: метоксигруппы метоксиэтильного заместителя при 3,20; синглет метинового протона в положении 5 гетероцикла при 5,40-5,50; сигналы протонов метильной группы этилиденового остатка в области 2,00-2,50. Кроме этого, в спектрах присутствуют сигналы протонов первичных аминогрупп при 9,85-11,50 м.д.
Данные ИК – и ПМР – спектроскопии подтверждают, что соединения XI существуют в енгидразинной форме.
Биологическая активность синтезированных соединений
Биологические исследования были проведены в Пермской государственной фармацевтической академии на кафедре клинической фармакологии с курсом иммунологии аспирантом Яценко К.В., под руководством д.м.н., проф., зав. кафедрой Юшкова В.В.; на кафедре физиологии и патологии Марковой Л.Н., под руководством д.м.н., проф., зав. каф. Сыропятова Б.Я.; на кафедре микробиологии с курсом гигиены и экологии при участии к.х.н., доц. Ворониной Э.В., под руководством д.ф.н., зав. каф., доц. Одеговой Т.Ф., которым автор выражает глубокую благодарность.
Всего биологическим испытаниям было подвергнуто 68 соединений на противовоспалительную, анальгетическую, противомикробную, влияние на свертываемость крови и токсичность. В качестве препаратов-эталонов сравнения были использованы известные лекарственные препараты: диклофенак натрия (ортофен), метамизол (анальгин), этакридина лактат, фурацилин, гепарин, этамзилат.
Острую токсичность (ЛД50) определяли, в основном, для соединений, показавших хорошую противовоспалительную активность при скрининге. В результате проведенных исследований установлено, ЛД50 у изученных соединений при пероральном пути введения составляет Vи 5000, а Vл > 6500 мг/кг. Из данных следует что соединение Vи в 6,7 раза менее токсично, а соединение Vл в 8,7 раз менее токсично, чем препарат сравнения - диклофенак натрия.
Противовоспалительная активность (ПВА) была изучена на белых беспородных крысах на каррагениновой модели воспаления. Каждая серия опытов включала 6 животных. Исследуемые вещества вводили двумя способами: перорально (п/о) или внутрибрюшинно (в/б), в дозе 50 мг/кг, а препарат-эталон, диклофенак натрия - в дозе 10 мг/кг и 25 мг/кг за час до моделирования каррагениного воспаления. Испытуемые соединения и препарат – сравнения вводили в виде раствора в 2 % крахмальной слизи.
Были апробированы 33 соединения. Результаты противовоспалительного действия наиболее активных соединений показаны в таблице 1. Нами выявлены некоторые зависимости противовоспалительного действия соединений в отдельных рядах и среди разных рядов соединений.
При подведении итогов испытаний следует выделить ряд соединений, показавших выраженную противовоспалительную активность в дозе 50 мг/кг при в/б пути введения через 3 часа - это Iв,г ; IVг,д; Vв; VIа, которые снижают воспаление вызванное каррагенином в целом на 43,3 – 56,5% через 3 часа, и сохраняют свою активность по истечению 5 часов. По силе противовоспалительного действия они располагаются в следующий ряд : IVд > VIa > Iв > Vв > Iг > IVг. При пероральном пути введения в этой же дозе наиболее активными оказались соединения : Ia ; Vг,и,л, вызывающие противовоспалительный эффект через 3 часа в пределах 27,4–44,8 % и по силе действия расположены в порядке: Vи > Vл > Vг > Iа. Из приведенных данных следует, что наиболее активными в противовоспалительном отношении являются 1-(2-метоксиэтил)-5-(3-нитрофенил)-4-(бутиламиноэтилиден)тетрагидропиррол-2,3-дион (соед. IVд) и 1-(2-метоксиэтил)-5-(4-хлорфенил)-4-(4-бромфениламиноэтилиден)тетрагидропирол-2,3-дион (соед. Vи), а также соединение (Vл), содержащее в своей структуре остаток 4-аминофенилсульфонилгуанидина у атома углерода в боковой цепи пиррол-2,3-диона.
Следует отметить, что все апробированные соединения по своей противовоспалительной активности уступают таковой препарата - эталона диклофенака натрия как при в/б так и п/о пути введения.
Анализ результатов исследований показывает, что на проявление активности оказывает действие природа и положение заместителя в ароматическом кольце. Противовоспалительное действие проявляется в наибольшей степени у соединений, имеющих метильную, метоксигруппы, атомы хлора или брома в основном в пара положении ароматического кольца. Конденсированные гетероциклические соединения оказались неактивными.
ПВА соединений I, IV-VI в дозе 50 мг/кг
I а IV г,д
Vв,г,и,л VIа
| Соеди нение | R1 | R2 | Путь введения | ПВА, % торможения каррагенинового отека, через | ||
| 1 час | 3 часа | 5 часов | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Iа | CH3 | H | п/о | н/а | 27,4±8,60* | 39,4±9,30*** |
| Iв | CH3 | 3-NO2 | в/б | 38,7±12,62 | 53,6±12,19* | 53,1±10,72 |
| Iг | CH3 | 4-Cl | в/б | 67,2±9,30* | 49,5±10,01 | 44,7±11,84 |
| IVг1 | CH3 | 4-Cl | в/б | 27,5±13,77 | 43,3±7,87 | 42,2±8,31 |
| IVд2 | CH3 | 3-NO2 | в/б | 46,9±28,66 | 56,5±18,13* | 58,4±15,36* |
| Vв | 3-NO2 | 4-CH3O | в/б | 67,3±16,39* | 52,2±4,88** | 24,1±9,21 |
| Vг | 4-Cl | 4-CH3O | п/о | 4,8±2,70 | 28,8±4,20*** | 28,2±4,20** |
| Vи | 4-Cl | 4-Br | п/о | 4,8±5,70 | 44,8±2,30*** | 35,2±3,40** |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Vл3 | H | - | п/о | н/а | 37,0±2,20*** | 26,8±3,30*** |
| VIа | H | 4- CH3O | в/б | 42,7±15,15 | 56,2±6,83** | 48,1±6,47** |
| диклофенак натрия 10 мг/кг | п/о | 22,0±7,40 | 56,0±7,30*** | 63,0±5,00** | ||
| диклофенак натрия 25 мг/кг | в/б | - | 69,4*** | 50,0** | ||
р < 0,05, ** р < 0,01, *** р < 0,001 по сравнению с контролем
1 R3 = (CH2)3CH3, 2 R3 = (CH2)2OH, 3 R2 = SO2NHC(NH)NH2,
Таким образом, в результате испытаний выявлено, что соединения (Vи,л), в дозе 50 мг/кг при пероральном пути введения, обладают выраженной противовоспалительной активностью и вызывают торможение каррагенинового отека через три часа соответственно на 44,8 и 37,0 %, а через пять часов соответственно на 35,2 и 26,8 %, а также проявляют анальгетическую активность при низкой токсичности равной ЛД50 5000 (Vи); >6500 (Vл) и могут быть рекомендованы для дальнейшего углубленного изучения.
Анальгетическая активность соединений изучена по методу «горячей пластинки» в дозе 50 мг/кг при пероральном пути введения. В качестве эталона сравнения использовали метамизол (анальгин) и диклофенак натрия (ортофен) в дозах 10 и 50 мг/кг при этом же пути введения. Установлено, что соединения Vи, Vл обладают слабым анальгетическим действием, уступающим таковому препаратам сравнения.
Противомикробная активность (ПМА) была определена у 68 соединений, сгруппированных по химической природе в 10 рядах в отношении золотистого стафилококка и кишечной палочки. Для определения использовали метод последовательных разведений в мясопептонном бульоне. В качестве эталона сравнения использовали этакридина лактат, фурацилин.
При изучении результатов биологических испытаний синтезированных соединений на наличие противомикробной активности следует отметить, что из 68 апробированных - 16 соединений обладают одинаковой активностью в отношении золотистого стафилококка и кишечной палочки при МИК равной 500 мкг/мл и одно соединение Vе оказывает действие при МИК 250 мкг/мл к данным культурам. Остальные соединения показали в основном слабую противомикробную активность их МИК составляет в среднем около 1000 мкг/мл по отношению к обеим культурам. Наибольшее количество соединений с МИК 500 мкг/мл выявлено в рядах 1-(3-изопропоксипропил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов (соед. III а,в,д,е,з), а также 1-(2-метоксиэтил)-5-арил-4-(ариламиноэтилиден)тетрагидропиррол-2,3-дионов (соед. V а,д,е,з,к).
Исследование влияния соединений на свертывающую систему крови проведено in vitro с помощью коагулометра «Минилаб 701». Для исследования брали цитратную (3,8 %) кровь (9:1). Влияние соединений на свертывание крови изучали в одинаковой концентрации 1 мг/мл. В качестве эталона сравнения антикоагулянтной активности использовали раствор гепарина в концентрации 1 ЕД/мл крови. Эталон сравнения гемостатической активности – этамзилат в концентрации 1 мг/мл.
Проведено исследование 7 соединений, относящихся к рядам 1-(2-метоксиэтил)-
5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов (соед. I б,г,и,к) и 1-(2-метоксиэтил)-5-арил-4-(1-алкиламиноэтилиден)тетрагидропиррол-2,3-дионов (соед. IV а,е,л) и установлено, что апробированные соединения не оказывают существенного влияния на свертываемость крови.
Таким образом, в результате исследования осуществлен синтез ранее неизвестных соединений, среди которых выявлены вещества, обладающие противовоспалительной, анальгетической, противомикробной активностью. Выявлены некоторые закономерности зависимости биологической активности от структуры соединений, которые могут быть учтены в дальнейшем целенаправленном поиске новых БАВ в ряду пирролин-2,3-дионов.
Выводы
- Установлено, что при взаимодействии метиловых эфиров ацилпировиноградных кислот со смесью ароматического альдегида и 2-метоксиэтиламина образуются 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-оны.
- Трехкомпонентная реакция метиловых эфиров ацилпировиноградных кислот со смесью бензальдегида или гетероциклического альдегида и 3-изопропоксипропиламина, приводит к образованию 1-(3-изопропоксипропил)-5-арил(гетерил)-4-ацил-3-пирролин-2-онов.
- Обнаружено, что в реакциях 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов с бутиламином и этаноламином образуются 1-(2-метоксиэтил)-5-арил-4-(1-алкиламиноэтилиден)тетрагидропиррол-2,3-дионы. В результате реакции 1-(2-метоксиэтил)-5-арил-4-ацетил-3-пирролин-2-онов с ацетатом аммония были выделены 5-арил-4-(аминоэтилиден)тетрагидропиррол-2,3-дионы, а в случае 5-(4-хлорфенил)-4-бензоил-3-гидрокси-3-пирролин-2-она 1-(2-метоксиэтил)-5-арил-4-бензоил-3-амино-3-пирролин-2-он.
- Установлено, что при нагревании в уксусной кислоте или сплавлении 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов с пара-замещенными ариламинами образуются 1-(2-метоксиэтил)-5-арил-4-(1-ариламиноэтилиден)тетрагидропиррол-2,3-дионы, в случае 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов атака нуклеофила переносится на карбонильную группу С(3)О и образуются 1-(2-метоксиэтил)-5-арил-4-бензоил-3-ариламино-3-пирролин-2-оны.
- Выявлено, что взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацетил- или 1-(2-метоксиэтил)-5-арил-4-бензоил-3-гидрокси-3-пирролин-2-онов с гидразингидратом в уксусной кислоте приводит к образованию соответственно 3-ацетил- или 3-бензоил-4-арил-5-(2-метоксиэтил)-4,6-дигидропирроло[3,4-c]пиразол-6-онов.
- Показано, что при взаимодействии 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов с фенилгидразином, тиосемикарбазидом и гидразидом салициловой кислоты реакция протекает по ацетильному фрагменту 3-пирролин-2-она и сопровождается образованием 4-(R-аминоэтилиден)производных тетрагидропиррол-2,3-дионов.
- Изучена противовоспалительная, анальгетическая, противомикробная активность, влияние на гемостаз и острая токсичность 68 соединений. Обнаружена взаимосвязь между структурой и противовоспалительной активностью полученных соединений. Результаты скрининга показывают, что исследования в данной области перспективны.
- По результатам скрининга выявлено соединение – 1-(2-метоксиэтил)-5-(4-хлорфенил)-4-[1-(4-бромфениламиноэтилиден)]тетрагидропиррол-2,3-дион, обладающее выраженной противовоспалительной активностью при низкой токсичности, которое представляет определенный интерес для исследований.
Основное содержание диссертации опубликовано в работах :
1. Синтез 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов и их противомикробная активность / В.А. Михалев, Э.В. Воронина, М.И. Вахрин, Н.Н. Касимова, В.Л. Гейн, Е.Б. Бабушккина // Фармация и здоровье. Материалы междунар. науч.-практ. конф : [Тез. докл.]. - Пермь, 2005. - С. 74.
2. Взаимодействие 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов с ариламинами и их противомикробная активность / В.А. Михалев, Э.В. Воронина, М.И. Вахрин, В.Л. Гейн // Фармация и здоровье. Материалы междунар. науч.-практ. конф : [Тез. докл.]. - Пермь, 2005. - С. 75.
3. Михалев, В.А. Синтез 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов и их взаимодействие с нуклеофильными реагентами / В.А. Михалев, В.Л. Гейн, М.И. Вахрин // VIII молодежная научная школа-конференция по органической химии. : [Тез. докл.]. – Казань, 2005. - С. 223.
4. Синтез 5-R-4-ароил-3-гидрокси-1-(3-изопропоксипропил)-3-пирролин-2-онов и их противомикробная активность / В.А. Михалев, Н.Н. Касимова, М.И. Вахрин, В.Л. Гейн. // VI Региональная конференция молодых учёных и студентов актуальных вопросов химии. : [Тез. докл.]. – Днепропетровск, 2005. - С. 35.
5. Михалев, В.А. Синтез 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов и их взаимодействие с нуклеофильными реагентами / В.А. Михалев, Л.Ф. Гейн, В.Л. Гейн // IV Международная конференция молодых учёных по органической химии. Современные тенденции в органическом синтезе и проблемы химического образования. : [Тез. докл.]. - СПб., 2005. - С. 192 - 193.
6. Синтез и свойства 1-(2-метоксиэтил)-5-арил-4-ацетил-3-гидрокси-3-пирролин-2-онов / В.А. Михалев, В.Л. Гейн, М.И. Вахрин, Е.Б. Бабушкина // Всероссийская конф. «Техническая химия. Достижения и перспективы.» : [Тез. докл.]. – Пермь, 2006. – С. 147 - 149.
7. Синтез и противомикробная активность 1-алкоксиалкил-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов / В.Л. Гейн, В.А. Михалев и др. //Хим.-фармацевт. журн. - 2007. - Т. 41, № 4. - С. 30 - 32.
8. Противовоспалительная активность производных 1-(2-метоксиэтил)-5-арил-4-ацил-3-гидрокси-3-пирролин-2-онов /В.А. Михалев, В.Л. Гейн, В.В. Юшков, К.В. Яценко, М.И. Вахрин //Материалы 62-й региональной конф. Разработка, исследование и маркетинг новой фармацевтической продукции ГОУ ВПО Пятигорской фармацевтической академии, Выпуск 62, Пятигорск, – 2007- С. 509 - 510.
9. Противовоспалительная активность 3-R-4-ароил-5-алкоксиалкил-4,6-дигидропирроло[3,4-С]пиразин-6-онов / В.А. Михалев, И.А. Замараев, В.Л. Гейн, Л.Н. Маркова, Б.Я. Сыропятов, Е.Б. Бабушкина, М.И. Вахрин // XIV Российский национальный конгресс “ Человек и лекарство”.: [Тез. докл.]. - Москва, 2007. – С. 306.
10. Синтез и биологическая активность 5-арил-4-ацил-1-(2-метоксиэтил)-пиррол-2,3-дионов и их производных / В.Л. Гейн, В.А. Михалев, В.В. Юшков, К.В. Яценко, М.И. Вахрин, Е.Б. Бабушкина // Науч.-практ. журн. Вестник ПГФА № 2, Пермь 2007 - С. 34 - 36.
11..Яценко, К.В. Противовоспалительная активность производных пиррол-2,3-дионов / К.В. Яценко, В.А. Михалев // Психо фармакология и биологическая наркология журн.-III Съезд фармакологов России. Фармакология - практическому здравоохранению. : [Тез.докл.]. - СПб., -Т. 7, 2007. – С. 2025-2026.

