Разработка состава и технологии профилактических средств с антисептиками гуанидинового ряда
На правах рукописи
Беляцкая Анастасия Владимировна
РАЗРАБОТКА СОСТАВА И ТЕХНОЛОГИИ ПРОФИЛАКТИЧЕСКИХ СРЕДСТВ С АНТИСЕПТИКАМИ ГУАНИДИНОВОГО РЯДА
15.00.01 – Технология лекарств и организация фармацевтического дела
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата фармацевтических наук
Москва – 2008
Работа выполнена в ГОУ ВПО Московская медицинская академия имени И.М. Сеченова Росздрава.
Научный руководитель:
Доктор фармацевтических наук,
профессор Галина Павловна Матюшина
Официальные оппоненты:
Доктор химических наук,
профессор Юрий Яковлевич Харитонов
Доктор фармацевтических наук Константин Сергеевич Гузев
Ведущая организация: Всероссийский научно-исследовательский институт лекарственных и ароматических растений РАСХН (ВИЛАР РАСХН)
Защита состоится «21» апреля 2008 г. на заседании Диссертационного Совета (Д 208.040.09) при ГОУ ВПО Московская медицинская академия имени И.М. Сеченова Росздрава по адресу: г. Москва, Никитский бульвар, 13
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Московская медицинская академия имени И.М. Сеченова Росздрава (117998 г. Москва, Нахимовский проспект, 49)
Автореферат разослан «___» марта 2008 г.
Ученый секретарь Диссертационного совета
доктор фармацевтических наук,
профессор Наталья Петровна Садчикова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. В связи со значительным распространением грибкового поражения стоп (частота заболеваемости в развитых странах мира колеблется от 3 до 8%), инфекционных заболеваний кожи и увеличением числа полирезистентных штаммов микроорганизмов становится актуальным внедрение в практику новых антисептиков широкого спектра действия в удобной для применения форме в виде лечебно-профилактических препаратов.
Созданные отечественными химиками (Гембицкий П.А. и сотр., 1968-1995гг.) антисептики гуанидинового ряда – фосфат и хлорид полигексаметиленгуанидина (ПГМГф и ПГМГх) – характеризуются широким спектром фунгицидного и бактерицидного действия, безопасностью применения (IV класс опасности при поступлении через кожу), а также низкой трансэпидермальной резорбцией, что позволяет говорить об их высокой медицинской эффективности при малой частоте побочных системных эффектов. Совокупность перечисленных качеств делает их перспективными для применения с целью профилактики и лечения местных инфекций различной этиологии, в том числе и микозов стоп.
В настоящее время существуют антимикотические лекарственные препараты (ЛП) с широким спектром действия для наружного и системного применения в виде различных лекарственных форм (ЛФ): мягких (гели, мази, кремы); жидких (спреи, аэрозоли, растворы); твердых (таблетки, порошки). Твердые лекарственные формы могут использоваться как для внутреннего, так и для наружного применения (приготовление растворов из быстрорастворимых «шипучих» таблеток). Последние – практически не представлены на современном фармацевтическом рынке России. Тем не менее, они являются весьма перспективными, так как представляют собой ЛФ для наружного применения, что позволяет избежать многих побочных эффектов, вызываемых ЛП для системного применения.
Таким образом, разработка составов, технологии изготовления и методов
контроля качества быстрорастворимых гранул и таблеток для приготовления растворов для наружного применения, с целью профилактики и лечения микозов стоп, содержащих в качестве действующего вещества антисептики гуанидинового ряда, представляется весьма перспективной.
Цель и задачи исследования
Экспериментально разработать и научно обосновать составы и технологию изготовления быстрорастворимых гранул и таблеток для приготовления растворов для наружного применения, содержащих антисептики гуанидинового ряда, и эффективных для профилактики и лечения микозов стоп.
Для достижения поставленной цели предстояло решить следующие основные задачи:
1. Изучить бактерицидную и фунгицидную активность ПГМГф и ПГМГх в отношении основных санитарно-показательных коллекционных штаммов: Escherichia coli АТСС 25922, Staphylococcus aureus АТСС 6538-Р; а также в отношении штаммов – возбудителей микозов стоп: Trichophyton mentagrophytes interdigitale, Trichophyton verrucosum, Microsporum canis, Trichophyton gypseum и Candida utilis ЛИА-01. Установить их фунгистатическую, фунгицидную, бактериостатическую и бактерицидную концентрации, способные обеспечить необходимый противогрибковый и антимикробный эффект при соответствующем способе применения.
2. Теоретически и экспериментально обосновать оптимальные по специфической активности и показателям качества составы, предложить технологию изготовления быстрорастворимых гранул и таблеток, содержащих антисептики гуанидинового ряда.
3. Оценить возможность применения существующих методик качественного и количественного анализа полигуанидинов для анализа разработанных лечебно-профилактических препаратов и, при необходимости, модифицировать их.
4. Оценить качество разработанных твердых лекарственных форм по критериям нормативной документации и исследовать их стабильность в процессе длительного хранения.
5. Изучить биологическую безвредность разработанных препаратов в опытах in vivo.
Научная новизна
В результате проведенных исследований с использованием физико-химических методов впервые разработаны и научно обоснованы составы и технология изготовления быстрорастворимых гранул и таблеток, для приготовления растворов для наружного применения, содержащие соли отечественного полигуанидинового антисептика ПГМГ; подобраны вспомогательные вещества (ВВ), обеспечивающие весь комплекс необходимых структурно-механических и медико-биологических свойств ЛФ в соответствии с их терапевтическим действием.
Предложена новая модификация методики количественного определения ПГМГф и ПГМГх в разработанных препаратах. Проведены комплексные исследования по оценке качества разработанных твердых ЛФ и установлена их стабильность при хранении.
Установлено отсутствие общетоксического и местно-раздражающего действия разработанных препаратов.
Практическая значимость
На основании проведенных исследований предложены рецептуры и технология изготовления быстрорастворимых гранул и таблеток, для приготовления растворов для наружного применения, применяемых для профилактики и лечения микозов стоп, содержащих антисептики гуанидинового ряда – ПГМГф и ПГМГх. Подана заявка на изобретение в Роспатент №2008100986 на «Средство для профилактики и лечения микозов стоп (варианты)».
Апробация работы. Основные положения диссертационной работы доложены на заочной международной конференции «Приоритеты фармацевтической науки и практики» (Москва, октябрь 2005 г); X Всероссийской научно-практической конференции «Молодые ученые в медицине» (Казань, апрель 2005 г); XIV Российском национальном конгрессе «Человек и лекарство» (Москва, апрель 2007 г); XII Всероссийской научно-практической конференции с международным участием «Молодые ученые в медицине» (Казань, апрель 2007 г).
Публикации. По теме диссертации опубликовано 8 печатных работ.
Связь задач исследования с проблемным планом фармацевтических наук. Диссертационная работа выполнена в соответствии с комплексной научной темой ГОУ ВПО Московская медицинская академия имени И.М. Сеченова Росздрава «Разработка современных технологий подготовки специалистов с высшим медицинским и фармацевтическим образованием на основе достижений медико-биологических исследований» (№ Государственной регистрации 01.2.00606352).
Основные положения, выносимые на защиту:
- Обоснование выбора концентрации гуанидинового антисептика для разработки быстрорастворимых препаратов для профилактики и лечения микозов стоп.
- Результаты определения содержания солей ПГМГ в разработанных препаратах с использованием модифицированной методики количественного определения.
- Результаты исследований по разработке и научному обоснованию составов и технологии изготовления быстрорастворимых гранул и таблеток для приготовления растворов для наружного применения, содержащих ПГМГф и ПГМГх.
- Результаты исследований, подтверждающие стабильность разработанных препаратов, эффективность и биологическую безвредность.
Объем и структура диссертации. Диссертационная работа изложена на 206 страницах машинописного текста. Состоит из введения, обзора литературы (глава 1), экспериментальной части (главы 2-3), общих выводов, библиографии и приложений. В работе 34 таблицы, 13 рисунков в основном тексте и 48 рисунков в приложениях. Список цитируемой литературы включает в себя 168 источников, из них 52 иностранных.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования.
В качестве основных действующих веществ в работе использованы антисептики гуанидинового ряда: полигексаметиленгуанидина фосфат в виде 70% водного раствора (Фосфопаг, ТУ 9392-010-41547288-2000); ПГМГф в твердом агрегатном состоянии, полученный одним из двух способов: либо путем лиофилизации 70% водного раствора ПГМГф; либо высушиванием при температуре 110±10°С (Фосфопаг, ТУ 9392-010-41547288-2000); а также полигексаметиленгуанидина хлорид (Биопаг, ТУ 9392-008-41547288-00). В качестве вспомогательных веществ использованы: разрыхляющие, газообразующие – винная кислота (ГОСТ 5817-77), лимонная кислота (ФС 42-0008-00), яблочная кислота (ТУ 6-09-4058-75), натрия карбонат безводный (ГОСТ 83-79); связующие – натрий карбоксиметилцеллюлоза (NaКМЦ, ТУ-6-55-39-90), метилцеллюлоза (МЦ, ФС 42-1532-96), поливинилпирролидон-8000±2000 (ПВП, ФСП 42-0345-4368-03), гидроксипропилцеллюлоза (ГПЦ, сертификат Hercules), коллидон VA 64 (сертификат 42-8683-98 BASF, Германия); антифрикционные – глицин (НД-42-12805-03), натрия бензоат (ФС 42-2065-01), аэросил (ГОСТ 14922-77); наполнитель – лактоза (ТУ 9229-128-04610209-2003); растворители – изопропиловый спирт (ТУ 2632-015-11291058-95), этиловый спирт (ГОСТ Р 51652-2000), вода очищенная (ФС 42-2619-97).
Для достижения поставленной цели использовали следующие методы исследования: физико-химические – для определения качественных, количественных и технологических характеристик быстрорастворимых гранул и таблеток; микробиологические – для исследования противогрибковой и антибактериальной активности гуанидиновых антисептиков и разработанных препаратов, их содержащих, испытания на микробиологическую чистоту; биологические – для доказательства безопасности разработанных препаратов.
Выбор концентрации гуанидинового антисептика для введения в состав лечебно-профилактических противогрибковых препаратов
Штаммы, использованные в работе, были получены из коллекций культур: Федерального Государственного Учреждения «Всероссийский государственный Центр качества и стандартизации лекарственных средств для животных и кормов» (ФГУ «ВГНКИ»); испытательного лабораторного центра ФГУН Центрального научно-исследовательского института эпидемиологии (ИЛЦ ФГУН ЦНИИЭ).
Так как ПГМГф и ПГМГх обладают не только фунгистатическим и фунгицидным, но и антибактериальным действием, возможно использование в качестве индикатора чувствительности к ним санитарно-показательных коллекционных штаммов микроорганизмов. Таким образом, была проведена оценка чувствительности Escherichia coli АТСС 25922 и Staphylococcus aureus АТСС 6538-Р к ПГМГф и ПГМГх.
Оценка чувствительности проводилась методом определения минимальной ингибирующей концентрации (МИК) путем разведений образцов ДВ в мясо-пептонном агаре с последующим засеванием испытуемым штаммом (Несвижский Ю.В., Тимофеева М.Ю., 2004).
Установлено, что ПГМГф и ПГМГх проявляют биоэквивалентную бактерицидную активность. Среднее значение МИК24ч, по числу проведенных опытов, для исследуемых образцов по отношению к штаммам Escherichia coli и Staphylococcus aureus составило в массо-объемной концентрации 0,025%.
На следующем этапе исследований проводилось определение минимальной подавляющей и минимально ингибирующей концентраций солей ПГМГ в отношении штаммов – возбудителей микозов стоп: Trichophyton mentagrophytes interdigitale, Trichophyton verrucosum и Microsporum canis. Также фунгицидная активность солей ПГМГ была изучена в отношении штаммов Trichophyton gypseum и Candida utilis ЛИА-01. Осуществлена оценка чувствительности к солям ПГМГ при 5-минутной экспозиции следующих штаммов: Trichophyton mentagrophytes interdigitale, Trichophyton verrucosum, Microsporum canis, Escherichia coli, Staphylococcus aureus.
На основании микробиологических исследований in vitro, с учетом перехода от микробиологических к клиническим концентрациям, для введения в состав быстрорастворимых гранул и таблеток, предназначенных для приготовления растворов с фунгицидным действием, была выбрана концентрация ПГМГф равная 0,4%, а для ПГМГх – 0,5%.
Разработка состава и технологии изготовления гранул, содержащих в качестве действующего вещества соли ПГМГ
Исследования по разработке составов и технологии изготовления шипучих гранул, содержащих в качестве действующего вещества ПГМГф, велись в следующих направлениях:
1). Использование метода влажного гранулирования с раздельным гранулированием кислотного и щелочного компонентов, применяемого для получения стабильных твердых ЛФ, включающих физико-химические несовместимости.
2). Применение метода совместного влажного гранулирования, в котором в качестве связывающих компонентов использовали неводные растворы, а ДВ (70% водный раствор ПГМГф) предварительно высушивали или лиофилизировали.
3) Использование метода влажного совместного гранулирования раствора ДВ и газообразующей смеси.
Гранулы, содержащие ПГМГх, получали методом влажного гранулирования всех компонентов, без введения разрыхляющих газообразующих веществ.
В таблице 1 представлены составы быстрорастворимых гранул, отобранные в ходе скрининга как наиболее соответствующие требованиям ГФ XI к данной ЛФ.
Таблица 1
Отобранные рецептуры гранул, содержащих ПГМГф и ПГМГх в качестве ДВ
| Ингредиент на 100,0 г гранулята | № состава | ||||
| 1-1 | 2-1 | 29-2 | 46-2 | 59 | |
| ПГМГф, г 70% р-р | 36,20 | 36,30 | – | 50,00 | – |
| ПГМГф, г (в готовом грануляте) | 25,30 | 25,40 | 32,40 | – | – |
| ПГМГф, г порошок | – | – | 32,40 | – | – |
| ПГМГх, г порошок | – | – | – | – | 9,70 |
| Винная кислота, г | 41,70 | – | 37,20 | 28,70 | – |
| Лимонная кислота, г | – | 41,70 | – | – | – |
| Натрия карбонат, г | 30,80 | 30,90 | 27,50 | 21,30 | – |
| Гранулирующая жидкость | 10% р-р коллидона | 10% р-р коллидона | 5% р-р коллидона | – | 20% р-р коллидона |
| Объем ГЖ, мл | 16,20/5,80 | 16,20/3,80 | 58,00 | – | 15,00 |
| Коллидон, г | 1,62/0,58 | 1,62/0,38 | 2,90 | – | 3,00 |
| Лактоза, г | – | – | – | – | 87,30 |
Оценка качества разработанных составов лекарственной формы гранулы проводилась по следующим показателям: внешний вид, качественное и количественное содержание ДВ, определение гранулометрического (фракционного) состава, насыпной массы, сыпучести, угла естественного откоса, влажности, распадаемости, значения рН водного раствора, испытание на микробиологическую чистоту, контроль антимикробной и противогрибковой активности.
Качественное обнаружение соединений, производных полигуанидина, основано на их взаимодействии с реактивом на гуанидиновую группу с образованием соединения, окрашенного в розовый цвет (Давлетшина Р.Я., 1995). Также для подтверждения присутствия солей ПГМГ в разработанных препаратах применяли метод ТСХ анализа. Система растворителей: бутанол:уксусная кислота:вода очищенная в соотношении 25:9:4, объем наносимых проб 10 мкл, пластинки «Силуфол» (Абрикосова Ю.Е., 2005).
Определение количественного содержания ДВ проводилось на основе явления гашения флуоресценции при титровании раствора комплекса ДНК с ионом этидия растворами ПГМГф и ПГМГх (Pjura P.E., Grzeskowiuk K., Dickerson R.E., 1987). Спектры флуоресценции получали на спектрофлуориметре Cary-Eclipse фирмы Varian (США). Содержание солей ПГМГ в образцах гранулятов составляло 100±5%, где за 100% принимали количество ПГМГф/ПГМГх в растворах, использованных для построения калибровочных графиков (концентрация 1 г/л).
В таблице 2 представлены основные технологические характеристики разработанных составов гранул.
Таблица 2
Показатели качества разработанных составов гранул, не подвергавшихся хранению
| Показатели | Номер состава | ||||||||||
| 1-1 | 2-1 | 29-2 | 46-2 | 59 | |||||||
| Описание | Гранулы белого цвета | Гранулы белого цвета | Гранулы белого цвета | Гранулы белого цвета | Гранулы белого цвета | ||||||
| Подлинность | Взаимодействие с реактивом на гуанидиновую группу с образованием соединения, окрашенного в розовый цвет; ТСХ - соответствие свидетелю | ||||||||||
| Содержание ДВ с±с, г/л | 4,0318±0,1264 | 3,8716±0,1420 | 4,0484± 0,1980 | 3,9276± 0,1583 | 4,8865± 0,2241 | ||||||
| с±с, % | 100,79±3,14 | 96,79±3,62 | 101,20±4,84 | 98,19±4,03 | 97,73±4,16 | ||||||
| Насыпная масса, г/см2 (Хср±Х, n=6) | 0,61±0,06* | 0,72±0,04** | 0,56±0,05* | 0,50±0,02 | 0,51±0,03 | 0,50±0,02 | |||||
| 0,68±0,02 | 0,65±0,04 | ||||||||||
| Сыпучесть, г/с (Хср±Х, n=6) | 14,27±0,61* | 14,65±0,43** | 10,68±0,17* | 10,24±0,09 | 10,42±0,17 | 10,75±0,43 | |||||
| 14,04±0,54 | 12,31±0,32 | ||||||||||
| Угол естеств. откоса,° (Хср±Х, n=6) | 27±2* | 27±4* | 29±3* | 32±2 | 29±3 | 33±1 | |||||
| 28±5 | 31±1 | ||||||||||
| Остаточная влажность, % (Хср±Х, n=6) | 0,52±0,13 | 1,84±0,19 | 0,79±0,19 | 1,40±0,20 | 1,50±0,25 | 2,00±0,70 | |||||
| 2,40±0,24 | 2,30±0,26 | ||||||||||
| Распадаемость, с (tср±t, n=6) | 93±7 | 89±6 | 32±2 | 39±2 | менее 15 мин | ||||||
| рН (Хср±Х, n=6) | 5,6±0,1 | 5,5±0,2 | 5,6±0,1 | 5,7±0,1 | 6,9±0,2 | ||||||
Примечание: * – кислотная компонента гранулята; ** – щелочная компонента гранулята.
Как видно, из данных приведенных в таблице 2, анализируемые составы обладают хорошими реологическими свойствами, высокими показателями насыпной массы. Несмотря на широкий интервал значений, все образцы разработанных составов обладали высокой сыпучестью, минимум в два раза превышающей требуемые значения (не менее 4-5 г/с). Угол естественного откоса также охарактеризовал исследуемые составы как хорошо сыпучие, так как его значения для всех образцов находились в интервале 25-34.
Распадаемость для составов 1-1, 2-1, 29-2 и 46-2 составила менее 5 минут, что считается удовлетворительным для быстрорастворимых («шипучих») гранулятов и таблеток (European pharmacopoeia, 5 edition). Распадаемость состава 59 составила менее 15 минут (ГФ XI, вып.2).
Измерение рН растворов, образуемых при растворении образцов составов 1-1, 2-1, 29-2 и 46-2 показало, что данный показатель близок к рН кожного покрова человека и, следовательно, растворы не должны обладать местно раздражающим действием.
Разработанные составы гранул соответствовали требованиям ГФ XI по статье «Испытание на микробиологическую чистоту» и Изменению №3 «Методы микробиологического контроля ЛС» от 19.06.2003 г (Изм. №3). Растворы гранул с концентрацией ДВ 0,4% (ПГМГф) и 0,5% (ПГМГх) полностью подавляли рост следующих микроорганизмов: Escherichia coli АТСС 25922, Staphylococcus aureus АТСС 6538-Р, Trichophyton mentagrophytes interdigitale, Trichophyton verrucosum и Microsporum canis.
Таким образом, на основании проведенных исследований можно сделать вывод о том, что основные качественные, количественные и технологические характеристики гранулятов составов 1-1, 2-1, 29-2 и 46-2 и 59 удовлетворяют предъявляемым к ЛФ «Гранулы» требованиям.
С целью установления стабильности образцы составов гранул были заложены на хранение. С этой целью образцы составов гранул хранили в полимерных банках с навинчивающимися крышками: одну часть наработанных составов гранул хранили в сухом, защищенном от света месте при температуре 15-25°С, а другую в термостате при температуре 40±1°С. В день изготовления и в процессе хранения (через каждые 6 месяцев при хранении в естественных условиях, через каждые 46 суток при хранении по методу ускоренного старения) образцы гранул анализировали по следующим показателям: внешний вид, подлинность, количественное содержание ДВ, определение фракционного состава, насыпной массы, сыпучести, угла естественного откоса, остаточной влажности, распадаемости и значения рН. Анализ полученных данных свидетельствуют о стабильности изучаемых образцов как в процессе естественного хранения (в течение 2 лет), так и методом ускоренного старения (в течение срока эквивалентного 2 годам хранения в естественных условиях). Основные технологические характеристики гранул, а также распадаемость и значение рН образуемых растворов практически не изменяются. Гранулы характеризуются постоянством качественного и количественного содержания действующего вещества в течение всего срока хранения. Образцы гранул, хранившиеся по методу ускоренного старения и в естественных условиях в течение 2 лет, соответствуют требованиям статьи ГФ XI «Испытание на микробиологическую чистоту» и Изм. №3, сохраняют антимикробную и противогрибковую активность.
Полученные данные позволяют рекомендовать срок хранения составов 1-1, 2-1, 29-2, 46-2 и 59, расфасованных в полимерные банки, в сухом, защищенном от света месте при температуре 15-25°С в течение 2 лет (срок наблюдения).
Разработка состава и технологии изготовления быстрорастворимых таблеток, содержащих ПГМГф
На основе разработанных составов и технологии получения быстрорастворимых гранул, содержащих в качестве ДВ ПГМГф, была проведена оценка возможности прессования гранулятов, с целью получения ЛФ таблетки. В состав образцов вводили смазывающие ВВ, обладающие гидрофобными и гидрофильными свойствами: аэросил, кислоту стеариновую, натрия бензоат и глицин в количестве 1-4% от общей массы гранулята.
На основании полученных экспериментальных данных нами для таблетирования была отобрана рецептура состава 29-2, представленная в таблице 3.
Таблица 3
Рецептура состава, отобранного для таблетирования, содержащего ПГМГф в качестве ДВ
| Ингредиент | 29-2 | ||
| На 1 таблетку | На 100,0 г | ||
| мг | % | ||
| ПГМГф (лиофилизированный) | 477 | 31,8 | 31,8 |
| Винная кислота | 546 | 36,4 | 36,4 |
| Натрия карбонат | 405 | 27,0 | 27,0 |
| Коллидон | 42 | 2,8 | 2,8 |
| Натрия бензоат | 30 | 2,0 | 2,0 |
С целью выявления оптимальной для таблетирования величины влагосодержания гранулята, было проведено изучение зависимости механической прочности на сжатие и времени распадаемости таблеток от остаточной влажности разработанных составов. На рис. 1 и 2 приведены зависимости механической прочности и распадаемости таблеток от остаточной влажности гранулята.
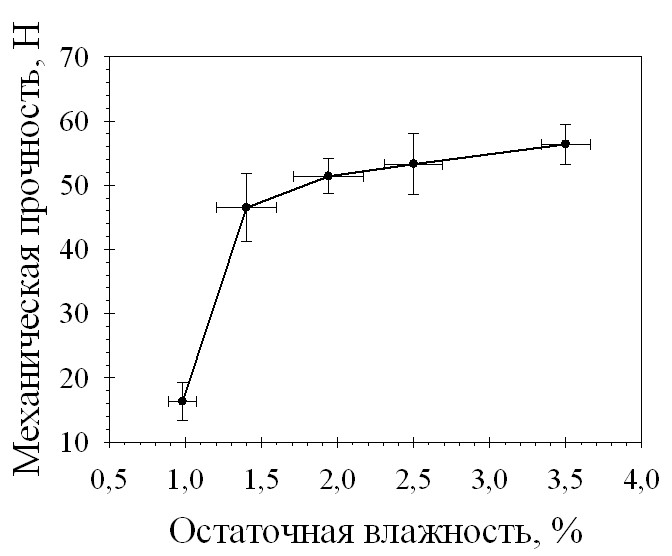
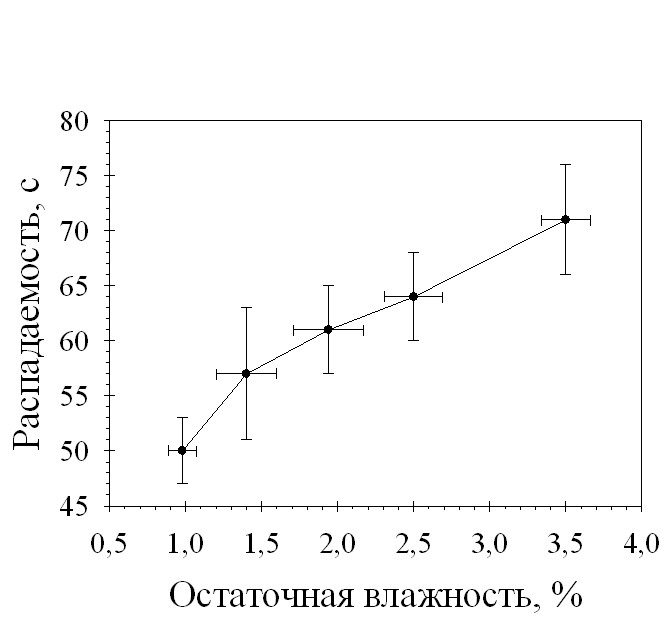
Рис. 1. Зависимость механической прочности на сжатие таблеток состава 29-2 от остаточной влажности гранулята
Рис. 2. Зависимость распадаемости таблеток состава 29-2 от остаточной влажности гранулята
Проведенные исследования показали, что распадаемость разработанных составов таблеток напрямую зависит от остаточной влажности гранулята, но на протяжении всего интервала исследуемых давлений прессования не превышает 5 минут. Механическая прочность таблеток возрастает при увеличении остаточной влажности, при значении влажности гранулята менее 1% таблетки обладают очень низкой (менее 20Н) механической прочностью. Оптимальная для таблетирования гранулята состава 29-2 влажность
составила 1,2-1,6%.
С целью выявления оптимального режима таблетирования было проведено изучение зависимости основных характеристик таблеток от величины прилагаемого давления прессования (рис. 3 и 4). При увеличении давления прессования увеличивается механическая прочность на сжатие и распадаемость. При любом значении давления прессования время распадаемости не превышало 5 минут, прочные таблетки получаются при давлении прессования выше 150 МПа. Таким образом, оптимальный диапазон давления прессования для разработанного состава таблеток составляет 150-240 МПа.
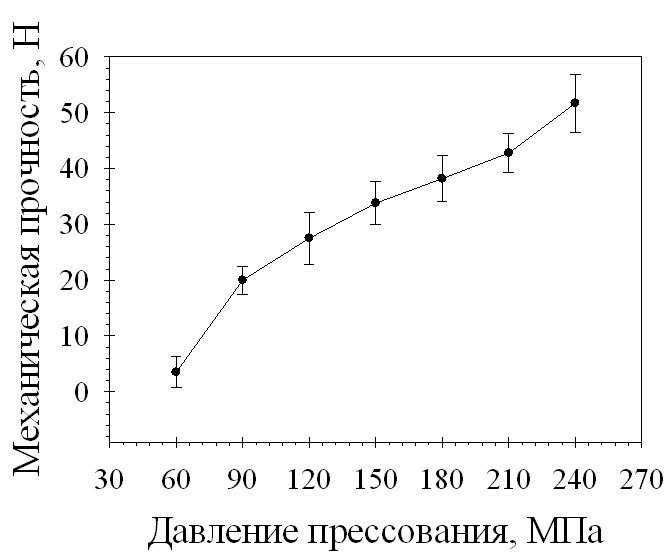
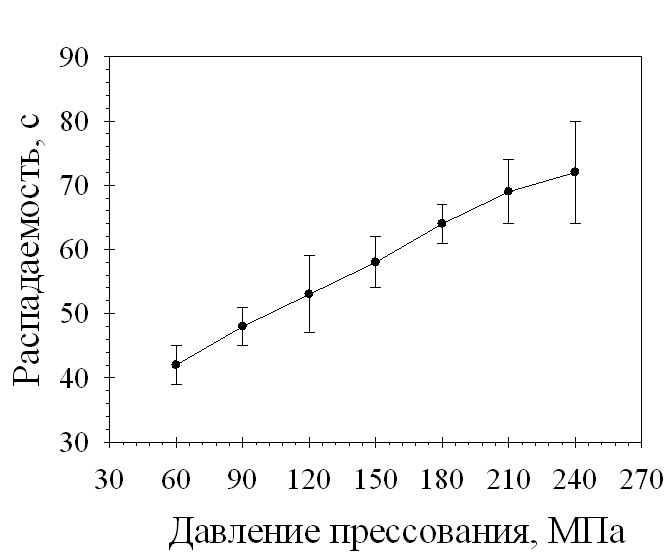
Рис. 3. Зависимость механической прочности на сжатие таблеток состава 29-2 от давления прессования
Рис. 4. Зависимость распадаемости таблеток состава 29-2 от давления прессования
Технология выбранного нами метода влажного гранулирования (рис. 5) позволила получить однородный гранулят с хорошей сыпучестью, прессуемостью и высокой насыпной массой.
Доброкачественность таблеток оценивали на основании качественных и количественных характеристик. Оценка качества полученных таблеток проводилась по следующим показателям: внешний вид, качественное и количественное содержание ДВ, отклонение от средней массы, механическая прочность, истираемость, распадаемость, значение рН водного раствора, микробиологическая чистота, контроль антимикробной и противогрибковой активности (данные представлены в таблицах 4, 5).
Рис. 5. Технологическая схема изготовления гранул и таблеток состава 29-2 с использованием метода влажного гранулирования
Таблица 4
Результаты анализа таблеток состава 29-2, полученных методом влажного гранулирования, при выпуске
| Показатели | № серии | ||
| 01 | 02 | 03 | |
| Описание | Таблетки белого цвета | ||
| Подлинность | Соответствует | ||
| Средняя масса (от 1,425 до 1,575 г) | 1,498 | 1,504 | 1,502 |
| Отклонение от средней массы (1,5±5%) | Соответствует | ||
| Содержание ДВ с±с, % | 100,53±4,84 | 100,21±3,98 | 99,76±4,23 |
| Содержание ДВ с±с, г/л | 4,0212±0,1960 | 4,0084±0,1595 | 3,9904±0,1688 |
| Механическая прочность на сжатие, Н (Хср±Х, n=6) | 46,5±3,2 | 44,3±2,1 | 47,1±3,9 |
| Коэфф. пресс., г/см (Кпр.ср. ± Кпр, n=6) | 2,01±0,04 | 1,98±0,05 | 2,02±0,06 |
| Истираемость, % (Хср±Х, n=6) | 99,5±0,1 | 99,4±0,2 | 99,5±0,2 |
| Остаточная влажность, % (Хср±Х, n=6) | 1,40±0,09 | 1,40±0,10 | 1,38±0,13 |
| Распадаемость, с (tср±t, n=6) | 116±6 | 121±7 | 112±5 |
| рН Хср±Х, n=6 | 5,5±0,1 | 5,6±0,2 | 5,5±0,1 |
Примечание: * – взаимодействие с реактивом на гуанидиновую группу с образованием соединения, окрашенного в розовый цвет; ТСХ – соответствие свидетелю
Таблица 5
Показатели качества таблеток состава 29-2, полученных методом влажного гранулирования, при хранении в естественных условиях в течение 1 года и при хранении по методу ускоренного старения (при температуре 40±1°С)
| № серии | Срок хранения, год | Описание | Подлинность* | Средняя масса от 1,425 до 1,575 г | Отклонение от средней массы 1,5±5% | Содержание ДВ с±с, % | Содержание ДВ с±с, г/л | Механическая прочность на сжатие, Н (Хср±Х, n=6) | Истираемость, % (Хср±Х, n=6) | Остаточная влажность, % (Хср±Х, n=6) | Распадаемость, с (tср±t, n=6) | рН Хср±Х, n=6 |
| Хранение в течение 1 года в естественны условиях | ||||||||||||
| 01 | 0 | Таблетки белого цвета | Соотв. | 1,498 | Соотв. | 100,53±4,87 | 4,0212±0,1960 | 46,5±3,2 | 99,5±0,1 | 1,40±0,09 | 116±6 | 5,5±0,1 |
| 0,5 | // | 1,497 | // | 99,73±4,26 | 3,9892±0,1699 | 51,2±4,1 | 99,7±0,1 | 1,38±0,10 | 125±8 | 5,5±0,2 | ||
| 1,0 | // | 1,496 | // | 100,37±4,63 | 4,0148±0,1859 | 44,2±2,9 | 99,5±0,2 | 1,44±0,12 | 122±6 | 5,5±0,1 | ||
| 02 | 0 | Таблетки белого цвета | Соотв. | 1,504 | Соотв. | 100,21±3,98 | 4,0084±0,1595 | 44,3±2,1 | 99,4±0,2 | 1,40±0,10 | 121±7 | 5,6±0,2 |
| 0,5 | // | 1,501 | // | 100,49±4,53 | 4,0196±0,1821 | 46,3±2,9 | 99,6±0,3 | 1,37±0,05 | 118±5 | 5,5±0,1 | ||
| 1,0 | // | 1,500 | // | 100,34±4,71 | 4,0136±0,1890 | 45,7±3,4 | 99,8±0,1 | 1,36±0,06 | 120±4 | 5,5±0,1 | ||
| 03 | 0 | Таблетки белого цвета | Соотв. | 1,502 | Соотв. | 99,76±4,23 | 3,9904±0,1688 | 47,1±3,9 | 99,7±0,2 | 1,38±0,13 | 112±5 | 5,5±0,1 |
| 0,5 | // | 1,500 | // | 100,22±4,60 | 4,0088±0,1844 | 50,2±3,0 | 99,6±0,2 | 1,38±0,10 | 119±7 | 5,5±0,1 | ||
| 1,0 | // | 1,506 | // | 99,84±3,88 | 3,9936±0,1550 | 47,3±3,5 | 99,8±0,3 | 1,42±0,11 | 118±7 | 5,6±0,2 | ||
| Хранение по методу ускоренного старения (при температуре 40±1°С) | ||||||||||||
| 01 | 0 | Таблетки белого цвета | Соотв. | 1,498 | Соотв. | 100,53±4,84 | 4,0212±0,1960 | 46,5±3,2 | 99,5±0,1 | 1,40±0,09 | 116±6 | 5,5±0,1 |
| 0,5 | // | 1,497 | // | 99,87±4,37 | 3,9948±0,1746 | 45,2±2,9 | 99,6±0,1 | 1,42±0,10 | 118±5 | 5,5±0,1 | ||
| 1,0 | // | 1,498 | // | 100,24±3,82 | 4,0096±0,1532 | 47,4±3,4 | 99,5±0,2 | 1,40±0,09 | 113±6 | 5,5±0,2 | ||
| 1,5 | // | 1,498 | // | 100,12±4,78 | 4,0048±0,1914 | 46,5±4,1 | 99,5±0,1 | 1,40±0,12 | 121±6 | 5,4±0,1 | ||
| 2,0 | // | 1,497 | // | 99,27±3,95 | 3,9708±0. 1568 | 45,8±3,6 | 99,6±0,2 | 1,41±0,07 | 119±5 | 5,5±0,1 | ||
| 02 | 0 | Таблетки белого цвета | Соотв. | 1,504 | Соотв. | 100,21±3,98 | 4,0084±0,1595 | 44,3±2,1 | 99,4±0,2 | 1,40±0,10 | 121±7 | 5,6±0,2 |
| 0,5 | // | 1,502 | // | 100,06±4,03 | 4,0024±0,1613 | 44,6±3,2 | 99,4±0,1 | 1,40±0,13 | 127±5 | 5,5±0,1 | ||
| 1,0 | // | 1,502 | // | 100,44±4,37 | 4,0176±0,1756 | 43,4±3,0 | 99,3±0,3 | 1,40±0,10 | 122±6 | 5,6±0,2 | ||
| 1,5 | // | 1,503 | // | 100,32±4,56 | 4,0128±0,1830 | 45,1±2,4 | 99,5±0,2 | 1,42±0,09 | 125±5 | 5,4±0,2 | ||
| 2,0 | // | 1,502 | // | 100,41±4,62 | 4,0164±0,1856 | 44,0±3,5 | 99,2±0,3 | 1,43±0,12 | 125±7 | 5,5±0,1 | ||
| 03 | 0 | Таблетки белого цвета | Соотв. | 1,502 | Соотв. | 99,76±4,23 | 3,9904±0,1688 | 47,1±3,9 | 99,5±0,2 | 1,38±0,13 | 112±5 | 5,5±0,1 |
| 0,5 | // | 1,502 | // | 99,47±4,58 | 3,9788±0,1822 | 46,7±3,1 | 99,7±0,2 | 1,37±0,07 | 131±6 | 5,4±0,2 | ||
| 1,0 | // | 1,501 | // | 99,72±3,71 | 3,9888±0,1480 | 47,1±2,5 | 99,4±0,2 | 1,38±0,12 | 123±4 | 5,4±0,1 | ||
| 1,5 | // | 1,502 | // | 99,89±4,82 | 3,9956±0,1926 | 47,3±1,8 | 99,4±0,1 | 1,40±0,13 | 120±7 | 5,5±0,3 | ||
| 2,0 | // | 1,502 | // | 99,58±4,39 | 3,9832±0,1748 | 47,7±2,4 | 99,6±0,3 | 1,38±0,10 | 118±4 | 5,5±0,2 | ||
Анализ технологических характеристик, полученных при хранении быстрорастворимых таблеток по методу ускоренного старения (при температуре 40±1°С в течение 182 суток), показал, что таблетки состава 29-2 выдерживают хранение в течение двух лет. Срок наблюдения за таблетками, хранившимися в естественных условиях, составил 1 год. Таблетки характеризуются постоянством: основных технологических характеристик, качественного и количественного содержания действующего вещества в течение всего срока хранения (таблица 5), а также соответствуют требованиям ГФ XI «Испытание на микробиологическую чистоту» и Изм. №3, сохраняют фунгицидное и бактерицидное действие. Полученные данные позволяют рекомендовать срок хранения таблеток состава 29-2, расфасованных в полимерные банки, в сухом, защищенном от света месте при температуре 15-25°С в течение 1 года (срок наблюдения).
Изучение безвредности растворов, получаемых путем растворения разработанных составов гранул и таблеток
С целью выявления потенциальной опасности вредного воздействия разработанных препаратов на макроорганизм было проведено изучение in vivo биологической безвредности составов, путем определения острой (при однократном пероральном введении и накожном нанесении) и хронической токсичности (при 30 дневном накожном нанесении). Изучали биологическую безвредность растворов, получаемых путем растворения отобранных образцов быстрорастворимых гранул и таблеток, содержащих в качестве действующего вещества ПГМГф, следующего состава (таблица 6):
Таблица 6
Состав испытуемых на безвредность гранул и таблеток, содержащих ПГМГф
| Ингредиент | 2-1 | 29-2 | Нормативная документация | ||
| На 5,0 г гранулята | На 100,0 г | На таблетку массой 1,5 г | На 100,0 г | ||
| 1 | 2 | 3 | 4 | 5 | 6 |
| ПГМГф (лиофилизированный) | - | - | 0,48 | 31,80 | ТУ 9392-010-41547288-2000 |
| ПГМГф | 1,27 | 25,40 | - | - | –//– |
| Винная кислота | - | - | 0,55 | 36,40 | ГОСТ 5817-77 |
| Лимонная кислота | 2,08 | 41,73 | - | - | ФС 42-0008-00 |
| 1 | 2 | 3 | 4 | 5 | 6 |
| Карбонат натрия | 1,55 | 30,84 | 0,40 | 27,00 | ГОСТ 83-79 |
| Коллидон | 0,10 | 2,03 | 0,04 | 2,80 | сер-кат 42-8683-98 BASF |
| Бензоат натрия | - | - | 0,03 | 2,00 | ФС 42-2065-01 |
Изучение острой токсичности растворов гранул и таблеток, содержащих ПГМГф
Исследование проводили на базе отдела фармакологии и токсикологии Всероссийского научно-исследовательского института патологии, фармакологии и терапии Российской академии сельскохозяйственных наук (ВНИВИПФиТ РАСХН); в опытах были использованы половозрелые конвенциональные нелинейные разнополые белые мыши с массой тела 19-21 г (252 головы) и белые крысы с массой тела 190-210 г (252 головы).
Острая токсичность препаратов испытана при пероральном способе введения: растворов препаратов, приведенных в таблице 6; растворов ВВ входящих в растворы вышеуказанных препаратов; раствора ПГМГф (100 мг/кг); раствора ПГМГх (125 мг/кг). Препараты вводили однократно внутрижелудочно в дозах от 5000,0 до 50000,0 мг/кг массы тела в объеме 0,5 мл на мышь и 5,0 мл на крысу. На протяжении 14 дней наблюдения за животными, случаев гибели отмечено не было. Патоморфологическое изучение по окончании эксперимента не выявило нарушений в структурной организации внутренних органов, как у белых мышей, так и у белых крыс. Среднелетальную дозу – LD50 изучаемых препаратов при пероральном введении определить не удалось, так как при введении препарата в максимально возможных дозах 50000,0 мг/кг – белым мышам и белым крысам, не отмечалось гибели животных. Таким образом, препараты по степени токсичности можно отнести к IV классу опасности – малоопасные вещества (ГОСТ 12.1.007-76).
Также изучали острую токсичность препаратов при наружном применении. Установлено, что препараты не оказывают общетоксического действия и не вызывают гибели животных. Водные растворы препаратов, содержащие ПГМГф в концентрации 0,4%, не обладают острым токсическим действием при однократном внутрижелудочном (на организм мышей и крыс) и наружном (на организм крыс) введении; вспомогательные вещества в составе исследованных препаратов не усиливают токсичность ПГМГф при однократном внутрижелудочном и наружном применении.
Изучение хронической токсичности растворов гранул и таблеток, содержащих ПГМГф
Изучение хронической токсичности проводили на 42 белых крысах-самцах с массой тела 165-185 г и на 42 белых крысах-самках с массой тела 150-170 г при нанесении препаратов на кожу в течение 30 дней. Препараты наносили ежедневно один раз в день в течение 30 суток. Объем препарата 5,0 мл (на марлевой салфетке); площадь нанесения 20 см2; плотность нанесения препарата 0,25 мл/см2; продолжительность обработки 5 минут; доза ПГМГф в испытуемых препаратах составляла 1 мг/см2.
Экспериментальные группы животных различались по составу апплицируемых рецептур следующим образом: группа 1 – водный раствор гранул состава 2-1; группа 2 – водный раствор ВВ состава 2-1; группа 3 – водный раствор таблеток состава 29-2; группа 4 – водный раствор ВВ состава 29-2; группа 5 – водный раствор ПГМГф в дозе 1,0 мг/см2; группа 6 – водный раствор ПГМГх в дозе 1,25 мг/см2.
При изучении хронической токсичности в опытных и контрольной группах на протяжении всего эксперимента случаев гибели белых крыс не зарегистрировано. Клинические показатели состояния подопытных животных соответствовали показателям животных контрольной группы.
Препарат не вызывал изменений в поведенческих реакциях, реакции на внешние раздражители, а также нарушений в двигательной активности животных.
Динамика массы тела подопытных животных не отличалась от таковой у контрольных (таблица 7). В течение всего хронического эксперимента не было отмечено раздражающего действия изучаемых препаратов, содержащих ПГМГф, на кожу крыс. При ежедневном визуальном осмотре отсутствовали: шелушение, гиперемия, отек, изъязвление.
Таблица 7
Влияние хронического введения препаратов на динамику массы тела у крыс
| Группа животных | Кол-во животных | Время от начала эксперимента (дни) | |||
| Исходная | 10 | 20 | 30 | ||
| Масса тела животных, mср±m, г | |||||
| Самцы | |||||
| Контроль | 6 | 175,6±5,4 | 183,4±4,1 | 194,6±6,3 | 213,8±5,4 |
| №1 | 6 | 178,2±6,1 | 186,1±9,5 | 197,3±6,8 | 216,2±8,4 |
| №2 | 6 | 176,8±5,5 | 185,2±7,2 | 197,3±9,0 | 213,2±14,3 |
| №3 | 6 | 171,9±4,8 | 180,1±5,2 | 190,5±4,7 | 210,9±5,3 |
| №4 | 6 | 174,7±4,3 | 182,4±3,9 | 193,2±7,1 | 213,3±10,4 |
| №5 | 6 | 173,6±4,2 | 181,2±8,1 | 192,6±7,5 | 205,2±6,3 |
| №6 | 6 | 174,9±6,1 | 183,1±6,8 | 193,4±8,4 | 209,4±10,9 |
| Самки | |||||
| Контроль | 6 | 166,7±5,9 | 176,4±5,9 | 196,4±8,3 | 235,1±9,7 |
| №1 | 6 | 160,7±7,3 | 170,1±6,8 | 191,2±6,5 | 232,9±9,6 |
| №2 | 6 | 165,9±5,6 | 174,9±6,0 | 200,5±9,5 | 238,9±15,1 |
| №3 | 6 | 164,8±4,2 | 175,3±8,1 | 198,0±7,6 | 230,7±6,8 |
| №4 | 6 | 161,9±4,8 | 170,8±7,7 | 195,7±9,3 | 234,1±11,7 |
| №5 | 6 | 162,8±7,2 | 171,5±9,7 | 194,6±9,0 | 234,8±9,0 |
| №6 | 6 | 168,6±4,3 | 177,1±7,5 | 201,1±7,8 | 233,5±14,6 |
Результаты исследований, представленные в таблице 8, свидетельствуют, что 30-дневное применение препаратов в испытанных дозах у крыс не вызывает изменений относительной массы внутренних органов – тимуса, селезенки, печени, почек, надпочечников, сердца, легких, семенников по сравнению с контрольными животными.
Таблица 8
Весовые коэффициенты внутренних органов крыс после 30-дневного применения препаратов
| Органы | Группа животных | ||||||
| Контроль | №1 | №2 | №3 | №4 | №5 | №6 | |
| Самцы крыс (в каждой группе n=6) | |||||||
| Тимус | 0,72±0,05 | 0,78±0,30 | 0,70±0,11 | 0,71±0,05 | 0,78±0,16 | 0,77±0,21 | 0,70±0,09 |
| Селезенка | 4,44±0,31 | 3,73±0,25 | 4,24±0,55 | 3,87±0,28 | 3,77±0,09 | 3,92±0,24 | 3,83±0,27 |
| Печень | 29,78±2,15 | 31,00±0,62 | 30,02±0,76 | 29,28±0,27 | 30,91±0,36 | 29,05±0,98 | 30,96±1,71 |
| Почки | 5,40±0,26 | 5,88±0,36 | 5,67±0,24 | 5,75±0,10 | 5,69±0,25 | 5,71±0,04 | 5,91±0,19 |
| Надпочечники | 0,20±0,014 | 0,20±0,02 | 0,21±0,02 | 0,20±0,02 | 0,21±0,03 | 0,20±0,015 | 0,20±0,04 |
| Сердце | 3,19±0,07 | 3,54±0,19 | 3,38±0,35 | 3,29±0,08 | 3,44±0,13 | 3,30±0,01 | 3,58±0,15 |
| Легкие | 5,56±0,18 | 5,27±0,43 | 5,77±0,34 | 5,23±0,03 | 5,49±0,03 | 5,52±0,08 | 5,21±0,27 |
| Семенники | 12,87±0,24 | 12,19±0,28 | 12,03±0,08 | 12,36±0,71 | 12,06±0,10 | 12,56±0,33 | 12,04±0,50 |
| Самки крыс (в каждой группе n=6) | |||||||
| Тимус | 1,01±0,04 | 1,10±0,16 | 1,17±0,12 | 1,22±0,13 | 1,05±0,08 | 1,14±0,11 | 1,13±0,10 |
| Селезенка | 4,00±0,33 | 3,80±0,17 | 3,92±0,26 | 3,96±0,10 | 3,83±0,14 | 3,91±0,27 | 3,83±0,23 |
| Печень | 30,11±1,51 | 30,63±1,62 | 29,35±2,74 | 31,11±1,64 | 29,90±1,07 | 29,62±2,38 | 31,07±1,84 |
| Почки | 5,62±0,16 | 5,58±0,27 | 5,46±0,31 | 5,48±0,13 | 5,55±0,21 | 5,35±0,12 | 5,39±0,26 |
| Надпочечники | 0,21±0,02 | 0,20±0,019 | 0,21±0,014 | 0,20±0,004 | 0,20±0,015 | 0,22±0,01 | 0,20±0,011 |
| Сердце | 3,55±0,15 | 3,94±0,20 | 3,13±0,12 | 3,48±0,18 | 3,78±0,13 | 3,30±0,25 | 3,32±0,17 |
| Легкие | 5,28±0,15 | 4,91±0,36 | 5,54±0,31 | 5,32±0,32 | 5,11±0,28 | 5,33±0,06 | 5,29±0,23 |
Препараты не оказывают влияние на гематологические показатели животных (таблица 9).
Таблица 9
Влияние хронического введения препаратов на гематологические показатели крыс
| Показатели | Контроль | Группа животных | |||||
| №1 | №2 | №3 | №4 | №5 | №6 | ||
| Крысы-самцы | |||||||
| Эритроциты,1012/л | 8,4±0,4 | 8,4±0,3 | 8,5±0,3 | 8,4±0,2 | 8,1±0,2 | 8,4±0,4 | 8,2±0,3 |
| Лейкоциты, 109/л | 13,4±0,6 | 13,5±1,6 | 13,6±1,8 | 12,9±1,1 | 13,1±1,7 | 11,9±0,9 | 12,5±1,3 |
| Гемоглобин, г/л | 124,1±10,1 | 132,8±4,5 | 131,6±9,1 | 133,1±7,9 | 133,2±4,4 | 133,4±6,7 | 130,1±2,0 |
| Гематокрит, % | 40,5±3,56 | 45,4±3,7 | 42,0±1,61 | 44,1±1,27 | 45,0±5,6 | 42,5±3,17 | 43,7±5,19 |
| Крысы-самки | |||||||
| Эритроциты,1012/л | 8,2±0,7 | 8,3±0,6 | 8,4±0,2 | 8,4±0,5 | 8,2±0,3 | 8,4±0,2 | 8,1±0,4 |
| Лейкоциты, 109/л | 12,9±1,3 | 12,9±0,9 | 13,2±1,1 | 13,0±3,0 | 13,1±2,4 | 12,9±2,8 | 12,3±2,0 |
| Гемоглобин, г/л | 120,7±6,9 | 123,0±8,5 | 121,0±5,0 | 124,4±9,1 | 123,2±6,1 | 123,9±3,4 | 125,0±7,0 |
| Гематокрит, % | 41,1±1,19 | 45,0±3,7 | 43,2±2,36 | 42,6±2,13 | 43,4±2,9 | 43,0±1,47 | 42,1±3,02 |
С целью изучения влияния на функциональное состояние печени, почек и поджелудочной железы крыс при длительном нанесении на их кожу препаратов, содержащих ПГМГф, определяли некоторые биохимические показатели и активность ферментов сыворотки крови. Установлено, что аппликации исследуемых препаратов в течение 30 дней не вызывали изменений уровня общего белка, холестерина, общих липидов, триглицеридов, билирубина, мочевины, глюкозы и креатинина по сравнению с контрольными животными. В условиях хронического эксперимента не зарегистрировано достоверных изменений активности аланинтрансаминазы (АлАТ), аспартаттрансаминазы (АсАТ) и щелочной фосфотазы (ЩФ) у крыс опытных групп по сравнению с контрольными (таблица 10).
Таблица 10
Влияние хронического введения препаратов на биохимические показатели крови крыс
| Показатели | Контроль | Группа животных | |||||
| №1 | №2 | №3 | №4 | №5 | №6 | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Крысы-самцы | |||||||
| АлАТ, мМ/л.час | 0,75±0,09 | 0,69±0,11 | 0,73±0,07 | 0,77±0,10 | 0,71±0,08 | 0,71±0,06 | 0,69±0,06 |
| АсАТ, мМ/л.час | 1,25±0,12 | 1,15±0,02 | 1,19±0,05 | 1,23±0,09 | 1,03±0,04 | 1,16±0,02 | 1,18±0,02 |
| ЩФ, мМ/л.час | 5,00±0,15 | 4,67±0,05 | 4,65±0,06 | 4,67±0,10 | 4,52±0,14 | 4,71±0,10 | 5,12±0,16 |
| Глюкоза, мМ/л | 7,74±0,51 | 7,53±0,48 | 7,60±0,33 | 7,62±0,23 | 7,80±0,17 | 7,94±0,27 | 7,56±0,19 |
| Общ.белок, г/л | 66,04±2,56 | 68,36±3,74 | 66,62±4,50 | 68,94±1,98 | 67,20±2,13 | 69,52±1,87 | 68,94±1,90 |
| Триглицериды, мМ/л | 0,76±0,01 | 0,74±0,03 | 0,80±0,01 | 0,83±0,02 | 0,76±0,02 | 0,77±0,02 | 0,80±0,03 |
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Общ.липиды, г/л | 2,10±0,10 | 1,89±0,06 | 2,11±0,12 | 2,04±0,11 | 1,89±0,06 | 2,06±0,10 | 2,00±0,08 |
| Холестерин,мМ/л | 1,42±0,20 | 1,41±0,12 | 1,43±0,10 | 1,36±0,10 | 1,44±0,14 | 1,48±0,12 | 1,41±0,20 |
| Креатинин,мкМ/л | 47,3±2,5 | 47,0±1,7 | 49,4±2,1 | 48,2±2,9 | 46,7±1,5 | 46,9±1,8 | 47,9±1.5 |
| Мочевина, мМ/л | 3,95±0,60 | 3,96±0,43 | 4,00±0,40 | 3,28±0,25 | 3,62±0,16 | 4,12±0,28 | 4,10±0,26 |
| Билирубин,мкМ/л | 3,25±0,24 | 3,44±0,60 | 3,31±0,23 | 3,25±0,11 | 3,30±0,20 | 3,45±0,22 | 3,50±0,30 |
| Крысы-самки | |||||||
| АЛаТ, мМ/л.час | 0,65±0,05 | 0,68±0,14 | 0,63±0,06 | 0,68±0,11 | 0,60±0,04 | 0,62±0,05 | 0,64±0,03 |
| АСаТ, мМ/л.час | 1,31±0,19 | 1,35±0,07 | 1,28±0,03 | 1,34±0,09 | 1,21±0,07 | 1,34±0,07 | 1,38±0,08 |
| ЩФ, мМ/л.час | 5,32±0,27 | 5,06±0,11 | 5,00±0,10 | 5,12±0,19 | 5,52±0,21 | 4,99±0,15 | 5,10±0,21 |
| Глюкоза, мМ/л | 7,13±0,43 | 7,36±0,61 | 7,09±0,26 | 7,00±0,34 | 7,18±0,29 | 6,92±0,65 | 6,87±0,42 |
| Общ.белок, г/л | 70,1±3,24 | 69,5±5,12 | 71,3±2,71 | 71,5±2,11 | 70,3±4,68 | 72,0±5,62 | 69,0±3,15 |
| Триглицериды, мМ/л | 0,70±0,01 | 0,71±0,01 | 0,76±0,08 | 0,75±0,03 | 0,70±0,06 | 0,72±0,01 | 0,73±0,02 |
| Общ.липиды, г/л | 1,78±0,09 | 1,71±0,02 | 1,90±0,15 | 1,84±0,15 | 1,68±0,03 | 1,96±0,15 | 1,75±0,10 |
| Холестерин, мМ/л | 1,36±0,14 | 1,30±0,15 | 1,30±0,11 | 1,25±0,09 | 1,20±0,11 | 1,38±0,14 | 1,32±0,20 |
| Креатинин,мкМ/л | 40,4±4,1 | 42,9±4,7 | 39,8±1,1 | 46,9±3,1 | 41,5±4,5 | 37,2±3,0 | 41,0±1,7 |
| Мочевина, мМ/л | 4,16±0,51 | 3,94±0,20 | 4,25±0,34 | 4,21±0,16 | 4,00±0,22 | 4,02±0,40 | 3,89±0,31 |
| Билирубин,мкМ/л | 2,92±0,30 | 3,04±0,13 | 2,87±0,16 | 2,90±0,17 | 3,10±0,16 | 2,95±0,11 | 3,11±0,27 |
Таким образом, на основании оценки вегетативного статуса, динамики массы тела, гематологических показателей и состояния системы гемостаза подопытных животных после 30-дневных аппликаций исследуемых препаратов можно сделать следующие выводы: водные растворы препаратов, содержащие ПГМГф в концентрации 0,4%, не обладают хроническим токсическим и местно-раздражающим действием при наружном применении в соответствующей дозировке; введение в состав твердых лекарственных форм вспомогательных веществ (лимонной и винной кислот, натрия карбоната, коллидона, изопропанола, натрия бензоата) не усиливает токсичность ПГМГф при наружном применении.
ОБЩИЕ ВЫВОДЫ
1. Установлены бактериостатическая и бактерицидная концентрации ПГМГф и ПГМГх в отношении основных санитарно-показательных коллекционных штаммов: Escherichia coli АТСС 25922 и Staphylococcus aureus АТСС 6538-Р; а также фунгистатическая и фунгицидная концентрации в отношении штаммов – возбудителей микозов стоп: Trichophyton mentagrophytes interdigitale, Trichophyton verrucosum, Microsporum canis, Trichophyton gypseum и Candida utilis ЛИА-01. Оптимальная концентрация, обеспечивающая необходимый противогрибковый и антимикробный эффект при соответствующем
способе применения, составляет для ПГМГф 0,4%, для ПГМГх 0,5%.
2. Разработаны оптимальные по специфической активности и показателям качества составы шипучих гранул и таблеток, предназначенных для получения растворов для наружного применения. Предложены технологические схемы изготовления быстрорастворимых гранул и таблеток, содержащих антисептики гуанидинового ряда.
3. Экспериментально подтверждена стабильность разработанных составов быстрорастворимых гранул и таблеток в процессе хранения по методу ускоренного старения и в естественных условиях.
4. Для количественного определения солей ПГМГ в растворах, получаемых путем растворения гранул и таблеток, содержащих в качестве ДВ соли ПГМГ, модифицирована методика, основанная на явлении гашения флуоресценции комплекса ДНК с этидий-бромидом при титровании раствором препарата, содержащего гуанидиновый антисептик.
5. В опытах in vivo установлено, что растворы шипучих гранул и таблеток, предназначенные для наружного применения с целью лечения и профилактики микозов стоп, не обладают общетоксическим и местно-раздражающим действием.
По теме диссертации опубликованы следующие работы:
- Беляцкая А.В., Краснюк И.И., Матюшина Г.П., Попков В.А. Разработка и анализ состава гранул на основе полигексаметиленгуанидиновых антисептиков//Тез. Докладов X Всероссийской научно-практической конференции «Молодые ученые в медицине». – Казань, 2005. – С. 199.
- Краснюк И.И., Матюшина Г.П., Беляцкая А.В. Разработка состава, технологии и оценка качества гранул на основе полигексаметиленгуанидиновых антисептиков//Материалы Заочной международной конференции «Приоритеты фармацевтической науки и практики». – М.: Издательство Российского университета дружбы народов, 2006. – С. 205.
- Беляцкая А.В., Краснюк И.И., Матюшина Г.П. Сравнительный анализ бактерицидной, фунгистатической и фунгицидной активности полигексаметиленгуанидина фосфата и полигексаметиленгуанидина хлорида//Сборник научных трудов «Разработка, исследование и маркетинг новой фармацевтической продукции», выпуск 62. – Пятигорск, 2007. – С. 446-447.
- Беляцкая А.В., Краснюк И.И., Матюшина Г.П. Исследование фунгистатической и фунгицидной активности полигексаметиленгуанидина фосфата//XIV-ой Росс. Нац. Конгресс «Человек и лекарство». Тез. докл. – М., 2007. – С. 529.
- Беляцкая А.В., Краснюк И.И., Матюшина Г.П. Исследование фунгистатической и фунгицидной активности полигексаметиленгуанидина хлорида//XIV-ой Росс. Нац. Конгресс «Человек и лекарство». Тез. докл. – М., 2007. – С. 530.
- Беляцкая А.В., Краснюк И.И., Матюшина Г.П. Оценка стабильности состава гранул, содержащего полигексаметиленгуанидина фосфат в качестве действующего вещества, обладающего противогрибковым действием, с помощью метода ИК-спектроскопии//Тез. докладов XII Всероссийской научно-практической конференции «Молодые ученые в медицине». – Казань: «Отечество», 2007. – С. 247.
- Беляцкая А.В., Краснюк И.И., Матюшина Г.П., Селезнев А.С. Изучение фунгистатической, фунгицидной и бактерицидной активности солей полигексаметиленгуанидина//Российский медицинский журнал. – 2007. –№5. – С. 35-38.
- Беляцкая А.В. Особенности технологии изготовления быстрорастворимых (шипучих) гранул и таблеток//Фармация. – 2008. – №3. – С. 21-22.

