Извлечение цветных и редких металлов из отх о дов металлургического производства и нетрадиционных источников сырья с использованием кристаллизационных и сорбционных пр о цессов
На правах рукописи
Черемисина Ольга Владимировна
ИЗВЛЕЧЕНИЕ ЦВЕТНЫХ И РЕДКИХ МЕТАЛЛОВ
ИЗ ОТХОДОВ МЕТАЛЛУРГИЧЕСКОГО ПРОИЗВОДСТВА
И НЕТРАДИЦИОННЫХ ИСТОЧНИКОВ СЫРЬЯ
С ИСПОЛЬЗОВАНИЕМ КРИСТАЛЛИЗАЦИОННЫХ
И СОРБЦИОННЫХ ПРОЦЕССОВ
| Специальность 05.16.02 - | Металлургия черных, цветных и редких металлов |
А в т о р е ф е р а т
диссертации на соискание ученой степени
доктора технических наук
Санкт-Петербург
2010
Работа выполнена в государственном образовательном учреждении высшего профессионального образования Санкт-Петербургском государственном горном институте имени Г.В.Плеханова (техническом университете).
Научный консультант:
доктор химических наук, профессор
Чиркст Дмитрий Эдуардович
Официальные оппоненты:
доктор технических наук, профессор
Петров Георгий Валентинович
доктор технических наук, профессор
Захаров Виктор Иванович
доктор технических наук, профессор
Шнеерсон Яков Михайлович
Ведущее предприятие – ООО «Институт Гипроникель» (г. Санкт-Петербург, Россия)
Защита диссертации состоится « 29 » октября 2010 г. в 14.30 на заседании диссертационного совета Д 212.224.03 при Санкт-Петербургском государственном горном институте имени Г.В.Плеханова (техническом университете) по адресу: 199106, г. Санкт-Петербург, 21-я линия, д.2, ауд. 2203.
С диссертацией можно ознакомиться в библиотеке Санкт-Петербургского государственного горного института.
Автореферат разослан 7 сентября 2010 г.
УЧЕНЫЙ СЕКРЕТАРЬ
диссертационного совета
д-р техн. наук В.Н.БРИЧКИН
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Истощение богатых месторождений редкоземельных и цветных металлов обуславливает вовлечение в промышленное производство все более бедное минеральное сырье и низкоконцентрированные природные и техногенные материалы. Проблемы рационального комплексного использования сырья, перехода на безотходные технологии его переработки, вторичного использования техногенных образований являются крайне актуальными. Переработка низкоконцентрированных природных и техногенных материалов, которыми являются промышленные технологические растворы, сточные воды химических и металлургических производств, почвы и грунты, загрязненные промышленными отходами, требует принципиально нового подхода к созданию эффективных технологий извлечения цветных и редких металлов. Комплексная переработка сырья и материалов имеет большое значение, как с точки зрения экономики, так и с точки зрения защиты окружающей среды. Необходимость рациональной комплексной переработки природных ресурсов диктуется с одной стороны необходимостью их экономного расходования, ограниченными запасами основного минерального сырья, с другой - все увеличивающимися темпами роста объема промышленного производства, сопряженного с загрязнением окружающей среды.
Проблема использования дополнительных источников редкоземельных и цветных металлов не решена в объеме, удовлетворяющем современную промышленность. Почти 82% балансовых запасов редкоземельных металлов (РЗМ) России приходится на содержащие РЗМ апатитовые руды, в том числе более 70% запасов связано с апатит-нефелиновыми рудами месторождений Хибинской группы в Мурманской области, где среднее содержание Ln2O3 не превышает 0,4%. Из добываемых руд редкоземельные элементы не извлекаются, они остаются в хвостах обогащения, складированных в отвалах обогатительных фабрик. Попутное извлечение РЗМ ведется только на Ловозерском лопаритовом месторождении в Мурманской области. Его руды содержат редкоземельные металлы преимущественно цериевой группы. В рудах уникального российского месторождения Томторское, расположенного на северо-западе Республики Саха (Якутия), содержится в среднем от 12,8% (в корах выветривания) до 7,98% (в коренных рудах) РЗМ, в том числе 0,5% триоксида иттрия. Однако месторождение не разрабатывается и находится в нераспределенном фонде недр, так как располагается в районе с суровыми климатическими условиями и неразвитой инфраструктурой.
Из шестнадцати месторождений РЗМ, учитываемых Государственным балансом, к нераспределённому фонду, кроме Томторского, относятся ещё четыре месторождения, в том числе крупные - Селигдарское и Белозиминское. В настоящее время единственный действующий источник сырья редкоземельных металлов – Ловозерский ГОК не может полностью обеспечить потребность страны в редкоземельных продуктах. Суммарная потребность на начало 2011 года составляет 10 12 тыс. тонн в год, которую можно удовлетворить только за счет переработки дополнительных нетрадиционных источников сырья редкоземельных металлов.
Полный технологический цикл современных предприятий металлургической отрасли, разнообразие перерабатываемого сырья, сложность и многостадийность производственных процессов обуславливают большой выход технологических и сточных вод, высокую степень их загрязненности цветными металлами, извлечение которых повышает рентабельность производства в целом.
Исследования по теории и технологии рационального использования нетрадиционного сырья, развитие и совершенствование существующей технологической базы отражены в трудах отечественных и зарубежных ученых: В.М. Сизякова, А.А. Берлина, И.Н. Белоглазова, Д.Э. Чиркста, Н.М. Телякова, Г.И. Дрозда, А.И. Окунева, Я.М. Шнеерсона, И. Пригожина, П. Гленсдорфа и др.
В то же время, изменения в сырьевой базе цветных и редких металлов, увеличение спроса на тяжелые металлы, ужесточение природоохранных мероприятий требуют дальнейшего развития технологии извлечения металлов из нетрадиционных источников сырья и низкоконцентрированных материалов металлургического производства. Разработка новых эффективных технологий рационального использования природных ресурсов и защиты окружающей среды определяет дальнейшее совершенствование теории и практики наукоемких технологий извлечения цветных и редкоземельных металлов из низкоконцентрированных природных и техногенных материалов.
Цель работы.
Разработка сорбционных и кристаллизационных технологий извлечения металлов из низкоконцентрированных природных и техногенных материалов химико-металлургических производств на основе исследований термодинамики и кинетики гетерогенных процессов и повышение эффективности переработки минеральных ресурсов с целью получения соединений РЗМ, очистки грунтов, сточных и природных вод от тяжелых металлов.
Идея работы.
Глубокое извлечение металлов из отходов металлургического производства и нетрадиционных источников сырья целесообразно путем интенсификации процесса массовой кристаллизации, использования сорбционных и ионообменных процессов с применением неорганических сорбентов природного происхождения.
Основные задачи исследования:
- создание термодинамической модели процесса извлечения фосфатов и фторидов РЗМ из производственных растворов продукционной и оборотной экстракционных фосфорных кислот (ПЭФК и ОЭФК);
- исследование кинетики кристаллизации фосфатов и фторидов лантаноидов из модельных фосфорнокислых растворов и растворов экстракционных фосфорных кислот (ЭФК);
- модификация сорбентов на основе железомарганцевых конкреций (ЖМК), определение термодинамических и кинетических характеристик ионного обмена тяжелых металлов на поверхности ЖМК;
- исследование термодинамики и кинетики ионного обмена катионов с высокой вытеснительной способностью для излечения тяжелых металлов из почв и грунтов.
Научные положения, выносимые на защиту:
- С целью достижения высокой степени извлечения фосфатов и фторидов РЗМ из метастабильных растворов оборотных экстракционных фосфорных кислот с температурой 80-90оС и максимальной скорости роста кристаллов из продукционных экстракционных фосфорных кислот следует вводить затравочные фазы, обладающие структурным подобием с растущими кристаллами.
- Для получения готового продукта фосфата РЗМ с содержанием не менее 80 масс. % из промышленных растворов экстракционных фосфорных кислот необходимо применение колонного кристаллизатора, создающего псевдокипящий слой твердой фазы и обеспечивающего предельное извлечение фосфатов РЗМ, что существенно снижает степень токсичности ЭФК, используемых для производства удобрений.
- Новый сорбционный материал, полученный гранулированием железомарганцевых конкреций с бентонитовыми глинами, превышает по своим сорбционным характеристикам импортные аналоги, что обеспечивает эффективную сорбцию тяжелых металлов, независимо от механизма процесса; термодинамические характеристики сорбированных катионов и ионообменных равновесий являются решениями модифицированного уравнения Лэнгмюра.
- Технологии кучного и конвективного выщелачивания тяжелых металлов из грунтов различного минерального состава, основанные на ионообменных процессах с использованием растворов солей, содержащих катионы с высокой вытеснительной способностью, обеспечивают необходимую для данного типа грунта степень извлечения и возможность последующего введения грунтов в земельный оборот.
Научная новизна работы:
- получены термодинамические зависимости растворимости фосфатов и фторидов РЗМ в широком интервале температур и концентраций производственных растворов экстракционных фосфорных кислот;
- установлены значения констант скорости кристаллизации, энергий активации кристаллизации фосфатов и фторидов РЗМ; определена линейная скорость роста кристаллов, доля активной поверхности затравочных фаз;
- определен механизм кристаллизации фосфатов РЗМ на затравочных фазах, включающий стадию депротонирования дигидрофосфатных комплексов;
- предложены принципы создания методики расчета констант ионного обмена, термодинамических характеристик сорбируемых катионов с помощью линейного модифицированного уравнения Лэнгмюра;
- определены механизмы и лимитирующие стадии сорбционных процессов тяжелых металлов на ЖМК;
- термодинамически обоснован выбор элюента-вытеснителя, содержащего катионы с высоким комплексообразующим действием, для возможности извлечения из почв и грунтов тяжелых металлов на примере радионуклидов стронция-90 и цезия-137.
Практическая значимость работы:
- разработаны сорбционные и кристаллизационные технологии извлечения цветных и редкоземельных металлов, позволяющие расширить сырьевую базу и снизить давление на окружающую среду за счет уменьшения выбросов в водоемы и грунты производственных отходов металлургических предприятий;
- разработанная кристаллизационная технология извлечения фосфатов и фторидов РЗМ на затравочных матрицах из производственных растворов экстракционных фосфорных кислот не затрагивает основной технологии получения ЭФК, не требует применения дорогостоящих реагентов, громоздких установок и значительных капиталовложений. Кристаллизационная технология применима на всех производствах получения экстракционных фосфорных кислот по дигидратной схеме. В результате опытно-промышленных испытаний на ОАО «Балаковский химзавод» получен продукт с содержанием 85 масс. % безводного фосфата суммы РЗМ;
- разработана сорбционная технология очистки сточных вод металлургических предприятий с применением универсального сорбента, модифицированного на основе ЖМК, для извлечения цветных металлов и железа (2+), исключающая дополнительное применение окислителей. Получен фильтрующий сорбент на основе ЖМК, который прошел полупромышленные испытания по очистки сточных вод производственного предприятия ЗАО «НПП «Биотехпрогресс» от различных форм железа на опытно-промышленной фильтрующей установке.
- разработана ионообменная технология кучного и конвективного выщелачивания, позволяющая извлекать из грунтов различного типа, отвалов и почв тяжелые металлы, относящиеся к классу опасности «А» по радионуклидам. Технология обеспечивает необходимую степень извлечения, не требует вывоза грунта, громоздких установок, специальных производственных помещений и может быть реализована на любом промышленном объекте непосредственно на месте загрязнения грунта.
Полученные теоретические и экспериментальные результаты работы рекомендованы к использованию в учебном процессе, при написании учебников и учебных пособий, в справочных изданиях.
Личный вклад автора заключается в выборе и обоснованности направлений исследования, организации, проведении и обобщении результатов экспериментов, разработке методик и технологических регламентов сорбционных и кристаллизационных технологий извлечения металлов из низкоконцентрированных отходов металлургического производства и нетрадиционного сырья. Все разработки осуществлялись под непосредственным руководством и при участии соискателя.
Методика исследований. В работе использованы современные методы химических и физико-химических анализов: объемный, весовой, спектральный, рентгенофазовый (РФА), рентгеноспектральный (РСА), фракционный, рН-метрический, потенциометрический, ионометрический, спектрофотометрический, электронной спектроскопии, инфракрасной спектроскопии, минералогический, метод радиоактивных индикаторов с использованием изотопов Се144, Eu155, Sr90 и Cs137, гамма-, бета- спектрометрический.
Экспериментальные исследования выполнены в лабораторном, укрупненно-лабораторном и опытно-промышленном масштабах. Теоретические исследования проведены с применением методов термодинамического анализа ионно-минеральных равновесий многокомпонентных систем ЭФК с использованием программы термодинамических расчетов «Гиббс».
Достоверность полученных результатов, научных исследований, выводов и рекомендаций подтверждаются сходимостью результатов прикладных и теоретических исследований, воспроизводимостью результатов анализов, проведенных различными физическими и физико-химическими методами. Результаты, полученные при исследовании модельных систем, подтверждены в опытно-промышленном эксперименте на ОАО «Балаковский химзавод»; опытно-промышленными испытаниями очистки сточных вод от катионов железа (2+) и (3+) в ЗАО «НПП «Биотехпрогресс»; натурными испытаниями по извлечению радионуклидов из грунтов территорий 5-го квартала Васильевского острова г. Санкт-Петербурга, Новозыбковского района Брянской области, 30-километровой зоны бурта могильника в 15 км от 4-го блока ЧАЭС.
Публикации. По теме диссертационной работы опубликовано 73 печатных работы, из них 1 монография, 58 статей, в том числе 7 статей в журналах, рекомендованных ВАК Минобрнауки России, 4 патента.
Апробация работы. Материалы диссертации докладывались и обсуждались на конференциях: Third Internat. Symp. on Hydrothermal Reactions. Frunze. sept. 12-15, 1989; IV Internat. Symp. on Solubility Phenomens. Troy, New York, 1990; The 8th ISSP. Niigata, Japan, 1998; The 5th International conference «Ecology and Baltic sea region’s countries development». Kronshtadt – Kotka, 2000; V Междунар. конф. «Экология и развитие стран Балтийского региона». Кронштадт-Котка, 6-9 июля 2000 г.; VI Междунар. конф. «Экология и развитие Северо-Запада России». 11-16 июля 2001 г. СПб.; V Всероссийская конф. по проблемам науки и высшей школы. 8-9 июня 2001 г. СПб.; VIII Междунар. конф. «Экология и развитие общества». 23-28 июля 2003, СПб; Всероссийская научно-практическая конференция «Новые технологии в металлургии, химии, обогащении и экологии». СПб. 26-27 октября 2004; Всерос. конференция «Научные основы химии и технологии переработки комплексного сырья и синтеза на его основе функциональных материалов» КНЦ РАН, г. Апатиты, 8-11 апреля 2008; ХII Международная научно-техническая конференция «Наукоемкие химические технологии-2008», Волгоград, 9-11 сентября; 58 Berg- und Httenmnnischer Tag. Innovation in Geoscience, Geoengineering and Metallurgy. Technische Universitt Bergakademie Freiberg. Freiberger Forschungshefte. 2007.; 59 Berg- und Httenmnnischer Tag. Innovation in Geoscience, Geoengineering and Metallurgy. Technische Universitt Bergakademie Freiberg. Freiberger Forschungshefte. 2008; XIII Всероссийский семинар «Термодинамика поверхностных явлений и адсорбции». 6 -11 июля 2009 г., г. Плес; IV региональная конференция молодых ученых «Теоретическая и экспериментальная химия жидкофазных систем (Крестовские чтения). 17-20 ноября 2009, г. Иваново; Всероссийская конференция «Исследование в области переработки и утилизации техногенных образований и отходов». 24-27 ноября, г. Екатеринбург, а также отражены в научных отчетах, проведенных в рамках следующих научно-технических программ:
- межведомственная научно-техническая программа (МНТП) Минобразования РФ «Научные исследования высшей школы по приоритетным направлениям науки и техники», 2000 -2004 г.г.;
- ведомственная научная программа (ВНП) Министерства образования и науки РФ «Развитие научного потенциала высшей школы», 2005-2008 г.г.;
- аналитическая ведомственная целевая программа (АВЦП) «Развитие научного потенциала высшей школы (2009– 2010 годы)».
Работа выполнена при поддержке следующих грантов:
грант Министерства образования РФ отделения технических наук (МО РФ ТО) 5.1.189 2001-2002 г.; грант МО РФ ТО 2-05.1-3413 2003-2004 г; грант СПб в области научной и научно-технической деятельности 2003 г.
Объем и структура. Диссертационная работа состоит из введения, 6 глав, заключения, 2-х приложений, списка литературы из 300 наименований. Общий объем работы – 363 страницы, в том числе 109 таблиц, 63 рисунка.
Содержание работы.
Во введении обоснованы актуальность и направление исследования, сформулирована цель и определены основные решаемые задачи.
В первой главе дан краткий научно-технический анализ современного состояния и перспектив комплексного извлечения редкоземельных металлов в схеме переработки кольских апатитов, рассмотрены экспериментальные методы изучения роста кристаллов, описаны объекты исследования, методы анализа, обоснован выбор затравочной фазы кристаллизации РЗМ, разработана методика получения затравочных кристаллов фторидов и фосфатов РЗМ, исследованы формы кристаллизации лантаноидов из производственных растворов экстракционных фосфорных кислот, определены области метастабильности пересыщенных фосфорнокислых растворов.
Во второй главе приведены результаты термодинамического расчета и экспериментальных исследований зависимости растворимости фосфата церия (III) и фосфата суммы РЗМ в модельных растворах ортофосфорной кислоты, в многокомпонентных промышленных фосфорнокислых растворах от температуры и концентрации фосфорной кислоты, оценен ионный состав растворов. Процессы кристаллизации и растворения фосфатов РЗМ описаны соответствующими реакциями.
Исследованы механизмы реакций кристаллизации фосфатов и фторидов лантаноидов в производственных и модельных растворах фосфорных кислот без и в присутствии затравочных фаз, определены лимитирующие стадии процесса кристаллизации. Найдена линейная скорость роста кристаллов, доля активной поверхности затравок.
В третьей главе исследованы параметры кристаллизационного извлечения фосфатов и фторидов РЗМ из пересыщенных растворов в динамических условиях, разработаны технология и оборудование опытно-промышленной установки для извлечения соединений РЗМ из растворов ЭФК, проведена технико-экономическая оценка внедрения технологии выделения соединений РЗМ из растворов ЭФК.
Четвертая глава посвящена сорбционному способу очистки природных и сточных вод с использованием модифицированного сорбента на основе железомарганцевых конкреций, приведены результаты прочности, динамической емкости и удельной поверхности неорганического сорбционного материала с окислительной функцией. Определены механизмы процесса сорбции катионов железа (2+), стронция, никеля (2+) на ЖМК, исследованы изотермы ионного обмена катионов Na+, Cu2+, Sr2+, Ni2+, Pb2+, Hg2+ на поверхности ЖМК, модифицировано уравнение Лэнгмюра для описания изотерм ионного обмена, решение которого позволяет установить направление смещения термодинамического равновесия и силу связи катионов с поверхностью сорбента. Проведены испытания сорбционного материала по очистке сточных вод от различных форм железа.
В пятой главе исследована термодинамика сорбционных процессов извлечения тяжелых радиоактивных металлов из почв и грунтов различного состава, подобраны селективные компоненты-вытеснители, приведены результаты кинетических исследований десорбции радионуклидов.
В шестой главе обоснованы технологии кучного и конвективного выщелачивания, представлена схема цепи аппаратов без и с регенерацией элюента и приведено технико-экономическое обоснование дезактивации грунтов территории 5-го квартала Васильевского острова г. Санкт-Петербурга.
Защищаемые положения диссертации
- С целью достижения высокой степени извлечения фосфатов и фторидов РЗМ из метастабильных растворов оборотных экстракционных фосфорных кислот с температурой 80-90оС и максимальной скорости роста кристаллов из продукционных экстракционных фосфорных кислот следует вводить затравочные фазы, обладающие структурным подобием с растущими кристаллами.
Растворы оборотных и продукционных экстракционных фосфорных кислот, получаемых в результате сернокислотной переработки апатита при температурах 60-80 оС, пересыщены как фосфатами, так и фторидами РЗМ (содержание суммы РЗМ в ОЭФК 0,04-0,08 масс. %, в ПЭФК 0,09-0,12 масс. %), где РЗМ представлены металлами цериевой подгруппы с содержанием церия около 55 масс. %. Определены концентрационные и температурные области метастабильности пересыщенных по лантаноидам производственных фосфорнокислых растворов.
Выявлено, что в области метастабильности пересыщенных растворов кристаллизация не протекает спонтанно, но может быть проведена на поверхности затравки. В результате экспериментальных исследований в качестве затравочной твердой фазы выбраны фосфаты или фториды церия, а также суммы РЗМ (La, Ce, Pr, Nd, Sm, Eu, Gd, Dy), синтезированных из нитратного промышленного раствора ТУ-95-120-84, получаемого на Горно-металлургическом заводе «Силмет» (г. Силламяэ).
Выработана методика синтеза затравочных кристаллов фосфатов и фторидов церия или РЗМ, повышающая поверхностную активность затравок и обеспечивающая фильтруемость получаемых осадков. Осаждение фосфатов и фторидов РЗМ проводится из разбавленных производственных нитратных растворов с содержанием лантаноидов 0,15-0,2 мольдм-3 при рН=0,8-1,0 фосфорной или фтороводородной кислотами с концентрациями 0,1 мольдм3 при температуре 20-30 оС и с последующей термической обработкой при 200-220 оС фосфатов церия или суммы РЗМ и при 100 оС фторидов церия или суммы РЗМ. По данной методике синтезированы фосфат церия, фосфат суммы РЗМ со структурой рабдофанита LnРО40,5Н2О и фторид церия, фторид суммы РЗМ со структурой флюоцерита LnF3, где Ln= La, Ce, Pr, Nd, Sm, Eu, Gd, Dy. При введении в горячий пересыщенный раствор ЭФК затравочных кристаллов синтезированных соединений РЗМ наблюдали 2 - 3 кратное понижение концентрации РЗМ в растворе (до 0,066 масс. % в ПЭФК и до 0,022 масс. % в ОЭФК ОАО «Фосфорит», г. Кингисепп).
По данным химического, термического и рентгенофазового анализов формы кристаллизации лантаноидов зависят от вида затравок: на поверхности затравки фосфата церия и фосфата РЗМ кристаллизуется LnРО40,5Н2О со структурой рабдофанита, на поверхности затравки фторида церия и фторида РЗМ кристаллизуется LnF3 со структурой флюоцерита.
Для нахождения оптимальных условий извлечения РЗМ из ОЭФК и ПЭФК изучена растворимость фосфата церия в растворе модельной фосфорной кислоты в зависимости от концентрации кислоты и температуры. Процесс растворения СеРО40,5Н2О выразили уравнениями с учетом всех основных ионных равновесий. Решением системы уравнений химических реакций растворения СеРО40,5Н2О и взаимодействия ионов при температурах 298,15373,15К, включающей семь ионных равновесий, найдены константы ионных равновесий и оценен ионный состав раствора. Согласно термодинамическим расчетам при концентрации Н3РО4, моделирующей состав ПЭФК, 98 % церия (III) находится в растворе в виде дигидрофосфатных комплексов, из них 62 % - в виде комплекса первой ступени координации Ce(H2PO4)2+, а 36 % - в виде комплекса второй ступени координации Ce(H2PO4)2+. С увеличением температуры и уменьшением концентрации H3PO4 количество ионов Ce(H2PO4)2+ уменьшается до 54-55 %, а Ce(H2PO4)2+ растет от 36 до 44 %.
Поэтому стехиометрические коэффициенты реакции растворения СеРО40,5H2O(S) аппроксимированы следующим уравнением:
| СеРО4 0,5H2O(S) + 2H3PO4(aq) 0,6[Ce(H2PO4)]2+(aq) + +0,4[Ce(H2PO4)2]+(aq) + 1,6H2PO4- (aq) + 0,5H2O | (1) |
Из значения теплового эффекта данной реакции rH0298 = 30,2 кДжмоль-1 найдена сумма теплот образования комплексов [Ce(H2PO4)]2+(aq) и [Ce(H2PO4)2]+(aq) и определены их термодинамические характеристики.
По уравнению изобары зависимости константы равновесия реакций образования комплексов [Ce(H2PO4)]2+(aq) и [Ce(H2PO4)2]+(aq) от температуры рассчитаны теплоты образования комплексов в интервале температур: 298,15-373,15К. Коэффициенты активности всех участвующих в реакции кристаллизации ионов рассчитаны по экспериментальному уравнению, описывающему зависимость в фосфорнокислых растворах коэффициентов активностей от ионной силы I в интервале I = 0 2 молькг-1.
Установлено, что растворимость СеРО40,5H2O уменьшается с ростом температуры и увеличивается с ростом концентрации Н3РО4. Термодинамический расчет подтвержден экспериментальными исследованиями. По расчетным и экспериментальным данным получена зависимость показателя растворимости рS фосфата церия от рН раствора. Данная зависимость линейна и аппроксимируется следующим уравнением:
| pS = -lg[S] = 2pH + 1,04. | (2) |
Так как растворимость пропорциональна квадрату концентрации ионов водорода S [H+]2 и практически весь церий находится в растворе в виде дигидрофосфатных комплексов, то одной из определяющих стадий кристаллизации является стадия отщепления двух протонов от дигидрофосфатных комплексов и процесс кристаллизации происходит по следующей реакции:
| 0,6[Ce (H2PO4)]2+(aq) +0,4[Ce(H2PO4)2]+(aq) + 0,5H2O СеРО4 0,5H2O(S) + 0,4H2PO4-(aq) + 2Н+( aq), | (3) |
энергия Гиббса которой составляет rG0298= 13,48 кДж·моль-1.
Термодинамический расчет равновесного состава производственных растворов, выполненных по программе «Гиббс», алгоритм которой основан на минимизации энергии Гиббса заданной системы, показал, что при температурах 298,15 - 363,15 К и концентрациях ОЭФК 2,03 - 2,44 молькг-1 и ПЭФК и 5,05 - 5,71 молькг-1 60 % растворенного церия находится в виде комплекса [Ce(H2PO4)]2+(aq), а 40 % - в виде комплекса [Ce(H2PO4)2]+(aq).
Растворимость фосфата церия (III) в растворах ЭФК понижается с ростом температуры и повышается с ростом концентрации фосфорной кислоты, однако выше растворимости фосфата церия в модельной Н3РО4 при одинаковых температурах и концентрациях фосфорных кислот, что объясняется снижением концентрации собственно церия (III) в растворе при переходе от модельной кислоты к ЭФК (рис. 1).

Рис. 1 – Зависимость растворимости СеРО40,5Н2О в модельном растворе (кривая 2) и в ПЭФК (кривая 1) от температуры при концентрации Н3РО4 5,78 молькг-1
Зависимость растворимости фосфатов суммы РЗМ от рН раствора согласуется с расчетными и экспериментальными данными, полученными для модельных растворов, и подтверждает реакцию кристаллизации (3) с отщеплением протонов от дигидрофосфатных комплексов.
Растворы ЭФК пересыщены и по фториду лантаноидов. Растворимость фторидов лантаноидов увеличивается с ростом концентрации H3РO4 и понижением температуры, однако для фторидов РЗМ наблюдается практически одинаковая степень извлечения в твердую фазу из всех растворов ЭФК, и более слабая зависимость растворимости от температуры, чем для фосфатов. Из ПЭФК концентрацией вплоть до 7 мольдм-3 можно извлечь РЗМ, используя фторидную затравку даже при 20 °С, в то время как при комнатной температуре выделение фосфатов лантаноидов не происходит и концентрационным пределом для извлечения фосфатов РЗМ из продукционных кислот являются значения 5,5-5,8 мольдм-3.
Исследованы механизмы процесса кристаллизации фосфатов РЗМ на различных затравках и процесса спонтанной кристаллизации. Рассчитанные энергии активации Еакт демонстрируют многократное понижение активационного барьера при проведении кристаллизации на поверхности затравки:
| Затравочная фаза: | CePO40,5H2O | CaSO40,5H2O | отсутствует |
| Eакт, кДжмоль-1: | 37,3±1,0 | 7,2±2,0 | 120,0±3,0 |
Таким образом, на образование зародышей кристаллов расходуется энергия 8085 кДжмоль-1, что обуславливает метастабильность пересыщенных растворов.
Высокое значение Еакт (120,0 кДжмоль-1) при проведении спонтанной кристаллизации без внесения затравочной фазы и увеличение константы скорости в 3 раза при возрастании температуры на 10 °С определяют лимитирующую стадию данного процесса, которой является химическая реакция депротонирования дигидрофосфатных комплексов.
Более слабая зависимость константы скорости реакции от температуры при проведении процесса на поверхности рабдофанита и понижение Еакт до значения 37,3 кДжмоль-1 объясняются изменением лимитирующей стадии – процесс протекает в диффузионно-кинетическом режиме.
Кристаллизация на поверхности сульфата кальция протекает с меньшей скоростью, чем на собственной фазе, вследствие неполного соответствия граней растущих кристаллов и затравки. Меньшая по величине энергия активации при кристаллизации на поверхности сульфата кальция указывает на диффузионный механизм процесса.
Линейные зависимости логарифма концентрации лантаноидов во времени при 40- 90°С подтверждают первый порядок реакции кристаллизации соединений РЗМ на затравках из растворов ЭФК.
С ростом концентрации экстракционной фосфорной кислоты степень извлечения из нее фосфатов лантаноидов снижается, а скорость их кристаллизации, мало изменяясь в разбавленных растворах ОЭФК, резко возрастает при переходе к концентрированному раствору ПЭФК.
Из всей суммы лантаноидов полнее и быстрее всех кристаллизуется фосфат церия, так как степень извлечения и скорость кристаллизации из модельного раствора выше, чем из аналогичного по концентрации промышленного раствора и на затравке LnРО40,5Н2О кристаллизация происходит вдвое медленнее, чем в аналогичном растворе на затравке СеРО40,5Н2О. Таким образом, лантаноиды изоморфно сокристаллизуются с церием с меньшими скоростями.
В ходе эксперимента получены данные об удовлетворительной сокристаллизации европия с фосфатом церия (III), коэффициент распределения европия КN(Eu) между твердой и жидкой фазами составил 158.
Примесь кальция в фосфорнокислых растворах не оказывает заметного влияния на ионные формы церия в растворе, с ростом концентрации кальция растворимость церия понижается незначительно. Анализ твердой фазы показывает, что в процессе кристаллизации фосфата РЗМ достигается значительная очистка конечного продукта от кальция.
На фторидных затравках наблюдается слабая зависимость скорости кристаллизации от температуры в интервале 60-80 °С, в то время как на фосфатной затравке снижение температуры с 80 до 60 °С приводит к уменьшению константы скорости кристаллизации в 2,2 раза, что соответствует формальной энергии активации процесса 37,3 кДжмоль-1.
Таким образом, установленные кинетические характеристики процесса кристаллизации и термодинамические зависимости растворимости фосфатов и фторидов церия и суммы РЗМ от концентрации ЭФК и температуры доказывают принципиальную возможность кристаллизации на затравочных фазах, обладающих структурным подобием с растущими кристаллами из производственных растворов ЭФК.
Для достижения наибольшей степени извлечения фосфатов РЗМ предпочтительнее использовать растворы ОЭФК при температурах 80-90oС, максимальная скорость роста кристаллов фосфатов РЗМ наблюдается при использовании растворов ПЭФК, что не является столь существенным для скорости роста и полноты осаждения фторидов лантаноидов.
- Для получения готового продукта фосфата РЗМ с содержанием не менее 80 масс. % из промышленных растворов экстракционных фосфорных кислот необходимо применение колонного кристаллизатора, создающего псевдокипящий слой твердой фазы и обеспечивающего предельное извлечение фосфатов РЗМ, что существенно снижает степень токсичности ЭФК, используемых для производства удобрений.
Экспериментальные исследования по кристаллизации соединений РЗМ на гранулированных затравках в динамических условиях при пропускании производственных растворов ЭФК через термостатированные колонки в непрерывном режиме «сверху вниз» позволили определить оптимальные параметры проведения технологического процесса кристаллизации в производственных условиях.
Полученные зависимости концентрации РЗМ в выходящем из колонки фосфорнокислом растворе от времени контакта твердой и жидкой фаз на различных затравках при разных температурах и концентрациях ЭФК представлены на рисунке 2.
В качестве характеристики кристаллизационного извлечения фосфата и фторида суммы РЗМ из ЭФК определены значения минимально допустимого времени контакта, ниже которого наблюдается проскок лантаноидов через колонку.
Как видно из графиков (кривые 1-2 и 3-4) минимальное время контакта твердой и жидкой фаз не зависит от параметров колонок и массы затравок, таким образом, выходные кривые становятся инвариантными.
Повышение температуры процесса способствует уменьшению минимального времени контакта твердой и жидкой фаз tmin (кривые 1 и 3, 2 и 4 на рис. 2). С ростом температуры уменьшается концентрация лантаноидов в растворе ЭФК на выходе из колонки в полном соответствии с понижением растворимости и возрастает выход РЗМ.

Рис. 2 - Зависимость концентрации РЗМ Свых (масс. %) в растворах ЭФК на выходе из колонки от времени контакта твердой и жидкой фаз t (мин) на затравке CePO40,5Н2О:
1 - m=4,0 г, h=7,5 см, S=0,5 см2, Т=60°С, ОЭФК
2 - m=16,1 г, h=14 см, S=1 см2, Т=60°С, ОЭФК
3 - m=4,0 г, h=7,5 см, S=0,5 см2, Т=80°С, ОЭФК
4 - m=16,1 г, h=14 см, S=1 см2, Т=80°С, ОЭФК
5 - m=4,0 г, h=7,5 см, S=0,5 см2, Т=80°С, ПЭФК,
где m – масса затравки, h, S – высота и сечение колонок.
Рост концентрации ЭФК (кривая 5 на рис. 2) приводит к повышению концентрации лантаноидов в растворе на выходе из колонки и к снижению tmin от 6,8 до 3,4 мин, что соответствует росту пропускной способности установки.
Замена затравки фосфата церия (III) на затравку фосфата суммы РЗМ приводит к резкому росту tmin до 17,2 мин (рис. 3).
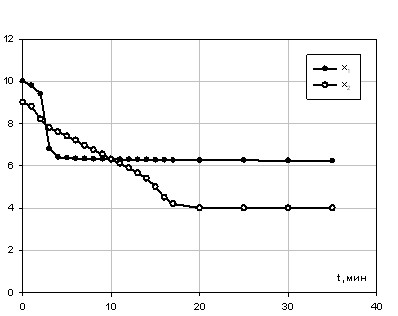
Рис. 3 - Зависимость концентрации РЗМ Свых (масс. %) в растворе ПЭФК на выходе из колонки на затравках
1 - CePO40,5Н2О и 2 - LnPO40,5Н2О от времени контакта твердой и жидкой фаз t (мин) при Т = 80 °С
В случае кристаллизации на фосфате РЗМ из ПЭФК максимум скорости роста кристаллов соответствует времени 16 18 мин (кривая 2 на рис. 4).
Высокая степень извлечения РЗМ с использованием фторидных затравок соответствует времени контакта фаз 16 - 19 мин, сопоставимым с минимальным временем контакта фосфатных затравок, а максимальная скорость роста кристаллов достигается в диапазоне времени 1 – 11 мин.
На основании проведенных исследований кристаллизации соединений РЗМ в динамических условиях в промышленных растворах ЭФК и анализа технологических особенностей передела производства фосфорной кислоты предложена и испытана технология извлечения фосфатов суммы лантаноидов в условиях ОАО «Балаковский химзавод».
В результате испытаний получен продукт фосфатов РЗМ с содержанием до 85 масс. % без учета гидратной воды, что соответствует 55 % степени извлечения из растворов ОЭФК.

Рис. 4 - Зависимость скорости роста кристаллов v (мгч-1) на затравках CePO40,5Н2О (1) и LnPO40,5Н2О (2) от времени контакта твердой и жидкой фаз t (мин)
Технологическая схема передела кристаллизации соединений РЗМ при условии сохранения технико-экономических показателей действующего производства фосфорной кислоты представлена на рисунке 5.
В данной схеме извлечения фосфатов и фторидов суммы РЗМ рекомендован к применению пульсационный колонный аппарат непрерывного действия с транспортом затравки через поток ЭФК.
Конструкция колонного аппарата с модифицированными узлами и блоками, учитывая особенности технологического процесса кристаллизации соединений РЗМ, позволяет достичь предельного извлечения фосфатов и фторидов РЗМ из растворов ЭФК, используемых для производства минеральных удобрений. При огромных масштабах производства удобрений извлечение редких земель на промежуточной стадии процесса является рентабельным и вместе с тем, уменьшает загрязнение пахотной земли редкоземельными металлами.

Рис. 5– Аппаратно-технологическая схема установки
1 – сборник; 2 – расходомер; 3 – теплообменник (90°С); 4 – кристаллизатор; 5 – секторный питатель; 6 – мембранный пульсатор; 7 нижняя зона колонны; 8, 17 – шланговые вентили; 9 – накопительная емкость; 10 – виброгрохот; 11 – дробилка; 12 – экструдер; 13 – сушилка (400°С), 14, 15 - ресиверы; 16 – заглушка; М1, М2 - мембраны
В качестве готовой продукции, получаемой при выполнении технологической разработки, принят концентрат фосфатов РЗМ с содержанием LnРО4 80 масс. %, соответствующим следующему составу:
| Ce | Pr | Nd | Sm | Cd | Eu | Dy |
| 40% | 5,0% | 2,0% | 2,6% | 1,75% | 0,5% | 1% |
Полученный продукт является готовой товарной продукцией, предназначенной для выделения индивидуальных РЗМ, применяемых в металлургической, электронной, нефтеперерабатывающей и других областях промышленности.
- Новый сорбционный материал, полученный гранулированием железомарганцевых конкреций с бентонитовыми глинами, превышает по своим сорбционным характеристикам импортные аналоги, что обеспечивает эффективную сорбцию тяжелых металлов, независимо от механизма процесса; термодинамические характеристики сорбированных катионов и ионообменных равновесий являются решениями модифицированного уравнения Лэнгмюра.
Для очистки и извлечения из сточных и природных вод катионов цветных металлов и железа перспективно использование отечественных железомарганцевых конкреций, месторождение которых имеют достаточно большое распространение по площади дна Финского залива Балтийского моря, залегая в основном на поверхности дна.
Очистка сточных вод металлургических предприятий от различных форм железа, проводимая традиционным нейтрализационным способом, не обеспечивает осаждение катионов железа (2+) до ПДК 0,1 мг·л-1 в виде малорастворимого гидроксида Fe(OH)2 в силу высокого значения рН гидратообразования (9,5) и требует дополнительное применение различных окислителей для перевода Fe2+ в степень окисления +3.
Использование модифицированного сорбента с окислительной функцией на основе ЖМК позволяет исключить дополнительное применение окислителей.
Вещественный состав ЖМК представлен гидроксидами железа и марганца, в изоморфной связи с которыми находятся цветные металлы. Характерной особенностью ЖМК является гигроскопичность, обусловленная развитой поверхностью материала (пористость составляет 58%).
Сравнения свойств отечественного и импортного пиролюзитсодержащих материалов по удельной поверхности показали, что значение удельной поверхности у конкреций Финского залива более чем в 20 раз выше, чем у сорбента «Аквамандикс» европейского производства.
В виду неудовлетворительной прочности ЖМК проведена их модификация с бентонитом (коллоидными глинами), поливинилацетатным клеем, жидким стеклом при различных соотношениях связующих материалов и температурах с последующим гранулированием. Модифицированный сорбент по прочности соответствует требованиям ГОСТ и по динамической емкости, определенной по количеству ионов железа (2+), поглощенных единицей массы воздушно-сухого сорбента, превышает более чем в 30 раз емкость импортных пиролюзитсодержащих материалов, что объясняется увеличением удельной поверхности в процессе размола и грануляции со связующим материалом.
Результаты сравнения прочностных характеристик и значений динамических емкостей до проскока 0,1 мг·дм-3 Fe (2+) отдельных модифицированных сорбентов и импортных аналогов представлены в таблице 1.
Несмотря на низкое содержание пиролюзита в конкрециях (в 3-4 раза ниже по сравнению с импортными аналогами), высокие значения удельной поверхности и динамической емкости объясняют высокую сорбционную способность железомарганцевых конкреций. Вторым фактором является наличие на поверхности конкреций затравок для осаждения гидроксида железа (III) в виде гетита и других железосодержащих минералов.
Преимуществами сорбента на основе модифицированных ЖМК являются: низкая насыпная масса, высокие значения пористости, удельной поверхности и высокой прочности, которые можно регулировать путём размалывания и связывания с бетонитом.
Таблица 1
Динамическая емкость до проскока 0,1 мг·дм-3 Fe (2+) и механическая прочность пиролюзитсодержащих сорбционных материалов
| Образец | Насыпная масса, кг·дм-3 | Динамическая емкость | Прочность | ||
| Измельчаемость | Истираемость | ||||
| экв·кг-1 | г·кг-1 | % | % | ||
| 1 | 0,70 | 1,39 | 38,92 | 0,48 | 0,36 |
| 2 | 0,72 | 1,50 | 42,00 | 2,08 | 0,31 |
| 3 | 0,55 | 2,16 | 60,48 | 0,70 | 0,43 |
| 4 | 0,62 | 2,00 | 56,00 | 2,85 | 0,35 |
| 5 | 0,80 | 4,15 | 116,17 | 3,76 | 0,30 |
| 6 | 0,73 | 4,41 | 123,48 | 3,87 | 0,21 |
| Пир. | 0,67 | 0,74 | 20,72 | < 4 | < 0,5 |
| Акв. | 1,12 | 0,12 | 3,36 | < 4 | < 0,5 |
| ЖМКI | 0,35 | 2,41 | 67,48 | 7,4 – 9,8 | 1,3 – 1,4 |
| ЖМК II | 0,35 | 2,54 | 71,12 | 7,4 – 9,8 | 1,3 – 1,4 |
1, 2 - ЖМК, модифицированные жидким стеклом при 150оС и 900оС , 3, 4 - клеем ПВА при 150оС и 25оС, 5, 6 - бентонитовыми глинами при 25оС, Пир. - пиролюзитсодержащий сорбент китайского производства, Акв.- пиролюзитсодержащий сорбент европейского производства «Аквамандикс», ЖМК I и II - сырые железомарганцевые конкреции.
В результате исследования кинетики сорбции катионов железа (2+), никеля (2+) и стронция (2+) на ЖМК определены механизмы и лимитирующие стадии процесса сорбции.
Высокое значение энергии активации Еакт=58,4 кДжмоль-1, первый порядок реакции, независимость констант скорости процесса от грансостава ЖМК и интенсивности перемешивания характеризуют лимитирующую стадию процесса сорбции железа (2+), которой является окислительно-восстановительная химическая реакция. Данную реакцию подтверждает рентгенофлуоресцентный анализ, который показал отсутствие катионов Mn2+ в отфильтрованных растворах после их контакта с сорбентом:
| MnO2 + 2Fe2+ + 5H2O MnО + 2Fe(OH)3 + 4H+ | (4) |
Кинетические зависимости процесса сорбции катионов никеля и стронция интерпретированы уравнениями первого порядка, по которым вычислены значения констант скорости процесса сорбции во внешне- и внутридиффузионной областях. Константы скорости внешней диффузии катионов никеля и стронция незначительно возрастают с увеличением температуры, с уменьшением размера гранул ЖМК и с увеличением интенсивности перемешивания.
Значения констант скорости внутренней диффузии не зависят от температуры процесса, интенсивности перемешивания и незначительно снижаются с уменьшением размера гранул ЖМК. Низкие значения энергий активации процессов сорбции Ni2+ Еакт =7,43 кДжмоль-1 и Sr2+ Еакт = 4,38 кДжмоль-1, первые порядки реакций определяют лимитирующие стадии процесса сорбции катионов стронция и никеля в режиме диффузии.
Для определения термодинамических характеристик сорбируемых катионов исследован процесс ионного обмена катионов Cu2+, Ni2+, Co2+, Pb2+, Hg2+, Sr2+ и Na+ из водных растворов при температуре 298 К на поверхности железомарганцевых конкреций, переведенных в натриевую форму. Изотермы сорбции катионов представлены на рисунке 6.
Термодинамическое описание ионного обмена для реакций:
| 2Na+(s) + Met2+(aq) 2Na+(aq) + Met2+(s) |
проведено при допущении идеальности твердой фазы.
Для описания изотерм предложено новое модифицированное уравнение, аналогичное линейной форме уравнения Лэнгмюра:
 , , | (5) |
где К – кажущаяся константа ионного обмена, ![]() – равновесные концентрации натрия и обменивающихся катионов, ± - среднеионные коэффициенты активности,
– равновесные концентрации натрия и обменивающихся катионов, ± - среднеионные коэффициенты активности, ![]() и
и ![]() – величины сорбции ионов (моль·кг-1) и
– величины сорбции ионов (моль·кг-1) и ![]() - величина предельной сорбции ионов, моль кг-1.
- величина предельной сорбции ионов, моль кг-1.

Рис. 6 – Изотермы сорбции сорбции катионов Sr2+, Ni2+, Co2+, Cu2+, Pb2+, Hg2+ на поверхности ЖМК: 1- Cu2+, 2- Ni2+, 3- Pb2+, 4- Hg2+, 5Co2+, 6 - Sr2+; Г– величина сорбции ионов (моль·кг-1), СMet – равновесная концентрация ионов (моль·кг-1)
Решениями приведенного уравнения являются значения предельной сорбции обменивающихся ионов, кажущихся констант обмена ионов и ионных потенциалов z/rsorb катионов, где z - заряд, rsorb - радиус сорбированных катионов на ЖМК, которые приведены в таблице 2.
Таблица 2
Предельная сорбция обменивающихся ионов, константы ионного обмена и радиусы сорбированных ионов на поверхности сорбента
| Обмени-вающийся катион | Предельная сорбция ионов, моль·кг-1 | Радиус сорбированного катиона, пм | Кажущаяся константа ионного обмена | z/rsorb·103, пм-1 |
| Sr2+ | 0,49 | 217 | 1,90±0,15 | 9,2 |
| Hg2+ | 0,90 | 160 | 2,00±0,21 | 12,5 |
| Pb2+ | 0,87 | 163 | 4,50±0,18 | 12,3 |
| Co2+ | 0,67 | 186 | 4,65±0,30 | 10,8 |
| Ni2+ | 1,05 | 149 | 8,13±0,34 | 13,4 |
| Cu2+ | 1,43 | 127 | 43,86±0,50 | 15,7 |
Экспериментально определенные радиусы катионов, сорбированных на ЖМК, имеют значения промежуточные между кристаллографическими радиусами катионов по Бокию и радиусами гидратированных катионов по Стоксу, поэтому являются средними эффективными радиусами частично дегидратированных ионов на поверхности сорбента. Их значения свидетельствуют о сильной дегидратации, высоком поляризующем действии катиона и более прочной связи катионов с отрицательно заряженными активными центрами поверхности ЖМК. Последние образуются на гидролизованной поверхности пиролюзита вследствие диссоциации групп MnOH, значения pH изоэлектрического состояния марганцевых минералов в составе ЖМК равны 1,5 – 2,8.
Прочность кулоновского взаимодействия в двойном электрическом слое Штерна коррелирует с повышением ионного потенциала катионов в сорбированном состоянии и с понижением энергии Гиббса ионного обмена, это подтверждается составленным на основе полученных результатов рядом вытеснительной способности катионов:
| Na+< | Sr2+< | Hg2+< | Pb2+< | Co2+< | Ni2+< | Cu2+< | |
| 0 | 1,59±0,12 | 1,7±0,2 | 3,7±0,3 | 3,8±0,3 | –5,2±0,5 | –9,3±0,5 |
Вдоль ряда сорбционной способности катионов с понижением энергии Гиббса ионного обмена растет вытеснительная способность катионов. Термодинамические данные свидетельствуют о смещении ионообменного равновесия в сторону вытеснения ионов натрия с поверхности сорбента в раствор двухзарядными катионами, следовательно, железомарганцевые конкреции являются универсальным сорбентом цветных металлов и железа.
Испытания модифицированного материала на основе железомарганцевых конкреций проведены на опытно-промышленной фильтрующей установке Киришского филиала научно-производственного предприятия ЗАО «НПП «Биотехпрогресс» по сорбционной технологии очистки сточных вод.
Проведенные испытания показали высокую эффективность обесцвечивания, очистки воды от различных форм железа и взвешенных веществ на полученной опытной партии сорбционного материала. Значения всех этих показателей лежат в диапазоне от 70 до 90 %.
Таким образом, применение данного сорбента позволяет исключить из общепринятых технологических схем ряд циклов, требующих дополнительных затрат, связанных с доокислением Fe2+ и удалением взвешенных веществ. Регенерация предлагаемого сорбента не требуется, так как в настоящее время проводится переработка ЖМК по технологии выщелачивания цветных и черных металлов сернистым ангидридом в растворах серной кислоты или пирометаллургическим способом. Модифицированный материал позволяет заменить импортные сорбенты, так как по высокой емкости и низкой себестоимости превосходит мировые аналоги.
- Технологии кучного и конвективного выщелачивания тяжелых металлов из грунтов различного минерального состава, основанные на ионообменных процессах с использованием растворов солей, содержащих катионы с высокой вытеснительной способностью, обеспечивают необходимую для данного типа грунта степень извлечения и возможность последующего введения грунтов в земельный оборот.
Тяжелые металлы находятся в почвах и грунтах в двух химических формах: в органической составляющей почвы в виде комплексов с гуминовыми и фульвокислотами и в адсорбированном состоянии на поверхности минералов.
На основе термодинамических и кинетических исследований ионного обмена в почвах и грунтах разработана технология извлечения тяжелых радиоактивных металлов цезия-137 и стронция-90 путем ионного обмена их на катионы с высоким комплексообразующим действием и более сильной вытеснительной способностью, которая пропорциональна заряду катиона и обратно пропорциональна его радиусу в гидратированном состоянии. По этим параметрам в качестве иона-вытеснителя выбран катион Fe3+. В качестве элюента для извлечения из почв и грунтов радиоактивных металлов использован раствор хлорида железа (3+) концентрацией 0,01-0,2 мольл-1 с эквимолярной добавкой хлорида аммония для стабилизации рН и в качестве неизотопного носителя для цезия-137. При концентрации ниже 0,01 мольл-1 не достигается предельная адсорбция катионов железа (3+) почвой, а при концентрации выше 0,2 мольл-1 катионы железа маскируются в форме хлоридных комплексов.
Для термодинамического обоснования ионообменного способа изучена совместная сорбция катионов Sr2+ и Fe3+ на образце кембрийской голубой глины, переведенной в Н-форму.
Из уравнения (6) изотермы ионного обмена для реакции:
| 3Sr2+sol + 2Fe3+aq 3Sr2+aq + 2Fe3+sol |
| (6) |
вычислены величины предельной сорбции ионов ![]() = 42,5 мэквкг-1, кажущейся константы ионного обмена
= 42,5 мэквкг-1, кажущейся константы ионного обмена ![]() = 12,14 и энергии Гиббса обмена катионов стронция на катионы железа (3+) на поверхности глины
= 12,14 и энергии Гиббса обмена катионов стронция на катионы железа (3+) на поверхности глины ![]() = 6,19 кДж·моль-1.
= 6,19 кДж·моль-1.
В уравнении (6) обозначены: ![]() и
и ![]() - величины сорбции катионов в совместном присутствии (моль·кг-1),
- величины сорбции катионов в совместном присутствии (моль·кг-1), ![]() - величина предельной сорбции катионов (экв·кг-1),
- величина предельной сорбции катионов (экв·кг-1), ![]() и
и ![]() - активности катионов в растворе (моль·кг1), отнесенные к стандартной активности 1 моль·кг1.
- активности катионов в растворе (моль·кг1), отнесенные к стандартной активности 1 моль·кг1.
Отрицательное значение энергии Гиббса свидетельствует о смещении ионообменного равновесия в сторону вытеснения стронция из грунта растворами солей железа (3+).
Исследована кинетика десорбции радионуклидов 137Cs и 90Sr из образцов почв, отобранных в зонах отчуждения дер. Халеевичи Новозыбковского р-на Брянской обл. и бурта могильника в 15 км от 4-го блока ЧАЭС. Десорбция 137Сs и 90Sr из грунтов относится к реакции первого порядка.
По определенным значениям констант скорости десорбции, равным для цезия 0,072 сут-1, для стронция - 2,9·10-4 с-1, рассчитано время, необходимое для извлечения 70±5% 137Сs и 90±5% 90Sr, которые составляют 14 суток и, соответственно, 2,2 ч.
Экспериментально определены коэффициенты диффузии для реальных грунтов, которые по цезию составляют DCs 10-8 м2·с-1, по стронцию - DSr 10-6 м2·с-1, что указывает на более высокую подвижность 90Sr и более прочную фиксацию 137Cs.
Изучено извлечение радионуклидов элюирующими растворами трилона Б (0,025-0,05 мольл-1), азотной кислоты (0,1-0,5 мольл-1) и хлорида железа (III) с эквимолярной добавкой хлорида аммония (0,02-0,04 мольл-1) в динамических условиях на образцах грунта природно-техногенного происхождения, отобранных на территории бывшего военгородка № 6 5-го квартала Васильевского острова г. СПб, где выявлены 2 участка площадью 2500 м2, загрязненных выше предельно допустимой активности: по 137Cs до 5105 Ки·кг-1, по 90Sr до 4105 Ки·кг-1 с мощностью дозы до 10 мР·час-1.
Удовлетворительная степень извлечения (96,8-97,8 %) получена при использовании в качестве элюента азотной кислоты, что объясняется высоким содержанием карбонатов грунте. Кислота хорошо вымывает стронций из карбонатных форм и с поверхности минералов, но значительно хуже из органокомплексов. С повышением содержания органической составляющей в грунте элюирующая способность кислоты по отношению к тяжелым металлам падает, тогда как вытеснительное действие растворов хлорного железа понижается в меньшей степени, поэтому раствор хлорида железа (III) является более универсальным элюентом.
Зависимость коэффициента очистки от соотношения объёма элюента к массе грунта V/m описана следующим эмпирическим уравнением:
| (7) |
где коэффициент распределения Dж/т не зависит в этом уравнении от V/m, а определяется только типом грунта или почвы и концентрацией промывного раствора.
По технологиям кучного и конвективного выщелачивания апробирован способ ионообменного извлечения тяжелых радиоактивных металлов стронция и цезия из грунтов на территории бывшего военного городка в 5-ом квартале Васильевского острова. Согласно нормативным документам требуется очистка грунта до удельной активности (1-2)106 Кикг-1. По технологии кучного выщелачивания раствором хлорида железа (III) концентрацией 0,05 мольл-1 при отношении V/m=2,3 дм3·кг-1получена степень очистки 60 %, по технологии конвективного выщелачивания при V/m=3,5 дм3·кг-1 степень очистки составила 90 %.
Количество циклов промывки n, необходимых для достижения заданного коэффициента очистки, и конечную удельную активность An рассчитывают по формулам (8) и (9):
 , , | (8) |
где Vi – объем промывного раствора в одном цикле, DЖ/Т – коэффициент распределения металлов между грунтом и промывным раствором, m – масса промываемого грунта.
 | (9) |
где A0 – исходная удельная активность грунта.
На рисунке 7 приведена технологическая схема цепи аппаратов ионообменного способа извлечения радиоактивных металлов из грунтов по технологиям кучного и конвективного выщелачивания с регенерацией промывного раствора.


Рис. 7 – Схема цепи аппаратов
Нейтрализацию промывных вод проводят содой до рН = 8 - 9 с отделением отстоя. Осадок в виде карбонатов прокаливают до феррита кальция, содержащего стронций-90 и цезий-137 в качестве изоморфных включений, то есть в жестко фиксированной форме, и направляют на захоронение. Водную фазу направляют на установку радиационной очистки. Масса поступающего на захоронение отхода не превышает 10-20 кг на тонну грунта.
Технология кучного выщелачивания экономична, отвечает условию элюирования в наиболее эффективном динамическом режиме. Технология конвективного выщелачивания с перемешиванием фаз позволяет обеспечить любые заданные коэффициенты очистки и степень извлечения радиоактивных металлов для данного типа грунта.
Заключение
Представленная диссертация является научно-квалификационной работой, в которой разработаны физико-химические основы сорбционной и кристаллизационной технологий извлечения редких и цветных металлов из нетрадиционных источников сырья и низкоконцентрированных природных и техногенных материалов, позволяющие существенно снизить расход материальных ресурсов. Полученные научные результаты составляют основу эффективных технологий извлечения соединений РЗМ из нетрадиционного сырья – экстракционных фосфорных кислот, получаемых при переработке апатита и используемых в качестве удобрений, тяжелых металлов из техногенных отходов металлургических предприятий – почв, грунтов и сточных вод с использование модифицированного железомарганцевого сорбента, что существенно снижает степень токсичности производственных отходов металлургических предприятий.
Основные научные и практические результаты работы.
- Разработаны физико-химические основы сорбционной и кристаллизационной технологий извлечения тяжелых металлов из низкоконцентрированных нетрадиционных источников сырья и природных и техногенных материалов химико-металлургических производств.
- Установлено, что растворы ОЭФК и ПЭФК, получаемые в результате сернокислотной переработки апатита при производственных температурах на выходе из аппарата, пересыщены как фосфатами, так и фторидами РЗМ.
- Выявлены концентрационные и температурные области метастабильности пересыщенных растворов, в которых доказано извлечение соединений РЗМ на затравках.
- Разработана технология синтеза затравочных фаз, обладающих структурным подобием с растущими кристаллами. Доказано, что на поверхности затравки LnPO40,5H2O (Ln- сумма лантаноидов) кристаллизуется фосфат суммы РЗМ со структурой рабдофанита, на поверхности затравки LnF3 - фторид РЗМ со структурой флюоцерита.
- Проведен термодинамический расчет растворимости фосфата церия (III) и его равновесных ионных форм в модельном растворе фосфорной кислоты, а также компьютерный термодинамический расчет ионно-минеральных равновесий в многокомпонентных системах ЭФК, позволившие оценить ионный состав исследуемых растворов ЭФК в широком интервале температур 298,15-373,15К и концентраций 1,3-5,8 молькг-1 фосфорных кислот.
- Описаны процессы кристаллизации и растворения фосфатов РЗМ соответствующими реакциями. Найдены величины энтальпий реакций растворения и кристаллизации фосфата лантаноидов в насыщенном растворе.
- Рассчитаны стандартные термодинамические характеристики комплексных ионов [Ce(H2PO4)2+], [Ce(H2PO4)2+] и соединения CеPO40,5H2O, отсутствующие в справочной литературе.
- Установлены зависимости растворимости фосфатов и фторидов церия и РЗМ от температуры и концентрации фосфорнокислых растворов ПЭФК, ОЭФК, подтверждающие термодинамические расчеты.
- Исследован механизм реакции кристаллизации фосфатов лантаноидов в производственных и модельных растворах без и в присутствии затравочных фаз: определена лимитирующая стадия данного процесса, которой является химическая реакция депротонирования дигидрофосфатных комплексов вблизи поверхности твердой фазы.
- Определена линейная скорость роста кристаллов, доля активной поверхности затравок. Выявлен оптимальный режим извлечения фосфатов и фторидов РЗМ на затравках, соответствующий максимальной скорости роста кристаллов.
- Разработана технологическая схема с использованием колонного кристаллизатора, создающего псевдокипящий слой твердой фазы и обеспечивающего предельное извлечение РЗМ.
- На основе грануляции ЖМК с бентонитовыми глинами получен прочный сорбционный материал с высокими значениями удельной поверхности и емкости.
- Определены значения энергий активации процессов сорбции катионов железа (2+), стронция, никеля (2+) на неорганическом сорбенте, обладающим окислительной функцией.
- Для описания изотерм ионного обмена модифицировано уравнение Лэнгмюра, решением которого являются значения констант ионного обмена катионов Na+, Co2+, Hg2+, Pb2+, Cu2+, Sr2+, Ni2+ на ЖМК, размеров «посадочных» площадок и радиусов сорбированных катионов, характеризующие силу связи катионов с поверхностью сорбента, а также значения энергий Гиббса ионного обмена, характеризующие направление смещения термодинамического равновесия.
- Представлен ряд вытеснительной способности катионов на поверхности ЖМК, коррелирующий с понижением энергии Гиббса ионного обмена.
- Исследована сорбционная способность ряда минералов. В порядке убывания обменной емкости, удельной поверхности и коэффициента распределения катионов стронция между водным раствором и твердой фазой минералы расположены в следующий ряд: каолинит > микроклин > доломит > альбит > олигоклаз, обосновывающий преимущественную фиксацию тяжелых металлов на глинистых минералах.
- Изучена раздельная и совместная сорбция катионов Sr2+ и Fe3+ на образцах кембрийской глины из водных растворов. Экспериментально определены значения константы и энергии Гиббса ионного обмена катионов стронция и железа (3+), доказывающие возможность ионообменного извлечения из грунта тяжелых металлов.
- В качестве иона-вытеснителя выбран катион Fe3+ c большим зарядом, малым гидратированным радиусом и с высоким комплексообразующим действием. Обоснован выбор элюента раствора хлорида железа (3+) и аммония и определен его концентрационный диапазон: 0,01-0,2 мольл-1.
- Разработана технологическая схема цепи аппаратов с регенерацией элюента. Предложены формулы для расчета коэффициентов очистки и числа промывных циклов растворов для достижения заданной степени очистки.
- Проведены технико-экономические расчеты опытно-промышленных установок для извлечения цветных и редких металлов.
Основные публикации по диссертации:
- Черемисина О.В. Теория и практика извлечения цветных, черных и редкоземельных металлов из промышленных растворов, стоков, природных вод и грунтов. СПб. СПГГИ (ТУ). 2008. 149 с.
- Пат. 2340022 РФ. Способ получения сорбента для очистки среды/ С.З.Эль-Салим, Д.Э.Чиркст, О.В.Черемисина, А.А.Чистяков, И.Т.Жадовский. Опубл. 27.11.2008. Бюл. № 33.
- А.с. 1656832 Способ извлечения фторидов редкоземельных элементов/ И.А.Дибров, Д.Э.Чиркст, О.В.Черемисина, И.В.Мелихов, В.Н. Рудин. Опубл. 15. 02. 1991.
- Пат. 2298168 РФ. Анализатор мутных сред/ И.Н.Белоглазов, О.В.Черемисина, С.З.Эль-Салим, Д.С.Киреев. Опубл. 26.02.06 г. Бюл. № 12.
- Пат. 2326951 РФ. Способ извлечения германия из шлаков переработки полиметаллических руд/ Д.Э.Чиркст, О.В.Черемисина, А.А.Чистяков, И.Т.Жадовский. Опубл. 20.11.2006 г. Бюл. № 17.
- Черемисина О.В. Кинетика кристаллизационных процессов соединений редкоземельных металлов на затравочных фазах. Цветные металлы. 2009 г. № 10. С. 47-52.
- Черемисина О.В. Опытно-промышленная установка для извлечения соединений редкоземельных металлов из производственных растворов. Цветные металлы. 2009 г. № 12. С. 45-52.
- Черемисина О.В. Термодинамика кристаллизации фосфатов редкоземельных металлов из растворов ортофосфорной кислоты / Д.Э. Чиркст, О.В.Черемисина, М.В. Иванов, И.Т. Жадовский, А.А. Чистяков // Цветные металлы. 2006. № 11. С. 33–41.
- Черемисина О.В. Гидрометаллургический способ получения чистых оксидов цинка и германия из шлаков медно-свинцового производства / Д.Э. Чиркст, О.В.Черемисина, А.А. Чистяков// Известия вузов. Цветная металлургия. 2008. № 5. С. 37-43.
- Черемисина О.В. Изучение сорбции германия, цинка и свинца на анионите / А.А. Чистяков, Д.Э. Чиркст, О.В.Черемисина // Цветные металлы. № 6. 2009. С. 93-99.
- Черемисина О.В. Горный институт – колыбель первой в России химической научной школы / Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова // Цветные металлы. 2003. № 10. С. 4 – 8.
- Черемисина О.В. Термодинамика гетерогенных процессов в гидрометаллургии и экологии / Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова // Цветные металлы. 2003. № 7. С. 106 – 111.
- Черемисина О.В. Исследование кристаллизации фосфата церия в присутствии фосфата кальция. / И.А. Дибров, Д.Э. Чиркст, О.В. Черемисина, И.В. Мелихов, В.Н. Рудин // Журнал прикладной химии. 1990. Т. 63. № 9. С. 1970-1976.
- Черемисина О.В. Некоторые закономерности кристаллизации фосфата церия (III) из фосфатных растворов / Д.Э. Чиркст, И.В. Мелихов, И.А. Дибров, О.В. Черемисина // Журнал прикладной химии. 1990. Т. 63. № 9. С. 2044-2047.
- Черемисина О.В. Формы кристаллизации лантаноидов из экстракционной фосфорной кислоты / Д.Э. Чиркст, О.В.Черемисина, И.В. Мелихов, Л.Н. Сыркин, К.Н. Чалиян // Журнал прикладной химии. 1991. № 12. С. 2576-2581.
- Черемисина О.В. Растворимость фосфата церия (III) в фосфорной кислоте / Д.Э.Чиркст, И.А.Дибров, О.В. Черемисина, И.В. Мелихов // Журнал физической химии. 1991. Т. 65. № 8. С. 2180-2183.
- Черемисина О.В. Изучение растворимости фосфата и фторида лантаноидов в фосфорнокислых растворах сложного солевого состава / Д.Э.Чиркст, К.Н.Чалиян, О.В. Черемисина// Журнал прикладной химии. 1993. Т. 66. № 9. С. 1927-1933.
- Черемисина О.В. Кинетика кристаллизации фосфатов и фторидов лантаноидов из экстракционной фосфорной кислоты/ И.А. Дибров, Д.Э. Чиркст, О.В.Черемисина// Журнал прикладной химии. 1999. Т. 72. № 5. С. 739-744.
- Черемисина О.В. Извлечение редких металлов и радионуклидов из бедного сырья и грунтов/ Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова// Записки Горного института. 2001. Т. 147. С.186-193.
- Черемисина О.В. Опытная технология дезактивации грунтов, загрязненных радионуклидом стронцием-90 / Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова, М.И. Стрелецкая // Радиохимия. 2001. Т. 43. № 5. С. 575 - 478.
- Черемисина О.В. Поведение цезия в процессе дезактивации грунта 5-го квартала Васильевского острова / Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова, М.И. Стрелецкая, М.В. Иванов // Радиохимия. 2002. Т. 44. С. 378-381.
- Черемисина О.В. Физико-химическое обоснование дезактивации 5-го квартала Васильевского острова Санкт-Петербурга от загрязнения стронцием-90 / Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова, М.В. Иванов //Записки Горного института. 2003. Т. 154. С. 32 - 37.
- Черемисина О.В. Определение поверхности минералов методами сорбции метиленового голубого и тепловой десорбции аргона / Д.Э. Чиркст, О.В. Черемисина, И.С. Красоткин, М.И.Стрелецкая, М.В.Иванов // Журнал прикладной химии. 2003. Т. 76. № 4. С. 687 – 689.
- Черемисина О.В. Термодинамическое исследование сорбции катионов железа (3+) на глине / Д.Э.Чиркст, О.В. Черемисина, Т.Е.Литвинова, М.В.Иванов, Н.А.Мироненкова // Журнал прикладной химии. 2003. Т. 76. № 6. С. 922 – 925.
- Черемисина О.В. Изотерма сорбции катионов стронция на глине / Д.Э.Чиркст, О.В. Черемисина, М.В. Иванов, Н.А. Мироненкова // Журнал прикладной химии. 2003. Т. 76. № 5. С. 755-758.
- Черемисина О.В. Изотерма обмена ионов стронция и железа (3+) на глине / Д.Э. Чиркст, О.В.Черемисина, Т.Е. Литвинова, М.В. Иванов // Журнал прикладной химии. 2004. Т. 77. С. 580-582.
- Черемисина О.В. Сорбция железа (2+) железомарганцевыми конкрециями / Д.Э. Чиркст, О.В.Черемисина, М.В. Иванов, И.Т. Жадовский // Журнал прикладной химии. 2005. Т. 78. № 4. С. 599-605.
- Черемисина О.В. Изотерма обмена катионов никеля и натрия на железомарганцевых конкрециях/ Д.Э. Чиркст, О.В.Черемисина, М.В. Иванов, А.А. Чистяков, И.Т. Жадовский // Журнал прикладной химии. 2006. Т. 79. № 7. С. 1101-1105.
- Черемисина О.В. Термодинамический расчет растворимости фосфатов редкоземельных металлов при различной температуре и концентрациях ортофосфорной кислоты / О.В.Черемисина, Д.Э. Чиркст // Записки Горного института. 2006. Т. 169. С. 219–227.
- Черемисина О.В. Изотерма обмена катионов стронция и натрия на железомарганцевых конкрециях / Д.Э. Чиркст, О.В. Черемисина, М.В. Иванов, И.Т. Жадовский // Журнал прикладной химии. 2006. Т. 79. № 3. С. 374 – 377.
- Черемисина О.В. Кинетика сорбции катионов никеля железомарганцевыми конкрециями / Д.Э. Чиркст, О.В. Черемисина, М.В. Иванов, А.А. Чистяков, И.Т. Жадовский // Известие вузов. Химия и хим. технология. 2006. Т. 49. № 11. С. 81 – 86.
- Cheremisina O. Thermodynamic probe of dissolubility of a phosphate of cerium (III) at different temperatures and concentrations orthophosphates acids. Technische Universitt Bergakademie Freiberg. Freiberger Forschungshefte. 2007. S. 169-172.
- Черемисина О.В. Кинетика сорбции катионов стронция железомарганцевыми конкрециями / Д.Э. Чиркст, О.В.Черемисина, А.А. Чистяков, И.Т. Жадовский // Известия вузов. Химия и хим. технология. 2008. Т. 51. № 3. С. 40-45.
- Черемисина О.В. Влияние температуры на сорбцию германия на анионите / Д.Э. Чиркст, А.А. Чистяков, О.В. Черемисина // Журнал физической химии. 2008. Т. 82. № 12. С. 2382-2387.
- Cheremisina O. Deactivation ground a method of an ionic exchange. Technische Universitt Bergakademie Freiberg. Freiberger Forschungshefte. 2008. S. 148-152.
- Черемисина О.В. Изотерма обмена катионов натрия и меди на железомарганцевых конкрециях / Д.Э. Чиркст, О.В.Черемисина, М.В. Иванов, А.А. Чистяков, И.Т. Жадовский // Журнал прикладной химии. 2009. Т. 82. № 2. С. 238-242.

