Роль вязко-эластических свойств глаза в определении давления цели и оценке развития глаукоматозного процесса
На правах рукописи
АРУТЮНЯН ЛУСИНЕ ЛЕВОНОВНА
РОЛЬ ВЯЗКО-ЭЛАСТИЧЕСКИХ СВОЙСТВ ГЛАЗА
В ОПРЕДЕЛЕНИИ ДАВЛЕНИЯ ЦЕЛИ И ОЦЕНКЕ РАЗВИТИЯ ГЛАУКОМАТОЗНОГО ПРОЦЕССА
14.00.08 – глазные болезни
01.02.08 – биомеханика
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2009
Работа выполнена в ФГУ «Московский научно-исследовательский институт глазных болезней им. Гельмгольца Росмедтехнологий» (директор – заслуженный деятель науки РФ, д.м.н., профессор В.В. Нероев).
Научные руководители:
доктор медицинских наук, профессор Катаргина Людмила Анатольевна
доктор биологических наук Иомдина Елена Наумовна
Официальные оппоненты:
доктор медицинских наук, профессор Степанов Анатолий Викторович
доктор медицинских наук, профессор Бейдик Олег Викторович
Ведущая организация: ГУ НИИ глазных болезней Российской академии медицинских наук.
Защита состоится 10 марта 2009 г. в 14 часов на заседании диссертационного совета Д 208.042.01 при ФГУ «МНИИ глазных болезней им. Гельмгольца Росмедтехнологий» (105062, г. Москва, ул. Садовая - Черногрязская, д.14/19).
С диссертацией можно ознакомиться в научной библиотеке ФГУ «МНИИ глазных болезней им. Гельмгольца Росмедтехнологий».
Автореферат разослан «____»________2009.
Ученый секретарь
диссертационного совета
доктор медицинских наук И.А. Филатова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Последние исследования, проведенные специалистами из Университета Джона Хопкинса (США), свидетельствуют о том, что глаукома является второй по значимости причиной слепоты в мире. H.A. Quigley с соавт. (2006) прогнозируют число больных глаукомой к 2010 году в 60,5 млн. человек, а к 2020 году 79,6 млн. В России также установлен значительный рост заболеваемости глаукомой – с 1,7 до 4,7 и уровня первичной инвалидности с 0,17 до 0,81 (на 1000 человек населения) (Е.С. Либман с соавт., 2000). Актуальность проблемы возрастает в связи с поражением населения трудоспособного возраста. Доля глаукомы в нозологической структуре первичной инвалидности в России по причине заболеваний глаз увеличилась с 14% в 1997 г. до 24% в 2002 г (Е.С. Либман с соавт., 2004). Такой уровень распространённости глаукомы во всём мире и её ведущее место в структуре необратимой слепоты и слабовидения делают это заболевание особенно важным с медико-социальных позиций.
При первичной открытоугольной глаукоме (ПОУГ) ориентиром эффективности лечения служит поиск такого индивидуального целевого давления, которое при минимальных лечебных воздействиях и приемлемых затратах способно обеспечить сохранность имеющегося зрения для улучшения качества жизни пациента. Признавая клинический полиморфизм ПОУГ и многофакторность причин распада зрительных функций, основным фактором в развитии необратимых глаукоматозных изменений сетчатки и зрительного нерва совершенно очевидно следует считать повышение уровня офтальмотонуса выше толерантного. И до тех пор, пока не будут известны все звенья патогенеза ПОУГ, усилия, направленные на достижение давления цели, следует считать оправданными. Индивидуальный подход при определении целевого давления предполагает учет множества существующих факторов риска. Одним из них является прочность (биомеханическая устойчивость) соединительно-тканных структур глаза (В.В. Волков, 2004). При развитии ПОУГ клинически достоверно наблюдается значительное постепенное истончение склеры (Н.И. Затулина, 1988). А.И. Симановский (2005), сопоставив эти данные с данными В.В. Волкова о визуально наблюдаемом изменении экскавации ДЗН по мере развития глаукомы, предполагает, что изменение биомеханических свойств склеры происходит синхронно с истончением решетчатой мембраны склеры. Те же тенденции наблюдаются и в отношении снижения толщины роговицы (И.И. Коган, 1999; EGPS, 2006; F. Rufer, 2007). Развитие некомпенсированной ПОУГ сопровождается патологическим ускорением естественных геронтологических процессов изменения эластичности и упругости оболочек глаза (В.И. Козлов, 1983; А.П. Нестеров, 1995; А.И. Симановский, 2005; И.Н. Кошиц с соавт., 2005). Согласно расчетам О.В. Светловой с соавт. (2002), ригидность здоровых и глаукомных глаз может отличаться в 3 раза. Выполненный Н.И. Затулиной с соавт. (2000) многофакторный клинический эксперимент с продолжительностью наблюдений в 15 лет позволил выдвинуть новую концепцию патогенеза ПОУГ, согласно которой начальным звеном в патогенезе глаукомы является нарастающая дезорганизация, деструкция соединительной ткани, как переднего, так и заднего отрезков глаза. Исследования последних лет показали, что патология решетчатой пластины коррелирует с изменениями свойств роговицы (D.A. Luce, 2005; N.G. Congdon, 2006). Клинические исследования, проведенные с помощью Ocular Response Analyzer (ORA), свидетельствуют о потенциальной значимости для развития ПОУГ не только толщины роговицы, но и ее биомеханических показателей – корнеального гистерезиса (КГ) и фактора резистентности роговицы (ФРР). Возможно, низкое значение КГ является независимым фактором возникновения и прогрессирования глаукоматозного процесса, отражающим результат «корнеального ремоделирования» при глаукоме, а повышение ФРР наблюдается в результате снижения эластичности роговицы под воздействием повышенного ВГД (N.G. Congdon, 2006; D.L. Rogers, 2007). Эти данные дают полное основание предполагать, что давление цели при ПОУГ зависит от индивидуальных биомеханических свойств корнеосклеральной капсулы глаза. Вместе с тем, целенаправленных исследований, доказывающих это предположение, до сих пор не проводилось.
Цель исследования
Оценка значимости биомеханических свойств роговицы для определения давления цели и прогноза динамики глаукоматозного процесса.
Задачи исследования
- Изучить характеристики биомеханических свойств роговицы в зависимости от стадии ПОУГ и уровня офтальмотонуса.
- Установить взаимосвязь состояния и динамики зрительных функций с характеристиками биомеханических свойств роговицы.
- Определить биомеханические критерии расчета целевого давления.
- Оценить диагностическую значимость биомеханических показателей роговицы при ПОУГ.
- На основании полученных данных разработать новые критерии диагностики глаукоматозного процесса и риска его прогрессирования.
Научная новизна
- Впервые проведен анализ результатов исследования биомеханических свойств корнеосклеральной оболочки глаза при разных стадиях ПОУГ и показана статистически значимая корреляционная зависимость биомеханических показателей и параметров ДЗН.
- Предложен новый метод определения целевого давления у больных с ПОУГ на основе исследования биомеханических показателей корнеосклеральной оболочки глаза.
- Предложена оригинальная формула расчета биомеханического коэффициента роговицы, определена клиническая значимость нового критерия для диагностики глаукомы и прогнозирования риска ее прогрессирования.
- Впервые установлено нарушение термомеханических свойств склеральной ткани (повышение уровня ее поперечной связанности) при развитии глаукомы, обуславливающее клиническое изменение биомеханических параметров корнеосклеральной оболочки глаза, что является важным звеном в понимании патогенеза глаукоматозного процесса и может стать основой для разработки новых методов лечения ПОУГ.
Практическая значимость
- Использование нового метода определения целевого давления, учитывающего индивидуальные биомеханические свойства корнеосклеральной оболочки глаза, позволит подобрать адекватную гипотензивную терапию, обеспечивающую стабилизацию глаукоматозного процесса и сохранность зрительных функций.
- Оригинальный биомеханический коэффициент, рассчитанный на основе предложенной формулы, позволит объективно оценить и своевременно диагностировать начальные глаукомные изменения и прогрессирование процесса.
- Выявленные биомеханические и биохимические особенности фиброзной капсулы глаза при ПОУГ могут служить основанием для разработки новых критериев диагностики и патогенетической терапии глаукомной оптической нейропатии.
Основные положения, выносимые на защиту
- Биомеханические параметры корнеосклеральной оболочки глаза при ПОУГ нарушены. Снижение биомеханического показателя – корнеального гистерезиса (КГ) – происходит параллельно с развитием патологических структурных изменений ДЗН, что свидетельствует о специфичности и чувствительности этого показателя.
- При КГ < 8,2 мм рт.ст. повышается риск прогрессирования глаукоматозного процесса и требуется коррекция гипотензивного режима.
- При определении целевого давления необходимо учитывать биомеханические параметры корнеосклеральной оболочки глазного яблока.
- При отсутствии изменений общепринятых клинико-функциональных характеристик снижение биомеханического коэффициента (БКрог <0,82) является серьезным основанием для постановки диагноза глаукомы.
- Вязко-эластические свойства корнеосклеральной капсулы (в частности, КГ) оказывают более сильное влияние на показатели тонометрии, чем центральная толщина роговицы (ЦТР). В связи с этим, роговично-компенсированное ВГД, определенное с учетом биомеханических свойств корнеосклеральной капсулы, меньше зависит от ЦТР, чем ВГД по Гольдману.
- Абсолютное значение ЦТР у конкретного пациента не может быть надежным диагностическим и прогностическим критерием дальнейшего течения глаукоматозного процесса.
- Прогрессирование ПОУГ приводит к формированию избыточных поперечных химических связей в коллагеновых структурах склеры, что повышает ее жесткость и клинически проявляется в снижении КГ.
Внедрение результатов работы в практику
Новый метод определения целевого давления у пациентов с ПОУГ и метод ранней диагностики глаукомы на основе нового параметра – биомеханического коэффициента внедрены в практику работы отделения глаукомы ФГУ «Московский научно-исследовательский институт глазных болезней им. Гельмгольца Росмедтехнологий».
Апробация работы
Материалы диссертации доложены на II Всероссийской научной конференции молодых ученых «Актуальные проблемы офтальмологии» (Москва, 2007); на конференции «Современные методы диагностики и лечения заболеваний роговицы и склеры» (телемост Москва-Нью-Йорк, 2007); на HRT клубе России – 2007 (Москва, 2007); на III Всероссийской научной конференции молодых ученых «Актуальные проблемы офтальмологии» (Москва, 2008); на симпозиуме «Биомеханика глаза», проведенном в рамках научно-практической конференции «Российский общенациональный офтальмологический форум» (Москва, 2008); на HRT клубе России – 2008 (Москва, 2008).
Публикации
По теме диссертации опубликовано 18 работ (из них 3 в центральной Российской печати и 4 в зарубежных изданиях). Получено два положительных решения от 24.10.08 по заявке на патент РФ № 2007144345 и от 05.11.08 по заявке на патент РФ № 2008102209.
Структура и объем диссертации
Диссертация изложена на 160 страницах машинописного текста, состоит из введения, обзора литературы, 4 глав собственных исследований, заключения, выводов и практических рекомендаций. Работа иллюстрирована 26 таблицами, 10 гистограммами и 36 рисунками. Список литературы содержит 200 источников (из них 44 – отечественных и 156 – иностранных).
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Проведено комплексное офтальмологическое обследование 238 лиц (311 глаз). Первая часть работы основана на анализе результатов однократного (поперечного) клинико-инструментального исследования офтальмологического статуса 193 глаз 155 пациентов, из них 74 мужчин (92 глаза) и 81 женщины (101 глаз). Средний возраст пациентов составил 67±8,4 года (от 40 до 84 лет). Во второй части работы проведен анализ результатов динамического обследования пациентов с подозрением на глаукому (26 пациентов, 32 глаза) и пациентов с глаукомой на фоне эффективной гипотензивной терапии (56 пациентов, 62 глаза). Длительность наблюдения составила от 6 месяцев до 2 лет. С целью изучения структурно-биомеханических и биохимических особенностей склеральной ткани глаукомных глаз у 28 пациентов (28 глаз) с различными стадиями глаукомы при проведении синустрабекулэктомии с профилактической задней трепанацией взяты образцы склеры. Средний возраст этих пациентов составил 67,4±2,3 года с разбросом от 52 до 81 года. Для сравнительной оценки полученных показателей проведено исследование биомеханических свойств оболочек глаза 29 лиц без офтальмопатологии (13 женщин и 16 мужчин, всего 58 глаз), которые составили контрольную группу. Средний возраст здоровых лиц не отличался от такового в группах наблюдения и составил 62,8±6,47 лет (от 41 года до 78 лет). Все больные были разделены на 4 группы. Первую группу составили пациенты с подозрением на глаукому, вторую – с I стадией ПОУГ, третью – со II стадией ПОУГ, четвертую группу составили пациенты с III стадией ПОУГ.
Офтальмологическое обследование: визо- и рефрактометрия, тонометрия по методу Маклакова, биомикроскопия, гониоскопия, офтальмоскопия, компьютерная периметрия, ретинальная томография диска зрительного нерва, ультразвуковое определение переднезадней оси глазного яблока (ПЗО), исследование биомеханических свойств роговицы.
Состояние полей зрения оценивали с помощью статической компьютерной периметрии на анализаторе Humphrey Visual Field Analyzer II (HFA II) 750 (Германия). Всем пациентам проводили центральный пороговый тест 30-2. Анализировали сумму пороговых значений светочувствительности сетчатки в каждом квадранте (децибел, дБ), а также среднестатистические показатели среднего отклонения (mean deviation, MD) и среднеквадратичного отклонения (pattern standart deviation, PSD).
Ретинотомографическое исследование проводили методом конфокальной сканирующей лазерной офтальмоскопии на приборе Heidelberg Retina Tomograph II (Heidelberg Engineering, Германия). Анализировали выдаваемые прибором 100 параметров, из которых 22 общих, характеризующих ДЗН в целом и 78 секторальных – по 13 параметров в каждом из 6 секторов.
Исследование вязко-эластических свойств роговицы проводили на анализаторе биомеханических свойств глаза (Ocular Response Analyzer, ORA, Reichert, США). Работа ORA основана на бесконтактной пневмотонометрии. В данном приборе в качестве внешнего воздействия используется быстрый воздушный импульс, а также специальная электронно-оптическая (инфракрасная) система для определения двух независимых аппланационных значений давления: при первом уплощении роговицы, двигающейся кзади, и при втором уплощении роговицы, возвращающейся к исходной конфигурации. Благодаря вязкому затуханию динамичного воздушного импульса в роговичной ткани происходит некоторая задержка второго уплощения роговицы, что приводит к регистрации двух различных значений давления. Среднее значение двух величин давления, согласно утверждению разработчиков ORA, соответствует показателю ВГД по Гольдману. Разность между этими двумя значениями давления является новым показателем, получившим название корнеальный гистерезис (КГ), который вычисляется по формуле КГ=0,149(Р1-Р2), где P1 первое аппланационное значение давления, P2 – второе аппланационное значение давления. Дополнительный биомеханический параметр, который ORA на основании проведенных измерений рассчитывает с помощью специального алгоритма, назван фактором резистентности роговицы (ФРР). Формула его расчета выглядит следующим образом: ФРР=0,149(P1-0,7P2). ФРР служит показателем суммарной сопротивляемости роговицы. Для расчета роговично-компенсированного ВГД (ВГДрк) используются данные измерений и специальный алгоритм, учитывающий вязко-эластические свойства роговицы: ВГДрк=P2-0.43P1. Результаты измерения, помимо числовых значений в мм рт.ст., отображаются на мониторе прибора в виде корнеограммы. Встроенный ультразвуковой пахиметр дает возможность измерения центральной толщины роговицы (ЦТР).
Для оценки структурных (термомеханических) показателей склеры использовали современный высокотехнологичный метод дифференциальной сканирующей калориметрии (ДСК). Аминокислотный состав упаренного гидролизата склеры определяли с помощью аминокислотного анализатора (Hitachi-835, Япония) с предварительным катионообменным разделением и последующей фотометрической реакцией с нингидрином. Данные исследования проведены совместно с сотрудниками МГУ им. Ломоносова канд. хим. наук Н.Ю. Игнатьевой и Н.А. Даниловым.
Статистическую обработку данных проводили с применением методов параметрической и непараметрической статистики. При этом рассчитывали средние значения, стандартное отклонение, стандартную ошибку, медиану, 25-ый и 75-ый процентили, минимальное и максимальное значение параметров, 95% доверительный интервал распределения показателей. Проводили непараметрический сравнительный анализ независимых групп ANOVA по критериям Манна-Уитни и Крускал-Уоллиса, корреляционный анализ по Спирмену (коэффициент ранговой корреляции R) с использованием программного пакета Statistica 6.0, StatSoft, inc.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В контрольной группе здоровых добровольцев с помощью ORA получена информация о нормальном уровне роговично-компенсированного офтальмотонуса и определены другие важные параметры, характеризующие вязко-эластические свойства роговицы – КГ и ФРР (табл. 1). В здоровых глазах значения КГ и ФРР варьируют, составляя в среднем 10,58±1,4 и 10,64±1,65 мм рт.ст., соответственно. ЦТР в этой группе составила 546±26 мкм.
Измерение этих показателей, особенно КГ, дает возможность судить о биомеханических свойствах роговицы и об индивидуальной восприимчивости структур глаза к длительно существующему уровню внутриглазного давления. Выявленная положительная корреляция между КГ и ЦТР (R=0,464, р<0,045) говорит о логичном увеличении сопротивляемости роговицы механическим нагрузкам, в том числе ВГД, с увеличением ее толщины. В то же время КГ, как показатель, отражающий биомеханические свойства роговицы, влияет на индивидуальные показатели ВГД в большей степени, чем ЦТР.
Широкий разброс показателей КГ и ЦТР в группе здоровых лиц и соответствие тонким роговицам относительно низких значений корнеального гистерезиса предопределило актуальность такой комплексной оценки биомеханического статуса роговицы, которая позволила бы учесть как количественные, так и качественные показатели ткани роговицы, то есть ЦТР и КГ. В связи с этим нами была предложена формула определения нового параметра – биомеханического коэффициента роговицы (БКрог):
БКрог = КГ/ЦТРх50.
По предлагаемой формуле рассчитан биомеханический коэффициент роговицы в контрольной группе. Его значения варьируют от 0,82 до 1,21, в среднем БКрог = 0,98±0,09. На рис. 1 и 2 показана положительная корреляционная зависимость между КГ и ЦТР и отсутствие зависимости между БКрог и ЦТР. Анализ результатов определения БКрог в контрольной группе и у пациентов с различными стадиями глаукомы позволил предположить, что при его значениях ниже 0,82 с высокой долей вероятности можно прогнозировать развитие и прогрессирование глаукомы (положительное решение от 05.11.08 по заявке на патент РФ № 2008102209 «Способ прогнозирования риска развития и прогрессирования глаукомы»).
В дальнейшем исследовании мы оценили клиническую и диагностическую ценность предложенного коэффициента при подозрении на глаукому. Результаты динамического наблюдения группы пациентов с подозрением на глаукому показали необоснованность диагноза у лиц с высоким значением КГ, нормальным значением БКрог и толстой роговицей. ВГДрк у этих пациентов оказалось ниже ВГДГ. Обследование в динамике показало отсутствие изменений в исследуемых параметрах.
У 10 пациентов при сохранной светочувствительности и анатомо-топографических параметрах головки зрительного нерва биомеханический коэффициент был ниже 0,82 (0,63-0,82). Значения КГ у этих пациентов варьировали от низких до нормальных (7,1-9,8 мм рт.ст.). ЦТР составила 494-584 мкм. Значение ВГДГ определилось 15,5±2,2 мм рт.ст., что в среднем на 3,6 мм рт.ст. меньше ВГДрк (19,1±2,2 мм рт.ст.). В данной ситуации БК оказался единственным сниженным параметром (р<0,05), что позволило предположить ценность этого показателя для ранней диагностики глаукомы. Через 6 и 18 месяцев у шести пациентов определилась депрессия пороговой светочувствительности и сглаживание профиля ретинальной поверхности. Это послужило основанием для установления диагноза глаукомы и подтвердило диагностическую и прогностическую значимость биомеханического коэффициента. Таким образом, показана обоснованность отнесения пациентов к группе риска развития глаукомы при значениях КГ ниже 8,3 мм рт.ст. и БКрог ниже 0,82, несмотря на нормальные показатели компьютерной периметрии и ретинальной томографии.
На следующем этапе работы мы оценили исследуемые структурно-функциональные и биомеханические показатели при разных стадиях глаукомы. Медианы и процентили всех параметров в зависимости от стадии ПОУГ представлены в табл. 1.
Таблица 1
| Группы | Показатели, медиана (процентиль Q25-Q75) | |||||
| Возраст, годы | ВГДГ мм рт.ст. | ВГДрк мм рт.ст. | ЦТР мкм | КГ мм рт.ст. | ФРР мм рт.ст. | |
| Подозрение на глаукому | 51 (51-67) | 18,9 (16,5-20,6) | 19,1 (18,5-20,3) | 586 (524-597) | 10,4 (7,8-10,8) | 11,8 (8,4-12,5) |
| I стадия ПОУГ | 66 (59-68) | 16,4 (14,3-18,3) | 16,8 (14,3-19,8) | 537 (523-551) | 10,1 (8,2-10,8) | 10,3 (9,4-11,6) |
| II стадия ПОУГ | 69 (67-74) | 16,0 (14,7-18,8) | 18,5 (16,7-20,2) | 535 (509-554) | 9,1 (8,3-10,1) | 9,4 (8,7-10,7) |
| III стадия ПОУГ | 74 (66-76) | 15,1 (12,6-17,1) | 17,4 (15,1-20,4) | 524 (496-541) | 8,6 (7,7-9,6) | 8,7 (7,8-9,6) |
| Контрольная группа | 61,5 (52-72) | 15,4 (12,2-18,9) | 15,05 (12,2-19,1) | 548 (521-564) | 10,5 (9,5-11,3) | 10,7 (9,2-11,9) |
Значения биомеханических параметров в зависимости от стадии ПОУГ
В группе с I стадией ПОУГ среднее значение ЦТР составило 541±23 мкм, при этом в 68% глаз этой группы толщина роговицы укладывается в диапазон средних значений. В остальных случаях поровну, по 16%, было глаз, имевших тонкую и толстую роговицу. Среднее значение КГ составило 9,9±1,4 мм рт.ст., что несколько ниже его значений в контрольной группе (р<0,219). Однако процентное распределение значений данного показателя отличается от такового у здоровых лиц контрольной группы, в которой значений КГ меньше 8,2 мм рт.ст. не отмечено, а КГ более 10 мм рт.ст. получен в 65% случаев. В исследуемой группе КГ более 10 мм рт.ст. выявлен лишь в 45% случаев, а низкие значения КГ (< 8,2 мм рт.ст.) определены в 16% случаев. Это показывает, что, несмотря на нормальные цифры ВГД, у данных пациентов индивидуальные целевые значения давления не достигнуты. У пациентов с начальной стадией глаукомы отмечено соответствие высоким значениям КГ лучших морфометрических характеристик ДЗН. На глазах с выраженными структурными изменениями ДЗН БКрог был низким, что позволяет сделать заключение о его прогностической значимости. В соответствии с низкими значениями БКрог у 23% пациентов этой группы можно прогнозировать повышенный риск прогрессирования глаукомы.
В группе со II стадией ПОУГ среднее значение ЦТР составило 535±23 мкм. Распределение показателей ЦТР было следующим: тонкие роговицы– 34,8%, средние – 54,8%, толстые – 10,4%. Среднее значение КГ в этой группе составило 9,0±1,3 мм рт.ст., причем в большей части случаев (57,9%) показатель КГ был 8,3-10,1 мм рт.ст., тогда как в контрольной группе в 65% случаев значения КГ были в пределах 10-12 мм рт.ст и даже выше (в среднем 10,48±1,4 мм рт.ст.). У 21,4% пациентов значения КГ были ниже 8,2 мм рт.ст. и составили 5,5-8,1 мм рт.ст., то есть, несмотря на нормальные цифры ВГД, целевое давление у этих пациентов не достигнуто. Низкие значения БКрог у 34% пациентов этой группы свидетельствовали о повышенном риске прогрессирования глаукомы. В группе со II стадией ПОУГ появляются высокие и статистически достоверные отрицательные коэффициенты корреляции между КГ и объемными соотношениями экскавации, чего не наблюдалось при I стадии глаукомы. Очевидно, более серьезные патологические структурные изменения ДЗН в продвинутых стадиях глаукомы протекают параллельно с более выраженными изменениями биомеханических свойств склеры, что проявляется в снижении корнеального гистерезиса, повышая специфичность и чувствительность этого показателя.
В группе с III стадией ПОУГ среднее значение ЦТР составило 526±24 мкм. Необходимо отметить, что в III стадии ПОУГ, по сравнению с I и II, чаще встречаются тонкие роговицы и гораздо реже – толстые. Распределение показателей ЦТР было следующим: тонкие роговицы – 44,3%, средние – 52%, толстые – 3,7%. В этой группе появляется корреляция между ЦТР и морфометрическими параметрами ДЗН, чего не наблюдалось в группах с I и II стадиями. Отрицательный характер коэффициентов корреляции указывает на более выраженные патологические изменения структурных характеристик диска у пациентов с тонкой роговицей. В данной группе среднее значение КГ (8,4±1,3 мм рт.ст) оказалось ниже, чем в I и II стадиях. Причем в 37,5% случаев КГ был ниже 8,2 мм рт.ст. и только в 17% был выше 10 мм рт.ст. Значит, у 37,5% пациентов с III стадией ПОУГ и нормальным ВГД индивидуальное целевое давление не достигнуто, а в 47,5% случаев, соответственно значениям БКрог, можно предположить высокую вероятность дальнейшего прогрессирования глаукоматозного процесса.
Сравнительный анализ клинической значимости КГ у пациентов с ПОУГ выявил отсутствие зависимости исследуемого параметра от биометрических характеристик глаза. Это означает, что КГ является новым детерминированным параметром, характеризующим биомеханические свойства роговицы.
Анализ зависимости КГ от стадии ПОУГ выявил статистически значимое снижение этого показателя при прогрессировании глаукоматозного процесса (рис. 3). Значения КГ достоверно отличаются в I и II (p<0,0007), II и III (p<0,03), I и III стадиях (p<0,0001) (достоверность различий определена по U-критерию Манна-Уитни). Это закономерное снижение КГ показывает, что при глаукоме имеет место изменение биомеханических свойств корнеосклеральной капсулы, или ее ремоделирование, которое усугубляется по мере развития глаукоматозного процесса.

Рис. 3. КГ при разных стадиях ПОУГ
Статистически достоверные коэффициенты корреляции отмечаются между КГ и морфометрическими параметрами ДЗН в верхне-височном (R=0,33, p<0,0001 для площади экскавации) и верхне-носовом (R=0,34, p<0,002 для площади НРП) секторах. Из этого следует, что КГ как биомеханический показатель состояния корнеосклеральной оболочки, может предопределять появление специфичных структурных изменений в ДЗН. Регрессионный анализ по Морфилду показал, что низкие значения КГ коррелируют с более выраженным истончением нейроретинального пояска (НРП) в верхне-височном секторе.
Достоверная корреляция КГ и периметрических индексов (R=0,41, p<0,0001 для MD, R=0,20, p<0,034 для PSD) свидетельствует о том, что у пациентов со сниженными биомеханическими характеристиками вероятность появления дефектов в нижних квадрантах поля зрения, топографически соответствующих структурным изменениям ДЗН в верхне-височном и верхне-носовом секторах, намного выше, чем при нормальном биомеханическом статусе корнеосклеральной оболочки. Таким образом, при ПОУГ существует корреляционное соответствие между уровнем КГ и состоянием структурно-функциональных параметров глаза (табл. 2).
Таблица 2
Морфометрические и функциональные параметры зрительного нерва при разных значениях КГ
| Медиана параметров (процентили Q25-Q75) | ||||||
| rim area | cup/disc area ratio | cup shape measure | linear cup/disc ratio | MD | PSD | |
| I группа КГ 8,3-12,5 мм рт.ст. | 1,468 (1,342-1,654) | 0,258 (0,125-0,317) | -0,181 (-0,230- -0,127) | 0,408 (0,189-0,265) | -3,9 (-6,3- -1,6) | 2,4 (1,8-4,2) |
| II группа КГ 5,5-8,2 мм рт.ст. | 1,154 (0,887-1,458) | 0,423 (0,199-0,589) | -0,118 (-0,247- -0,050) | 0,689 (0,130-0,268) | -6,7 (-12,7- -3,9) | 5,2 (2,9-9,7) |
| *p<, статистическая значимость разницы | 0,01 | 0,02 | 0,04 | 0,02 | 0,058 | 0,039 |
*p<0,05 соответствует достоверной разнице по Uкритерию Манна Уитни
На основании динамического изучения КГ и морфофункциональных показателей состояния зрительного нерва у пациентов с идентичными исходными значениями ВГДГ выявлена обратная корреляция КГ и прогрессирования ГОН. В течение 6-24 месяцев у 67% больных с низким значением КГ произошло снижение светочувствительности сетчатки, что характеризуется уменьшением периметрического индекса MD. Динамика параметра в течение срока наблюдения представлена на рис. 4.
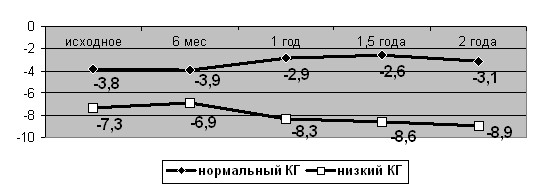
Рис. 4. Динамика периметрического индекса MD в группах с разными значениями КГ
У 71% пациентов этой же группы увеличилось количество и размеры локальных дефектов. Об этом можно судить по динамике периметрического индекса PSD (рис. 5). Средние изменения функциональных показателей в группе с низким значением КГ составили от 38 до 100%.

Рис. 5. Динамика периметрического индекса PSD в группах с разными значениями КГ
Анализ изменений ретиномографических показателей выявил, что в подгруппе с низким КГ в наибольшей степени уменьшилась средняя толщина слоя нервных волокон (ТСНВ) сетчатки и площадь его поперечного сечения, несмотря на то, что изначально эти параметры в подгруппах различались статистически недостоверно (рис. 6).

Рис. 6. Динамика ТСНВ в группах с разными значениями КГ
Прогрессирование глаукомы у пациентов с низким значением КГ отразилось в изменении модуляции контурной линии в нижне-височном секторе. Это дает основание предположить, что прогрессирование структурных изменений ДЗН начинается именно с данного сектора. Значимо увеличилось соотношение вертикального размера экскавации и диска зрительного нерва (рис. 7). У больных с нормальным значением КГ изменение структурных и функциональных параметров было незначительным и не носило достоверного характера.
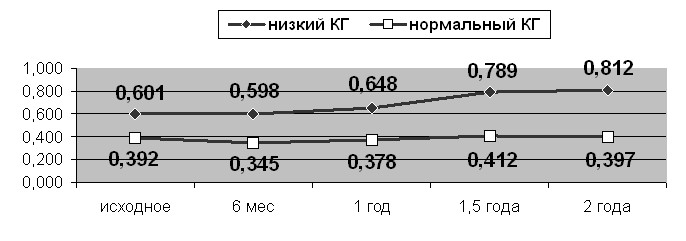
Рис. 7. Динамика вертикального размера экскавации в группах с разными значениями КГ
Результаты обследования контрольной группы показали, что значение КГ остается относительно постоянным при различных уровнях ВГДГ, что демонстрирует независимость этого показателя от давления в здоровых глазах. Однако при анализе корреляции КГ и давления в группах с глаукомой получена абсолютно разная зависимость при компенсированном и высоком давлении. При компенсированном давлении КГ не коррелирует с ВГДГ (R=0,08, p<0,33), а при высоком давлении имеется достоверно высокая отрицательная корреляция (R= 0,68, p<0,0001). Это значит, что при компенсированном давлении определение ВГДГ не дает возможности судить о биомеханическом статусе роговицы. В то же время ВГДрк в значительной степени учитывает состояние корнеосклеральной капсулы, поскольку между ВГДрк и КГ имеется высокая и статистически достоверная отрицательная корреляция как при компенсированном, так и при некомпенсированном давлении (R=0,67, p<0,0001). Это свидетельствует об изменении вязко-эластических свойств роговицы под воздействием ВГД выше целевого уровня. При ПОУГ с высоким давлением эта зависимость клинически не существенна, так как и ВГДрк и ВГДГ находятся в обратной зависимости от КГ. В то же время при ПОУГ с нормализованным давлением значения КГ играют определяющую роль для получения истинной величины ВГД.
Напряжение роговицы, как вязкоупругого материала, и, соответственно, уравновешивающее ее внутриглазное давление, резко возрастают при увеличении вязкого компонента. Поскольку величина КГ обратно пропорциональна значению именно этого компонента, что подтверждают полученные нами высокие отрицательные коэффициенты корреляции между КГ и ВГД, давлению цели будут соответствовать высокие значения КГ. В этом случае вязкоупругий компонент напряжения становится минимальным и не оказывает существенного влияния на величину измеряемого давления. Это необходимо учитывать как при определении давления цели, так и при оценке эффективности проводимого гипотензивного лечения. Данное представление легло в основу определения давления цели новым методом (положительное решение от 24.10.2008 по заявке на патент № 2007144345 «Способ определения целевого давления при первичной открытоугольной глаукоме»). Суть метода заключается в оценке показателя КГ: низкие его значения (менее 8,2 мм рт.ст.) свидетельствуют об отсутствии нормализации ВГД и о необходимости коррекции гипотензивной терапии. Целевым следует считать ВГД, соответствующее нормальному значению КГ.
Ретроспективный анализ достоверности нового метода определения целевого давления проведен по результатам динамического обследования 23 пациентов с низким КГ, ВГД меньше 21 мм рт.ст. и прогрессированием глаукоматозного процесса. У этих пациентов гипотензивная терапия была откорригирована с учетом биомеханических показателей. У 20 пациентов (87%) в результате лечения были получены нормальные цифры КГ, и динамическое наблюдение в течение 1,5-2 лет показало стабильность структурно-функциональных параметров ДЗН, что подтверждает достижение давления цели у этих пациентов. Только у 3 пациентов (13%) даже в результате максимально возможной гипотензивной терапии значения КГ не превысили 8,2 мм рт.ст., и у двоих из них в результате прогрессирования глаукомы возникла клиническая необходимость оперативного вмешательства.
На рис. 8б показана корнеограмма пациента на фоне гипотензивной терапии, откорригированной с учетом биомеханических параметров корнеосклеральной оболочки. Это привело к уменьшению вязкого компонента напряжения и, как следствие, к увеличению КГ и биомеханического коэффициента. Динамическое наблюдение показало стабилизацию процесса у данного пациента.
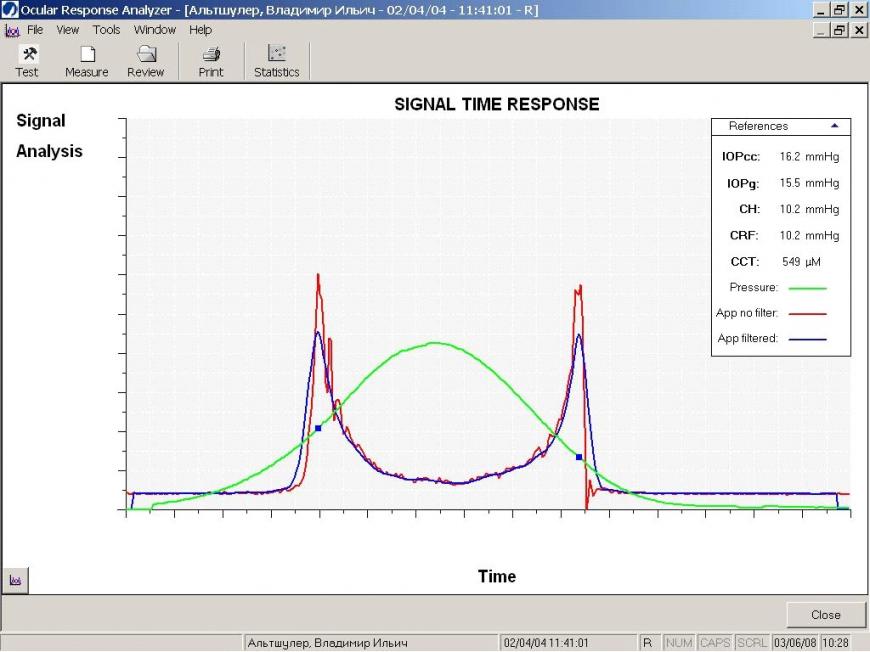

Рис. 8. Корнеограммы пациента до (а) и после терапии, откорригированной с учетом биомеханических показателей корнеосклеральной оболочки глаза (б)
В ходе сравнительного анализа клинической значимости ЦТР у пациентов с ПОУГ была выявлена недооценка тонометрических данных при наличии тонкой роговицы и завышение показателей ВГД у пациентов с толстой роговицей, что свидетельствует о необходимости измерения ЦТР для выяснения корректности данных тонометрии. Наши данные показали, что ВГДрк меньше зависит от ЦТР, чем ВГДГ. Представляют интерес процентные соотношения тонких, средних и толстых роговиц в различных стадиях глаукомы. В III стадии почти в 3 раза больше пациентов с тонкой роговицей (I стадия – 16%, III стадия – 44,3%), и лишь у единичных пациентов была толстая роговица (рис. 9).
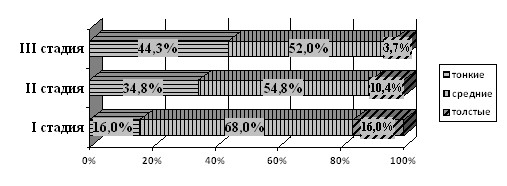
Рис. 9. Процентные соотношения толщины роговицы в группах пациентов
с разными стадиями ПОУГ
Оценка структурно-функциональных показателей глаз пациентов с тонкой, средней и толстой роговицей показала, что у пациентов со средней и толстой роговицей не было различий ни в структурных, ни в функциональных параметрах (p<0,5-0,9). При сравнении показателей у пациентов с тонкой и средней роговицей обнаружилась статистически достоверная разница в периметрических и некоторых морфометрических параметрах (табл. 3).
Таблица 3
Структурно-функциональные параметры у пациентов с ПОУГ с тонкой и средней роговицей
| Функционально-структурные параметры | Медиана значений при тонкой роговице | Медиана значений при средней роговице | *p<, статистическая значимость разницы |
| rim area (mm2) | 1,215 | 1,433 | 0,033 |
| cup shape measure | -0,094 | -0,165 | 0,043 |
| MFC tmp/sup | 102,667 | 102,256 | 0,033 |
| MD (dB) | -10,07 | -5,48 | 0,003 |
| PSD (dB) | 6,45 | 3,89 | 0,003 |
*p<0,05 соответствует достоверной разнице по Uкритерию Манна-Уитни
Полученные данные свидетельствуют о том, что толщина роговицы имеет относительную прогностическую значимость в отношении появления локальных дефектов в нижней полусфере центрального поля зрения. Анализ взаимоотношений ЦТР с ретинотомографическими параметрами выявил ее связь с уменьшением площади НРП в височном секторе, с изменением объемного профиля экскавации в верхне-носовом секторе, а также с изменением соотношения площади экскавации и площади диска.
Это могло дать основание считать, что у пациентов с тонкой роговицей вероятность прогрессирования глаукоматозного процесса намного выше. Однако два факта вызывают сомнения в истинности данного предположения. Во-первых, это отсутствие корреляции толщины роговицы и структурно-функциональных параметров в начальной стадии и ее появление только при далекозашедшей глаукоме. Во-вторых, отсутствие в динамике у пациентов с исходно тонкой роговицей прогрессирования глаукоматозного процесса. Возможно, что толщина роговицы уменьшается в процессе прогрессирования глаукомы. Для доказательства этого предположения требуется длительное динамическое наблюдение. Таким образом, несмотря на общую тенденцию снижения доли толстых роговиц по мере развития глаукоматозного поражения, абсолютное значение ЦТР у конкретного пациента не может быть надежным диагностическим и прогностическим критерием дальнейшего течения процесса.
Изменения биомеханических показателей корнеосклеральной капсулы при ПОУГ, выявленные нами клинически, могут быть обусловлены нарушением структурной организации этой соединительной ткани, а именно избыточным формированием ковалентных поперечных внутри- и межмолекулярных связей в коллагеновых структурах. Для проверки этой гипотезы мы провели термомеханический анализ образцов склеры глаз с различными стадиями глаукомы методом дифференциальной сканирующей калориметрии (ДСК) и выявили, что для начальной стадии глаукомы характерен эндотермический переход со средним температурным пиком Tm = 60,3±1,20C, в то время как при развитой и далеко зашедшей стадиях основной пик плавления коллагена склеры соответствует достоверно более высокой температуре Tm = 62,0±0,80C и Tm = 64,5±0,40C, соответственно (p<0,05) (рис. 10).
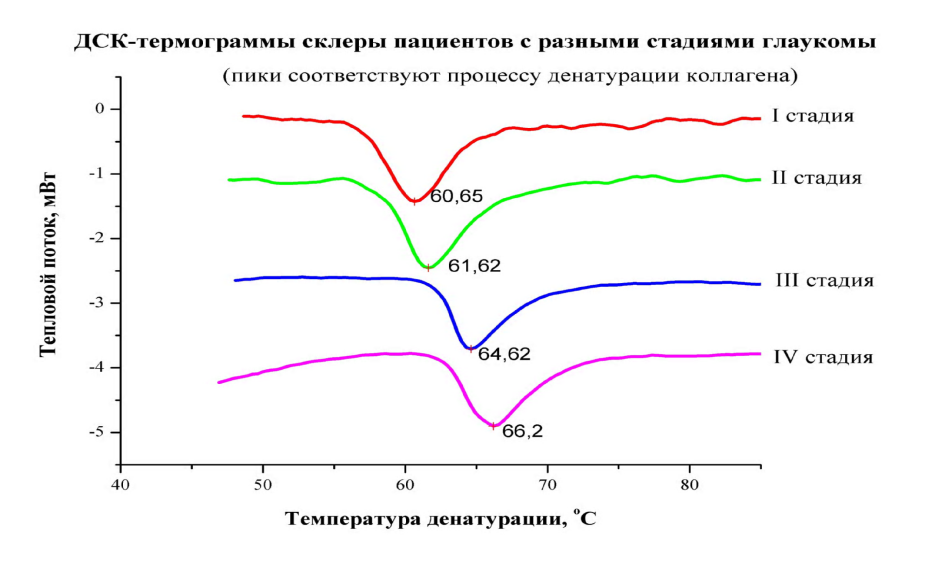
Рис. 10. ДСК-термограммы образцов склеры пациентов с ПОУГ
Полученные данные свидетельствуют о существенном возрастании уровня поперечной связанности склеры по мере прогрессирования глаукоматозного процесса, т.е. об изменении ее биомеханических характеристик в сторону увеличения жесткости.
Для более глубокого изучения биохимических сдвигов, лежащих в основе патологического поперечного связывания коллагена склеры глаз с глаукомой, нами был проанализирован ее аминокислотный состав. Обнаружено, что уровень коллагена склеры составил, соответственно, 45,9±1,1% при I стадии глаукомы, 50,8±0,9% при II и 53,7±0,4% при III стадии глаукомы. Эти значения существенно выше, чем полученные F. Keeley с соавт. (1984) при анализе нормальной склеры взрослого (39±4%). На основе аминокислотного анализа, а именно, по соответствующим соотношениям гидроксипролина к гидроксилизину (HYP/HYL) и глицина к аланину (GLY/ALA), впервые установлен типовой состав коллагена склеры глаукомных глаз. Во всех образцах соотношение GLY/ALA составило 2,74±0,2, а отношение HYP/HYL в I стадии составило 15,0±2,7, а в III стадии (за счет низкой доли гидроксилизина) 21,2±2,2, что указывает на присутствие в склере глаукомных глаз коллагена I типа и практическое отсутствие коллагена типов II и III. Снижение уровня гидроксилизина, очевидно, связано с частичной конверсией данной аминокислоты при посттрансляционной модификации в продукты гликации, что свидетельствует о формировании дополнительных поперечных сшивок. Наличие повышенного уровня поперечной связанности подтверждается также пониженным содержанием орнитина, который, в свою очередь, является продуктом гидролиза первичных сшивок.
Выявленная структурно-биомеханическая и биохимическая патология склеры глаз с глаукомой, а именно избыточное формирование в коллагеновых структурах поперечных химических связей, повышающих жесткость склеры, представляется существенным шагом в понимании патогенетических механизмов этого заболевания, и может служить основанием для разработки новых критериев диагностики и патогенетической терапии, направленной на регуляцию биомеханических характеристик склеры.
Выводы
- Клиническое изучение вязко-эластических свойств корнеосклеральной оболочки глаза показало их нарушение при ПОУГ. Установлено, что снижение биомеханического показателя – корнеального гистерезиса (КГ) – происходит параллельно с развитием патологических структурных изменений ДЗН, что свидетельствует о специфичности и чувствительности этого показателя.
- Впервые на основании динамического изучения КГ и морфофункциональных показателей состояния зрительного нерва обнаружена отрицательная корреляция между КГ и выраженностью ГОН. Установлено, что при КГ < 8,2 мм рт.ст. повышается риск прогрессирования глаукоматозного процесса и требуется коррекция гипотензивного режима.
- Показано, что корнеальный гистерезис определяется не только вязко-упругими свойствами корнеосклеральной капсулы, но и ее напряжением под действием ВГД. Установлена обратная зависимость между КГ и ВГД, что легло в основу определения давления цели новым методом. Целевым следует считает ВГД, соответствующее нормальному значению КГ (выше 8,2 мм рт.ст.).
- Предложен новый расчетный показатель – биомеханический коэффициент роговицы (БКрог), который не зависит от ее толщины. Определен разброс значений данного параметра в здоровой популяции (0,82-1,21) и выявлена высокая диагностическая и прогностическая ценность БКрог при подозрении на глаукому. При отсутствии изменений общепринятых клинико-функциональных характеристик снижение БКрог (<0,82) является основанием для постановки диагноза глаукомы.
- Вязко-эластические свойства корнеосклеральной капсулы (в частности, КГ) оказывают более значимое влияние на показатели тонометрии, чем ЦТР. В связи с этим, роговично-компенсированное ВГД, определенное с учетом биомеханических свойств корнеосклеральной капсулы, меньше зависит от ЦТР, чем ВГД по Гольдману.
- По мере прогрессирования глаукоматозного процесса существенно (почти в 3 раза) повышается доля тонких роговиц (I стадия – 16%, III стадия – 44,3%) и значительно снижается доля толстых роговиц (I стадия – 16%, III стадия – 3,7%). Однако абсолютное значение ЦТР у конкретного пациента не может быть надежным диагностическим и прогностическим критерием дальнейшего течения процесса, поскольку достоверной корреляции динамики морфофункциональных параметров зрительного нерва с толщиной роговицы не выявлено.
- Впервые проведенный термомеханический (определение температуры денатурации коллагена) и аминокислотный анализ склеры глаз с разными стадиями ПОУГ выявил существенное повышение уровня ее поперечной связанности по мере прогрессирования глаукоматозного процесса. Формирование при ПОУГ избыточных поперечных химических связей в коллагеновых структурах склеры повышает ее жесткость, что клинически проявляется в снижении КГ и БКрог, а также в нарушении морфофункциональных показателей ДЗН.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- При диагностике глаукомы помимо структурных, функциональных и тонометрических исследований необходимо проводить исследования биомеханических параметров корнеосклеральной оболочки.
- Для выяснения корректности тонометрических показателей необходимо измерять ЦТР, однако абсолютное значение ЦТР у конкретного пациента с ПОУГ не может быть надежным диагностическим и прогностическим признаком характера течения процесса.
- Определение значений корнеального гистерезиса позволяет правильно подобрать индивидуально переносимое давление и этим обеспечить стабилизацию глаукоматозного процесса.
- Значения КГ менее 8,2 мм рт.ст. свидетельствуют о необходимости коррекции гипотензивного режима.
- При подозрении на глаукому значимым диагностическим критерием, позволяющим объективно оценить и своевременно диагностировать начальные глаукомные изменения и прогрессирование процесса, является снижение биомеханического коэффициента.
- Изучение биомеханических и биохимических параметров корнеосклеральной оболочки глазного яблока может служить основанием для разработки новых критериев диагностики и патогенетической терапии ПОУГ.
Список статей и изобретений, опубликованных по теме диссертации
- Арутюнян Л.Л. Офтальмогипертензия после экстракции катаракты у больных глаукомой // Глаукома. – 2007. – № 1. – С. 77-89.
- Арутюнян Л.Л., Еричев В.П., Филлипова О.М.. Акопян А.И. Вязко-эластические свойства роговицы при первичной открытоугольной глаукоме // Глаукома. – 2007. – № 2. – С. 14-20.
- Арутюнян Л.Л. Роль биомеханических свойств глаза в определении целевого давления // Глаукома. – 2007. – № 3. – С. 60-69.
- Арутюнян Л.Л. Диагностическая значимость биомеханических свойств роговицы при ПОУГ // II Всероссийская научная конференция молодых ученых «Актуальные проблемы офтальмологии». – Сб. науч. ст. – М., 2007. – С. 108-111.
- Arutunyan L.L. Corneal biomechanical proportions after trabeculectomy // XXV Congress of the ESCRS. – Stockholm, 2007. – Р. 228.
- Арутюнян Л.Л., Еричев В.П., Иомдина Е.Н. Корнеальный гистерезис как фактор риска прогрессирования ПОУГ // «Современные методы диагностики и лечения заболеваний роговицы и склеры». – Сб. науч. ст. – М., 2007. – С. 250-258.
- Arutunyan L.L., Filippova O.M., Iomdina E.N. Changes in corneal biomechanics after trabeculectomy // Общерос. научно-практическая конференция молодых ученых «Advances in ophthalmology». – Cб. тез. – М., 2007. – С. 12-13.
- Арутюнян Л.Л., Еричев В.П., Филиппова О.М. Корнеальный гистерезис у больных первичной открытоугольной глаукомой // VII съезд офтальмологов Республики Беларусь: Сб. науч. ст. – Минск, 2007.– С. 12-14.
- Арутюнян Л.Л. Ремоделяция роговицы или решетчатой пластинки: что первично при первичной открытоугольной глаукоме? // Глаукома: теории, тенденции, технологии. HRT Клуб России 2007: сб. тез. V Международной конференции. – М., 2007. – С. 18-25.
- Арутюнян Л.Л., Катаргина Л.А., Иомдина Е.Н. Новая тактика определения целевого давления при первичной открытоугольной глаукоме // VII всероссийская школа офтальмологов. – Сб. науч. тр. – М., 2008. – С. 33-39.
- Бессмертный А.М., Калинина О.М., Робустова О.В., Филлипова О.М., Арутюнян Л.Л., Фатуллоева Н.Ф. Нидлинг фильтрационной подушки как способ повышения эффективности фистулизирующих вмешательств // VII Всерос. школа офтальмологов. – Сб. науч. тр. – М., 2008. – С. 48-50.
- Фатуллоева Н.Ф., Арутюнян Л.Л., Акопян А.И., Бессмертный А.М. Биомеханические свойства глаза у больных с псевдоэксфолиативным синдромом, псевдоэксфолиативной глаукомой и первичной открытоугольной глаукомой // VII Всерос. школа офтальмологов. – Сб. науч. тр. – М., 2008. – С. 183-189.
- Arutunyan L.L., Iomdina E.N. Corneal hysteresis as a risk factor of POAG progression // 8th EGS congress. – Berlin, 2008. – P. 159.
- Арутюнян Л.Л., Иомдина Е.Н., Катаргина Л.А. Диагностическая значимость биомеханического коэффициента у лиц с подозрением на глаукому // III Всерос. научная конференция молодых ученых «Актуальные проблемы офтальмологии». – Сб. науч. ст. – М., 2008. – С. 253-255.
- Arutunyan L.L., Katargina L.A. Corneal hysteresis – important factor at definition of target pressure in patients with POAG // XVIII International Congress of Eye Research. – CD-Edition, Beijing, 2008.
- Fatulloeva N.F., Bessmertny A.M., Arutunyan L.L. The characteristics of biomechanical properties in patients with pseudoexfoliative syndrome, pseudoexfoliative glaucoma and POAG // XVIII International Congress of Eye Research. – CD-Edition, Beijing, 2008.
- Иомдина Е.Н., Арутюнян Л.Л., Игнатьева Н.Ю., Данилов Н.Ю., Катаргина Л.А. Структурно-биомеханические особенности склеры у больных с разными стадиями первичной открытоугольной глаукомы (ПОУГ) // Научно-практическая конференция «Российский общенациональный офтальмологический форум». – Сб. науч. ст.– М., 2008. – С. 253-255.
- Арутюнян Л.Л., Иомдина Е.Н., Игнатьева Н.Ю., Катаргина Л.А. Биохимические и термомеханические особенности склеры у больных с ПОУГ // Глаукома: теории, тенденции, технологии. HRT Клуб России 2008: сб. науч. ст. VI Международной конференции. – М., 2008. – С. 80-85.
Изобретения
- Арутюнян Л.Л., Еричев В.П. Положительное решение от 24.10.08 по заявке на патент РФ № 2007144345 «Способ определения целевого давления при первичной открытоугольной глаукоме».
- Арутюнян Л.Л. Положительное решение от 05.11.08 по заявке на патент РФ № 2008102209 «Способ прогнозирования риска развития и прогрессирования глаукомы».
СПИСОК СОКРАЩЕНИЙ
БКрог – биомеханический коэффициент роговицы
ВГД – внутриглазное давление
ВГДГ – ВГД по Гольдману
ВГДрк – роговично-компенсированное ВГД
ГОН – глаукомная оптическая нейропатия
ДЗН – диск зрительного нерва
ДСК – дифференциальная сканирующая калориметрии
КГ – корнеальный гистерезис
НРП – нейроретинальный поясок
ПОУГ – первичная открытоугольная глаукома
РМ – решетчатая мембрана
ФРР – фактор резистентности роговицы
ЦТР – центральная толщина роговицы
MD – mean deviation – среднее отклонение
ORA – Ocular Response Analyzer – анализатор биомеханических свойств глаза
PSD – pattern standard deviation – среднеквадратичное отклонение

