Клинико-патогенетическое обоснование диагностики и коррекции артериальной гипертензии при выполнении плановых некардиологических хирургических вмешательств
На правах рукописи
Репникова Рената Витальевна
КЛИНИКО-ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ ДИАГНОСТИКИ И КОРРЕКЦИИ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИИ ПРИ ВЫПОЛНЕНИИ ПЛАНОВЫХ НЕКАРДИОЛОГИЧЕСКИХ ХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВ
14.01.04 – внутренние болезни
14.01.17 – хирургия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Барнаул – 2012
Диссертационная работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Кемеровская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации
Научный консультант:
| доктор медицинских наук, профессор | Барбараш Ольга Леонидовна |
Официальные оппоненты:
доктор медицинских наук, профессор Стрюк Раиса Ивановна
доктор медицинских наук, профессор Осипова Ирина Владимировна
доктор медицинских наук, профессор Короткевич Алексей Григорьевич
Ведущая организация:
Государственное бюджетное образовательное учреждение высшего профессионального образования «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздравсоцразвития России, г. Москва
Защита состоится «14» марта 2012 г. в 10:00 часов на заседании диссертационного Совета Д 208.002.01 при ГБОУ ВПО «Алтайский государственный медицинский университет» Минздравсоцразвития России по адресу: 656038, г. Барнаул, проспект Ленина, 40.
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО «Алтайский государственный медицинский университет» Минздравсоцразвития России (656031, г. Барнаул, ул. Папанинцев, 126)
Автореферат разослан «_____»_______________2012 г.
| Ученый секретарь диссертационного совета доктор медицинских наук, профессор |  | Буевич Е. И. |
ВВЕДЕНИЕ
Актуальность исследования
Имеющаяся на сегодняшний день эпидемиологическая ситуация в России характеризуется возрастающей распространенностью и «омоложением» артериальной гипертензии (АГ), высокой инвалидизацией и смертностью от её осложнений (Самойленко В.В., 2008; Шальнова С.А., 2008). В процессе жизни лица с повышенным артериальным давлением (АД) довольно часто сталкиваются с необходимостью проведения хирургических вмешательств. Несмотря на то, что основную долю из них составляют пациенты с низкими степенями АГ, они относятся к группе повышенного операционного-анестезиологического риска в связи с вероятностью развития в периоперационном периоде таких осложнений, как мозговой инсульт, инфаркт миокарда (ИМ), нарушения ритма и проводимости вплоть до остановки сердца (Нечаева Г.И., 2006; Прощаев К.И., 2009; Freeman W.K., 2009). Вместе с тем, в современных рекомендациях по оценке периоперационного риска при выполнении некардиологического хирургического вмешательства не учитывается наличие у пациента АГ и степень ее компенсации.
Однако риск периоперационных осложнений у пациентов с сопутствующей АГ традиционно определяется только «офисным» измерением АД и контролем поражения органов-мишеней. Использование столь узкого набора диагностических процедур не всегда позволяет адекватно оценить риск развития сердечно-сосудистых осложнений у данной категории больных. До сих пор использование суточного мониторирования АД (СМАД), являющегося стандартной процедурой у пациентов терапевтического профиля, позволяющей выявить вариабельность АД, не является общепринятым в хирургической клинике. Вместе с тем, информация о суточной динамике АД может быть полезна для решения вопроса о проведении дооперационной подготовки, непосредственно анестезиологического пособия во время операционного вмешательства, прогнозирования послеоперационной реабилитации для данной категории больных.
Исследования последних лет свидетельствуют о том, что одним из важных звеньев в патогенезе АГ является воспалительная реакция сосудистой стенки с развитием дисфункции эндотелия (Титов В.Н., 2008). Провоспалительным цитокинам – интерлейкинам (ИЛ) -1, ИЛ-6, ИЛ-8 отводится особая роль в индукции сосудистого повреждения. Эти маркеры воспаления могут выступать в качестве предиктора развития инфаркта миокарда и неблагоприятного прогноза (Howren M., 2009). Вместе с тем, до сих пор отсутствуют данные о взаимосвязи психоэмоциональных реакций с динамикой воспалительного ответа у пациентов с АГ и периоперационных осложнений.
До сих пор не определены наиболее адекватные меры профилактики сердечно-сосудистых осложнений у пациентов с сопутствующими заболеваниями сердца и сосудов, подвергающихся некардиологическим операциям. Наиболее активна дискуссия по поводу использования в периоперационном периоде бета-адреноблокаторов (БАБ). Обсуждаются как показания к назначению (выделение группы пациентов, у которых польза от применения БАБ превышает риск) (London M.J., 2008), сроки и дозы назначения БАБ перед проведением вмешательства (Bangalore S., 2008), так и выбор конкретного препарата (Небиеридзе Д.В., 2007; Fleischmann К.Е., 2009).
Таким образом, до сих пор отсутствует единое мнение о значении АГ в оценке риска развития как сердечно-сосудистых, так и некардиологических осложнений при выполнении хирургических вмешательств. Понимание клинико-патогенетических влияний АГ на течение периоперационного периода позволит обосновать оптимальные подходы к управлению рисками различных осложнений у пациентов хирургического профиля.
Цель исследования: Патогенетически обосновать клиническую и прогностическую значимость артериальной гипертензии при выполнении оперативных вмешательств различной категории тяжести и риска.
Задачи исследования
1. Оценить частоту выявления АГ у пациентов, подвергающихся плановой лапароскопической холецистэктомии и определить факторы, влияющие на риск развития неблагоприятных событий в течение 3-х лет наблюдения.
2. Определить особенности периоперационной динамики показателей артериального давления, в том числе, его суточной динамики у пациентов с наличием артериальной гипертензии при выполнении плановой лапароскопической холецистэктомии.
3. Выявить различия в частоте развития осложнений госпитального периода у пациентов с лапароскопической холецистэктомией в зависимости от факта наличия артериальной гипертензии и определить наиболее значимые предикторы послеоперационных осложнений.
4. Определить гуморальные корреляты (С-реактивный белок, интерлейкины -1, -6, -8, -10, кортизол, эндотелин-1) стресс-индуцированных изменений гемодинамики у пациентов, подвергшихся плановой лапароскопической холецистэктомии.
5. Оценить взаимосвязь периоперационной динамики маркеров воспаления и дисфункции эндотелия, и послеоперационных осложнений у пациентов при проведении плановой лапароскопической холецистэктомии в зависимости от наличия АГ.
6. Проанализировать предоперационную динамику маркеров психоэмоционального статуса, а также их взаимосвязь со стресс-индуцированными нарушениями показателей гемодинамики и воспаления у пациентов с лапароскопической холецистэктомией в зависимости от наличия АГ.
7. Оценить эффективность и безопасность использования бисопролола в периоперационном периоде у пациентов с артериальной гипертензией, подвергшихся плановой лапароскопической холецистэктомии.
8. Оценить основные характеристики синдрома АГ у пациентов с облитерирующим атеросклерозом сосудов нижних конечностей, планируемых на реконструктивные вмешательства на сосудах.
9. Определить возможность использования параметров «офисного» измерения артериального давления и его суточного мониторирования для оценки риска и характера развития интра- и ранних послеоперационных осложнений при выполнении бедренно-подколенного шунтирования.
10. Оценить возможность использования показателей «офисного» измерения артериального давления и суточного мониторирования артериального давления для прогнозирования риска развития сердечно-сосудистых событий в течение года после перенесенного хирургического вмешательства по поводу атеросклеротического поражения аорты и ее ветвей.
Научная новизна исследования
Впервые проведена комплексная оценка клинической и прогностической значимости различных подходов к диагностике синдрома АГ в периоперационном и отдаленном послеоперационном периодах у пациентов, подвергнутых некардиологическим оперативным вмешательствам низкого и высокого риска, а также выявлены наиболее важные механизмы развития стрессиндуцированных периоперационных осложнений.
Доказано, что наличие у пациента хирургического профиля синдрома АГ, особенно неконтролируемого с помощью медикаментозной терапии, может рассматриваться в качестве уникального маркера риска развития как ранних послеоперационных осложнений, так и неблагоприятного течения отдаленного послеоперационного периода.
Впервые показано, что для пациентов с АГ, в отличие от пациентов без АГ, в условиях периоперационного стресса при выполнении плановой лапароскопической холецистэктомии (ЛХЭ), несмотря на постоянную антигипертензивную терапию характерна более высокая стресс-реактивность основных показателей гемодинамики: по данным СМАД за 24 часа до операции по сравнению с показателями, оцененными за 2 недели до госпитализации, усугубляются проявления синдрома АГ в виде повышения среднесуточных, ночных и дневных показателей АД. При этом больший предоперационный стресс-индуцированный прирост суточных показателей АД (систолическое (САД) среднее суточное и дневное, пульсовое (ПАД) среднее суточное, индекс площади диастолического АД (ДАД) ассоциирован с вероятностью развития как кардиологических, так и некардиологических осложнений послеоперационного периода.
Доказано, что пациенты с АГ перед оперативным вмешательством имеют проявления классического стресс-синдрома, характеризующегося не только повышением АД, но и дисбалансом про- и антивоспалительного цитокинового профиля, повышением концентрации в крови эндотелина-1, кортизола, высокими значениями тревожности. Выраженность стресс-реакции может выступать в качестве прогностического фактора в отношении развития послеоперационных осложнений, повышая вероятность развития как кардиологических, так и некардиологических осложнений. Впервые доказано, что одним из механизмов развития послеоперационных осложнений у пациентов с АГ является стресс-индуцированная активация воспалительной реакции, степень которой коррелирует с предоперационной динамикой показателей суточного мониторирования АД.
Практическая значимость
У пациентов хирургического профиля высока вероятность выявления АГ: при выполнении холецистэктомии – более чем у 57%, у пациентов с облитерирующими заболеваниями сосудов нижних конечностей (ОЗСНК) – 53%. При этом, более чем у половины пациентов отсутствует адекватный контроль АД. Доказана необходимость углубленного анализа основных показателей АД в течение суток у пациентов с АГ в предоперационном периоде, так как наличие как самого факта выявления в анамнезе АГ, особенно при отсутствии неадекватного контроля АД ассоциируется с более чем 2,5-кратным увеличением частоты развития кардиологических и некардиологических осложнений, а также большей частотой обращений за медицинской помощью и госпитализаций в течение 3 лет послеоперационного наблюдения.
Доказано, что проведение СМАД в предоперационном периоде позволяет более эффективно выявлять пациентов с неадекватным контролем АД, а следовательно, с большим риском развития периоперационных осложнений. Для пациентов хирургического профиля как с ОЗСНК, так и с желчнокаменной болезнью предоперационная диагностика АГ только по данным «офисного» измерения АД не является достаточным, потому что проведение СМАД позволяет дополнительно выявить пациентов с АГ. Для пациентов с ОЗСНК характерны патологические суточные профили АД – «non-dipper» и «night-peaker» (до 70 %). Пациенты с ОЗСНК, имеющие в предоперационном периоде патологические СИ «non-dipper» и «night-peaker», относятся к группе высокого риска развития эпизодов нестабильной гемодинамики во время оперативного вмешательства.
Продемонстрировано, что у пациентов с ЛХЭ использование в предоперационном периоде БАБ – бисопролола в течение 14 дней до операции и 30 дней после нее при условии тщательной титрации дозы препарата безопасно и позволяет в 4 раза снизить число кардиологических послеоперационных осложнений.
Положения, выносимые на защиту:
- Более половины пациентов хирургического профиля трудоспособного возраста имеют в анамнезе синдром АГ, адекватная коррекция этого синдрома выявляется из них только у 50%. Наличие АГ, особенно при отсутствии ее предоперационного контроля, повышает вероятность регистрации послеоперационных кардиологических и некардиологических осложнений, удлиняет сроки госпитализации и ухудшает отдаленный послеоперационный прогноз.
- Для пациентов с АГ, по сравнению с пациентами без АГ, характерны более выраженные предоперационные стресс-индуцированные нарушения гомеостаза: дестабилизация АГ, психоэмоциональных дисфункций, нарушение баланса между про- и противовоспалительными маркерами.
- Оценка показателей «офисного» измерения АД не является адекватным методом оценки операционного риска. Для пациентов с АГ в предоперационном периоде необходимо проводить суточное изучение динамики АД.
- Предоперационная терапия пролонгированным селективным бета-адреноблокатором – бисопрололом, начатая за 2 недели до оперативного вмешательства, при условии титрации дозы у пациентов промежуточного риска безопасна и позволяет уменьшить гемодинамические проявления стресса у пациентов с АГ, что проявляется четырехкратным снижением числа послеоперационных осложнений и длительности пребывания пациентов в стационаре.
Внедрение результатов исследования в практику
Научные положения и практические рекомендации, сформулированные в диссертации, внедрены в клиническую практику хирургических, терапевтических и кардиологических отделений, амбулаторную практику ГУЗ «Кемеровская областная клиническая больница», НИИ комплексных проблем сердечно-сосудистых заболеваний СО РАМН и ГУЗ «Областной клинический госпиталь для ветеранов войн» г. Кемерово. Полученные данные используются при обучении врачей и студентов на кафедрах факультетской терапии, кардиологии и сердечно-сосудистой хирургии ГБОУ ВПО КемГМА Минздравсоцразвития России. Результаты исследования представлены в методических рекомендациях «Оценка периоперационного риска у пациентов с артериальной гипертензией при выполнении некардиологических хирургических вмешательств», утвержденные ДОЗН Кемеровской области.
Апробация работы
Основные положения диссертации доложены и обсуждены на Межрегиональной научно-практической конференции молодых ученых «Проблемы медицины и биологии» (Кемерово, 2008), Областном дне специалиста-гастроэнтеролога на базе ГУЗ КОКБ (Кемерово, 2008), Российском научном конгрессе кардиологов «Кардиология: реалии и перспективы» (Москва, 2009), Областном дне специалиста-гастроэнтеролога на базе ГУЗ КОКБ (Кемерово, 2009), Межрегиональной научно-практической конференции молодых ученых «Проблемы медицины и биологии» (Кемерово, 2009), 18-й научно-практической конференции «Достижения современной гастроэнтерологии» (Томск, 2010), Российском национальном конгрессе кардиологов (Москва, 2010), Областном дне специалиста-гастроэнтеролога на базе ГУЗ КОКБ (Кемерово, 2011), Всероссийском конгрессе с международным участием «Психосоциальные факторы и внутренние болезни: состояние и перспективы» (Новосибирск, 2011), 14-й Краевой кардиологической конференции, посвященной 75-летию почетного кардиолога России, профессора Шульмана В.А. (Красноярск, 2011).
Объем и структура диссертации
Диссертация изложена на 270 страницах машинописного текста, состоит из введения, аналитического обзора литературы, описания материала и методов исследования, результатов собственных исследований и их обсуждения, заключения, выводов, практических рекомендаций и списка литературы, включающего 413 источников, из них – 214 иностранных. Работа иллюстрирована 32 рисунками и 45 таблицами.
Публикации
По теме диссертации опубликовано 48 печатных работ, в том числе 11 – в журналах, рекомендованных ВАК для представления научных результатов диссертации на соискание ученой степени доктора наук.
Личный вклад автора
Анализ литературы по теме диссертационного исследования, сбор и систематизация первичных клинических материалов, результатов лабораторно-инструментального исследования, в том числе суточного мониторирования артериального давления и психологического тестирования, изучение архивного материала и отдаленных результатов, их статистическая обработка и написание работы выполнены лично автором. Проведена курация 999 пациентов с ЖКБ и 102 пациентов с ОЗСНК, планируемых на плановое оперативное вмешательство. Оценка показателей воспаления осуществлялась совместно с врачами биохимической лаборатории МУЗ «Кемеровский кардиологический диспансер» и аспирантами кафедры факультетской терапии ГБОУ ВПО Минздравсоцразвития России.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Общее количество пациентов, включенных в исследование, составило 1101. Протокол исследования одобрен Локальным этическим комитетом КемГМА. Перед проведением исследования все пациенты подписывали информированное согласие на участие в исследовании.
Для изучения особенностей периоперационного периода в качестве модели операции «промежуточного риска» по классификации ASA (Chand M., 2007) были обследованы пациенты с ЖКБ, планируемые на выполнение ЛХЭ (999 пациентов); в качестве модели операции «высокого риска» - пациенты с облитерирующими заболеваниями сосудов нижних конечностей, у которых планировалось оперативное вмешательство на артериях нижних конечностей ниже пупартовой связки (102 пациента).
Из обследованных пациентов 999 были с ЖКБ, поступивших в различные стационары города Кемерово для проведения ЛХЭ (см. дизайн исследования, рис. 1).
Критерии включения: пациенты с установленной ЖКБ, подвергшиеся проведению плановой ЛХЭ. Критерии исключения: осложненное течение ЖКБ; неспособность пациента выполнять требования, предъявляемые в ходе исследования; наличие в анамнезе заболеваний центральной нервной системы, а также наличие онкопатологии, ожирения (Индекс Кетле 30 кг/м2), острого или обострения хронического воспалительного заболевания любой локализации; наличие противопоказаний к назначению БАБ.
Для данной категории пациентов определены этапы исследования: дооперационный (за 2 недели до госпитализации, за 24 часа до операции); интраоперационный (в течение оперативного вмешательства); ранний послеоперационный (госпитальный послеоперационный период, в среднем 5-7 дней).
Кроме того, в исследование вошли 102 пациента с облитерирующими заболеваниями сосудов нижних конечностей, поступивших в клинику УРАМН НИИ Комплексных проблем сердечно-сосудистых заболеваний СО РАМН.
Критерии включения: наличие у пациентов атеросклеротического поражения артериального русла различных бассейнов, у которых планировалось оперативное вмешательство на артериях нижних конечностей ниже пупартовой связки. Критерии исключения: ранее выполненные реконструктивные или другие вмешательства на брюшной аорте и артериях нижних конечностей; перенесенный ИМ давностью менее 6 месяцев; острое нарушение мозгового кровообращения (ОНМК) в анамнезе, давностью менее 6 месяцев; тяжелая соматическая патология; онкологические заболевания.
Обследование пациентов проводили на следующих этапах: дооперационный (продолжительность от 12 до 28 дней); интраоперационный (средняя продолжительность от 1,5 до 6 часов); ранний послеоперационный (госпитальный послеоперационный период) и отдаленный этап после операции (через 12 месяцев).
В качестве контрольной группы обследованы 16 здоровых людей для оценки референсных значений биологических маркеров.
Общеклиническая характеристика больных
Для решения поставленных задач первоначально был проведен анализ 467 историй болезни пациентов, оперированных в 2006-2008 г.г. в МУЗ ГКБ №2 и МУЗ ГКБ №11 по поводу ЖКБ, для выявления роли синдрома АГ в развитии осложнений в периоперационном периоде, а также для проспективного анализа – уточнение прогностической ценности стресс-индуцированной предоперационной АГ для риска развития сердечно-сосудистых событий в течение трехлетнего послеоперационного наблюдения. Лапароскопическая холецистэктомия выполнялась по стандартной методике под эндотрахеальным наркозом (ЭТН) с использованием карбоксиперитонеума.
Среди пациентов было 413 (88,44%) женщин и 54 (11,56%) мужчины, средний возраст которых составил 52,00 (48,00;57,00) лет.
АГ выявлялась у 299 (64,03%) больных: их них у 22 (7,35%) – впервые выявленная в стационаре, у 277 (92,65%) – АГ ранее существующая. При поступлении пациента в стационар АД определялось «офисным» измерением. Всем обследованным пациентам при постановке диагноза АГ руководствовались Российскими рекомендациями по профилактике, диагностике и лечению АГ Всероссийского научного общества кардиологов (ВНОК) 2004 года (Оганов Р.Г., 2004). Антигипертензивную терапию регулярно получали 195 (65,21%) больных.
Клинико-анамнестическая характеристика больных в зависимости от наличия синдрома АГ представлена в таблице 1.
Таблица 1 Основные клинико-анамнестические характеристики у пациентов с ЖКБ в зависимости от наличия синдрома АГ
| Характеристики | Пациенты без АГ (n=168) | Пациенты с АГ (n=299) | р |
| Средний возраст (лет) | 46,00 (42,00;48,00) | 56,50 (51,00;58,50) | <0,001 |
| Пол, n (%): Мужчины | 18 (10,71) | 36 (12,04) | 0,24 |
| Женщины | 150 (89,29) | 263 (87,96) | 0,24 |
| ХОБЛ, n (%) | 4 (2,38) | 6 (2,01) | 0,95 |
| Повышение уровня холестерина, n (%) | 4 (2,38) | 42 (14,05) | 0,05 |
| Курение, n (%) | 32 (19,04) | 84 (28,09) | 0,02 |
| ИМТ, кг/м2 | 28,80 (26,10;30,09) | 30,04 (28,66;32,30) | <0,001 |
Анализ наблюдения пациентов в течение 3-х лет после операции включал визиты к врачу каждые 6 месяцев с осмотром специалиста и по показаниям – лабораторно-инструментальной диагностикой, при невозможности прихода пациента в клинику по какой-либо причине (отпуск, командировка и др.) выполнялся дозвон по телефону. В отдаленном послеоперационном периоде оценивалась частота развития событий (госпитализаций или обращений к врачу) на протяжении 36 месяцев. В зависимости от развития этих событий пациенты разделились на группы: 1-я – с благоприятным (n=372), 2-я – с неблагоприятным прогнозом (n=95).
Кроме того, было выполнено проспективное клинико-инструментальное исследование 409 пациентов с ЖКБ, поступивших в хирургическое отделение Кемеровской областной клинической больницы для проведения плановой ЛХЭ (2007-2009 г.г.). Среди 409 больных, включенных в исследование, было 351 (85,82%) женщина и 58 (14,18%) мужчин. В возрасте до 45 лет наблюдалось 123 (30,07%) пациента, 45-59 лет – 145 (35,45%), 60-74 года – 122 (29,83%) и в возрасте 75 лет и более – 19 человек (4,65%).
Из всех обследованных 409 больных в дальнейшем более подробно будут рассмотрены пациенты (n=145) среднего возраста (53,00 (49,00;57,00) лет).
В данную выборку вошли: 1) группа пациентов с АГ (n=84, из них 77 (91,67%) женщин и 7 (8,33%) – мужчин), которую использовали с целью анализа «офисных» значений АД, у 52 из них оценивались данные СМАД (за 2 недели до планируемой госпитализации и за 24 часа до операции) и роль провоспалительных факторов и эндотелиальной дисфункции во взаимосвязи с уровнем тревоги для течения послеоперационного периода; 2) группа контроля (пациенты без АГ) – 61 пациент (55 (90,16%) – женщин и 6 (9,84%) – мужчин), для аналогичного анализа, из которых у 48 пациентов дополнительно выполнено определение параметров СМАД в те же сроки, что и у пациентов с АГ, оценка эндотелиальной дисфункции и показателей воспаления, а также психосоциального статуса. Средний возраст пациентов первой группы составил 55,00 (51,00;57,50) лет, второй группы – 54,00 (50,00;56,00) лет (р=0,10).
По степени АГ пациенты представлены следующим образом: 1 степень – 7 человек (8,33%), 2 степень – 56 (66,67%), 3 степень – 21 (25,00%) пациент, по стадиям: I стадия выявлена у 12 (14,29%) человек, II стадия – у 53 (63,09%), III стадия – у 19 (22,62%) пациентов. По степени компенсации на момент поступления больные распределялись следующим образом: у 25 (29,76%) цифры артериального давления превышали 140/90 мм рт. ст., у 59 (70,24%) была достигнута компенсация АГ. Среди пациентов с АГ у 19 (22,62%) имела место ИБС, ФК I – 6 (31,58%), ФК II – 13 (68,42%). В анамнезе ИМ выявлен у 3 (3,57%) пациентов, ОНМК и транзиторные ишемические атаки (ТИА) – у 3 (3,57%). Хроническая сердечная недостаточность по NYHA была представлена следующими стадиями: ФК I – 18 (21,43%), ФК II – 1 (1,19%). Нарушения ритма сердца выявлены у 3 (3,57%) пациентов, из них: у 2 - мерцательная аритмия, у 1 – AВ-блокада 1 степени.
В качестве другой сопутствующей патологии у пациентов с АГ встречались: заболевания дыхательных путей (хроническая обструктивная болезнь легких (ХОБЛ) – 2 (2,38%), бронхиальная астма – 1 (1,19%)), заболевания мочевыделительной системы (хронический пиелонефрит – 2 (2,38%)), заболевания органов пищеварения (язвенная болезнь двенадцатиперстной кишки – у 1 (1,19%)).
У пациентов без АГ имели место: ХОБЛ – 1 (1,64%), бронхиальная астма – 1 (1,64%). Курение выявлено у 15 (17,9%) пациентов с АГ, у 10 (16,4%) – без АГ. Индекс массы тела пациентов с АГ составил 27,22 (24,86;28,30), без АГ – 26,52 (25,20;27,93) кг/м2, р=0,39. Обе группы больных не имели различий по индексу массы тела, половому (женщины (р=0,49), мужчины (р=0,49)) и возрастному составу.
Для оценки медикаментозной коррекции (коррекция БАБ) дополнительно обследовано 123 пациента (18 мужчин и 105 женщин) с АГ, которым планировалось выполнение плановой ЛХЭ. Средний возраст пациентов составил 55,00 (46,00;65,00) лет. Данные пациенты (n=123) были рандомизированы методом конвертов на 2 группы. Первую группу составили 57 больных, у которых в предоперационном периоде за 2 недели до предполагаемой даты оперативного вмешательства (День-14 (Д-14)) к проводимой ранее терапии был добавлен БАБ – бисопролол. Начальная доза препарата (2,5-5 мг в сутки определялась исходными значениями АД, частотой сокращения сердца и возрастом пациента). Через 1 неделю (Д-7) оценивался эффект препарата, и при отсутствии достижения целевого АД доза бисопролола увеличивалась. Пациенты были госпитализированы в клинику за 2-3 дня до оперативного вмешательства. Вторую группу (контрольная) составили 66 пациентов, которым в предоперационном периоде была проведена коррекция ранее получаемой антигипертензивной терапии без добавления БАБ. Для контроля АД у пациентов 2-й группы 42 (63,64%) потребовалось увеличение дозы ингибиторов ангиотензинпревращающего фермента (иАПФ), а 14 (33,33%) – присоединение индапамида. При этом пациенты данной группы посещали терапевта и были госпитализированы в те же сроки, что и пациенты группы воздействия. Все пациенты, включенные в исследование, не принимали в течение последнего месяца БАБ. Также у всех обследованных пациентов (n=123) отсутствовали клинико-анамнестические признаки ИБС.
Наблюдение за пациентами составило 30 дней после хирургического вмешательства. На 30-е сутки после операции пациентам первой группы даны рекомендации продолжить терапию бисопрололом в подобранной в ходе исследования дозе препарата, а пациентам группы сравнения проведена индивидуальная коррекция антигипертензивной терапии, согласно современным рекомендациям (ВНОК, 2004).
Сравнительная характеристика пациентов представлена в таблице 2.
Тактика анестезиологического пособия, квалификация хирургов были сопоставимы у представителей трех клиник (МУЗ ГКБ №2, МУЗ ГКБ №11 и Кемеровской областной клинической больницы), в которых проводилась плановая ЛХЭ пациентам, включенным в данное исследование.
Таблица 2 Исходная характеристика пациентов, включенных в подысследование по оценке эффективности и безопасности периоперационной терапии БАБ (1 группа – пациенты, получающие БАБ; 2 группа – пациенты без добавления к антигипертензивной терапии БАБ)
| Показатели | 1 группа (n=57) | 2 группа (n=66) |
| Средний возраст, лет | 58,00 (49,00;66,00) | 55,00 (45,00;64,00) |
| Женщины, n (%) | 47 (82,46) | 58 (87,88) |
| СД 2 типа, n (%) | 8 (14,04) | 7 (10,61) |
| ФВ левого желудочка, % | 64,53 (61,47;67,59) | 65,15 (60,74;69,86) |
| ОНМК и ТИА в анамнезе, n (%) | 5 (8,77) | 9 (13,64) |
| ХСН I – II ФК по NYHA, n (%) | 51 (89,47) | 56 (84,85) |
| Предшествующая антигипертензивная терапия, n (%) | ||
| иАПФ | 53 (92,98) | 56 (84,85) |
| диуретики | 14 (24,56) | 22 (33,33) |
| антагонисты кальция | 4 (7,02) | 10 (15,15) |
| нерекомендованные препараты | - | 6 (9,09) |
Также в исследовании представлен анализ результатов клинико-инструментального исследования 102 больных с атеросклеротическим поражением абдоминального отдела аорты и ее ветвей, находившихся на лечении в отделении сердечно-сосудистой хирургии Кемеровского кардиологического центра в период за 2005-2007 г.г., у которых планировалось оперативное вмешательство на артериях нижних конечностей ниже пупартовой связки в плановом порядке. Среди обследованных больных лица мужского пола составили 98 (96,08%), женского – 4 (3,92%), в возрасте от 43 до 80 лет (средний возраст 61,00 (56,00;67,00) лет).
Всем обследованным больным с учетом характера основной патологии (атеросклероз абдоминального отдела аорты и ее ветвей) выполнено плановое оперативное вмешательство на сосудах нижних конечностей – подвздошно-бедренное протезирование или шунтирование.
В зависимости от значений АД при его «офисном» измерении в предоперационном периоде все обследованные пациенты были разделены на 2 группы (табл. 3). В первую группу вошли 48 (47,06%) пациентов без АГ, вторую группу составили 54 (52,94%) пациента с АГ.
При хирургическом вмешательстве на артериях нижних конечностей оказывалось анестезиологическое пособие в объеме комбинированной анестезии (спинно-мозговая + ЭТН). Госпитальная летальность при данной операции не регистрировалась. Интраоперационно оценивались специфичные для вида операции различные осложнения.
Таблица 3 Клинико-анамнестические характеристики пациентов с наличием и отсутствием синдрома артериальной гипертензии при «офисном» измерении АД
| Характеристики | Пациенты без АГ (n=48) | Пациенты с АГ (n=54) | р |
| Возраст (лет) | 57,00 (50,00;65,00) | 60,00 (53,00;68,00) | 0,12 |
| Холестерин, ммоль/л | 6,80 (5,70;7,80) | 6,70 (5,70;7,60) | 0,76 |
| ХОБЛ, n (%) | 26 (54,17) | 40 (74,07) | 0,05 |
| СД 2 типа, n (%) | 2 (4,17) | 10 (18,52) | 0,03 |
| Курение | 44 (91,67) | 50 (92,59) | 0,63 |
| ИМТ, кг/м2 | 23,90 (22,10;24,75) | 24,30 (22,50;25,16) | 0,17 |
| ИБС, n (%): | |||
| 1. Стенокардия | 24 (50,00) | 10 (18,52) | 0,05 |
| 2. ПИКС | 6 (12,50) | 10 (18,52) | 0,05 |
| АГ в анамнезе, n (%) | 8 (16,67) | 22 (40,74) | 0,01 |
| Ангиографические признаки коронарного атеросклероза, n (%) | 32 (66,67) | 32 (59,26) | 0,44 |
| Степень ишемии нижних конечностей, n (%): | |||
| IIБ стадия | 24 (50,00) | 29 (53,70) | 0,51 |
| III стадия | 21 (43,75) | 28 (51,85) | 0,69 |
У всех у 102 пациентов изучены отдаленные результаты операции в сроки через 12 месяцев в условиях амбулаторного приема. Под неблагоприятным отдаленным прогнозом понимали наличие повторных госпитализаций и оперативных вмешательств по поводу хронической ишемии нижних конечностей, ампутации конечности, летальный исход.
Инструментальные методы исследования: измерение АД проводилось методом Короткова; оценку СМАД осуществляли системой BPLab МнСДП-2 (ООО «Петр Телегин», г. Нижний Новгород); электрокардиография (ЭКГ) проводилась («Siemens») в 12 отведениях; эхокардиография (Эхо-КГ) проводили аппаратом «Aloca»; селективную коронарографию – всем пациентам с ОЗСНК («Innova»); цветное дуплексное сканирование сосудов нижних конечностей пациентам с ОЗСНК («Aloca»).
Психофизиологические методы обследования проводили с помощью оценочных шкал личностной и реактивной тревожности Спилбергера-Ханина.
Лабораторные методы: интенсивность воспалительного процесса оценивали методом твердофазного иммуноферментного анализа по содержанию в сыворотке крови интерлейкинов (ИЛ-1, ИЛ-6, ИЛ-8, ИЛ-10) с использованием тест-наборов (Bio Sourse International Inc. USA), кортизола («Алкор Био», Россия). Концентрация С-реактивного белка (СРБ) оценивалась количественным методом (hsCRP (BIOMEDICA, Австрия). Уровень эндотелина-1 (Biomedica ENDOTELIN) в сыворотке крови определялся специальными тест наборами (Bio Sourse International Inc. USA) с последующей колориметрической оценкой концентраций (Stut Fax 3300 580/630 Нм). Все лабораторные исследования проводили в один день с суточным мониторированием АД.
Статистическая обработка материала проводилась с помощью программы STATISTICA версии 8.0.360.0 компании StatSoft, Inc (США, серийный номер STA862D175437Q). Значения представлены для относительных величин в виде процентного соотношения, для количественных – в виде медианы (Ме) и интерквартильного размаха (25-й и 75-й процентили). С целью сравнения двух независимых групп по количественному признаку оценивали U-критерий Манна-Уитни или метод Колмогорова-Смирнова. Для анализа различия частот в двух независимых группах использовали критерий Фишера с двусторонней доверительной вероятностью и критерий Пирсона с поправкой Йетса. Для выявления связи между изучаемыми величинами применяли корреляционный анализ по Спирмену. Динамику параметров во времени оценивали по критерию Вилкоксона. Для определения прогностической значимости изучаемых параметров использовался регрессионный анализ с использованием модели пропорционального риска Кокса, а также анализ риска развития неблагоприятных событий по методу Каплана-Мейера. Для определения диагностической силы предложенной модели оценки риска неблагоприятного прогноза у пациентов с ЛХЭ (трехгодичный прогноз) и пациентов с ОЗСНК (годичный прогноз) оценивали ROC-кривую (С-статистика). Диагностически значимым является значение площади под ROC-кривой, превышающее 0,70. Во всех процедурах статистического анализа уровень значимости (р) принимался менее 0,05.

РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Клинико-патогенетическое значение синдрома артериальной гипертензии у пациентов с лапароскопической холецистэктомией
Анализ течения госпитального периода у 467 больными, подвергшихся ЛХЭ в различных клиниках г. Кемерово показал, что пациенты с АГ и без нее различались по наличию послеоперационных осложнений. Так, у пациентов с наличием синдрома АГ, по сравнению с пациентами без АГ, зарегистрировано в целом практически в 2 раза большее (10,37% против 5,95%; р=0,01) количество развившихся послеоперационных осложнений, частота возникновения которых зависела от степени компенсации АГ.
В течение трехлетнего периода наблюдения этих больных неблагоприятные события наблюдались у 95 из 467 (20,34%) пациентов. Выявлено, что на риск развития неблагоприятного трехлетнего прогноза влияет наличие у пациентов на момент проведения оперативного вмешательства АГ (с благоприятным прогнозом – 61,83%, с неблагоприятным – 72,63%; р=0,048) и отсутствие достижения целевых значений АД в дооперационном периоде (регистрировалось в 2 раза чаще, чем у пациентов с благоприятным прогнозом; 16,67% против 32,63%; р=0,02), гиперхолестеринемии (7,79% против 17,89%; р=0,02), и ХОБЛ (0,07% против 6,32%; р=0,002) в анамнезе, а также развитие кардиологических (3,15% против 7,36%; р=0,02) и хирургических гнойных осложнений со стороны области хирургического вмешательства в раннем послеоперационном периоде (2,72% против 7,36%; р<0,001). Отмечено, что частота неблагоприятных событий (обращений за медицинской помощью, госпитализаций) в течение трехлетнего наблюдения пациентов с наличием синдрома АГ была достоверно выше, чем у пациентов без АГ – 23,08% против 15,48%; р=0,03), причем в 1,5 раза больше у пациентов с отсутствием достижения целевых значений АД в дооперационном периоде – 31,11% против 19,62%; р=0,02).
Риск развития кардиологических неблагоприятных событий у пациентов, подвергшихся ЛХЭ, определяется отсутствием достижения целевых показателей АД на момент проведения оперативного вмешательства, а также фактом отсутствия приема антигипертензивной терапии иАПФ+БАБ. Качество полученной модели оценено с помощью С-статистики, площадь под ROC-кривой составила 0,70 (95% доверительный интервал 0,63-0,82), p=0,03.
С целью определения периоперационной динамики показателей АД, в том числе, по данным СМАД, первоначально было обследовано 409 пациентов, поступивших в Областную клиническую больницу для проведения плановой ЛХЭ по поводу ЖКБ. Ранее существующая АГ имела место у 51,83%, впервые выявленная – у 4,89% их них. С увеличением возраста пациентов было выявлено закономерное увеличение лиц с наличием синдрома АГ (в 57,93% случаев пациентов среднего возраста и 89,35% – от 60 до 74 лет). Вместе с тем, АГ была выявлена у всех пациентов 75 лет и более. Таким образом, среди всех пациентов, поступающих в клинику для проведения ЛХЭ, более чем у половины – 56,72% имела место АГ.
Для последующего анализа выделена подгруппа пациентов в возрасте от 45 до 59 лет. Установлено, что синдром АГ среди 145 пациентов в анамнезе прослеживался также у 84 (57,93%), из них у 8 (5,52%) впервые зарегистрированы повышенные цифры АД при поступлении в клинику. Следует отметить, что регулярно антигипертензивную терапию принимали только 52,38% больных. В связи с этим, пациенты, достигшие целевых значений АД на момент госпитализации составили 70,24%, а с отсутствием достижения целевых значений АД – у трети пациентов, что было приведено ранее.
Анализ динамики «офисных» измерений средних показателей АД и ЧСС в периоперационном периоде у пациентов без АГ и с АГ показал, что более высокие средние значения показателей САД в 1-е сутки госпитализации (124,00 (116,00;132,00) мм рт. ст. против 128,00 (121,00;135,00) мм рт. ст.; р=0,02), за 24 часа до операции (121,00 (110,00;133,00) мм рт. ст. против 131,00 (121,00;142,00) мм рт. ст.; р<0,001) и в 1-е сутки после операции (130,00 (122,00;138,00) мм рт. ст. против 140,00 (132,00;148,00) мм рт. ст.; р=0,02); ДАД в 1-е сутки после операции (79,00 (72,00;84,00) мм рт. ст. против 79,00 (73,00;85,00) мм рт. ст.; р=0,02) и за 24 часа до операции (77,00 (68,00;87,00) мм рт. ст. против 81,00 (72,00;91,00) мм рт. ст.; р<0,001) и ЧСС в период интубации (83,00 (77,00;89,00) уд. в мин против 92,00 (85,00;99,00) уд. в мин; р=0,02) регистрировались у пациентов с АГ, достоверно отличающиеся от средних значений соответствующих показателей в группе без АГ.
Оценивая аналогичные показатели у пациентов в зависимости от компенсации АГ, выявлены достоверно высокие показатели САД, ДАД и ЧСС у пациентов с отсутствием достижения целевых значений АД, по сравнению с пациентами, достигшими целевых значений АД в дооперационном периоде (табл. 4).
Анализ течения послеоперационного периода показал, что у пациентов с наличием синдрома АГ, по сравнению с пациентами без АГ, зарегистрировано в 2,5 раза (23,81% против 8,19%; р=0,01) большее в целом количество развившихся послеоперационных осложнений, частота возникновения которых зависела от степени компенсации АГ. Таким образом, сердечно-сосудистая система представляет собой потенциальный источник осложнений во время ЛХЭ. Частота развития послеоперационных событий сопряжена с наличием как синдрома АГ, так и степенью её компенсации.
Таблица 4 Средние значения показателей АД и ЧСС в периоперационном периоде у обследованных пациентов с отсутствием достижения целевых значений АД (А) и достигших целевых значений АД в дооперационном периоде (Б)
| Состояние компенса-ции АГ | 1-е сутки госпитализации (1) | За 24 часа до операции (2) | Во время операции (период интубации) (3) | 1-е сутки после операции (4) | р |
| САД мм рт. ст. | |||||
| А | 135,00 (130,00;140,00) | 145,00 (140,00;150,00) | 143,00 (138,00;147,00) | 150,00 (143,00;156,00) | 1-2<0,001 1-4<0,001 |
| Б | 126,00 (124,00;133,00) | 127,00 (125,00;130,00) | 132,00 (130,00;135,00) | 132,00 (128,00;137,00) | 1-3<0,001 2-3<0,001 1-4<0,001 2-4=0,02 |
| р | <0,001 | <0,001 | 0,01 | <0,001 | |
| ДАД мм рт. ст. | |||||
| А | 82,00 (77,00;87,00) | 87,00 (83,00;91,00) | 82,00 (78,00;85,00) | 81,00 (75,00;86,00) | 1-2=0,03 2-4=0,01 |
| Б | 77,00 (76,00;79,00) | 79,00 (78,00;81,00) | 82,00 (80,00;85,00) | 71,00 (67,00;76,00) | 1-3<0,001 1-4=0,03 2-4=0,01 3-4<0,001 |
| р | <0,001 | <0,001 | 0,52 | 0,02 | |
| ЧСС уд. в мин | |||||
| А | 79,00 (77,00;82,00) | 76,00 (74,00;79,00) | 85,00 (82,00;88,00) | 85,00 (79,50;91,00) | 1-3<0,001 2-3<0,001 1-4=0,01 2-4<0,001 |
| Б | 75,00 (74,00;76,50) | 76,00 (75,00;78,00) | 82,00 (80,00;85,00) | 81,00 (77,00;86,00) | 1-3<0,001 2-3<0,001 1-4<0,001 2-4<0,001 |
| р | <0,001 | 0,95 | 0,12 | 0,06 | |
Анализ показателей СМАД в динамике предоперационного периода (табл. 5) показал, что у пациентов с АГ за 2 недели до госпитализации были достоверно более высокими показатели АД и ЧСС, по сравнению с пациентами без АГ.
Таблица 5 Характеристика показателей СМАД у пациентов в зависимости от наличия АГ (n=100)
| Показатели | Пациенты без АГ (n=48) | Пациенты с АГ (n=52) | р |
| За 2 недели до операции | |||
| САД средн. сут., мм рт.ст. | 117,50 (113,50;129,00) | 121,00 (114,00;133,00) | 0,01 |
| ДАД средн. сут., мм рт.ст. | 75,00 (70,00;85,50) | 75,50 (70,00;79,00) | 0,08 |
| ЧСС средн. сут., уд. в мин | 66,00 (64,00;71,00) | 68,00 (61,00;75,00) | 0,04 |
| САД день, мм рт. ст. | 119,00 (116,00;133,50) | 123,00 (117,00;133,00) | 0,01 |
| САД ночь, мм рт. ст. | 113,00 (107,00;122,00) | 115,00 (105,00;121,50) | 0,03 |
| ДАД день, мм рт. ст. | 76,50 (70,00;86,00) | 77,50 (73,00;81,00) | 0,07 |
| ДАД ночь, мм рт. ст. | 73,00 (68,00;83,50) | 70,00 (63,00;74,00) | 0,61 |
| ПАД день, мм рт. ст. | 42,00 (37,00;48,00) | 46,00 (42,00;54,00) | 0,002 |
| ПАД ночь, мм рт. ст. | 39,50 (38,00;45,00) | 42,00 (40,00;49,00) | 0,03 |
| ЧСС день, уд. в мин | 68,00 (62,00;76,00) | 69,00 (65,00;72,00) | 0,20 |
| ЧСС ночь, уд. в мин | 59,50 (54,00;65,00) | 64,00 (62,50;73,00) | 0,004 |
| За 24 часа до операции | |||
| САД средн. сут., мм рт.ст. | 123,00 (111,00;136,50) | 134,00 (122,00;140,00)*** | 0,001 |
| ДАД средн. сут., мм рт.ст. | 78,00 (72,00;89,00) | 79,50 (75,00;85,00)* | 0,04 |
| ЧСС средн. сут., уд. в мин | 69,00 (64,50;73,00) | 69,00 (63,00;74,00) | 0,65 |
| САД день, мм рт. ст. | 126,00 (114,00;137,00) | 136,50 (125,00;144,00)** | 0,002 |
| САД ночь, мм рт. ст. | 121,00 (109,00;138,00) | 124,00 (108,00;135,50)* | 0,01 |
| ДАД день, мм рт. ст. | 80,00 (72,00;89,00) | 82,00 (78,00;86,00)* | 0,04 |
| ДАД ночь, мм рт. ст. | 80,50 (68,00;89,00) | 81,50 (75,00;92,00)** | 0,89 |
| ПАД день, мм рт. ст. | 46,50 (39,00;49,00) | 50,00 (47,00;58,00)* | 0,003 |
| ПАД ночь, мм рт. ст. | 41,50 (37,00;47,50) | 51,00 (44,00;61,00)* | 0,002 |
| ЧСС день, уд. в мин | 70,00 (65,00;74,00) | 70,50 (65,00;75,00)* | 0,86 |
| ЧСС ночь, уд. в мин | 65,50 (60,00;70,00) | 68,00 (61,00;70,00)* | 0,04 |
Примечание: * - при р<0,05; ** - при р<0,01; *** - при р<0,001 между показателями в группе пациентов с АГ в динамике; у пациентов без АГ достоверных различий в динамике не наблюдалось
Анализ СМАД выявил (рис. 2), что у половины пациентов с АГ за 2 недели до госпитализации в стационар преобладал нормальный суточный профиль АД – «dipper», как для САД, так и для ДАД. За 24 часа до операции увеличилось число пациентов с суточной кривой «non-dipper» по САД на 11,53% (р=0,04), а по ДАД – практически в три раза по сравнению с исходными данными (р=0,01). Итак, независимо от достижения целевых значений АД, накануне операции пациенты испытывают «предоперационный стресс», выражающийся в активации нейро-гуморальных систем, проявлением которого является некомпенсированный синдром АГ.

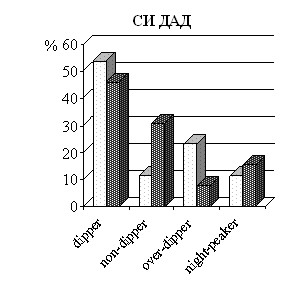
Рисунок 2 – Типы суточной кривой артериального давления у пациентов с артериальной гипертензией исходно (за 2 недели до госпитализации) и накануне операции (за 24 часа до операции)
Для выявления различий в частоте развития осложнений госпитального периода у пациентов с ЛХЭ в зависимости от наличия АГ и определения наиболее значимых предикторов послеоперационных осложнений обследованные пациенты с АГ (n=52) были распределены на 2 группы в зависимости от развития послеоперационных осложнений: первая – с отсутствием и вторая – с наличием осложнений (кардиологических и хирургических). По частоте выявляемости превалировали хирургические осложнения (у 11,54% больных) со стороны области хирургического вмешательства. Кардиологические осложнения проявлялись отсутствием достижения целевых значений АД (было так: имели характер декомпенсации АГ) в послеоперационном периоде у 4 (7,69%) больных и кардиалгии, не сопровождающейся изменениями ЭКГ у 2 (3,85%) пациентов.
В отличие от пациентов с наличием синдрома АГ, пациенты без АГ (n=48) не имели кардиологических и хирургических осложнений. Прочие осложнения (признаки желудочной и кишечной диспепсии) у пациентов без АГ наблюдались лишь в 3 (6,25%) случаях. Итак, у пациентов с АГ более чем в 3 раза чаще (р=0,04) встречались послеоперационные осложнения, по сравнению с пациентами без АГ.
У пациентов с АГ с осложненным послеоперационным периодом, по сравнению с лицами с АГ без осложнений, отмечалось достоверное увеличение как общей продолжительности госпитализации (14,00 (13,00;17,00) койко-дней против 10,00 (9,00;11,00) койко-дней; р<0,001), так и послеоперационного периода (10,00 (8,00;10,00) койко-дней против 7,00 (6,00;8,00) койко-дней; р<0,001). Причем длительность нахождения пациентов на больничной койке была достоверно большей у пациентов с отсутствием достижения целевых значений АД по сравнению с пациентами, достигшими целевых значений АД (дооперационный период – 3,00 (2,00;6,00) койко-дней против 2,00 (2,00;4,00) койко-дней; р=0,04), и общая продолжительность госпитализации – 12,00 (8,00;20,00) койко-дней против 8,00 (7,00;11,00) койко-дней; р=0,04).
Пациенты с АГ с развитием послеоперационных осложнений отличались от пациентов с неосложненным течением исходно более высокими средними значениями САД, ДАД и ПАД, зафиксированными накануне операции (табл. 6).
Таблица 6 Характеристика показателей СМАД исходно (за 2 недели до госпитализации) и накануне операции (за 24 часа до операции) у пациентов с АГ в зависимости от наличия послеоперационных осложнений
| Показатели | Пациенты без осложнений (n=42) | Пациенты с наличием осложнений (n=10) | р |
| За 2 недели до госпитализации | |||
| САД средн. сут., мм рт.ст. | 118,00 (113,00;129,00) | 125,00 (122,00;133,00) | 0,19 |
| САД день, мм рт. ст. | 123,00 (116,00;132,00) | 126,00 (122,00;133,00) | 0,32 |
| САД ночь, мм рт. ст. | 112,00 (107,00;118,00) | 123,00 (121,00;127,00) | 0,04 |
| ДАД средн. сут., мм рт.ст. | 75,00 (70,00;78,00) | 78,00 (74,00;81,00) | 0,47 |
| ДАД день, мм рт. ст. | 77,00 (73,00;80,00) | 78,00 (74,00;81,00) | 0,76 |
| ДАД ночь, мм рт. ст. | 69,00 (63,00;73,00) | 76,00 (74,00;80,00) | 0,04 |
| ПАД средн. сут., мм рт.ст. | 44,00 (41,00;51,00) | 50,00 (44,00;53,00) | 0,27 |
| ПАД день, мм рт. ст. | 46,00 (42,00;52,00) | 51,00 (45,00;55,00) | 0,27 |
| ПАД ночь, мм рт. ст. | 42,00 (40,00;48,00) | 48,00 (41,00;52,00) | 0,25 |
| ЧСС средн. сут., уд. в мин | 66,00 (63,00;69,00) | 68,00 (65,00;71,00) | 0,25 |
| За 24 часа до операции | |||
| САД средн. сут., мм рт.ст. | 127,00 (116,00;139,00) | 140,00 (140,00;148,00) | 0,04 |
| САД день, мм рт. ст. | 135,00 (120,00;140,00) | 143,00 (141,00;150,00) | 0,10 |
| САД ночь, мм рт. ст. | 113,00 (105,00;136,00) | 138,00 (132,00;142,00) | 0,04 |
| ДАД средн. сут., мм рт.ст. | 79,00 (75,00;83,00) | 81,00 (78,00;89,00) | 0,26 |
| ДАД день, мм рт. ст. | 80,00 (78,00;85,00) | 83,00 (83,00;93,00) | 0,32 |
| ДАД ночь, мм рт. ст. | 68,00 (64,00;83,00) | 77,00 (74,00;78,00) | 0,43 |
| ПАД средн. сут., мм рт.ст. | 50,00 (45,00;55,00) | 59,00 (47,00;69,00) | 0,04 |
| ПАД день, мм рт. ст. | 50,00 (44,00;55,00) | 57,00 (47,00;62,00) | 0,10 |
| ПАД ночь, мм рт. ст. | 49,00 (44,00;52,00) | 62,00 (50,00;78,00) | 0,03 |
| ЧСС средн. сут., уд. в мин | 68,00 (63,00;74,00) | 73,00 (72,00;74,00) | 0,38 |
Кроме того, у пациентов с АГ с наличием осложнений в послеоперационном периоде патологические суточные индексы (СИ) САД и ДАД регистрировались в 2 раза чаще, чем у лиц без осложнений: СИ САД – у 18 (42,85%), СИ ДАД – у 20 (47,62%) больных. Важно отметить, что у пациентов с АГ с развитием послеоперационных осложнений предоперационный прирост показателей СМАД более выражен по сравнению с пациентами без осложнений. Также достоверно увеличивалась длительность пребывания пациента на больничной койке, которая была достоверно большей у пациентов, не достигших целевых значений АД.
При определении гуморальных коррелятов стресс-индуцированных изменений гемодинамики у пациентов с ЛХЭ в зависимости от наличия АГ отмечено, что у пациентов с АГ, по сравнению с пациентами без АГ, исходно имела место тенденция к более высоким значениям ИЛ-8 (6,74 (5,02;31,32) пг/мл против 4,17 (2,43;6,29) пг/мл; р=0,06) при отсутствии различий по другим показателям. Перед операцией у пациентов с АГ, по сравнению с пациентами без АГ, более чем в 1,5 раза были выше показатели концентрации в крови эндотелина-1 (1,03 (0,72;1,28) фмоль/мл против 0,64 (0,49;0,86) фмоль/мл; р=0,01), в 2,9 раза – СРБ (9,23 (4,19;16,40) мг/л против 3,22 (2,75;4,23) мг/л; р=0,02) и в 2,3 раза – провоспалительного ИЛ-8 (10,15 (4,16;36,27) пг/мл против 4,49 (3,46;7,46) пг/мл; р=0,03) при тенденции к более низким значениям уровня противовоспалительного ИЛ-10 по сравнению с лицами без АГ (0,93 (0,75;1,65) пг/мл против 1,43 (1,29;1,68) пг/мл; р=0,09). Кроме того, в день операции, по сравнению с исходными значениями, у больных с АГ наблюдалось увеличение в 2 раза уровня СРБ (9,23 (4,19;16,40) мг/л против 4,45 (1,58;9,76) мг/л; р=0,02), повышение концентрации ИЛ-8 – на 50,59% (10,15 (4,16;36,27) пг/мл против 6,74 (5,02;31,32) пг/мл; р=0,009). Одновременно с увеличением содержания провоспалительного цитокина ИЛ-6 на 26,72% (1,47 (1,01;1,96) пг/мл против 1,16 (0,55;1,91) пг/мл; р=0,04) отмечено уменьшение на 25,00% (0,93 (0,75;1,65) пг/мл против 1,24 (0,94;2,04) пг/мл; р=0,02) содержания противовоспалительного цитокина – ИЛ-10. У пациентов с АГ перед оперативным вмешательством также выявлено достоверное повышение (на 37,86%) в крови концентрации мощного вазоконстриктора – эндотелина-1, по сравнению с исходным уровнем (1,03 (0,72;1,28) фмоль/мл против 0,68 (0,56;1,37) фмоль/мл; р=0,02). Перед выпиской из стационара у пациентов с АГ, по сравнению с пациентами без АГ, сохранялись более высокие значения маркеров воспаления (ИЛ-6 – в 1,9 раза выше (1,43 (0,97;1,92) пг/мл против 0,74 (0,57;1,48) пг/мл; р=0,04), ИЛ-8 – в 2,3 раза (9,73 (5,64;32,75) пг/мл против 4,26 (3,14;6,89) пг/мл; р=0,04) и дисфункции эндотелия (эндотелин-1 – в 1,6 раз (1,28 (0,85;2,36) фмоль/мл против 0,79 (0,40;1,53) фмоль/мл; р=0,02).
Выявлены корреляционные связи между изучаемыми биомаркерами и параметрами СМАД. Так, за 2 недели до предполагаемой хирургической процедуры обнаружена положительная корреляционная связь концентрации эндотелина-1 в сыворотке крови с величиной утреннего подъема САД (r=0,42; р=0,03), а за 24 часа до операции между содержанием ИЛ-6 в сыворотке крови и величиной утреннего подъема САД (r=0,44; р=0,03).
Таким образом, пациенты с синдромом АГ исходно демонстрируют более высокие показатели провоспалительного маркера ИЛ-8, достоверное нарастание уровней ИЛ-6, ИЛ-8 и СРБ перед операцией на фоне снижения концентрации противовоспалительного ИЛ-10, а также усиление вазопрессорного эффекта эндотелина.
При сравнении динамики анализируемых показателей у пациентов с АГ в зависимости от наличия осложнений (табл. 7) выяснилось, что у лиц с осложненным послеоперационным периодом регистрировались достоверно более высокие значения кортизола, эндотелина-1, СРБ и ИЛ-8. Кроме того, отмечена в 2 раза ниже концентрация ИЛ-10, а уровни ИЛ-1 и ИЛ-6 достоверно не различались по сравнению с аналогичными показателями пациентов с неосложненным послеоперационным периодом. Анализируя периоперационный прирост определяемых показателей у пациентов с АГ выявлено, что у лиц с развившимися осложнениями периоперационная динамика маркеров воспаления, дисфункции эндотелия и концентрации кортизола была бльшая (рис. 3).

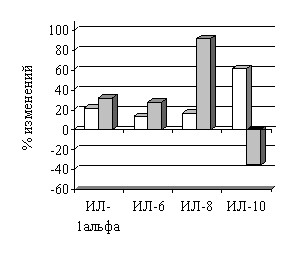
Рисунок 3 Процент изменения концентрации в крови интерлейкинов накануне операции (А) перед выпиской из стационара (В) по сравнению с исходными данными у пациентов с АГ в зависимости от наличия послеоперационных осложнений
Таблица 7 Показатели гормонального профиля, эндотелиальной дисфункции и воспаления у пациентов с синдромом АГ в зависимости от наличия послеоперационных осложнений исходно (за 2 недели до госпитализации), перед операцией (за 24 часа до операции) и перед выпиской (в среднем через 5-7 суток после операции)
| Показатели | Пациенты с отсутствием послеоперационных осложнений (n=42) | Пациенты с наличием послеоперационных осложнений (n=10) | ||||
| Исходно | Перед операцией | Перед выпиской | Исходно | Перед операцией | Перед выпиской | |
| Кортизол, нмоль/мл | 521,35 (438,40;638,25) | 534,40 (474,50;770,90) | 528,46 (458,50;730,00) | 563,20 (443,80;645,70) | 672,50 ** (511,80;766,80) | 654,21 (514,70;749,00) |
| Эндотелин-1, фмоль/мл | 0,62 (0,55;1,27) | 0,98 (0,72;1,13) | 1,43 • (0,68;2,19) | 0,79 (0,68;1,38) | 1,05 (0,46;1,82) | 1,65 • (0,67;2,39) |
| СРБ, мг/л | 4,13 (0,98;4,51) | 8,13 ## (0,60;10,00) | 25,85 ••• (11,90;34,60) | 17,03 *** (7,94;27,90) | 18,75*** (14,35;26,20) | 32,65 (30,60;33,49) |
| ИЛ1-, пг/мл | 0,82 (0,78;0,89) | 0,77 (0,76;0,82) | 1,00 (0,82;1,21) | 0,82 (0,78;0,84) | 0,83 (0,76;0,89) | 1,08 (0,89;1,76) |
| ИЛ-6, пг/мл | 1,18 (0,55;1,71) | 1,38 (0,78;1,63) | 1,34 (0,67;1,57) | 1,10 (0,97;3,04) | 1,47 (1,47;2,70) | 1,41 (1,39;2,63) |
| ИЛ-8, пг/мл | 5,39 (4,68;13,58) | 7,76 (3,05;36,03) | 6,31 (5,62;11,78) | 10,15 *** (6,40;36,37) | 20,06 *** # (6,91;34,64) | 19,42 *** # (6,57;35,12) |
| ИЛ-10, пг/мл | 1,24 (0,94;1,98) | 1,09 (0,79;1,65) | 2,00 (1,22;2,47) | 2,11 *** (1,09;6,57) | 0,97 ## (0,75;1,67) | 1,36 ** (1,05;5,07) |
Примечание: * - р<0,05, ** - р<0,01, *** - р<0,001 по сравнению с аналогичными показателями между группами;
# - р<0,05, ## - р<0,01 динамика между аналогичными показателями в группах накануне операции по сравнению с исходным уровнем;
• - р<0,05, ••• - р<0,001 динамика между аналогичными показателями в группах перед выпиской по сравнению с исходным уровнем
Выявлена взаимосвязь показателей гормонального профиля и данных суточного мониторирования АД, выполненных накануне проведения оперативного вмешательства у пациентов с наличием послеоперационных осложнений. Так, в группе больных с осложнениями перед операцией регистрировалась сильная положительная корреляционная связь концентрации кортизола с показателями СМАД: общим ДАД >90 мм рт. ст. (r=0,90; р=0,03), ДАД днем >90 мм рт. ст. (r=0,90; р=0,03), ДАД ночью >90 мм рт. ст. (r=0,90; р=0,03) и средней ЧСС уд. в мин ночью (r=0,87; р=0,05), а также содержанием провоспалительного цитокина ИЛ-6 (r=0,97; р<0,001). В свою очередь, у пациентов без осложнений в послеоперационном периоде корреляционные связи имели меньшую значимость. Отмечена лишь положительная связь средней силы ИЛ-1 с вариабельностью суточного ДАД (r=0,48; р=0,03); ИЛ-6 с вариабельностью ЧСС ночью (r=0,56; р=0,01); ИЛ-10 с индексом времени САД ночью (r= -0,51; р=0,03). У пациентов с осложнениями выявлена сильная корреляционная связь показателей, оцененных накануне операции – эндотелина-1 со средним за сутки и ночь пульсовым АД (r=0,97; р<0,001), в группе без осложнений достоверных связей такого рода не обнаружено. Кроме того, у пациентов с послеоперационными осложнениями выявлена сильная положительная корреляционная связь между оцененными за 2 недели до операции уровнем ИЛ-1, с одной стороны, и вариабельностью ДАД в дневное время суток (r=0,95; р=0,01), а также отрицательная связь между степенью ночного снижения ДАД (r= -0,90; р=0,03); ИЛ-6 со средним значением ДАД ночью (r=0,97; р<0,001); ИЛ-10 с вариабельностью ЧСС днем (r=0,90; р=0,03). В свою очередь, у пациентов без осложнений в послеоперационном периоде корреляционные связи имели меньшую значимость.
Таким образом, пациенты с АГ перед оперативным вмешательством имеют проявления классического стресс-синдрома, характеризующегося не только повышением артериального давления, но и дисбалансом про- и антивоспалительного цитокинового профиля, повышением эндотелина-1, кортизола. Выраженность стресс-реакции может выступать в качестве прогностического фактора в отношении развития послеоперационных осложнений, повышая вероятность развития различных как кардиологических, так и некардиологических осложнений.
При анализе динамики предоперационных стресс-индуцированных изменений психологического состояния пациентов с АГ при плановой ЛХЭ (табл. 8), установлено, что накануне операции, по сравнению с исходными данными, у пациентов с АГ достоверно увеличивался средний балл реактивной тревожности (РТ). У пациентов с наличием и отсутствием послеоперационных осложнений не было выявлено достоверных различий в уровнях тревожности (личностной и реактивной), оцененной в предоперационном периоде. Однако у пациентов с осложнённым течением послеоперационного периода средний балл тревожности, как личностной (ЛТ), так и РТ, имели тенденцию к повышению накануне операции, по сравнению с исходными их значениями (табл. 9).
Таблица 8 Средние баллы тревожности у пациентов в зависимости от наличия АГ исходно (за 2 недели до госпитализации) и накануне операции
| Параметры | Исходно | Накануне операции | р |
| Пациенты с АГ (n=52) | |||
| ЛТ | 48,00 (43,00;54,00) | 48,50 (44,00;51,00) | 0,21 |
| РТ | 36,50 (32,00;39,00) | 38,00 (35,00;41,00) | 0,01 |
| Пациенты без АГ (n=48) | |||
| ЛТ | 39,00 (36,00;47,00)*** | 42,00 (35,00;48,00)*** | 0,14 |
| РТ | 35,00 (33,00;38,00) | 36,00 (34,50;39,00) | 0,25 |
Примечание: *** – р<0,001 при сравнении ЛТ между группами
Таблица 9 Средние баллы тревожности у пациентов с АГ и без АГ в зависимости от наличия осложнений исходно (за 2 недели до госпитализации) и накануне операции
| Параметры | Исходно | Накануне операции | р |
| Пациенты с АГ без осложнений (n=42) | |||
| ЛТ | 47,00 (42,00;52,00) | 48,00 (44,00;51,00) | 0,63 |
| РТ | 38,00 (33,00;40,00) | 38,00 (34,00;41,00) | 0,06 |
| Пациенты с АГ с наличием осложнений (n=10) | |||
| ЛТ | 48,00 (44,00;56,00) | 50,00 (46,00;56,00) | 0,07 |
| РТ | 37,00 (35,00;38,00) | 40,00 (38,00;40,00) | 0,07 |
| Пациенты без АГ без осложнений (n=45) | |||
| ЛТ | 38,00 (37,00;44,00) | 40,00 (35,00;48,00) | 0,11 |
| РТ | 35,00 (35,00;39,00) | 36,00 (34,00;39,00) | 0,44 |
| Пациенты без АГ с наличием осложнений (n=3) | |||
| ЛТ | 38,00 (32,00;48,00) | 45,00 (38,00;45,00) | 0,05 |
| РТ | 38,00 (37,00;38,00) | 39,00 (39,00;40,00) | 0,11 |
Примечание: достоверных различий между средним баллом ЛТ и РТ у пациентов обеих групп с осложненным и неосложненным периодом исходно и накануне операции не выявлено
Анализ различий в параметрах, характеризующих тревожность в зависимости от степени компенсации АГ, показал, что за 2 недели до госпитализации у пациентов, достигших целевых значений АД регистрировался у большего числа средний и высокий уровень ЛТ (38,10% и 57,14%, соответственно), а низкий уровень – в 4,76% случаев. У пациентов без достижения в дооперационном периоде целевых значений АД исходно преобладал высокий уровень ЛТ (80,00%), пациентов с низким уровнем ЛТ не было. Данная закономерность по уровням ЛТ прослеживалась и накануне операции.
Средний уровень РТ наблюдался у большинства пациентов вне зависимости от степени компенсации АГ как исходно (с достижением целевых значений АД – 85,71%; без достижения целевых значений АД – 60,00%), так и накануне операции (с достижением целевых значений АД– 85,71%; без достижения целевых значений АД – 80,00%). Однако у пациентов без достижения целевых значений АД в дооперационном периоде в отличие от пациентов, достигших целевых значений АД, накануне операции регистрировался достоверный прирост среднего балла РТ на 13,51% (42,00 (41,00;43,00) балла против 37,00 (35,00;43,00) баллов; р=0,02), по сравнению с исходными данными.
Таким образом, в предоперационном периоде у большинства больных с АГ диагностированы высокий уровень ЛТ и средний уровень РТ. Предоперационный период у пациентов с АГ характеризовался увеличением накануне оперативного вмешательства показателей РТ при отсутствии динамики показателей ЛТ. Пациенты с отсутствием достижения целевых значений АД имели больший прирост среднего балла РТ накануне операции, по сравнению с исходными данными.
Анализ корреляции уровня тревожности с цитокиновым профилем показал их тесную связь, степень и сила которой менялась в зависимости от времени их оценки. Уровень ЛТ, оцененный за 2 недели до поступления пациента в стационар, коррелировал со следующими изучаемыми маркерами воспаления: с концентрацией ИЛ-6 (r=0,69; р=0,04) и ИЛ-10 (r=-0,83; р=0,01). В то же время накануне операции была выявлена прямая корреляционная связь РТ с концентрацией провоспалительного ИЛ-8 (r=0,58; р=0,01) и имела место обратная корреляционная связь с уровнем ИЛ-10 (r=-0,43; p=0,03).
Проведена оценка эффективности и безопасности использования бисопролола в периоперационном периоде у 123 пациентов с АГ, подвергшихся плановой ЛХЭ. На фоне предшествующей антигипертензивной терапии по данным «офисного» измерения АД за 2 недели до оперативного вмешательства у всех пациентов имелась 1 степень АГ, что характеризует терапию как неадекватную. К моменту поступления в стационар на фоне подбора антигипертензивной терапии у всех больных были достигнуты целевые уровни АД. Средние значения «офисного» измерения АД, ЧСС, а также показатели СМАД, оцененные за 2 недели до предполагаемого вмешательства, достоверно не различались в двух анализируемых группах.
У пациентов, принимающих БАБ, ЧСС как при поступлении в стационар, так и накануне оперативного вмешательства (за сутки до операции) оказалась достоверно ниже – на 12,12% и 21,31% соответственно, чем у пациентов контрольной группы (табл. 10). При анализе динамики показателей СМАД выяснено, что в течение «предоперационных» суток значения ночных и дневных измерений АД не различались в анализируемых группах, в то время как показатели ЧСС были достоверно ниже у пациентов, принимавших бисопролол (табл. 11).
Мониторирование показателей АД и ЧСС в интраоперационном периоде показало их различия в обследуемых группах (рис. 4).
Примечание: * - р<0,05 при сравнении показателей САД между группами
Рисунок 4 – Показатели гемодинамики у обследованных пациентов в интраоперационном периоде
Таблица 10 Динамика средних показателей «офисного» измерения АД (мм рт. ст.) и ЧСС (уд. в мин) у пациентов с планируемой лапароскопической холецистэктомией в исследуемых группах
| Показатели | Исходно | При поступлении в стационар | За сутки до операции | |||
| 1 группа | 2 группа | 1 группа | 2 группа | 1 группа | 2 группа | |
| САД | 125,00 ••• (117,00;134,00) | 126,00 ••• (118,00;133,00) | 128,00 ••• (119,00;136,00) | 128,00 ••• (121,00;136,00) | 138,00 (126,00;151,00) | 139,00 (128,00;149,00) |
| ДАД | 76,00 (70,00;83,00) | 75,00 (69,00;83,) | 78,00 (72,00;85,00) | 80,00 (73,00;86,00) | 77,00 (67,00;86,00) | 79,00 (69,00;88,00) |
| ЧСС | 74,00 ••• (67,00;83,00) | 75,00 (67,00;82,00) | 66,00 • (59,00;72,00) | 74,00 *** (64,00;83,00) | 61,00 (54,00;67,00) | 74,00 *** (62,00;85,00) |
Примечание: *** - р<0,001 по сравнению с аналогичным показателем противоположной группы;
• - р <0,05, ••• - р<0,001 по сравнению с аналогичным показателем за сутки до операции
Таблица 11 Средние показатели АД (мм рт. ст.) и ЧСС (уд. в мин) по данным СМАД исходно (за 2 недели до операции) и за сутки до операции
| Показатели | 1 группа | 2 группа | ||
| Исходно | За сутки до операции | Исходно | За сутки до операции | |
| СИ САД, % | 7,00 (3,00;11,00) | 9,00 (4,00;15,00) | 7,50 (3,00;14,50) | 10,00 (4,00;17,00) |
| СИ ДАД, % | 9,00 (3,00;14,00) | 9,00 (3,00;16,00) | 10,00 (4,00;15,50) | 14,50 (7,00;23,00) |
| САД ср. дн. | 132,50 (126,00;144,00) | 118,00 (113,00;129,50) | 140,50 (113,00;167,00) | 123,00 (116,00;133,00) |
| ДАД ср. дн. | 87,50 (82,00;95,00) | 73,00 (66,00;81,00) | 83,00 (76,00;91,00) | 76,50 (72,00;80,00) |
| ЧСС ср. дн. | 76,00 (74,50;83,00) | 62,00 (60,50;71,00) * | 78,00 (76,00;84,00) | 74,00 (69,00;83,50) • |
| САД ср. ночн. | 127,00 (106,00;149,00) | 113,00 (106,00;122,50) | 126,00 (107,50;147,00) | 114,00 (105,50;120,00) |
| ДАД ср. ночн. | 82,00 (75,00;91,50) | 69,00 (64,00;79,00) | 87,00 (80,00;96,00) | 67,00 (61,00;75,00) |
| ЧСС ср. ночн. | 68,00 (64,00;74,00) | 58,00 (54,00;62,00) * | 74,00 (67,00;82,00) | 73,00 (65,00;82,00) • |
Примечание: * - р<0,05 по сравнению с исходными значениями;
• - р<0,05 по сравнению с соответствующими значениями пациентов 1 группы
У 25 (37,88%) пациентов контрольной группы и 11 (19,30%) пациентов группы воздействия выявлены послеоперационные осложнения. Соответственно, в группе пациентов с предоперационной подготовкой БАБ, по сравнению с пациентами, не принимавшими БАБ, эти цифры составили 3,51% случаев локальных хирургических осложнений (против 3,03%; 2=0,85), 7,08% случаев сердечно-сосудистых осложнений (против 27,27%; 2=0,03) и 8,77% случаев прочих событий (против 7,58%; 2=0,76). Выявлены достоверные различия по средней длительности пребывания пациентов в стационаре – у пациентов контрольной группы – 12,00 (9,00;16,00) койко-дней, у пациентов группы воздействия – 9,00 (6,00;11,00) койко-дней (р=0,04). Кроме того, количество пациентов, у которых течение периоперационного периода оказалось неосложненным, было больше при использовании в предоперационном периоде БАБ (80,70%), чем у пациентов без них (62,12%).
Таким образом, терапия БАБ, основанная на титровании доз в предоперационном периоде оказалась безопасной. Подтверждением эффективности такого подхода являются различия в частоте развития кардиоваскулярных осложнений у обследуемых групп пациентов. Так, у пациентов с использованием в предоперационном периоде БАБ их частота была в 4 раза ниже, чем у пациентов группы сравнения.
Артериальная гипертензия у пациентов с атеросклеротическим поражением аорты и ее ветвей
В данном исследовании проведена оценка частоты выявления и особенности синдрома АГ у пациентов с ОЗСНК (n=102) по результатам оценки «офисного» АД и его суточного мониторирования.
При анализе различий показателей СМАД в анализируемых группах (табл. 12) выяснено, что по таким важным показателям, определяющим прогноз пациентов как средние дневные и ночные показатели САД и ДАД, а также степень ночного снижения АД, определяемая СИ, достоверных различий выявлено не было.
Таким образом, несмотря на «нормальные» значения «офисного» измерения АД, пациенты с ОЗСНК по данным СМАД демонстрируют близкие значения АД, по сравнению с пациентами с АГ. Данный факт позволяет прийти к выводу о том, что «офисное» измерение АД у пациентов с ОЗСНК является обязательным, но недостаточным в диагностике АГ. А проведение СМАД позволяет выявить АГ дополнительно у 15 (14,71%) пациентов с неизмененными «офисными» цифрами АД. Кроме того, для пациентов с ОЗСНК характерна изолированная систолическая АГ. Так, у 42 из 69 (60,87%) пациентов с АГ выявлена данная форма АГ, в то время как у остальных – систоло-диастолическая.
Таблица 12 Сравнение показателей СМАД (мм рт. ст.) в исследуемых группах
| Характеристики | Пациенты без АГ (n=48) | Пациенты с АГ (n=54) | р |
| САД мин. | 91,50 (85,00;99,00) | 91,00 (84,00;100,50) | 0,58 |
| ДАД мин. | 60,00 (52,00;67,00) | 61,00 (53,00;69,50) | 0,30 |
| САД макс. | 158,00 (148,00;169,00) | 168,00 (157,50;180,00) | <0,001 |
| ДАД макс. | 95,00 (90,50;99,00) | 98,50 (92,00;109,00) | 0,01 |
| САД средн. днем | 131,00 (117,00;147,00) | 135,00 (120,50;149,00) | 0,20 |
| ДАД средн. днем | 77,00 (70,00;87,00) | 78,00 (70,00;88,00) | 0,95 |
| Вариабельность САД днем | 15,50 (11,00;19,00) | 16,00 (13,00;20,00) | 0,19 |
| Вариабельность ДАД днем | 11,00 (9,50;13,00) | 13,50 (12,00;15,00) | 0,01 |
| САД средн. ночью | 118,00 (106,00;135,50) | 122,00 (106,00;132,00) | 0,32 |
| ДАД средн. ночью | 67,00 (60,00;71,50) | 68,00 (61,00;73,00) | 0,82 |
| Вариабельность САД ночью | 10,00 (6,00;13,00) | 11,00 (8,00;14,00) | 0,06 |
| Вариабельность ДАД ночью | 9,50 (5,00;12,50) | 10,00 (7,00;13,00) | 0,07 |
| Среднее пульсовое АД | 49,00 (47,00;55,00) | 50,00 (43,00;59,00) | 0,83 |
| СИ САД, % | 9,00 (2,50;18,00) | 10,50 (4,00;18,50) | 0,13 |
| СИ ДАД, % | 12,00 (4,00;22,00) | 14,00 (7,00;20,00) | 0,16 |
| % САД общ 140 | 37,00 (21,50;54,00) | 38,00 (24,00;57,00) | 0,63 |
| % ДАД общ 90 | 25,50 (5,00;48,00) | 25,00 (4,00;49,00) | 0,33 |
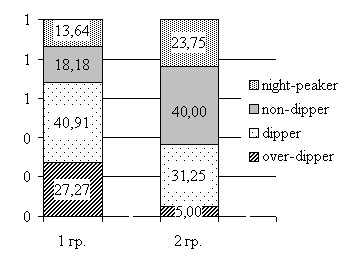
Анализ пациентов, разделенных по результатам «офисного» измерения АД на лиц с повышенным и нормальным значениями АД (см. ранее приведенную табл. 3), по суточным индексам АД (рис. 5) продемонстрировал, что независимо от значений «офисного» АД, для пациентов с ОЗСНК характерен патологический суточный индекс АД.


Примечание: для межгрупповых различий *р=0,01 по СИ САД и *р=0,50 по СИ ДАД.
Первая группа – пациенты без АГ, вторая – с АГ при «офисном» измерении
Рисунок 5 Сравнительная характеристика показателей СМАД по СИ САД и СИ ДАД у пациентов с атеросклеротическим изменением аорты и ее ветвей
Так, среди пациентов с повышенными значениями АД при «офисном» его измерении только у 18 (37,5%) выявляется суточный профиль АД по САД «dipper», в то время как у остальных пациентов – 30 (62,5%) наблюдались патологические суточные профили. В группе пациентов с нормальным «офисным» АД был также наиболее высок процент выявления пациентов с отсутствием снижения в ночное время САД. Такая же закономерность проявлялась и при анализе распределения суточного профиля по ДАД. Патологические профили АД по результатам СМАД выявлены в целом (для САД и ДАД) у 70,9% 1-й группы и 70,4% пациентов - 2-й. Приведенный факт свидетельствует о том, что у большинства пациентов с ОЗСНК независимо от выявления синдрома АГ при «офисном» измерении АД выявляются патологические суточные профили АД.
Оценена возможность прогнозирования риска развития интраоперационных осложнений, используя показатели только офисного измерения АД. В качестве интраоперационных осложнений анализировались нестабильность гемодинамики во время оперативного вмешательства, нарушение коронарного кровообращения.
Выяснилось, что интраоперационная нестабильность показателей гемодинамики в виде критического повышения АД более 180/100 мм рт. ст., и/или снижения его ниже 80/50 мм рт. ст., а также необходимость, соответственно, введения вазодилятаторов или вазоконстрикторов регистрировалась у 80 из 102 пациентов (78,43%). При этом риск развития эпизодов нестабильности показателей гемодинамики был достоверно выше у пациентов 2 группы (с «офисной» АГ) – 49 (90,74%), по сравнению с пациентами с нормальными цифрами АД – 31 (64,58%); р=0,02. Вместе с тем, у пациентов с наличием осложнений в виде эпизодов нестабильности гемодинамики не выявлено различий в исходных значениях показателей Эхо-КГ, по сравнению с пациентами без такого осложнения.
Сравнительный анализ параметров СМАД в группах пациентов с наличием и отсутствием нестабильности показателей гемодинамики (табл. 13) продемонстрировал, что эти группы пациентов во время оперативного вмешательства по показателям СМАД достоверно отличались по большинству анализируемых показателей.
Таблица 13 Показатели СМАД (мм рт. ст.) в группах со стабильной и нестабильной гемодинамикой во время оперативного вмешательства
| Показатель | Нестабильная гемодинамика (n=80) | Стабильная гемодинамика (n=22) | р |
| САД средн. днем | 139,00 (129,00;152,00) | 131,00 (129,00;140,00) | 0,02 |
| ДАД средн. днем | 83,00 (73,50;89,00) | 76,00 (75,00;80,00) | 0,01 |
| Вариабельность САД днем | 18,00 (14,00;23,00) | 15,00 (12,00;19,00) | <0,001 |
| Вариабельность ДАД днем | 12,00 (10,00;13,00) | 12,00 (9,00;14,00) | 0,99 |
| САД средн. ночью | 120,50 (112,00;139,00) | 121,00 (114,00;129,00) | 0,83 |
| ДАД средн. ночью | 69,00 (63,00;72,00) | 67,00 (63,50;68,00) | 0,41 |
| Вариабельность САД ночью | 10,00 (6,00;14,00) | 10,00 (8,00;13,00) | 0,26 |
| Вариабельность ДАД ночью | 9,00 (6,00;11,00) | 10,00 (6,00;13,00) | 0,10 |
| Среднее пульсовое АД | 49,00 (38,00;58,00) | 50,00 (42,00;60,00) | 0,63 |
| СИ САД, % | 14,00 (3,00;21,00) | 8,00 (1,50;16,00) | 0,01 |
| СИ ДАД, % | 18,00 (8,00;30,00) | 11,00 (4,00;19,00) | <0,001 |
| % САД общ 140 | 43,00 (22,00;58,00) | 36,50 (19,00;53,00) | 0,18 |
| % ДАД общ 90 | 38,00 (12,00;56,00) | 22,00 (0,50;42,00) | 0,02 |
Кроме того, при оценке характера измерений показателей СМАД у пациентов с наличием интраоперационных осложнений выяснилось, что у пациентов с наличием этих осложнений в предоперационном периоде чаще регистрировались такие СИ как «non-dipper» по САД и по ДАД, в то время как у пациентов с отсутствием осложнений – «dipper» (рис. 6).

Примечание: для межгрупповых различий *р=0,006 по СИ САД и *р=0,017 по СИ ДАД.
Первая группа – пациенты со стабильной гемодинамикой, вторая – с нестабильной
Рисунок 6 Связь типа суточной кривой АД интраоперационно с нестабильностью гемодинамики по СИ САД и СИ ДАД
Относительный риск интраоперационных осложнений (нестабильность гемодинамики) при наличии типа суточной кривой по САД «non-dipper» и «night-peaker» составляет 3,77 ДИ [1,38-10,31]; по ДАД – 3,57 ДИ [1,20-10,62] (р=0,01).
Одним из наиболее важных показателей неблагополучного прогноза является развитие коронарной недостаточности во время оперативного вмешательства, проявляющаяся динамикой сегмента ST. Цифры АД, оцененные накануне операции, не были связаны с риском развития коронарной недостаточности. При дооперационной верифицированной ИБС относительный риск интраоперационной коронарной недостаточности составил 22,90 ДИ [8,09-64,76].
При сравнении показателей СМАД в группах с наличием и отсутствием коронарной недостаточности во время оперативного вмешательства, было установлено, что группы различались по вариабельности САД и ДАД ночью (табл. 14), в то время как по среднесуточным показателям САД и ДАД, а также СИ (рис. 7) достоверных различий не было.
Таблица 14 Показатели СМАД (мм рт. ст.) в группах больных с наличием и отсутствием коронарной недостаточности во время оперативного вмешательства
| Показатели | Коронарная недостаточность во время операции | р | |
| Не отмечалась (n=64) | Отмечалась (n=38) | ||
| САД средн. днем | 133,00 (120,50;138,00) | 132,00 (120,00;136,00) | 0,96 |
| ДАД средн. днем | 77,00 (70,00;81,00) | 77,00 (66,00;85,00) | 0,96 |
| Вариабельность САД днем | 16,00 (12,00;18,00) | 15,00 (11,00;19,00) | 0,11 |
| Вариабельность ДАД днем | 12,00 (9,00;14,00) | 12,00 (10,00;13,00) | 0,27 |
| САД средн. ночью | 122,00 (115,00;131,00) | 120,00 (118,00;127,00) | 0,70 |
| ДАД средн. ночью | 67,00 (63,00;82,00) | 66,00 (64,00;80,50) | 0,77 |
| Вариабельность САД ночью | 12,00 (9,50;14,00) | 9,00 (7,00;10,00) | 0,04 |
| Вариабельность ДАД ночью | 11,00 (9,00;13,00) | 8,00 (6,00;10,00) | 0,03 |
| Среднее пульсовое АД | 50,00 (39,00;58,00) | 49,00 (39,00;60,00) | 0,79 |
| СИ САД, % | 9,00 (0,50;16,00) | 9,00 (1,00;18,00) | 0,63 |
| СИ ДАД, % | 13,00 (4,00;18,00) | 12,00 (3,00;20,00) | 0,52 |
| % САД общ 140 | 38,00 (19,00;52,00) | 37,00 (20,00;51,00) | 0,83 |
| % ДАД общ 90 | 28,00 (4,00;50,00) | 23,00 (1,00;40,00) | 0,19 |

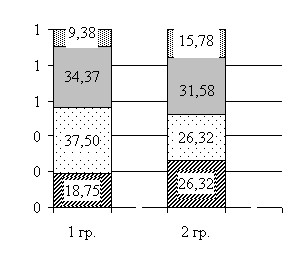
Примечание: для межгрупповых различий *р=0,076 по СИ САД, *р=0,075 по СИ ДАД
Первая группа – пациенты с отсутствием коронарной недостаточности, вторая – с ее наличием
Рисунок 7 Связь типа суточной кривой АД с интраоперационным развитием коронарной недостаточности по СИ САД и СИ ДАД
В связи с выявлением множества показателей, способных оказывать влияние на попадание пациента в группу неблагоприятного прогноза, в данной работе проведен множественный регрессионный анализ: Z = -3,880 - ИБС*2,712 + СД*1,163 + Вариабельность ДАД ночью*0,300 + Вариабельность САД ночью*0,274. Для прогнозирования развития периоперационной нестабильности гемодинамики: Z = -5,307 – СИ ДАД*0,485 – АД «офисное»*1,383 + САД макс.*0,036 + Вариабельность САД днем*0,164.
Выяснено, что, в целом, осложненное течение послеоперационного периода было характерно для 20 (41,67%) пациентов 1 группы и 32 (59,26%) – 2 группы (р=0,03). Таким образом, «офисные» показатели АД могут быть использованы в качестве предикторов развития ранних послеоперационных осложнений. Вместе с тем, по отдельным показателям не выявлено достоверных различий у пациентов с нормальными и повышенными значениями «офисного» АД.
И, наконец, была оценена возможность использования показателей «офисного» измерения АД и СМАД для прогнозирования риска развития сердечно-сосудистых событий в течение года после операции по поводу атеросклеротического поражения аорты и ее ветвей. Среди пациентов с осложненным течением послеоперационного периода (n=38) у 14 (37%) выявлялась в анамнезе АГ. В то время как среди пациентов с благоприятным прогнозом (n=64) проявления АГ в анамнезе были у 16 (25%). Выяснено, что достоверных различий по частоте выявления традиционных факторов риска в анализируемых группах не выявлено. Таким образом, используя для прогнозирования таких показателей как возраст пациента, факт повышения АД при «офисном» измерении, наличие в анамнезе ХОБЛ, ИБС невозможно прогнозировать отдаленные результаты оперативного вмешательства.
В качестве факторов, определяющих годовую судьбу пациентов, были идентифицированы уровень холестерина, давление в легочной артерии (ДЛА), размеры левого предсердия (ЛП) и толщина задней стенки левого желудочка (ЗСЛЖ), так как у пациентов с неблагоприятным прогнозом данные показатели были достоверно выше, чем у пациентов с благоприятным прогнозом (табл. 15).
Таблица 15 Исходные клинические и лабораторные показатели пациентов с благоприятным и неблагоприятным течением отдаленного послеоперационного периода
| Показатели | Прогноз | р | |
| Благоприятный (n=64) | Неблагоприятный (n=38) | ||
| Холестерин, ммоль/л | 6,23 (4,68;6,50) | 6,92 (5,77;8,75) | 0,049 |
| КДО, мл | 145,75 (134,50;157,00) | 145,00 (135,70;155,50) | 0,07 |
| ДЛА, мм рт. ст. | 17,00 (12,92;20,70) | 19,44 (13,00;25,56) | 0,01 |
| ЛП, см | 3,63 (3,32;3,90) | 3,70 (3,25;4,15) | 0,01 |
| ЗСЛЖ, см | 1,13 (1,10;1,22) | 1,24 (1,16;1,34) | 0,02 |
| ФВ, % | 62,12 (55,80;68,42) | 60,25 (53,27;67,19) | 0,30 |
Результаты анализа СМАД показали, что у пациентов с неблагоприятным прогнозом, по сравнению с лицами, имеющими благоприятное течение отдаленного послеоперационного периода, достоверно большей была вариабельность в ночное время САД (11,00 (8,50;14,00) мм рт. ст. против 10,00 (8,00;12,00) мм рт. ст.; р=0,03) и ДАД 10,00 (7,00;12,00) мм рт. ст. против 9,00 (6,00;13,00) мм рт. ст.; р=0,01). Кроме того, в группе пациентов с неблагоприятным прогнозом у большинства пациентов по СИ САД и СИ ДАД преобладала суточная кривая типа «non-dipper» (по СИ САД – 52,62% против 15,63%; р=0,002 и по СИ ДАД – 47,37% против 18,75%; р=0,002) и «night-peaker» (по СИ САД – 26,34% против 18,75%; р=0,002 и по СИ ДАД – 23,68% против 12,50%; р=0,002).
С целью определения независимых предикторов неблагоприятного исхода в течение года после перенесенного хирургического вмешательства проведен дискриминационный анализ, в который были включены все ранее исследуемые параметры (клинико-анамнестические данные, данные «офисного» измерения АД и СМАД, показатели метаболического профиля, данные Эхо-КГ). В качестве факторов неблагоприятного прогноза идентифицированы следующие показатели: такие как ДЛА выше 30 мм рт. ст., фракция выброса (ФВ) ниже 40% (по данным дооперационной Эхо-КГ) и процент измерений САД >140 мм рт. ст. по данным СМАД. Прогностическая модель, включающая указанные показатели, объясняет 68,6% наблюдений, что является хорошим результатом. Качество полученной модели оценено с помощью С-статистики, площадь под ROC-кривой составила 0,70 (95% доверительный интервал 0,59-0,80), p=0,001.
Таким образом, полученные данные исследования свидетельствуют о том, что использование для предоперационного обследования показателей СМАД позволяет повысить эффективность оценки риска развития интраоперационных и отдаленных послеоперационных осложнений у пациентов с ОЗСНК. Приведенные данные могут явиться основанием для использования показателей СМАД в качестве критериев эффективности медикаментозных вмешательств у пациентов с ОЗСНК.
Представленные в настоящем исследовании результаты позволяют утверждать, что АД, оцененное при поступлении пациента в хирургическую клинику, является важным, однако не достаточным исследованием для оценки риска развития интра- и послеоперационных осложнений у пациентов, подвергающихся некардиологическим операциям. Проведение в предоперационном периоде СМАД позволяет выделить группу высокого риска развития периоперационных осложнений. К такой категории должны быть отнесены, прежде всего, пациенты, имеющие недостаточное снижение АД в ночное время, а также высокую его вариабельность. Данный факт должен быть использован не только для предоперационной риск-стратификации, но и для оценки эффективности проводимой терапии, нацеленной, в частности, на нормализацию показателей артериального давления.
ВЫВОДЫ
- Среди пациентов, подвергшихся плановой ЛХЭ, более чем у 60% выявляется синдром АГ. В течение трехлетнего послеоперационного наблюдения риск развития неблагоприятных событий, в том числе, кардиологических, определялся наличием АГ, ее декомпенсацией в предоперационном периоде и фактом отсутствия приема в дооперационном периоде иАПФ и БАБ.
- Для пациентов с АГ при проведении плановой ЛХЭ характерны более высокие значения показателей гемодинамики, оцененные в пред-, интра- и в раннем послеоперационном периодах по сравнению с пациентами без АГ. Пациенты с АГ в предоперационном периоде характеризуются достоверно более частым выявлением патологических суточных индексов АД, а также большим процентом измерений стресс-индуцированных показателей гемодинамики, оцененных за 2 недели до госпитализации и накануне операции. Проведение СМАД в предоперационном периоде позволяет более эффективно определять степень компенсации АГ.
- Частота развития ранних послеоперационных, в том числе, кардиологических осложнений у пациентов с АГ в 3 раза выше, по сравнению с пациентами без синдрома АГ. У пациентов с осложненным послеоперационным течением на фоне АГ патологические суточные индексы САД и ДАД регистрировались в 2 раза чаще («non-dipper» с 60% исходно (за 2 недели до госпитализации) до 100% накануне операции), чем у лиц без осложнений. Пациенты с АГ и осложненным послеоперационным течением, по сравнению с пациентами без осложнений, характеризовались в 2 раза более частым выявлением в предоперационном периоде патологических суточных индексов «non-dipper».
- У пациентов с АГ регистрируется большая стресс-индуцированная периоперационная динамика маркеров воспаления (СРБ, ИЛ-6, ИЛ-8 и ИЛ-10), дисфункция эндотелия – эндотелин-1, по сравнению с пациентами без АГ. Только у пациентов с АГ существует корреляционная связь между маркерами воспаления и эндотелиальной дисфункцией (ИЛ-6, эндотелин-1), с одной стороны, и показателями СМАД, с другой, оцененные как за 2 недели до планируемой госпитализации, так и за 24 часа до операции.
- Существует взаимосвязь между вероятностью развития послеоперационных осложнений и предоперационным уровнем маркеров воспаления и дисфункцией эндотелия. Пациенты с осложненным течением послеоперационного периода характеризуются более высоким уровнем в предоперационном периоде СРБ, ИЛ-8, эндотелина-1 и кортизола и более низким – противовоспалительного ИЛ-10.
- Для пациентов с ЖКБ и сопутствующей АГ в предоперационном периоде характерны высокие показатели личностной тревожности. Выраженность психоэмоциональной дисфункции коррелирует с активностью субклинического воспаления.
- Использование в предоперационном периоде бета-блокатора бисопролола за 14 дней до предполагаемой плановой ЛХЭ позволяет в 4 раза снизить частоту развития кардиологических осложнений, гемодинамические проявления периоперационного стресса у пациентов с АГ и является безопасным.
- По результатам «офисного» измерения АД синдром АГ выявляется у 53% пациентов с ОЗСНК. Проведение СМАД позволяет повысить эффективность выявления АГ до 67%. Для пациентов с ОЗСНК характерна изолированная систолическая АГ, которая выявляется у 61% больных с АГ, а также высокая частота выявления патологических суточных индексов АД – «non-dipper» и «night-peaker» (до 70%).
- Выявление по данным СМАД патологических индексов по САД и по ДАД, принадлежащих к типу кривой «non-dipper» и «night-peaker», сочетается с более чем в 3,5 раза большим числом эпизодов нестабильности гемодинамики в интраоперационном периоде при выполнении бедренно-подколенного шунтирования. Риск развития интраоперационной коронарной недостаточности повышается по мере увеличения показателей вариабельности САД и ДАД в ночное время суток.
10.В качестве факторов неблагоприятного прогноза в отношении развития сердечно-сосудистых осложнений в течение 1 года после проведения бедренно-подколенного шунтирования идентифицированы следующие дооперационные показатели: давление в легочной артерии выше 30 мм рт. ст., фракция выброса левого желудочка ниже 40% (по данным дооперационной Эхо-КГ) и процент показателей САД >140 мм рт. ст. по данным СМАД.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Для пациентов с АГ, планируемых на хирургическое вмешательство, с целью адекватной оценки степени компенсации АД, помимо «офисного» его измерения в план предоперационной оценки риска необходимо включать оценку показателей суточного мониторирования АД и суточных индексов.
2. Для оценки риска ранних и поздних осложнений, в том числе кардиологических при проведении плановых некардиологических хирургических вмешательств должны быть использованы показатели суточного мониторирования АД – степень повышения систолического АД в течение суток, отсутствие физиологического снижения систолического и диастолического АД, а также высокая его вариабельность в ночное время.
3. Для снижения риска развития стресс-индуцированных периоперационных осложнений у пациентов с планируемым некардиологическим хирургическим вмешательством в предоперационном периоде необходимо использовать БАБ (бисопролол в начальной дозе 2,5 – 5 мг) с титрацией препарата минимум в течение 14 дней до операции с продолжением терапии в течение 30 дней после нее.
4. Для оценки риска течения отдаленного послеоперационного периода (в течение 1-3 лет) могут быть использованы показатели компенсации АД в предоперационном периоде. Отсутствие целевых значений АД должно быть расценено как предиктор развития кардиологических и некардиологических событий (обращений за медицинской помощью, госпитализаций).
Список работ, опубликованных по теме диссертации
Статьи в журналах, рекомендованных ВАК
- Барбараш, О. Л. Предоперационный стресс у пациентов с ишемической болезнью сердца / О. Л. Барбараш, Р. В. Репникова // Сибирский медицинский журнал, Иркутск. – 2011. – Т. 101, № 2. – С. 59-62.
- Барбараш, О. Л. Психологический и провоспалительный статус у пациентов с артериальной гипертензией при выполнении лапароскопической холецистэктомии / О. Л. Барбараш, Р. В. Репникова, О. И. Голофаева // Сибирское медицинское обозрение. – 2011. – № 4. – С. 32-37.
- Барбараш, О. Л. Роль бета-адреноблокаторов в профилактике сердечно-сосудистых осложнений при некардиологических вмешательствах / О. Л Барбараш, Р. В. Репникова // Сердце. – 2011. – Т.10, №2. – С. 79-84.
- Влияние артериальной гипертензии на течение периоперационного периода при реконструктивных вмешательствах при атеросклеротическом поражении сосудов нижних конечностей / В. В. Евтушенко, Р. В. Репникова, А. А Головин, А.В. Фролов // Медицина в Кузбассе. – 2010. – № 4. – С. 12-17.
- Влияние бета-блокаторов на уровень артериального давления, периоперационные осложнениия и длительность госпитализации у пациентов с промежуточным риском сердечно-сосудистых осложнений при плановой холецистэктомии: открытое сравнительное рандомизированное исследование / О. Л. Барбараш, Р. В. Репникова, Т. В. Шофорусь, О. И. Голофаева // Рациональная фармакотерапия в кардиологии. – 2010. – № 5. – С. 683-688.
- Клинико-биохимические корреляты предоперационного стресса у пациентов с ишемической болезнью сердца / Р. В. Репникова, Я. В. Казачек, С. В. Иванов, О. Л. Барбараш // Лечебное дело. – 2011. - № 3. – С. 58-65.
- Особенности нейро-гуморального гомеостаза у пациентов с ишемической болезнью сердца / Р. В. Репникова, М. В. Мерзляков, В. Н. Каретникова, О. Л. Барбараш // Казанский медицинский журнал. – 2010. – Т. 91, № 4. – С. 460-463.
- Репникова, Р. В. Артериальная гипертензия и риск развития послеоперационных осложнений при лапароскопической холецистэктомии / Р. В. Репникова // Политравма. – 2011. – № 1. – С. 98-103.
- Репникова, Р. В. Взаимосвязь предоперационных стресс-индуцированных изменений психологического состояния пациента с провоспалитеьным статусом и послеоперационными осложнениями при выполнении лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Цитокины и воспаление. – 2011. – № 3. – С. 107-112.
- Репникова, Р. В. Взаимосвязь стресс-индуцированных нарушений гомеостаза с показателями суточного мониторирования артериального давления у пациентов с артериальной гипертензией при выполнении некардиологических оперативных вмешательств / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Сибирский медицинский журнал, Томск. – 2011. – Т. 26, № 1, выпуск 1. – С. 47-53.
- Репникова, Р. В. Предоперационная динамика показателей артериального давления, эндотелиальной функции и цитокинового профиля у пациентов с холецистэктомией / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Сибирский медицинский журнал, Иркутск. – 2011. – № 4. – С. 47-51.
Материалы конференций
- Барбараш, О. Л. Артериальная гипертензия в оценке предоперационного стресса у пациентов хирургического профиля (монография) / О. Л. Барбараш, Р. В. Репникова. – ООО «Полиграфист», Кемерово, 2011. – 123 с.
- Голофаева, О. И. Оценка уровня тревожности у пациентов хирургического профиля / О. И. Голофаева, Р. В. Репникова // Медицина в Кузбассе. – 2009. – № 3. – С. 45.
- Голофаева, О. И. Роль сердечно-сосудистых осложнений у пациентов, подвергшихся не кардиохирургическим вмешательствам / О. И. Голофаева, Р. В. Репникова // Медицина в Кузбассе. – 2010. – № 1. – С. 72-73.
- Евтушенко, В. Ю. Артериальная гипертензия – предиктор периоперационных осложнений у пациентов с атеросклерозом / В. Ю. Евтушенко, Е. В. Фролов, Р. В. Репникова, О. Л Барбараш // Материалы III съезда кардиологов Уральского федерального округа. – Тюмень, 2008. – С. 29.
- Евтушенко, В. Ю. Клиническая значимость синдрома артериальной гипертензии у пациентов с атеросклерозом сосудов нижних конечностей / В. Ю. Евтушенко, Е. В. Фролов, Р. В. Репникова, О. Л. Барбараш // Актуальные вопросы клинической кардиологии: сб. науч. работ, посвящ. 20-летию Алтайского краевого кардиологического диспансера. – Барнаул, 2008. – С. 40-41.
- Мироненко, А. Е. Артериальная гипертензия и периоперационные осложнения у пациентов с холецистэктомией / А. Е. Мироненко, Р. В. Репникова // Медицина в Кузбассе. – 2009. – № 3. – С. 117.
- Мироненко, А. Е. Влияние артериальной гипертензии на течение операционного периода у пациентов с холецистэктомией / А. Е. Мироненко, Р. В. Репникова // Медицина в Кузбассе. – 2008. – № 2. – С. 129.
- Репникова, Р. В. Артериальная гипертензия в предоперационном периоде у пациентов с атеросклерозом сосудов нижних конечностей / Р. В. Репникова, В. Ю. Евтушенко, Е. В. Фролов, О. Л. Барбараш // Сибирский медицинский журнал. – 2008. – Том 23, №3 (выпуск 2). – С. 174.
- Репникова, Р. В. Взаимосвязь показателей субклинического воспаления и послеоперационных осложнений у пациентов при некардиологических оперативных вмешательствах / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Российский журнал гастроэнтерологии, гепатологии и колопроктологии. – Т. 21, № 1, прил. 37: Материалы XVI Российского конгресса «Гепатология сегодня». – Москва, 2011. – С. 243.
- Репникова, Р. В. Взаимосвязь предоперационных изменений психологического состояния с провоспалительным статусом и послеоперационными осложнениями у пациентов при плановой лапароскопической холецистэктомии / Р. В. Репникова // Сибирский медицинский журнал. – 2011 (прил. 1): Материалы Конгресса «психосоциальные факторы и внутренние болезни: состояние и перспективы». – Новосибирск, 2011. – С. 207.
- Репникова, Р. В. Влияние синдрома артериальной гипертензии на развитие ранних послеоперационных осложнений у пациентов, перенесших плановую холецистэктомию / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Вестник современной клинической медицины. – 2010. – Т. 3, № 1 (прил). – С.149-150.
- Репникова, Р. В. Влияние сопутствующей артериальной гипертензии на течение госпитального периода у пациентов с плановой эндохолецистэктомией / Р. В. Репникова, Т. В. Шофорусь, А. Е. Мироненко др. //Сибирский вестник гепатологии и гастроэнтерологии. – 2008. – № 22 – 74-77.
- Репникова, Р. В. Влияние стресса на течение послеоперационного периода у больных с артериальной гипертонией после холецистэктомии / Р. В. Репникова, С. Н. Трищенкова, Т. В. Шофорусь // Медицина в Кузбассе. – 2005. – № 3. – С. 84-86.
- Репникова, Р. В. Гемодинамические осложнения у пациентов, страдающих гипертонической болезнью, при проведении плановой лапароскопической холецистэктомии / Р. В. Репникова, Т. В. Шофорусь, О. Л. Барбараш // Многопрофильная больница: проблемы и решения : материалы III Всерос. науч.-практ. конф. – Новосибирск, 2010. – С. 334-335.
- Репникова, Р. В. Значение офисного измерения артериального давления для прогнозирования риска развития сердечно-сосудистых и других событий в течение трехлетнего периода после перенесенной лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Сибирский вестник гепатологии и гастроэнтерологии. – 2011. – № 25. – С. 115-121.
- Репникова, Р. В. Клиническая значимость синдрома артериальной гипертензии у пациентов с плановыми некардиологическими хирургическими вмешательствами / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Международный журнал прикладных и фундаментальных исследований (материалы конф.). – Тайланд, 2011. – № 3. – С. 120-121.
- Репникова, Р. В. Лапароскопическая холецистэктомия и риск развития послеоперационных осложнений / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Медицина в Кузбассе. – 2010. – № 3. – С.112-113.
- Репникова, Р. В. Место -адреноблокаторов в профилактике сердечно-сосудистых осложнений у пациентов, подвергшихся некардиохирургическим вмешательствам / Р. В. Репникова, О. И. Голофаева, Е. Д. Баздырев, О. Л. Барбараш // Вестник Кузбасского научного центра. Выпуск № 12. Актуальные вопросы муниципального здравоохранения : материалы восьмой науч.-практ. конф. – Кемерово, 2010. – С. 159-161.
- Репникова, Р. В. Особенности провоспалительного статуса у пациентов с синдромом артериальной гипертензии при проведении лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Тезисы докладов II Международного конгресса «Кардиология на перекрестке наук» совместно с V Международным симпозиумом по эхокардиографии и сосудистому ультразвуку, XVIII ежегодной науч.-практ. конф. «Актуальные вопросы кардиологии». – Тюмень, 2011. – С. 269.
- Репникова, Р. В. Особенности синдрома артериальной гипертензии у пациентов, подвергшихся лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш //Экология и медицина: современное состояние, проблемы и перспективы : материалы международ. науч.-практ. конф. – Москва, 2010. – С. 72-73.
- Репникова, Р. В. Особенности суточного профиля артериального давления у пациентов с лапароскопической холецистэктомией / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // XI международный конгресс «Здоровье и образование в XXI веке» «Научные и прикладные аспекты концепции здоровья и здорового образа жизни». – Москва, 2010. – С. 555-556.
- Репникова, Р. В. Оценка стресс-индуцированных нарушений гомеостаза при ишемической болезни сердца // Материалы Российского национального конгресса кардиологов.– Москва, 2010. – С. 283.
- Репникова, Р. В. Показатели субклинического воспаления, эндотелиальной дисфункции и гормонального профиля у пациентов с артериальной гипертензией при некардиологических оперативных вмешательствах / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // XVIII Российский национальный конгресс «Человек и лекарство»: сб. материалов конгресса. – Москва, 2011. – С. 117-118.
- Репникова, Р. В. Предоперационные стресс-индуцированные изменения психологического состояния пациентов и их взаимосвязь с провоспалительным статусом и послеоперационными осложнениями при выполнении лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Тезисы докладов II Международного конгресса «Кардиология на перекрестке наук» совместно с V Международным симпозиумом по эхокардиографии и сосудистому ультразвуку, XVIII ежегодной науч.-практ. конф. «Актуальные вопросы кардиологии». – Тюмень, 2011. – С. 270.
- Репникова, Р. В. Предоперационные стресс-индуцированные изменения гомеостаза и психологического статуса пациента при выполнении лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // 13-й Славяно-Балтийский научный форум «Гастроэнтерология Санкт-Петербурга». – 2011, № 3. – С. М77.
- Репникова, Р. В. Прогностическое значение синдрома артериальной гипертензии в периоперационном периоде при холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Вестник современной клинической медицины. – 2010. – Т. 3, № 1 (прил). – С. 149.
- Репникова, Р. В. Психосоматическая характеристика пациентов с ишемической болезнью сердца / Р. В. Репникова, О. Л. Барбараш // Сб. науч. статей, посвящ. 50-летию кафедры факультетской терапии, профболезней, клинической иммунологии и эндокринологии КемГМА. – Кемерово, 2010. – С.129-135.
- Репникова, Р. В. Психосоматический статус у больных ИБС / Р. В. Репникова, О. Л. Барбараш // Сибирский медицинский журнал. – 2009. – Том 24, № 4 (выпуск 2). – С. 116-117.
- Репникова, Р. В. Оценка периоперационного риска у пациентов с артериальной гипертензией при выполнении некардиологических хирургических вмешательств (методические рекомендации) / Р. В. Репникова, О. Л. Барбараш. – Кемерово, 2011. – 93 с.
- Репникова, Р. В. Сердечно-сосудистые осложнения у пациентов, перенесших лапароскопическую холецистэктомию / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Сибирский вестник гепатологии и гастроэнтерологии. – 2010. – № 24. – С. 124-125.
- Репникова, Р. В. Характеристика клеточного иммунитета на фоне операционного стресса у пациентов накануне аорто-коронарного шунтирования / Р. В. Репникова, О. Л. Барбараш // Материалы Российского национального конгресса кардиологов. – Москва, 2010. – С. 283.
- Репникова, Р. В.Показатели субклинического воспаления при лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш // Материалы V Национального конгресса терапевтов. – Москва, 2010. – С. 203-204.
- Репниковаа, Р. В. Риск развития послеоперационных осложнений при лапароскопической холецистэктомии / Р. В. Репникова, О. И. Голофаева, О. Л. Барбараш //Сибирский вестник гепатологии и гастроэнтерологии, 2010. – № 24. – С. 79-81.
- Трищенкова, С. Н. Периоперационные показатели центральной и периферической гемодинамики у больных с атеросклерозом сосудов нижних конечностей в сочетании с ИБС / С. Н. Трищенкова, Р. В. Репникова, Е. А. Савицкая // Медицина в Кузбассе. – 2006. – № 3. – С. 146-147.
- Трищенкова, С. Н. Гемодинамические реакции у пациентов при плановой эндохолецистэктомии / С. Н. Трищенкова, Р. В. Репникова, Т. В. Шофорусь // Медицина в Кузбассе. – 2007. – № 2. – С.182.
- Шофорусь, Т. В. Артериальная гипертония, стресс и активность вегетативной нервной системы у пациентов при плановой холецистэктомии / Т. В. Шофорусь, Р. В. Репникова, О. Л. Барбараш // Формирование здорового образа жизни как личностного и национального приоритетов : сб. материалов науч.-практ. конф. Международная выставка-ярмарка «Мединтекст». – Кемерово, 2007. – С. 79-81.
- Шофорусь, Т. В. Синдром артериальной гипертензии у хирургических больных / Т. В. Шофорусь, О. Л. Барбараш, Р. В. Репникова, С. Н. Трищенкова // Дальневосточный медицинский журнал. – 2007. – №2. – С. 99.
Список сокращений
| АВ-блокада – атриовентрикулярная блокада | ОЗСНК – облитерирующие заболевания сосудов нижних конечностей |
| АГ – артериальная гипертензия | ОНМК – острое нарушение мозгового кровообращения |
| АД – артериальное давление | ПАД – пульсовое артериальное давление |
| Ат – атеросклероз | РТ – реактивная тревожность |
| БАБ – бета-адреноблокаторы | САД – систолическое артериальное давление |
| ДАД – диастолическое артериальное давление | СД – сахарный диабет |
| ДИ – доверительный интервал | СИ – суточный индекс |
| ДЛА – давление в легочной артерии | СМАД – суточное мониторирование АД |
| ЖКБ – желчнокаменная болезнь | СРБ – С- реактивный белок |
| иАПФ – ингибиторы ангиотензинпревращающего фермента | ТИА – тромбоишемическая атака |
| ИБС – ишемическая болезнь сердца | ФК – функциональный класс |
| ИЛ – интерлейкин | ФР – фактор риска |
| ИМ – инфаркт миокарда | ХОБЛ – хроническая обструктивная болезнь легких |
| ИМТ – индекс массы тела | ХСН – хроническая сердечная недостаточность |
| КДО конечный диастолический объем | ЧСС – частота сердечных сокращений |
| ЛП – левое предсердие | ЭКГ – электрокардиография |
| ЛТ – личностная тревожность | ЭТН – эндотрахеальный наркоз |
| ЛХЭ – лапароскопическая холецистэктомия | Эхо-КГ эхокардиография |

