Гнойно-септические осложнения сосудистых доступов у больных на программном гемодиализе
На правах рукописи
Козлов Денис Владимирович
Гнойно-септические осложнения сосудистых доступов у больных на программном гемодиализе
14.01.17 - хирургия
Автореферат
диссертации на соискание ученой степени кандидата медицинских наук
Москва 2011
Работа выполнена в Первом Московском Государственном Медицинском Университете имени И.М. Сеченова.
Научный руководитель:
доктор медицинских наук, профессор Евсеев Максим Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Липницкий Евгений Михайлович
доктор медицинских наук, профессор Хачатрян Нана Николаевна
Ведущая организация: Российский Государственный Медицинский Университет им. Н.И. Пирогова
Защита состоится « ___» _________________ 2011г. в 14 часов на заседании Диссертационного совета Д.208.040.03 в ГОУ ВПО Первый Московский Государственный Медицинский Университет имени И.М. Сеченова (119991, Москва, ул. Трубецкая, д. 8, стр. 2).
С диссертацией можно ознакомиться в ГЦНМБ ГОУ ВПО Первый Московский Государственный Медицинский Университет имени И.М.Сеченова (117998, Москва, Нахимовский проспект, 49).
Автореферат разослан «___» _____________________ 2011г.
Ученый секретарь Диссертационного совета
доктор медицинских наук,
профессор Шулутко Александр Михайлович
Актуальность проблемы
Лечение пациентов с терминальной стадией хронической почечной недостаточности (тХПН), требующей облигатного проведения программного гемодиализа, является одной из актуальных междисциплинарных проблем современной медицины. За последнее десятилетие в России отмечается неуклонный рост количества больных с тХПН, находящихся на лечении программным гемодиализом (ПГД), с ежегодным приростом в 10,5% [Бикбов Б.Т., Томилина Н.А., 2009]. Общепринятой практикой при проведении длительного (многомесячного и многолетнего) ПГД является формирование постоянного сосудистого доступа (ПСД), потенциально опасного в плане развития ряда специфических осложнений. Наиболее тяжелым из осложнений при функционировании ПСД является развитие гнойно-септических осложнений (ГСО), в том числе – ангиогенного сепсиса [Сальмайер А.А.,1986;Мойсюк Я.Г., Беляев А.Ю.,2004]. Частота развития ангиогенного сепсиса при гнойном воспалении в зоне ПСД составляет от 13,2% до 29,5% [Abbott K.C., Agodoa L.Y., 2001;Saxena A. et al., 2003], летальность при развитии ангиогенного сепсиса достигает 43% [Филипцев П.Я. и соавт., 1988; Arduino M.J., 2005; U.S. Renal Data System, 2007], частота потери ПСД достигает 60-100% [Костылева Е.В., 1999; Мойсюк Я.Г., 2004].
К гнойно-септическим осложнениям ПСД – артерио-венозной фистулы (АВФ) и синтетического сосудистого протеза (ССП) - относят: инфильтрат, флегмону, абсцесс, наружный гнойный свищ. Особая значимость данных осложнений обусловлена очевидной возможностью поступления микроорганизмов и их токсинов в системный кровоток, минуя биологические барьеры, из очага находящегося в просвете сосуда, создавая предпосылки для развития ангиогенного сепсиса [Лыткин М.И., Шихвердиев Н.Н.,1983; Костюченко А.Л.,1987; Дундаров З.А., 2001].
Частота инфицирования ПСД варьирует в широких пределах, но большинство авторов отмечают значительное преобладание возникновения инфекции у больных с ССП, которая составляет от 5-9% [Даугирдас Дж.Т. и соавт., 2003;Minga Т.Е. et al., 2002; Darouiche R.O., 2004] до 11-35% случаев [Padberg F.T. et al., 1992; Zibari G.B. et al., 1997; Schild A.F. et al., 2008].
Несмотря на то, что операции формирования ПСД формально относятся к группе «чистых» операций, доказанная на сегодняшний день роль эндогенной условно-патогенной микрофлоры в развитии ГСО при формировании сосудистых доступов с возрастанием доли антибиотикорезистентных штаммов микроорганизмов в качестве возбудителей ГСО, свидетельствует о необходимости проведения антибиотикопрофилактики ГСО. Принято считать, что антибиотикопрофилактику следует проводить дифференцированно, в зависимости от имеющихся факторов риска развития гнойных осложнений [Хачатрян Н.Н. и соавт., 2003; Ronald K. et al., 1998]. Тем не менее выбор антибактериальных препаратов и режима антибиотикопрофилактики ГСО у больных с ПСД является в настоящее время предметом дискуссии.
Известно, что в этиологии ангиогенного сепсиса у больных, находящихся на гемодиализе, преобладает грамположительная микрофлора (преимущественно S. aureus), в меньшей степени – грамотрицательные бактерии и патогенные грибы [Костюченок Б.М., Светухин А.М.,1981; Гринев М.В. и соавт.,2001; Даугирдас Дж.Т. и соавт.,2003; Minga T.E. et al., 2001; Ryan S.V. et al., 2004]. Однако единое мнение по вопросу проведения адекватной антибактериальной терапии, основанной на современных особенностях этиологии ГСО у пациентов на гемодиализе в настоящее время отсутствует [Филипцев П.Я.,1987; Ганеев Т.С., Ганеева А.Т.,2003; Мойсюк Я.Г., Беляев А.Ю., 2004].
Таким образом, выявление особенностей этиологии и клинического течения гнойно-септических осложнений сосудистого доступа, выработка алгоритмов профилактики и лечения больных с гнойно-септическими осложнениями, находящихся на программном гемодиализе, является актуальной и клинически значимой задачей.
Цель исследования
Улучшение результатов лечения больных с постоянным сосудистым доступом, сформированным для проведения программного гемодиализа.
Задачи исследования
- Установить частоту развития гнойно-септических осложнений сосудистого доступа у больных на программном гемодиализе.
- Изучить микробный спектр и его динамику при лечении гнойно-септических осложнений у больных на программном гемодиализе.
- Выявить особенности клинической картины гнойно-септических осложнений у больных на программном гемодиализе.
- Определить прогностические критерии развития гнойно-септических осложнений и разработать дифференцированную тактику антибиотикопрофилактики гнойно-септических осложнений у больных с постоянным сосудистым доступом, получающих программный гемодиализ.
- Оценить эффективность антибактериальной терапии и оптимизировать лечебную тактику при возникновении гнойно-септических осложнений при эксплуатации постоянного сосудистого доступа у больных на программном гемодиализе.
Научная новизна
На значительном клиническом материале изучены особенности клинического течения, клинико-лабораторной и инструментальной диагностики гнойно-септических осложнений сосудистых доступов у больных на программном гемодиализе, проведена оценка микробного пейзажа и резистентности микроорганизмов.
Впервые с целью объективизации оценки тяжести и течения гнойно-септических осложнений постоянного сосудистого доступа у больных на гемодиализе использована интегральная шкала APACHE III.
Впервые выявлены клинико-лабораторные факторы риска развития гнойно-септических осложнений сосудистого доступа у больных на гемодиализе.
Разработаны алгоритмы проведения антибиотикопрофилактики и лечебных мероприятий при возникновении гнойно-септических осложнений постоянного сосудистого доступа у больных на гемодиализе.
Практическая значимость
Выявлено, что наиболее часто среди гнойно-септических осложнений сосудистого доступа у больных, получающих программный гемодиализ, развивается ангиогенный сепсис.
На основании данных о микробном пейзаже и выявленных факторах риска развития гнойно-септических осложнений при формировании постоянного сосудистого доступа, оптимизирована антибиотико-профилактика, позволяющая предотвратить развитие данных осложнений у большинства пациентов. Использование цефалоспоринов III генерации в раннем послеоперационном периоде, позволяет снизить частоту возникновения инфицирования сосудистого доступа.
На основании данных о динамике микробного пейзажа разработан алгоритм антибактериальной терапии при возникновении гнойно-септических осложнений постоянного сосудистого доступа у больных на гемодиализе, позволяющий улучшить результаты лечения.
Внедрение результатов исследования
Результаты работы используются в практической деятельности в отделениях сосудистой и гнойной хирургии, нефрологии и отделении гемодиализа Госпиталя ветеранов войн №2 г. Москвы.
Положения, выносимые на защиту
1. Наиболее часто гнойно-септические осложнения характеризовались развитием ангиогенного сепсиса, преимущественно у пациентов с синтетическим сосудистым протезом.
2. Микробный пейзаж ГСО был преимущественно представлен грамположительной флорой, доля которой в последующих посевах гемокультуры и раневого отделяемого снижается.
3. Применение дифференцированного подхода к проведению периоперационной антибиотикопрофилактики при формировании ПСД, основанного на наличие факторов риска ГСО, способствует снижению развития гнойно-септические осложнения.
4. Использование алгоритмизированного деэскалационного режима антибиотикотерапии гнойно-септические осложнения, основанного на использовании ванкомицина в качестве антибиотикотерапии инфекции, вызванной грамположительной флорой, а при наличии грамотрицательная флора – меропенема, позволяет в подавляющем большинстве случаев увеличить частоту сохранения постоянного сосудистого доступа и снизить летальность.
Апробация диссертации
Состоялась на совместном научно-методическом совещании сотрудников кафедры общей хирургии лечебного факультета Первого МГМУ им. И.М. Сеченова и коллектива хирургических отделений ГВВ №2 г. Москвы.
Публикации
По теме диссертации опубликовано 8 научных работ, в том числе 2 работы в изданиях, рекомендованных ВАК РФ.
Объем и структура работы
Диссертация изложена на 143 страницах машинописного текста и состоит из введения, 4 глав, заключения, выводов, практических рекомендаций и библиографии. Диссертация включает 27 таблиц и 8 рисунков. Библиографический указатель включает 187 источников, из них 96 отечественных и 91 зарубежный.
ОБЩАЯ ХАРАКТЕРИСТИКА КЛИНИЧЕСКИХ НАБЛЮДЕНИЙ
И МЕТОДЫ ИССЛЕДОВАНИЯ
Дизайн исследования.
В ходе исследования произведен ретроспективный анализ 238 и проспективный анализ 262 историй болезни 500 больных с терминальной стадией ХПН, находящихся на программном гемодиализе (ПГД), за период с 1996 по 2009 годы. Проведение сеанса ПГД осуществляется через временный сосудистый доступ – двухпросветный катетер или постоянный сосудистый доступ (ПСД) – артерио-венозную фистулу (АВФ) или синтетический сосудистый протез (ССП) из политетрафторэтилена. Всем 500 пациентам было выполнено формирование или реконструкция ПСД.
Среди больных с ГСО женщины составило – 56%, мужчины – 44% соответственно. Средний возраст больных 51,3±15,3 года.
Основной нозологией у больных с ГСО, приводящей к развитию тХПН был сахарный диабет в 17% случаев, в большинстве случаев 89% – I типа. Наиболее частыми сопутствующими заболеваниями явились: анемический синдром 95%, вирусные гепатиты 44%, пневмония 36%, ишемическая болезнь сердца 35%.
Согласно Цели и Задачам исследования все пациенты (n=500) были распределены на 3 клинические группы. I группа – группа ретроспективного анализа, составила 238 (47,6%) пациентов, которые находились на лечении в период 1996-2002 гг. включительно. I группа была разделена на I А – основную (пациенты с ГСО, n=22) и I Б – контрольную (без ГСО, n=216).
II группа – проспективного анализа, включившего 262 (52,4%) пациента, находившихся на лечении в период 2003-2009 гг. включительно. В этой группе выделено 4 подгруппы: II А – основная (больные с ГСО, n=21), II Б подгруппа – вошли 45 больных с высокой и средней степенью риска развития ГСО, была проведена апробация алгоритма дифференцированного подхода периоперационной антибиотикопрофилактики. Подгруппа II В – больные (n=71), имевшие среднюю или высокую степень риска ГСО, которым не применялся алгоритмизированный дифференцированного подхода периоперационной антибиотикопрофилактики. Подгруппа II Г – контрольная группа (n=125). У пациентов I А и II А подгрупп – анализировались особенности местной и системной реакции организма, микробиологический анализ выделенных возбудителей, исход лечении: у больных I А подгрупп оценивался эскалационный режим антибактериальной терапии, у пациентов II А – деэскалационный режим. Пациенты контрольных подгрупп – I Б и II Г (без ГСО) сравнивались по тяжести состояния и лабораторным показателям с пациентами, имевшие ГСО (группа I А и II А). У пациентов I А и II А и части больных I Б и II Г, были выявлены факторы риска развития гнойно-септических осложнений.
Использованные методы исследования
Анализ производился на основании рутинных клинико-лабораторных (общий анализ крови, биохимия крови, коагулограмма, кислотно-щелочное состояние крови) и инструментальных исследований (ультразвуковое дуплексное ангиосканирование сосудистого доступа, УЗИ органов брюшной полости, ЭХО-КГ, рентгенологическое исследование органов грудной клетки, ЭГДС), а также динамического бактериологического исследования гемокультуры и раневого отделяемого.
В настоящей работе сепсис диагностировался и классифицировался по критериям согласительной конференции Американского Колледжа пульмонологов и Общества специалистов критической медицины США –ACCP/SCCM [Bone R.C. et al., 1992]. Для объективной оценки тяжести состояния больного и анализа адекватности антибиотикотерапии была использована интегральная шкала APACHE III [Knaus W.A. et al., 1991], которая проводилась на 1-е, 3-е, 7-е сутки исследования и при выписке или гибели больного.
Для выявления факторов риска развития инфицирования постоянного сосудистого доступа использовался статистического метода 2 (хи-квадрат) Пирсона. Для оценки влияния прогностического фактора на развитие ГСО был использован критерий Z с поправкой Йетса на непрерывность.
На основании степени риска развития гнойно-септических осложнений, разработан алгоритм периоперационной антибиотикопрофилактики ГСО у больных на программном гемодиализе.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Из всех оперированных больных у 43(8,6%) отмечено возникновение ГСО, из этих пациентов развитие ангиогенного сепсиса (АС) отмечено у 29 (67,4%) пациентов, инфекции области хирургического вмешательства (ИОХВ) – воспалительные инфильтраты, нагноение гематом, абсцессы и флегмоны, наружные свищи были выявлены у 14 (32,6%) пациентов.
Наиболее часто инфицирование сосудистого доступа было отмечено у 23 (53,5%) пациентов с ССП, менее часто поражались нативные АВФ – у 16 (37,2%) пациентов, у 4(9,3%) пациентов имелась картина катетер-ассоциированной инфекции.
Летальность у больных с ГСО, находящихся на программном гемодиализе составила 19(44,2%) случаев. Из всех умерших больных, у 15(78,9%) больных был диагностирован ангиогенный сепсис. Летальность в группе с ангиогенным сепсисом в 1,8 раза выше, чем в группе с ИОХВ. Частота сохранения ПСД в группе с ангиогенным сепсисом была выше в 1,3 раза, чем в группе с ИОХВ, что вероятно обусловлено наличием в качестве ПСД нативной АВФ – в 75% случаев.
Длительность лечения больных программным гемодиализом до момента возникновения ГСО составила 39,8±5,4 месяцев, при этом развитие ИОХВ в большинстве случаев (58,1%) было отмечено в позднем послеоперационном периоде (> 4 мес), преимущественно через 6,8±1,2 месяцев. ГСО развивались в 4,7 раза чаще у пациентов с повторно-формируемыми доступами (83%), по сравнению с пациентами с первично-формируемыми доступами 17% (p<0,05).
Клиническая картина ИОХВ была разнообразной, типичные проявления локального воспалительного ответа была диагностирована у 37(86,05%) пациентов из всей группы больных с ГСО и лишь у 48,3% больных с ангиогенным сепсисом.
Из клинических форм ИОХВ преобладали: инфицированная гематома (32,4%), наружный свищ (24,3%), флегмона (18,9%). В большинстве случаев (75,0%) инфицирование гематом, подтвержденное при пункции под УЗИ-контролем, возникло у пациентов с ССП.
Каждый седьмой пациент (13,5%) с ГСО поступал в стационар с картиной аррозионного кровотечения из сосудистого протеза, что в позднем послеоперационном периоде является абсолютным клиническим признаком инфицирования трансплантата и нередко единственным проявлением этого осложнения. У 12(27,9%) пациентов, выявлен тромбоз ПСД: тромбоз АВФ и ССП составил – 4(33,3%) и 8(66,7%) случаев соответственно, что говорит о гиперкоагуляционных нарушениях при сепсисе.
При анализе локализации инфекционного процесса отмечено, что ГСО развивались в 4,8 раза чаще у пациентов с ПСД на нижней конечности по сравнению с пациентами, имевшими ПСД на верхней конечности (p<0,05).
При сравнении пациентов по виду сосудистого доступа, наиболее выраженная картина местного гнойного воспаления была отмечена у пациентов с ССП (78,6%), как реакция макроорганизма на инфицированный имплантированный инородный материал.
Неотъемлемым проявлением гнойно-воспалительного процесса явился синдром лихорадки. У больных с АС лихорадка была выявлена в 69% случаев, а у пациентов с ИОХВ – только у 50% больных. Во всей группе больных с ГСО фебрильная температура была констатирована у 41,8% пациентов. У трети больных (30,2%) с ГСО отмечено афебрильное течение.
В клинической картине ГСО отмечено развитие синдрома полиорганной недостаточности с поражением легких, печени, селезенки, сердца, желудочно-кишечного тракта, кровеносной системы и нарушением неврологического статуса.
У 34,9% больных с ГСО отмечено развитие вторичной септической пневмонии, с преимущественным односторонним поражением (80% случаев). Гепатомегалия была диагностирована у 14,0% больных, гепато-спленомегалия, как и изолированная спленомегалия – у 11,6% больных. Инфекционный эндокардит был диагностирован у 4(13,8%) пациентов с АС.
У больных с ГСО сосудистого доступа эрозивно-язвенное поражение гастро-дуоденальной зоны было выявлено в 16,3% случаях: эрозивный эзофагит, был диагностирован у 1(2,3%) пациента, эрозивный гастрит – у 6 (14%) пациентов, из которых у 2(4,7%) пациентов осложнился развитием кровотечения.
Изменения в неврологическом статусе у большинства больных (67,4%) проявлялись остро возникшим развитием: дезориентации, сонливости вплоть до спутанности сознания, а также порой эпизодами необъяснимого возбуждения или заторможенности. В целом, необходимо отметить несоответствие тяжести общего состояния больного с имеющимися минимальными местными проявлениями инфицирования области сосудистого доступа.
При анализе лабораторных показателей периферической крови у пациентов с ГСО отмечается ряд особенностей. Так тяжелая степень анемии была диагностирована у каждого третьего пациента – 36,4% случаев. У большинства пациентов имело место стойкая гипохромная анемия, не поддающаяся консервативной терапии (гемотрансфузией эритроцитарной массы, эритроконцентрата, инъекциями синтетического эритропоэтина и парентеральными железосодержащими препаратами). Наличие нейтрофильного лейкоцитоза диагностировано у 44,2% больных, из них в 16(55,2%) случаях – у больных с ангиогенным сепсисом. Обращает на себя внимание тот факт, что в 23(53,5%) случаях уровень лейкоцитов в периферической крови оставался в пределах допустимой нормы. Сдвиг лейкоцитарной формулы влево диагностирован лишь у 6(14,0%) пациентов, что характерно для гнойных инфекций и интоксикаций. Наличие лимфопении в периферической крови было выявлено у 39,5% больных, что говорит о вторичной иммунодепрессии. Синдром ускорения СОЭ более 50 мм/ч выявлен у 51,2% больных.
В биохимическом анализе крови диагностирована гипопротеинемия, которая была более выражена у больных с ангиогенным сепсисом по сравнению с больными с ИОХВ, где уровень общего белка составил – 58,7±0,3г/л и 66,2±0,9г/л соответственно (р<0,05). Также обращает внимание наличие у больных с АС наличие цитолитического синдрома (повышение уровня АЛТ и АСТ – 47,3±5,4 и 45,02±4,0 ЕД/л соответственно), что указывает на нарушение белоксинтезирующей и дезинтоксикационной функции печени на фоне гнойно-септического процесса. У более половины больных (72,1%) на фоне проведения регулярных сеансов гемодиализа нарастал уровень азотемии (мочевина – 18,4±0,2 ммоль/л, креатинин – 682,2±5,8 мкмоль/л) и калия – 5,8±0,1 ммоль/л. Все это обусловлено увеличением белкового катаболизма на фоне гнойно-септического процесса.
У больных с АС в коагулограмме отмечено значимое повышение уровня АЧТВ по сравнению с больными с местными гнойными осложнениями – 39,6 и 29,5 секунд соответственно (р<0,05), что говорит о гипокоагуционных нарушениях. При этом у 47% больных с ГСО в сыворотке крови отмечено увеличение уровня общего фибриногена (до 5±0,1г/л), что подтверждает гиперкоагуляцию, обусловленную, увеличением концентрации острофазных белков воспаления. В показателях КОС состояния картина метаболического ацидоза средней степени отмечена у больных с АС (pH=7,28), а у пациентов с ИОХВ – метаболический ацидоз легкой степени (pH=7,37) (р<0,05).
Исходя из вышеизложенного, о возникновении ГСО, в частности развитие ангиогенного сепсиса у пациентов с тХПН, получающих программный гемодиализ, свидетельствуют следующие признаки: наличие синдрома лихорадки и других признаков ССВО (синдрома системного воспалительного ответа) при отсутствии или наличии минимальных признаков синдрома локального воспалительного ответа (в том числе гнойной инфекции мягких тканей в зоне сосудистого доступа) с синдромом полиорганной недостаточности.
Этиологическая структура ГСО у больных на гемодиализе была представлена штаммами грамположительных микробов – 82% случаев, из которых S.aureus – 43%, коагулазонегативные стафилококки – 31%; представители грамотрицательной флоры – 15,7%, грибы Actinomyces spp. – 2% случай (табл. 1). Необходимо отметить, что среди всех штаммов S.aureus, MRSA оставили – 68,4%. При АС отмечено абсолютное преобладание грамположительной флоры (89,3%). Грамотрицательная флора в 27,8% случаев была выделена у больных с ИОХВ. Выделенные микроорганизмы составляют группу основных возбудителей нозокомиальных инфекций, представленные патогенными и условно-патогенными микроорганизмами.
Таблица 1. Видовой состав возбудителей гнойно-септических осложнений.
| № | Микроорганизмы (n=51) | Частота встречаемости микроорганизма при АС, % | Частота встречаемости микроорганизма при ИОХВ, % | Всего n (%) |
| Грамположительные микроорганизмы | 42 (82,4%) | |||
| 1. | Staphylococcus aureus | 11 | 11 | 22 (43,1%) |
| 2. | Staphylococcus epidermidis | 6 | 4 | 10 (19,61%) |
| 3. | Staphylococcus saprophyticus | 3 | 2 | 5 (9,8%) |
| 4. | Enterococcus faecalis | 4 | 0 | 4 (7,81%) |
| 5. | Streptococcus pneumoniae | 1 | 0 | 1 (1,96%) |
| Грамотрицательные микроорганизмы | 8 (15,7%) | |||
| 1. | Escherichia сoli | 1 | 2 | 3 (5,9%) |
| 2. | Escherichia fergusonii | 1 | 0 | 1 (1,96%) |
| 2. | Pseudomonas aeruginosae | 0 | 1 | 1 (1,96%) |
| 3. | Pseudomonas mendocina | 0 | 1 | 1 (1,96%) |
| 4. | Proteus mirabilis | 0 | 1 | 1 (1,96%) |
| 5. | Klebsiella pneumoniae | 1 | 0 | 1 (1,96%) |
| Грибы | 1 (1,9%) | |||
| Actinomyces spp. | 1 | 0 | 1 (1,96%) | |
| ИТОГО | 29 | 22 | 51 | |
Качественный состав микрофлоры при повторных посевах крови и раневого отделяемого претерпевает кардинальные изменения: выделение грамотрицательной флоры увеличилось почти в 4 раза, по сравнению со штаммами грамположительной флоры (рис. 1). Анализируя динамику выделенной микрофлоры за весь период наблюдения, отмечается рост удельного веса штаммов S.aureus, S.epidermidis и E.coli. При микробиологическом анализе раневого экссудата и гемокультуры, в первичных посевах преобладала монокультура микроорганизмов (75%), по сравнению с повторными посевами, где доля ассоциаций микроорганизмов увеличивалась с 25,0% до 54,5% случаев. Все это говорит о нарушении в системе иммунной защиты, иммунореактивности и возможности проникновения бактерий во внутреннюю среду организма, минуя барьеры покровных тканей.
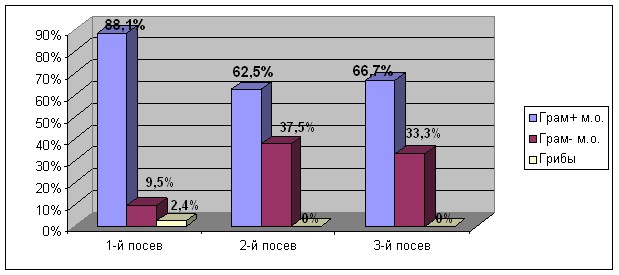
Рис.1. Динамика изменения микрофлоры ран и гемокультуры у пациентов с ГСО.
Анализируя чувствительность выделенной микрофлоры, было отмечено, что штаммы коагулазонегативных стафилококков (КНС), представленных S.epidermidis и S.saprophyticus, были чувствительны к фузидиевой кислоте, имипенему, ципрофлоксацину в 90%, 90%, 60% и 80%, 70%, 60% случаев соответственно. При анализе чувствительности наиболее часто выделенных микроорганизмов к антибиотикам, была отмечена устойчивость к оксациллину КНС (28,6%). Все штаммы MRSA, MRSE и КНС были чувствительны к ванкомицину, штаммов VRE – выделено не было. Штаммы MRSA были чувствительны к: имипенему (93,8%), фузидиевой кислоте (93,8%), цефалоспоринам II-III поколения (84,6%), гентамицину (43,8%), ципрофлоксацину (62,5%). Штаммы E.coli были резистентны к цефалоспоринам I-II поколения – цефазолину (100%), цефамандолу (67,7%); ампициллину (67,7%). Максимально активными в отношении E.coli явились: меропенем (100%), амикацин (100%) и ципрофлоксацину (100%), в меньшей степени – гентамицин (66,7%), цефалоспоринам III поколения – цефотаксим (66,7%) и цефтазидим (66,7%).
Проведенный мониторинг чувствительности к основным антибактериальным препаратам может говорить об использовании ванкомицина в качестве антибиотикотерапии инфекции, вызванной грамположительной флорой, а для лечения инфекции, вызванной грамотрицательной флорой – меропенема.
Для объективной оценки тяжести состояния больного использовалась интегральная шкала APACHE III. Была отмечена корреляция показателей по шкале АРАСНЕ III с возрастом, с критериями ССВО и классификацией сепсиса по АССР/SCCM (1992). Картина ССВО при развитии ГСО имела свои особенности у больных на программном гемодиализе. Наличие 2-х критериев ССВО выявлено – у 23 (53,5%) больных, 3-х критериев – у 19 (44,2%) больных, наличие всех 4 признаков ССВО отмечено только у 1 (2,3%) больного.

Рис.2. Распределение больных по возрасту и тяжести состояния.
Показатель тяжести состояния по шкале APACHE III в группе с 2 критериями ССВО составил 76,4±9,1 балла; в группе с 3-мя критериями ССВО составил 86,42±6,4; с 4-мя – 95,1±6,4 балла. При утяжелении сепсиса значения интегральной шкалы прогрессивно увеличивались: от 82,2±9,3 баллов при сепсисе, 87,3±0,6 – при тяжелом сепсисе, до 95,1±6,4 баллов при септическом шоке (рис. 2, табл. 2).
Для оценки дифференцированного подхода антибиотикопрофилактики развития ГСО при формировании ПСД, проанализированы препараты различных групп: полусинтетических пенициллинов, цефалоспоринов I и III поколений, линкозамидов, фторхинолонов II поколения. Выявлено, что при использовании полусинтетических пенициллинов развитие ГСО отмечено – в 58% случаев, линкозамидов – в 23%, при использовании фторхинолонов II поколения – в 7%, цефалоспоринов I поколения – 12%, при применении цефтриаксона – 0%. Периоперационная антибиотикопрофилактика проводилась цефалоспорином III поколения – введением цефтриаксона за 30 мин до кожного разреза и в течение 3-х дней после операции.
Таблица 2. Сравнительная оценка больных с сепсисом, тяжелым сепсисом, септическим шоком и ИОХВ.
| Ангиогенный сепсис (n=29) | ИОХВ (n=14) | ||||
| Сепсис | Тяжелый сепсис | Септический шок | |||
| n, % | 16 (55,2%) | 10 (34,5%) | 3 (10,3%) | 14 (100%) | |
| Женщины (%) | 9 (56,3%) | 6 (60%) | 3 (100%) | 6 (42,9%) | |
| Возраст, лет | 54,4±0,8 | 42,1±1,6 | 62,0±3,5 | 50,4±1,3 | |
| APACHE III, баллы | 82,2±9,3 | 87,3±0,6 | 95,1±6,4 | 85,0±0,8 | |
| Умер-шие | Абс. число, % | 2 (12,5%) | 10 (100%) | 3 (100%) | 4 (28,6%) |
| Возраст, лет | 54±10,6 | 42,1±1,6 | 62,0±3,5 | 64,3±3,2 | |
| АРАСНЕ III, баллы | 89,7±3,1* | 87,3±0,6 | 95,1±6,4 | 91,1±1,0 | |
| Соотношение различных видов доступа АВФ:ССП:ВСД | 0, 9 : 1 : 0,1 | 1,3 : 1 : 0,3 | 1 : 1 : 1 | 0,3 : 1 : 0,1 | |
| Возбуди-тели | Гр (+) микробы | 11 (78,6%) | 11 (100%) | 3 (75%) | 13 (72,2%) |
| Гр (-) микробы | 2 (14,3%) | 0 % | 1 (25%) | 5 (27,8%) | |
| Грибы | 1 (7,1%) | 0% | 0% | 0% | |
Для определения факторов риска возникновения ГСО у больных, находящихся на гемодиализе с ПСД, был проведен анализ 148 (37 –клинических и 111 – лабораторных) показателей гипотетически способных с различной степенью вероятности повлиять на процесс развития ГСО ПСД.
Выявлены 6 факторов риска развития ГСО, имевших числовое значение:
Z(ССП)=0,4754, Z(анемия, уровень гемоглобина 79 г/л)=0,4156, Z(лимфопения)=0,3118, Z(возраст, 60-74 года)=0,2799, Z(сахарный диабет)=0,1368, Z(гипергликемия)=0,1071 балла. При этом имеется сильная прямая корреляция между 6 факторами и возникновением ГСО (r=+0,94). Наличие гипергликемии, как фактора риска, обусловлено усилением глюконеогенеза из-за катаболизма белков, и активацией липолиза на фоне гнойно-септического процесса.
При математическом анализе было выявлено некоторое число Zкр=0,5719 балла (Z критическое) для оценки степени риска ГСО. Разработан алгоритм периоперационной антибиотикопрофилактики ГСО у больных, находящихся на программном гемодиализе (табл.3), основанный на следующем. Если сумма баллов по имеющимся факторам риска Zрасчетное у каждого конкретного больного будет равна или больше значения Zкр, то данный пациент будет входить в группу среднего или высокого риска, где необходимо обязательное проведение антибиотикопрофилактики цефтриаксоном. В случае наличия только одного из факторов риска (Zрасчетное<Zкр) – проведение антибиотикопрофилактики необходимо осуществлять индивидуально.
Таблица 3. Проведение антибиотикопрофилактики в зависимости от степени риска развития ГСО.
| Уровень показателя ГСО, (Zрасчетное) | Степень риска развития ГСО | Назначение Антибиотикопрофилактики |
| -0,0107Z0,166 | Низкий уровень риска ГСО | Нет или требуется индивидуальный подход |
| 0,166<Z0,6661 | Средний уровень риска развития ГСО | Необходимо |
| 0,6661<Z1,7159 | Высокий уровень риска развития ГСО | Строго обязательно |
У больных IIВ клинической подгруппы, имевших среднюю или высокую степень риска ГСО, которым формировался ПСД и проводилась антибиотикопрофилактика: полусинтетическими пенициллинами, линкозамидами, цефалоспоринами 1 и 2 поколения, на протяжении 12 месяцев позднего послеоперационного периода, частота ГСО составила 11(15,6%) случаев, а летальность – 2(2,8%) случая (p<0,05). Применение дифференцированного подхода к проведению антибиотико-профилактики цефтриаксоном у пациентов III клинической группы – случаев ГСО на протяжении 12 месяцев зарегистрировано не было.
На основании чувствительности выделенной микрофлоры в посеве гемокультуры и/или раневого отделяемого и наличии локализации очага инфекции в кровеносном русле, у больных на программном гемодиализе с ГСО, разработан алгоритм деэскалационного режима антибактериальной терапии, схема которого приведена на рис. 3.
Исходя из предложенного алгоритма, эмпирическую антибактериальную терапию необходимо начинать с инфузий ванкомицина, а затем по результатам микробиологического исследования крови и/или раневого отделяемого начать собственно деэскалационную терапию: при выделении штамма грамположительной флоры – продолжить терапию ванкомицином или линезолидом – при резистентности к ванкомицину; в случае присоединения грамотрицательной флоры – дополнить антибактериальную терапию меропенемом.

Рис.3. Алгоритм проведения антибактериальной терапии у больных с ГСО, получающих программный гемодиализ.
Для оптимизации тактики антибактериальной терапии у больных с ГСО, получающих программный гемодиализ, были проанализированы две клинические группы больных. Пациентам IА клиническую подгруппу (n=22) проводилась антибиотикотерапия в эскалационном режиме. Пациентам IIА клинической группы, был апробирован алгоритм деэскалационного режима антибиотикотерапии. Лечение ГСО ванкомицином осуществлялось путем внутривенного введения 1,0 грамма 1 раз в 7 дней, а лечение меропенемом проводилось путем внутривенной инфузии 1,0 грамма 1 раз в день. Общая длительность антибактериальной терапии составляла не менее 4-х недель.
Эффективность деэскалационной антибиотикотерапии характеризует достоверное снижение значения по шкале APACHE III у больных IIА подгруппы на 3-й день (87,2 vs 77,1 балла) и 7-й день (88,4 vs 74,3 балла), и по окончании лечения (90,6 vs 71,1 балла). При этом, если при деэскалационном режиме антибактериальной терапии позитивная динамика тяжести состояния (APACHE III 82,6 vs 71,1 балла), то эскалационный вариант антибиотикотерапии приводил к усугублению тяжести состояния (84,5 vs 90,6 балла). Объективным критерием эффективности антибактериальной терапии следует считать достоверное снижение показателей APACHE III в динамике ниже 77,1 баллов (табл. 4).
Таблица 4. Оценка сравнительной эффективности эскалационной и деэскалационной антибактериальной терапии у больных с ГСО.
| Критерии | Больные I А клинической подгруппа (n=22) | Больные II А клинической подгруппа (n=21) | Р | |
| Продолжительность госпитализации, койко-дней | 95,0±2,1 | 56,8±8,4 | *<0,05 | |
| Тяжесть состояния больного по шкале APACHE III, баллы | при поступлении | 84,5±9,4 | 82,6±4,8 | **>0,05 |
| на 3 день после начала лечения | 87,2±2,3 | 77,1±3,1 | *<0,05 | |
| на 7 день после начала лечения | 88,4±5,7 | 74,3±3,5 | *<0,05 | |
| по окончании Лечения | 90,6±3,3 | 71,1±2,7 | *<0,05 | |
| Сохранению ПСД, абс. числ., % | 5 (22,7%) | 8 (38,1%) | *<0,05 | |
| Уровень летальности, абс. числ.,% | 12 (54,5%) | 7(33,3%) | *<0,05 | |
Следствием применения алгоритмизированной тактики антибиотико-терапии являются: увеличение частоты сохранения постоянного сосудистого доступа с 22,7% до 38,1% и снижение летальности на 21,2%.
ВЫВОДЫ
- Гнойно-септические осложнения сосудистого доступа у больных, получающих программный гемодиализ, встречаются в 8,6% случаев, и в большинстве случаев характеризуются развитием ангиогенного сепсиса (67,4%). Инфицирование сосудистого доступа чаще имеет место у пациентов с синтетическими сосудистыми протезами (53,5%).
- Микробиологический пейзаж при развитии гнойно-септических осложнений характеризуется наличием монокультуры микроорганизмов (73,9%), с выделением грамположительной флоры в 82,4% случаев (S.aureus – 43,1% случаев, из них MRSA – 68,4% случаев). При исследовании гемокультуры и раневого отделяемого в динамике, отмечается тенденция к нарастанию штаммов грамотрицательной флоры (33,3%) и ассоциации микроорганизмов (54,5%).
- Клинические проявления гнойно-септических осложнений постоянного сосудистого доступа включали в себя типичные локальные проявления инфекционно-воспалительного процесса – 86,05% случаев, наличием фебрильной лихорадки – 41,8% случаев. Маркерами развития локальных гнойных осложнений и ангиогенного сепсиса у больных на программном гемодиализе, являются: пневмония –34,9%, тромбоз постоянного сосудистого доступа – 27,9%, аррозионное кровотечение из сосудистого протеза – 11,6%, гепатоспленомегалия – 11,6%, инфекционный эндокардит – 9,3%.
- Для развития гнойно-септических осложнений постоянного сосудистого доступа были характерны: тяжелая степень анемии (36,4%), нормальный уровень лейкоцитов (53,5%) и отсутствие сдвига лейкоцитарной формулы влево (58,1%), увеличение СОЭ более 50 мм/ч (51,2%), наличие лимфопении (39,5%) и гиперфибриногенемии (46,5%).
- Прогностическими факторами, свидетельствующими о высокой вероятности гнойно-септических осложнений постоянного сосудистого доступа являются: возраст пациентов старше 60 лет, сахарный диабет, наличие в качестве постоянного сосудистого доступа синтетического сосудистого протеза, лимфопения, анемия (гемоглобин менее 79 г/л), гипергликемия.
- Применение деэскалационного режима антибиотикотерапии (ванкомицин – в качестве стартовой терапии, меропенем – при присоединении грамотрицательной флоры) при возникновении гнойно-септических осложнений у больных на программном гемодиализе, позволило снизить уровень летальности на 21,2% и увеличить частоту сохранения постоянного сосудистого доступа у больных с инфицированными гематомами и инфильтратом на 15,4%. Возникновение флегмоны, абсцесса, наружного свища и развитие ангиогенного сепсиса требовало облигатной ликвидации сосудистого доступа, санации гнойного очага с формированием временного сосудистого доступа для продолжения программного гемодиализа.
- Антибиотикопрофилактика у пациентов с высоким риском развития гнойно-септических осложнений постоянного сосудистого доступа, основанная на превентивном применении цефтриаксона, позволила снизить частоту развития гнойно-септических осложнений на 43%.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Прогнозирование гнойно-септического осложнения постоянного сосудистого доступа следует проводить с учетом факторов риска и их математической значимости: наличие в качестве постоянного сосудистого доступа синтетического сосудистого протеза (Z=0,4754), анемия – гемоглобин менее 79 г/л (Z=0,4156), лимфопения (Z=0,3118), возраст пациентов старше 60 лет (Z=0,2799), сахарный диабет (Z=0,1368), гипергликемия Z(гипергликемия)=0,1071 балла. О высокой степени риска развития гнойно-септических осложнений свидетельствует сумма баллов по имеющимся факторам риска (Zрасчетное) большая или равная 0,5719.
- В качестве антибактериального препарата для антибиотикопрофилактики необходимо использовать цефалоспорин III поколения (цефтриаксон).
- Признаками гнойно-септических осложнений сосудистого доступа у больных на программном гемодиализе следует считать: локальный гнойный процесс в зоне сосудистого доступа; пневмонию; тромбоз постоянного сосудистого доступа, аррозионное кровотечение из сосудистого протеза, инфекционный эндокардит, гепатоспленомегалию.
- При возникновении гнойно-септического осложнения сосудистого доступа эмпирическую антибактериальную терапию необходимо начинать в деэскалационном варианте инфузий ванкомицина; по результатам микро-биологического исследования крови и/или раневого отделяемого – при выделении штамма грамположительной флоры следует продолжить терапию ванкомицином/линезолидом, в случае присоединения грамотрицательной флоры – дополнить антибиотикотерапию меропенемом. Длительность антибактериальной терапии должна составлять не менее 4-х недель.
- Развитие флегмоны в зоне сосудистого доступа, тромбоза сосудистого доступа, аррозионного кровотечения, верификация ангиогенного сепсиса являются показаниями к ликвидации сосудистого доступа: удаление двухпросветного катетера, полное удаление сосудистого протеза с пластикой дефекта артерии аутовенозной заплатой, разобщение артерио-венозной фистулы. Для продолжения программного гемодиализа в период ликвидации гнойно-септических осложнений необходимо установление туннельного катетера в магистральную вену с последующим формированием в плановом порядке нового постоянного сосудистого доступа.
- Объективным критерием эффективности проводимой антибактериальной терапии следует считать достоверное снижение показателей APACHE III на 3 сутки лечения ниже 77,1 баллов.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ
1. Исмаилов Н.Б., Козлов Д.В. «Дифференциальная тактика лечения тромбозов постоянного сосудистого доступа у гемодиализных больных». // Сборн. науч. трудов.- Вып. 4. «Особенности хирургической тактики у больных старших возрастных групп в условиях современного многопрофильного стационара», Москва, 2008г. С. 72-74.
2. Исмаилов Н.Б., Козлов Д.В., Байков Б.В. «Применение низкомолекулярных гепаринов для профилактики тромбозов постоянного сосудистого доступа у больных, находящихся на программном гемодиализе».// Сборн. науч. трудов.- Вып. 4.- «Особенности хирургической тактики у больных старших возрастных групп в условиях современного многопрофильного стационара», Москва, 2008г. С.74-77.
3. Евсеев М.А., Исмаилов Н.Б., Козлов Д.В. «Особенности течения гнойно-септических осложнений у больных, получающих программный гемодиализ». // Материалы V Всероссийской научной конференции общих хирургов объединенной с пленумом проблемных комиссий РАМН «Неотложная хирургия» и «Инфекция в хирургии» межведомственного научного совета по хирургии. Ростов-на-Дону, 2008г., С.111-113.
4. Евсеев М.А., Исмаилов Н.Б., Козлов Д.В., Байков Б.В. «Гнойно-септические осложнения при постоянном сосудистом доступе у больных, находящихся на программном гемодиализе». // «Хирургия. Журнал имени Н.И. Пирогова», 2009г., №9, С. 30-33.
5. Евсеев М.А., Козлов Д.В. «Антибиотикопрофилактика гнойно-септических осложнений при формировании постоянных сосудистых доступов у больных, получающих программный гемодиализ».// Материалы VI Всероссийской конференции общих хирургов, объединенной с VI Успенскими чтениями. Тверь, 2010г., С.179-180.
6. Евсеев М.А., Козлов Д.В., Байков Б.В. «Алгоритм антибактериальной терапии гнойно-септических осложнений у больных с постоянными сосудистыми доступами, находящихся на программном гемодиализе».//Материалы VI Всероссийской конференции общих хирургов, объединенной с VI Успенскими чтениями. Тверь, 2010г, С.180-181.
7. Исмаилов Н.Б., Козлов Д.В., Байков Б.В. «Антибиотикопрофилактика гнойно-септических осложнений у гемодиализных больных». // «Ангиология и сосудистая хирургия». Материалы 22(XXVI) Международной конференции Российского общества Ангиологов и сосудистых хирургов. Москва, 2010г., том 16, №4 (приложение), C. 160-161.
8. Евсеев М.А., Исмаилов Н.Б., Круглянский Ю., Козлов Д.В. и др. «Локальные гнойно-септические осложнения сосудистых доступов и ангиогенный сепсис у больных на программном гемодиализе». // Вестник экспериментальной и клинической хирургии. 2011. Том IV, № 2, С. 227-233.

