Совершенствование хирургического метода лечения больных раком лёгкого
На правах рукописи
ЧЕРНЫХ
АЛЕКСАНДР ВЛАДИСЛАВОВИЧ
СОВЕРШЕНСТВОВАНИЕ ХИРУРГИЧЕСКОГО МЕТОДА
ЛЕЧЕНИЯ БОЛЬНЫХ РАКОМ ЛЁГКОГО
14.01.17 – хирургия
14.01.12 – онкология
А В Т О Р Е Ф Е Р А Т
Диссертации на соискание ученой степени
доктора медицинских наук
Рязань 2010г.
Работа выполнена в Государственном образовательном учреждении
высшего профессионального образования «Воронежская государственная
медицинская академия им. Н.Н Бурденко Федерального агентства
по здравоохранению и социальному развитию»
Научныe консультанты:
доктор медицинских наук, профессор Пархисенко Юрий Александрович
доктор медицинских наук, профессор Полоцкий Борис Евсеевич
Официальные оппоненты:
доктор медицинских наук, профессор Базаев Тамази Владимирович
доктор медицинских наук, профессор Сигал Евгений Иосифович
доктор медицинских наук, профессор Петерсон Сергей Борисович
Ведущая организация:
Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
Защита диссертации состоятся «22» октября 2010 года в 12.00. часов на заседании Диссертационного совета Д 208.084.04 при ГОУ ВПО РязГМУ Росздрава (390026 г.Рязань,ул. Высоковольтная, 9).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РязГМУ Росздрава (390026, РФ, г. Рязань, ул. Шевченко, 34).
Автореферат разослан «20» сентября 2010г.
| Ученый секретарь Диссертационного Совета, доктор медицинских наук, профессор | М.А. Бутов |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
АКТУАЛЬНОСТЬ ТЕМЫ. Актуальность проблемы рака лёгкого связана с ростом заболеваемости, высокой смертностью и неудовлетворительными результатами лечения. Рак лёгкого занимает первое место в структуре онкологической заболеваемости мужчин России, он же остаётся лидером среди причин смертности от злокачественных опухолей. Низкая чувствительность опухоли к существующей консервативной терапии делает хирургическое вмешательство основным методом лечения больных с данным заболеванием (Аксель Е.М., 2003, Давыдов М.И., Полоцкий Б.Е., 2004., ЧиссовВ.И., Трахтенберг А.Х. 2008, Перельман М.И., Ясногородский О.О., 2009).
В нашей стране и за рубежом периодически появляются статьи и монографические издания, посвящённые хирургическому лечению рака лёгкого. Вместе с тем работ по проблеме хирургического лечения рака лёгкого явно не достаточно. Имеющиеся отдельные главы в руководствах и журнальные статьи, на наш взгляд, не полностью отражают суть современного состояния проблемы.
Несмотря на более чем полувековую историю разработки лечебной тактики при раке лёгкого, многие принципиальные вопросы хирургического лечения и сегодня требуют обсуждения и уточнения. Так, до сих пор нет единого мнения об объёме вмешательства на лёгком и регионарных лимфатических коллекторах.
Спорным остаётся вопрос о профилактической медиастинальной билатеральной лимфаденэктомии, как о «золотом стандарте» при всех стадиях рака лёгкого. Но тем не менее хирургический метод лечения, как приоритетный при раке лёгкого, на сегодняшний день не имеет оппонентов (Давыдов М.И., Полоцкий Б.Е., 2003., Трахтенберг А.Х., 2008., Takizawa T., et al., 1997., Izbicki J.R. et al., 1998., Okada M., et al., 1998., Schinkel C., et al., 1999).
Развитие анестезиологии и торакальной реаниматологии обеспечили эволюцию хирургического метода. Стали возможными резекции лёгких при местнораспростаненных и осложнённых формах рака лёгкого. Эту проблему пытаются решать комбинированные операции по поводу рака лёгкого – вмешательства нестандартные, включающие в это понятие множество различных по характеру, объёму, технике выполнения оперативных приёмов. Но ряд положений, касающихся принципиально важных вопросов хирургической техники, обеспечивающих радикальность оперативного вмешательства, требуют специальной оценки, с точки зрения обязательного компонента комбинированной операции при раке лёгкого. Это, прежде всего, относится к необходимости выполнения медиастинальной лимфоаденэктомии. Иными словами, должна ли каждая комбинированная операция при раке лёгкого быть расширенной комбинированной резекцией?
Существует также ряд объективных причин, препятствующих активному внедрению прогрессивных хирургических методик в практику: отсутствие конкретно сформулированных показаний к удалению различных групп лимфатических узлов в зависимости от локализации опухоли в лёгком; отсутствие единой классификации типов операции в зависимости, от объёма удаления регионарных и отдалённых лимфоколлекторов, и самое главное, отсутствие чётко описанной методологии выполнения приёмов лимфоаденэктомии.
Всё вышесказанное позволяет считать анализ различных аспектов хирургического лечения больных раком лёгкого, с целью определения оптимальной лечебной тактики, проблемой весьма актуальной на современном этапе и подтверждает необходимость её детального изучения.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Создание концептуального подхода хирургического лечения рака лёгкого, определяющего адекватность объёма операции без увеличения числа послеоперационных осложнений и летальности.
ЗАДАЧИ ИССЛЕДОВАНИЯ
- Дать определение «типичной» и «расширенной» операции для рака лёгкого, с учётом прогностической значимости удаления различных групп региональных и отдалённых лимфоузлов.
- Изучить прогностические факторы и их клиническую значимость по своим представлениям об онкологическом радикализме в процессе совершенствования хирургического метода в лечении рака лёгкого.
- Разработать и внедрить оригинальные методы выполнения адекватной расширенной лимфодиссекции (прежде всего систематической медиастинальной билатеральной лимфодиссекции), повышающие радикальность хирургических вмешательств.
- Изучить и сравнить непосредственные и отдалённые результаты хирургических вмешательств с «типичной» и «расширенной» лимфодиссекцией при раке лёгкого. Изучить частоту и характер послеоперационных осложнений «расширенных операциях».
- Обосновать оптимальный хирургический доступ для адекватного объёма удаления поражённого органа, регионарных лимфоколлекторов, а так же возможных комбинированных резекций.
- Создать протокол стандартизованного макро- и микроскопического исследования удалённого препарата с целью корректного стадирования опухолевого процесса и индивидуального прогнозирования течения заболевания.
- Определить современные возможности лечения мелкоклеточного рака лёгкого и оценить место хирургического метода в лечении этой патологии.
НАУЧНАЯ НОВИЗНА
Впервые с современных позиций клинической онкологии проведен анализ большого числа наблюдений больных раком лёгкого получавших лечение в торакальных отделениях Клинической медсанчасти Новолипецкого металлургического комбината и Липецкой областной клинической больницы.
В результате анализа:
- отработан методологический подход к решению актуальных задач хирургического лечения рака лёгкого. Определена рациональная лечебная тактика и обоснован выбор метода хирургического лечения в зависимости от локализации опухоли в лёгком, степени её распространения и состояния больного.
- с учётом изученной прогностической значимости удаления различных групп лимфоколлекторов, впервые даны характеристики стандартной и расширенной лимфодиссекции для рака лёгкого. Унифицирована методика медиастинальной лимфодиссекции. Впервые на большом клиническом материале проведен сравнительный анализ непосредственных и отдалённых результатов (частота послеоперационных осложнений, летальность, выживаемость) операций со стандартной и расширенной лимфодиссекцией у больных раком лёгкого. Обоснован оптимальный хирургический доступ при различной локализации опухоли и степени её распространения.
- доказана целесообразность экстренных повторных вмешательств при возникновении недостаточности шва бронха и пути интраоперационной профилактики недостаточности бронхиального шва после пневмон-, лоб- и билобэктомии.
- с целью корректного стадирования опухолевого процесса и определения показаний к проведению дополнительной терапии, разработан протокол стандартизованного послеоперационного макро- и микроскопического исследования удалённого препарата.
- доказана целесообразность применения хирургического метода в лечении мелкоклеточного рака лёгкого.
- изучены значимые факторы индивидуального прогноза при раке лёгкого.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ
- Впервые с современных позиций проведен анализ большого числа наблюдений больных получавших хирургическое лечение рака лёгкого в двух крупных клиниках: отделение торакальной хирургии Клинической медсанчасти Новолипецкого металлургического комбината и отделение торакальной хирургии Липецкой областной клинической больницы. В результате проведенных клинических исследований получены результаты, подтверждающие целесообразность и правомочность операций с расширенной лимфодиссекцией при раке лёгкого.
- Усовершенствована методика уточняющей диагностики рака лёгкого, рационально оптимизирован процесс обследования больного.
- Полученные данные дают возможность расширить границы хирургического метода. Обоснованы расширенно-комбинированные операции с резекцией поражённых органов и магистральных сосудов средостения.
- Обоснован и определён оптимальный хирургический доступ при раке лёгкого с возможной резекцией поражённых органов и магистральных сосудов средостения, выполнения расширенной лимфодиссекции.
- Показана целесообразность реоперации при ранней недостаточности бронхиального шва, унифицирована методика укрытия бронхиального шва, что позволяет повысить его надёжность и улучшить результаты лечения этого грозного осложнения.
- Изучены факторы прогноза при хирургическом лечении рака лёгкого.
- Обосновано использование хирургического метода в комплексном лечении мелкоклеточного рака лёгкого, что приводит к улучшению отдалённых результатов.
- Разработан и внедрён в практику протокол стандартизованного послеоперационного макро- и микроскопического исследования удалённого препарата, повысивший стадирование опухолевого процесса.
Результаты диссертации внедрены в лечебную практику отделения торакального хирургического торакоабдоминального отдела НИИ клинической онкологии РОНЦ им. Н.Н. Блохина РАМН, в практической работе отделения торакальной хирургии ФГУ «Института хирургии им. А.В. Вишневского» Минздравсоцразвития России, отделения торакальной хирургии ГУЗ «Воронежская областная клиническая больница № 1», отделения торакальной хирургии ГУЗ Курская областная клиническая больница, отделения торакальной хирургии ГУЗ Липецкая областная клиническая больница, учебный процесс Государственного образовательного учреждения высшего профессионального образования «Воронежская государственная медицинская академия им. Н.Н. Бурденко Федерального агентства по здравоохранению и социальному развитию».
ТЕОРЕТИЧЕСКАЯ ЗНАЧИМОСТЬ
Доказано, что основными клинико-морфологическими параметрами рака лёгкого, оказывающими влияние на длительную выживаемость, являются стадия процесса, размер опухоли и метастатическое поражение регионарных лимфоузлов, а наличие поражённых лимфоузлов, их локализация и число зон метастазирования, вовлечённых в процесс, коррелируют с основными клинико-морфологическими характеристиками рака лёгкого и оказывают влияние на отдалённые результаты хирургического лечения и прогноз заболевания.
Разработаны предпосылки правомерности постановки вопроса о хирургическом лечении мелкоклеточного рака лёгкого с последующей химиотерапией в локо-регионарной стадии заболевания, изменив отношение к ним как к потенциально излеченным.
Разработан протокол морфологического исследования способствующий совершенствованию хирургической техники оперирования на лимфатических коллекторах, позволяющий детально исследовать удалённый препарат и более точно стадировать опухолевый процесс, планировать дальнейшую лечебную тактику, облегчает статистическую обработку данных для специализированных стационаров в масштабах России.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ
У всех пациентов с диагностированным раком легкого необходимо проведение «расширенной» операции, в понятие которой мы вкладываем удаление или резекцию лёгкого с систематической медиастинальной билатеральной лимфодиссекцией. Именно такой объем способствует уточнению распространённости опухолевого процесса и повышает радикальность операции.
Наличие поражённых лимфоузлов, их локализация и число зон метастазирования, вовлечённых в процесс, оказывают влияние на отдалённые результаты хирургического лечения и прогноз заболевания, а их удаление является непременным условием обеспечения радикализма оперативных вмешательств.
Общая выживаемость больных после «расширенных» операций лёгких, с учётом всех стадий опухоли на порядок выше выживаемости, чем после «типичных» операций с учётом аналогичных стадий. При этом процент послеоперационных осложнений и летальность при «расширенных» операциях на порядок ниже, чем при «типичных».
Передне-боковой хирургический доступ наиболее оптимален при раке лёгкого, так как менее травматичен и адекватен для проведения резекции поражённых органов, магистральных сосудов средостения с выполнением систематической медиастинальной билатеральной лимфодиссекцией.
Разработанный протокол стандартизованного послеоперационного макро- и микроскопического исследования удалённого препарата повышает качество стадирования опухолевого процесса и прогнозирование течения заболевания.
Пациентов с верифицированным МРЛ I-II стадии после полноценного обследования и проведении адекватной пред- и послеоперационной полихимиотерапии следует оперировать. Такой алгоритм позволяет на порядок улучшить результаты лечения.
Разработанный способ укрытия перикарда после его резекции позволяет закрыть дефект перикарда аутотрансплантатом из одной операционной зоны, что даёт возможность устранить осложнения, наблюдаемые при применении традиционных методов.
АПРОБАЦИЯ РАБОТЫ
Основные положения диссертации доложены на: Международном конгрессе по онкохирургии (Краснодар, 28 мая – 1 июня 2008), «Первой международной конференции по торако-абдоминальной хирургии», посвящённой к 100-летию со дня рождения академика Б.В. Петровского (Москва, 5-6 июня 2008), XII Российском онкологическом конгрессе с международным участием (Москва, 18-20 ноября 2008), Научно-медицинский вестник Центрального Черноземья (Спецвыпуск по материалам юбил. науч.-практ. конф. «Актуальные вопросы современной хирургии», посвящ. 90-летию ВГМА им. Н.Н.Бурденко (Воронеж, 11-12 октября 2007), Международный конгресс «Актуальные направления современной кардио-торакальной хирургии» (Санкт-Петербург, 18-20 июня 2009).
По теме исследования опубликовано 44 работы, в том числе 9 публикаций в журналах рекомендованных ВАК Минобрнауки РФ.
ОБЬЁМ И СТРУКТУРА ДИССЕРТАЦИИ
Работа состоит из введения, 6 глав, заключения, выводов, практических рекомендаций и списка литературы. Диссертация иллюстрирована 50 рисунками и 31 таблицей. Список литературы содержит 305 источников, из них 92 отечественных и 213 зарубежных авторов. Диссертация изложена на 231 страницах машинописного текста.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
- В исследование включены 300 больных раком лёгкого, различных возрастных групп, которым было проведено хирургическое лечение в хирургических отделениях торакальной хирургии Липецкой областной клинической больницы и Клинической медсанчасти Новолипецкого металлургического комбината. В данной работе детально изучены клинические наблюдения на этапах развития хирургии рака лёгкого с использованием современных компьютерных программ статистической обработки.
- Проведен следующий объём исследований больных с диагнозом рак
лёгкого:
а) ретроспективный анализ лечения рака лёгкого.
По имеющимся архивным данным определено состояние хирургической помощи больным раком лёгкого на этапе образования, развития торакальной хирургии, её диагностических возможностях в Липецке и Липецкой области.
б) проспективный анализ хирургии рака лёгкого.
Анализ имеющегося материала (значительное количество анализируемых больных) позволил определить настоящее состояние хирургии рака лёгкого, её эволюционный рост на этапах диагностического обследования, техники хирургического лечения, объёма оперативного вмешательства.
Критерии включения в исследование: больные раком лёгкого, которым было проведено радикальное (расширенные операции) или паллиативное (типичные операции) хирургическое лечение в период начала развития хирургии рака лёгкого, период созревания и становления хирургии рака лёгкого и период современного (настоящего) этапа хирургии рака лёгкого в Липецке и Липецкой области.
Изучен и оценен эволюционный рост хирургии рака лёгкого в исследуемом регионе, уровень значимости объёма оперативного вмешательства в хирургическом лечении рака лёгкого.
В основу работы положен анализ непосредственных и отдалённых результатов лечения 300 больных немелкоклеточным и мелкоклеточным раком лёгкого, оперированных в торакальных отделениях Клинической медсанчасти Новолипецкого металлургического комбината и Липецкой областной клинической больнице в период с 1995 по 2008 годы. 150 пациентам в этой группе была выполнена операция (пневмонэктомия, лоб- и билобэктомия) без систематической медиастинальной билатеральной лимфодиссекции – в дальнейшем именуемые, как «типичной» операции. 150 пациентам, в рамках программы хирургического лечения рака лёгкого, выполнялась систематическая медиастинальная билатеральная лимфодиссекция по принципиальным соображениям - в дальнейшем именуемые, как «расширенной» операции. Мужчин среди них было 281(93,7%) и женщин 19(6,3%). Возраст пациентов варьировал от 31 до 78 лет. Большинство больных (40.3%) были старше 50 лет, пациентов старше 60 лет было 33,7%. В возрасте 70 лет оперировано 2,7% (табл.1).
Таблица 1
Распределение больных по возрасту
| ВОЗРАСТ | ЧИСЛО БОЛЬНЫХ | ||
| Мужчины | Женщины | Всего | |
| До 45 лет | 14 | 2 | 16 (5.3%) |
| 46 – 50 лет | 49 | 5 | 54 (18.0%) |
| 51 – 60 лет | 112 | 9 | 121 (40.3%) |
| 61 – 70 лет | 98 | 3 | 101 (33.7%) |
| 71 и старше | 8 | 0 | 8 (2.7%) |
| Итого: | 281 (93.7%) | 19 (6.3%) | 300 (100%) |
Оценка распространённости опухоли проводилась в соответствии с международной классификацией по системе TNM (5-е издание, 1997 год) на основании данных обследования, операционных и морфологических находок (табл. 2).
Таблица 2
| СТАДИЯ | ЧИСЛО БОЛЬНЫХ | ||
| ВСЕГО | Объём операции | ||
| Расширенная | Типичная | ||
| I стадия T1N0M0 T2N0M0 | 55 (18,3%) 22 33 | 10 (6,7%) 2 8 | 45 (30,0%) 20 25 |
| II стадия T1N1M0 T2N1M0 T3N0M0 | 103 (34,3%) 11 61 31 | 60 (40,0%) 3 31 26 | 43 (28,7%) 8 30 5 |
| IIIA стадия T1-2N2M0 T3N1-2M0 | 142 (47,6) 39 103 | 80 (53,3%) 17 63 | 62 41,3%) 22 40 |
| Итого | 300 (100%) | 150 (50%) | 150 (50%) |
Распределение больных по распространённости опухоли и объёму выполненной операции (Международная классификация по системе TNM, 5-е издание, 1997)
Указан процент от количества операций в данной группе
У 55(18,3%) больных была I стадия, у 103(34,3%) – II стадия и у 142(47,6%) – IIIA стадия.
В группе «расширенных» операций, больные I стадией составили 10(6,7%), II стадия установлена у 60(40%) и IIIA у 80(53,3%) пациентов. Среди «типичных» операций I стадия диагностирована у 45(30,0%), II у 43(28,7%) и IIIA у 62(41,3%) больных.
В большинстве наблюдений был отмечен плоскоклеточный рак – 158(52,7%), в группе «расширенных» операций он составил – 76(25,2%), в группе «типичных» – 82(27,4%). Аденокарцинома была выявлена у 102(34,0%) больных, в группе «расширенных» операций у 46(15,3%) и в группе «типичных» – 56(18,3%). Смешанный рак был выявлен у 10(3,3%) больных, в группе «расширенных» операций у 8(2,7%), в группе «типичных» – у 2(0,7%). Мелкоклеточный рак был выявлен у 30(10%) больных, в группе «расширенных» у 20(6,7%) больных, в группе «типичных» – у 10(3,3%). Центральный и периферический рак были установлены в 205(68,3%) и 95(31,7%) наблюдениях соответственно. Центральный рак встречался чаще в группе «расширенных» оперативных вмешательств, чем в «типичных» (37,0% и 31,3% соответственно). Периферический рак наоборот (13,0% и 18,7% соответственно). При I стадии частота центрального и периферического рака составила – 9(19,1%) и 38(80,9%), при II стадии – 44(43,6%) и 57(52,4%), а при IIIA стадии 152(100%) у всех больных отмечался центральный рак.
Из общего числа операций пневмонэктомии составили 146(48,7%), лоб- и билобэктомии – 154(57,3%). При I стадии это соотношение было 9(16,7%) против 45(83,3%), при II стадии – 49(41,2%) против 70(58,8%) и при IIIA стадии – 88(69,3%) против 39(31,0%) соответственно. Из выполненных пневмонэктомий – 93(31,0%) были расширенными, 53(17,7%) – типичными. Среди лобэктомий – 57(19,0%) были выполнены в расширенном объёме, 97(32,3%) явились типичными (табл. 3).
Таблица 3
Распределение больных по распространённости и типу хирургического вмешательства после “расширенных” и “типичных” операций
| СТАДИЯ | ЧИСЛО БОЛЬНЫХ | ||||
| Тип операции | |||||
| Всего | пневмонэктомии | лоб и билобэктомии | |||
| расширенные | типичные | расширенные | типичные | ||
| I стадия T1N0M0 T2N0M0 | 54 | 1(1,2%)* 0 1 | 8(15,1%)* 1 7 | 11(19,3%)* 6 5 | 34(35,1%)* 3 31 |
| II стадия T1-2N1M0 T3N0M0 | 119 | 29(31,2%)* 10 19 | 20(37,7%)* 8 12 | 33(57,9%)* 25 8 | 37(38,1%)* 22 15 |
| IIIA стадия T1-2N2M0 T3N1-2M0 | 127 | 63(67,7%)* 18 45 | 25(47,2%)* 9 16 | 13(22,8%)* 8 5 | 26(26,8%)* 21 11 |
| Итого | 300(100%) | 93(31,0%) | 53(17,7%) | 57(19,0%) | 97(32,3%) |
* Указан процент от количества операций в данной группе
При изучении особенностей регионарного метастазирования использован материал 150 пациентов оперированных в торакальном отделении Липецкой областной клинической больницы в период с 2001 по 2008 годы. Маркировка лимфатических узлов производилась интраоперационно, и после удаления препарата. Удалённые лимфатические узлы подсчитывались и маркировались соответственно регионарным группам (на основании карты регионарных зон метастазирования рака лёгкого T. Naruke, 1978). Данные вносились в созданный в отделении протокол гистологического исследования и вместе с препаратом направлялись на микроскопическое исследование. У 111(74,0%) пациентов диагностирован центральный и у 39(26,0%) периферический рак. Верхнедолевые локализации справа составили 26,7% (40 из 150), слева 53,3% (50 из 150). В нижних долях опухоль локализовалась справа в 24,0% (36 из 150), слева в 16,0% (24 из 150).
Для определения гистологического типа опухоли и наличия метастазов в лимфатических узлах изучали парафиновые срезы, окрашенные гематоксилином-эозином и пикрофуксином по Ван-Гизону.
Предоперационное обследование больного раком лёгкого включало клинико-инструментальную оценку местной и отдалённой распространённости опухолевого процесса, а также результаты лабораторного и функционального исследования органов и систем организма. В последнее десятилетия благодаря использованию рентгенологических, бронхологических, морфологических (гистологических, цитологических), радионуклидных, ультразвуковых, хирургических и многих других методов диагностики опухолей лёгких удалось выработать стройную систему (алгоритм) мероприятий, цель которых – установление точного диагноза.
Обязательные методы исследования (первичная диагностика).
При центральной форме опухоли проводят:
- Общеклиническое обследование.
- Рентгенологическое исследование органов грудной клетки:
1) стандартную рентгенографию в двух проекциях (прямой и боковой); 2) контрастное исследование пищевода для оценки состояния бифуркационных лимфатических узлов; 3) томо(зонно)графию: а) в прямой проекции в срезе бифуркации трахеи (оценка состояния трахеи, главных и промежуточного бронхов, а также основных групп внутригрудных лимфатических узлов); б) в косых проекциях (получения изображения верхнедолевых бронхов и их сегментарных ветвей); в) в боковой проекции (получение изображения промежуточного, нижнедолевых и среднедолевого бронхов); 4) компьютерную томографию грудной клетки.
III. Цитологическое исследование мокроты (5-6 анализов), особенно после бронхоскопии.
- Бронхологическое исследование с получением материала для
морфологического исследования (отпечатки опухоли, смыв с бронхов, прямая биопсия, транстрахеобронхиальная пункция лимфатических узлов).
- Ультразвуковое исследование органов брюшной полости,
забрюшинного пространства, надключичных зон.
При периферической опухоли лёгкого осуществляют:
- Общеклиническое обследование.
- Рентгенологическое исследование: 1) рентгенографию органов
грудной клетки в двух проекциях (прямой и боковой); 2) контрастное исследование пищевода; 3) томо(зоно)графию: стандартную в прямой проекции (в срезе бифуркации трахеи) и прицельную в прямой и/или боковой проекции (в срезе патологической тени); 4) компьютерную томографию грудной клетки.
- Цитологическое исследование мокроты (5-6 анализов).
- Бронхологическое исследование с получением материала для
морфологической верификации (зондирование бронхов под рентгенологическим контролем, катетеризационная биопсия, трантрахеобронхиальная пункция лимфатических узлов).
- Трансторакальную (чрескожную) пункцию опухоли.
- Ультразвуковое исследование органов брюшной полости,
забрюшинного пространства, надключичных зон.
Клиническое, стандартное рентгенологическое и бронхологическое исследования, а также трансторакальная пункция и цитологическое исследование мокроты не всегда дают возможность морфологически верифицировать диагноз и установить степень распространения опухолевого процесса. Для уточняющей диагностики нередко необходимо применения по показаниям специальных дополнительных методов диагностики.
Дополнительные методы исследования (уточняющая диагностика).
1. Рентгенологическое исследование: а) рентгеноскопия–изучение функциональных симптомов, подвижности тени по отношению к другим органам и структурам; б) суперэкспонированная рентгенография; в) бронхография; г) ангиография (ангиопневмонография, селективная ангиография бронхиальных артерий); д) диагностический пневмоторакс; е) рентгенография скелета грудной стенки; ж) компьютерная томография головного мозга и других органов.
2. Радионуклидные методы (сканирование костей, головного мозга).
3. Хирургические методы: а) пункция или биопсия (прескаленная) надключичных лимфатических узлов; б) медиастиноскопия; в) парастеральная медиастинотимия; г) торакоскопия; д) лапароскопия или диагностическая лапаротомия.
4. Пункция костного мозга.
5. Лабораторные методы исследования.
Необходимо отметить, что при мелкоклеточном раке лёгкого к обязательным методам исследования наряду с перечисленными следует отнести сцинтиграфию костей, сканирование и/или компьютерную томографию головного мозга, пункция или трепанобиопсию костного мозга.
Результаты исследования и их обсуждение
Хирургический метод остаётся по-прежнему ведущим в радикальном лечении больных раком лёгкого. Полувековой опыт его использования позволяет определиться по многим вопросам, в основном связанным с расширением возрастных и технических границ метода. В то же время остаются дискутабельными положения об онкологической целесообразности расширенных и комбинированных вмешательств, при выходе опухоли за пределы лёгкого.
Снижение послеоперационной летальности определяет возможность расширения показаний к хирургическому лечению. Термин «расширенных» отражает увеличение, её объёма за счёт удаления клетчатки и лимфоузлов средостения, а «комбинированная операция» – резекции прилегающих к лёгкому анатомических образований.
Необходимость полного удаления клетчатки и лимфоузлов средостения, как по принципиальным соображениям, так и вынужденно, может обосновываться изучением этапности лимфогенного метастазирования (Бисенков Л.Н. и соавт., 1998). Очевидна необходимость удаления всех групп лимфоузлов средостения, в том числе по принципиальным соображениям, при отсутствии явных изменений в них. Это определяется и сложностью обнаружения метастазов, которые остаются не распознанными при торакотомии.
Вызывает недоумение, что в публикациях, анализирующих пути улучшения результатов хирургического метода, перспективы связаны именно с проведением адъювантной лучевой терапии, а проведению лимфодиссекции не предаётся должного значения.
Отдельное внимание занимают больные мелкоклеточным раком лёгкого. В силу биологических особенностей этой опухоли и принятой концепции её первичной диссеминации длительное время получали только консервативное (химио-лучевое) лечение. Накопленный коллективный опыт в настоящее время позволяет занять своё место хирургическому методу, как компоненту комбинированного лечения этой формы рака лёгкого: операция оправдана при I и II стадии.
Изучение особенностей регионарного метастазирования рака лёгкого в зависимости от гистологической принадлежности и значения символа Т позволило определить некоторые закономерности (табл. 4):
Таблица 4
Регионарное метастазирование рака легкого в зависимости от
символа Т и гистологической структуры опухоли
| Регионарное метастазирование | Плоскоклеточный рак | Аденогенный рак | ||||||
| Т1 | Т2 | Т3 | Т4 | Т1 | Т2 | Т3 | Т4 | |
| N0 | 1 50% | 3 11,1% | 13 27,7% | - | - | 1 5% | 8 30,8% | - |
| N1 | 1 50% | 17 62,9% | 18 38,3% | - | - | 11 55% | 7 26,9% | - |
| N2 | - | 7 26% | 16 34% | - | - | 8 40% | 11 42,3% | - |
| N3 | - | 0 | - | - | - | - | - | - |
| Всего | 2 | 27 | 47 | 0 | 0 | 20 | 26 | 0 |
- частота регионарного метастазирования плоскоклеточного рака и аденокарциномы, в целом, не имеет достоверных различий. При плоскоклеточном раке не выявлено достоверных различий в увеличении частоты общего регионарного метастазирования по мере возрастания символа Т2-Т3, p<0,05. Аналогичная картина прослеживается и при аденогенном раке.
Достоверность метастазирования в лимфоузлы зон N1-N2 аденогенного и плоскоклеточного рака при Т1 не проводилась из-за малого числа наблюдений.
- судить о достоверности метастазирования смешенного рака (плоскоклеточного и аденокарциномы) во внутрилёгочные и внутригрудные лимфоузлы при Т1 и Т2 стадиях не представляется возможным, так как в наших наблюдениях он выявлен только в Т3-4 стадиях, с уже имеющимися метастазами в N1 и N2 (25% и 75% соответственно).
- в группе мелкоклеточного рака не выявлено достоверных различий в увеличении частоты общего регионарного метастазирования по мере возрастания символа Т от Т1 до Т3 (р>0,05). В отличии от плоскоклеточного рака, аденогенного и смешанного рака, данный факт свидетельствует о более злокачественном течении мелкоклеточного рака лёгкого уже начиная с размеров опухоли соответствующих символу Т1. Сравнение мелкоклеточного рака с другими формами рака в пределах одного значения Т показывает, что при опухолях соответствующих Т1 при МРЛ наблюдается раннее метастазирование в лимфоколлекторы зон N2, N3 (табл. 5).
Таблица 5
Регионарное метастазирование рака легкого в зависимости от символа Т и гистологической структуры опухоли
| Регионарное метастазирование | Мелкоклеточный рак | Смешанный рак (плоскоклеточный + аденогенный) | ||||||
| Т1 | Т2 | Т3 | Т4 | Т1 | Т2 | Т3 | Т4 | |
| N0 | 1(25%) | 1(14,3%) | 0 | - | - | - | - | - |
| N1 | 2(50%) | 3(42,9%) | 4(44,4%) | - | - | - | 2(25%) | - |
| N2 | 1(25%) | 3(42,9%) | 3(33,%) | - | - | - | 6(75%) | - |
| N3 | - | - | 2(22,2%) | - | - | - | - | - |
| Всего | 4 | 7 | 9 | - | 0 | 0 | 8 | 0 |
Характер лимфогенного метастазирования рака лёгкого в регионарные лимфоколлекторы в зависимости от размера первичного опухолевого очага – иллюстрирует табл. 6.
Таблица 6
Размер опухоли и частота метастазов в лимфотических узлы при немелкоклеточном раке лёгкого
| Размер опухоли | N0 | N1 | N2 | N1+N2 | Всего |
| 0-25мм | 2 (50%) | 1 (25%) | 1 (25%) | - | 4 (100%) |
| 26-30мм | 5 (18,5%) | 3 (11,1%) | 8 (29,6%) | 11 (40,7%) | 27 (100%) |
| 31-50мм | 7 (9,9%) | 8 (11,3%) | 24 (33,8%) | 32 (45,1%) | 71 (100%) |
| >51мм | 21 (43,8%) | - | 14 (29,2%) | 13 (27,1%) | 48 (100%) |
| Сумма | 35 (23,3%) | 12 (8%) | 47 (31,3%) | 56 (37,9%) | 150 (100%) |
Как видно из данных представленных в таблице 16, при опухоли, максимальный размер которой, превышал 5 см, отсутствие метастазов в лимфатических узлы зарегистрировано в 44,4% наблюдений. Лимфатические узлы средостения были вовлечены в опухолевый процесс в 28,9%, а в 26,7% наблюдений метастазы в средостение выявлялись наряду с поражением лимфатических коллекторов первого порядка (N1). Изолированного поражения корневых лимфатических узлов не наблюдалось.
При опухолях, размер которых не превышал 25 мм, метастазы в лимфатические узлы отсутствовали в 50% наблюдений, поражение первого уровня лимфоколлекторов (N1) наблюдалось в 25%, и в 25% наблюдений поражались лимфатические узлы средостения и корневые, подтверждает необходимость лимфодиссекции даже при опухолях столь малого размера.
Наблюдалось увеличение распределения показателей метастазирования во второй уровень лимфоколлекторов (N2) по сравнению с первым (N1), в группе наблюдений с размером первичной опухоли от 31 до 50 мм, что составило 34,3% и 11,9% (р<0,05) соответственно. В то же время при опухолях, размеры которых превышали 50 мм, преобладало поражение лимфоузлов уровня N2 (28,9%), тогда, как изолированное поражение лимфатических узлов уровня N1 вообще отсутствовало (р<0,05). При опухолях, размер которых превышал 25 мм, наблюдалось достоверно частое метастазирование в лимфатические узлы корня лёгкого и средостения, (р<0,05) в сравнении с опухолями меньшего размера.
Метастазирование немелкоклеточного рака верхней доли правого лёгкого. Количество больных с верхнедолевыми локализациями опухоли составило 40. Периферический рак – 11(27,5%) и центральный – 29(72,5%) наблюдений (рис. 1).

Рис. 1. Распределение больных по клинико-анатомической форме при локализации опухоли в верхней доле правого лёгкого
При центральном раке метастазы выявлены у 21 из 29 больных.
“Прыжковые” метастазы имели место в 30% наблюдениях (12 из 40). При центральном раке – это составило 66,6% (у 8 пациентов), при периферическом – 33,3% (у 4 пациентов). Таким образом, в зависимости от клинико-анатомической формы при опухолях верхней доли правого лёгкого достоверных различий в частоте “прыжкового” метастазирования не наблюдалось, р>0.05.
Метастазирование немелкоклеточного рака нижней доли правого лёгкого. У 36 больных опухоль локализовалась в нижней доле справа. Периферический рак наблюдался у 12 (33,3%) и центральный у 24 (66,7%) пациентов (рис. 2).

Рис. 2. Распределение больных по клинико-анатомической форме при локализации опухоли в нижней доле правого лёгкого
При локализации опухоли в нижней доле правого лёгкого, при центральном раке метастазы выявлены у 21 из 24 больных. При периферическом раке метастазы выявлены у 9 из 12 больных. «Прыжковые» метастазы наблюдались в 52,8% наблюдений.
Метастазирование немелкоклеточного рака верхней доли левого лёгкого. Оперировано 50 больных с верхнедолевой локализацией опухоли. Периферический рак наблюдался у 14 (28%), центральный у 36 (72%) пациентов (рис. 3).
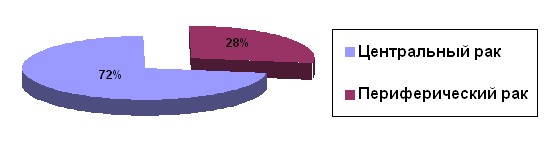 Рис. 3. Распределение больных по клинико-анатомической форме при локализации опухоли в верхней доле левого лёгкого
Рис. 3. Распределение больных по клинико-анатомической форме при локализации опухоли в верхней доле левого лёгкого
При центральном раке верхней доли левого лёгкого метастазы выявлены у 30 из 36 больных.
При периферическом раке метастазы выявлены у всех 14 пациентов.
В нашем исследовании, при локализации опухоли в верхней доле левого лёгкого “прыжкового” метастазирования не выявлено.
Метастазирование немелкоклеточного рака в нижней доле левого лёгкого. У 24 больных опухоль локализовалась в нижней доле левого лёгкого. Периферический рак наблюдался у 6 (25%) и центральный у 18 (75%) пациентов (рис. 4).

Рис. 4. Распределение больных по клинико-анатомической форме при локализации опухоли в нижней доле левого лёгкого
При центральном раке нижней доли левого лёгкого метастазы выявлены у 12 больных из 18.
При периферическом раке метастазирование в корневые лимфоузлы наблюдалось у 3 пациентов. Метастазирование в верхнее, нижнее и переднее средостение не наблюдалось.
«Прыжковые» метастазы имели место в 16,7% наблюдений (у 4 пациентов из 24), при центральном раке.
При сравнении регионарного метастазирования рака лёгкого в зависимости от локализации первичной опухоли выявлены следующие закономерности:
- при локализации опухоли в нижней доле правого лёгкого достоверно чаще происходила «прыжковых» метастазов (52,8%) в сравнении с верхнедолевой локализацией справа (30%), верхнедолевой локализацией слева (0%) и нижнедолевой локализацией слева (16,7%), (р<0,05).
- при расположении опухоли в верхних долях с обеих сторон поражение лимфатических узлов нижнего средостения, в частности бифуркационной зоны не происходило, минуя лимфатические узлы верхнего средостения (р<0,05).
- закономерностей в этапности метастазирования опухолей нижних долей с обеих сторон выявлено не было. Бифуркационная зона не являлась пограничным уровнем в метастазировании, в верхнее средостение. (P>0,05).
Долгое время в литературе обсуждается вопрос о том, влияет ли систематическая медиастинальная билатеральная лимфодиссекция на улучшение отдалённых результатов после радикальных операций по поводу рака лёгкого. Нами проведена сравнительная оценка непосредственных результатов «типичных» и «расширенных» операций. Сравнение проводилось в группах пациентов с одинаковой распространённостью опухоли, соответствующей критериям Т, N и М. В группе “расширенных” операций больные I стадией составили 10 (7%), II – 60 (40%) и IIIА – 80 (53%), в группе “типичных” – 45 (30%), 43 (29%), и 62 (41%) соответственно.
При сравнении общей выживаемости, последняя достоверно была выше после операций с систематической медиастинальной билатеральной лимфодиссекцией р=0,03, log rank test), (рис. 5). Так, 3-х, 5- летняя общая кумулятивная выживаемость после “расширенных” операций составила 70% и 59%, после «типичных» – 30% и 9% соответственно. Медиана выживаемости равнялась 2100 дней (70 месяцев).
 Рис. 5. Кривые общей выживаемости после “расширенных” и “типичных операций” (p=0,03)
Рис. 5. Кривые общей выживаемости после “расширенных” и “типичных операций” (p=0,03)
Отдаленные результаты хирургического лечения больных раком лёгкого характеризуются не только продолжительностью их жизни, но и частотой и характером развития рецидива заболевания. Учитывая особенности выполненных операций, проведен анализ частоты метастазирования во внутригрудные и надключичные лимфатические узлы, а так же появление рецидива в области культи бронха.
После «типичных» операций рецидив в культе бронха выявлен в 7,3%, метастазы в лимфатические узлы средостения в 10,7% и в надключичные лимфоузлы в 2,7% наблюдений. После «расширенных» операций возврат болезни в культе бронха составил 1,3%, метастазы в лимфатические узлы средостения и надключичной области 2,6% и 0,9% соответственно. Данные представлены в табл. 7, и свидетельствуют о достоверном снижении локо-регионарных рецидивов в группе больных, у которых оперативное вмешательство сопровождалось систематической медиастинальной лимфодиссекцией (р<0,05).
На рис. 6, представлена частота рецидивов в зависимости от стадии рака лёгкого.

Рис. 6. Рецидивы расширенных и типичных операций в зависимости от стадии болезни
Таблица 7
Рецидивы после выполненных операций
| Локо-регионарные рецидивы | Объём операции | |
| Типичные (n=150) | Расширенные (n=150) | |
| Рецидив в культе | 11 (7,3%) | 2 (1,3%) |
| МТС в внутригрудные л/у | 16 (10,7%) | 4 (2,6%) |
| МТС в надключичные л/у | 4 (2,7%) | 1 (0,9%) |
При I стадии после «типичных» операций общее число локо-регионарных рецидивов составило 28,4%. Рецидив в культе бронха установлен у 4% (2 из 45), метастазы в надключичные лимфатические узлы у 2,2% (1 из 45) и метастазы в лимфатические узлы средостения 22,2% (10 из 45) больных. После «расширенных» операций общее число локо-регионарных рецидивов при I стадии составило 10%. Рецидивов в культе бронха не наблюдалось ни в одном случае, метастазов в надключичные лимфатические узлы не было и метастазы в лимфатические узлы средостения наблюдались у 10% (1 из 10) оперированных.
При II стадии общее число рецидивов после «типичных» операций в 3 раза превышало их число после расширенных (27,8% против 8,3% соответственно), p<0,05. После «типичных» и «расширенных» операций локо-регионарные рецидивы составили: рецидив в культе бронха – 9,3% (4 из 43) против полного отсутствия таковых (0 из 60), метастазы в лимфатические узлы средостения – 13,9% (6 из 43) против 6,6% (4 из 60) и метастазы в надключичные лимфатические узлы – 4,6% (2 из 43) против 1,7% (1 из 60).
При IIIА стадии после «типичных» операций локо-регионарные рецидивы наблюдались в 3 раза чаще, чем после «расширенных» (24,2% против 7,5% соответственно), P<0,05. После «типичных» операций рецидив в культе бронха наблюдался у 8,1% (5 из 62), метастазы в надключичные лимфатические узлы у 4,8% (3 из 62) и метастазы в лимфатические узлы средостения у 11,3% (7 из 62) пациентов. После «расширенных» операций рецидив в культе бронха наблюдался у 1,2% (1 из 80), метастазы в лимфатические узлы средостения 3,7% (3 из 80) и метастазы в надключичные лимфатические узлы у 2,5% (2 из 80) больных.
Таким образом, полученные результаты свидетельствуют о достоверном снижении всех типов локо-регионарных рецидивов (рецидив в культе бронха, метастазы в лимфатические узлы средостения и надключичной зоны) в группе больных, оперативное вмешательство у которых сопровождалось выполнением систематической медиастинальной билатеральной лимфодиссекцией (р<0,05).
Длительное время в литературе обсуждается вопрос о влиянии объёма операции на отдалённые результаты хирургического лечения рака НМРЛ. За период с 1995 по 2008 годы число больных I стадией НМРЛ оперированных в объёме “расширенных” и “типичных” операций составило 10 и 45 соответственно.
При проведённом анализе результатов лечения вышеуказанных групп нами получены следующие данные: 1, 3 и 5 – летняя выживаемость после «расширенных» операций составила 99%, 80,4% и 80,4% против 90,1, 28,9% и 19% после «типичных» соответственно (табл. 8, рис. 7).

Рис. 7. Кумулятивная выживаемость в зависимости от объёма операции при I стадии НМРЛ
Таблица 8
Результаты хирургического лечения НМРЛ I стадии в зависимости от объёма оперативного вмешательства
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||
| 1 год | 3 года | 5 лет | ||
| Расширенные n=10 | 99% | 80,4% | 80,4% | 3927 дней (127 мес) |
| Типичные n=45 | 90,1% | 28,9% | 19% | 986 дней(32 мес) |
Таким образом, полученные данные свидетельствуют о достоверном улучшении отдалённых результатов хирургического лечения в группе пациентов, которым выполнены «расширенные» операции (p=0,03, log rank test).
Количество больных II стадией НМРЛ оперированных в объёме «расширенных» и «типичных» операций составило 60 и 43 соответственно. При проведенном анализе результатов лечении вышеуказанных групп нами получены следующие данные: 1, 3 и 5-летняя выживаемость после «расширенных» операций составила 99,9%, 80,3% и 70% против 90,1%, 60% и 19% после «типичных» соответственно (табл. 9).
Таблица 9
Результаты хирургического лечения НМРЛ II стадии в зависимости от объёма оперативного вмешательства
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||
| 1 год | 3 года | 5 лет | ||
| Расширенные n=60 | 99,9% | 80,3% | 70% | 2149 дней (70 мес) |
| Типичные n=43 | 90,1% | 60% | 19% | 1881 дней (62 мес) |
Сравнительный анализ двух кривых выживаемости при сопоставляемых объёмах оперативных вмешательств, приведен на рис. 8. Полученные данные свидетельствуют о достоверном улучшении отдалённых результатов хирургического лечения в группе пациентов, которым выполнены операции, сопровождающиеся систематической медиастинальной лимфодиссекцией (p=0,03, log rank test).
 Рис. 8. Кумулятивная выживаемость в зависимости от объёма операции при II стадии НМРЛ
Рис. 8. Кумулятивная выживаемость в зависимости от объёма операции при II стадии НМРЛ
Нужно отметить, что полученные результаты достигнуты за счет пациентов со IIB стадией (T2N1M0 и T3N0M0), так как пациенты имеющие IIA стадию составили лишь 10% из общего числа наблюдений больных со II стадией в общем.
При сравнении результатов лечения во IIA стадии никаких достоверных различий в сравниваемых группах (в зависимости от гистологической структуры опухоли, клинико-морфологической формы, локализации и типа выполненной операции) получено не было. Данный факт, мы, прежде всего, связываем с очень малым числом наблюдений в данной группе, которое составило 11 пациентов.
Количество больных IIIA стадией НМРЛ оперированных в объёме “расширенных” и “типичных” операций составило 80 и 62 соответственно. При проведенном анализе результатов лечения вышеуказанных групп нами получены следующие данные: 1, 3 и 5-летняя выживаемость после “расширенных” операций составила 95,9%, 71% и 50% против 81%, 10% и 5% после “типичных” соответственно (табл. 10). Медиана выживаемости составила после «расширенных» – 965 дней (23 месяца), против 432 дня (14 месяцев) после «типичны».
Таблица 10
Результаты хирургического лечения НМРЛ IIIА стадии в зависимости от объёма оперативного вмешательства
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||
| 1 год | 3 года | 5 лет | ||
| Расширенные n=80 | 95,9% | 71% | 50% | 965 дней (32 мес) |
| Типичные n=62 | 81% | 10% | 5% | 432 дней (14 мес) |
Сравнительный анализ двух кривых выживаемости при сравниваемых объёмах оперативных вмешательств, приведен на рис. 9. Полученные данные свидетельствуют о достоверном улучшении отдалённых результатов хирургического лечения в группе пациентов, которым выполнены операции, сопровождающиеся систематической медиастинальной билатеральной лимфодиссекцией средостения (p=0,03, log rank test).
 Рис. 9. Кумулятивная выживаемость в зависимости от объёма операции при IIIА стадии НМРЛ
Рис. 9. Кумулятивная выживаемость в зависимости от объёма операции при IIIА стадии НМРЛ
Количество больных с распространённостью процесса T1-2N2M0, оперированных в объёме «расширенных» и «типичных» пневмонэктомий составило 17 и 22 соответственно. При проведенном анализе результатов лечения вышеуказанных групп нами получены следующие данные: 1, 3 и 5-летняя выживаемость после «расширенных» пневмонэктомий составила 95,9%, 62,3% и 42,1% против 86%, 11% и 0,7% после «типичных» соответственно (табл. 11). Медиана выживаемости составила после «расширенных» – 974 дня (32 месяца), против 468 дней (15 месяцев) после «типичных».
Таблица 11
Результаты хирургического лечения НМРЛ IIIА стадии с распространённостью T1-2N2M0 после пневмонэктомии
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||
| 1 год | 3 года | 5 лет | ||
| Расширенные n=17 | 95,9% | 62,3% | 42,1% | 974 дней (32 мес) |
| Типичные n=22 | 86% | 11% | 0,7% | 468 дней (15 мес) |
Сравнительный анализ двух кривых выживаемости при сравниваемых объёмах оперативных вмешательств, приведен на рис. 10. Полученные данные свидетельствуют о достоверном улучшении отдалённых результатов хирургического лечения в группе пациентов, которым выполнены пневмонэктомии, сопровождающиеся систематической медиастинальной лимфодиссекцией (p=0,03,log rank test).
 Рис. 10. Кумулятивная выживаемость в зависимости от объёма операции при НМРЛ IIIА стадии с распространённостью T1-2N2M0 после пневмонэктомии
Рис. 10. Кумулятивная выживаемость в зависимости от объёма операции при НМРЛ IIIА стадии с распространённостью T1-2N2M0 после пневмонэктомии
Количество больных с распространённостью процесса T3N1-2M0, оперированных в объёме «расширенных» и «типичных» пневмонэктомий составило 63 и 40 соответственно. При проведенном анализе результатов лечения вышеуказанных групп нами получены следующие результаты: 1, 3 и 5-летняя выживаемость после «расширенных» пневмонэктомий составила 95,9%, 78% и 58% против 86%, 28% и 5% после «типичных» пневмонэктомий соответственно (табл. 12). Медиана составила 960 дней (32 месяца) и 477 дней (16 месяцев) соответственно.
Таблица 12
Результаты хирургического лечения НМРЛ IIIА стадии с распространённостью T3N1-2M0 после пневмонэктомии
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||
| 1 год | 3 года | 5 лет | ||
| Расширенные n=63 | 95,9% | 78% | 58% | 960 дней (32 мес) |
| Типичные n=40 | 86% | 28% | 5% | 477 дней (16 мес) |
Сравнительный анализ двух кривых выживаемости при сравниваемых объёмах оперативных вмешательств, приведен на рис. 11. Полученные данные свидетельствуют о достоверном улучшении отдалённых результатов хирургического лечения в группе пациентов, которым выполнены пневмонэктомии, сопровождающиеся систематической медиастинальной билатеральной лимфодиссекцией (p=0,03, log rank test).

Рис. 11. Кумулятивная выживаемость в зависимости от объёма операции при НМРЛ IIIА стадии с распространённостью T3N1-2M0 после пневмонэктомии
Лоб и билобэктомии с расширенной лимфодиссекцией выполнены 57 больным с распространённостью процесса T1-2N2M0, типичному объёму подверглось 97 пациентов. 1, 3 и 5-летняя выживаемость после «расширенных» операций составила 95,9%, 82%, 70% против 90,1%, 30% и 0,9% после «типичных» соответственно, медианы выживаемости составили 1704 дня (57 месяцев) и 534 дня (18 месяцев), соответственно (табл. 13).
Таблица 13
Результаты хирургического лечения НМРЛ IIIА стадии с распространённостью T1-2N2M0 после лоб и билобэктомии в зависимости от объёма операции
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||
| 1 год | 3 года | 5 лет | ||
| Расширенные n=57 | 90,9% | 82% | 70% | 1704 дней (57 мес) |
| Типичные n=97 | 90,1% | 30% | 0,9% | 534 дней (18 мес) |
Полученные данные свидетельствуют о достоверном улучшении отдалённых результатов в группе «расширенных» операций, p<0,05, log rank test, (рис. 12).

Рис. 12. Кумулятивная выживаемость при НМРЛ IIIА с распространённостью T1-2N2M0 в зависимости от объёма операции после лоб и билобэктомии
В течении последних 20 лет идёт интенсивное изучение возможностей и роли хирургического метода в лечении мелкоклеточного рака лёгкого. В 70-х годах в связи с неудовлетворительными отдалёнными результатами (5-летняя выживаемость 1%) хирургического лечения его проведение считали нецелесообразным. В последующие годы количество публикаций, в которых обсуждаются вопросы хирургического лечения, прогрессивно увеличилось. В них многие авторы приводят весьма обнадёживающие показатели 5-летней выживаемости.
Мы провели сравнительное исследование 30 больных мелкоклеточным раком лёгкого (МРЛ): распространенность опухоли соответствовала I стадии (T1-2N0M0) у 7 больных; II стадии (Т1-2N1M0, T3N0M0) – 12 и III стадии (T1-2N2M0, Т3N2M0) у 11 больных. 70% новообразований располагались центрально и только 30% в периферических отделах лёгкого. Исследованные больные представлены 2 группами: 1-я – оперированные в различных объёмах с расширенной медиастинальной лимфодиссекцией (20 человек) и 2-я (10человек) – которые оперированы в различных объёмах без расширенной медиастинальной лимфодиссекции.
При проведении анализа вышеуказанных групп нами получены следующие результаты: 1, 2, 3, и 5-летняя выживаемость после «расширенных» радикальных операций составила 84%, 48%, 30%, 28% и 28% против 58% переживших 1 год (табл. 14). Остальные 42% больных умерли, на втором году жизни не дожив 2-х лет, от прогрессирования заболевания. Медиана выживаемости составила 875 дней (29 месяцев) против 365 дней (12 месяцев).
Таблица 14
Результаты хирургического лечения МРЛ в зависимости от объёма оперативного вмешательства
| Объём операции | Кумулятивная выживаемость | Медиана выживаемости | ||||
| 1 год | 2 года | 3 года | 4 года | 5 лет | ||
| Расширенные n=20 | 84% | 48% | 30% | 28% | 28% | 875 дней (29 мес) |
| Типичные n=10 | 58% | - | - | - | - | 365дней (12 мес) |
При сравнении общей выживаемости (рис. 14), полученные данные свидетельствуют о достоверном улучшении отдалённых результатов хирургического лечения в группе пациентов, которым выполнены «расширенные» операции (p=0,03, log rank test).

Рис. 14. Общая кумулятивная выживаемость в зависимости от объёма операции при МРЛ
Число больных мелкоклеточным раком лёгкого I стадии, оперированных в различных объёмах с расширенной медиастинальной лимфодиссекцией составило 5 человек. 1, 2, 3, 4, и 5-летняя выживаемость после “расширенных” операций составила 90%, 88%, 58%, 51% и 50% против 32% проживших 1 год, остальные умерли на 2-м году жизни. Медиана составила 795 дней (26,5 месяцев) против 210 дней (7 месяцев) соответственно (рис. 15).
 Рис. 15. Кумулятивная выживаемость в зависимости от объёма операции при I стадии МРЛ
Рис. 15. Кумулятивная выживаемость в зависимости от объёма операции при I стадии МРЛ
Число больных мелкоклеточным раком лёгкого II стадии, оперированных в различных объёмах с расширенной медиастинальной билатеральной лимфодиссекцией средостения составило 10 больных. 1, 2, 3, 3, 4 и 5- летняя выживаемость составила 82%, 75%, 50%, 35% и 32% против 15% переживших первый год. Остальные умерли на втором году жизни. Медиана выживаемости составила 690 дней (23 месяца) против 195 дней (6,5 месяцев).
Сравнительный анализ двух кривых выживаемости (рис. 16) показал достоверное улучшение отдалённых результатов хирургического лечения в группе пациентов, которым выполнены «расширенные» операции (p<0,05, log rank test).

Рис. 16. Кумулятивная выживаемость в зависимости от объёма
операции при II стадии МРЛ
Число больных мелкоклеточным раком лёгкого III стадии, оперированных в различном объёме с систематической медиастинальной билатеральной лимфодиссекцией составило 5 больных. Выживание в этой группе больных ограничивается 2 годами жизни. У пациентов с III стадией мелкоклеточного рака, которым выполнены «типичные» операции в различных объёмах, выживаемость ограничивается до 1 года (340 дней). Медиана составила 510 дней (17 месяцев) против 200 дней (6 месяцев) соответственно (рис. 17).
Полученные данные свидетельствуют о достоверном улучшении отдалённых результатов в группе «расширенных» операций (p<0,05, log rank test).

Рис. 17. Кумулятивная выживаемость в зависимости от объёма операции при III стадии МРЛ
Приведенные выше малоутешительные показатели 5-летней выживаемости больных могут вызвать недоумение и послужить поводом для отказа от каких-либо попыток лечения этого многочисленного и тяжелейшего контингента больных. Если 2 – 3 десятилетия назад средняя продолжительность жизни больных составляла 3 – 6 месяцев, современные показатели 5-летней выживаемости выглядят по-иному при I – II стадиях приближаются к таковым при немелкоклеточном раке лёгкого.
В итоге следует ещё раз подчеркнуть, что к больным мелкоклеточным раком лёгкого необходимо относиться как к потенциально излеченным и при их лечении в полном объёме использовать по показаниям современные методы лечебного воздействия.
Частота послеоперационных осложнений за столь продолжительный период времени не может характеризовать потенциал хирургического метода, ибо характеристика эта достаточно не объективна. За 13 лет в торакальных отделениях города Липецка оперировали хирурги трёх поколений. Выполнялись вмешательства различные по объёму лимфодиссекции, резекции лёгкого и соседних структур. Тем не менее, мы сочли целесообразным на столь большом клиническом материале продемонстрировать спектр послеоперационных осложнений, ожидаемых в хирургии рака лёгкого.
До сих пор остаются достаточно высокими частота послеоперационных осложнений и летальность (25-30%). Это обстоятельство связано с травматичностью лёгочных операций, требующих значительного напряжения компенсаторных механизмов и часто выполняющихся у лиц пожилого возраста с сопутствующими заболеваниями, ослабленных опухолевым и/или воспалительным процессом, с выраженными нарушениями гемодинамики, газообмена и метаболизма.
Условно основные послеоперационные осложнения подразделяют на «терапевтические» (которые не связаны с техническими особенностями операции и лечатся, как правило, консервативно) и «хирургические» (нередко ятрогенной природы, лечение их предусматривает зачастую применение хирургических методов).
Такие хирургические осложнения, как кровотечение и недостаточность бронхиального шва, представляют значительную угрозу для жизни больных. Однако, не все хирурги, являются сторонниками повторных операций при лечении последних. В качестве аргумента приводятся случаи выживания пациентов при традиционных консервативных методах лечения, таких как дренирование, эндоскопическая санация на фоне антибактериальной и дезинтоксикационной терапии. Столь сдержанная позиция, прежде всего, объясняется высоким риском повторных операций.
Непосредственные результаты хирургического лечения рака лёгкого в значительной мере зависят от квалификации хирургов, анестезиологов и оснащённости клиник, поэтому для широкого круга практических врачей проблемы высокой частоты осложнений и летальности остаются особенно актуальными.
Острая дыхательная недостаточность, пневмония, эмпиема плевры и аррозивное кровотечение при плевробронхиальном свище определяют течение основного послеоперационного осложнения, тяжесть состояния больного и могут быть непосредственной причиной смерти.
В табл. 15, представлены послеоперационные осложнения наблюдавшиеся в нашей клинике после операций, выполненных в расширенном объёме, то есть с систематической медиастинальной билатеральной лимфодиссекцией в период с 2001 по 2008 годы.
Непосредственные результаты операции закономерно связаны с её объёмом и травматичностью, что подтверждается нашими наблюдениями. Частота осложнений после пневмонэктомий (28,1%) была больше, чем после лоб и билобэктомий (19,4%), р < 0,05.
Критическое осмысление «хирургических» послеоперационных осложнений убедило, нас, прежде всего, их развитие связано с дефектами оперативной техники, неправильной оценкой интраоперационной ситуации, порой, создания самим хирургом дополнительных сложностей. В меньшей степени, на наш взгляд, возникновение этих осложнений зависит от так называемых «общебиологических» причин. Представляется, что деление послеоперационных осложнений на «хирургические» и «нехирургические» практически оправдано, так как заставляет хирургов более внимательно относится к выполнению технических приёмов операции.
Анализ показывает, что общее число осложнений после расширенных операций на лёгких при раке остается достаточно высоким – 21,3%, что связано с категорией больных и травматичностью операций.
Таблица 15
Общая структура осложнений после «расширенных» операций
| Всего оперировано Без осложнений С осложнениями | 150 больных 118(78,%) 32(21,3%) | Умерло - 10(6,7%) |
| Общая структура осложнений | Число осложнений | |
| Хирургические: Пищеводно-бронхиальный свищ Бронхиальный свищ Эмпиема плевры Кровотечение Нагноение раны Не полное расправление лёгкого | 1(0,7%) 6(4,0%) 3(2,0%) 3(2,0%) 7(4,7%) - | - 1(0,7%) - 1(0,7%) - - |
| Всего | 20(13,3%) | 2(1,4%) |
| Нехирургические: Пневмония Лёгочно-сердечная недостаточность Нарушение сердечного ритма Острая сердечно-сосудистая недостаточность Инфаркт миокарда Тромбоэмболия лёгочной артерии Почечно-печёночная недостаточность Ранний пневмоторакс | 2(1,3%) 5(3,3%) 2(1,3%) 3(2,0%) - - - - | - 4(2,6%) 1(0,7%) 3(2,0%) - - - - |
| Всего | 12(8,0%) | 8(5,3%) |
Именно поэтому наибольшее число осложнений возникает после пневмонэктомий - 24,7%. Достаточно часто (6,3%) развивается недостаточность швов бронха, пневмония единственного лёгкого (2,1%), лёгочно-сердечная недостаточность (4,3%). Лоб и билобэктомии сопровождаются меньшим числом осложнений (15,8%) и в структуре их значительное место заняло нагноение послеоперационной раны (8,8%), нарушение сердечного ритма (1,8%), острая сердечно-сосудистая недостаточность (1,8%) и лёгочно-сердечная недостаточность (1,8%).
При анализе частоты осложнений после «расширенных» и «типичных» операций, выявлено, что после пневмонэктомий выполненных в «типичном» объёме она в 1,4 раза выше (33,9%), чем при «расширенных» операциях (24,7%). В целом различия недостоверны, p>0,05. Нужно отметить, что «хирургические» осложнения в сравниваемых группах были сопоставимы (после «типичных» – 16,9%, после «расширенных» – 15,1%, p>0,05), тогда как «нехирургические» осложнения после «типичных» операция (17,0%) наблюдались более чем в 1,5 раза чаще, чем после расширенных (9,4%), (p<0,05). Данный факт, прежде всего, связан с тем, что типичные операции выполнялись в нашей клинике в период с 1995 до 2000 годов, тогда, как, начиная с 2001 года, систематическая медиастинальная билатеральная лимфодиссекция является стандартным объёмом при операциях на лёгком по поводу рака. Естественно, совершенствование предоперационной подготовки и послеоперационного ведения больных, анестезиологического обеспечения, интенсивной терапии и хирургической техники способствовали значительному снижению частоты осложнений в данной группе больных, несмотря на расширение объёмов вмешательства.
Отражение общего возросшего уровня хирургии рака лёгких является послеоперационная летальность.
Наши данные показывают, что после «расширенных»” операций общая послеоперационная летальность составила 6,7% (после пневмонэктомий – 7,5%, после лоб(билоб)эктомий – 5,3%), после «типичных» операций – 7,3% (после пневмонэктомий – 9,2%, после лоб(билоб)эктомий – 6,2%). Данные представлены на рис. 18.
Рис. 18. Летальность в зависимости от объёма и типа операции
Послеоперационная летальность изучалась на основании 3 месячного срока прошедшего с момента оперативного вмешательства.
Динамика послеоперационной летальности представлена на графике (рис. 19). Кривую летальности с тенденцией на снижение, особенно в последние годы, можно прокомментировать отработкой методики оперативного вмешательства и повышением технического мастерства хирургов, а также возросшим опытом и квалификацией анестезиологов и реаниматологов. Оценивая частоту послеоперационных осложнений и летальность, следует отметить, что расширенные операции не влияют на их увеличение, даже напротив, наблюдается уменьшение этих показателей.
 Рис. 19. Динамика послеоперационной летальности
Рис. 19. Динамика послеоперационной летальности
Общая кумулятивная выживаемость больных после резекций лёгких, с учётом всех стадий опухоли представлены на графике (рис. 20).
Результаты труда коллектива клиники за последние 6 лет нам представляются приемлемыми. Общая 5-летняя выживаемость равная 30%, при послеоперационной летальности 6,7%, свидетельствует о высоком качестве хирургической, а так же анестезиологической и реаниматологической помощи в клинике. Представленная выживаемость нескоррегированная, с учётом послеоперационной летальности. До настоящего времени прослежены 254 (85,0% от 300) пациента.
 Рис. 20. Общая выживаемость больных после резекции
Рис. 20. Общая выживаемость больных после резекции
лёгких (2001 – 2008 гг.)
При оценке непосредственных и отдалённых результатов хирургического лечения исследовалась кумулятивная выживаемость по методу Kaplan-Meier с использованием компьютерной программы Statistic 6.0. Для оценки достоверности различий в сравниваемых группах использовались «log rank test». При оценке достоверности различий в малых выборках использовался критерий Фишера.
ВЫВОДЫ
1. «Типичной операцией» (стандартной) при раке лёгкого в настоящее время считается пневмонэктомия, или лоб- билобэктомия с удалением лимфатических узлов корня лёгкого и средостения (медиастинальная лимфодиссекция со стороны поражения). В понятие «расширенная операция» мы вкладываем удаление или резекцию лёгкого с удалением клетчатки и лимфатических узлов средостения – включающим паратрахеальные, параэзофагеальные и передние медиастинальные с обеих сторон. Эти операции позволяют повысить радикализм и адекватно оценить внутригрудную распространённость опухоли и достоверно улучшают результаты хирургического лечения больных раком лёгкого (р<0,05, log rank test).
2. Основным клиническим прогностическим фактором при раке лёгкого является метастазирование в регионарные лимфатические узлы (N). При отсутствии метастазов в регионарных лимфатических узлах 5-летняя выживаемость в сравнении с метастатическим их поражением (N1) выше в 1,2 раза и (N2) в 2 раза (р<0,05). При N0 она составила 80,4%, при N1 – 70% и при N2 – 42,1%.
3. Разработанный оригинальный метод адекватной «расширенной» лимфодиссекции (прежде всего систематической медиастинальной билатеральной лимфодиссекции) позволяет достичь желаемой точности диагностики рака лёгкого и является методом не только уточняющей диагностики, но и решает задачи таргентной терапии.
4. Частота осложнений и послеоперационная летальность при хирургическом лечении рака лёгкого сохраняются достаточно высокими. Систематическая медиастинальная билатеральная лимфодиссекция не влияет на увеличение летальности (6,7% против 7,3%) и частоту послеоперационных осложнений у пациентов по сравнению с “типичной” операцией (21,3% и 30,5% соответственно, р>0,05), что создают условия для расширения границ хирургического вмешательства на путях лимфооттока и внедрения в практику этого объёма операций у больных раком лёгкого.
5. Переднебоковая торакотомия, как справа, так и слева, обеспечивает полноценный доступ к корню лёгкого, ко всем регионарным зонам метастазирования, органам средостения и является оптимальным хирургическим доступом при раке лёгкого.
6. Стандартизованный протокол морфологического исследования помогает клиницисту более точно стадировать опухолевый процесс и планировать дальнейшую лечебную тактику.
7. Мелкоклеточный рак лёгкого характеризуется морфологической неоднородностью, определяющей клиническое течение, частоту и характер метастазирования во внутригрудные лимфатические узлы и отдалённые органы, но и при этой гистологической структуре рака лёгкого имеются локорегионарные стадии заболевания (I и II), при которых правомерно хирургическое лечение с обязательной последующей химиотерапией.
СПИСОК ТРУДОВ ПО ТЕМЕ ДИССЕРТАЦИИ
- Новые подходы к лечению больных с осложнениями после пневмонэк-
томий // XV Нац. конгр. по болезням органов дыхания: сб. тез. - М., 2005. – С. 67. – (Совм. с: Ю.А. Пархисенко, В.В. Булынин, Е.И. Боровских).
- Пат. 2283040 RU, МПК8 А61В 17/00. Способ лечения перфорации пи-
щевода после пульмонэктомии слева / Ю.А. Пархисенко [и др.]; Воронежская мед. акад. - № 2005107965; заявл. 21.03.05; опубл.10.09.06,Бюл.25.- 1с.
- Пат. 2295302 RU, МПК8 А61В 17/00. Способ дренирования плевральной
полости после пульмонэктомии / В.В. Булынин, А.В. Черных, И.А. Больдинов; Воронежская мед. акад. - № 2006104073; заявл. 10.02.06; опубл. 20.03.07, Бюл.8.- 3с.
- Пат. 2295303 RU, МПК8 А61В 17/00. Способ пластики перикарда после
обширной резекции / Ю.А. Пархисенко, В.В. Булынин, А.В. Черных; Воронежская мед. акад. - № 2006104074; заявл. 10.02.06; опубл. 20.03.07, Бюл.8.- 3с.
- Пат. 2295333 RU, МПК8 А61Р 11/00. Способ химического плевродеза
при лечении пневмоторакса / В.В. Булынин [и др.]; Воронежская мед. акад. - № 2006104072; заявл. 10.02.06; опубл. 20.03.07, Бюл. 8.- 3с.
- Непосредственные результаты хирургического лечения немелкоклеточ
ным раком лёгкого // Науч. – мед. вестн. Центрального Черноземья. - 2007. - №30 (Спец. вып.). - С. 50-53.- (Содерж. спец. вып.: Актуальные вопросы современной хирургии: материалы юбил. науч. - практ. конф., посвящ. 90-летию ВГМА им. Н.Н. Бурденко (11-12 окт.)).
- Оптимизация хирургического лечения немелкоклеточного рака лёгкого
// Науч. – мед. вестн. Центрального Черноземья.- 2007.- №30 (Спец. вып.).- С.29-37. - (Содерж. спец. вып.: Актуальные вопросы современной хирургии: материалы юбил. науч. - практ. конф., посвящ. 90-летию ВГМА им. Н.Н. Бурденко(11-12 окт.)).- (Совм. с: Ю.А. Пархисенко, В.В. Булынин).
- Возможные осложнения систематической медиастинальной билате
ральной лимфодиссекции при раке легкого и пути их профилактики // Сиб. онкол. журн.- 2008.- №5 (29).- С.55–58.
- Непосредственные результаты хирургического лечения немелкоклеточ
ного рака лёгкого // Онкол. журн.- 2008.- № 8.- С.30-35.
- Оптимальные варианты лечения немелкоклеточного рака лёгкого //
Системный анализ и управление в биомедицинских системах. – 2008. - Т. 7, № 1. – С.87-93.
- Паранеоплазии и рак лёгкого // Актуальные вопросы клинической хи-
рургии: материалы науч. – практ. конф. хирургов Центрального федерального округа Российской Федерации. – Ярославль, 2008. – С.76 -77. – (Сер. Альманах клинической медицины. – Т.XVII).- (Соавт.: Ю.А. Пархиснко, В.В. Булынин).
- Паранеопластический синдром у больных раком лёгкого // XII Рос. Он-
кол. конгр.- М., 2008.- С.180. - (Совм. с: Ю.А. Пархисенко).
- Результаты медиастинальной лимфоаденэктомии // Материалы Первой
Междунар. конф. по торако - абдоминальной хирургии. – М., 2008.- С. 324.
- Результаты систематической билатеральной медиастинальной лимфо-
диссекции // Актуальные вопросы клинической хирургии: материалы науч. – практ. конф. хирургов Центрального федерального округа Российской Федерации. – Ярославль, 2008. – С.77-78. – (Сер. Альманах клинической медицины. – Т.XVII).- (Соавт.: Б.Е. Полоцкий).
- Систематическая медиастинальная билатеральная лимфодиссекция в
лечении НМРЛ // XII Рос. онкол. конгр. – М., 2008. - С. 181-182.
- Современные взгляды на хирургическое лечение больных немелкокле-
точным раком лёгкого III стадии // Системный анализ и управление в биомедицинских системах. – 2008. - Т.7, №1. – С.209-213.
- Хирургическое лечение, осложнения и выживаемость больных немел-
коклеточным раком лёгкого // Онкол. журн.- 2008.- № 5.- С.40-45.
- Медиастинальная билатеральная лимфодиссекция в хирургическом ле-
чении немелкоклеточного рака лёгкого (НМРЛ) // Современные организационные, диагностические и лечебные технологии в практике хирургической службы: материалы XIII съезда хирургов Липецкой области. – Липецк, 2009. – С. 74-75.
- Немелкоклеточный рак лёгкого: оптимизация лечения // Прикладные
информационные аспекты медицины: (науч. – практ. журн.).- 2009. – Т.12,№1.– С.134-142.
- Оптимизация критериев классификации TNM в лечении рака лёгкого
// Актуальные направления современной кардио-торакальной хирургии: Междунар. конгр.– СПб., 2009. – С. 100.
- Проявление паранеоплазии у больных раком лёгкого // Современные
организационные, диагностические и лечебные технологии в практике хирургической службы: материалы XIII съезда хирургов Липецкой области. – Липецк, 2009. – С. 78-80.
- Рак лёгкого осложненный параканкрозом: подходы к диагностике и
тактика лечения // Науч. – мед. вестн. Центрального Черноземья: ежеквартальный науч. – практ. журн. - 2009. - №37. – С.56-63.
- Расширение хирургического объема в лечении рака легкого // Сиб. Он-
кол. журн.- 2009.- №1(31).- С.48-50.
- Расширенные и комбинированные операции при немелкоклеточном ра-
ке лёгкого III стадии // Актуальные направления современной кардио-торакальной хирургии: Междунар. конгр. – СПб., 2009. – С. 100.
- Расширенные и комбинированные операции при немелкоклеточном ра-
ке лёгкого III стадии // Современные организационные, диагностические и лечебные технологии в практике хирургической службы: материалы XIII съезда хирургов Липецкой области. – Липецк, 2009. – С. 77-78.
- Риск осложнений при медиастинальной лимфодиссекции у больных
немелкоклеточным раком лёгкого // Рос. медико-биол. вестн. им. акад. И.П. Павлова.- 2009.- № 1.- С.115-118.
- Совершенствование хирургического лечения немелкоклеточного рака
лёгких // Современные организационные, диагностические и лечебные технологии в практике хирургической службы: материалы XIII съезда хирургов Липецкой области. – Липецк, 2009. – С. 75-76.
- Современные варианты лечения немелкоклеточного рака лёгкого
// Вестн. Санкт-Петербургского университета. – 2009.- Сер.11, вып 2. – С.150-163.
- Эффективность систематической медиастинальной билатеральной
лимфодиссекции в хирургическом лечении рака лёгкого // Рос. медико-биол. вестн. им. акад. И.П. Павлова.-2009.- № 2.- С.121-126.
- Видеоторакоскопический плевродез в лечении злокачественных экссуда-
тивных плевритов // Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара и на догоспитальном этапе: материалы IV науч. – практ. конф. – Воронеж, 2010. – С.113-114. - (Совм. с: Ю.А. Пархисенко, В.В. Булынин).
- Комплексная диагностика рака лёгкого // Актуальные вопросы органи-
зации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара и на догоспитальном этапе: материалы IV науч. – практ. конф. – Воронеж, 2010. – С.92. – (Совм. с: В.В. Булынин).
- Опыт хирургического лечения НМРЛ III стадии // Актуальные вопросы
организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара и на догоспитальном этапе: материалы IV науч. – практ. конф. – Воронеж, 2010. – С.132.
- Особенности лечения осложнённых форм рака лёгкого // Актуальные
вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара и на догоспитальном этапе: материалы IV науч. – практ. конф. – Воронеж, 2010.– С.132-134.
- Особенности хирургического лечения немелкоклеточного рака лёгкого
III стадии // Рос. онкол. журн. – 2010.- №1. – С.4-8.- (Соавт.: Б.Е. Полоцкий, К.К. Лактионов).
- Профилактика осложнений после обширных резекций перикарда // Ак-
туальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара и на догоспитальном этапе: материалы IV науч. – практ. конф. – Воронеж, 2010. – С.131-132.
- Трансторакальная пункционная биопсия новообразований лёгкого под
контролем ультразвука // Актуальные вопросы организации, оказания первичной, специализированной медицинской помощи в условиях многопрофильного стационара и на догоспитальном этапе: материалы IV науч. – практ. конф. – Воронеж, 2010. – С.114-115. - (Совм. с: Ю.А. Пархисенко).
- Обоснование систематической медиастинальной билатеральной лим-
фодиссекции в хирургическом лечении немелкоклеточного рака лёгкого // Вестн. эксперим. и клинич. хирургии. – 2010. - Т.3, №2. – С.129-132. – (Соавт.: Л.В. Агафонова).
- Частота гнойно-деструктивных изменений при раке лёгкого // Актуаль-
ные вопросы хирургии: науч. – практ. конф. хирургов Центрального федерального округа Российской Федерации. – Белгород, 2010. – С. 338-339.
- Хирургическое лечение рака лёгкого осложненного гнойно-
деструктивными изменениями // Актуальные вопросы хирургии: науч. – практ. конф. хирургов Центрального федерального округа Российской Федерации. – Белгород, 2010. – С. 340-342.
- Особенности диагностики гнойно-деструктивных изменений в лечении
рака лёгкого // Актуальные вопросы хирургии: науч. – практ. конф. хирургов Центрального федерального округа Российской Федерации. – Белгород, 2010. – С. 336-338.
- Анализ выживаемости после хирургического лечения НМРЛ // Онко-
хирургия. – 2010. – Прил. 1. – С. 169.- (Прил. №1 к журн.: В будущее через новые технологии: Междунар. онкол. науч. – образоват. форум «ОНКОХИРУРГИЯ-2010». – М., 2010).
- Значимость паранеоплазии на эффективность лечения больных раком
// Онкохирургия. – 2010. – Прил. 1. – С. 169-170.- (Прил. №1 к журн.: В будущее через новые технологии: Междунар. онкол. науч. – образоват. форум «ОНКОХИРУРГИЯ-2010». – М., 2010).
- Особенности лечения осложнённых форм рака лёгкого // Онкохирургия.
– 2010. – Прил. 1. – С. 170.- (Прил. №1 к журн.: В будущее через новые технологии: Междунар. онкол. науч. – образоват. форум «ОНКОХИРУРГИЯ-2010». – М., 2010).
- Адекватный объём оперативного лечения НМРЛ // Онкохирургия. –
2010. – Прил. 1. – С. 170-171.- (Прил. №1 к журн.: В будущее через новые технологии: Междунар. онкол. науч. – образоват. форум «ОНКОХИРУРГИЯ-2010». – М., 2010).
© ГОУ ВПО «Воронежская государственная медицинская
академия им. Н.Н. Бурденко Росздрава», 2010 г.
Формат 60х841/16. Ризография.
Подписано в печать «28» июня 2010 г.
Объем 1,0 усл.печ.листов – Тираж 100 экз, Заказ № 144
Липецкий Государственный Технический Университет
Типография ЛГТУ, 398600 Липецк, ул. Московская, 30

