Оптимизация ростового прогноза у детей с гонадотропинзависимыми формами преждевременного полового развития опухолевого и неопухолевого генеза. (
На правах рукописи
Болмасова Анна Викторовна
Оптимизация ростового прогноза у детей с гонадотропинзависимыми формами преждевременного полового развития опухолевого и неопухолевого генеза
.
(14.01.02 – Эндокринология)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва- 2012
Работа выполнена в ФГБУ «Эндокринологический научный центр» Министерства здравоохранения и социального развития Российской Федерации
(Директор – академик РАН и РАМН, профессор И.И. Дедов)
Научный руководитель: член-корреспондент РАМН, профессор
Петеркова Валентина Александровна
Официальные оппоненты: доктор медицинских наук, профессор
Самсонова Любовь Николаевна
доктор медицинских наук, профессор
Уварова Елена Витальевна
Ведущая организация: ГБОУ ВПО Российский национальный исследовательский медицинский университет
имени Н.И. Пирогова МЗ СР РФ
Защита состоится «29» февраля 2012г. в 14 часов на заседании Диссертационного совета Д.208.126.01 ФГБУ Эндокринологический научный центр Минздравсоцразвития РФ по адресу: Москва, ул. Дмитрия Ульянова, д.11.
С диссертацией можно ознакомиться в библиотеке ФГБУ ЭНЦ Минзравсоцразвития РФ.
Автореферат разослан «27»января 2012г.
Ученый секретарь Диссертационного совета
Доктор медицинских наук, профессор Е.А. Трошина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Терапия аналогами люлиберина, для лечения центральных форм преждевременного полового развития используется во мире уже более 30 лет. В России лечение аналогами люлиберина активно используется с 1994 года, но к настоящему моменту долгосрочных и катамнестических исследований не проводилось.
В ряде зарубежных публикациях доложено о высокой эффективности данной терапии в отношении блокирования секреции гонадотропных гормонов и прогрессии полового созревания, но по-прежнему дискутируются вопросы об эффективности в отношении конечного роста, сроков завершения терапии и восстановления работы гипоталамо-гипофизарной оси, безопасности терапии. [Torsten Tuvemo и соавт. 2006г]
В некоторых зарубежных исследованиях выявлено значительное увеличение индекса массы тела в течение терапии [Martin Diaz MG, Aguiar AL и соавт. 2006г], [Anna Maria Pasquino и соавт, 2008г], однако по результатам других работ данные изменения минимальны [Bertrlonny S 1998].
Большой интерес представляет изучение механизма активации пубертата. Изучается роль взаимодействия нейропептида кисспептина с его рецептором GPR54. Известно, что данный нейропептид, кодируется геном KISS-1, и, по мнению многих авторов, его взаимодействие с рецептором играет критическую роль в запуске полового созревания. Определение уровня кисспептина в крови может в таком случае являться новым диагностическим маркером центральных форм ППР, позволяющими ускорить диагностику и раньше начать терапию, что впоследствии оптимизирует ростовой прогноз.
Все больше работ посвящено проблемам психологического состояния детей с ППР. Показано негативное влияние ранней активации гипоталамо-гипофизарно-гонадальной оси на психологическое состояние детей, а также изменение психики уже во взрослом состоянии. [Line Tremblay и соавт. 2005г, Baumann DA, Landolt MA, 2001г, Svend Erik Mouridsen, 1995г]. Активно дискутируется вопрос о необходимости психологической оценки как дополнительного критерия назначения или отмены терапии.
Таким образом, проблема преждевременного полового развития в настоящее время оставляет много вопросов, решение которых представляет большой теоретический и практический интерес.
Цель исследования
Оптимизировать схемы терапии аналогами люлиберина у детей с различными формами гонадотропинзависимого преждевременного полового развития.
Задачи
- Определить значимость исследования уровня кисспептина-54 сыворотки крови методом хроматографии для диагностики центральных форм ППР.
- Оценить эффективность терапии аналогами люлиберина в отношении конечного роста при разных вариантах гонадотропинзависимого преждевременного полового развития в зависимости от костного возраста перед началом лечения, сроков назначения и длительности лечения.
- Определить сроки возобновления гипофизарно-гонадотропной функции после отмены терапии.
- Изучить психологические особенности девочек с ППР.
Научная новизна
Впервые в России был исследован уровень кисспептина-54 в сыворотке крови у девочек с гонадотропинзависимым ППР. Показано отсутствие взаимосвязи концентрации данного нейропептида в крови с активацией пубертата.
Впервые проведено долгосрочное исследование терапии аналогами люлиберина различных нозологических форм гонадотропинзависимого ППР. Получены данные об успешном блокировании ЛГ-РГ пульсации на всем протяжении терапии аналогами люлиберина, а также об обратимости этого влияния. Показана эффективность терапии аналогами люлиберина в отношении конечного роста пациентов. Впервые в России доказана безопасность лечения аналогами люлиберина, в том числе отсутствие влияния на индекс массы тела.
Выявлено, что пациенты с гипоталамической гамартомой имеют наиболее прогрессирующее течение и неблагоприятный ростовой прогноз по сравнению с другими центральными формами ППР. Показано, что наиболее раннее начало терапии позволяет улучшить ростовой прогноз.
Впервые проведена оценка психологического статуса у девочек с гонадотропинзависимыми формами ППР. Результаты данного исследования выявили ряд психологических особенностей у девочек с преждевременным пубертатом таких, как недовольство своим телом, приписывание к себе более взрослого ролевого поведения, повышенный самоконтроль, что требует специализированной помощи психологов.
Научно-практическое значение
В работе показано отсутствие значимости определения кисспептина-54 в крови как маркера активации пубертата. Доказана необходимость ранней диагностики и начала терапии аналогами люлибенина в плане увеличения ростового прогноза у детей с гонадотропинзависимыми формами ППР. Показана эффективность и безопасность проводимого лечения. Доказана необходимость психологической помощи девочкам с центральными формами преждевременного полового развития.
Апробация работы
Результаты исследования: Основные материалы диссертации были доложены на Всероссийской конференции педиатров-эндокринологов «Достижения эндокринологии-здоровью детей» (Москва, июнь 2011г.), Европейском конгрессе детских эндокринологов (ESPE): «50 Annual Meeting of the European Society for Pediatric Endocrinology» (Глазго, сентябрь 2011г.), Пятой городской научно-практической конференции «Эндокринологические аспекты в педиатрии» (Москва, ноябрь 2011г.). Апробация защиты проведена на межотделенческой научной конференции ФГУ ЭНЦ Минздравсоцразвития РФ (Москва, ноябрь 2010г.).
Публикации
По материалам диссертации опубликовано 8 научных работ, 1 из них является практическим руководством для врачей и 2 статьи в журналах, рецензируемых ВАК РФ.
Объем и структура работы
Диссертация изложена на 114 страницах машинописного текста, состоит из введения, обзора литературы, описаний собственных исследований, заключения, выводов, практических рекомендаций, и указателя списка литературы, который содержит 9 отечественных и 106 зарубежных источников. Диссертация иллюстрирована 20 таблицами и 30 рисунками.
Содержание работы
Материалы исследования
Для решения поставленных задач нами была сформирована выборка, из 126 пациентов с гонадотропинзависимыми формами ППР.
109 пациентов с центральными формами ППР получали лечение аналогами люлиберина, 17 пациентов с центральными формами ППР не получали лечение в связи с поздней диагностикой и являлись группой контроля конечного роста.
Методы исследования
Клинический осмотр пациентов проводился по стандартной методике при поступлении, а также во время скрининговых визитов 1 раз в 12 мес.
Оценка физического развития проводилась на основании результатов антропометрических показателей – длины и массы тела. Рост пациентов измерялся с помощью механического стадиометра (Harpender stadiometer, Holtain Ltd, UK) с точностью до 0,1 см. Для оценки степени отклонения роста пациентов от среднего роста в популяции рассчитывался коэффициент стандартного отклонения SDS роста по следующей формуле: SDS = X – X’/SD, где Х – рост пациента, Х’ – средний рост для данного хронологического возраста и пола, SD – стандартное отклонение для данного хронологического возраста и пола. Для оценки отклонения скорости роста пациентки от средней скорости роста в популяции рассчитывался коэффициент стандартного отклонения SDS скорости роста по следующей формуле: SDS скорости роста = (Y – Y’) / SD, где Y – скорость роста за период между хронологическим возрастом 1 и хронологическим возрастом 2, Y’ – средняя скорость роста для данного пола и среднего хронологического возраста, SD – стандартное отклонение роста для данного пола и среднего хронологического возраста. Расчет целевого (генетического) роста проводился по формуле
Рост отца + рост матери ± 13 см
2
Расчет прогнозируемого конечного роста ребенка для оценки потенциально возможного роста проводился по таблицам Bayley N, Pinneau S (1982). Вес измерялся на напольных калиброванных весах в килограммах. Индекс массы тела рассчитывался по формуле: ИМТ = вес (кг)/рост (м). SDS веса и ИМТ рассчитывались как X – X’/SD, где Х – lg веса и ИМТ пациента, Х’ – lg среднего веса и ИМТ для данного хронологического возраста и пола, SD – lg стандартного отклонения веса и ИМТ для данного хронологического возраста и пола. При расчете SDS весоростовых показателей пациентов использовались популяционные данные, используемые в базе KIGS: SDS роста пациенток, родителей, SDS скорости роста – данные Tanner J, Whitehouse H (1966, 1976).
Степень прогрессирования костного возраста у пациентов оценивался при помощи соотношения костный возраст/хронологический возраст.
Кроме того, для оценки выраженности костной прогрессии определялся показатель SDS костного возраста относительно хронологического возраста по стандартной методике.
Оценка полового развития осуществлялась согласно классификации Tanner (1968).
Гормональные исследования проводились в лаборатории гормонального анализа ФГУ ЭНЦ (рук. – проф. Н.П. Гончаров). Образцы венозной крови забирались натощак в утренние часы. Определение концентрации эстрадиола, тестостерона, лютеинизирующего гормона и фолликулостимулирующего гормона проводилось при помощи автоматизированной системы “Vitrus” фирмы “Johnson and Johnson company” методом усиленной люминесценции.
Стимуляционный тест с аналогами люлиберина короткого действия проводился с препаратом Бусерелин интраназального введения (производитель - ЗАО Фарм-Синтез Россия, Москва). Забор венозной крови для определения ЛГ и ФСГ проводился в нулевой точке, а так же через 1 час и 4 часа после введения.
Исследование уровня кисспептина-54 проводились в лаборатории гормонального анализа ФГУ ЭНЦ (рук. – проф. Н.П. Гончаров) методом хроматографии с помощью набора Peninsula Laboratories, LLC, фирмы Bachem Group (США).
Рентгенография кистей с лучезапястными суставами осуществлялась в отделении рентгенологии ФГУ ЭНЦ (рук. – д.м.н. О.В. Ремизов) на аппарате Siemens Axiom Iconos R200 фирмы Siemens. Костный возраст пациентов определялся в соответствии с методикой, представленной в «Рентгенологическом атласе развития скелета руки и запястья». Greulich W, Pyle S, (второе издание, 1959г).
Магнитно-резонансная томография головного мозга проводилась в отделении МР-томографии ФГУ ЭНЦ (рук. – д.м.н. А.В. Воронцов) на томографе Magnetom Harmony фирмы Siemens (Германия) с напряженностью магнитного поля 1 Тесла.
Ультразвуковое исследование органов малого таза проводилось в отделении функциональной диагностики ФГУ ЭНЦ (рук. – к.м.н. Т.В. Солдатова) на ультразвуковых аппаратах Hewlett Packard Image Point (США), Toshiba Aplio XG-790 (Япония) с использованием конвексного трансабдоминального датчика с частотой 3,5МГц по общепринятой методике.
Терапия аналогами люлиберина. 109 пациентам после постановки диагноза была назначена терапия депо-аналогом люлиберина Трипторелин 3,75 мг (торговое название Диферелин, производитель- фирма Beaufour Ipsen International (Франция)) в дозировке 100 мкг/кг, кратностью введения 1 раз в 28 дней. 17 пациентов терапию не получали в связи с поздней диагностикой (закрытые зоны роста).
Оценка психологического статуса проводилась сотрудниками Института психологии, социологии и социальных отношений Московского городского педагогического университета (директор- д.п.с, профессор, академик Российской Академии социальных наук Е.С.Романова) к.п.н., доцентом Е.В. Свистуновой. и психологом, ассистентом кафедры Е.А.Мильке. при помощи методик, адекватных возрасту испытуемых и задачам исследования: «Возраст. Пол. Роль» (В.Юстицкис, Э.Г.Эйдемиллер); «Неоконченные предложения» (составлен и апробирован авторами исследования для определения телесной, именной, половой и возрастной идентичностей); «Методика исследования детского самосознания» (Н.Л.Белопольская); Опросник полоролевой идентичности для детей (В.Е.Каган); «Цветовой тест отношений» (Е.Ф.Бажин, А.М.Эткинд); «Определение эмоционального уровня самооценки» (А.В.Захаров); «Двойной рисунок человека» (модификация Е.В.Свистуновой). Для удобства дальнейшего анализа результатов, и возможности статистической обработки, полученные данные были переведены в стены (от 1 – низкий уровень выраженности признака, до 10 – высокий уровень выраженности признака)
Статистическая обработка полученных результатов производилась с помощью стандартных методов статистического анализа с использованием программного обеспечения для персонального компьютера: Microsoft Excel и Statistica 8.0. Количественные данные в группах проверялись на нормальность распределения с помощью теста Шапиро-Уилка, затем проверялась гипотеза о равенстве дисперсий с помощью теста Левена, при подтверждении истинности этих двух гипотез данные анализировались с помощью параметрических методов статистики, а в обратном случае использовались их непараметрические аналоги. В случае нормального распределения результаты представлялись как среднее значение ± SD, при необходимости указан минимум-максимум. При непараметрическом распределении данные представлялись как медиана, с указанием 25-75 перцентиля. Для проверки статистических гипотез при анализе количественных признаков с параметрическим распределением использовался Т-тест, в случае непараметрического распределения были использованы следующие критерии: критерий Вилкоксона для анализа различий данных для связанных групп; критерий Манна-Уитни для анализа различий данных для несвязанных групп; при множественных сравнениях применялся критерий Крускала-Уоллиса, а при выявлении отличий между группами, далее был использован метод множественных парных сравнений. Выявление меры линейной связи между параметрами проводилось с помощью коэффициента ранговой корреляции Спирмена. Различия принимались как статистически значимые при p<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Оценка значимости определения уровня кисспептина-54 методом хроматографии
Исследование уровня кисспептина-54 в сыворотке крови, проведено у 22 девочек (10 девочек с диагнозом Гонадотропинзависимое преждевременное половое развитие (ППР), 6 девочек с диагнозом Изолированное телархе (ИТ) и 6 здоровых девочек в допубертатном возрасте). Возраст девочек статистически не отличался во всех группах и составил: в группе с ППР 5,25 года [2,2-7,7], в группе ИТ 4,2 года [3,0-5,6], и в группе контроля 4,7 лет [3,2-6,0] (p>0,05). Всем детям был взят анализ крови для исследования уровня кисспептина до проведения стимуляционного теста с аналогами люлиберина и начала терапии.
В результате, уровень кисспептина-54 в группе детей с ППР составил 9,2 пмоль/л [8,95-9,2], в группе ИТ также 9,2 пмоль/л [8,6-9,2], а в группе контроля 9,0 пмоль/л [8,8-9,2] (p=1,0).
Таким образом, уровень кисспептина-54 периферической крови, определяемый методом хроматографии не отражает истинную концентрацию данного нейропептида в центральной нервной системе, и не может быть использован как диагностический маркер активации гипоталамо-гипофизарно-гонадальной системы.
Характеристика группы в зависимости от нозологической формы
Клинические характеристики
Группа детей с ППР, получавших лечение, была обозначена как группа 1 и включала в себя 4 нозологическе формы: идиопатическое ППР-45 детей (41 девочка и 4 мальчика), Гипоталамические Гамартомы-35 детей (24 девочки и 11 мальчиков), Глиальные опухоли-12 детей (7 девочек и 5 мальчиков) и Органические поражения ЦНС-17 детей (9 девочек и 8 мальчиков). Возраст появления первых симптомов заболевания отличался между собой в зависимости от диагноза (Рис.1).
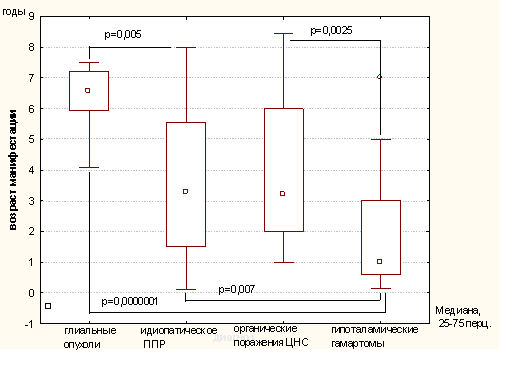
Рис. 1. Возраст манифестации заболевания при различных формах ППР
Пациенты с гипоталамическими гамартомами имели самый ранний среди всех групп возраст манифестации заболевания равный 1,8+/-1,62 года (от 0,15- до 7,0).
У пациентов с глиальными опухолями ЦНС, напротив, был выявлен наиболее поздний срок возникновения первых симптомов ППР
Возраст постановки диагноза во всех группах значимо отличался от сроков манифестации, и наиболее значимая разница отмечалась в группах с идиопатическим ППР и гипоталамической гамартомой (Табл.1).
Таблица 1. Различия между возрастом манифестации и постановкой диагноза
| Группа 1 | Возраст манифестации (годы, SD, min-max) | Возраст постановки диагноза (годы, SD, min-max) | p |
| Идиопатическое ППР | 3,59+/- 2,4 (0,1-8,0) | 5,17+/-2,39 (0,92-9,24) | p=0,0000001 |
| Гипоталамические гамартомы | 1,8+/-1,62 (0,15-7,0) | 3,68 +/- 2,13 (0,74-8,37) | p=0,000001 |
| Глиальные опухоли | 6,41+/-1,04 (4,08-7,5) | 7,52+/-1,17(5,19-10,46) | p=0,0022 |
| Органические поражения ЦНС | 4,23+/-2,5 (1,0-8,43) | 5,76+/-2,37(1,86-9,31) | p=0,0004 |
Антропометрические показатели на момент поступления
Во всех группах был проведен сравнительный анализ антропометрических показателей. Для оценки различия между группами по каждому параметру использовался метод Крушкал-Вэллиса. При выявлении отличий между группами, далее был использован метод множественных парных сравнений. Данные сведены в Таблице 2 с указанием медианы и 25-75 перцентиля.
SDS роста было наиболее высоким у группы с гипоталамическими гамартомами. (Табл. 2). SDS скорости роста отличался внутри групп и наиболее значимо между группами пациентов с глиальными опухолями и гамартомами (p=0,0036). При этом медиана SDS скорости роста в группе с глиальными опухолями также не выходила за пределы +2SD, что могло свидетельствовать о менее прогрессирующем течении.
Показатель SDS роста/костный возраст имел отрицательное значение у всех детей, а наиболее значимые отличия наблюдались между группами с глиальными опухолями и гамартомами.
Таблица 2. Антропометрические показатели у детей с различными вариантами гонадотропинзависимого ППР
| Показатель | Идиопатическое ППР (1) | Гамартомы (2) | Глиальные Опухоли (3) | Органическое поражение ЦНС (4) | p |
| Скорость роста (см/год) | 10,78 [8,6-15,81] | 15,25 [12,1-24,95] | 7,26 [3,95-7,3] | 12,39 [11,72-12,97] | р1-3=0,068 р2-3=0,00045 |
| SDS скорости роста | 3,65 [2,22-6,06] | 4,96 [3,77-6,09] | 1,57 [-2,5-2,32] | 3,93 [1,88-7,18] | р2-3=0,0036 |
| SDS роста/КВ | -1,69[-2,51-(-0,67)] | -2,68[-3,73-(-1,38)] | -1,38[-2,03-0,5] | -1,88[-2,73-(-0,88)] | р1-2=0,059 р2-3=0,049 |
| Конечный прогнозируемый рост (см) | 152,4[148,7-159,9] | 154,8[144,1-161,1] | 154,6[150,7-165,7] | 156,1[140,2-159,3] | p>0,05 |
| SDS конечного прогнозируемого роста | -1,6[-2,22-(-0,35)] | -1,68[-2,99 –(-1)] | -1,33 [-1,88-(-0,23)] | -1,27[-3,23-(-0,52)] | p>0,05 |
| КВ/ХВ | 1,61 [1,33-2,02] | 2,35 [1,84-3,05] | 1,49[1,35-1,52] | 1,58[1,43-1,99] | р1-2=0,000026 р2-3=0,000002 р2-4=0,0017 |
| SDSИМТ | 0,89[0,44-2,03] | 1,58[0,91-2,3] | 2,12[0,83-2,75] | 1,22[0,53-2,21] | p=0,05 |
| Целевой рост (см) | 165,2[160-171,5] | 167[161-170,5] | 165,7[161-173,2] | 172[165,5-176,5] | p>0,05 |
| SDS Целевого роста | 0,49[-0,33-1,5] | 0,54[-0,56-1,17] | 0,53[-0,17-0,7] | 0,58[-0,09-1,17] | p>0,05 |
Соотношение костного и хронологического возрастов имело наибольшую величину в группе с гипоталамическими гамартомами, значительно превосходившее все остальные нозологические формы, что свидетельствовало о более прогрессивном течении полового развития в данной когорте.
Конечный прогнозируемый рост, как и его SDS, статистически значимо не отличались между группами. При этом показатель конечного прогнозируемого роста не отличался от остальных в группе детей с гипоталамическими гамартомами, имевшей наибольшую прогрессию костного возраста, что объяснялось более высоким ростом и значимо меньшим хронологическим возрастом в данной группе. Показатели целевого роста были статистически значимо выше, чем конечный прогнозируемый рост до лечения, и не различались между группами, что свидетельствовало об однородности популяции.
Показатель SDS индекса массы тела был наибольшим в группе с глиальными опухолями, и достигал 2,12 SD [0,83-2,75]. При этом, медиана данного показателя не превышала нормативных значений в остальных нозологических группах.
Лабораторные и инструментальные данные
Базальные уровни ЛГ и ФСГ во всех подгруппах имели пре- и пубертатные значения, однако статистических различий между группами найдено не было. Стимулированный уровень ЛГ был наиболее высоким в группах с гипоталамическими гамартомами и при идиопатической форме и достигал соответственно 64,65 Ед/л [30,5-120] и 48,5[32,9-66,6].
При этом пиковый уровень ФСГ между группами не отличался. Уровни тестостерона, эстрадиола имели пубертатный уровень и не различались в зависимости от диагноза. Не было найдено выраженных отличий по объему яичников в зависимости от диагноза. При сравнительном анализе относительно длины матки также не было выявлено значимой разницы между группами (Табл.3)
Таблица 3. Лабораторные и инструментальные показатели нозологических форм
| Показатель | Идиопатическое ППР (1) | Гамартомы (2) | Глиальные опухоли (3) | Органичес-кие поражения ЦНС (4) | p |
| ЛГ базальный (Ед/л) | 2,15[1,4-3,8] | 2,55[1,6-4,1] | 2,9[1,7-4,3] | 2,0[1,5-3,2] | p>0,05 |
| ФСГ базальный (Ед/л) | 4,45[3,5-5,76] | 3,15[2,1-4,9] | 2,9[1,8-4,5] | 2,9[1,1-7,5] | p>0,05 |
| Пик ЛГ (Ед/л) | 48,5[32,9-66,6] | 64,65[30,5-120] | 19,5[16,05-48,4] | 34,0[30-45,5] | р2-3=0,0088 р2-4=0,048 |
| Пик ФСГ (Ед/л) | 22,5[15,5-29,3] | 30,0[12,2-46,0] | 16,65[6,0-22,1] | 19,0[12,2-24,0] | р2-3=0,05 |
| Эстрадиол (пмоль/л) | 121,5[78,05-163,5] | 197,8[116-232] | 136,0[80-140] | 196 [155,5-479,5] | p=0,06 |
| Тестостерон (нмоль/л) | 14,5[8,8-17,25] | 14,8[11,8-20,7] | 10,3[8,8-10,5] | 7,65[4,4-19,0] | p>0,05 |
| Объем тестикул (мл) | 13,5[10-17,5] | 15,0[10-19] | 11,0[10-17] | 10,0[7-15] | p>0,05 |
| Объем яичников (мл) | 2,69[1,68-3,62] | 2,42[1,5-3,46] | 4,13[2,36-5,49] | 3,89[2,47-5,26] | p>0,05 |
| Длина матки (см) | 3,35[3,0-4,0] | 3,5[3,2-3,9] | 3,8[3,6-4,2] | 4,2[3,8-4,4] | р1-4=0,05 |
Для оценки эффективности и безопасности лечения группа 1 была разделена на подгруппы в зависимости от приближения к конечному росту:
1А. Пациенты, получающие лечение до настоящего времени (n=76)
1B. Пациенты, закончившие лечение, но имеющие открытые зоны роста (n=19)
1С. Пациенты, закончившие терапию и имеющие закрытые зоны роста (конечный рост) (n=14)
Группа 1А (пациенты, получающие лечение до настоящего времени)
В данной группе у большинства детей преобладала идиопатическая форма ППР – 34 пациента (45%) и ППР при гипоталамической гамартоме – 24 пациента (32%). Средний возраст манифестации в данной группе составил 3,23+/- 2,55 года (от 1,0 до 5,56), возраст постановки диагноза 4,86 +/-2,51 года (от 0,74 до 10,46), а возраст начала терапии 4,89 +/-2,57 года (от 0,7 до 10,63). При этом между возрастом манифестации и возрастом постановки диагноза существовала статистически значимая разница (p=0,00001), так же как между возрастом манифестации и началом терапии (p=0,000001).
Длительность лечения в среднем составляла 2,38 +/-1,5 года (от 0,3 до 6,5 лет).
Антропометрические показатели группы 1А
У пациентов с ППР до лечения наблюдалось прогрессирующее увеличение темпов роста, а также опережение костного возраста относительно паспортного. В среднем SDS роста и скорости роста составили +2,76 (1,83-3,92) и +3,77(1,96-5,15) соответственно. Медиана скорости роста составила 11,5(8,4-18,18) см/год, что выше 95-й перцентили для здоровых сверстников. Антропометрические данные пациентов до и на фоне лечения представлены в таблице 4 в виде Медианы (25-75 перц.). (Таблица 4).
Таблица 4. Антропометрические показатели группы 1 А
| Показатель | Начало терапии (1) N= 74 | Через 1 год лечения (2) N=33 | Через 2 года лечения (3) N=11 | Более 2 лет терапии (4) N=10 | p |
| SDS роста | 2,76 [1,83-3,92] | 2,77 [2,39-3,36] | 2,57 [1,89-3,65] | 2,17 [1,83-3,3] | р1-3=0,012 р1-4=0,004 р2-3=0,027 р2-4=0,043 р3-4=0,043 |
| Скорость роста (см/год) | 11,5 [8,4-18,18] | 7,5 [4,73-9,41] | 6,89 [4,17-7,1] | 6,52 [5,53-8] | р1-2=0,0099 р1-3=0,027 р1-4=0,017 |
| SDS скорости роста | 3,77 [1,96-5,15] | -0,24 [-1,43-1,4] | -0,49 [-2,09-0,04] | -0,15 [-1,32-0,51] | р1-2=0,001 р1-3=0,043 р1-4=0,028 |
| SDS роста/КВ | -1,87 [-3,11- -0,84] | -1,37 [-2,36- -0,64] | -1,25 [-1,92- -0,8] | -0,33 [-1,78-0,54] | р1-2=0,01 р1-3=0,01 р1-4=0,012 |
| КВ/ХВ | 1,98 [1,44-2,23] | 1,66 [1,34-2,05] | 1,51 [1,34-1,63] | 1,34 [1,21-1,63] | р1-2=0,0008 р1-3=0,0044 р1-4=0,015 р2-3=0,03 |
| Конечный прогнози-руемый рост (см) | 148,7 [150,2-165,7] | 163,9 [151,5-172,3] | 160 [151,3-173] | 160 [157-170] | р1-2=0,014 р1-3=0,022 р1-4=0,03 |
| SDS конечного прогнозируемого роста | -1,34 [1,98- -0,23] | -0,69 [-2,39-0,44] | -0,34 [-2,24 -0,22] | 0,014 [-0,51-1,24] | р1-2=0,01 р1-3=0,028 р1-4=0,001 р2-3=0,05 р2-4=0,034 р3-4=0,043 |
| SDSИМТ | 1,09 [0,49-2,35] | 1,52 [0,67-2,37] | 1,64 [0,14-2,41] | 1,16 [0,34-1,7] | p>0,05 |
| Целевой рост (см) | 168 [160,5-173] |
Скорость роста на фоне 12 мес. терапии аналогами люлиберина составила 7,5 [4,73-9,41] см/год, что оказалось в 1,5 раза ниже скорости роста до лечения. На втором году терапии скорость роста снизилась до 6,89 [4,17-7,1] см/год, а после 2-х лет лечения составила 6,52 [5,53-8] см/год, что в 1,84 раза ниже, чем до начала терапии. Таким образом, статистически значимое снижение основных антропометрических показателей у детей с ППР, а также увеличение конечного прогнозируемого роста на фоне терапии аналогами люлиберина свидетельствует об эффективности терапии в отношении оптимизации ростового прогноза. SDS индекса массы тела, рассчитанный до лечения, через 1, 2 и более 2-х лет терапии статистически значимо не изменялся.
Лабораторные исследования группы 1А
Через 1 год лечения аналогами люлиберина, уровни гонадотропинов, а также эстрадиола и тестостерона статистически значимо снизились вплоть до допубертатных значений. Через 2 и более года не отмечалось статистически значимого повышение ЛГ, ФСГ и половых стероидов, что свидетельствовало об адекватном подавлении гипоталамо-гипофизарно-гонадальной оси и эффективности проводимой терапии.
Объем тестикул, до лечения равный 11,5 [8-18] мл в процессе лечения снижался, и через 2 года терапии достигал в среднем 8,0 мл [6-8]. Объем яичников уже через 1 год лечения приближался к допубертатным величинам. Так же отмечалось отсутствие роста матки, что свидетельствовало об эффективно проводимом лечении.
Таблица 5 Лабораторные показатели группы 1А
| Показатель | До терапии (1) N=72 | Через 1 год терапии (2) N=23 | Через 2 года терапии (3) N=12 | Более 2х лет лечения (4) N=11 | p |
| ЛГ Ед/л (базальный) | 2,1 [1,5-3,7] | 0,3 [0,2-0,9] | 0,5 [0,2-0,7] | 0,2 [0-0,2] | р1-2=0,00014 р1-3=0,017 р1-4=0,0001 |
| ФСГ Ед/л(базальный) | 4,2 [2,6-5,2] | 1,2 [1,1-1,8] | 1,3 [0,7-2,3] | 1,3 [1-1.8] | р1-2=0,000014 р1-3=0,012 р1-4=0,0017 |
| Пик ЛГ | 39,3 [24,4-63,37] | ||||
| Пик ФСГ | 21,3 [13,3-29,3] | ||||
| Эстрадиол (пмоль/л) | 129,8[81,3-204,9] | 41,1 [27,5-56] | 50,0 [43,7-57,35] | 38,4 [32,0-39,6] | р1-2=0,0015 р1-3=0,0011 р1-4=0,00001 |
| Тестостерон (нмоль/л) | 13,35 [8,8-19] N=14 | 0,25 [0,1-0,8] N=10 | 0,6 [0,5-0,8] N=10 | 0,7 [0,5-1,0] N=7 | р1-2=0,043 р1-3=0,043 р1-4=0,028 |
| Объем тестикул (мл) | 11,5 [8-18] N=14 | 10 [8-12] N=10 | 8,0 [6-8] N=10 | 9,0 [6,5-10] N=7 | р1-2=0,034 р1-3=0,025 р1-4=0,0012 |
| Объем яичников (мл) | 2,8 [1,6-4,2] | 1,35 [0,82-2,37] | 1,0 [0,94-1,07] | 1,86 [1,12-2,43] | р1-2=0,036 р1-3=0,0038 р1-4=0,017 |
| Длина матки (см) | 3,55 [3,2-4,0] | 3,2 [2,8-4,1] | 3,4 [2,8-3,75] | 3,0 [2,0-3,7] | р1-2=0,05 |
Таким образом, терапия аналогами люлиберина оказывает эффективное и стойкое влияние на подавление процесса полового созревания.
Группа 1В (пациенты, закончившие лечение, но имеющие открытые зоны роста)
В преобладающим большинстве, ППР в этой группе было вызвано гипоталамической гамартомой (42%), а также глиальными опухолями (26%), органическим поражением ЦНС (16%) и идиопатической формой (16%). При этом СТГ- дефицит был диагностирован у одной пациентки с астроцитомой, которая была исключена из группы при расчете антропометрических показателей. Возраст манифестации в данной выборке составил 4,23 +/-2,6 года (от 0,3 до 8), а возраст начала терапии 5,09 +/-2,1 года (от 2 до 7,9), что статистически значимо отличалось (p=0,0004). Продолжительность лечения составила 3,6+/-2,01 года (от 0,9 до 6,76), а возраст отмены 8,94+/- 1,69 года (от 5,0 до 12,4). Антропометрические и лабораторные показатели оценивались на момент начала и отмены лечения.
Антропометрические показатели группы 1В
Показатели темпов роста (SDS роста, скорость роста, SDS скорости роста) выражено снизились на момент отмены терапии (Табл.6). Соотношение костного и хронологического возраста, а также SDS роста/костный возраст до лечения и после отмены статистически значимо отличались, что свидетельствовало о торможении прогрессирования КВ и улучшению ростового прогноза. Конечный прогнозируемый рост на момент отмены в среднем был на 5,9 см выше, чем до лечения, однако не достигал целевого роста, равного 164,7 см [161-169,5], p=0,0069. SDS ИМТ не выходил за пределы +2 SD и статистически не отличался до и после проведенного лечения.
Таблица 6 Антропометрические показатели группы 1В
| Показатель | Начало терапии | Отмена терапии | p |
| SDS роста | 2,67 [1,06-3,75] | 1,75 [0,99-2,59] | p=0,0037 |
| Скорость роста | 12,57 [7,3-13,11] | 3,61[3,01-5,39] | p=0,040 |
| SDS скорости роста | 2,77 [1,57-10,2] | -2,15 [-3,0- (-0,47)] | p=0,043 |
| SDS роста/костный возраст | -2,52 [-2,98 – (-1,25)] | -1,18 [-1,6-0,92] | p=0,001 |
| КВ/ХВ | 1,67 [1,51-2,23] | 1,35 [1,24-1,52] | p=0,0069 |
| Конечный прогнозируемый рост | 151,0 [144,9-152,4] | 156,9 [150,8-157,0] | p=0,036 |
| SDS конечного прогнозируемого роста | -2,52 [-4,42 – (- 1,53)] | -1,46 [-2,34- (- 0,76)] | p=0,042 |
| SDSИМТ | 1,92 [0,9-2,41] | 1,54 [0,87-2,0] | p=0,26 |
| Целевой рост | 164,7 [161-169,5] |
Лабораторные исследования группы 1В
Базальные уровни ЛГ и ФСГ имели пубертатные значения до терапии, статистически значимо снижались через 1 год лечения, и возвращались к исходному пубертатному уровню через 12 мес после отмены лечения. (Рис. 2 а,б).
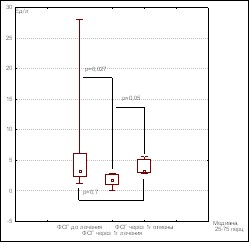
Рисунок 2 а Динамика уровня ЛГ Рисунок 2 б Динамика уровня ФСГ
Стимулированные уровни ЛГ и ФСГ определяемые на момент постановки диагноза в данной группе статистически различались. При этом пик ЛГ значимо превышал пик ФСГ (р=0,0058). Уровень эстрадиола, статистически значимо снижался после 1 года лечения, и возвращался к прежним пубертатным значениям через 1 год после отмены (p<0,05).
Длина матки, равная в среднем до лечения 3,8 [3,5-4,1] см, не увеличивалась в процессе терапии, а через год после отмены ее размер превосходил «дотерапевтический» уровень на 0,45 см. Объем яичников снижался до допубертатных значений в период терапии, а через год после отмены вновь достигал пубертатного уровня.
Эти данные позволяют утверждать, что терапия аналогами ЛГ-РГ является полностью обратимой в течение 12 месяцев.
Группа 1С (пациенты, закончившие терапию и имеющие закрытые зоны роста (конечный рост)).
Данная группа состояла из 14 пациентов (2 мальчика и 12 девочек), закончивших лечение и достигших конечного роста. Оценка показателей проводилась на момент начала терапии и при достижении конечного роста. Выборка была представлена пациентами с идиопатической формой ППР (50%), пациентами с гипоталамической гамартомой (21%) и органическими поражениями ЦНС (29%). Возраст манифестации заболевания в данной группе составил 3,25 +/- 1,6 года (от 1,12до 6,0), при этом терапия была начата спустя 1,75 года от проявления первых симптомов (возраст начала лечения 5,37 +/- 2,42 года (от 2 до 8,96), p=0,0014). Продолжительность лечения составила в среднем 3,65 +/- 2,36 года (от 0,89 до 7,82), а возраст отмены 9,03+/- 1,03 года ( от 6,5 до 10,3). На момент окончания лечения костный возраст составил 12,25 лет [12-13,75].
Антропометрические показатели группы 1С
Антропометрические показатели данной группы представлены в Таблице 7
Таблица 7 Антропометрические показатели группы 1С
| Показатель | Начало терапии | Отмена терапии | p |
| SDS роста | +2,91 SD[2,43-4,37] | +1,96 SD [1,89-2,03] | p=0,01 |
| Скорость роста | 11,06 см/год [9,1-12,6] | 5,51 см/год [4,92-6,1] | p=0,027 |
| SDS скорости роста | 3,38 SD [2,91-3,96] | -0,38 SD [-2,79-0,8] | p=0,028 |
| SDS роста/костный возраст | -1,49 [-2,61—0,65] | -0,3 [-0,3—0,29]. | p=0,016 |
| КВ/ХВ | 1,69 [1,56-2,31] | 1,24 [1,24-1,38] | p=0,043 |
| SDSИМТ | 1,21 [0,66-1,98] | 1,13 [0,87-1,28] | p=0,89 |
Темпы роста (SDS роста, скорость роста, SDS скорости роста) статистически значимо снизились до нормальных значений за 3 года терапии. Соотношение КВ/ХВ на момент отмены приблизилось к 1, что являлось следствием торможения прогрессии костного возраста. Показатель SDS роста\костный возраст вырос от -1,49 до -0,3 за период лечения, что свидетельствовало о более благоприятном ростовом прогнозе. SDSИМТ статистически не изменился от начала терапии и на момент ее завершения.
При проведении корреляционной взаимосвязи не было найдено различий между конечным ростом и возрастом начала терапии и длительностью лечения.
Гормональные показатели группы 1С
В процессе терапии у всех детей группы 1С прогрессирование половых признаков приостановилось, а менструации прекратились у всех девочек.
Возобновление менструаций у девочек произошло в среднем через 16,16 мес. [12-24] после отмены лечения (n=9). При этом у 3 из 9 девочек наблюдался нерегулярный менструальный цикл, спустя 2 и более года от менархе.
Группа 2 ( группа контроля)
Данная группа состояла из 17 пациентов (14 девочек и 3 мальчика) не получавших лечение и достигнувших в процессе наблюдения конечного роста. Возраст манифестации в данной группе составил 4,65 года +/-2,18, а возраст поступления в стационар 7,6 лет +/-2,17, что статистически значимо отличалось (p=0,00041). Половое развитие девочек на момент диагностики в основном соответствовало стадии 3 по Таннеру (54%). Менструации присутствовали у 13 из 14 девочек. Возраст менархе составил 4,34 года +/- 2,24г. У мальчиков половое развитие соответствовало стадии 4 (у двух мальчиков) и стадии 3 (у одного).
Антропометрические и гормональные показатели группы 2
В Таблице 8 представлены основные антропометрические и гормональные показатели группы 2 на момент поступления в стационар
Таблица 8 Антропометрические и гормональные показатели группы 2
| Показатель | Значение |
| SDS роста | 1,78 [1-1,95] |
| SDS скорости роста | 0,3[-0,81-3,0] |
| КВ | 14,7 [13-16] |
| КВ/ХВ | 1,88[1,54-1,96] |
| Целевой рост (см) | 163,0 [159-166,2] |
| Конечный рост (см) | 146,2 [141-152]. |
| SDS ИМТ | 1,28[0,31-1,94] |
| Пик ЛГ(Ед/л) | 24,5 [21,7-34,6] |
| Пик ФСГ(Ед/л) | 15,3 [12,8-19,4] |
| Эстрадиол (пмоль/л) | 51,0 [34-175] |
| Тестостерон (нмоль/л) | 12 [6-14] |
| Объем яичников (мл) | 2,59[1,76-4,1] |
| Длина матки (см) | 4,05 [3,65-4,6] |
| Объем яичек (мл) | 20 [15-25] |
Сравнение конечного роста группы 1С и 2.
Конечный рост пациентов группы 1С достиг 156,0 см [152,8-164], что было выше на 10 см, чем конечный рост группы 2, равный 146,2 см[141-152].
( p=0,0002) (Рис 3).
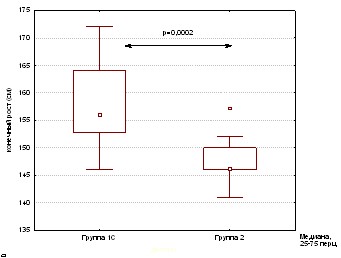
Рисунок 3. Сравнения конечного роста в группе 1С и 2
При этом целевой рост группы 1С: (166,5 см [163,7-172,0]) и целевой рост группы 2 (163,0 [159-166,2]) статистически не отличались (p=0,12), что свидетельствовало об отсутствии генетических факторов влияющих на различие в достигнутом конечном росте.
Однако, несмотря на проводимую терапию, конечный рост в группе 1С не достигал значений целевого роста (p=0,017) (Рис.4). Возможно, это было связано с несвоевременным началом терапии, так как имелась статистическая разница между возрастом манифестации и началом лечения.
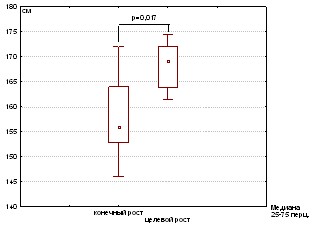
Рисунок. 4 Соотношение конечного и целевого роста в группе 1С
Оценка эффективности лечения в зависимости от нозологической формы проводилась в группах с идиопатическим ППР и гипоталамической гамартомой. Группы с глиальными опухолями была исключена из сравнения в связи с наличием СТГ-дефицита у половины пациентов. Группа с органическими поражениями ЦНС была также исключена из сравнения в связи с малочисленностью.
Сравнительная характеристика антропометрических и лабораторных показателей группы идиопатического ППР и ППР при гипоталамической гамартоме на фоне терапии.
Как было указано выше, группа пациентов с гипоталамической гамартомой отличалась наиболее ранним возрастом манифестации заболевания, а также быстро прогрессирующим течением. По локализации гипоталамических гамартом с наибольшей частотой встречался инфра-гипоталамический (педункулярный) тип - 66,% а наиболее редким был интрагипоталамический (сесильный) тип-11%.
Возраст начала терапии в группе с гипоталамической гамартомой был ниже, чем у детей с идиопатическим ППР (3,66+/-2,02 года (от 0,7 до 8,7л) и 5,32+/-2,39 года (от 0,94 до 9,2) соответственно), что статистически отличалось (p=0,0052). Количество пациентов закончивших лечение в каждой группе было равно 9-ти. При этом возраст отмены в обеих группах статистически не отличался и составил: в группе с идиопатическим ППР-9,28+/-0,77 года (от 7,9 до 10,36) а в группе с гипоталамической гамартомой 8,76+/-1,62 года (от 5 до 10,3)(p=0,75).
Через год после начала лечения SDS роста в группе с идиопатической формой составил 3,04 [2,48-3,95], а в группе с гипоталамической гамартомой 4,3 [2,84-4,9], что статистически не отличалось от показателей на момент начала терапии (p=0,17 и 0,71 соответственно). При сравнении данного показателя между группами через год лечения статистически значимая разница между ними сохранялась (SDS скорости роста через год терапии значительно снизился как в группе с идиопатической формой (p=0,012), так и в группе с гипоталамической гамартомой (p=0,039)). Различий в SDS скорости роста между группами через год лечения выявлено не было (p=0,13).
Показатель КВ/ХВ, через год лечения составил в группе с идиопатической формой 1,51 [1,33-1,9], что было значительно меньше, чем на момент начала терапии (p=0,00012). В группе с гипоталамической гамартомой, показатель КВ/ХВ составил 1,77[1,6-2,74], что так же выражено отличалось от первоначального показателя (p=0,039). При сравнении КВ/ХВ между группами, была получена статистическая разница (p=0,016).
Коэффициент SDS роста/костный возраст возрастал на протяжении первого года лечения в обеих группах, что свидетельствовало об улучшении ростового прогноза. В группе с идиопатической формой этот показатель составил -0,04 [-1,09-1,37] (p=0,032), а в группе с гипоталамической гамартомой -2,64 [-2,78- -1,2] (p=0,05).Однако, при сравнении между группами, через год лечения статистическая разница сохранялась (р=0,035).
При проведении корреляционного анализа, было выявлено, что имелась отрицательная корреляция между SDSроста/костный возраст в момент окончания лечения и возрастом начала терапии в группе с гипоталамической гамартомой (R=-0,49, p=0,05), при этом подобной корреляционной связи в группе с идиопатической формой выявлено не было (R=-0,2, p=0,17). Наличие данной связи в группе гипоталамической гамартомой, может быть связано с более продолжительным периодом терапии, чем в группе с идиопатической формой, таким образом, более раннее начало лечения у детей с гипоталамической гамартомой, может улучшать их ростовой прогноз, несмотря на более злокачественное течение.
Медиана SDS ИМТ не выходила за пределы +2 SD как на момент диагностики, так и через год терапии (p>0,05), и не отличалась в двух группах (p>0,05).
После двух лет лечения статистически значимых различий в показателях SDS роста между группами не отмечалось. (p=0,12). SDS скорости роста снижалось в течение первых двух лет терапии в обеих группах, достигнув через 4-6 лет отрицательных значений (идиопатическое ППР:-1,52 SD[-2,79- -0,6], гамартомы: -1,33 SD[-3,14-0,8] p=0,73). Соотношение КВ/ХВ, через 2 года лечения, как и в последующий период наблюдения не отличался между группами (КВ/ХВ через 4 года гипоталамические гамартомы=1,3 [1,23-1,48], идиопатическая форма 1,34 [1,21-1,4] (p=0,8).
SDSроста/костный возраст возрастал на протяжении терапии, что свидетельствовало об улучшении ростового прогноза. Различия между группами сохранялись в течение 2-х лет терапии, и нивелировались на третьем году лечения. (SDSроста/костный возраст через 3 года лечения в группе гипоталамические гамартомы составил -1,1 [-1,44- -0,3], а в группе идиопатической формы- -1,13 [-2,04-0,37] (p=0,92).
Десять девочек в процессе исследования достигли конечного роста который составил 155,6 см [150-156] (n=6) в группе с идиопатическим ППР и 161,5 см [157,8-167,4] (n=4) в группе с гипоталамической гамартомой (p=0,088). Отсутствие статистически значимой разницы в конечном росте между данными группами объясняется более ранним началом лечения в группе детей с гипоталамической гамартомой.
Мы не нашли различий в целевом росте между группами, что говорит об отсутствии специфических генетических факторов, влияющих на конечный рост при данных формах заболевания. При достижении конечного роста SDS ИМТ также был статистически идентичным в двух группах (p=0,65).
Оценка половой функции через год после отмены лечения аналогами люлиберина.
Всего восемнадцать пациентов (по девять пациенток из каждой группы) завершили лечение в течение периода исследования. Причиной отмены терапии у всех пациентов послужило достижение хронологического возраста, близкого к среднему возрасту нормального пуберата, а также снижение SDS скорости роста до равного или меньшего -2SD. Возраст отмены терапии в обеих группах статистически не отличался и составил в группе с идиопатическим ППР 9,3 года [8,7-9,86], а в группе с гипоталамической гамартомой 8,9 лет [8,0-9,95] (p=0,75).
Спустя 1 год после отмены терапии обследование проведено шести девочкам (три из группы с гипоталамической гамартомой и три – из группы с идиопатическим ППР). Уровни ЛГ, ФСГ, эстрадиола у этих пациенток вновь поднялись до пубертатных значений, также увеличились размеры матки и придатков. Статистически значимой разницы между группами по данным показателям выявлено не было. У 3-х девочек с идиопатическим ППР менструации возобновились через 12 мес. [1-18], у 3-х девочек с гипоталамической гамартомой также через 12 мес [7,5-12,5].
Таким образом, у пациентов с гипоталамической гамартомой, несмотря на более прогрессирующее течение полового развития и высокую скорость роста, не было выявлено различий в отношении конечного роста. После отмены лечения аналогами люлиберина произошло восстановления работы гипоталамо-гипофизарно-гонадальной оси в течение одного года в обеих группах.
Оценка психологического статуса детей с ППР
В исследовании приняли участие 36 девочек в возрасте от 5 до 11 лет с диагнозом ППР, а так же 6 девочек с диагнозом Изолированное телархе
Характеристика основной группы (n=36)
Таблица 9 Характеристика исследуемой группы
| Возраст манифестации | 3,0 [1,0-5,5] |
| Возраст постановки диагноза | 5,6 [3,34-7,19] |
| Количество детей с менструациями | 14 |
| Возраст Менархе | 2,93 [1,1-4,78] |
| Количество менструальных циклов | 3,2+/-3,83(1-10) |
| Костный возраст при постановке диагноза | 9,5[7,12-12,0] |
| Возраст начала лечения | 5,05[3,0-7,0] |
| Возраст осмотра психологами | 7,8 [5,6-9,1] |
| Костный возраст при осмотре психологами | 11,6 [8,5-12,75] |
У девочек с ППР, принимавших участие в исследовании, не наблюдалось задержки умственного развития. Интеллект либо соответствовал возрасту ребенка (то есть, отставал от внешнего вида), либо опережал реальный возраст. Они отличались подчеркнутой взрослостью поведения и серьезностью высказываний.
Со слов родителей, такие особенности начали проявляться достаточно рано, еще на 1-3 году жизни: девочки мало играли со сверстниками, тянулись к старшим детям или предпочитали компанию взрослых людей, отличались «взрослостью» суждений.
Личностная идентичность.
Личностная идентичность понимается как самотождественность самому себе во времени и в пространстве и через отношение к значимому социальному окружению. Результаты изучения личностной идентичности через самоотношение, отношение к значимым окружающим и адекватность восприятия образов мужчины и женщины представлены в таблице 10.
Таблица 10 Принятие себя и людей из ближайшего окружения девочками с ППР
| Самоотношение M ± sd | Отношение к матери M ± sd | Отношение к отцу M ± sd | Отношение к сверстнику M ± sd | Отношение к женщине M ± sd | Отношение к мужчине M ± sd | |
| Девочки с ППР | 9,6± 0,39 | 9,4 ± 0,23* | 7,2 ± 0,68 | 5,6 ± 0,21* | 9,3± 0,59* | 6,2± 0,94 |
| Контрольная группа | 8,9 ± 0,55 | 8,1 ± 0,49 | 7,0 ± 0,99 | 8,3 ± 0,34 | 8,1 ± 0,48 | 6,7 ± 0,31 |
* Данные достоверно отличаются (p0,05)
Самоотношение девочек с ППР количественно не отличалось от самоотношения сверстниц. В этом возрасте дети обычно показывают высокий уровень самоуважения и принятия себя. По тесту «Незаконченные предложения» были обнаружены некоторые качественные различия. Девочек с ППР отличал высокий уровень самоконтроля склонность к самоанализу и рефлексии. Для девочек с ППР характерен высокий уровень самопринятия и самооценки. В отличие от сверстников, он оказался более устойчивым, касался не только состояния «здесь и сейчас», но и распространялся на будущее. Девочки чаще, чем сверстники идентифицировали себя с «Матерью» и «Женщиной», показывали высокий уровень принятия этих образов. Отношение к образу «Мужчины» у девочек с ППР качественно отличалось от оценок сверстниц и характеризовалось полярностью высказываний, кокетством и явным интересом к противоположному полу. Принятие сверстников у девочек с ППР заметно ниже, чем у девочек с нормативным развитием. Это связано с двумя факторами: неприятием сверстниками физически сильных и внешне значительно отличающихся девочек и рано появившимся у них самих интересом к старшим детям.
Вторым этапом работы было изучение идентификаций, которые не выбираются индивидом, а даются ему a priori. Отношение к телу, возрасту, полу - этим, независящим от него, характеристикам определяют отношение к своему «Я». Результаты изучения половой, возрастной, телесной идентичности представлены в таблице 11.
Таблица 11. Отношение к своему полу, возрасту и телу девочек с ППР
| Половая идентичность M ± sd | Возрастная идентичность M ± sd | Телесная идентичность M ± sd | |
| Девочки с ППР | 9,2 ± 0,64 | 3,5 ± 0,43* | 7,6 ± 0,28 |
| Контрольная группа | 9,1 ± 0,35 | 9,0 ± 0,75 | 8,3 ± 0,69 |
* Данные достоверно отличаются (p0,05)
Количественные показатели половой идентичности девочек с ППР достоверно не отличались от показателей девочек с нормативным половым развитием. Все испытуемые хорошо дифференцировали признаки маскулинности и феминности и в рисунках, и в опросниках. Девочки с ППР достоверно чаще проявляли недовольство своим телом, чем дети из контрольной группы. В их ответах также имелись качественные различия. Девочки с ППР хотели уменьшить рост, изменить грудь («чтобы маленькая совсем была»), а девочки из контрольной группы мечтали отрастить длинные волосы, похудеть. Существенные отличия между девочками с ППР и контрольной группы коснулись возрастной идентичности. Достоверно чаще девочки с ППР дошкольного возраста идентифицируют себя с возрастом 8-12 лет, а девочки с ППР школьного возраста «перескакивают» через возрастную группу, идентифицируя себя с девушками 14-17 лет. Возрастная идентификация соответствует не реальному, а костному возрасту девочек. Качественные отличия ответов девочек с ППР от сверстников заключались в приписывании себе более взрослого ролевого поведения.
Выводы
- Гонадотропинзависимые формы ППР обусловлены в 32,1% гипоталамическими гамартомами, в 15,6% органическими поражениями ЦНС, в 11 % глиальными опухолями и в 41,3% являются идиопатическими.
- Лечение аналогами люлиберина адекватно подавляет активацию гипоталамо-гипофизарно-гонадной оси, что сопровождается снижением скорости роста, полового развития и прогрессирования костного возраста. Это приводит к увеличению конечного роста на 10 см, по сравнению с не получавшими лечение пациентами.
- Терапия аналогами люлиберина вызывает торможение гипоталамо-гипофизарно-гонадной оси только в период лечения, после отмены которого система активируется полностью через 12 мес., а менструальный цикл восстанавливается через 16 [12-24] мес.
- Пациенты с гипоталамической гамартомой имеют наиболее раннее начало заболевания, более прогрессирующее течение и наиболее неблагоприятный ростовой прогноз по сравнению с другими формами гонадотропинзависимого ППР.
- Уровень кисспептина-54 сыворотки крови определяемый методом хроматографии не отражает степень активации гипоталамо-гипофизарной системы, и не может быть использован как диагностический маркер.
- Лечение аналогами люлиберина является безопасным, так как серьезных побочных эффектов не было отмечено на протяжении всей терапии.
- Психологическими особенностями девочек с ППР являются: высокий уровень самоконтроля, склонность к рефлексии, низкое принятие сверстниками, недовольство своим телом, приписывание себе более взрослого ролевого поведения.
Практические рекомендации
- Поздняя диагностика ППР и, следовательно, несвоевременное лечение, приводящее к отставанию конечного роста более чем на 10 см, диктует необходимость распространения знаний по этому вопросу среди педиатров.
- Всем детям с гонадотропинзависимым ППР необходимо назначать терапию аналогами люлиберина в как можно более ранние сроки.
- Детям и с ППР и их родителям необходимо наблюдение у психолога для улучшения социальной адаптации.
Публикации по теме диссертации
- Болмасова А.В., Карева М.А. Современные методы диагностики и лечения гонадотропинзависимых форм преждевременного полового развития. //Репродуктивное здоровье детей и подростков 2011г. №1 с. 74-81.
- Карева М.А., Болмасова А.В., Орлова Е.М. Преждевременное половое развитие. Руководство для врачей. Москва 2011г.
- Болмасова А.В., Карева М.А., Орлова Е.М. Особенности течения, диагностики и терапии детей с преждевременным половым развитием при гипоталамической гамартоме и идиопатической форме.// Проблемы эндокринологии» – 2012 - №1 – т. 58– принято в печать.
- Болмасова А.В., Орлова Е. М. Гонадотропинзависимое преждевременное половое развитие: диагностика и лечение. // Доктор.ру №6 (50) 2009г. с. 43-45.
- Свистунова Е.В., Ковалева А.В. Особенности становления идентичности у девочек с преждевременным половым развитием// Материалы IV международного конгресса «Молодое поколение 21 века: актуальные проблемы социально-психологического здоровья». Киров 2009г, с. 121-122.
- Болмасова А.В., Орлова Е.М., Петеркова В.А. Гонадотропинзависимое преждевременное половое развитие у мальчика с синдромом МакКьюна-Олбрайта-Брайцева. // Сборинк Всероссийского конгресса «Современные технологии в эндокринологии». Москва 2009г, с. 259-260
- Bolmasova А., Kareva М, Orlova Е, Peterkova V. The efficacy of gonadotropin-releasing analogues in children with central precocious puberty. //J. Hormone Research in paediatrics-2011.- Vol 76 (suppl 2).-P.311. (abstract from 50 Annual Meeting of the European for Paediatric Endocrinology, Glasgow 25-28 Sept. 2011).
- Карева М.А., Болмасова А.В. Показания и противопоказания к назначению и прекращению терапии аналогами гонадотропин-релизинг гормона в детском возрасте. // Материалы V городской научно-практической конференции «Эндокринологические аспекты в педиатрии» Москва, 23-24 ноября 2011г., с. 23.
Список условных сокращений
ППР преждевременное половое развитие
ЛГ-РГ лютеинизирующий гормон - релизинг гормон
ФСГ фолликулостимулирующий гормон
ЛГ лютеинезирующий гормон
ЦНС центральная нервная система
КВ костный возраст
ХВ хронологический возраст
ИМТ индекс массы тела

