Кислородный статус и оксидантный стресс в остром периоде ишемического инсульта в каротидной системе
На правах рукописи
БОДЫХОВ Михаил Константинович
КИСЛОРОДНЫЙ СТАТУС И ОКСИДАНТНЫЙ СТРЕСС В ОСТРОМ ПЕРИОДЕ ИШЕМИЧЕСКОГО ИНСУЛЬТА В КАРОТИДНОЙ СИСТЕМЕ
14.00.13 – нервные болезни
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2006
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский Государственный Медицинский Университет Федерального агентства по здравоохранению и социальному развитию».
Научный руководитель:
член-корреспондент РАМН,
доктор медицинских наук, профессор Вероника Игоревна Скворцова
Научный консультант:
кандидат физико-математических наук,
директор НИИ цитохимии и
молекулярной фармакологии Ярослав Рюрикович Нарциссов
Официальные оппоненты:
доктор медицинских наук, профессор Софья Алексеевна Румянцева
доктор медицинских наук, профессор Марина Юрьевна Максимова
Ведущее учреждение:
Московский областной научно-исследовательский клинический институт
им. М.Ф. Владимирского
Защита состоится 30 января 2007 года в 14.00 часов на заседании диссертационного совета К 208.072.01 в ГОУ ВПО «Российский Государственный Медицинский Университет Федерального агентства по здравоохранению и социальному развитию» (117997, г. Москва, ул. Островитянова, д.1).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава
(г. Москва, ул. Островитянова, д.1).
Автореферат разослан «18»декабря 2006года.
Ученый секретарь
диссертационного совета
кандидат медицинских наук, доцент Леонид Васильевич Губский
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Проблема церебрального ишемического инсульта является одной из наиболее актуальных проблем современной медицины в связи с высокой частотой развития заболевания, большим процентом инвалидизации и смертности (Е.И. Гусев, В.И. Скворцова, 2001).
Исследования, проведенные в последние десятилетия ХХ века, показали стадийность развития ишемического повреждения мозга при инсульте. В связи с этим была сформирована концепция «терапевтического окна», созданы блоки интенсивной терапии и отделения нейрореанимации для больных с инсультом. Таким образом, произошло внедрение методов реаниматологии и интенсивной терапии в сосудистую неврологию.
Ключевым звеном любого ишемического повреждения является гипоксия. В связи с этим оксигенотерапия может быть обоснованным методом лечения при ишемических поражениях головного мозга (С.В. Царенко, 2005). Однако в условиях гипоксического повреждения клетка не всегда в состоянии утилизировать кислород в дыхательной цепи митохондрий в результате развития биоэнергитической гипоксии (Л.Д. Лукьянова, 1997). В связи с этим оксидантный стресс (ОС), развившийся в условиях гипоксии, может усиливаться, приводя к новой волне клеточной деструкции (В.А. Неговский и соавт., 1988; А.И. Федин, С.А. Румянцева, 2002).
Таким образом, в патогенезе ишемического инсульта лежит не только циркуляторная, но и цитотоксическая (биоэнергетическая) гипоксия, приводящая к патологическому пути утилизации кислорода – образованию его активных форм. В связи с этим дальнейшее изучение ОС и кислородного статуса, у больных с острым церебральным инсультом, по-прежнему занимает ведущее место в клинической неврологии.
Цель исследования
Изучение влияния газообмена и оксидантного стресса в остром периоде ишемического инсульта на течение и исход заболевания.
Задачи исследования:
- Изучить показатели газового состава артериальной крови в остром периоде каротидного ишемического инсульта.
- Определить активность ферментов антиоксидантной системы, концентрацию восстановленного глутатиона и вторичных продуктов перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой, а также активность митохондриальных ферментов и щелочной фосфатазы в периферической крови у больных в остром периоде ишемического инсульта в каротидной системе.
- Выявить показатели газового состава артериальной крови, влияющие на активность оксидантной и антиоксидантной систем, течение и исход инсульта.
- Оценить эффективность влияния антигипоксанта-антиоксиданта мексидола в остром периоде каротидного ишемического инсульта на параметры оксидантной и антиоксидантной систем, тяжесть и исход заболевания.
Научная новизна
Впервые у больных в остром периоде ишемического инсульта в каротидной системе проведена оценка газового состава артериальной крови параллельно с комплексным клиническим, нейрофизиологическим, биохимическим, цитохимическим исследованием.
Выявлен гипервентиляционный синдром, развивающийся в первые сутки ишемического инсульта и приводящий к развитию относительной гипероксии. У больных с ишемическим инсультом в остром периоде установлена стадийность развития биоэнергетической гипоксии, начиная с первых суток инсульта. Выявлены зависимости между функциональным состоянием головного мозга (по данным ЭЭГ), тяжестью инсульта, активностью основных ферментов антиоксидантной системы и содержанием вторичных продуктов перекисного окисления липидов, а также между показателями кислородного статуса артериальной крови, активностью основных ферментов антиоксидантной системы и содержанием вторичных продуктов перекисного окисления липидов.
Проведенное двойное слепое плацебо-контролируемое исследование антигипоксанта-антиоксиданта мексидола впервые показало безопасность, эффективность и патогенетическую обоснованность применения этого препарата в остром периоде ишемического инсульта.
Практическое значение работы
Полученные результаты обосновывают выбор патогенетической терапии у больных с ишемическим инсультом в каротидной системе атеротротромботического или кардиоэмболического типов.
Доказана вредность рутинного назначения оксигенотерапии в остром периоде ишемического инсульта, не осложненного нарушениями функций внешнего дыхания и газотранспортной функцией крови.
В остром периоде ишемического инсульта показана безопасность и эффективность применения мексидола в дозе 300 мг в сутки, с целью оптимизации процессов клеточного дыхания и повышения активности антиоксидантной системы (АОС).
Внедрение в практику
Результаты работы внедрены в клиническую практику блока интенсивной терапии ГКБ №20, отделения нейрореанимации для больных с инсультом ГКБ №31 г. Москвы и учебную программу студентов и ординаторов кафедры фундаментальной и клинической неврологии Российского Государственного Медицинского Университета.
Апробация работы
Официальная апробация работы состоялась 13 декабря 2005 года на совместной конференции Кафедры фундаментальной и клинической неврологии и НИИ Инсульта РГМУ. Основные положения и результаты исследования доложены на IX Всероссийском съезде неврологов, Ярославль, 2006 г. (стендовый доклад); Конгрессе «Человек и лекарство», Москва, 2006 г. (I премия в конкурсе на лучшую научную и научно-практическую работу по применению препарата мексидол в клинической практике в номинации «молодой ученый»).
Публикации
По теме диссертации опубликовано 6 научных работ.
Объем и структура диссертации
Работа изложена на 163 страницах. Диссертация состоит из введения, обзора литературы, описания общей характеристики больных и методов исследования, собственных результатов и их обсуждения, выводов, практических рекомендаций, списка цитируемой литературы, включающего 96 отечественных и 40 зарубежных источников. Работа иллюстрирована 18 таблицами, 32 рисунками, 1 текстовым приложением, 2 клиническими наблюдениями.
СОДЕРЖАНИЕ РАБОТЫ
Общая характеристика больных и методов исследования
Общая характеристика больных
В основу работы положены результаты обследования 61 больного с ишемическим инсультом в каротидной системе в возрасте от 45 до 85 лет (средний возраст – 69,4±9,8 лет); 25 мужчин, 36 женщин. Критериями включения в исследование являлись: клиническая картина первого в жизни ишемического инсульта в каротидной системе атеротромботического или кардиоэмболического генеза по критериям TOAST (Trial of Org 10172 in Acute Stroke Treatment), поступление в клинику в течение 24 часов от момента развития заболевания. Из исследования исключали больных с полным регрессом неврологической симптоматики в течение первых 24 часов от начала развития заболевания; пациентов с лакунарным инсультом (по критериям TOAST); больных с острым инфарктом миокарда, выраженной сердечной, печеночной или почечной недостаточностью; другими заболеваниями, сопровождающимися грубыми нарушениями системной гемодинамики и метаболизма.
На основании анализа неврологического статуса все больные были разделены на две группы. Группу больных с инсультом средней тяжести (балл по шкале NIH < 14) составили 35 человек, среднее значение по шкале NIH 8,2±3,14 баллов. Группу больных с тяжелым инсультом (балл по шкале NIH 14) составили 26 человек, среднее значение по шкале NIH 18,2±3,14 баллов (табл. 1).
Таблица 1. Распределение обследованных больных по полу, возрасту, локализации очага поражения
| Характеристики | Состояние средней тяжести | Тяжелое состояние | Группа I «мексидол» | Группа II «плацебо» | |
| Количество больных | 35 | 26 | 24 | 27 | |
| Средний возраст | 68,5±9,6 | 70,7±10,1 | 65,8±9,6 | 73,0±8,9 | |
| < 60 лет | 8 | 3 | 2 | 3 | |
| 60-80 лет | 22 | 19 | 18 | 13 | |
| > 80 лет | 5 | 4 | 4 | 4 | |
| Пол | мужской женский | 14 | 11 | 13 | 8 |
| 21 | 15 | 11 | 19 | ||
| Локализа-ция очага | правое полушарие левое полушарие | 15 | 17 | 11 | 14 |
| 20 | 18 | 13 | 17 | ||
| Тип инсульта | атеротромботический кардиоэмболический | 13 | 12 | 10 | 14 |
| 22 | 14 | 14 | 13 | ||
Всем пациентам проводили максимально унифицированную базисную терапию в соответствии с рекомендациями Европейской Инициативной Группы по проблеме Инсульта (EUSI, 2003). Учитывая эффективность глицина, доказанную в ходе рандомизированного двойного слепого плацебо-контролируемое исследования (В.И. Скворцова, 1999), всем пациентам, в остром периоде заболевания, назначали этот нейропротектор в дозе 1г 1 раз в сутки сублингвально.
Методом простой рандомизации и вслепую все пациенты разделялись на две группы (табл. 1). Пациентам первой группы (25 человек) в качестве препарата антиоксидантной направленности применяли отечественный препарат мексидол в дозе 300 мг в сутки: в первые трое суток внутривенно, капельно на 200,0 физиологического раствора NaCl, далее по 100 мг (2,0, 5% раствора) внутимышечно, 3 раза в сутки, до 14 суток от начала заболевания. Пациентам второй группы (27 человек) на фоне проведения базисной терапии по вышеописанной схеме вводили плацебо. По возрасту, полу, фоновым заболеваниям, локализации очага поражения мозга и патогенетическому типу инсульта достоверных различий между указанными группами не отмечалось.
В группу контроля было включено 27 практически здоровых добровольцев, не переносивших инсультов или транзиторных ишемических атак.
Методы исследования
Клинические методы
Всем больным проводили исследования соматического и неврологического статуса по общепринятым методикам в первые сутки заболевания (при поступлении), на 3-и, 7-е, 14-е и 21-е сутки от начала инсульта. Для объективизации тяжести состояния, выраженности очагового неврологического дефицита и оценки динамики клинических показателей использовалась балльная шкала NIH (H. Adams, J. Biller, 1989), степень функционального восстановления определялась на 21-е сутки инсульта с помощью индекса Бартел (D. Barthel, 1965).
Ишемический характер инсульта был установлен по данным анамнеза, клинической картины заболевания, данных Эхо-ЭС и подтвержден МРТ исследованием головного мозга. Патогенетический вариант развития инсульта устанавливался в соответствии с критериями TOAST, на основании данных анамнеза и особенностей клинической картины заболевания, данных ультразвуковой допплерографии магистральных артерий головы, ЭКГ, Эхо-КГ, МРТ исследования.
Определение газового состава крови
Анализ газового состава крови осуществляли с помощью газоанализатора ABL 500 производство «Radiometer» (Дания). Заборы крови проводили из бедренной артерии по общепринятой методике в гепаринизированные шприцы на первые сутки заболевания (при поступлении), 3-и и 7-е сутки от начала инсульта.
Определение активности ферментов антиоксидантной системы и концентрации вторичных продуктов перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой
Для определения активности ферментов АОС: супероксиддисмутазы (СОД), каталазы, глутатионпероксидозы (ГПО), глутатионредуктазы (ГР), концентрации восстановленного глутатиона (Г-SH), и концентрации вторичных продуктов перикисного окисления липидов, реагирующих с тиобарбитуровой кислотой (ТБКРП) в первые сутки заболевания (до начала терапии при поступлении), на 3-и, 7-е и 14-е сутки от начала инсульта осуществляли забор крови из локтевой вены (10,0 мл) с помощью вакуумных пробирок, содержащих гепарин. Забранная кровь немедленно разделялась на клеточный компонент и плазму методом центрифугирования в течение 15 минут (при 2000 об/мин) с помощью центрифуги ОС-6М. Плазма и клеточный компонент отделялись друг от друга с помощью стандартных пипеток, помещались в эпиндорфы (1,0 мл) и замораживались при Т = -20оС. Активность ферментов определяли спектрофотометрически на спектрофотометре "SPE-CORD W-VIS" в кювете с перемешиванием и толщиной слоя 1 см. Расчет активности ферментов производили на мг гемоглобина. Концентрацию гемоглобина в гемолизате определяли гемоглобинцианидным методом.
Определение цитохимических показателей крови
Для определения цитохимических показателей крови в первые сутки заболевания (до начала терапии при поступлении), на 3-и, 7-е и 14-е сутки от начала инсульта осуществляли забор капиллярной крови, приготовление мазков, высушивание и фиксацю в течение 30 секунд 10% раствором спирт-формалина (для определения активности щелочной фосфатазы - ЩФ) или раствором ацетона, насыщенным трилоном Б (для определения активности сукцинатдегидрогеназы - СДГ и альфа-глицерофосфатдегидрогеназы - -ГФДГ). Затем предметные стекла с мазками промывали дистиллированной водой и высушивали. Проводили окраску мазков с помощью метода азосочетания (для определения активности ЩФ) и метода Р.П. Нарциссова (с помощью солей тетразолия) для определения активности СДГ и -ГФДГ). После этого осуществляли микрокопирование мазков под масляной иммерсией, подсчет прокрашенных гранул и определение активности ферментов.
Электроэнцефалографическое исследование
Регистрация электроэнцефалограммы производили на приборе EEG-24 (фирмы МБН, Москва). Запись осуществлялась в течение 15 минут по стандартной методике, в первые сутки инсульта (до начала терапии при поступлении), на 3-и, 7-е и 14-е сутки от начала заболевание. При введении мексидола или плацебо в 1-е сутки инсульта проводилась острая фармакологическая проба. Использовали монополярный монтаж, 19 активных электродов, расположенных на поверхности кожи головы по международной системе «10-20», относительно раздельных референтных ушных электродов.
Анализ, обработку и хранение ЭЭГ-данных выполняли с помощью пакета программ ЭЭГ-Нейрокартограф. Во всех случаях проводили визуальный анализ всей записи. Для спектрального анализа использовали безартефактные эпохи продолжительностью 30 секунд.
Статистическая обработка
Статистическую обработку полученных данных выполняли с помощью программы «STATISTICA-6.0». Учитывая, что большинство совокупностей данных имели распределение отличное от нормального, достоверность различий устанавливали с помощью непараметрического U-критерия Манна-Уитни. Качественные признаки оценивали с помощью критерия с поправкой Йейтса. Если хотя бы одно из ожидаемых значений в таблице сопряженности было менее 5, то для анализа использовался односторонний вариант точного критерия Фишера. Ранговые коэффициенты корреляции рассчитывали по Спирмену. Для всех тестов был выбран двусторонний 5% уровень значимости.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Учитывая большую распространенность хронических заболеваний легких и возрастные изменения органов дыхания у пациентов пожилого возраста, рядом авторов (Г.А. Рябов, 1988; Дж.Э. Морган-мл., С.Михаил Мэгид, 2001) рекомендован индивидуальный подход к оценке напряжения кислорода в артериальной крови. Должное значение РаО2 рассчитывалось по формуле Лахмана: 96,63 – (0,2833 х возраст).
В 1-е сутки инсульта наблюдались максимальные значения PaO2, которые, при пересчете с поправкой на возраст пациентов, превышают расчетные более чем на 20%. В дальнейшем, на 3-и и 7-е сутки от начала развития инсульта, прослеживалась тенденция к снижению PaO2, что приводило к нивелированию различий между PaO2 измеренным и PaO2 расчетным. Однако значения PaO2 во всех наблюдаемых случаях не опускались ниже 60 мм рт. ст. (табл. 2).
Средние значения PaСO2 на 1-е и 3-и сутки от начала развития инсульта находились ниже нормальных значений. Таким образом, относительное повышение PaO2 и тенденция к снижению PaСO2 на 1-е и 3-и сутки инсульта, могут свидетельствовать о развитии у этих больных альвеолярной гипервентиляции и гипероксии, которые регрессировали к 7-ым суткам инсульта.
Таблица 2. Показатели газового состава артериальной крови и кислотно-основного равновесия у больных с ишемическим инсультом при самостоятельном дыхании (FiO2 0,21)
| Показатели | 1-е сутки | 3-и сутки | 7-е сутки |
| PaO2 истинное, мм рт.ст. | 90,0 ± 28,8 | 77,82 ± 14,0 | 71,0 ± 10,9 |
| % PaO2, от расчетного | 124,95 ± 31,7 | 116,67 ± 22,3 | 106,7 ± 15,8 |
| SaO2, % | 95,4 ± 3,8 | 95,1 ± 2,2 | 93,2 ± 5,4 |
| РаСО2, мм рт.ст. | 35,7 ± 5,2 | 34,84 ± 4,7 | 36,9 ± 4,2 |
| НСО3, мэкв/л | 22,7±3,9 | 23,07±2,6 | 23,8±2,9 |
| рH | 7,41 ± 0,03 | 7,44 ± 0,02 | 7,43 ± 0,02 |
В оценке доставки кислорода к тканям, особенно в условиях гипокапнии, большое значение имеет pH. Наличие алкалемии приводит к сдвигу кривой диссоциации гемоглобина влево и нарушению отдачи кислорода тканям (Г.А. Рябов, 1988; Дж.Э Морган-мл., С.Михаил Мэгид, 2001, С.В. Царенко, 2005). Наличие метаболической компенсации (снижение НСО3), наиболее выраженной на 1-е сутки инсульта, не приводит к значительному повышению pH, а, следовательно, не повышает сродство гемоглобина к кислороду.
При изучении митохондриальных ферментов и ЩФ выявлено, что уже в 1-е сутки инсульта имело место снижение активности СДГ, при этом активность -ГФДГ увеличивалась, по сравнению с контрольным значением, в 2,8 раза (табл. 3). Таким образом, очевидна депрессия одного из основных компенсаторных метаболических путей окисления – сукцинатоксидазного. Повышение активности -ГФДГ на этом фоне, по-всей видимости, свидетельствует об усилении анаэробных механизмов получения энергии. При анализе активности исследуемых ферментов в зависимости от времени развития инсульта, выявлено достоверное повышение активности -ГФДГ (более чем в 5 раз) у пациентов, госпитализированных в первые 12 часов от начала развития инсульта, тогда как активность СДГ у этих больных была несколько выше, но достоверно не отличалась от контрольного значения. Иная картина наблюдалась у больных, госпитализированных позднее: активность -ГФДГ и СДГ снижалась, но, при этом, активность -ГФДГ оставалась в 2,7 раза выше контрольного значения (табл. 3).
Таблица 3. Активность митохондриальных ферментов и ЩФ в 1-е сутки инсульта
| Время от начала развития инсульта | Балл по NIHSS | Возраст, годы | СДГ, у. е. активности | -ГФДГ, у. е. активности | ЩФ, у. е. активности |
| 3-12 часа | 10,5±7,0 | 70,5±8,4 | 605,8±60,0 | 234,0±90,9** | 48,2±16,0* |
| 12-24 часа | 12,7±5,3 | 72,4±9,2 | 473,7±92,2##** | 111,2±56,2##** | 31,0±22,3 |
| 3-24 часа | 10,5±5,7 | 69,4±9,8 | 496,0±104,1* | 115,6±79,3** | 35,3±21,9 |
| Группа контроля | 64,4±5,2 | 562,0±68,6 | 41,4±14,4 | 27,8±20,9 |
* - p<0,05, ** - p<0,01 достоверность различий по сравнению с группой контроля;
# - p<0,05, ## - p<0,01; достоверность различий по сравнению с показателями в первые 12 часов
Таким образом, в первые часы ишемического инсульта наблюдается преобладание первой (компенсаторной) стадии биоэнергетической гипоксии, о чем свидетельствует тенденция к повышению активности СДГ (Л.Д. Лукьянова, 1997; Е.И. Гусев, В.И. Скворцова, 2001). Достоверное отсутствие повышения активности этого фермента по-всей видимости связано с большей выраженностью этого процесса на более ранних сроках инсульта. Повышение активности -ГФДГ в первые сутки инсульта, по-всей видимости, является подтверждением активации анаэробного гликолиза, особенно ярко проявляющегося в первые 12 часов от начала развития заболевания, о чем свидетельствует и резкое повышение активности ЩФ в те же сроки.
У 16 больных с инсультом различной тяжести, не получавших препаратов с антиоксидантными и антигипоксантными свойствами было проведено исследование активности СДГ, -ГФДГ и ЩФ в динамике (рис. 1-4).
У больных обеих групп наблюдалось снижение активности СДГ лимфоцитов, по сравнению с контрольными значениями, особенно выраженное к 7-ым, 14-ым суткам от начала развития инсульта (рис. 1).
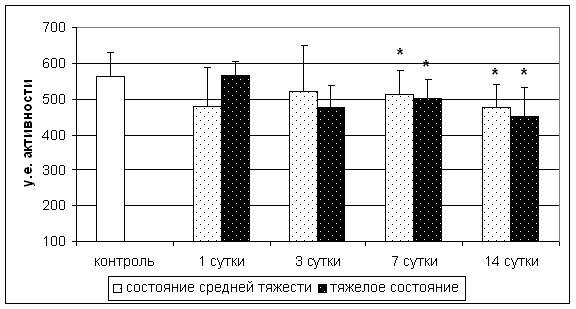
* - p<0,05; ** - p<0,01 по сравнению с группой контроля
Рис. 1. Активность СДГ у больных с инсультом различной тяжести
Активность -ГФДГ, по сравнению с СДГ, претерпевала обратные изменения. Наблюдалась общая тенденция к повышению активности -ГФДГ. Обращает на себя внимание достоверное повышение активности этого фермента у больных с инсультом средней тяжести на 3-и сутки заболевания, как по сравнению с контрольной группой, так и по сравнению с группой больных с тяжелым инсультом. При этом активность -ГФДГ у больных с тяжелым инсультом на 3-и сутки заболевания достоверно не отличалась от таковой в группе контроля (рис. 2).
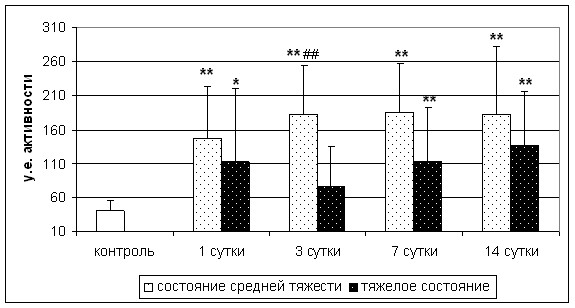
* - p<0,05; ** - p<0,01 по сравнению с группой контроля; ## - p<0,01 по сравнению с группой тяжелых больных
Рис. 2. Активность -ГФДГ у больных с инсультом различной тяжести
Активность ЩФ нарастала к 3-им суткам инсульта в обеих группах, однако достоверные отличия от группы контроля наблюдаются только у больных с тяжелым инсультом. После 3-х суток инсульта активности фермента у больных исследуемых групп разнится: у пациентов с инсультом средней тяжести она не отличается от значений в группе контроля, а у больных с тяжелым инсультом она сохраняется высокой, при этом на 14-е сутки заболевания активность ЩФ у больных с инсультом различной тяжести достоверно различается (рис. 3).

** - p<0,01 по сравнению с группой контроля; # - p<0,05 по сравнению с группой тяжелых больных
Рис. 3. Активность ЩФ у больных с инсультом различной тяжести
Кроме того, выявлено достоверное повышение активности ЩФ на 7-е сутки инсульта у больных с тяжелой инвалидизацией, по сравнению с контрольными значениями и группой больных с хорошим восстановлением нарушенных неврологических функций (рис. 4).
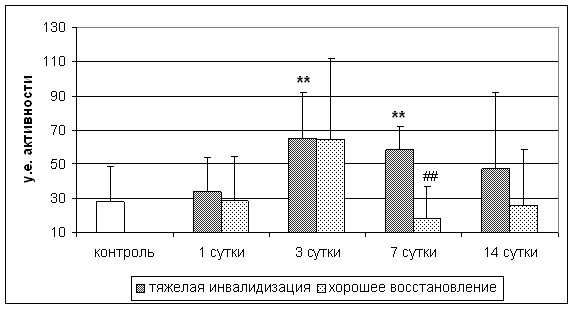
** - p<0,01 по сравнению с группой контроля; ## - p<0,01 по сравнению с группой больных с тяжелой инвалидизацией
Рис. 4. Активность ЩФ у больных с различной степенью функционального восстановления на 21-е сутки инсульта
У 37 больных, не получавших препаратов с известными антиоксидантными или антигипоксическими свойствами, был проведен анализ активности ферментов АОС, концентрации Г-SH и ТБКРП в периферической крови. Уже в первые часы заболевания выявлено снижение активности ГПО, снижение концентрации Г-SH и повышение концентрации ТБКРП по сравнению с контрольными значениями. Позднее (у больных, госпитализированных в первые 12-24 часа) наблюдалось снижение активности СОД, каталазы, ГР, ГПО, как по сравнению с контрольными значениями, так и с группой больных, госпитализированных в более ранние сроки (3-12 часов от дебюта заболевания). При динамическом наблюдении выявлено снижение активности СОД, каталазы, ГПО, концентрации Г-SH при сравнении с контрольными значениями (табл. 4).
Средние значения содержание ТБКРП по группе в целом не отличались от контрольного значения, однако у больных с тяжелым инсультом было выявлено достоверное повышение концентрации во всех точках исследования по сравнению с контролем и на 7-е сутки по сравнению с группой больных с инсультом средней тяжести (рис. 5). Кроме того, у больных с плохим восстановлением нарушенных неврологических функций выявлено повышение концентрации ТБКРП на 14-е сутки инсульта как по сравнению с группой контроля, так и по сравнению с группой больных с хорошим восстановлением (рис. 6).
Таблица 4. Активность ферментов АОС концентрация Г-SH и ТБКРП у больных различной тяжести, не получавших антиоксидантов
| Ферменты | Время от начала развития инсульта | Контроль | |||||
| 3-12 час | 12-24 час | 1 сутки | 3 сутки | 7 сутки | 14 сутки | ||
| СОД, Ед/Hb | 276,9 ±82,9 | 151,2##** ±62,1 | 215,9* ±91,4 | 224,0* ±82,2 | 211,4** ±70,9 | 210,3** ±82,9 | 278 ±66,0 |
| Каталаза, мммоль/мин/Hb | 3,1 ±0,6 | 2,7#** ±0,8 | 2,8** ±0,8 | 2,9** ±0,9 | 2,7** ±0,8 | 3,0** ±0,6 | 3,3 ±0,4 |
| ГПО, мкмоль/ мин/Hb | 26,5* ±4,9 | 21,9##** ±7,4 | 24,6** ±7,1 | 26,3** ±6,8 | 25,6** ±5,3 | 25,2** ±6,4 | 30,2 ±4,5 |
| ГР, мкмоль/ мин/Hb | 4,6 ±1,5 | 3,6#** ±1,0 | 3,9 ±1,3 | 4,1 ±1,5 | 4,1 ±1,5 | 4,0 ±1,3 | 4,5 ±1,0 |
| Г-SH, мкмоль/Hb | 2,1** ±1,4 | 3,1#** ±2,0 | 3,0** ±2,1 | 2,8** ±1,8 | 3,0** ±1,9 | 3,8** ±2,1 | 5,1 ±0,9 |
| ТБКРП, нммоль/мл | 5,1* ±1,0 | 5,2 ±1,5 | 4,9 ±1,2 | 5,1 ±1,2 | 5,3 ±1,4 | 5,1 ±1,2 | 4,4 ±0,5 |
* - p<0,05, ** - p<0,01 достоверность различий по сравнению с группой контроля; ## - p<0,01 достоверность различий по сравнению с группой больных, госпитализированных в первые 3-12 часов от начала развития инсульта
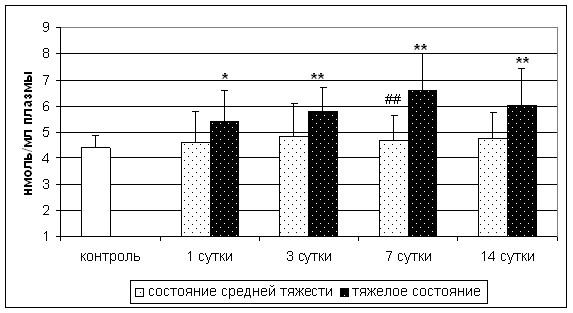
*- p<0,05; ** - p<0,01 по сравнению с группой контроля; ## - p<0,01 по сравнению с группой больных тяжелым инсультом
Рис. 5. Концентрация ТБКРП у больных с инсультом различной тяжести
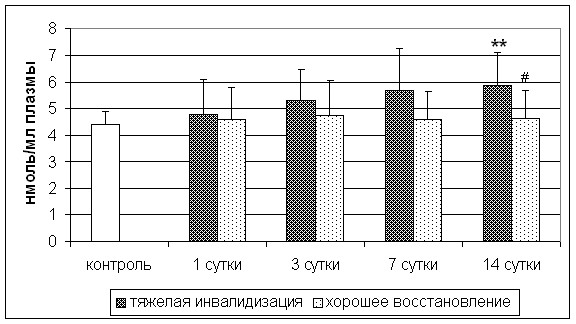
** - p<0,01 по сравнению с группой контроля; ## - p<0,01 по сравнению с группой больных с тяжелой инвалидизацией
Рис. 6. Концентрация ТБКРП у пациентов с различной степенью восстановления на 21-е сутки инсульта
Активность СОД также влияла на исход инсульта: у больных с плохим восстановлением она была ниже контрольного значения во всех точках исследования, а также ниже таковой у больных с хорошим восстановлением на 7-е и 14-е сутки (рис.7).
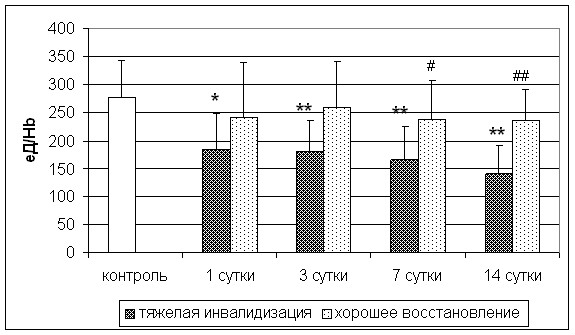
* - p<0,05; ** - p<0,01 по сравнению с группой контроля; # - p<0,05, ## - p<0,01 по сравнению с
группой больных с тяжелой инвалидизацией
Рис. 7. Активность СОД у пациентов с различной степенью восстановления на
21-е сутки инсульта
При анализе зависимостей между баллом по NIHSS и интегральным показателем ЭЭГ (Int = /) были выявлены тесные отрицательные корреляционные связи во всех точках исследования, как для интактного, так и для пораженного полушарий головного мозга (r = -0,6, p<0,01). Таким образом, было подтверждено, что чем тяжелее инсульт (выше балл по NIH), тем ниже интегральный показатель ЭЭГ, отражающий соотношение основных ритмов ЭЭГ к патологическим медленным ритмам.
При анализе зависимостей между показателями кислородного статуса и клинико-электроэнцефалографическими характеристиками состояния больных были выявлены прямые зависимости между SaO2 на 1-е сутки инсульта и баллом по NIHSS на 7-е (r = 0,8, p<0,01) и обратные зависимости (r = -0,8, p<0,01) между SaO2 на 1-е сутки инсульта и Int (для обоих полушарий) на 7-е (рис. 8). Кроме того, были получены корреляции между: SaO2 на 1-е сутки и баллом по NIHSS на 14-е (r = 0,7, p<0,05); SaO2 на 1-е сутки и Int для пораженного полушария мозга на 3-и (r = -0,8, p<0,05) и на 7-е сутки (r = -0,9, p<0,01).
Рис 8. Корреляционные связи между насыщением гемоглобина артериальной крови кислородом (SaO2) баллом по NIHSS и интегральным показателем ЭЭГ (Int)
Также выявлены зависимости между величиной процента от расчетного PaO2 (% PaO2). % PaO2 на 1-е сутки и балл по NIHSS на 7-е (r = 0,8, p<0,05) и на 14-е сутки (r = 0,7, p<0,05); % PaO2 на 1-е сутки и Int для пораженного полушария на 1-е сутки (r = -0,9, p<0,01), а также Int для пораженного и здорового полушарий мозга на 3-и сутки (r = -0,9, p<0,01 и r = -0,8, p<0,05 соответственно), рис. 9.
Рис. 9. Корреляционные связи между величиной процента от расчетного напряжения кислорода в артериальной крови (%PaO2), баллом по NIHSS и интегральным показателем ЭЭГ (Int)
Были выявлены корреляционные связи между активностью СОД 3-и сутки инсульта и баллом по NIHSS на 1-е сутки (r = -0,4, p < 0,05), активностью СОД 14-е сутки и баллом по NIHSS на 3-и, 7-е, 14-е сутки (r = -0,4, p < 0,05); между активностью СОД на 14-е сутки и Int как для пораженного, так и для интактного полушарий мозга на 3-и сутки (r = 0,6, p < 0,01), активностью СОД на 3-и сутки и Int (для обоих полушарий) на 14-е сутки (r = 0,6, p < 0,01), рис. 10.
Рис. 10. Корреляционные связи между активностью СОД, баллом по NIHSS и интегральным показателем ЭЭГ (Int)
Более тесные корреляционные связи были получены между концентрацией ТБКРП и Int. Концентрация ТБКРП на 1-е, 3-и, 7-е и 14-е сутки инсульта и Int как для пораженного, так и для здорового полушарий на 3-и сутки (r = -0,5, p < 0,01), концентрация ТБКРП на 1-е сутки и Int для пораженного полушария на 7-е сутки (r = -0,4, p < 0,01); концентрацией ТБКРП на 7-е сутки и баллом по NIHSS на 1-е, 3-и, 7-е, сутки (r = 0,5, p < 0,01), рис. 11.
Рис 11. Корреляционные связи между концентрацией ТБКРП, баллом по NIHSS и интегральным показателем ЭЭГ (Int)
Кроме того, были получены зависимости между %PaO2 на 3-и сутки и активностью СОД на 7-е сутки (r = -0,8, p<0,05); PaO2 и SaO2 на 3-и сутки и активностью СОД на 14-е сутки (r = -0,9, p<0,05); PaO2 и SaO2 на 3-и сутки и концентрацией ТБКРП на 14-е сутки (r = 0,9, p<0,05).
Полученные корреляции свидетельствуют о том, что повышение SaO2 и процента от расчетного PaO2 в 1-е сутки инсульта, соотносится с преобладанием патологических медленных ритмов ЭЭГ над основными, и более тяжелым течением инсульта (выше балл по шкале NIH). Кроме того, сохранение высоких значений PaO2, SaO2 и %PaO2 на 3-и сутки инсульта связаны со снижением активности СОД и повышением концентрации ТБКРП. Последние, в свою очередь, тесно коррелируют как с тяжестью инсульта, так и с интегральным показателем ЭЭГ.
Таким образом, относительная гипероксия отрицательно влияет на биоэлектрическую активность мозга и течение инсульта за счет активации процессов ОС.
При анализе динамики клинического балла по шкале NIH (рис. 12) было выявлено опережение восстановления нарушенных неврологических функций у пациентов, получавших мексидол (более выраженное снижение суммарного клинического балла), по сравнению с группой больных, получавших плацебо. При этом достоверные (р<0,05) различия между группами наблюдались к окончанию курсового введения препарата (к 14-м суткам).
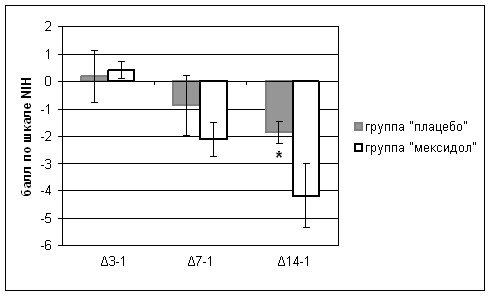
* p<0,05 достоверность различий при сравнении двух групп
3-1 динамика клинического балла по NIH на 3-и сутки от начала развития инсульта, 7-1 динамика клинического балла по NIH на 7-е сутки от начала развития инсульта, 14-1 динамика клинического балла по NIH на 14-е сутки от начала развития инсульта.
Рис. 12. Динамика клинического балла по шкале NIH
При анализе сроков госпитализации больных в обеих группах выявлено по 17 пациентов, включенных в исследование в первые 6 часов от начала развития инсульта. При анализе клинической картины инсульта у больных, включенных в исследование в первые 6 часов и получавших мексидол, выявлен достоверно больший клинический бал по шкале NIH на 1-е и 3-и сутки инсульта, по сравнению с пациентами, получавшими плацебо (табл. 5). При этом, обращает на себя внимание отсутствие достоверных различий между группами на 7-е и 14-е сутки, а также достоверно больший балл по шкале Бартел на 21-е сутки у пациентов, получавших мексидол.
Таблица 5. Динамика клинического балла по шкале NIH и степень восстановления по шкале Бартел (BI) у больных, поступивших в клинику в первые 6 часов от начала развития инсульта
| группы | Баллы по шкале NIH | BI | |||
| 1 сутки | 3 сутки | 7 сутки | 14 сутки | 21 сутки | |
| плацебо | 10,8±6 | 11,1±6,1 | 10,1±6,2 | 9,1±6,1 | 58,0 |
| мексидол | 15,6±6* | 16,4±7,5* | 13±8,1 | 10,5±7,3 | 72,5* |
* p<0,05 достоверность различий при сравнении двух групп
При анализе динамики клинического балла по шкале NIH у пациентов, поступивших в клинику в первые 6 часов от начала развития инсульта, было выявлено достоверное (р<0,05) опережение восстановления нарушенных неврологических функций к 14-м суткам заболевания у пациентов, получавших мексидол, по сравнению с группой больных, получавших плацебо (рис. 13).
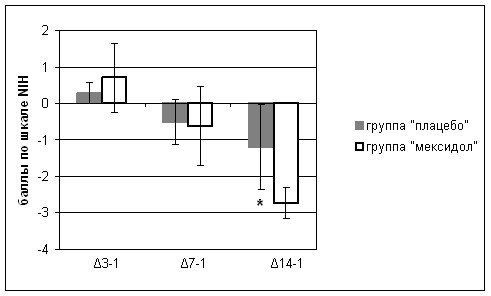
* p<0,05 достоверность различий при сравнении двух групп
Рис.13. Динамика клинического балла по шкале NIH у больных, поступивших в клинику в первые 6 часов от начала развития инсульта
Достоверных различий по тяжести состояния пациентов двух групп, поступавших в более поздние сроки, выявлено не было. К 21-м суткам инсульта достоверных различий в показателях летальности при прогредиентном инсульте между группами выявлено не было. Каких либо побочных эффектов при внутривенном или внутримышечном введении мексидола не отмечено.
При анализе показателей биоэлектрической активности мозга при проведении острой фармакологической пробы установлено, что у больных, получавших плацебо, в течение 150 мин регистрации ЭЭГ после первого введения плацебо увеличился индекс тета активности (достоверно, по сравнению с группой больных, получавших мексидол, в непораженном полушарии, р<0,05) и уменьшилась частота альфа ритма в затылочных отведениях (достоверно, по сравнению с группой больных, получавших мексидол, в непораженном полушарии, р<0,005), отмечались тенденция к уменьшению индекса альфа ритма в обоих полушариях и перераспределение мощности альфа ритма с увеличением его представленности в передне-центральных отведениях (достоверно, по сравнению с группой больных, получавших мексидол, в обоих полушариях увеличился индекс Ап/Аз, р<0,05). В группе больных, получавших плацебо, также было выявлено увеличение представленности медленной активности по отношению к быстрой (достоверно, по сравнению с группой больных получавших мексидол, увеличился индекс М/Б в обоих полушариях, р<0,05). В группе пациентов, получивших мексидол, показатели биоэлектрической активности в течение 150 мин после первого введения препарата, оставались стабильными (табл. 6).
Таблица 6. Значения некоторых показателей ЭЭГ при проведении острой фармакологической пробы (регистрации ЭЭГ до и после введения препарата в течение 150 мин)
| Показа- тель ЭЭГ | Плацебо | Мексидол | ||||
| До введения препарата | Через 150 мин | р< | До введения препарата | Через 150 мин | р< | |
| Частота альфа ритма, Гц | А 11,05+0,22 Б 11,05+0,29 | А 11,03+0,23 Б 10,96+0,29 | 0,48 0,001 | А 11,13+0,16 Б 11,09+0,18 | А 11,16+0,22 Б 11,07+0,19 | 0,30 0,61 |
| Ап/Аз | А 1,79+0,96 Б 1,92+1,58 | А 2,32+1,42 Б 2,35+1,64 | 0,02 0,03 | А 1,94+1,47 Б 1,99+1,19 | А 1,92+1,24 Б 2,29+1,55 | 0,88 0,22 |
| Индекс тета | А 0,38+0,14 Б 0,30+0,11 | А 0,41+0,15 Б 0,33+0,14 | 0,11 0,01 | А 0,44+0,12 Б 0,37+0,13 | А 0,42+0,12 Б 0,35+0,10 | 0,16 0,29 |
| Индекс М/Б | А 2,64+1,95 Б 1,21+0,84 | А 3,08+2,55 Б 1,60+1,15 | 0,04 0,02 | А 2,67+1,62 Б 1,42+0,81 | А 2,61+1,39 Б 1,36+0,83 | 0,77 0,70 |
| МПА Д, % | 0,20+0,37 | 0,18+0,39 | 0,85 | 0,07+0,87 | 0,13+0,72 | 0,75 |
| МПА Т, % | 41,11+36,91 | 49,94+42,7 | 0,05 | 41,91+28,3 | 42,06+31,8 | 0,97 |
А – показатель пораженного полушария; Б – показатель интактного полушария
Выявленные изменения в группе пациентов, получавших плацебо, и относительная стабильность показателей в течение 150 мин регистрации ЭЭГ в группе пациентов, получавших мексидол, отражают действие мексидола, нормализующее функциональную активность структур головного мозга подкорково-диэнцефального уровня, что может свидетельствовать об антигипоксической направленности препарата.
Достоверные различия в динамике показателей биоэлектрической активности в группах больных выявлены на 3-и сутки заболевания. В группе мексидола отмечена нормализация распределения альфа ритма в непораженном полушарии (р<0,05) и достоверное снижение показателя Ап/Аз, по сравнению с 1-ми сутками. К 14-м суткам значение показателя Ап/Аз составляет 0,66 в группе мексидола и 1,5 - группе плацебо (р<0,005). Индекс тета ритма в группе мексидола снижался, начиная с 3-х суток, для интактного полушария это снижение с 7-х суток становилось достоверным. При этом в группе плацебо индекс тета ритма он незначительно увеличивался к 3-м и 7-м суткам, по сравнению с 1-ми сутками. На 14-е сутки соотношение медленной к быстрой активности в группе пациентов, получавших мексидол, было достоверно ниже, чем в группе больных, получавших плацебо (М/Б равен 1,54 и 2,8 соответственно (р<0,05), табл. 7.
Таблица 7. Показатели биоэлектрической активности мозга у больных, получавших мексидол или плацебо
| Показатель ЭЭГ | Сутки | Полуша-рие | Плацебо | Мексидол | р< |
| Индекс отношения мощности альфа активности в передних и задних отделах головного мозга (Ап/Аз) | 3 | А Б | 1,14+0,31 1,28+0,48 | 1,20+0,75 0,91+0,32 | 0,74 0,01 |
| 7 | А Б | 0,97+0,33 1,22+0,96 | 0,86+0,29 0,74+0,26 | 0,38 0,11 | |
| 14 | А Б | 0,96+0,23 1,05+0,26 | 0,78+0,32 0,66+0,14 | 0,17 0,001 | |
| 3-1 | А Б | 0,17+0,29 0,31+0,64 | 0,07+0,71 -0,04+0,29 | 0,57 0,05 | |
| 7-1 | А Б | 0,01+0,48 0,25+0,99 | -0,26+0,45 -0,26+0,26 | 0,14 0,09 | |
| 14-1 | А Б | -0,21+0,30 -0,001+0,33 | -0,31+0,46 -0,35+0,30 | 0,61 0,03 | |
| Индекс тета ритма | 3 | А Б | 0,09+0,05 0,09+0,02 | 0,11+0,06 0,12+0,06 | 0,17 0,03 |
| 14 | А Б | 0,09+0,04 0,07+0,03 | 0,10+0,07 0,12+0,04 | 0,48 0,01 | |
| 7-1 | А Б | -0,02+0,07 0,01+0,05 | -0,02+0,05 -0,03+0,06 | 0,98 0,04 | |
| 14-1 | А Б | -0,06+0,10 -0,02+0,06 | -0,001+0,06 -0,02+0,05 | 0,07 0,78 | |
| Отношение мощности медленной активности к быстрой (М/Б) | 14 | А Б | 2,7+0,18 1,19+0,73 | 1,54+0,33 0,88+0,58 | 0,03 0,35 |
А – показатель пораженного полушария; Б – показатель интактного полушария
Таким образом, применение мексидола в остром периоде ишемического инсульта в каротидной системе способствует нормализации биоэлектрической активности головного мозга. Тенденция к нормализации зонального распределения альфа-ритма с 3-х суток и снижение индекса тета-ритма в здоровом полушарии пациентов, получавших мексидол, дополнительно подтверждает влияние мексидола, в первую очередь, на структуры подкорково-диэнцефального уровня.
У всех пациентов в первые дни инсульта было выявлено достоверное снижение активности СОД по сравнению с группой контроля. На 3-и сутки от начала развития инсульта у пациентов, получавших плацебо, выявлены бльшие значения активности СОД по сравнению с пациентами, получавшими мексидол (p<0,01), однако, обращает на себя внимание инверсия значений активности этого фермента к 14-м суткам заболевания и отсутствие достоверных отличий с группой контроля у пациентов, получавших мексидол (табл. 8).
Таблица 8. Активности СОД у больных, получавших мексидол или плацебо
| группы | Активность СОД, ед/Hb | ||||
| 1 сутки | 3 сутки | 7 сутки | 14 сутки | группа контроля | |
| плацебо | 215,9±91,5* | 224±82,2* # | 211,4±70,9** | 210,3±82,9** | 278,8±66 |
| мексидол | 181,7±95,3** | 163,8±94,9** | 172,6±90,2** | 220,2±94,9 | |
** p<0,001, * p<0,05 достоверность различий, в сравнении с контрольной группой;
# p<0,01 достоверность различий, при сравнении с группой больных, получавших мексидол
Учитывая способность мексидола оптимизировать энергосинтезирующие функции митохондрий за счет активации сукцинатоксидазного пути окисления, у больных была определена активность СДГ, -ГФДГ и ЩФ.

* p<0,05 достоверность различий при сравнении двух групп
Рис. 14. Динамика активности СДГ у больных, получавших мексидол или плацебо
У пациентов обеих групп наблюдалась тенденция к снижению активности СДГ с течением инсульта. У получавших плацебо, имело место достоверное (р<0,05) снижение активности СДГ на 7-е и 14-е сутки от начала развития инсульта, по сравнению с группой контроля, тогда как активность этого фермента, у пациентов, получавших мексидол, достоверно не отличалась от контрольных значений. К 14-м суткам заболевания активность СДГ была достоверно выше на фоне назначения мексидола, чем в группе плацебо (p<0,05) (рис. 14).
Активность -ГФДГ была достоверно (р<0,05) повышена во всех точках исследования у пациентов обеих групп. Однако у пациентов, получавших мексидол, наблюдалось достоверное (р<0,05) снижение активности -ГФДГ на 7-е и 14-е сутки от начала развития инсульта (рис. 15).
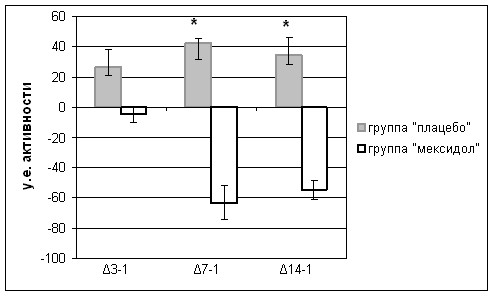
* p<0,05 достоверность различий, при сравнении двух групп
Рис. 15. Динамика активности -ГФДГ у больных, получавших мексидол или плацебо
Таким образом, у пациентов, получавших мексидол, по сравнению с пациентами, получавшими плацебо, имеет место нарастание активности СДГ и снижение активности -ГФДГ.
Повышение активности СДГ, свидетельствующее об активации основного – сукцинатоксидазного метаболического пути получения энергии, характерно для действия мексидола – препарата, являющегося антигипоксантом прямого действия. Снижение активности -ГФДГ у пациентов, получавших мексидол, по-видимому, является компенсаторным и свидетельствует о снижении анаэробных и усилении аэробных процессов получения энергии. Таким образом, на фоне введения мексидола происходит переход преимущественно анаэробного пути получения энергии на аэробный. Это подтверждается инверсией отношения СДГ к -ГФДГ, наблюдаемой к 7-м суткам от начала развития инсульта (рис. 16).
Рис. 16. Динамика отношения СДГ/-ГФДГ у больных, получавших мексидол или плацебо

Переход на преимущественно аэробный путь получения энергии за счет активации сукцинатоксидазной метаболической цепи у пациентов, получавших мексидол, приводит к стабилизации клеточных мембран и снижению активности ЩФ (рис. 17).
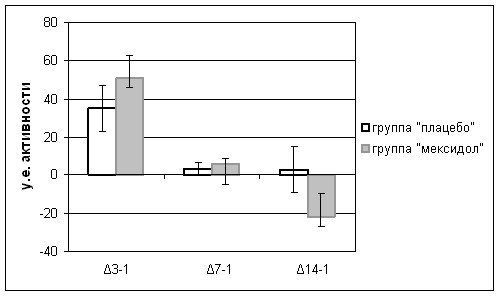
Рис. 17. Динамика активности ЩФ у больных, получавших мексидол или плацебо
ВЫВОДЫ
1. У больных в остром периоде ишемического инсульта имеет место гипервентиляционный синдром, сопровождающийся относительной гипероксией, которая максимально выражена в 1-е и 3-и сутки заболевания (увеличение PaO2. на 20% и 16% соответственно).
2. Относительная гипероксия в 1-е и 3-и сутки от начала развития инсульта является неблагоприятным патогенетическим и прогностическим фактором, отрицательно влияющим как на клиническую картину заболевания (r= 0,8, р<0,001), так и на биоэлектрическую активность головного мозга (r= -0,8, р<0,001).
3. У больных в остром периоде ишемического инсульта наблюдаются снижение активности основных ферментов антиоксидантной системы и концентрации Г-SH а также нарастание концентрации ТБКРП, в периферической крови более выраженное у больных с тяжелым инсультом (р<0,05) по сравнению с контрольными значениями.
4. Снижение активности эндогенного антиоксиданта СОД в периферической крови ниже 185 Ед/Hb с первых суток инсульта и сохранение низкой активности фермента к 7-ым и 14-ым суткам позволяет прогнозировать плохое восстановление нарушенных неврологических функций к 21-му дню заболевания (индекс Бартел менее 35). Повышение концентрации ТБКРП в периферической крови выше 5,4 нммоль/мл с первых суток заболевания сопровождает тяжелое течение инсульта; сохранение высокой концентрации ТБКРП к 14-ым суткам заболевания соотносится с плохим восстановлением нарушенных неврологических функций к 21-му дню инсульта (индекс Бартел менее 35).
5. У больных в остром периоде инсульта начиная с первых 12-24 часов заболевания наблюдается снижение активности СДГ (до 16% по сравнению с контролем, p<0,01), а также повышение активности -ГФДГ в 2,6 раза (p<0,01, по сравнению с контролем). Активности -ГФДГ более 182,6 у.е. (p<0,01, по сравнению с контролем и группой больных с тяжелым инсультом) на 3-и сутки заболевания сопровождает средне тяжелое течение заболевания, что, по-видимому, свидетельствует о функционировании процессов клеточного дыхания в условиях ишемического повреждения мозга.
6. У больных в остром периоде инсульта наблюдается повышение активности ЩФ лимфоцитов, максимально выраженное на 3-и сутки инсульта, что, по видимому, отражает интенсивность некротических процессов при ишемическом повреждении мозга. При этом снижение активности ЩФ на 7-е сутки инсульта ниже 18,2 у.е. позволяет прогнозировать хорошее функциональное восстановление к 21-му дню инсульта (индекс Бартел более 65).
7. Раннее (до 6 часов) применение мексидола в дозе 300 мг в сутки на протяжении 14 дней острого периода ишемического инсульта способствует ускоренному регрессу неврологических нарушений (p<0,05, по сравнению с плацебо) и положительному влиянию на биоэлектрическую активность мозга за счет оптимизации работы ферментов дыхательной цепи и восстановления активности СОД.(p<0,01, по сравнению с плацебо).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Больным в остром периоде ишемического инсульта, не осложненного нарушениями функций внешнего дыхания и газотранспортной функцией крови, не показано рутинное проведение оксигенотерапии.
2. С целью предупреждения развития гипоксемии целесообразно неинвазивное мониторирование SaO2.
3. С целью оптимизации процессов клеточного дыхания и повышения активности АОС, больным в остром периоде ишемического инсульта атеротромботическиго или кардиоэмболического генеза, рекомендуется назначение мексидола в дозе 300 мг в сутки на протяжении первых 14 дней от начала развития инсульта.
СПИСОК НАУЧНЫХ РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Скворцова В.И., Бодыхов М.К., Федоров В.Н. Свободные радикалы при ишемии головного мозга. Инсульт. Приложение к журналу неврологии и психиатрии им. С.С. Корсакова, 2004, вып.10,c. 33-38
- Скворцова В.И., Бодыхов М.К., Нарциссов Я.Р., Смирнова И.Н., Шутьева А.Б. Влияние мексидола на ферментативный статус лейкоцитов в остром периоде ишемического инсульта. В сб. трудов Второго международного конгресса «Восстановительная медицина и реабилитация». Москва, 2005, с. 80-81.
- Бодыхов М.К., Нарциссов Я.Р., Калинина Е.В., Новичкова М.Д., Манина И.В., Скворцова В.И. Изменения активности супероксиддисмутазы в остром периоде ишемического инсульта при назначении мексидола. В сб. материалов IХ Всероссийского общества неврологов, Ярославль, 2006, с. 374.
- Бодыхов М.К., Скворцова В.И. Гипервентияционный синдром у больных в остром периоде ишемического инсульта в каротидной системе. В сб. материалов IХ Всероссийского общества неврологов, Ярославль, 2006, с. 374.
- Нарциссов Я.Р., Бодыхов М.К., Гудкова Ю.В., Солдатенкова Т.Д., Кондрашова Т.Т., Шутьева А.Б., Смирнова И.Н., Скворцова В.И. Изменения активности митохондриальных ферментов лейкоцитов капиллярной крови в 1-е сутки ишемического инсульта в каротидной системе. В сб. материалов IХ Всероссийского общества неврологов, Ярославль, 2006, с. 449.
- Скворцова В.И., Нарциссов Я.Р., Кичук И.В., Бодыхов М.К., Изменения газового состава артериальной крови, антиоксидантной системы и митохондриальных ферментов в остром периоде ишемического инсульта. В сб. материалов IХ Всероссийского общества неврологов, Ярославль, 2006, с. 478.
- Скворцова В.И., Стаховская Л.В., Нарциссов Я.Р., Бодыхов М.К., Кичук И.В., Пряникова Н.А., Гудкова Ю.В., Солдатенкова Т.Д., Кондрашова Т.Т., Калинина Е.В., Новичкова М.Д., Кербиков О.Б. Рандомизированное, двойное слепое, плацебо-контролируемое исследование эффективности и безопасности мексидола в комплексной терапии ишемического инсульта в остром периоде. Инсульт. Приложение к журналу неврологии и психиатрии им. С.С. Корсакова, 2006, вып.18, c. 33-38.
СПИСОК СОКРАЩЕНИЙ
BI – индекс Бартел
Int – отношение основных ритмов ЭЭГ к патологическим медленным ритмам
NIH – шкала национального института здоровья США
SaO2 – насыщение гемоглобина кислородом в артериальной крови
НСО3 – анион гидрокарбоната
рH – отрицательный десятичный логарифм концентрации ионов водорода
РаСО2 – напряжение углекислого газа в артериальной крови
PaO2 – напряжение кислорода в артериальной крови
% PaO2 – процент от расчетного напряжение кислорода в артериальной крови
-ГФДГ – альфа-глицерофосфатдегидрогеназа
АОС – антиоксидантная система
Ап/Аз – отношение мощности альфа ритма в передних и задних отделах головного мозга
Г-SH – восстановленный глутатион
ГПО – глутатионпероксидоза
ГР – глутатионредуктаза
Индекс М/Б – отношение мощности медленной активности к быстрой
МРТ – магнитно-резонансная томография
ОС - оксидантный стресс
СДГ – сукцинатдегидрогеназа
СОД – супероксиддисмутаза
ТБКРП – вторичные продукты перекисного окисления липидов, реагирующие с тиобарбитуровой кислотой
ЩФ – щелочная фосфатаза
Эхо-ЭС – эхоэнцефалоскопия
Эхо-КГ – эхокардиография
ЭЭГ – электроэнцефалография

