Оптимизация пренатальной подготовки и родоразрешения беременных с резус -отрицательной принадлежностью крови в со четании с железодефицитной анемией
На правах рукописи
БИЙБОЛАТОВА ДИАННА ТАЖИТДИНОВНА
ОПТИМИЗАЦИЯ ПРЕНАТАЛЬНОЙ ПОДГОТОВКИ
И РОДОРАЗРЕШЕНИЯ БЕРЕМЕННЫХ
С РЕЗУС-ОТРИЦАТЕЛЬНОЙ ПРИНАДЛЕЖНОСТЬЮ КРОВИ В СОЧЕТАНИИ С ЖЕЛЕЗОДЕФИЦИТНОЙ АНЕМИЕЙ
14.00.01 – Акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата
медицинских наук
Волгоград - 2006
Работа выполнена в ГУ «Дагестанский научный центр РАМН» и ГОУ ВПО «Дагестанская государственная медицинская академия Федерального агентства министерства здравоохранения и социального развития РФ».
| Научный руководитель: Официальные оппоненты: Ведущее учреждение: | член-корр. РАМН, заслуженный деятель науки РФ и РД, доктор медицинских наук, профессор Омаров Султан-Мурад Асланович. доктор медицинских наук, профессор кандидат медицинских наук, доцент Костенко Татьяна Ивановна |
Защита состоится «___» 2006 г. в ____ часов на заседании диссертационного совета (К 208. 008. 01) при Волгоградском государственном медицинском университете по адресу: 400131, г. Волгоград, пл. Павших борцов, 1.
С диссертацией можно ознакомиться в библиотеке Волгоградского государственного медицинского университета.
Автореферат разослан «___» ___________ 2006 г.
Ученый секретарь
диссертационного совета
доцент, к.м.н. Селихова М.С.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. По распространенности, прямому и косвенному влиянию на материнскую, перинатальную заболеваемость и смертность, а также социально-экономическим последствиям сочетание резус-отрицательной принадлежности крови и анемии беременных является одной из весьма актуальных проблем мирового здравоохранения.
Репродукция здорового поколения при резус-конфликте является актуальной проблемой клинической иммунологии, акушерства и неонаталогии.
Сложность и важность проблемы определяются существующими объективными и субъективными условиями развития резус-сенсибилизации и реализации ее в гемолитическую болезнь плода и новорожденного (ГБН).
По данным многих авторов, гемолитические заболевания плода и новорожденного, составляют не менее 20% перинатальной патологии. В числе причин, которые могут привести к усиленному гемолизу эритроцитов, прежде всего, следует назвать изоиммунологический конфликт между матерью и плодом по резус-фактору и группе крови (Rightmire D. A., Nico-laides К.N., 1986; Mills L., Napier J. A.,1988; Савельева Г.М., 1990; Быкова Е.Г.,1995; Садыков Б.Г., 1999; AiskinP.D., 1999; Ulm В, Ulm., et al., 1999. Ерицян Р.Г. и соавт.,2002). Гемолитическая болезнь плода и новорожденного остается одной из ведущих нозологических единиц в структуре перинатальной заболеваемости и смертности (Быкова Е.Я., 1995; Нажмутдинова Д.К., 1995; Горюшина Н.Б., 1996; Гольдинберг К.К, 1999; Завгородний Г.Н., 2002; Саакян Е.Н., 2002; Севастьянова О.Н., 2002; Clarke С., 2002; Fischer K.N., 2002).
Согласно существующим представлениям, сенсибилизация происходит путем поступления через плаценту эритроцитов плода, содержащих чужеродный антиген, причем количество антигена может быть очень незначительным. При ЖДА отмечается нарушения в формировании фетоплацентарного комплекса, дистрофические процессы приводят к изменению проницаемости плацентарного барьера, что создает условия для более легкого перехода клеток плода в кровоток матери и антител от матери к плоду.
Во всем мире в настоящее время отмечается высокая распространенность железодефицитной анемии (ЖДА). По данным ВОЗ - 600 млн. человек страдает ЖДА. По данным различных авторов и экспертов ВОЗ, частота анемии беременных в различных частях земного шара колеблется в широких пределах и составляет 15-90 %. (Егорова Н.А. 1996.; Lin F. К., Sugg S. S,,Word. 1991). В Великобритании и Франции частота анемии среди беременных составляет 15%, в Иордании - 50-65%, а в Индии -90%, что обусловлено различиями в уровне социально-экономического развития государств. В России анемию выявляют у 30-40 % беременных (Атаджанов Т.В. 1990.; Коноводова Е.Н.,Бурлев В.А.,1996.; Никитин Е.И., Корепанов A.M. и др. 1999).
В России в последние годы в связи с ухудшением социально-экономического статуса населения возросла заболеваемость ЖДА, особенно женщин и детей за последние 7-8 лет с 21%до 80%. По данным МЗ РФ за последние 10 лет частота этой патологии увеличилась в 6,3 раза. В республике Дагестан анемия при беременности наблюдается у 40-60% женщин (Омаров Н.С.-М.,1999).
Одним из факторов, способствующим развитию или усугублению гипоксии у матери является анемия, являющаяся наиболее распространенной патологией беременных, частота которой в России неуклонно возрастает. (World Health. 1991, Белокриницкая Т.Е., КузникБ.И.1993.; Егорова Н.А.1996.)
Несмотря на успехи, достигнутые в изучении и лечении заболеваний крови, проблема железодефицитной анемии (ЖДА) по-прежнему остается актуальной. Установлено, что дефицит железа является непосредственной причиной анемии у 49-99%.
На сегодняшний день накоплен большой материал по изучению особенностей гестации и перинатальных осложнений у беременных как при ЖДА, так и при резус-конфликте. В то же время особенности течения беременности при сочетании двух патологий остались вне поля зрения исследователей. Значимость данной проблемы обусловлена несколькими причинами: распространенностью этой патологии в популяции, существующими объективными и субъективными условиями развития резус-сенсибилизации и реализации ее в гемолитическую болезнь плода и новорожденного (ГБН), патофизиологическими изменениями фетоплацентарного комплекса, способствующими взаимоотягощающему влиянию сочетанной патологии на перинатальные исходы. Учитывая, что имеется тенденция к росту числа беременных как с ЖДА, так и с резус-конфликтом, становится очевидной актуальность изучения течения беременности и исходов гестации у женщин с Rh-отрицательной принадлежностью крови на фоне железодефицитной анемии.
Целью нашего исследования являлось усовершенствование системы пренатальной подготовки беременных с резус-отрицательной принадлежностью крови в сочетании с железодефицитной анемией.
Задачи исследования
- Изучить особенности течения беременности и родов у женщин с резус- отрицательной принадлежностью крови на фоне железодефицитной анемии.
- Изучить состояние фетоплацентарного комплекса в динамике у женщин с резус-отрицательной принадлежностью крови на фоне железодефицитной анемии.
- Изучить состояние новорожденного при сочетании резус-отрицательной принадлежности крови и железодефицитной анемии.
- Изучить морфологию плаценты.
- Разработать систему пренатальной подготовки женщин с резус-отрицательной принадлежностью крови в сочетании с железодефицитной анемией.
Научная новизна исследования
Впервые изучены особенности течения беременности и родов у женщин с резус-отрицательной принадлежностью крови в сочетании с анемией.
Впервые с использованием современных перинатальных и иных медицинских технологий изучено состояние фетоплацентарного комплекса в динамике.
Впервые изучена морфология плаценты при сочетании резус-отрицательной принадлежности крови и анемии.
На основании результатов проведенных исследований впервые разработана система пренатальной подготовки и родоразрешения женщин с резус-отрицательной принадлежностью крови в сочетании с анемией.
Практическая значимость
Результаты настоящего исследования имеют определенное значение для практического здравоохранения, так как могут быть использованы для прогнозирования, предупреждения и лечения осложнений гестации у женщин с резус-отрицательной принадлежностью крови в сочетании с анемией.
Показано, что, разработанная система пренатальной подготовки и родоразрешения женщин с резус-отрицательной принадлежностью крови в сочетании с анемией, эффективна, снижает частоту осложнений гестации у женщин с резус-отрицательной принадлежностью крови в сочетании с анемией и может быть применена в повседневной практике.
Внедрение результатов в практическое здравоохранение
Работа выполнена в рамках республиканской программы «Безопасное материнство» и по плану научно-исследовательских работ Дагестанского научного центра РАМН. Результаты исследования и разработки внедрены в практическую деятельность родовспомогательных учреждений Республики Дагестан.
Основные положения работы включены в программу подготовки интернов, клинических ординаторов и курсантов Дагестанской государственной медицинской академии.
Апробация работы
Основные положения работы и ее результаты доложены на очередном заседании ДНЦ РАМН (№5) 12 мая 2005г., а также на совместном заседании Ассоциации акушеров-гинекологов Республики Дагестан, сотрудников Научной проблемной лаборатории «Перинатальной медицины и репродуктологии» Дагестанского научного центра РАМН и кафедр акушерства и гинекологии Факультета повышения квалификации и последипломной подготовки специалистов и лечебного факультета Дагестанской Государственной Медицинской академии, как апробационной комиссии 23 июня 2006 г.
По материалам диссертации опубликовано 4 работы в виде научных статей и тезисов. Издана монография «Особенности гестации у женщин с резус-отрицательной принадлежностью крови и анемией».
Основные положения, выносимые на защиту.
1. Наличие у женщин с резус-отрицательной принадлежностью крови анемии, способствует возникновению резус-сенсибилизации и усугубляет различные осложнения течения беременности. Специфическая реактивность материнского организма при гестационном резус-конфликте на фоне железодефицитной анемии характеризуется наличием иммунопатологических реакций, которые отличаются максимальной выраженностью при наличии анемии среднетяжелой и тяжелой степени.
2. У беременных с резус-отрицательной принадлежностью крови на фоне железодефицитной анемии отмечаются нарушения как в маточно-плацентарном комплексе, так и в плодово-плацентарном кровотоке в отличие от ресус-конфликтной беременности, не осложненной анемией, где преобладают первоначальные изменения плодово-плацентарного кровотока.
3. Течение гестационного периода у женщин с резус-отрицательной принадлежностью крови в сочетании с железодефицитной анемии сопровождается дисфункцией фетоплацентарной системы, проявляющейся ускорением созревания плацентарной ткани на фоне морфологических изменений ее структуры с нарушением гемодинамических процессов.
4. Разработанная программа превентивной терапии и системы дородовой подготовки снижает частоту осложнений течения беременности, родов, послеродового периода, улучшает перинатальные исходы у женщин с резус-отрицательной принадлежностью крови в сочетании с железодефицитной анемией.
Объем и структура диссертации.
Диссертация состоит из введения, обзора литературы, изложения материалов и методов исследования, клинической характеристики обследованных больных, главы, освещающей результаты собственных исследований. Завершается работа обсуждением результатов исследований, выводами, практическими рекомендациями и указателем литературы.
Работа изложена на 169 страницах машинописного текста, содержит 40 таблиц и 14 рисунков.
Указатель литературы включает 255 источников, 110 – на русском языке и 145 – на иностранных языках.
Работа выполнена в Перинатальном центре Республики Дагестан (клиническая база кафедры акушерства и гинекологии факультета повышения квалификации и последипломной подготовки специалистов ДГМА), лабораториях Дагестанского научного центра РАМН, а также в Республиканской Станции Переливания Крови (РСПК) г.Махачкалы (главный врач - Кабардиева А.И.) и Хасавюртовской Станции Переливания Крови (ХСПК) г.Хасавюрта (главный врач – Хамзаева Н.Г.).
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования. В соответствии с целью исследования и для решения поставленных задач были обследованы различные группы беременных женщин. На этапе формирования групп наблюдения был использован метод рандомизации, обеспечивающий случайное распределение больных в группах, что позволяет добиться отсутствия различий между исследуемыми группами. Этим достигается снижение вероятности систематической ошибки в клинических исследованиях вследствие различий групп по каким-либо признакам.
Общее число обследованных составило 311 женщин. Основную группу составили 139 беременных с Rh-отрицательной принадлежностью крови в сочетании с анемией (Rh(-)+ЖДА). Для изучения эффективности проводимой терапии данную группу мы разделили на две подгруппы: 1А – 70 женщин с Rh-отрицательной принадлежностью крови на фоне анемии, которым проводилось лечение по разработанной системе пренатальной подготовки; 1В – 69 женщин, получивших курс антирезусной терапии по Грищенко и Персианинову в сочетании с антианемической терапией. В 1 группу сравнения объединены 72 пациентки с Rh-отрицательной принадлежностью крови (Rh(-)), во 2 группу сравнения - 50 беременных с железодефицитной анемией (ЖДА), 50 здоровых беременных женщин были обследованы в качестве контрольной группы.
В соответствии с поставленной целью и задачами в программу наших исследований было включено проведение клинико-статистического анализа особенностей гестации. Диагностика ГБП основывалась на результатах комплексного обследования матери и плода, которые включали в себя изучение анамнеза, определение группы крови матери и отца, титра резус-антител, ультразвуковую диагностику (эхографию с фето- и плацентометрией, включая определение биофизического профиля плода (БФПП)), допплерометрическое исследование кровотока в системе мать-плацента-плод, а также исследование околоплодных вод на содержание билирубина, общего белка, титра антител для определения степени тяжести ГБП. Всем беременным выполнялся стандарт обследования беременных женщин с учетом нозологии имеющейся патологии.
Проведены исследования реологических и коагуляционных свойств крови, электролитов и белкового состава крови, а также оценка объема кровопотери в родах и во время операции.
Критериями диагноза железодефицитной анемии считались: снижение гемоглобина ниже 103 г/л, ЦП ниже 0,85, количества эритроцитов ниже 3,51012 г/л, гематокрита менее, 0,33%, среднего объема эритроцитов ниже 72фл., содержания гемоглобина в эритроците ниже 25 пг., содержания сывороточного железа ниже 12,5 мкмоль/ль, сывороточного ферритина ниже 12 мкг/л (норма 32-35 мкг/л), коэффициент насыщения железа трансферрином ниже 16% (норма 30-50%), повышение ОЖСС выше 50,2 мкмоль/л (норма 30,6-84,6 мкмоль/л).
Измерялся объем плаценты с помощью УЗ-параметров по разработанным математическим формулам с учетом локализации плаценты в матке и формы ее плодовой поверхности. Определение БФПП проводили по шкале Vintzileos (1983), модифицированной Горюшиной Н.Б. и соавт. (1991) специально для беременных с резус-сенсибилизацией. Данная модификация отличается от исходной шкалы тем, что учитывается степень много-, а не маловодия, и толщину плаценты, а не степень ее зрелости, так как именно эти изменения характерны для ГБП. Состояние фетоплацентарного комплекса (ФПК) оценивали по результатам радиоиммунологичекого исследования концентрации плацентарного лактогена (ПЛ), эстриола (Э3) в крови беременных женщин.
Для изучения географического распространения той или иной группы крови среди популяций разных народов Республики Дагестан, нами был проведен анализ картотеки доноров Республиканской Станции Переливания Крови (РСПК) г.Махачкалы (главный врач - Кабардиева А.И.) и Хасавюртовской Станции Переливания Крови (ХСПК) г.Хасавюрта (главный врач – Хамзаева Н.Г.). Всего было обработано 28790 карточек доноров.
При анализе результатов плацентометрии проводили морфологическое исследование структурных компонентов плаценты и учитывали следующие морфологические показатели: диаметр (мм), толщина (мм), масса (г), объем (см3), площадь материнской поверхности (см3), плацентарно-плодовый индекс массы, межворсинчатый фибриноид (%), плодовый фибриноид (%), межворсинчатое пространство (%), количество капилляров в ворсинке, диаметр капилляров в ворсинке (мкм), толщина плацентарного барьера (мкм). Изучение морфологических особенностей в плацентах проводили с помощью гистологического метода окрашиванием гематоксилином-эозином.
В основу предложенной нами программы пренатальной подготовки беременных с резус-отрицательной кровью в сочетании с железодефицитной анемией входили: сбалансированная диета с содержанием 15 мг железа на каждые 1000 калорий; насыщающая терапия (до 300 мг/сут.) препаратом «Ферро-Фольгамма» при анемии легкой и среднетяжелой степени. При тяжелой анемии или, если прирост гемоглобина за неделю составлял менее чем на 7-8 г/л, парентеральная терапия Венофером в сочетании с рекомбинантным человеческим эритропоэтином Эпокрином по 50 МЕ/кг 3 раза в неделю для регуляции эритропоэза. В каждом триместре комплексное обследование матери и плода, которое включает определение титра резус-антител, эхографию с фето- и плацентометрией и допплерометрией, амниоцентез по показаниям. Для предотвращения изоиммунизации в резус-отрицательном организме женщины мы использовали иммуноглобулин человека антирезус Rh0(D), БэйРоу-Ди. С 16-18 недель проводили превентивную терапию фетоплацентарной недостаточности. В качестве метаболической терапии применялся поливитаминно-минеральный комплекс ЭЛЕВИТ Пронаталь. При высоком титре антител и отягощенном анамнезе проводили плазмаферез. Госпитализация за 2-3 нед. до предполагаемых родов для подготовки женщины к родоразрешению и комплексной оценки состояния плода с современных позиций перинатологии для выбора метода родоразрешения.
Программа подготовки женщин с Rh-отрицательной принадлежностью крови в сочетании с железодефицитной анемией к родам.
До 12 недель
|
20-24 недели беременности
|
32-36 недель беременности
|
| При признаках выраженного нарушении скорости кровотока в структурах фетоплацентарного комплекса на фоне сопутствующих осложнений у матери (гестоз и др.) и признаков развития ГБП – кесарево сечение в интересах плода | При нормальном состоянии матери и плода, отсутствии патологических изменений при комплексном исследовании ФПК – роды через естественные родовые пути. |
Рис. 1. Тактика подготовки беременных с Rh-отрицательной принадлежностью крови в сочетании с ЖДА к родам в зависимости от срока гестации.
Обработка полученных данных проводилась на персональном компьютере типа Pentium IV при помощи электронных таблиц Microsoft Excel XP Professional 2003 с использованием методов параметрической статистики. Вычислялись среднее арифметическое, ошибка средней арифметической. Все полученные данные подвергались статистическому анализу с помощью стандартных пакетов программ анализа «Биостат». Статистическую обработку данных проводили с помощью t-критерия Стьюдента и точного f-критерия Фишера с учетом неоднородности дисперсий в исследуемых группах c помощью критерия Манна-Уитни. Данные представлены в виде средней ± ошибка средней. Результаты оценивались с уровнем значимости р < 0,05.
Результаты исследования и их обсуждение. Для изучения географического распространения той или иной группы крови среди популяций разных народов Республики Дагестан, нами был проведен анализ картотеки доноров. Всего было обработано 28790 карточек доноров.
Нами отмечено, что в Кумторкалинском, Карабудахкентском, Буйнакском, Каякентском и Бабаюртовском районах, относящихся к Терско-Сулакской низменности и предгорным районам Дагестана, где большую часть населения составляют кумыки (67,5-44%), а также в Ногайском районе, где основная часть населения – ногайцы (87%), проживающие, кроме того, и в Бабаюртовском, Тарумовском и Кизлярском районах (16-7,8%) значительно чаще, чем в других районах, встречается III(В) группа крови (22,8-35,5%). Интенсивный показатель частоты Rh отрицательной крови среди данных народностей составляет 43,2-58,4 человек на 1000 населения (4,3-5,8%), что в 2,5-3 раза реже относительно других районов.
В Ахвахском, Ботлихском, Гергебильском, Гумбетовском, Гунибском, Казбековском, Тляратинском, Унцукульском, Хунзахском, Цумадинском, Цунтинском, Чародинском и Шамильском районах, относящихся к западному горному Дагестану, коренным населением которого являются аварцы, а также в Акушинском, Дахадаевском, Кайтагском, Левашинском районах - горные регионы среднего Дагестана, заселенные даргинцами, около половины населения имеют I(0) группу крови (47,3-52,2%), что несколько выше относительно общеевропейских показателей (40-45%). Rh отрицательная кровь, наблюдается у 124,1-147,3 человек на 1000 населения (12,4-14,7%), что совпадает с данными показателями среди населения большинства европейских стран.
Средний возраст обследованных нами женщин колебался от 17 до 44 лет и составил в среднем: в основной группе – 23,4±3,2 года, в 1 группе сравнения - 23,9±4,2 года, во 2 группе сравнения – 22,8±4,8 года и 23,6±2,5 года в контрольной группе.
Наиболее важными факторами, отражающими специфические функции женского организма и оказывающими непосредственное влияние на течение беременности и родов, возникновение анемии, несомненно, являются менструальная и репродуктивная функции. Нами выявлено, что нарушения менструальной функции носящие, в основном, функциональный характер, чаще встречались у 12,3% обследованных в основной группе и у 14,0% во 2 группе сравнения (4,2% у женщин с Rh-отрицательной принадлежностью крови и 4% у здоровых), что, вероятно, способствовало или было причиной развития анемии у данной категории женщин.
Среди обследованных преобладали повторнобеременные женщины – 84,9%, 77,8%, 82,0% и 68,0% в основной, 1 и 2 группах сравнения и в контрольной группе соответственно. С увеличением числа беременностей возрастает вероятность иммунизации. Кроме того, имеется четкая коррелятивная зависимость частоты и тяжести анемии от срока беременности, паритета, длительности интервалов между родами (Омаров С.-М.А., Хакимова С.Х., 1993). Надо отметить, что промежуток между родами у 55,4% в основной группе и у 58,0% во 2 группе сравнения был менее трех лет, а по данным ряда авторов (Омаров С.-М.А., Омаров Н.С.-М., 1999; Дворецкий Л.И., 1998; Егорова Н.А., 1996), чтобы восстановить депо железа в организме женщины, необходимо 4 года и более.
Самопроизвольные аборты, отмеченные в основной группе у 20,9%, у 15,3% в 1 группе сравнения (Rh(-)) и 8,0% во 2 группе сравнения (ЖДА), в большинстве случаев были причинно связаны с травмой, инфекционным заболеванием, воспалительными процессами внутренних половых органов. Вероятно, на ранних сроках беременности они скорее являются не следствием, а причиной резус сенсибилизации. Сопутствующая анемия сопровождается угнетением иммунологической реактивности организма, защитно-приспособительные реакции в отношении инфекционных осложнений, что подтверждается высокими показателями данного осложнения в основной группе относительно других групп сравнения.
Наличие в анамнезе самопроизвольных выкидышей является отягощающим моментом, так как с одной стороны может говорить об уже имевшейся сенсибилизации в предыдущие беременности, а с другой – оказывать сенсибилизирующее влияние на организм женщины с Rh-отрицательной принадлежностью крови. По данным различных авторов (Садыков Б.Г., Абдрахманова Л.Р., 1998; Гуревич П.С., 1992; Skrzypulec J., Wawryk W., 1973) иммунизация в этом случае наступает у 3-6% женщин.
Невынашивание беременности может быть связано с недостаточной выработкой прогестерона, который способствует благоприятному течению беременности. Благодаря повышенному содержанию прогестерона, клетки эндометрия продуцируют секреторный компонент, который снижает синтез простагландина, обеспечивая покой матке. С другой стороны, высокая концентрация прогестерона блокирует клеточный иммунный ответ на чужеродные антигены. Под влиянием прогестерона иммунокомпетентные клетки синтезируют прогестерон-индуцированный блокирующий фактор (PIBF), который запускает реакцию, ингибирующую отторжение плода (Szekeres-Bartho J., 2001). Кроме того, прогестерон стимулирует местно продукцию протеинов (Tj 6), которые вызывают апоптоз естественных киллеров в эндометрии. Таким образом, снижение выработки прогестерона способствует не только невынашиванию беременности, но и повышает вероятность развития гемолитической болезни плода и новорожденного, увеличивая проницаемость плацентарного барьера.
Основной причиной невынашивания беременности у женщин с анемией является фетоплацентарная недостаточность на фоне гемической и тканевой гипоксии, обменно-эндокринных, иммунных и иных нарушений. Происходит гипоплазия плаценты, снижение уровня вырабатываемых гормонов: хориального гонадотропина, прогестерона, эстрадиола, плацентарного лактогена (Омаров Н.С.-М., 1999; Гаврилов В.Я., Немиров Е.К., 1991). Поэтому закономерным является факт обнаружения высокого процента невынашивания в акушерском анамнезе беременных в основной группе относительно сравниваемых групп – 20,9% в сравнении с 15,3% в 1 группе сравнения, 8,0% во 2 группе сравнения и 2,0% в контрольной группе.
Экстрагенитальная патология часто ухудшает прогноз течения беременности у женщин с Rh-отрицательной принадлежностью крови. Женщины в обследуемых группах имели в анамнезе от 1 до 5 экстрагенитальных заболеваний, в 100% случаев в основной группе и 2 группе сравнения при настоящей беременности была диагностирована железодефицитная анемия. Женщины контрольной группы были соматически здоровы.
Общая соматическая патология значительно чаще встречалась в основной группе и 2 группе сравнения относительно 1 группы с Rh-отрицательной принадлежностью крови. Одновременно несколько очагов хронической инфекции выявлялось в 15,8% в основной группе, в 11,1% в 1 группе сравнения, в 14,0% во 2 группе сравнения.
Следует отметить, что 52,5% женщин из основной группы и 46,0% из 2 группы сравнения указали на заболевание анемией в прошлом, связывая это с предыдущими беременностями и родами. Более того, у 35,3% в основной группе и 30,0% во 2 группе сравнения настоящая беременность наступила на фоне неизлеченной анемии, которая имела прогрессирующий характер. В обследованных группах большинство женщин с ЖДА в анамнезе вне беременности не находилось на диспансерном учете и не получало систематического лечения.
Среднетяжелая анемия была диагностирована в основной группе у 42,4% женщин и у 40,0% 2 группы сравнения, тяжелая – у 14,4% и 14,0%, легкая – у 43,2% и 46,0% соответственно.
При анемии, в зависимости от ее тяжести, отмечается угнетение иммунологической реактивности организма. Иммунологические сдвиги проявляются в виде снижения фагоцитарной активности лейкоцитов и комплементарной активности сыворотки крови, дефицита циркулирующих Т-лимфоцитов, а в случаях тяжелой формы анемии – снижения уровня В-лимфоцитов в периферической крови (Казиева С.Э., 1999). Поэтому повышение частоты инфекционных заболеваний при анемии беременных, наряду с другими причинами, может быть обусловлено угнетением иммунологической реактивности организма.
По мнению многих авторов, повышенная чувствительность к резус-фактору есть проявление гипераллергической реакции организма (Т.Г. Соловьева, 1956; Woodrow D., 1968). Аллергологический анамнез был отягощен у 24,5% обследованных в основной группе, 16,7% в 1 группе сравнения и 18,0% во 2 группе сравнения. Кроме того, в основной группе одна женщина страдала геморрагическим васкулитом.
Проявлением гипераллергической реакции организма являются также иммунологически зависимые повреждения слизистой оболочки кишечника, связанные с феноменом пищевой непереносимости, который считается основным патогенетическим фактором такого хронического страдания, как синдром раздраженного кишечника. Это в свою очередь может способствовать нарушению всасывания железа в желудочно-кишечном тракте, способствуя развитию железодефицитной анемии.
Хронические энтероколиты имели место у 29,5% женщин в основной группе, 19,4% в 1 группе сравнения и 24,0% во 2 группе сравнения, тогда как в контрольной – лишь у 1 (2,0%).
Учитывая патогенетические особенности течения беременности у женщин с Rh-отрицательной принадлежностью крови, а также осложнения гестации, развивающиеся на фоне анемии, нами была разработана программа пренатальной подготовки беременных с сочетанной патологией. Для изучения эффективности проводимой терапии основную группу (139 женщин с сочетанной патологией) мы разделили на две подгруппы: 1А – 70 женщин с Rh-отрицательной принадлежностью крови на фоне анемии, которым проводилось лечение по разработанной системе пренатальной подготовки; 1В – 69 женщин, получивших курс антирезусной терапии по Грищенко В.И. и Персианинову Л.С. в сочетании с обычной антианемической терапией.
Лечение ЖДА включало рациональное питание, насыщающую терапию (до 300 мг/сут.) препаратом железа для приема внутрь «Ферро-Фольгамма» с последующим переходом на поддерживающую (100 мг/сут.). Продолжительность насыщающей терапии определялась темпами прироста гемоглобина (не менее 4 недель). Одновременно проводилась коррекция дефицита микроэлементов, витаминов, белка; ликвидация гипоксии организма; нормализация гемодинамики, системных, обменных и органных нарушений; профилактика и лечение акушерских осложнений, профилактика и лечение фетоплацентарной недостаточности.
Терапия препаратами железа считалась эффективной при приросте гемоглобина за неделю на 7-8 г/л. В том случае, если такой эффект не достигался, переходили на парентеральную терапию сахарозным комплексом железа – «Венофер».
Кумулятивная доза Венофера распределялась на разовые дозы по 100 мг железа (одна ампула препарата Венофер) и вводилась не более трех раз в неделю. Однако, при клинических состояниях, требующих быстрой доставки железа к местам его хранения в организме, дозу увеличивали до 200 мг железа и вводили не чаще трех раз в неделю.
Пациенткам с анемией II-III степени вводили подкожно 3 раза в неделю Эпокрин (рчЭПО), начальная доза препарата была 50 МЕ/кг 3-6 раз. Эту дозу поддерживали до повышения уровня гемоглобина.
Для предотвращения изоиммунизации использовали иммуноглобулин человека антирезус Rh0(D) БэйРоу-Ди, для внутримышечного применения в дозе 300 мкг при сроке 13-18 недель, 26-28 недель, а также в случае проведения амниоцентеза.
В связи с высокой частотой развития такого осложнения беременности, как ФПН, в качестве профилактики у женщин Rh-отрицательной принадлежностью крови в сочетании с ЖДА применяли дюфастон в суточной дозе 20 мг до 16-18 недель беременности, который способствует полноценному формированию плаценты, или утрожестан по 200-300 мг в сутки, а также антиагреганты (курантил, кардиомагнил).
В качестве метаболической терапии применялся поливитаминно-минеральный комплекс ЭЛЕВИТ Пронаталь внутрь по 1 таблетке в сутки после еды, запивая небольшим количеством воды в течение всей беременности и в период грудного вскармливания.
В 20-24 нед. мы проводили плановую госпитализацию для тщательного обследования беременной и коррекции проводимой терапии. Диагностика ГБП основывалась на результатах комплексного обследования матери и плода, которое включало определение титра резус-антител, эхографию с фето- и плацентометрией, амниоцентез по показаниям.
При высоком титре антител и отягощенном анамнезе мы проводили плазмаферез по 3-5 процедур на курс лечения с I триместра, 3-4 курса за беременность. Противопоказаниями к проведению ПФ были выраженные органические изменения со стороны сердечно-сосудистой системы, анемия (Нb ниже 100 г/л), гипопротеинемия (уровень белка ниже 55 г/л), гипокоагуляция, иммунодефицитные состояния.
Для проведения профилактического курса терапии фето-плацентарной недостаточности назначали актовегин по 2мл 4% раствора (80мг) в 200мл 5% раствора глюкозы в/в капельно, через день, 5 инфузий, или per os по 1 таблетке 3 раза в день 3 курсами по 3-4 недели, в каждом триместре беременности. В курс профилактики фетоплацентарной недостаточности мы включали оксигенотерапию (всего 8-10 процедур).
В 32-36 недель, даже при отсутствии клинических признаков развития данного осложнения, курс терапии фетоплацентарной недостаточности повторяли. Кроме того, в этом сроке гестации необходимо еще раз проводили комплексную оценку (УЗИ, допплерометрия, КТГ, определение БФПП) состояния фетоплацентарного комплекса для определения дальнейшей тактики ведения беременности.
Последняя плановая госпитализация осуществлялась за 2-3 нед. до предполагаемых родов для подготовки женщины к родоразрешению, для составления плана родоразрешения, проведения мероприятий по профилактике развития ГБ плода и новорожденного и осложнений родов и послеродового периода.
Мы расширяли показания к проведению абдоминального родоразрешения во время беременности в интересах плода, не дожидаясь развития родовой деятельности. Это было обусловлено тем, что глубокие нарушения маточной гемоциркуляции у женщин с Rh-отрицательной принадлежностью крови в сочетании с анемией, развивающиеся с началом родовых схваток, представляют особую опасность в плане развития гипоксического состояния у плода (за счет существенного снижения объемной скорости кровотока через интравиллезное пространство).
Женщины без отягощенного ГБП анамнеза, с низким титром антител и нормальными параметрами оценки состояния плода были родоразрешены при доношенной беременности. При появлении признаков страдания плода производилось досрочное родоразрешение после проведения мероприятий по профилактике РДС, с готовностью в вене, с достаточным запасом свежезамороженной плазмы, с постоянным контролем (УЗИ, КТГ, допплер) за состоянием плода. Для достижении зрелости шейки матки применяли простагландины Е1 в виде вагинального геля или вводили ламинарии в цервикальный канал. При достижении зрелости шейки матки, проводили родовозбуждение амниотомией, особенно показанное при многоводии, с последующим введением простагландинов. При тяжелых формах ГБП родоразрешали путем операции кесарева сечения с применением длительной перидуральной анестезии (ДПА). При применении ДПА значительно улучшается кровообращение в маточно-плацентарном комплексе, что позволяет увеличить поступление кислорода к плоду, страдающему ГБ. С целью профилактики кровотечения в раннем послеродовом периоде вводили окситоцин и эргометрин в/м, сайтотек - per rectum.
Всем родильницам с ресус-отрицательной кровью, родившим детей с резус-положительной принадлежностью крови вводили 300 мкг иммуноглобулина человека антирезус Rh0(D) БэйРоу-Ди. При операции кесарева сечения, ручном удалении последа, дозу увеличивали до 600 мкг.
Сравнительный анализ гематологических показателей, проведенный при заборе крови через 3 недели после начала лечения, свидетельствовал, что в 1А группе имелось повышение уровня гемоглобина на 17,2% относительно 1В группы. Средний прирост Hb за неделю составлял 7,9±0,3 г/л в 1А группе, 7,0±0,4г/л в 1В группе и 7,1±0,2 г/л во 2 группе сравнения (ЖДА). Еще более значительной была динамика показателя сывороточного железа, концентрация которого возросла в 1,3 раза относительно сравниваемых групп. У 52,5% женщин в из 1А группы уровень сывороточного железа соответствовал норме.
Через 21 день после начала лечения количество эритроцитов у основного большинства женщин в 1А группе было близким к нормальному (4,1±0,31012 г/л). Эритроциты с измененной морфологией встречались в 2 раза реже, чем в 1В группе и 2 группе сравнения. В подавляющем большинстве случаев в 1А группе отмечен ретикулоцитоз, что свидетельствовало о положительной реакции интрамедуллярного эритроидного кроветворения на адекватно подобранную антианемическую терапию.
При определении наличия фетальных эритроцитов в крови матери методом Kleihauer-Betke, положительной проба была у 21,4% женщин в 1А группе, 26,1% в 1В группе и 18,1% в 1 группе сравнения (Rh(-)). Впоследствии у всех новорожденных от этих матерей наблюдалась ГБ. Кроме того, отмечена зависимость частоты обнаружения фетальных эритроцитов в крови матери от степени тяжести анемии, что, вероятно, связано с усилением дистрофических процессов в плаценте и нарушением ее проницаемости при тяжелой анемии.
При анализе характера изменения титра антител имеет значение частая смена подъемов и спадов титра неполных антител («скачущий титр») в первой половине беременности, которая является характерным признаком возникновения между матерью и плодом иммуноконфликтных реакций. Снижение уровня титра антител с течением беременности является также неблагоприятным признаком, т.к. уменьшение концентрации антител происходит в результате перехода их к плоду, однако может быть и результатом эффективности проводимого лечения.
Таблица 1.
Величина титра резус антител у женщин в обследованных группах.
| Титр антител | Основная группа | 1 группа сравнения | ||||
| 1А | 1В | |||||
| до лечения | после лечения | до лечения | после лечения | до лечения | после лечения | |
| нет | 44,3 | 70,0 | 42,1 | 50,7 | 58,3 | 65,3 |
| 1:2 – 1:8 | 31,4 | 21,4 | 33,3 | 30,5 | 23,6 | 22,2 |
| 1:16 -1:32 | 14,3 | 8,6 | 13,0 | 11,6 | 12,5 | 8,3 |
| 1:64 – 1:128 | 7,1 | - | 8,7 | 7,2 | 5,6 | 4,2 |
| 1:256 – 1:1024 | 2,9 | - | 2,9 | - | - | - |
Р<0,05
При наличии железодефицитной анемии антитела в сыворотке крови в первой половине беременности выявлялись в 1,9 раза чаще, чем у женщин без этой патологии (таб. 1), причем отмечалась прямая коррелятивная зависимость от степени тяжести анемии. Проведение полноценной пренатальной подготовки позволяло снизить эти показатели в 1,3 раза. Во второй половине беременности впервые антитела возникали у беременных с анемией в 1,4 раза чаще. Также имелась прямая зависимость частоты появления антител от степени тяжести анемии, а проведение комплексной уменьшало эти показатели в 1,2 раза в 1А группе относительно 1В группы.
Проведение комплексной терапии при резус-сенсибилизированной беременности и анемии позволяет значительно уменьшить титр антител к исходу беременности. Число женщин без антител в сыворотке увеличилось в 1А группе относительно исходных в 1,6 раза, что значительно лучше, чем в 1В группе, где показатель увеличился в 1,2 раза, в 1 группе сравнения – в 1,1 раза. Уменьшилось число женщин с титром антител от 1:2 до 1:8 на 31,8% в 1А группе, в 1В группе – на 8,4%, в 1 группе сравнения - на 5,9%. Таким образом, в 1А группе показатели титра антител после комплексной терапии улучшились относительно показателей в 1В группе и 1 группы сравнения. Это подтверждает эффективность проводимой нами пренатальной подготовки в основной группе.
Было установлено, что у 10,1% женщин 1В группы титр антител нарастал в течение беременности, что в 1,7 раза чаще, чем у беременных без анемии (5,6%). Наиболее неблагоприятный «скачущий титр» отмечен у беременных с анемией в 2,1 раза чаще, чем в группе сравнения (4,3% и 1,4% соответственно), подтвердившийся впоследствии рождением детей с ГБ среднетяжелой и тяжелой степени тяжести. Эффективность комплексной превентивной терапии подтверждается тем, что у женщин из 1А группы титр антител возрастал лишь у 5,7%, что в 1,4 раза меньше, чем в 1В группе, а «скачущий титр» наблюдался в 1,4 раза реже.
По мнению многих исследователей (Сичинава Л.Г, 1989; Панина О.Б., 1989), большое значение в диагностике тяжести ГБП имеет не толщина плаценты, а ее объем, так как толщина превышает норму лишь у 1/3 пациенток, а при среднетяжелой и тяжелой форме заболевания у 2/3 больных. Установлено, что при ГБП объем плаценты увеличен по сравнению с неосложненной беременностью при всех степенях тяжести, но наибольший прирост объема плаценты наблюдается при тяжелой форме заболевания. По данным Горюшиной НБ. (1996), при легкой форме ГБП увеличение объема плаценты составляет в среднем – на 69,03±6,01 см3 у 75% беременных, при средней степени тяжести – на 221,12±19,26 см3 у 84% пациенток и при тяжелой форме заболевания – на 421,05±39,59 см3 у 95% беременных.
Как показали наши исследования (рис.2,3), подобная динамика наблюдалась в 1А и в 1 группе сравнения (Rh(-)), то есть с увеличением тяжести ГБП повышалась частота увеличения объема плаценты.
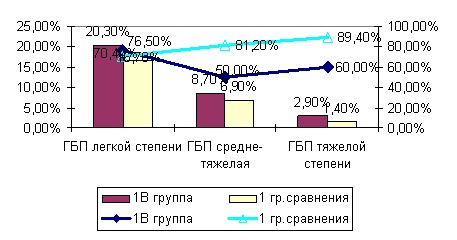
Рис. 2. Частота ГБП различной степени тяжести и частота обнаруженного при этом увеличения объема плаценты в обследованных группах (%).
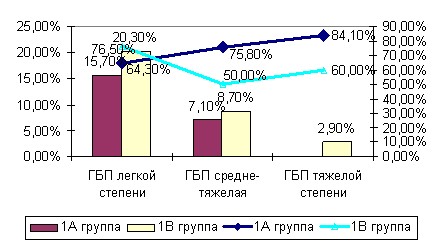
Рис. 3. Частота ГБП различной степени тяжести и частота обнаруженного при этом увеличения объема плаценты в обследованных группах в зависимости от проведенной терапии (%).
Однако при резус-конфликте и анемии в 1В группе в 30,0% случаев при средне-тяжелой степени ГБП и 40,0% при тяжелой ГБП наблюдалось уменьшение объема плаценты. Федорова М.В., Калашникова Е.П.(1986) объясняют этот факт тем, что объем плаценты может быть снижен, если гемолитическая болезнь развивается на фоне плацентарной недостаточности. Сниженный объем плаценты при таком диагнозе является неблагоприятным прогностическим признаком и связан с тяжестью ЖДА.
Гипоксическое состояние плода различной степени тяжести во время беременности, осложненной резус-сенсибилизацией, обусловлено не только наличием анемии, имеющейся в основной группе, и метаболических нарушений, развивающихся при гемолитической болезни, но и выраженными изменениями в плаценте. Дистрофические изменения в плаценте, развивающиеся в результате анемии у матери не только способствует, но и усугубляют внутриутробное страдание плода. В ответ на гипоксию реагируют различные органы и системы плода, но в первую очередь страдает ЦНС плода. Это определяется, во-первых, относительно более высокой чувствительностью ЦНС к гипоксии и непрямому билирубину, во-вторых, ролью ее в регуляции обмена и функции других систем организма, в частности дыхательной, двигательной активности, мышечного тонуса и реактивности сердечной деятельности плода.
Средняя оценка БФПП в 1А группе составила 7,6±0,03 баллов, в 1В группе – 7,8±0,07 баллов, в 1 группе сравнения - 8,1±0,06 баллов, во 2 группе сравнения – 8,4±0,04 балла, в контрольной - 11,2±0,04 баллов.
БФПП, оцененный, как сомнительный или патологический, получили в 1А группе 12,9%, в 1В группе 13,1%, в 1 группе сравнения – 9,7%, что в 1,3 раза реже относительно 1А и 1В групп, во 2 группе сравнения – 8,0%. Таким образом, сочетание Rh-отрицательной принадлежности крови и анемии значительно ухудшает состояние плода.
Средняя оценка БФПП в зависимости от проводимой терапии в 1А группе составила 8,8±0,03 баллов, в 1В группе – 8,3±0,02 балла, в 1 группе сравнения – 8,9±0,07 баллов, во 2 группе – 8,8±0,06 балла, в контрольной – 11,2±0,03 баллов. Эти показатели подтверждают эффективность проводимых лечебно-профилактических мероприятий в 1А группе.
При благоприятной оценке БФПП дети рождались в удовлетворительном состоянии, ранний неонатальный период у них протекал гладко.
При обследовании женщин, выявлено, что у женщин с Rh-отрицательной принадлежностью крови и анемией происходит повышение периферической сосудистой резистентности в маточных артериях, артерии пуповины плода. Однако оно менее выражено, чем в 1 группе сравнения, в которой иммунологическая несовместимость по Rh-фактору не осложнена сопутствующей анемией. Установлено, что во всех группах с Rh-отрицательной принадлежностью крови и анемией фетоплацентарная недостаточность развивается как по типу первоначальных изменений плодово-плацентарного кровотока, так и по типу первичных нарушений гемодинамики в маточно-плацентарном бассейне с постепенным последующим вовлечением в процесс пуповины и аорты плода.
Так, среди 64,3% обследованных в 1А группе с выявленными изменениями показателей КСК той или иной степени, гемодинамические нарушения с первичным вовлечением плодово-плацентарного звена кровотока наблюдались у 22,9% беременных, тогда как первоначальные изменения гемодинамики в маточно-плацентарном бассейне обнаруживались у 41,4%, в 1В группе из 60,9% соответственно у 23,2% и 37,7%. В 1 группе сравнения, наоборот, из 51,4% беременных с ФПН соответствующие изменения кровотока наблюдались в 40,3% и 11,1% случаев. Таким образом, при наличии анемии, в большинстве случаев, изменения гемодинамики в МППК начинаются с нарушений в маточно-плацентарном бассейне, при резус-конфликтной беременности без анемии – по типу первоначальных изменений плодово-плацентарного кровотока.
Наибольшую диагностическую ценность имеет допплерометрическая оценка кровотока в средней мозговой артерии плода, и именно она является решающей в тактике перехода от неинвазивных методов оценки степени тяжести ГБП к инвазивным (Mari N., 1995; Gottvall T. et al.,1994). При анемии отмечается значительное повышение скорости кровотока в средней мозговой артерии плода, которая коррелирует с тяжестью анемии при ГБП. (Whitecar P., 2000; Detti L., 2001). У 2,3% в 1А и 4,3% в 1В группе, а также у 2,8% в 1 группе сравнения при проведении допплерометрического исследования выявлено снижение индексов сосудистого сопротивления в средней мозговой артерии. Это говорит о сниженной плацентарной перфузии вследствие тяжелой гипоксии. Новорожденные от этих пациенток были рождены со среднетяжелой и тяжелой степенью ГБП, с ЗВРП 1-2ст.
Проведенная превентивная терапия в основной группе оказалась достаточно эффективной. Курсы метаболической терапии позволили снизить вероятность и тяжесть развития нарушений ФПК. В 1А группе тенденция к улучшению МППК отмечалась у 72,9%, в 1В группе у 54,3%, в 1 группе сравнения у 58,2% беременных с гемодинамическими изменениями МППК I А и I В степени.
Лечение при гемодинамических нарушениях МПК II и III степени было малоэффективным, но в 1А группе частота развития их в 1,4 раза меньше относительно 1В группы.
Образующиеся в процессе гемолиза эритроцитов плода токсины оказывают повреждающее действие на фосфолипиды и белки клеточных мембран, способствуя тем самым развитию ферментативной и гормональной недостаточности плаценты. Нарушение процессов фосфорилирования, гипо- и диспротеинемия, метаболический ацидоз при ГБП изменяют иммунные реакции, синтез гормонов и простагландинов в плаценте.
Установлено, что уровни экскреции эстриола и ПЛ снижаются до появления клинических признаков развития ГБ плода, поскольку синтез эстриола во время беременности протекает при активном участии плода, а сам гормон является продуктом единой фетоплацентарной системы. Поэтому определение концентрации ПЛ и эстриола в сыворотке крови беременных является достоверным методом диагностики состояния ФПС. Однако при значительном увеличении объема плаценты, наблюдающемся при ГБ тяжелой формы, экскреция эстриола часто бывает нормальной или даже повышенной, несмотря на угрожаемое состояние плода [79].
При первоначальном исследовании уровень ПЛ у беременных с резус-конфликтом и анемией (22,9%) был понижен относительно показателей в 1 группе сравнения. На фоне проводимых превентивных мероприятий уровень ПЛ в 1А группе заметно повысился на 11,8% относительно 1В группы и достиг нормальных значений. В данном случае, по-видимому, напряжённость защитно-приспособительных процессов, возникающая в организме женщин с ГБП, приводит к включению компенсаторно-приспособительных механизмов в плаценте, направленных на коррекцию обмена веществ в системе мать - плацента - плод. Это предположение подтверждается работами многих авторов (Савельева Г.М., Клименко П.А., 2004; Miller D.A., Chollet J.A., Goodwin T.M., 1997), обнаруживавших при исследовании плаценты у беременных с ГБП признаки внутриклеточной гипертрофии, свидетельствующей о тенденции к компенсации нарушенной функциональной активности органа.
С целью выяснения особенностей влияния Rh-отрицательной принадлежности крови и анемии на морфологическую структуру плаценты нами было исследовано 123 плаценты от рожениц основной группы - женщин с Rh-отрицательной принадлежностью крови и анемией и 50 плацент от практически здоровых женщин - контрольная группа.
У большинства родильниц основной группы 112 (80,5%) макроскопически выявлялись изменения в плацентах. Эти плаценты отличались отсутствием характерного блеска, наличием явлений отека и окрашиванием мекониалъными массами, ткань их рыхлая. На плодовой поверхности плацент отчетливо выступали наполненные кровью сосуды, на материнской - свежие инфаркты темно-красного цвета.
При осмотре материнской поверхности выявлена неравномерная толщина отдельных долей плацент по сравнению с группой контроля. Во многих участках плаценты отмечаются очаги некроза, склероз отечных ворсин. При тяжелой гемолитической желтухе чаще наблюдался не отечный, а гипопластический тип плаценты. В последах женщин с Rh-отрицательной принадлежностью крови и анемией значительно чаще отмечались очаги обызвествления, что, также вызывает нарушение маточно-плацентарной циркуляции.
Из общего числа 123 плацент от пациенток основной группы, в толще их у 30,8% обнаружены геморрагические инфаркты. Ишемические инфаркты отмечены у 4,1% плацент. Межворсинчатые тромбы среди плацент основной группы встречались у 18,6%, склероз отечных ворсин – у 27,6%.
Гипотрофия встречалась в плацентах родильниц основной группы в 4,1% случаев. Гипертрофия в основной группе составила 17,1%.
При макроскопическом осмотре обращал на себя внимание кальциноз плаценты у 16,2% родильниц с Rh-отрицательной принадлежностью крови на фоне анемии. Следовательно, уже только макроскопический вид последа свидетельствует о морфологических изменениях в плаценте, которые в основной группе наблюдаются в более чем в 91,1% случаев.
При микроскопическом исследовании наиболее часто наблюдались аномалии созревания плацент, так, ворсины с фибриноидными изменениями в хориальной пластинке выявлены у 13,8% женщин основной группы, отечные терминальные ворсины были характерны для 28,7% плацент, очаговая гиперплазия терминальных ворсин выявлена у 11,3%, диссоциированное созревание отмечено у 7,3% плацент.
На втором месте по частоте определена активация инволютивных процессов у 38,2% женщин с Rh-отрицательной принадлежностью крови и анемией. Так, полнокровные ворсины с обилием клеток Ланхганса и Кащенко-Гофбауэра в основной группе встречались в 15,4% случаев. Очаговая ангиопатия выявлялась в 15,4% плацент. Субтотальная ангиопатия была выявлена у 7,3% пациенток основной группы.
На третьем месте по частоте определены аномалии развития сосудов у 18,6%, из них наиболее часто выявлялась гиперплазия сосудов ворсин у 9,7%.
Суммируя вышесказанное, определено, что у 97,6% родильниц Rh-отрицательной принадлежностью крови и анемией определены микроскопические изменения в плацентах.
Результаты проведенных исследований показали, что течение беременности и родов у женщин с Rh-отрицательной принадлежностью крови и анемией сопровождается более частыми и тяжелыми осложнениями, как со стороны матери, так и со стороны плода в сравнении с группами, в которых наблюдалась одна из этих патологий.
Однако в группе беременных с Rh-отрицательной принадлежностью крови и анемией, получивших комплексную дородовую подготовку, процент осложнений намного меньше, чем в 1В группе и 1 группе сравнения. В 1А группе нами отмечено понижение частоты угрозы прерывания беременности - на 7,4%, гестоза - на 6,0%, ФПН - на 19,2% случаев относительно 1В группы.
Раннее проявление признаков ГБП и резистентность ее к проводимой терапии при резус-конфликтной беременности являлось показанием к досрочному прерыванию беременности и программированному варианту родов или абдоминальному родоразрешению в зависимости от состояния плода. Родами через естественные родовые пути завершились в 1А группе 82,9% беременностей, в 1В группе – 79,7%, в 1 группе сравнения (Rh(-)) – 86,1%, во второй группе сравнения (ЖДА) – 86,0%, в контрольной – 92,0%.
Особое место среди осложнений в родах занимает аномалия родовой деятельности, а именно слабость родовых сил. В развитии слабости родовой деятельности значительную роль играет выявленное нами при исследовании состояния ФПК нарушение нейрогуморальных взаимоотношений, снижение гормонпродуцирующей функции плаценты, наиболее выраженное в 1В группе.
Проведенная полноценная пренатальная подготовка в 1А группе позволила снизить частоту осложнений родов и послеродового периода, в том числе в 1,4 раза меньше частота несвоевременного излития околоплодных вод, в 1,3 раза реже случаи аномалии родовой деятельности относительно 1В группы, что является следствием преимущественно программированного ведения родов в 1А группе. Во всех случаях гипоактивности матки проводилась родостимуляция путем внутривенного введения простагландинов. Кроме того, у женщин 1А группы имело место снижение процента оперативного родоразрешения в 1,2 раза относительно 1В группы. В 1,6 раза меньше случаев разрыва мягких тканей родовых путей, в 2,4 раза - гипотоническое кровотечение.
В результате проведенных нами исследований, выявлено, что наличие анемии у женщин с Rh-отрицательной принадлежностью крови способствует возникновению резус-сенсибилизации и усугубляет ее течение. В 1В группе ГБН развилась в 1,3 раза чаще, чем в 1 группе сравнения.
Таблица 2.
Частота и формы течения ГБН в обследованных группах.
| Формы ГБН | 1А группа | 1В группа | Rh(-) |
| Анемическая | 8,7 | 15,9* | 9,7 |
| Желтушная | 11,4 | 11,7 | 13,9 |
| Отечная | 2,9 | 4,3* | 1,4 |
| Всего | 22,8 | 31,9* | 25,0 |
*Р<0,05
Результаты наших исследований показали достоверное снижение частоты осложнений у новорожденных в раннем неонатальном периоде у женщин с Rh-отрицательной принадлежностью крови и анемией при применении разработанной нами программы пренатальной подготовки. Так, средняя оценка новорожденных по шкале Апгар на первой и пятой минуте выше, переведены в отделение патологии новорожденных для дальнейшего выхаживания 8,6% детей, что в 1,8 раза меньше относительно 1В группы (15,9%). Гипоксическое поражение ЦНС оказалось наиболее частым осложнением у новорожденных, но число случаев в 1А группе меньше в 1,3 раза (24,3% и 31,9%), чем в 1В группе.
Таким образом, комплексное исследование особенностей течения гестации у женщин с Rh-отрицательной принадлежностью крови в сочетании с железодефицитной анемией позволило разработать программу пренатальной подготовки, а снижение частоты перинатальных осложнений, доказывает эффективность проведенной комплексной превентивной терапии.
ВЫВОДЫ
1. Наличие анемии у женщин с резус-отрицательной принадлежностю крови способствует возникновению резус-сенсибилизации и усугубляет ее течение,что подтверждается появлением антител в 1,9 раза чаще у пациенток основной группы уже в первой половине беременности, причем отмечается прямая коррелятивная зависимость от степени тяжести анемии. Неблагоприятный нарастающий титр антител в течение беременности у них наблюдается в 1,7 раза чаще, чем у беременных без анемии, а «скачущий титр» в 2,1 раза чаще.
2. Развитие резус-конфликта у беременных основной группы сопровождалось нарушениями как в маточно-плацентарном так и в плодово-плацентарном кровотоке, в то время как в первой группе сравнения преобладали первоначальные изменения плодово-плацентарного кровотока.
3. У беременных основной группы наблюдаются значительные изменения в системе мать – плацента – плод, проявляющиеся снижением содержания гормонов фетоплацентарного комплекса (эстрогена и плацентарного лактогена) на 36,2% и 21,1% соответственно относительно контрольной группы.
4. Анализ перинатальных исходов в обследуемых группах показывает неблагоприятное воздействие анте- и интранатальных факторов у женщин основной группы на состояние плода и новорожденного. Правильнее говорить не о сложении неблагоприятных факторов воздействия на фетоплацентарный комплекс, а об их умножении.
5. Морфологическая структура последов у изучаемых пациенток характеризуется признаками диссоцированного созревания, аномалиями развития сосудов, активацией инволютивных процессов. У 97,6% родильниц основной группы определены эти изменения в плацентах. Частота и выраженность этих нарушений прямопропорциональны тяжести анемии.
6. Разработанная нами программа пренатальной подготовки способствует снижению частоты осложнений гестации в 1,2-1,4 раза, в том числе развития фетоплацентарной недостаточности - на 19,2%, и благоприятному исходу для матери и плода. Эффективность комплексной превентивной терапии подтверждается также тем, что возрастающий титр антител и «скачущий титр» наблюдался в 1,4 раза реже.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Беременных женщин с резус-отрицательной принадлежностю крови в сочетании с железодефицитной анемией необходимо выделить в группу «высокого риска» по развитию акушерской и перинатальной патологии.
2. До 12 недель гестации в женской консультации необходимо полное исследование женщины. Беременные женщины с анемией легкой степени (гемоглобин 103-90 г/л), с титром антител ниже 1:16 и не имеющие в анамнезе больных гемолитической болезнью детей, могут наблюдаться в женской консультации с обычным алгоритмом ведения беременных. Отличительной особенностью является контроль уровня гемоглобина на фоне проводимой ферротерапии еженедельно, а также титра антител с момента взятия на учет ежемесячно до 30 недель, затем каждые 2 недели до родоразрешения.
3. Беременных с резус-отрицательной принадлежностю крови, страдающих железодефицитной анемией среднетяжелой и тяжелой степени (гемоглобин89г/л), необходимо госпитализировать в ранние сроки беременности. Этому контингенту пациенток необходимо на фоне коррекции железодефицитного состояния проводить периодические курсы профилактики и терапии фетоплацентарной недостаточности с первых недель беременности.
4. Лечение железодефицитной анемии должно включать рациональное питание, насыщающую терапию (до 300 мг/сут.) препаратом железа для приема внутрь «Ферро-Фольгамма» с последующим переходом на поддерживающую (100 мг/сут.). Продолжительность насыщающей терапии определяется темпами прироста гемоглобина (не менее 4 недель). Терапия препаратами железа считалась эффективной при приросте гемоглобина за неделю на 7-8 г/л. В том случае, если такой эффект не достигался, переходили на парентеральную терапию сахарозным комплексом железа – «Венофер» в сочетании с Эпокрином (рчЭПО), начальная доза препарата была 50 МЕ/кг 3-6 раз.
5. Всем беременным с резус-отрицательной принадлежностю крови в сочетании с железодефицитной анемией в 20-24 и 32-36 недель проводить курс антиоксидантной метаболической терапии, который в комбинации с железосодержащими препаратами и микроэлементами будет способствовать улучшению обменных процессов в системе «мать-плацента-плод», предупреждая тем самым нарушения в фетоплацентарном комплексе и развитие гемолитической болезни плода.
6. Последняя плановая госпитализация осуществляется за 2-3 нед. до предполагаемых родов в стационары высокого риска (III этапа) для подготовки женщины к родоразрешению, для составления плана родоразрешения, проведения мероприятий по профилактике развития гемолитической болезни плода и новорожденного и осложнений родов и послеродового периода. Рекомендуется расширить показания к проведению абдоминального родоразрешения во время беременности в интересах плода, не дожидаясь развития родовой деятельности в зависимости от результатов комплексной оценки (ультразвуковое исследование, допплерометрия, кардиотокография, определение биофизического профиля плода) состояния фетоплацентарного комплекса.
7. В женских консультациях при проведении прегравидарной подготовки среди женщин с резус-отрицательной принадлежностю крови целесообразно выделение группы риска с проведением целенаправленного лабораторного выделения латентного дефицита железа (снижение содержания сывороточного железа ниже 12,5 мкмоль/ль, сывороточного ферритина ниже 12 мкг/л (норма 32-35 мкг/л), коэффициента насыщения железа трансферрином ниже 16% (норма 30-50%), повышение общая железосвязывающая способность выше 50,2 мкмоль/л (норма 30,6-84,6 мкмоль/л)). Это позволит дифференцированно подходить к профилактическому назначению препаратов железа, что обеспечит снижение частоты побочных эффектов, риска гемосидероза и затрат на лечение во время беременности при высокой эффективности предупреждения анемии.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Бийболатова Д.Т. «Особенности гемодинамики в системе мать-плацента – плод у женщин с резус-конфликтной беременностью на фоне железодефицитной анемии» // Журнал «Медицина. Наука и Практика». – Махачкала. - №2. - 2005. - С. 29-34.
- Бийболатовой Д.Т., Джамалова М.Ш., Тамазаева Х.Н. «К вопросу исхода гестации при сочетании анемии с иммуноконфликтной беременностью» // Журнал «Медицина. Наука и Практика». – Махачкала. - №2. - 2005.- С. 43-47.
- Бийболатовой Д.Т. «К вопросу исхода гестации при иммуноконфликтной беременности на фоне железодефицитной анемии» // Журнал «Медицина. Наука и Практика». – Махачкала. - №1. - 2006.- С. 47-53.
- Бийболатова Д.Т. «Допплерометрическое исследование кровотока фетоплацентарного комплекса у женщин с резус-конфликтной беременностью на фоне железодефицитной анемии» // В сб.: Материалы VIII Российского форума «Мать и дитя».-М. – 2006.- в печати.
- Бийболатова Д.Т., Омаров Н.С.-М. «Особенности гестации у женщин с Rh-отрицательной принадлежностью крови и анемией» - Махачкала «Rizo press». – 2006. – 175 с.
СПИСОК СОКРАЩЕНИЙ
БФПП - биофизический профиль плода
ГБН - гемолитическая болезнь новорожденного
ГБП - гемолитическая болезнь плода
ЖДА – железодефицитная анемия
ЗВРП – задержка внутриутробного развития плода
ИР – индекс резистентности
КСК – кривые скоростей кровотока
КТГ – кардиотокография
МПК – маточно-плацентарный комплекс
ОПБ – оптическая плотность билирубина
ПЛ – плацентарный лактоген
ППК – плодово-плацентарный комплекс
РДС – синдром дыхательных расстройств
рчЭПО – рекомбинантный человеческий эритропоэтин
СДО – систолодиастолическое отношение
УЗИ – ультразвуковое исследование
ФПК – фетоплацентарный комплекс
ФПН – фетоплацентарная недостаточность
ЦНС – центральная нервная система
Ig – иммуноглобулин

