Возможности определения прижизненности и давности образования резаных ран методом атомно-силовой микроскопии
На правах рукописи
Белоусова
Ольга Дмитриевна
ВОЗМОЖНОСТИ ОПРЕДЕЛЕНИЯ
ПРИЖИЗНЕННОСТИ И ДАВНОСТИ ОБРАЗОВАНИЯ РЕЗАНЫХ РАН МЕТОДОМ АТОМНО-СИЛОВОЙ МИКРОСКОПИИ
14.03.05 – судебная медицина
14.03.02 – патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Санкт-Петербург
2013
Работа выполнена в Федеральном государственном казенном военном образовательном учреждении высшего профессионального образования «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации
Научные руководители:
Толмачёв Игорь Анатольевич, доктор медицинских наук, профессор
Гайдаш Александр Александрович, доктор медицинских наук
Официальные оппоненты:
Ягмуров Оразмурад Джумаевич, доктор медицинских наук, профессор, Государственное бюджетное образовательное учреждение высшего профессионального образования «Санкт-Петербургский государственный медицинский университет имени академика И.П. Павлова» Министерства здравоохранения Российской Федерации, заведующий кафедрой судебной медицины и правоведения
Тимофеев Игорь Владимирович, доктор медицинских наук, профессор, Федеральное государственное казенное военное образовательное учреждение высшего профессионального образования «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации, профессор кафедры патологической анатомии
Ведущая организация:
Федеральное государственное бюджетное учреждение «Российский центр судебно-медицинской экспертизы» Министерства здравоохранения Российской Федерации
Защита состоится 26 июня 2013 г. в 11-00 часов на заседании совета Д 215.002.02 по защите докторских и кандидатских диссертаций при ФГКВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ по адресу: 194044, Россия, Санкт-Петербург, ул. Академика Лебедева, д. 6.
С диссертацией можно ознакомиться в библиотеке ФГКВОУ ВПО «Военно-медицинская академия имени С.М. Кирова» МО РФ.
Автореферат разослан «___» мая 2013 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор
Чирский Вадим Семенович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы исследования
Одним из приоритетных вопросов судебно-медицинской экспертной практики является необходимость установления прижизненности и давности образования повреждений. Характеризуя наиболее перспективные научные проблемы судебно-медицинской науки Д.В. Богомолов (2006), В.Л Попов (2011) считают, что главным в решении указанной проблемы является поиск новых подходов и методов исследования, которые позволят существенно повысить точность диагностики прижизненности и давности травмы. Высокие требования к качеству судебно-медицинской диагностики и достоверности её результатов в настоящее время вызывают необходимость постоянного поиска новых диагностических «инструментов» (Maeda H. et al., 2009; Luna А., 2009; Maeda H. et al., 2011; Bremmer R.H. et. al., 2012) необходимых для решения поставленных экспертных задач.
Поиск ответов на вопросы о прижизненности и давности образования повреждений находится в области достаточно традиционных методов морфологических исследований. Наряду с гистологическим методом, предпринимаются попытки применять гистохимический, иммуногистохимический, биохимический и биофизический методы. Однако многие ученые сходятся во мнении, что ни один из предложенных методов не может быть использован самостоятельно, и приоритет остается за комплексным исследованием объектов экспертизы (Пиголкин Ю.И. с соавт., 2001).
Традиционно наиболее широкое распространение в судебно-медицинской практике получил гистологический метод, как наиболее информативный и объективно отражающий изменения клеток и тканей. При этом ведущую роль в диагностике прижизненности и давности образования повреждений имеет оценка выраженности неспецифических реактивных и репаративных реакций в области повреждений, а также регионарных и общих ответных реакций организма на травму (Науменко В.Г., Митяева Н.А., 1980; Пермяков А.В. с соавт., 1994).
Особые трудности при решении вопросов прижизненности и давности образования повреждений возникают при дифференциальной диагностике прижизненных повреждений от посмертных, если они нанесены в ранние сроки (первые часы) премортального или постмортального периодов. Это обусловлено тем, что реактивные изменения тканей в области прижизненной травмы не успевают развиться в полной мере, а также тем, что в посмертных повреждениях в связи с «переживаемостью» тканей возможно появление морфологических изменений, схожих с прижизненными (Попов В.Л., 1996).
С развитием сканирующей зондовой микроскопии, в частности атомно-силовой микроскопии, в арсенале исследователей появилась возможность изучать морфологические и локальные свойства поверхности твердого тела с высоким пространственным разрешением. При этом применение метода атомно-силовой микроскопии предоставляет возможность исследовать биологические объекты, не используя сложных методов фиксации. В доступной литературе имеется множество публикаций, демонстрирующих эффективность метода атомно-силовой микроскопии как аналитического инструмента, используемого в медицине.
Система крови – одна из важнейших гомеостатических систем организма. Возникающие в ней патологические процессы могут быть как проявлениями критических и терминальных состояний, так и причинами развития последних. Именно поэтому клетки крови, и в первую очередь эритроциты, являются постоянным объектом медицинских исследований. В судебно-медицинской литературе имеются лишь единичные публикации об использовании атомно-силовой микроскопии как инструмента для определения давности смерти (Chen Y., Cai J., 2006) и давности «образования» пятен крови (Strasser S.et al., 2007).
В то же время, в доступных литературных источниках приведены различные сведения о методике подготовки образцов для исследования эритроцитов методом атомно-силовой микроскопии. До сих пор не исследованными остаются особенности динамики морфологических изменений параметров эритроцитов и структуры мембран клеток в случаях образования прижизненных и посмертных повреждений. Отсутствуют также критерии дифференциальной диагностики прижизненности и давности образования повреждений при изучении эритроцитов методом атомно-силовой микроскопии. Изложенные обстоятельства позволили сформулировать цель и задачи данного диссертационного исследования.
Цель исследования: выявить морфологические изменения эритроцитов периферической крови и их динамику при экспериментально причиненных прижизненных и посмертных резаных ранах методом атомно-силовой микроскопии для расширения теоретической основы, характеризующей морфологические аспекты патогенетических механизмов развития раневого процесса, и поиска новых диагностических критериев судебно-медицинской диагностики прижизненности и давности образования повреждений.
Задачи исследования:
1. Определить оптимальный способ подготовки проб периферической крови для исследования морфологических параметров эритроцитов методом атомно-силовой микроскопии.
2. Выявить морфологические признаки эритроцитов периферической крови, обладающие значимой для диагностики изменчивостью в связи с развитием раневого процесса.
3. Изучить характер и проследить хронологическую последовательность изменений морфологических параметров эритроцитов периферической крови методом атомно-силовой микроскопии в ранний (до 40 минут) пре- и постмортальный период при нанесении экспериментальных резаных ран.
4. Разработать математическую модель для определения факта прижизненного (посмертного) образования резаных ран по результатам исследования изменений морфологических характеристик эритроцитов периферической крови методом атомно-силовой микроскопии.
5. Разработать математическую модель для определения давности образования прижизненных резаных ран по результатам исследования эритроцитов периферической крови методом атомно-силовой микроскопии.
Научная новизна результатов исследования
Для расширения современных представлений о динамике раневого процесса и решения практических вопросов судебно-медицинской экспертизы впервые использован прецизионный исследовательский метод атомно-силовой микроскопии, позволяющий производить изучение объектов в нанометровом диапазоне.
Установлено, что оптимальным способом подготовки пробы для атомно-силовой микроскопии является фиксация мазка крови высушиванием на воздухе, позволяющая регистрировать морфологические параметры эритроцитов в максимальной близости к их нативному состоянию.
Впервые выявлены динамические изменения морфологических признаков эритроцитов периферической крови, открывающие возможность решения проблем исследования патогенетических механизмов развития раневого процесса.
Результаты проведенного экспериментального исследования показали значимые морфологические параметры эритроцитов периферической крови и динамику их изменений в зависимости от давности образования резаных ран по отношению к моменту наступления смерти.
Разработаны эффективные математические модели, позволяющие выполнять дифференциально-диагностическое определение прижизненности (факта прижизненного причинения) и давности образования резаных ран в пределах короткого (до 40 минут) премортального временного диапазона.
Доказана целесообразность внедрения метода атомно-силовой микроскопии в практику патоморфологических и судебно-медицинских исследований эритроцитов периферической крови для диагностики временных интервалов раневого процесса и перспективность проведения дальнейших исследований, направленных на получение новых научных знаний в патологической анатомии и судебной медицине указанным методом.
Теоретическая значимость
Полученные в результате проведенного исследования данные в виде выявленных закономерностей изменений морфологических характеристик эритроцитов периферической крови в ранних премортальном и постмортальном периодах в условиях раневого процесса дополняют существующие представления о причастности системы крови к течению раневого процесса. Наибольшую ценность эти данные приобретают для расширения теоретической базы морфологической диагностики патогенетических механизмов развития раневого процесса и судебно-медицинской диагностики прижизненности и давности образования повреждений.
На этой основе доказана принципиальная возможность разработки высокоэффективных математических моделей, позволяющих устанавливать прижизненность и давность образования резаных ран в эксперименте.
Материалы диссертации могут быть использованы в учебном процессе в высших образовательных медицинских учреждениях при преподавании по курсам патологической анатомии, судебной медицины, гистологии, гематологии.
Практическая значимость
В результате проведенных экспериментальных исследований определен оптимальный способ подготовки пробы крови для регистрации размерных параметров эритроцитов и ультраструктурных характеристик поверхности мембран клеток методом атомно-силовой микроскопии, который заключается в высушивании мазка крови на воздухе.
Разработана методика определения прижизненности и давности экспериментальных резаных ран в раннем премортальном периоде по морфологическим параметрам эритроцитов периферической крови.
Доказанная эффективность метода атомно-силовой микроскопии для диагностики временных диапазонов развития раневого процесса предопределяет перспективу его внедрения в перечень методов, используемых патологической анатомией и судебной медициной для проведения новых научных исследований.
Методология и методы исследования
Экспериментальное исследование выполнено в соответствии с законами и нормативно-правовыми актами, регулирующими работу с экспериментальными животными.
На проведение исследований получено разрешение локального независимого комитета по вопросам этики при Военно-медицинской академии имени С.М. Кирова (протокол № 135 от 19.03.2013 года).
Использованные в работе методы исследования составили две группы:
- метод атомно-силовой микроскопии;
- методы статистической обработки полученных результатов.
Основные положения диссертации, выносимые на защиту:
1. Оптимальным способом подготовки пробы для атомно-силовой микроскопии является фиксация мазка крови высушиванием на воздухе, позволяющая регистрировать морфологические параметры эритроцитов в максимальной близости к их нативному состоянию.
2. В пределах исследованных раннего (до 40 минут) премортального, а также раннего (до 40 минут) постмортального периодов морфологические признаки эритроцитов периферической крови претерпевают статистически достоверные изменения.
3. Применение метода атомно-силовой микроскопии позволяет устанавливать факт прижизненного (посмертного) нанесения резаной раны и давность ее нанесения в пределах короткого (40 минут) премортального временного диапазона.
4. На основании выявленных статистически значимых различий значений морфологических параметров эритроцитов периферической крови разработана методика, позволяющая производить дифференциально-диагностическое определение прижизненности и давности образования резаных ран с использованием эффективных математических моделей.
Апробация и практическая реализация результатов исследования
По теме диссертации опубликовано 9 научных работ, из них 3 в ведущих рецензируемых научных журналах.
Основные результаты исследования доложены и обсуждены на Всероссийской научной конференции с международным участием «Современная военно-полевая хирургия и хирургия повреждений» (г. С.-Петербург, 2011), Всероссийской научно-практической конференции, посвященной современным проблемам военной медицины, обитаемости и профессионального отбора (г. С.-Петербург, 2011), Международном молодежном медицинском конгрессе «Санкт-Петербургские научные чтения – 2011» (г. С.-Петербург, 2011), Научно-практической конференции с международным участием «Актуальные проблемы судебно-медицинской экспертизы» (г. Москва, 2012), рабочем совещании научно-исследовательских лабораторий крови и тканей и электронной микроскопии и гистохимии ВМедА имени С.М. Кирова (2012), заседаниях Санкт-Петербургского общества судебных медиков (г. С.-Петербург, 2012, 2013), Межрегиональной научно-практической конференции «Актуальные проблемы судебной медицины и медицинского права» (г. Суздаль, 2013), а также межкафедральных совещаниях кафедр судебной медицины и патологической анатомии (2011, 2013).
Основные результаты работы используются в научной работе научно-исследовательских лабораторий крови и тканей и электронной микроскопии и гистохимии ВМедА имени С.М. Кирова, а также в учебном процессе кафедры судебной медицины Военно-медицинской академии имени С.М. Кирова.
Личный вклад автора в проведенные исследования
Автор непосредственно собрала и провела анализ данных отечественной и зарубежной литературы в отношении выбранной темы исследования, сформулировала цель, задачи и положения, выносимые на защиту, выполнила планирование, подготовку и проведение экспериментального исследования, произвела анализ и выполнила статистическую обработку полученных в ходе исследования данных, сформулировала выводы и практические рекомендации; принимала непосредственное участие в исследованиях экспериментального материала при помощи атомно-силового микроскопа.
Структура и объем диссертации
Работа изложена на 123 страницах машинописного текста, состоит из введения, четырех глав, выводов, практических рекомендаций, списка литературы и приложения. Текст иллюстрирован 21 таблицей и 35 рисунками. Список литературы включает 141 источник (81 отечественный и 60 зарубежных). Приложение представлено на четырех страницах.
СОДЕРЖАНИЕ РАБОТЫ
Материал исследования
На проведение исследований получено разрешение локального независимого комитета по вопросам этики при Военно-медицинской Академии им. С.М. Кирова (протокол № 135 от 19.03.2013 года).
Моделирование резаной раны проводили на лабораторных животных – самцах белых беспородных крыс массой 0,2-0,36 кг (средняя масса составила 0,248±0,06 кг), выращенных и содержавшихся в клинике экспериментальных животных (виварии) ВМедА имени С.М. Кирова.
Экспериментальное исследование выполнено на 30 крысах, в каждой исследовательской группе использовано по 10 крыс, группа контроля составила 10 крыс.
Манипуляции по нанесению резаной раны на внутреннюю поверхность бедра и забору крови из хвостовой вены крыс производили под кратковременным поверхностным эфирным наркозом.
В соответствии с задачами исследования были сформированы три исследовательские группы.
Первая группа включала десять животных, которым резаную рану наносили с целью моделирования прижизненного повреждения. Под поверхностным кратковременным эфирным наркозом крысам на внутреннюю поверхность бедра наносили резаную рану. Спустя 20 минут после нанесения резаной раны, под кратковременным поверхностным эфирным наркозом у пяти животных был выполнен забор крови из сосудов хвоста с целью изучения морфологических особенностей мембран эритроцитов методом атомно-силовой микроскопии. Аналогичные манипуляции произведены пяти крысам спустя 40 минут от момента нанесения повреждения.
Вторая группа составила десять животных, которым резаная рана была нанесена в условиях моделирования посмертного повреждения. Под предварительным глубоким эфирным наркозом животные были умерщвлены способом цервикальной дислокации. После прекращения сердцебиений на внутреннюю поверхность бедра крысы наносили резаную рану. Забор пробы крови осуществляли у пяти крыс через 20 минут от момента нанесения резаной раны. Аналогичные манипуляции произведены пяти крысам спустя 40 минут от момента нанесения резаной раны. Забор крови для проведения исследования у животных этой группы осуществлялся из сосудов хвоста.
Третья группа, контрольная, включала две подгруппы лабораторных животных, которым резаные раны нанесены не были. Первая подгруппа подопытных животных составила четыре крысы, у которых под кратковременным эфирным наркозом был выполнен забор крови из сосудов хвоста; вторая подгруппа составила шесть крыс, которые под предварительным глубоким эфирным наркозом были умерщвлены способом цервикальной дислокации. У трех животных забор крови из сосудов хвоста был выполнен через 20 минут после прекращения сердцебиений, аналогичные манипуляции произведены у трех крыс спустя 40 минут после прекращения сердцебиений.
Моментом наступления смерти считали момент прекращения сердцебиений у животных, определяемый пальпаторно.
В соответствии с планом эксперимента в каждой из групп у животных производился забор крови. Мазки крови готовили на обезжиренных стеклянных подложках стандартным способом (Ромейс Б., 1953) и высушивали на воздухе при температуре 24° С в течение 10 мин.
Методы исследования
В работе были использованы следующие методы исследования: 1) метод атомно-силовой микроскопии; 2) методы статистической обработки полученных результатов исследования.
1. Метод атомно-силовой микроскопии
Для исследования мазков крови использовали атомно-силовой микроскоп INTEGRA AURA («NT MDT», Россия). Сканирование поверхности образцов проводили в полуконтактном, а при измерении сил адгезии – в контактном режимах на воздухе. Использовали кремниевые зонды серии NSG01 («NT-MDT», Россия) жесткостью 7,2 нН/нм, резонансной частотой 190 кГц. Длина кантилевера - 125 мкм, ширина - 30 мкм, толщина - 2 мкм.
В работе использовали программное обеспечение «NOVA» для получения изображений и программу «Image Analysis» для анализа изображений.
Выбор эритроцита из мазка крови для проведения исследования осуществлялся при помощи оптической системы микроскопа случайным образом. Размер выборки составил 30 клеток для каждой исследовательской точки.
В ходе проведения сканирования мазка крови получали изображение размером 40х40 мкм, на котором случайным образом выбирали эритроциты для исследований. Каждая из отобранных клеток в дальнейшем была сканирована двукратно – получены изображения размерами 12х12 мкм и 3х3 мкм.
На изображении размером 12х12 мкм (рис. 1) при помощи программы «Image Analysis» (на боковых сечениях клеток – профилограммах) определяли диаметр (рис. 2), высоту клетки, глубину центральной впадины эритроцита, а также поверхностные дефекты мембраны клетки, называемые нами «эрозиями» поверхности мембраны (рис. 3).
 | 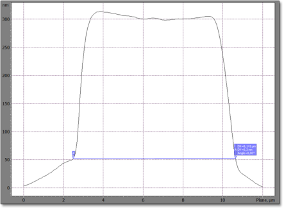 |
| Рис. 1. Изображение эритроцита в мазке крови крысы. Демонстрируется этап построения профилограммы клетки – при помощи курсора (белой линии) выбирается место расположения бокового сечения. Размер изображения 12х12 мкм. | Рис. 2. Профилограмма эритроцита. Демонстрируется этап измерения диаметра клетки. |
На изображениях размером 3х3 мкм при помощи аппаратного модуля программы «Image Analysis» подсчитывали общее количество пор в мембране эритроцита (рис. 4).
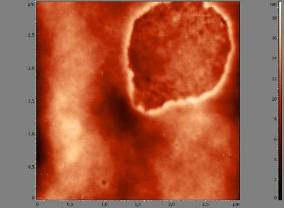 |  |
| Рис. 3. Изображение фрагмента мембраны эритроцита. Демонстрируется этап измерения длины большей и меньшей осей дефекта мембраны клетки («эрозии» поверхности мембраны). Размер изображения 3х3 мкм. | Рис. 4. Изображение фрагмента мембраны эритроцита. Стрелками указаны поры в мембране. Размер изображения 3х3 мкм. |
Площадь «эрозий», форма которых приближалась к форме эллипса, вычисляли по известной формуле:

где S – площадь эллипса; ![]()
![]() – число пи (3,1415); a – длина большой полуоси; b – длина малой полуоси.
– число пи (3,1415); a – длина большой полуоси; b – длина малой полуоси.
В ходе выполнения исследований производили измерение сил адгезии на поверхности мембраны клетки и подложке исследуемых образцов.
При помощи атомно-силового микроскопа было получено 525 сканов эритроцитов.
2. Методы статистической обработки результатов исследования
Полученные количественные и качественные показатели вносили в базу данных в программе Microsoft Office Excel. Для статистической обработки данных использовали пакет прикладных программ StatSoft, Inc. (2011) STATISTICA 10.
На первом этапе производилась оценка характера распределения количественных показателей при помощи модуля описательной статистики.
Для оценки закона распределения рассматриваемых количественных показателей был выполнен расчет их числовых характеристик и построение гистограмм распределения, а также проведена проверка соответствия эмпирического закона распределения теоретическому закону нормального распределения.
На основании соответствия эмпирического закона распределения теоретическому закону нормального распределения для оценки значимости различий средних значений показателей в группах применяли параметрический критерий t Стъюдента для независимых совокупностей.
За нулевую статистическую гипотезу была принята гипотеза о равенстве (соответствии) анализируемого показателя в опытной и контрольной группах. Нулевая гипотеза отвергалась при уровне значимости p<0,05.
Для сравнения групп по альтернативному признаку, принимающему два значения (либо есть, либо нет) была проведена оценка значимости различия частот наблюдений при помощи критерия 2-Пирсона.
Для решения практической задачи судебно-медицинской диагностики прижизненности образования повреждений был применен дискриминантный анализ. Диагностика осуществлялась по решающим правилам, представляющим собой линейные классификационные функции (ЛКФ), выработанные методами дискриминантного анализа на основе обучающей информации.
С целью решения вопросов давности образования прижизненных повреждений были применены многофакторный корреляционный анализ и регрессионный анализ изучаемых параметров эритроцитов.
На первом этапе определена степень выраженности связей изучаемых параметров со временем (давностью) причинения повреждений. Силу корреляционной связи определяли по величине коэффициента парной |rxy| корреляции (Юнкеров В.И., Григорьев С.Г., 2005).
Выполнение второго этапа математической обработки полученных результатов сопровождалось построением уравнения линейной регрессии для определения времени причинения повреждения по параметрам эритроцитов.
Полученное регрессионное уравнение было подвергнуто дисперсионному анализу с целью проверки информационной способности и уровня значимости модели.
Основные результаты исследования и их обсуждение
1. Особенности подготовки проб крови для исследования морфологических параметров и структуры мембран эритроцитов методом атомно-силовой микроскопии
С целью выбора оптимального способа подготовки проб для атомно-силовой микроскопии эритроцитов было выполнено несколько схем пробоподготовки, наиболее часто описываемых в литературе.
Наилучшее качество изображений эритроцитов было получено из мазков крови, фиксированных высушиванием на воздухе, мазков крови, фиксированных в 96% этиловом спирте с экспозицией 2 мин и мазков крови, фиксированных в 0,5% растворе глутарового альдегида с экспозицией 30 с и последующей проводкой в этиловом спирте в возрастающей концентрации.
Для того чтобы оценить, в какой мере каждый из трех отобранных способов фиксации образцов оказывает влияние на морфологические характеристики клетки, было проведено сравнение значений средних величин диаметра эритроцитов. Для этих целей было выполнено сканирование 30-ти эритроцитов, по 10 клеток для каждого способа подготовки проб. Для контроля использованы литературные данные о размерах эритроцитов крыс (Симонов В.В. с соавт., 2010) полученные по результатам атомно-силовой микроскопии клеток во влажной камере. Сравнительный анализ значений средних величин диаметра эритроцитов представлен в таблице 1.
Таблица 1. Средние величины диаметра эритроцитов при различных способах фиксации, (Х±mx)
| Показатель | Контрольная группа | Способы фиксации образцов для исследования | ||
| на воздухе (n=10) | в этиловом спирте (n=10) | в растворе глутарового альдегида (n=10) | ||
| 1 | 2 | 3 | 4 | |
| Диаметр, мкм | 6,35±0,65 3 | 7,82±0,59 | 8,24±0,48 1 | 5,22±0,52 |
Примечания: Х – среднее значение; mx – стандартное отклонение;
надстрочными знаками указаны достоверные различия в группах
сравнения (р0,05).
Действие альдегидов сводится к образованию связей между молекулами клеточных мембран и мембран органелл в прочную единую сеть за счет «сшивания», в основном, клеточных белков (Савченко С.В. c соавт., 2009). При данном способе фиксации клетка не распластывается по подложке и значения ее «макроморфометрических» параметров приближены к таковым нативных эритроцитов. Однако при получении изображений большей разрешающей способности отмечается сглаженность рельефа поверхности мембраны клетки (рис. 5, а). Таким образом, мембранные наноструктуры оценить при данном способе фиксации не представляется возможным.
Фиксация в 96% растворе этилового спирта с экспозицией 2 минуты характеризуется дегидратацией эритроцита. Распластывание клетки по поверхности подложки, по-видимому, свидетельствует о том, что при данном способе подготовки проб в большей степени осуществляется фиксация поверхностных мембранных белков, не затрагивая внутренние структуры и цитоскелет. Это, безусловно, изменяет морфологические параметры клетки, однако топография поверхности мембран становится более доступной для визуализации (рис. 5, б).
При фиксации мазков крови высушиванием на воздухе получена схожая морфологическая картина, однако распластывание клетки по поверхности подложки и изменение значений диаметра клетки были менее выражены. Можно предположить, что при высушивании на воздухе процессы дегидратации и связывания белков происходят более равномерно как в поверхностных, так и во внутренних структурах клетки. Средние величины диаметра эритроцитов, фиксированных высушиванием на воздухе достоверно не отличались от контрольных значений (см. таб. 1). При этом неоднородность поверхности мембран эритроцитов была выражена более четко и позволила визуализировать ряд мебранных наноструктур (рис. 5, в).
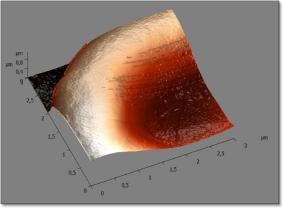 а а |  б б |
 в в | Рис. 5. Изображения фрагментов мембран эритроцитов. Размеры изображений 3х3 мкм. Пояснения в тексте. |
2. Сравнительный анализ величин изучаемых параметров эритроцитов
Для оценки значимости различий средних значений изучаемых показателей в группах было проведено сравнительное исследование полученных значений параметров эритроцитов. Результаты сравнения представлены в таблице 2.
Таблица 2. Значение величин параметров эритроцитов в исследовательских группах, (Х±mx)
| Показатель | Группы | ||||||
| прижизненные повреждения | посмертные повреждения | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Группа контроля (n=30) | 20 мин (n=30) | 40 мин (n=30) | Группа контроля для повреждений давностью 20 мин (n=30) | 20 мин (n=30) | Группа контроля для повреждений давностью 40 мин (n=30) | 40 мин (n=30) | |
| Диаметр, нм | 7816 ± 531,7 2 | 8313,9 ± 591,8 1,3 | 8010 ± 392,8 2 | 7284,5 ± 519,7 5 | 8288,9 ± 368,1 4 | 7366,4 ± 389,1 7 | 8378,4 ± 469,1 6 |
| Высота, нм | 283 ± 47 2 | 314,9 ± 57,7 1,3 | 281 ± 47,1 2 | 279 ± 37,4 | 268,4 ± 32,2 | 323,3 ± 84 7 | 274,8 ± 20,2 6 |
| Глубина центральной впадины, нм | 31,3 ± 17,7 2,3 | 44 ± 14,7 1,3 | 66,1 ± 41,1 1,2 | 25,5 ± 11,3 5 | 57,8 ± 14,7 4,7 | 32,3 ± 20,3 | 35,6 ± 16,6 5 |
Продолжение таблицы 2
| Показатель | Группы | ||||||
| прижизненные повреждения | посмертные повреждения | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| Группа контроля (n=30) | 20 мин (n=30) | 40 мин (n=30) | Группа контроля для повреждений давностью 20 мин (n=30) | 20 мин (n=30) | Группа контроля для повреждений давностью 40 мин (n=30) | 40 мин (n=30) | |
| Количество пор в мембране эритроцита | 304,4 ± 28,9 3 | 302 ± 29,7 3 | 439,4 ± 30,1 1,2 | 283,4 ± 32,1 5 | 471,2 ± 28,9 4 | 274,4 ± 38,9 7 | 472,1 ± 39,5 6 |
| Глубина «эрозий», нм | 13,3 ± 5,1 2 | 8,5 ± 2,7 1 | 10,3 ± 3,3 | 8,7 ± 1,7 1 | 8,6 ± 2,9 | 9 ± 2,4 1 | 9,7 ± 0,9 |
| Площадь «эрозий», нм2 | 879 164 ± 512 440 2 | 1 359 051 ± 439 7301,3 | 867 168 ± 439 4892 | 679 286 ± 583 844 5 | 1970 437 ± 217 6024,7 | 1 147 137 ± 100 705 | 1 039 279 ± 384 7375 |
| Сила адгезии на поверхности мембраны, нН | 8,4 ± 4,3 | 6,5 ± 2,7 | 9,1 ± 3,8 | 11 ± 4,2 | 16,2 ± 12 7 | 13,8 ± 5,6 7 | 7,8 ± 4,3 6,5 |
| Сила адгезии на поверхности подложки, нН | 6,9 ± 3 | 5 ± 2,8 3 | 8,5 ± 2,2 2 | 5,8 ± 0,7 5 | 13,8 ± 8,5 4,7 | 7,6 ± 1,5 | 7,5 ± 4,7 5 |
Примечание: Х – среднее значение; mx – стандартное отклонение;
надстрочными знаками указаны достоверные различия в
группах сравнения (р0,05).
При анализе полученных изображений эритроцитов было выявлено, что не все клетки имеют форму вогнутого диска, у некоторых из них центральная впадина выражена не была и форма клетки при этом была сферической или приближалась к таковой.
При оценке значимости различия частот наблюдения сфероцитов в изучаемых группах выявлено достоверное преобладание количества сфероцитов среди эритроцитов при посмертно причиненных резаных ранах над частотой наблюдения этого признака при прижизненно нанесенных резаных ранах (2=3,97; р=0,046) (табл. 3).
Также было выявлено, что некоторые клетки имеют поверхностные дефекты мембраны, называемые нами «эрозии» поверхности мембраны. Частота наблюдения эритроцитов, имеющих «эрозии» поверхности мембраны среди эритроцитов в группах прижизненно причиненных резаных ран давностью как 20, так и 40 минут достоверно ниже частоты наблюдения данного признака в контрольной группе (2=5,45; р=0,019 и 2=6,7; р=0,009 соответственно) (см. табл. 3).
Таблица 3. Значения критерия 2-Пирсона и уровней значимости различий количества сфероцитов и количества эритроцитов, имеющих «эрозии» поверхности мембраны в исследовательских группах
| Сравниваемые группы | Сфероциты | «Эрозии» поверхности мембраны | ||
| Значения критерия 2-Пирсона | Уровень значимости | Значения критерия 2-Пирсона | Уровень значимости | |
| Группа 2 и группа 1 | 0,1 | 0,754 | 5,45 | 0,019 * |
| Группа 3 и группа 1 | 0 | 1 | 6,7 | 0,009 * |
| Группа 5 и группа 4 | 3,45 | 0,063 | 0,66 | 0,416 |
| Группа 7 и группа 6 | 2,78 | 0,953 | 0,34 | 0,559 |
| Группа 2 и группа 3 | 0,1 | 0,754 | 0,07 | 0,791 |
| Группа 5 и группа 7 | 3,45 | 0,063 | 0 | 1,0 |
| Группа 2+3 и группа 5+7 | 3,97 | 0,046 * | 0,93 | 0,335 |
Примечание: * - достоверные различия в группах сравнения (р0,05).
Полученные в результате экспериментального исследования данные свидетельствуют о том, что на 20-ой минуте при прижизненно причиненных повреждениях происходит увеличение объема эритроцита (за счет увеличения диаметра и высоты клетки), а на 40-ой минуте значения диаметра и высоты клетки от контрольных значений не отличаются, что не противоречит сведениям о динамике развертывания адаптационных реакций в организме в ответ на повреждение (Шанин В.Ю., 1996). Выявленное увеличение глубины центральной впадины диска эритроцита, по всей видимости, также является адаптивной реакцией – увеличение соотношения поверхности и объема клетки приводит к облегчению газообмена между эритроцитом и клеточными структурами внутренней среды организма.
При изучении прижизненно причиненных повреждений на 40-ой минуте выявлено увеличение количества пор в мембране эритроцита по сравнению с группой контроля, при этом статистически достоверного увеличения сил адгезии, как на поверхности мембраны эритроцита, так и на поверхности подложки исследуемого образца выявлено не было. Известно, что эритроциты обладают высокой адгезивностью к поверхностям, несущим положительный электрический заряд, что считается неспецифическим типом адгезии и объясняется притяжением отрицательно заряженного гликокаликса эритроцитов (Hategan A. et al., 2003). В условиях нормы адгезия эритроцитов к сосудистому эндотелию относительно невелика, однако этот процесс существенно интенсифицируется при многих заболеваниях (Максименко А.В., Турашев А.Д., 2011). Отсутствие увеличения силы адгезии эритроцитов, циркулирующих в кровотоке, вероятно, можно объяснить малым по интенсивности и длительности травматическим воздействием в проведенном нами эксперименте.
На изображениях мембран эритроцитов, как при прижизненно, так и при посмертно нанесенных повреждениях, были визуализированы поверхностные дефекты мембраны клетки, названные нами «эрозиями». Морфологически «эрозии» имеют вид неглубоких дефектов, образованных как бы очаговым разрежением или «расползанием» поверхностно расположенной пленки плазмы крови, покрывающей эритроциты. Форма эрозий чаще приближается к эллипсам, края их, как правило, располагаются выше плоскости прилежащей к ним мембраны. На 20-ой минуте при прижизненно причиненных повреждениях глубина «эрозий» и их площадь статистически значимо увеличиваются по сравнению с аналогичными показателями в группе контроля, на 40-ой минуте – глубина «эрозий» от контрольных значений не отличается, а их площадь статистически значимо увеличивается. Вероятно, выявленные поверхностные дефекты пленки плазмы крови, покрывающей эритроциты, и морфологическая их неоднородность (как глубины, так и площади), связаны с изменениями билипидного слоя мембраны эритроцитов, а также с конформационными изменениями белков мембраны.
Целостность функциональной системы – совершенно необходимое условие ее нормального структурно-функционально-информационного трехмерного состояния, обеспечивающего на основе поступления информации, пластических и энергетических субстратов самовоспроизведение, сохранение дискретной морфологической структуры и активную в определенном биоритме адаптацию к среде с помощью компенсаторных процессов, направленных на сохранение гомеостаза (Шанин Ю.Н., 1995). Очевидно, что любое повреждение является нарушением целости системы, затрагивая и одну из важнейших гомеостатических систем организма – систему крови. Центральное место в пато- и морфогенезе травматической болезни занимает системный и органный гемодинамический ответ на повреждение (Тимофеев И.В., 1994).
Выявленные конформационные изменения эритроцитов периферической крови можно расценить как адаптационные и патологические изменения, происходящие в организме в ответ на повреждение, что соответствует существующим современных представлениям о развитии раневого процесса (Ерюхин И.А., 1994; Ерюхин И.А., Шляпников С.А., 1997).
При анализе показателей в группе посмертно причиненных повреждений также отмечаются статистически значимые изменения величин их значений. Так, на 40-ой минуте отмечается увеличение диаметра и снижение высоты эритроцита по сравнению со значениями аналогичных показателей в группе контроля, вместе с тем, на 20-ой минуте увеличивается диаметр и глубина центральной впадины диска эритроцита, высота клетки по сравнению со значением данного показателя в группе контроля не изменяется.
При посмертно причиненных повреждениях как на 20-ой, так и на 40-ой минутах отмечается увеличение количества пор в мембране эритроцитов по сравнению со значениями величин данных показателей в соответствующих им группах контроля. При этом к 40-ой минуте зафиксировано уменьшение силы адгезии на поверхности мембраны эритроцита. Изменений значений показателей глубины «эрозий» мембраны клетки при посмертно причиненных повреждениях по сравнению с соответствующими значениями показателей в контрольных группах выявлено не было. Площадь поверхности «эрозий» мембраны эритроцитов увеличивалась к 20-ой минуте с момента причинения резаной раны, а к 40-ой минуте не отличалась от среднего значения данного показателя в группе контроля.
Таким образом, к 40-ой минуте отмечается: увеличение диаметра и снижение высоты эритроцита, уменьшение выраженности центральной впадины диска клетки, двукратное увеличение количества пор в мембране эритроцита, уменьшение площади поверхности «эрозий» мембраны и величины силы адгезии на мембране клетки.
Наступление смерти и прекращение кровообращения изменяет состояние крови и сосудистой системы. Биохимические процессы, происходящие после наступления смерти приводят к образованию в организме качественно новых химических соединений (Kondo T., Ishida Y., 2010). Уже в раннем посмертном периоде (на 20 минуте от момента наступления смерти) нами были выявлены ультраструктурные изменения на уровне клеточных мембран эритроцитов (количества пор, глубины и площади «эрозий» мембраны клетки). В работе J. Kotyska с соавт. (2012), посвященной исследованию изменений поверхностных зарядов мембран эритроцитов в трупной крови после наступления внезапной смерти, имеются сведения о том, что нарушение химического состава клеточной мембраны вызывает изменение ее морфологических характеристик.
Несмотря на имеющиеся представления о начале развития аутолитических изменений с клеточного уровня, клетки крови (эритроциты, тромбоциты, лейкоциты) после наступления смерти остаются «относительно стабильными» в трупе (Laiho K., Penttil A., 1981).
В результате проведенных нами исследований в раннем постмортальном периоде (до 40 минут с момента наступления смерти) признаков гемолиза (фрагментации мембраны) эритроцитов нами выявлено не было. Это наблюдение соответствует данным K. Laiho и A. Penttil (1981), в работе которых подобная «стабильность» эритроцитов наблюдалась авторами до 270 часов с момента наступления смерти.
По мнению И.А. Кассирского и Г.А. Алексеева (1970) сфероцитарную трансформацию эритроцитов следует рассматривать как начальный, подготовительный этап гемолиза. При оценке значимости различия частот наблюдения сфероцитов в изучаемых группах нами выявлено достоверное преобладание количества сфероцитов среди эритроцитов при посмертно причиненных резаных ранах над частотой наблюдения этого признака при прижизненно нанесенных резаных ранах. Эти данные также подтверждаются работами K. Laiho и A. Penttil (1981), отмечавшими быструю трансформацию дискоцитов в эхиноциты и сфероциты в трупной крови.
Таким образом, полученные данные можно рассматривать как закономерные посмертные изменения, регистрируемые методом атомно-силовой микроскопии уже на 40-ой минуте после наступления смерти.
3. Математическое моделирование диагностики прижизненности образования повреждений
С целью формализации признакового пространства и оптимизации математической обработки полученных данных числовым значениям параметров эритроцитов были присвоены условные балльные оценки (табл. 3).
Таблица 3. Параметры эритроцитов, количественные и качественные характеристики и их коды
| Наименование параметра | Условное обозначение | Условная балльная оценка |
| Диаметр эритроцита, нм | Х1 | 1 - менее 7500 2 - от 7501 до 8000 3 - от 8001 до 8500 4 - от 8501 до 9000 5 - более 9001 |
| Высота эритроцита, нм | Х2 | 1 - менее 250 2 - от 250,1 до 300 3 - от 300,1 до 350 4 - от 350,1 до 400 5 - более 400,1 |
| Глубина впадины диска эритроцита, нм | Х3 | 0 – впадина не выражена 1 – до 40 2 – от 40,1 до 80 4 - от 80,1 до 120 3 – более 120,1 |
| Количество пор в мембране эритроцита | Х4 | 1 - менее 300 2 - от 301 до 350 3 - от 351 до 400 4 - от 401 до 450 5 - от 451 до 500 6 - более 501 |
| Глубина «эрозий» поверхности мембраны эритроцита, нм | Х5 | 0 – эрозий нет 1 - менее 5 2 - от 5,1 до 10 3 - от 10,1 до 15 6 - более 15,1 |
| Площадь «эрозий» поверхности мембраны эритроцита, нм2 | Х6 | 0 – эрозий нет 1 - менее 900000 2 - от 900001 до 1200000 3 - от 1200001 до 1500000 4 - от 1500001 до 1800000 5 - более 1800001 |
| Сила адгезии на поверхности мембраны эритроцита, нН | Х7 | 1 – менее 5 2 – от 5 до 7 3 – от 7 до 9 4- более 9 |
| Сила адгезии на поверхности подложки исследуемого образца, нН | Х8 | 1 – менее 5 2 – от 5 до 7 3 – от 7 до 9 4 – более 9 |
На следующем этапе была определена информативность изучаемых признаков. Наиболее информативными признаками (с уровнями значимости p<0,05) являются следующие: Х4 – количество пор в мембране эритроцита, Х5 – глубина «эрозий» поверхности мембраны эритроцита, Х6 – площадь «эрозий» поверхности мембраны эритроцита. Признаки: Х1 –диаметр эритроцита (р=0,37), Х2 – высота эритроцита (р=0,58), Х3 – глубина впадины диска эритроцита(р=0,08), Х7 – сила адгезии на поверхности мембраны эритроцита(р=0,51) и Х8 – сила адгезии на поверхности подложки исследуемого образца (р=0,98) не включены в линейную классификационную функцию, как низко информативные.
Коэффициенты линейных классификационных функций для решения диагностической задачи представлены в таблице 4.
Таблица 4. Коэффициенты линейных классификационных функций (ЛКФ)
| Параметр | Группа 1:1 p=0,49645 | Группа 2:2 p=0,50355 |
| Х4 | 1,6 | 2,9 |
| Х5 | 0,8 | -0,1 |
| Х6 | 0,4 | 1,2 |
| Константа | -16,2 | -22,1 |
В соответствии с этим для каждой исследовательской группы были получены решающие правила, представляющие собой линейные классификационные функции:
ЛКФ1= -16,2+1,6х4+0,8х5+0,4х6,
ЛКФ2= -22,1+2,9х4 – 0,1х5+1,2х6,
где ЛКФ1 – линейная классификационная функция для группы прижизненных повреждений; ЛКФ2 – линейная классификационная функция для группы посмертных повреждений.
Для решения диагностической задачи по информативным признакам производится расчет ЛКФ для двух исследовательских групп. Случай относят к той группе, для которой ЛКФ примет максимальное значение.
Нами была определена общая эффективность модели, а именно, доля правильно распознанных случаев при вычислении ЛКФ и оценки их по решающим правилам. Показатель общей эффективности модели определяли как отношение доли совпавших случаев по апостериорным (в результате использования диагностической модели) к доле априорных (заранее известных) случаев, выраженный в процентах.
Точность диагностики прижизненности образования повреждений по решающим правилам в среднем составляет – 83,6%, для группы прижизненных повреждений – 84,3%, для группы посмертных повреждений – 83,1%.
Для оценки эффективности решающих правил диагностики, кроме определения показателя общей эффективности модели, было выполнено определение показателей чувствительности, специфичности, безошибочности, показателей ложноотрицательных ответов и ложноположительных ответов (табл. 5).
Таблица 5. Показатели эффективности решающих правил диагностики для исследовательских групп по результатам дискриминантного анализа
| Группа | Показатель | ||||
| чувствитель-ности | специфичности | безошибоч-ности | ложноотрица-тельных ответов | ложнополо- жительных ответов | |
| 1 | 84,3% | 83,1% | 83,7% | 15,7% | 16,9% |
| 2 | 83,1% | 84,3% | 83,7% | 16,9% | 15,7% |
4. Математическое моделирование диагностики давности образования прижизненных повреждений
Методом корреляционного анализа определена сила связи изучаемых параметров эритроцитов со временем (давностью) причинения повреждений.
Из данных корреляционной матрицы изучаемых параметров (Х1 – Х8) с признаком «время (давность) причинения повреждений» (Y) следует, что прямая связь признака «время» установлена со следующими параметрами: диаметр эритроцита, глубина центральной впадины диска эритроцита, количество пор в мембране эритроцита и сила адгезии на подложке образца; обратная связь – с параметрами высоты эритроцита, глубины «эрозий» мембраны, площадью «эрозий» мембраны и силой адгезии на мембране эритроцита. Признак «время» имеет сильную корреляционную связь с параметром «количество пор в мембране эритроцита» и слабые корреляционные связи с остальными изучаемыми параметрами. Значимыми являются коэффициенты корреляции rx4y (p0,000), rx5y (p0,000), rx6y (p0,008).
Модель для признака «время (давность) причинения повреждений» получена методом пошагового регрессионного анализа. Отбор значимых факторов для включения в модель проведен при уровне F=1, что обеспечивает уровень значимости коэффициентов р0,30, а достоверность 1 – р0,70.
Коэффициенты признаков для модели и их уровни их значимости представлены в таблице 6.
Таблица 6. Коэффициенты признаков эритроцитов для модели диагностики давности образования повреждений
| Признак | Условное обозначение | Коэффициент модели | Уровень значимости, р |
| Диаметр эритроцита | Х1 | 3,2 | 0,001 |
| Высота эритроцита | Х2 | 1,5 | 0,17 |
| Глубина центральной впадины диска эритроцита | Х3 | -0,5 | 0,7 |
| Количество пор в мембране эритроцита | Х4 | 9,0 | 0,000 |
| Глубина «эрозий» мембраны | Х5 | -3,7 | 0,000 |
| Площадь «эрозий» мембраны | Х6 | 1,8 | 0,14 |
| Сила адгезии на мембране эритроцита | Х7 | -2,8 | 0,07 |
| Сила адгезии на подложке исследуемого образца | Х8 | 1,5 | 0,39 |
Модель для признака «время» (давность) причинения повреждений» имеет вид:
= -8+3,2Х1+1,5Х2+9Х4–3,7Х5+1,8Х6–2,8Х7
Для оценки информативности и значимости полученной модели выполнен дисперсионный анализ, по результатам которого выявлено, что информативность полученной модели составляет 83 %.
ВЫВОДЫ
1. Оптимальным способом подготовки пробы крови для атомно-силовой микроскопии, позволяющим регистрировать морфологические параметры эритроцитов (диаметр, высоту и глубину центральной впадины, а также наноструктуры поверхности мембраны) в максимальной близости к их нативному состоянию, является фиксация мазка крови высушиванием на воздухе.
2. Выявлены морфологические признаки эритроцитов периферической крови, обладающие изменчивостью в связи с нанесением резаной раны и последующим развитием раневого процесса: объемные параметры клетки (диаметр, высота и глубина центральной впадины диска эритроцита), ультраструктурные характеристики мембраны эритроцита (количество пор, глубина и площадь «эрозий» мембраны эритроцита).
Указанные изменения, выявляемые методом атомно-силовой микроскопии, могут являться одним из факторов, способствующих формированию стазов и сладжей эритроцитов в сосудах.
3. Установлена следующая хронологическая последовательность изменений морфологических параметров эритроцитов периферической крови в раннем (до 40 минут) пре- и постмортальном периодах:
- при прижизненно причиненных резаных ранах к 20-ой минуте выявлено: увеличение объема эритроцита (за счет увеличения диаметра и высоты клетки), увеличение глубины центральной впадины диска эритроцита, увеличение количества пор, уменьшение количества эритроцитов, имеющих «эрозии» поверхности мембраны (по сравнению с группой контроля), уменьшение глубины и увеличение площади «эрозий» мембраны; к 40-ой минуте при прижизненно причиненных резаных ранах: значения диаметра, высоты, глубины и площади «эрозий» мембраны от контрольных значений не отличались, а глубина центральной впадины диска клетки и количество пор в мембране эритроцита достоверно увеличивались;
- при посмертно причиненных резаных ранах к 40-ой минуте выявлено увеличение диаметра и снижение высоты эритроцита, уменьшение выраженности центральной впадины диска клетки, двукратное увеличение количества пор в мембране эритроцита, уменьшение площади поверхности «эрозий» мембраны.
4. Атомно-силовая микроскопия мазков периферической крови с использованием предложенной математической модели дискриминантного анализа может служить лабораторным методом определения прижизненности образования повреждений.
5. Разработанное посредством регрессионного анализа уравнение является математической моделью, позволяющей определять давность образования резаных ран по результатам исследования эритроцитов периферической крови в пределах 40 минут после причинения повреждения.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
При решении диагностической задачи определения прижизненности и/или давности образования прижизненного повреждения методом атомно-силовой микроскопии объектом исследования являются эритроциты периферической крови.
При заборе пробы крови для проведения исследований необходимо учитывать то обстоятельство, что при непосредственном контакте крови с металлической иглой, имеющей малый внутренний диаметр, могут произойти изменения как физико-химического состояния мембран клеток крови, так и их деформация. Во избежание вышеуказанных изменений морфологических характеристик эритроцитов представляется целесообразным выполнение забора крови при помощи игл, покрытых силиконом или венозного катетера для канюлирования вены с минимальной травматичностью, состоящего из иглы, покрытой силиконом и биосовместимого материала собственно катетера.
Мазок крови готовят по стандартной методике, используют шпатель для приготовления мазка из «мягкого пластика» с закругленным краем. Капля крови должна быть небольшой и соразмерна стеклянной подложке так, чтобы весь мазок помещался на стекле, не доходя 0,2-0,3 см до его края. При приготовлении мазка крови нельзя сильно прижимать шпатель к стеклу, дабы механически не повредить клетки крови. Мазки «густо-розового» и красного цвета непригодны для проведения исследований, так как клеточные элементы в таких мазках расположены в несколько слоев.
Для исследований мазков крови методом атомно-силовой микроскопии мазок должен содержать только один слой клеток. Хорошо выполненный мазок имеет слабый желтый цвет и оканчивается «метелочкой». После приготовления мазка его сушат на воздухе до исчезновения влажного блеска. Для хранения мазков крови можно использовать полиэтиленовые упаковочные пакеты с «застежкой».
Список работ, опубликованных по теме диссертации
1. Белоусова, О.Д. Быстротекущие изменения структурно-функциональной организации мембран эритроцитов в раннем периоде травматического стресса по данным сканирующей зондовой микроскопии / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш, Ю.П. Панчук // Современные проблемы военной медицины, обитаемости и профессионального отбора: материалы Всероссийской научно-практической конференции, 17-18 ноября 2011г. – СПб., 2011. – С.201.
2. Белоусова, О.Д. Содержание химических элементов на поверхности мембран эритроцитов в раннем периоде травматического стресса по данным рентген-энергодисперсионного анализа / О.Д. Белоусова // Тезисы IV Международного молодежного медицинского конгресса «Санкт-Петербургские научные чтения-2011», 7-9 декабря 2011г. – СПб., 2011. – С.251.
3. Толмачев, И.А. Изменение клеточных мембран эритроцитов в раннем периоде травматического стресса по данным атомно-силовой микроскопии /А.А. Гайдаш, О.Д. Белоусова, Ю.П. Панчук, А.О. Голубок, В.В. Левичев, И.С. Мухин, С.А. Черевков, И.С. Белоусов // Современная военно-полевая хирургия и хирургия повреждений: материалы Всероссийской научной конференции с международным участием, 13-14 октября 2011г. – СПб., 2011. – С.168.
4. Белоусова, О.Д. Возможности применения сканирующей зондовой микроскопии для определения динамики различий характеристик эритроцитов и структуры их поверхности при прижизненных и посмертных ранах / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш // Актуальные проблемы судебно-медицинской экспертизы: сборник тезисов научно-практической конференции с международным участием, 17-18 мая 2012г. / под ред. член. корр. РАМН Ю.И. Пиголкина, д.м.н. А.В. Ковалева. – М., 2012. – С.109-111.
5. Белоусова, О.Д. Буллезная деформация как один из механизмов повреждения эритроцитарных мембран в начальной стадии раневого процесса / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш, Ю.П. Панчук, И.С. Белоусов // Актуальные проблемы судебно-медицинской экспертизы: сборник тезисов научно-практической конференции с международным участием, 17-18 мая 2012г. / под ред. член. корр. РАМН Ю.И. Пиголкина, д.м.н. А.В. Ковалева. – М., 2012. – С.31-32.
6. Белоусова, О.Д. Химический состав и структура мембран эритроцитов периферического кровотока в раннем периоде раневого стресса по данным сканирующей электронной микроскопии / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш, Ю.П. Панчук, И.С. Белоусов // Актуальные проблемы судебно-медицинской экспертизы: сборник тезисов научно-практической конференции с международным участием, 17-18 мая 2012г. / под ред. член. корр. РАМН Ю.И. Пиголкина, д.м.н. А.В. Ковалева. – М., 2012. – С.33-34.
7. Белоусова, О.Д. Структура цитоплазматических мембран и химический состав эритроцитов в ранний период раневых повреждений по данным сканирующей зондовой микроскопии / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш, Е.В. Ивченко, А.О. Голубок, В.В. Левичев, И.С. Мухин, М.В. Жуков, И.В. Ткачук, И.С. Белоусов // Военно-медицинский журнал. – 2013. – Т.334, №1. – С. 19–24.
8. Белоусова, О.Д. Перспективы применения методов сканирующей зондовой микроскопии в судебно-медицинских исследованиях / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш // Судебно-медицинская экспертиза. – 2013. – №2. – С. 47–51.
9. Белоусова, О.Д. Особенности подготовки проб крови для исследования морфологических параметров и структуры мембран эритроцитов методом атомно-силовой микроскопии [Электронный ресурс] / О.Д. Белоусова, И.А. Толмачев, А.А. Гайдаш, В.В. Левичев, М.В. Жуков, И.С. Белоусов // Биомедицинский журнал Medline.ru. – 2012. – Т. 13, Ст. 80. – С. 954–966. – Режим доступа: http://medline.ru/public/art/tom13/art80.html

