Острая и внезапная сенсоневральная тугоухость: этиология, клиника, диагностика, эффективность ранней этиопатогенетической терапии
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ДОПОЛНИТЕЛЬНОГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «САНКТ-ПЕРЕРБУРГСКАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ ПОСЛЕДИПЛОМНОГО ОБРАЗОВАНИЯ ФЕДЕРАЛЬНОГО АГЕНСТВА ПО ЗДРАВООХРАНЕНИЮ И СОЦИАЛЬНОМУ РАЗВИТИЮ»
На правах рукописи
Беличева Эльвира Георгиевна
Острая и внезапная сенсоневральная тугоухость: этиология, клиника, диагностика, эффективность ранней этиопатогенетической терапии
14.00.04 - болезни уха, горла и носа
14.00.36 - аллергология и иммунология
Автореферат
на соискание ученой степени
доктора медицинских наук
Научные консультанты:
Доктор медицинских наук профессор В.И.Линьков
Доктор медицинских наук профессор Л.Н.Бубнова
Санкт-Петербург
2008
Работа выполнена в Санкт-Петербургской медицинской академии последипломного образования
| Научные консультанты: | доктор медицинских наук, профессор В.И.Линьков |
| доктор медицинских наук, профессор Л.Н. Бубнова | |
| Официальные оппоненты: | доктор медицинских наук, профессор Г.А. Таварткиладзе |
| доктор медицинских наук, профессор М.И.Говорун доктор медицинских наук, профессор Н.М.Калинина |
Ведущее учреждение: Российская медицинская академия последипломного образования
Защита диссертации состоится на заседании диссертационного совета
Д 215.002.09 при Военно-медицинской академии по адресу:
194175, г. Санкт-Петербург, ул. Лебедева, д.6.
С диссертацией можно ознакомиться в фундаментальной библиотеке академии.
Автореферат разослан « __» _____г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Черныш А.В.
Актуальность проблемы
Тугоухость является широко распространенным заболеванием. Число больных с нарушениями слуха в Российской Федерации превышает 13 млн. человек, более 1 млн. – это дети. Нарушения слуха имеются у 14% лиц в возрасте от 45 до 64 лет и у 30% лиц старше 65 лет. По данным ВОЗ, количество лиц с нарушением слуха в мире составляет около 4,2% всего населения Земного шара. Согласно прогнозам к 2020 году более 30% всей популяции земного шара будут иметь нарушения слуха (Таварткиладзе Г.А. и др., 2006). Актуальность и социальное значение проблемы ОСНТ обусловлены не только ростом числа больных, но и тем, что это заболевание поражает преимущественно лиц наиболее трудоспособного возраста, а также и с не всегда благоприятными результатами в отношении восстановления слуховой функции. Особое значение придаётся случаям острой сенсоневральной тугоухости (ОСНТ), поскольку именно при этих формах заболевания своевременная и адекватная помощь способствует улучшению и иногда даже восстановлению слуха. В противном случае в структурах слухового анализатора возникают необратимые нарушения, что приводит к развитию стойкой тугоухости или глухоте.
Несмотря на большое количество исследований, посвященных ОСНТ, остается нерешенным ряд основных вопросов патогенеза и лечения данного заболевания. До сих пор не существует единообразного подхода к определению собственно понятия ОСНТ и сроков ее возникновения. По определению одних авторов процесс может развиваться в течение 72 часов, другие ограничивают срок возникновения тугоухости 12 часами. Кроме того, существует и внезапная потеря слуха, когда тугоухость развивается молниеносно без каких либо предвестников. В настоящее время ОСНТ рассматривается как единая нозологическая единица с полиэтиологическим характером, известно около 100 этиологических факторов (состояний организма, заболеваний, факторов внешней среды, химических веществ, лекарственных препаратов), приводящих к возникновению острой сенсоневральной тугоухости.
Уже давно выдвигается тезис о необходимости четкой классификации и целесообразности выделения отдельных форм ОСНТ, так как существующая в настоящий момент этиологическая классификация не отражает патогенетических особенностей заболевания и не способствует разработке патогенетических методов лечения. (Пальчун В.Т., 1994).
В последнем десятилетии научный прогресс в исследовании проблемы сенсоневральной тугоухости обязан разработке и внедрению в медицинскую практику биотехнологических методов молекулярной биологии, благодаря им стало возможным открытие молекулярно-генетических факторов, определяющих наследственную природу нарушения слуха, понимание молекулярной патофизиологии тугоухости (Kikuchi T., 1995, Antoniadi T., 2001)
В настоящее время поиск в этом направлении ведется в основном в отношении наследственных форм или спорадических случаев прелингвальной сенсоневральной тугоухости. По данным G.E.Green et al. (2003) от 22 до 50% случаев хронической тугоухости, манифестирующей в раннем детском возрасте, обусловлена генетическими причинами.
Наследственный фактор актуален не только для спонтанно-развивающихся, но и для приобретенных фенотипов травматической и возрастной тугоухости (Bai U., 1997, Peters U., 2000, Prezant T. R, 1993, Sha S. H., 2001) Тугоухость, развивающаяся у взрослых, имеет многофакторную этиологию, в которой немалое место отводится генетическим причинам (Siedman M.D., 1997)
В настоящее время ОСНТ рассматривается как исключительно местное, локальное заболевание, связанное с поражением звуковоспринимающего аппарата внутреннего уха. Однако в последнее десятилетие многие авторы предлагают рассматривать ОСНТ как мультифакториальное заболевание, в этиологии и патогенезе которого играет роль определенное взаимодействие некоторых эндогенных факторов самого макроорганизма и экзогенных факторов внешней среды. Обращает на себя внимание факт, что далеко не у каждого человека развивается острая внезапная сенсоневральная тугоухость на фоне неблагоприятных отопатогенных факторов.
Поиск молекулярно-генетических факторов, определяющих снижение слуха или его потерю, является сегодня основным направлением, как в изучении патогенеза, так и в разработке мер по первичной профилактике СНТ.
Исследования последних десятилетий показали, что тканевые антигены Главного комплекса гистосовместимости человека относятся к эндогенным факторам риска развития многих заболеваний, так как являются условием для реализации действия средовых факторов. Важная роль в предрасположенности к развитию заболеваний при этом отводится генам главного комплекса гистосовместимости человека (системы HLA). Применительно к проблеме острой сенсоневральной тугоухости в литературе имеются лишь единичные работы, посвященные этой проблеме (Cao M.Y. et al., 1996, Yeo S.W. et al., 2000, Amor-Dorado J.C. et al., 2005).
Таким образом, развитие ОСНТ представляет собой сложнейший процесс взаимодействия огромного количества факторов, как внешней среды, так и внутренней среды организма. Множество этих факторов, а также динамичность многих из них не позволяет в настоящее время создать полноценную концепцию развития этого грозного заболевания. Однако с развитием новых направлений в медицине, таких как иммуногенетическое исследование, объективная аудиометрия, переоценка известных, но ранее малоизученных состояний, предоставляется возможность приблизиться к пониманию этого сложного процесса.
Цель: Повышение эффективности лечения и профилактики ОСНТ путем установления этиопатогенетических механизмов развития заболевания и разработки комплексного патогенетического метода лечения с применением отечественного антигипоксанта нового поколения Томпаслина.
Задачи исследования:
- Изучить клинические варианты ОСНТ, используя топическую диагностику уровня поражения звукового анализатора.
- Определить иммуногенетические и иммунологические особенности этиопатогенеза ОСНТ
- Установить значение генов-провокаторов и протекторов в предрасположенности к возникновению ОСНТ тугоухости.
- Изучить взаимосвязь индивидуальной чувствительности к гипоксической гипоксии и HLA-генотипа волонтеров по данным оксигемометрии
- Изучить в эксперименте фармакокинетику и антигипоксические свойства отечественного антигипоксанта нового поколения – препарата Томпаслин.
- Разработать метод патогенетической терапии с применением препарата Томпаслин.
- Оценить эффективность лечения ОСНТ с применением Томпаслина.
- Оценить отдаленные результаты лечения ОСНТ
Основные положения, выносимые на защиту:
- ОСНТ является гетерогенным заболеванием по основным этиологическим факторам, иммуногенетическим особенностям, иммунологическим нарушениям и эффективности лечения.
- Система HLA детерминирует индивидуальную чувствительность к гипоксии и является эндогенным фактором риска в развитии внезапной сенсоневральной тугоухости.
- Угнетение клеточного и гуморального иммунитета, снижение фагоцитарной активности являются важным звеном патогенеза ОСНТ
- Препарат Томпаслин обладает высокой антигипоксической и антисурдитантной активностью при действии различных отопатогенных факторов.
- Патогенетическим методом лечения ОСНТ является использование антигипоксанта Томпаслина в силу его выраженного протективного действия, обусловленного особенностями фармакокинетики, что обосновывает его применение для повышения эффективности лечения острой сенсоневральной тугоухости.
Научная новизна:
Впервые на основании комплексного изучения иммуногенетических, клинико-иммунологических факторов сформулирована и обоснована гипотеза о наследственной предрасположенности к развитию внезапной тугоухости, где ОСНТ рассматривается не как локальное заболевание внутреннего уха, а как генетически детерминированное гетерогенное заболевание.
Впервые показано, что индивидуальная чувствительность внутреннего уха к гипоксии является генетически опосредованной, что позволяет выделить группу риска развития ОСНТ.
Впервые установлено, что различные формы ОСНТ имеют иммунные нарушения различной степени выраженности (клеточного и гуморального иммунитета, процесса апоптоза, фагоцитоза). Это признаки, наряду с выявленными клиническими особенностями, позволили разработать новую концепцию ОСНТ, выделяющую две основные формы заболевания – внезапную и острую сенсоневральную тугоухость
Впервые в эксперименте на животных показана высокая антигипоксическая эффективность отечественного препарата Томпаслин и способность его проникать в ликвор и лабиринтную жидкость внутреннего уха, что позволило использовать его в качестве антисурдитантного препарата.
Впервые показано, что отечественный антигипоксант нового поколения Томпаслин является высокоэффективным средством лечения ОСНТ, позволяющим улучшить результаты лечения всех форм этого заболевания в среднем на 20% по сравнению с традиционным лечением.
Научно-практическая значимость
Результаты настоящего исследования имеют значение для дальнейшего развития представлений о патогенезе ОСНТ, решения медико-социальных задач лечения, а также осуществления первичной и вторичной профилактики ОСНТ.
Обнаруженные особенности иммуногенетического статуса у больных острой сенсоневральной тугоухостью позволяют рекомендовать метод молекулярно-генетического типирования для углубленной характеристики больных различных групп, прогнозирования характера течения заболевания и отдаленных результатов.
В ходе проведенного исследования получены данные, позволяющие прогнозировать риск развития острой сенсоневральной тугоухости и характер ее дальнейшего течения у больных, что дает возможность рационального решения вопросов лечения и диспансерного наблюдения за больными острой сенсоневральной тугоухостью.
С целью профилактики развития ОСНТ у лиц, работающих в экстремальных отопатогенных условиях, целесообразно исследовать иммуногенетический статус для формирования групп риска.
Апробация материалов диссертации:
Основные положения диссертационной работы доложены и обсуждены на Всероссийской научно-практическая конференции, посвященной 150-летию со дня рождения Н.П.Симановского (Санкт-Петербург, 2004), на Всероссийской научно-практической конференции с международным участием «Современные аспекты и перспективы развития оториноларингологии» (Москва, 2005), Всеармейской научно-практической конференции «Актуальные проблемы современной оториноларингологии», посвященной 130-летию со дня рождения В.И. Воячека (Санкт-Петербург, 2006), Всероссийской юбилейной конференции «Актуальные вопросы патологии уха и верхних дыхательных путей», посвященной 90-летию кафедры оториноларингологии Санкт-Петербургской медицинской академии последипломного образования (Санкт-Петербург, 2007), на пленарных заседаниях Санкт-Петербургского научно-медицинского общества оториноларингологов 2003, 2005, 2006, 2007 г.г.
Внедрение результатов
Результаты диссертационной работы внедрены в клиническую практику в ЛОР-клинике Санкт-Петербургской медицинской академии последипломного образования на базах Покровской больницы, Елизаветинской больницы, Областной клинической больницы, ЛОР-отделении 5-й городской инфекционной больницы, а также включены в учебный процесс по разделу острая сенсоневральная тугоухость.
Публикации:
По материалам диссертации опубликовано 17 работ в виде статей и тезисов в центральной печати, 12 в изданиях, рекомендуемых ВАК МО РФ для публикации статей, содержащих материалы диссертаций.
Структура и объем диссертации
Диссертация состоит из введения, обзора литературы, материалов и методов исследования, результатов собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы.
Диссертационная работа изложена на 240 страницах компьютерного набора текста (шрифт 14, интервал 1,5), иллюстрирована 45 таблицами и 15 рисунками.
Указатель литературы содержит 247 наименований источников, их них 80 отечественных и 167 иностранных работ.
Личный вклад автора.
Автором лично был проведен подбор, обследование и лечение всех больных, включенных в исследование. Лично выполнена экспериментальная часть работы по изучению фармакокинетики и протективного действия Томпаслина. Лично проведен анализ, статистическая обработка, обобщение и оформление результатов исследования. Личное участие в написание научных работ по теме диссертации – 95%.
Основное содержание работы
Объекты исследования
- 350 пациентов с острой сенсоневральной тугоухостью
- Для выявления лиц, высоко чувствительных к гипоксической гипоксии была проведена гипоксическая проба у группы из 148 здоровых волонтеров в возрасте от 18 до 25 лет
- В качестве экспериментальный животных было обследовано 210 мышей, 625 крыс, 24 кролика, 60 кошек (всего 919 животных)
- Лекарственный препарат Томпаслин
Критериями отбора больных служила типичная клиническая картина: острое или внезапное снижение слуха по перцептивному типу более чем 30 дБ на 3 частотах по данным пороговой тональной аудиометрии в течение 72 часов от начала заболевания. Все больные были госпитализированы немедленно после обращения. Обследование и лечение осуществлялось на кафедре оториноларингологии Санкт-Петербургской медицинской академии последипломного образования на базах Покровской и Елизаветинской больниц. Все больные обследованы непосредственно при поступлении в стационар и после окончании курса лечения (перед выпиской из стационара). 54 человека были обследованы в динамике отдаленные сроки - от 3 до 12 лет.
Методы исследования:
В программу клинического обследования пациентов включалось: общеклиническое обследование больных, функциональное исследование слухового анализатора, иммунологическое и иммуногенетическое исследование.
При общеклиническом обследовании обращалось внимание на жалобы больных: степень потери слуховой функции, наличие или отсутствие шума в ушах, его характеристики (высоко- или низкочастотный), время развития тугоухости, наличие или отсутствие вестибулярных расстройств, ощущение онемения в области ушной раковины, давность заболевания, проводимое лечение до обращения в стационар и оценка его эффективности. Производился сбор анамнезов заболевания и жизни. Сбор семейного анамнеза заключался в выяснении наличия у кровных родственников I степени родства заболеваний внутреннего уха, а также факторов риска развития сенсоневральной тугоухости (заболевания сердечно-сосудистой системы, нарушение углеводного, белкового, жирового обмена веществ и проч.). Для уточнения диагноза и исключения сопутствующей патологии проводилось эндоскопическое исследование ЛОР органов.
Проводилось рентгенологическое исследование сосцевидных отростков по Щуллеру, Маейру, при необходимости – компьютерно-томографическое или магнитно-резонансное исследование височных костей и полости черепа. С целью верификации возможной сосудистой этиологии ОСНТ производилась реоэнцефалография, доплеровское исследование магистральных сосудов шеи. У больных изучался клинический анализ крови, биохимические (содержание глюкозы, билирубина, белка и белковых фракций, электролитов), а также коагулляционные показатели крови.
Для выявления сопутствующей соматической патологии (шейный остеохондроз, заболевания сердечно-сосудистой и эндокринных систем) проводились консультации специалистов: терапевта, невролога, офтальмолога.
Функциональное исследование слухового анализатора включало исследование слуха с помощью шепотной и разговорной речи, камертональных методов исследования, проведения тональной пороговой и надпороговой аудиометрии. При невозможности дифференциальной диагностики периферической и ретрокохлеарной тугоухости методами надпороговой аудиометрии проводилась объективная оценка слуховой функции с помощью импедансометрии, отоакустической эмиссии, слуховых вызванных потенциалов. Степень утраты слуховой функции оценивалась по критериям международной классификации тугоухости.
Тональная пороговая аудиометрия проводилась на клиническом аудиометре A222 Interacoustics (Дания). Пороги слышимости устанавливались методом «границ» в диапазоне 125-8000 Гц по воздушной проводимости и 250-4000 Гц по костно-тканевой, по «восходящей» методике (Лопотко А.И. и др., 1986) Порогом слышимости считали интенсивность звука в дБ, получаемую как среднее арифметическое 3-х исследований на каждой частоте. Данные представлялись в виде тональной аудиограммы до и после прохождения курса лечения.
Иммунологическое исследование включало:
1. Изучение субпопуляционного состава лимфоцитов периферической крови с помощью моноклональных антител к различным дифференцировочным антигенам (табл. 1) в микроварианте лимфоцитотоксического теста (Исхаков А., 1988)
Таблица 1
Характеристика исследованных дифференцировочных антигенов
| Антиген | Характеристика |
| CD3+ | Зрелые Т-лимфоциты, Т-клеточный рецепторный комплекс |
| CD4+ | Т-лимфоциты (хелперы) |
| CD8+ | Т-лимфоциты (цитотоксические/супрессоры) |
| CD20+ | Зрелые В-лимфоциты |
| CD25+ | Рецептор к ИЛ-2 (IL-2R), маркер активации Т- и В-лимфоцитов |
| CD95+ | Fas-Ag, рецептор фактора некроза опухоли/фактор роста нервов |
2. Определение содержание иммуноглобулинов класса в сыворотке крови стандартным методом одномерной радиальной иммунодиффузии в агарозном геле по Mancini.
3. Определение уровня циркулирующих иммунных комплексов (ЦИК) средней и низкой молекулярной массы в сыворотке крови путем их осаждения в полиэтиленгликоле 5% и 7% концентрации, соответственно (Hashkova V., 1978)
4. Определение фагоцитарной активности нейтрофильных гранулоцитов исследовали методом Райта с использованием суточной культуры убитых клеток Staphyloccoccus аureus. Определяли фагоцитарный индекс (ФИ%) - процент фагоцитирующих клеток, фагоцитарное число (ФЧ) – среднее количество фагоцитированных микробных частиц, приходящихся на 1 фагоцит через 30 и 120 минут, и индекс завершенности фагоцитоза (ИЗФ).
Результаты, полученные при исследовании состояния иммунной системы больных ОСНТ, сопоставляли с результатами исследования иммунной системы контрольной группы, представленной практически здоровыми жителями Северо-Западного региона России. Для сопоставления иммунологических параметров была обследована группа из 50 доноров крови Российского НИИ гематологии и трансфузиологии в возрасте от 20 до 55 лет.
Иммуногенетическое исследование
Тканевое типирование HLA антигенов I класса (локусы А, В) проводили с помощью лимфоцитотоксического теста (Terasaki Р., 1964) с использованием панели сывороток Российского НИИ гематологии и трансфузиологии, выявляющей 15 антигенов локуса А, 28 антигенов локуса В. Определение аллелей генов HLA II класса локусов HLA DRВ1, DQB1 проводили методом полимеразной цепной реакции. В серии последовательных амплификаций с панелью сиквенс-специфических праймеров определяли 11 аллелей HLA-DRВ1-гена и 5 аллелей HLA-DQB1-гена. Типирование аллелей каждого из генов проводили в два этапа. Первый – амплийфикация второго экзона с помощью соответствующих пар праймеров для генов DRВ1, DQB1 из геномной ДНК. Второй этап – серия амплификаций с панелью специфических праймеров, где в качестве амплифицируемой ДНК использовался продукт первого этапа. Специфичность продукта амплификации оценивали по его длине в соотношении со стандартным маркером длин ДНК (PUC-19), методом горизонтального электрофореза в 3% агарозном геле.
Схемы лечения больных ОСНТ
Первая группа пациентов (239 чел.) получала традиционное лечение, состоящее из ежедневного парэнетерального введения следующих препаратов:
- Трентал – 5,0 мл, 200мл 0,9% раствора натрия хлорида в/в капельно, №10.
- Эуфиллин 2,4% - 10,0 мл в/в, №10;
- Аскорбиновая кислота 5% - 5,0мл, в/в, №10
- Никотиновая кислота – 2,0мл п/к, №10
- Мильгама 1,0 в/м №10
Средства, указанные в приведенной схеме лечения, в основном, улучшают внутричерепную гемодинамику и микроциркуляцию органа слуха, а также способствуют передачи нервно-мышечного возбуждения. При наличии сопутствующих заболеваний проводилась симптоматическая терапия.
В связи с тем, что при сосудистых, инфекционных, токсических и других патологических воздействиях на слуховой анализатор основным звеном патогенеза развития сенсоневральной тугоухости является внутриулитковая гипоксия, наиболее перспективным для предотвращения функциональных дегенеративных изменений в структурах периферического отдела слухового анализатора при острой сенсоневральной тугоухости является применение антигипоксантов. Известно, что выраженной противогипоксической активностью обладают соединения индола (Пастушенков Л.В., 1998)
Поэтому нам представлялось оправданным применение в качестве антигипоксанта отечественного препарата Томпаслин, синтезированного на базе Химико-фармацефтического института (Томчин А. Б., Пономарева М. М., Пастушенков А. Л., А. с. СССР № 1045587, 2006). Название препарата образовано из фамилий авторов (Б. Томчин, Л. В. Пастушенков, В. И. Линьков), утверждено комиссией Фармкомитета МЗ РФ в 2007 году. Томпаслин 3-[(2-Морфолиноэтил)тио]-5Н-1,2,4-триазино[5,6-b] индола дигидрохлорид моногидрат относится к 7.2 фармакологической группе.
В рамках настоящей работы проведено сравнительное рандомизированное открытое клиническое исследование эффективности и безопасности препарата при острой и внезапной сенсоневральной тугоухости (II фаза). Согласно результатам проведенного доклинического (GLP) и пилотным клиническим исследованиям показано, что новый препарат практически нетоксичен, не вызывает нарушений биохимических показателей крови, не оказывает негативного воздействия на основные физиологические системы и внутренние органы; лекарственная форма препарата не вызывает раздражающего эффекта; препарат не оказывает аллергизирующего и тератогенного действия
Таким образом, вторая группа пациентов (111 человек) дополнительно к традиционному лечению использовался Томпаслин, который вводился внутривенно капельно 40мг на 100мл 0,9% раствора натрия хлорида № 5 ежедневно.
Методы статистического анализа
Статистическую обработку всех результатов исследований проводили с помощью персонального компьютера, используя программу «Microsoft Office Excel 2003». В работе использованы методы общей статистики (М, m, процентное распределение), корреляционного анализа, сравнения средних выборочных величин проводили с использованием t-критерия Стъюдента.
Для иммуногенетических исследований использовали, кроме того, расчет и анализ следующих показателей. Анализ результатов распределения HLA-специфичностей включал изучение частоты встречаемости антигенов (F) (Зарецкая Ю.М.,1983) и их различных сочетаний, показателей относительного (RR) риска развития заболевания, этиологической (EF) и превентивной (PF) фракций (Svejgaard A.,1994). Для оценки достоверности различий в группах сравнения использовали критерий Хи-квадрат (2) (Svejgaard A.,1994). Величину "p", соответствующую вычисленному значению Хи-квадрат, определяли с помощью компьютерной программы (Михин А.Е., 1990) с учетом одной степени свободы.
Методы экспериментальных исследований
Противогипоксическую активность Томпаслина и препарата сравнения (гутимина) оценивали по увеличению выживаемости животных в условиях различных форм гипоксии: гипобарической, циркуляторной, смешанной гипоксии и гипоксии “нагрузки”.
Острую гипобарическую гипоксическую гипоксию моделировали с использованием барокамеры с приточно-вытяжной вентиляцией на животных трех видов – 150 мышах, 250 крысах и 24 кроликах. Моделирование гипобарической гипоксической гипоксии на мышах осуществлялось созданием давления в барокамере, эквивалентного подъему на “высоту” 1100 м, на крысах - 1200 м, на кроликах - 10000 м. Экспозиция животных на “высоте” составляла 20 минут. Томпаслин вводился внутривенно и внутрибрюшинно за 10, 30, 60 минут до создания гипоксического состояния в широком диапазоне доз (2-128 мг/кг).
Для получения циркуляторной гипоксии применяли модели аноксии миокарда и ишемии головного мозга. Моделирование аноксии миокарда у 120 крыс осуществляли путем остановки дыхания после внутривенного введения 1% раствора дитилина с последующей регистрацией ЭКГ после последнего агонального вдоха. Ишемию головного мозга моделировали на 145 крысах-самцах при одномоментной, двухсторонней перевязке общих сонных артерий по общепринятой методике под легким эфирным наркозом.
Томпаслин вводили мышам в дозе 64 мг/кг и крысам в дозах 11 и 55 мг/кг внутрибрюшинно трехкратно в течение суток. Изменение двигательной и исследовательской активности животных определяли с помощью общепринятых методов актометрии и «открытого поля».
В качестве гипоксии “нагрузки” использовали плавание животных (60 мышей, 110 крыс) с грузом, составляющим 7 % массы тела, до истощения. Предварительно за 30 минут вводили Томпаслин в дозе 55 мг/кг, гутимин в дозе 100 мг/кг.
Острую токсичность Томпаслина (ЛД50) исследовали при внутрибрюшинном введении на белых крысах обоего пола массой 200-250 г.
Изучение активности Томпаслина в качестве антисурдитанта проводили на моделях острой сенсоневральной тугоухости (стрептомициновая интоксикация, острая акустическая травма и гипоксическая гипоксия) на половозрелых кошках обоего пола весом 2,5-3,0 кг. Под внутрибрюшинным нембуталовым наркозом (40 мг/кг) обнажали слуховую буллу кошки. С помощью специальной электрофизиологической установки проводили регистрацию параметров суммарного электрического ответа (СЭО) улитки кошки в ответ на короткий звуковой сигнал “щелчок” длительностью 100 мсек в нормальных условиях, далее после действия различных патологических факторов и при сочетании патологического фактора и предварительного введения Томпаслина, который вводили однократно внутривенно за 1 ч до патологического воздействия на улитку в дозе 5 мг/кг веса животного.
Для моделирования стрептомициновой интоксикации слуховую буллу кошки заполняли на 15 минут раствором стрептомицина сульфата 0,5 мл (50 тыс. ЕД в 1 мл), предварительно произведя регистрацию амплитудных и временных параметров СЭО улитки. Далее раствор отсасывали, буллу промывали изотоническим раствором хлорида натрия и наблюдали за изменением СЭО улитки через 30 мин и 120 мин.
Моделирование острой гипоксической гипоксии осуществлялось вдыханием в течение 30 минут газовой смеси, содержащей 7% кислорода и 93% азота.
Для моделирования острой акустической травмы проводили озвучивание “белым шумом” интенсивностью 105 дБ над нормальным порогом слышимости в течение 5 минут. Изменение амплитудных характеристик наблюдали сразу после звуковой нагрузки и через 1 ч после озвучивания.
Для изучения способности Томпаслина проникать через гематоэнцефалический и гематолабиринтный барьер проводилось изучение концентрации Т в сыворотке крови, ликворе и лабиринтной жидкости. Определение концентрации томпаслина в физиологических жидкостях осуществлялось методом обратнофазовой микроколоночной хроматографии.
Для определения индивидуальной чувствительности (толерантности) к дефициту кислорода у волонтеров проводили гипоксическую пробу дыханием гипоксической смеси, содержащей 10% кислородно-азотной смеси при обычном атмосферном давлении, что соответствует подъему на высоту 5000 м. На основании данных оксигемометрии выделялась группа лиц, высокочувствительных к гипоксии и затем у них исследовался иммуногенетический статус.
Экспериментальная часть исследования
Противогипоксическую активность Томпаслина и препарата сравнения (гутимина) оценивали по увеличению выживаемости животных в условиях различных форм гипоксии: гипобарической, циркуляторной, смешанной гипоксии и гипоксии “нагрузки”.
Предварительное применение Томпаслина положительно влияет на выживаемость мышей в условиях гипобарической гипоксии. В контроле гибель мышей происходит через 2,2 ± 0,2 минуты, предварительное введение томпаслина в дозе 32мг/кг и 64 мг/кг повышает выживаемость мышей до 50 и 60% и увеличивает среднюю продолжительность жизни в 5-7 раз. Анализируя влияние доз и времени введения томпаслина на продолжительность жизни и выживаемость мышей, можно заключить, что средняя продолжительность жизни находится в прямой зависимости от дозы препарата, а увеличение времени введения препарата даже в большей дозе приводит к уменьшению процента выживаемости животных. Аналогичная картина наблюдается в опытах с крысами. Средняя продолжительность жизни крыс на «высоте» составила 4,9±0,8 минут, предварительное введение томпаслина в дозах 8,5 и 17 мг/кг увеличивает выживаемость до 30 и 40 % животных соответственно, то есть более чем в 2 раза. Применение томпаслина приводит также к увеличению продолжительности жизни у 52% кроликов в условиях гипоксии. Приведенные данные свидетельствуют о том, что препарат обладает выраженным противогипоксическим эффектом независимо от вида испытуемых животных. Этот эффект характеризуется достаточной фармакологической широтой. Действительно, величина ЛД50 томпаслина при внутрибрюшинном введении крысам составляет 550 мг/кг. Оптимальный противогипоксический эффект у крыс достигается при введении 1/10 ЛД50, а максимально вводимая доза томпаслина (110 мг/г), обеспечивающая выживаемость 87 % животных, соответствует 1/5 ЛД50.
На модели аноксии миокарда у крыс при раздельном внутрибрюшинном введении Томпаслина в дозе 55 мг/кг и гутимина в дозе 50 мг/кг длительность работы сердца, составляющая в контроле 7,5 ± 0,3 мин, увеличивается на 45 и 42 % (составляет 10,88 ± 0,4 мин и 10,65 ± 0,3 соответственно, р<0,05). На модели ишемии головного мозга при трехкратном (в течение 24 ч) внутрибрюшинном введении Томпаслина (55 мг/кг) и гутимина (50 мг/кг) выжило70 и 50 % животных соответственно, а в контрольной группе 10 % (р < 0,001).
При гипоксии «нагрузки» время плавания мышей в контроле составляет 6,9 ± 0,3 мин. При введении Томпаслина внутрибрюшинно в дозе 55 мг/кг длительность плавания мышей увеличивается на 138 ± 2% и составляет 9,52 ± 0,4 мин (р<0,05), тогда как гутимин в дозе 100 мг/кг вообще не изменяет уровня физической работоспособности животных.
Таким образом, томпаслин обладает сопоставимой с гутимином противогипоксической активностью при гипоксической и циркуляторной гипоксии, но превосходит его на модели гипоксии “нагрузки”. Противогипоксическая активность препарата не является видоспецифичной.
Нами проведено экспериментальное изучение антисурдитантного действия томпаслина при различных патологических состояниях с использованием объективных методов оценки функции периферического отдела слухового анализатора по данным регистрации биоэлектрической активности улитки.
В эксперименте были изучены показатели электрической активности улитки в норме, в условиях воздействия таких отопатогенных факторов как гипоксическая гипоксия, ототоксический антибиотик стрептомицин и воздействие отопатогенного фактора на фоне применения антигипоксанта.
В нормальных условиях при увеличении интенсивности звуковой нагрузки от 10 до 80 дБ происходит увеличение амплитуды МП с 30,3±0,8 до 1758,33±4,4 мкв и АП со 153,0±2,5 до 1750,00±5,7 мкв, средние значения равны соответственно 823,3±1,8 и 844,8±2,7 мкв.
В эксперименте по моделированию стрептомициновой интоксикации биоэлектрическая активность улитки резко снижается. При этом происходит угнетение функции рецепторного аппарата улитки, о чем свидетельствует уменьшение амплитуды МП при интенсивности «щелчка» в диапазоне от 10 до 80 дБ в среднем до 54,6±1,3% и АП до 47,1±4,8% от исходного значения без видимой тенденции к восстановлению. Однако при сочетанном воздействии стрептомицина на фоне применения Томпаслина уже через 30 минут после удаления стрептомицина начинает проявляться положительный эффект антигипоксанта: амплитуда МП в среднем составляет 66,4±1,3 % от нормы, а АП – 61,6±3,1 %, а через 2 часа уже 77,9±1,3 % и 80,9±3,1 % соответственно. Таким образом, предварительное применение томпаслина на 23,3 % увеличивает амплитуду МП и на 33,8 % N1 АП, что свидетельствует о протективном действии томпаслина при развитии стрептомициновой интоксикации улитки. Следует отметить, что при экспериментальном введении антигипоксанта в физиологических условиях препарат не оказывает влияния на функцию улитки, то есть амплитудные и временные параметры СЭО в течение двух часов после введения препарата не отличаются от нормальных значений.
При острой гипоксической гипоксии суммарный электрический ответ улитки значительно отличается от нормы. Установлено, что непосредственно после действия 30 минутной гипоксии амплитуда МП снижается в среднем до 60,3±1,8% от нормы. В условиях гипоксии более существенно уменьшается амплитуда N1 акционного потенциала и составляет в среднем 28,1±2,3 % от нормы.
Оценивая положительный эффект Томпаслина на величину снижения и восстановления амплитуды СЭО в условиях гипоксии, установлено, что он начинает оказывать протективное влияние непосредственно после действия патологического фактора: средняя амплитуда МП составляет 69,3±1,9 %, N1 АП - 51,3±1,8 %, повышаясь в течение последующего часа до 74,9±1,6 % и 73,7±3,7 % соответственно. То есть применение Томпаслина при гипоксической гипоксии на 14,7 % восстанавливает амплитуду МП и на 45,6% АП.
В условиях звуковой нагрузки средняя амплитуда МП падает до 60,4±2,3 % от нормы, предварительное применение Томпаслина непосредственно после акутравмы восстанавливает амплитуду МП на 8,9%, а через час после нагрузки еще на 5,7 %, т.е. общий эффект применения препарата в восстановлении амплитуды МП составляет 14,6 %.
Однако в этих условиях более существенным оказывается изменение амплитуды N1 АП, которая составляет всего 24,1 % от нормы. Томпаслин уже сразу после акутравмы почти в 2 раза повышает данный показатель до 44,2 %, а через 60 минут до 65,1 %, т.е. амплитуда N1 АП восстанавливается на 41 %, что свидетельствует о большем влиянии Томпаслина на нервные проводящие пути слухового анализатора.
Таким образом, данные, полученные данные, свидетельствуют о высокой противогипоксической активности Томпаслина и позволяют считать этот препарат перспективным патогенетическим средством для лечения острой сенсоневральной тугоухости
Для изучения особенностей фармакокинетики томпаслина было определено его содержание в физиологических жидкостях (плазме крови, ликворе и лабиринтной жидкости) экспериментальных животных (кошках).
Установлено, что концентрация препарата в плазме крови через 10 минут после введения находится в пределах от 9,72±1,37 мкг/мл, постепенно снижаясь в течение часа до 4,76±0,67 мкг/мл. Причем в 70% случаев максимальная концентрация появляется через 10 минут после введения препарата, а в остальных случаях в течение ближайших 20 мин. Это согласуется с данными электрофизиологических исследований по протективному влиянию томпаслина на моделях сенсоневральной тугоухости, проявляющемуся в уменьшении длительности СОЭ сразу после действия патологического фактора.
Установлено, что томпаслин проникает через гематоэнцефалический и гематолабиринтный барьер и определяется в лабиринтной жидкости и ликворе в концентрациях соответственно 1,24±0,35мкг/мл и 0,82±0,16 мкг/мл, причем статистически достоверной разницы содержания препарата в физиологических жидкостях нет. Следовательно, препарат практически без потерь проникает в лабиринт и непосредственно действует на слуховой анализатор.
Таким образом, по данным изучения фармакокинетики трисана можно сделать вывод о том, что антигипоксическое действие трисана определяется его способностью проникать через гематолабиринтный и гематоэнцефалический барьер. Препарат оказывает непосредственное влияние на периферический отдел слухового анализатора, что позволяет его считать специфическим антисурдитантом и применять его как патогенетическое средство лечения ОСНТ.
Клиническая часть исследования
Обследовано 350 пациентов с ОСНТ в возрасте от 15 до 70 лет, из них 169 мужчин (48,29%) и 181 женщина (51,71 %). Средний возраст пациентов составил 44,92±0,79 года.
Анализ жалоб больных, характера развития тугоухости позволяет представить наиболее типичную клиническую картину заболевания. В 84,67% случаев тугоухость развивается либо одномоментно, либо сразу после сна. Наиболее частыми жалобами является высокочастотный шум в ушах, который имеет место у 98,39% больных, ощущение заложенности уха (77,82%), чувство онемения в области ушной раковины (69,35%). Больше половины больных (61,69%) предъявляет жалобы на головокружение и субъективные вестибулярные расстройства, которые в основном появляются одновременно со снижением слуха.
У 145 человек (41,43%) тугоухость развилась без видимой причины, эти больные составили группу идиопатической тугоухости. У 139 больных (39,71%) ОСНТ возникала на фоне ухудшения гипертонической болезни или перенесенного гипертонического криза накануне развития тугоухости, эти больные составили группу больных с сосудистыми факторами риска. Инфекционные факторы имели место у 43 больных (12,29%), когда появлению тугоухости непосредственно предшествовали грипп или ОРВИ. В группу других причин тугоухости были отнесены токсические, травматические факторы, сахарный диабет и психоэмоциональная нагрузка (23 человека - 6,57%). Все виды формы заболевания с равной частотой встречаются как у мужчин, так и у женщин. Частота развития идиопатической тугоухости неравномерна в разных возрастных категориях: пик заболеваемости приходится на самый активный трудоспособный возраст 30-50 лет, и значительно меньше в младшей и старшей возрастной группе. Тугоухость сосудистого генеза до 30 лет не встречается вовсе, а пик заболеваемости приходится на возраст от 50 до 60 лет, затем происходит резкий спад заболеваемости. Тугоухость, развившаяся от других причин, также как и тугоухость инфекционного генеза встречается во всех возрастных группах с одинаковой частотой.
ОСНТ является преимущественно односторонним заболеванием (у 93,23% больных). Двусторонний процесс при идиопатической тугоухости встречается в единичных случаях, при сосудистой тугоухости не было ни одного случая двустороннего поражения, а при инфекционной тугоухости двусторонняя тугоухость имела место у каждого четвертого больного.
Анализ данных аудиометрического обследования свидетельствует о наличии у больных нисходящего типа воздушной и костной проводимости с преимущественным повышением порогов на высокие частоты. До лечения средние пороги по костной проводимости составляли 49,05±1,55 дБ, по воздушной проводимости - 57,84±1,10 дБ, что соответствует 3 степени тугоухости.
Более выраженное снижение слуха наблюдается при идиопатической и сосудистой тугоухости (пороги по воздушной проводимости соответствуют 3 степени снижения слуховой функции), при инфекционной тугоухости - 2 степени, при других причинах заболевания тугоухость носит менее выраженных характер (1 степень снижения слуха).
Иммуногенетическое исследование
Известно, что гены Главного Комплекса Гистосовместимости Человека определяют генетически детерминированную предрасположенность или резистентность организма к тому или иному заболеванию. Чаще это бывают заболевания, этиология которых окончательно не установлена, или заболевания, которые характеризуются наличием аутоиммунного компонента.
Специфичности HLA системы могут быть ассоциированы не только с заболеванием как нозологической единицей, а и с его отдельными клиническими формами, сроками развития болезни, тяжестью ее течения, наличием осложнений и т.п. (Певницкий Л.А., 1988). Для выявления генетических факторов риска развития острой сенсоневральной тугоухости было проведено изучение особенностей распределения специфичностей локусов А, В, DRB1 и DQB1 в группах больных с идиопатической, сосудистой, инфекционной тугоухостью, а также в группе «других причин» развития заболевания.
У больных с идиопатической тугоухостью достоверно установлено, что антиген В 51 встречается в 2 раза чаще, чем у здоровых лиц (20,00% против 10,59% в контроле, 2=5,92, RR=2,11, EF=0,11, р<0,05), так же как и антиген В44 (32,31% против 17,73% в контроле, 2=9,24, RR=2,21, EF=0,18, р<0,01). В локусе DRB1 достоверно чаще встречалась специфичность DRB1*03, которая связана, как известно, со склонностью к аутоиммунным заболеваниям. (31,25% против 16,5% в контроле, 2=7,73, RR=2,30, ЕF=0,18, р<0,01).
Антиген В18 при этой форме тугоухости встречался в 2 раза реже, чем у здоровых лиц (6,15% против 15,46% в контроле, 2=4,27, RR=0,36, F=0,06 р<0,05), так же как и DRB1*04 (9,38% против 21,1% в контроле, 2=4,77, RR=0,39, РF=0,09, р<0,05) и DRB1*13 (12,50% против 23,7% в контроле, 2=3,95, RR=0,46, РF=0,13, р<0,05).
На основании этих данных можно сделать вывод о том, что антигены В 44 и В 51 ассоциированы с идиопатической тугоухостью и являются ее маркерами. При наличии антигена В 44 риск развития идиопатической тугоухости повышается в 2,21 раза, согласно рассчитанной этиологической фракции у 18% больных тугоухость связана с носительством данного антигена. Наличие антигена В51 увеличивает риск развития тугоухости в 2,11 раза, при этом тугоухость связана с носительством данного антигена у 11% больных. При наличии в генотипе DRB1*03 риск развития тугоухости увеличивается в 2,3 раза у 18 % больных. Специфичности В 18, DRB1*04, DRB1*13 являются протекторными в развитии идиопатической тугоухости.
В локусах А и DQB1 у больных с идиопатической тугоухостью в сравнении с контрольной группой достоверных различий выявлено не было.
Таким образом, маркерами идиопатической тугоухости являются специфичности В 44, В51 и DRB1*03. Аллели В 18 и DRB1*04 и DRB1*13 ассоциированы с резистентностью к идиопатической тугоухости.
При анализе распределения HLA специфичностей у больных с сосудистой этиологией в 2 раза чаще, чем среди здоровых встречался антиген В 38 (17,39% против 8,69% в контроле, 2=4,30, RR=2,21, ЕF=0,10).
В локусе DRB1 достоверно чаще встречается специфичность DRB1*15 (43,75% против 28,3% в контроле, 2=4,76, RR=1,97, ЕF=0,22).
В локусах А и DQВ1 достоверных отличий в антигенном составе тканей больных не выявлено.
Таким образом, в качестве маркеров внезапной тугоухости сосудистого генеза выявлены специфичности В 38 и DRB1*15. При наличии антигена В38 риск развития тугоухости сосудистого генеза увеличивается в 2,21 раза у 10 % больных. При наличии аллеля DRB1*15 риск развития тугоухости увеличивается в 1,97 раз, причем у 22% больных наличие этой специфичности этиологически связано с сосудистым генезом заболевания.
Анализ специфичностей HLA-системы у больных с тугоухостью инфекционного генеза, так же как и в группе с другими причинами не выявил генетической предрасположенности к развитию этих форм заболевания.
С целью установления связи HLA системы и индивидуальной чувствительности к гипоксии нами была проведена гипоксическая проба у добровольцев. По данным оксигемометрии из всех испытуемых выделена группа лиц с повышенной чувствительностью к острой гипоксической гипоксии, затем у этих же испытуемых исследовался антигенный состав тканей. Оказалось, что в группе испытуемых высоко чувствительных к гипоксии, достоверно повышена частота встречаемости антигенов В 38 (14,39% против 8,69% в контроле, 2=4,30, RR=2,21, ЕF=0,10), В51 (21,3% против 10,59% в контроле, 2 =6,03, RR=3,66, ЕF=0,20), DRB1*03 (29,25% против 16,5% в контроле, 2=6,73, RR=2,30, ЕF=0,18, р<0,01), а аллель DRВ1*04 вообще не встретился у этих лиц, хотя распространенность его среди популяции достаточно велика. То есть у этой группы лиц наиболее часто встречаются те же антигены, что и у больных с внезапной сенсоневральной тугоухостью.
Следовательно, наличие у человека этих антигенов, вероятно, определяет повышенную чувствительность к гипоксии, что может свидетельствовать об их провоцирующей роли в развитии ОСНТ при воздействии отопатогенных факторов.
Иммунологическое исследование
Для установления особенностей иммунного статуса больных ОСНТ нами было проведено изучение основных показателей клеточного и гуморального иммунитета, а также показателей фагоцитарной активности у больных ОСНТ (Табл.2).
Содержание Т-лимфоцитов в общей группе больных оказалось умеренно сниженным: (CD3+ 56,32±1,55% против 61,36±1,00% в контроле) за счет редукции как фракции Т-хелперов (CD4 25,28 ±1,26% против 36,91±1,07%), так и Т- цитотоксических/супрессорных (CD8 18,28 ±0,95% против 24,85±1,03%). При этом иммунорегуляторный индекс не отличался от нормальных значений, поскольку содержание обеих фракций лимфоцитов снижалось примерно в равной степени. Также установлено достоверное снижение общего количества активированных клеток CD25+ (19,02±1,17%) по сравнению с контрольной группой (24,14±1,45%). Число иммунокомпетентных клеток, экспрессирующих на своей поверхности Fas-антиген, оказалось почти в 2 раза выше нормального уровня CD95+ 25,87±1,23%, а в контроле 13,25±0,96.
Содержание в периферической крови В-лимфоцитов, оцениваемое по наличию клеток CD20+, в общей группе больных ОСНТ не отличалось от контрольной группы (23,47±1,07% против 22,02±1,11%). Таким образом, у больных ОСНТ выявлено угнетение Т-клеточного звена иммунитета, которое выражалось в снижении относительного содержания Т-лимфоцитов за счет уменьшения содержания как Т-хелперов, так и Т-цитотоксических/супрессоров, уменьшения числа активированных клеток СD25+. Увеличение относительного количества лимфоцитов с фенотипом СD95+ свидетельствует о повышенной готовности к апоптозу лимфоцитов больных ОСНТ. В-клеточное звено иммунитета у больных ОСНТ не изменено.
При анализе содержания иммунокомпетентных клеток в периферической крови больных идиопатической, сосудистой и инфекционной тугоухостью было установлено, что самые низкие показатели имели место у больных с инфекционной тугоухостью (41,70±1,15%), у больных двух других групп содержание Т-лимфоцитов снижено в равной степени.
Содержание В-лимфоцитов у больных с идиопатической (25,53±1,73%), сосудистой (21,29±1,38%) и инфекционной (27,70±4,15%) тугоухостью, как и в общей группе больных, не отличалось от контрольной группы (22,02±1,11%), хотя в последней группе больных можно отметить тенденцию к увеличению этой клеточной популяции.
Анализ содержания CD4+и CD8+фракций иммунокомпетентных клеток у больных показывал, что во всех группах имеются однотипные изменения клеточного иммунитета, причем более выраженные также у больных с инфекционной тугоухостью.
Таблица 2
Содержание основных фракций иммунокомпетентных клеток в периферической крови у больных ОСНТ
| Группы сравнения | Фракции иммунокомпетентных клеток (%) | Иммунорегуляторный индекс | |||||
| CD3 | CD4 | CD8 | CD20 | CD25 | CD95 | CD4/CD8 | |
| Общая группа | 56,32±1,55 | 25,28 ±1,26*** | 18,28±0,95*** | 23,47±1,07 | 19,02±1,17* | 25,87±1,23*** | 1,71±0,15 |
| Идиопатическая (1 группа) | 57,54±2,51 | 26,41±2,41*** | 19,39±1,72*** | 25,53±1,73 | 19,06±2,16* | 27,87±2,03*** | 1,52±0,12 |
| Сосудистая (2 группа) | 57,47±1,51 | 24,92±1,41*** | 18,65±1,03*** | 21,29±1,38 | 19,41±1,44* | 25,06±1,56*** | 1,55±0,14 |
| Инфекционная (3 группа) | 41,70±1,15** | 21,73±5,22*** | 9,81±4,11*** | 27,70±4,15 | 10,67±1,52*** | 20,63±5,44*** | 3,87±1,50*** |
| Контроль | 61,36±1,00 | 36,91±1,07 | 24,85±1,03 | 22,02±1,11 | 24,14±1,45 | 13,25±0,96 | 1,58±0,07 |
| Р 1-2 | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 | >0,05 |
| Р 1-3 | <0,05 | >0,05 | <0,05 | >0,05 | <0,05 | >0,05 | <0,01 |
| Р 2-3 | <0,05 | >0,05 | <0,05 | >0,05 | <0,05 | >0,05 | <0,01 |
* - p<0,05; ** — p<0,01; *** — p< 0,001 статистически значимые различия по t-критерию Стьюдента в сравнении с контролем:
Так, имеющееся снижение содержания Т-лимфоцитов у больных с идиопатической и сосудистой тугоухостью обусловлено уменьшением как хелперной субпопуляции CD4+, так и супрессорно-цитотоксической субпопуляции CD8+. Соотношение между этими субпопуляциями лимфоцитов не нарушено, поэтому иммунорегуляторный индекс не отличался от контроля. У больных с инфекционной тугоухостью содержание супрессорно-цитотоксической субпопуляции CD8+ оказалось значительно сниженным, что сказалось на увеличении иммунорегуляторного индекса.
Выявленное снижение активированных лимфоцитов в общей группе больных оказалось характерным для всех форм тугоухости: у больных с идиопатической тугоухостью содержание CD25 составило 19,06±2,16% против 24,14±1,45 % в контроле, сосудистой 19,41±1,44%, причем наиболее низкие показатели отмечались у больных с инфекционной тугоухостью: 10,67±1,52%, т.е. более чем 2 раза ниже, чем у здоровых лиц.
Содержание лимфоцитов с рецепторами апоптоза повышено во всех группах больных, причем более выраженные изменения отмечаются у больных с идиопатической (27,87±2,03%, в контроле 13,25±0,96%) и сосудистой тугоухостью (25,06±1,56%), у которых содержание CD95+ в 2 раза превышает нормальные значения. У больных с инфекционным генезом заболевания это повышение менее выражено (20,63±5,44%).
Повышение относительного содержания клеток, экспрессирующих рецепторы апоптоза, может свидетельствовать об активной элиминации аутореактивных и активированных Т-клеток у больных с ОСНТ.
Таким образом, при изучении иммунокомпетентных клеток больных ОСНТ установлены изменения клеточного звена иммунитета, которые выражаются в угнетении Т-хелперного и Т-супрессорного/цитотоксического звеньев иммунитета, снижение числа активированных клеток и повышение клеток с рецептором апоптоза CD95. Эти изменения однотипны для больных с идиопатической и сосудистой этиологией заболевания. Что же касается группы больных с инфекционной этиологией заболевания, то фенотипические характеристики иммунокомпетентных клеток у них имеют, во-первых, более выраженные отличия от нормальных показателей, а во-вторых, и от показателей обеих других групп: содержание CD8+ лимфоцитов у них снижено значительно сильнее, что отразилось на величине иммунорегуляторного индекса, он повышен более чем в 2 раза. Известно, что цитотоксические лимфоциты являются основным звеном противовирусного иммунитета и, возможно, имеющийся у больных с инфекционной тугоухостью резкий дефицит цитотоксических клеток CD8+ является причиной неэффективной элиминации инфекционных агентов. Продолжающаяся персистенция вирусов в организме приводит к развитию осложнений вирусной инфекции в виде токсического поражения волоскового аппарата внутреннего уха и возникновению тугоухости.
Резкое снижение числа активированных клеток у больных с инфекционной тугоухостью (их в 2 раза меньше, чем у больных обеих других групп) также подтверждает более выраженное угнетение клеточного иммунитета у больных этой группы.
Для изучения состояния гуморального иммунитета больных ОСНТ нами было определено содержание циркулирующих иммунных комплексов различной молекулярной массы (средне- и низкомолекулярные) и основных классов сывороточных иммуноглобулинов (IgA, IgG, IgM).
Наиболее значимые изменения со стороны гуморального иммунитета у больных с ОСНТ были обнаружены нами при изучении содержания циркулирующих иммунных комплексов различной молекулярной массы (Табл.3).
Таблица 3
Содержание циркулирующих иммунных комплексов различной молекулярной массы в сыворотке больных
| Группы сравнения | Содержание ЦИК (у.е.) | |
| среднемолекулярные | низкомолекулярные | |
| Общая группа | 41,64 ±3,18 * | 180,20±11,75 *** |
| Идиопатическая (1 группа) | 45,67 ±3,90 ** | 196,20 ±18,66 *** |
| Сосудистая (2 группа) | 42,67 ±4,93 * | 181,80 ±16,90 ** |
| Инфекционная (3 группа) | 19,33 ±5,59* | 111,30 ±7,48 |
| Контроль | 30,61± 3,28* | 111,73± 15,04 |
| Р 1-2 | >0,05 | >0,05 |
| Р 1-3 | <0,01 | <0,05 |
| Р 2-3 | <0,05 | <0,05 |
* p<0,05;** — p<0,01;*** — p< 0,001: статистически значимые различия по t-критерию Стьюдента в сравнении с контролем
Уровень как среднемолекулярных циркулирующих иммунных комплексов в сыворотке больных (41,64 ±3,18 у.е. против 30,61± 3,28 у.е. в контроле), так и низкомолекулярных (180,20±11,75 у.е. против 111,73± 15,04 у.е. в контроле) повышен по сравнению с уровнем у здоровых лиц. Причем более выраженные изменения касались низкомолекулярных ЦИК, которых оказалось почти в 2 раза больше нормы. Данный факт можно объяснить нарушением элиминации ЦИК, которые избегают захвата фагоцитами периферической крови.
При анализе содержания ЦИК в группах с различными этиологическими факторами выяснилось, что увеличение содержания среднемолекулярных ЦИК было выражено у больных с идиопатической (45,67 ±3,90 у.е.) и сосудистой тугоухостью (42,67 ±4,93 у.е.), в то время как у больных с и инфекционной тугоухостью эти показатели были даже ниже, чем в норме (19,33 ±5,59 у.е., против 30,61± 3,28 у.е. в контроле).
Аналогичные изменения наблюдались и в содержании низкомолекулярных ЦИК: у больных с идиопатической (196,20 ±18,66 у.е.) и сосудистой тугоухостью (181,80 ±16,90 у.е.) эти показатели значительно повышены, в то время как у больных с инфекционной тугоухостью концентрация низкомолекулярных ЦИК не отличалась от показателей контрольной группы (111,30 ±7,48 у.е.).
Таким образом, ОСНТ возникает на фоне выраженного угнетения Т-клеточного звена иммунитета, которое проявляется как угнетением Т-хелперной, так и Т- цитотоксической/супрессорной субпопуляций. Эти изменения характерны для всех форм внезапной тугоухости, однако наиболее выраженное угнетение клеточного звена иммунитета отмечается у больных с инфекционной тугоухостью. У этих больных отмечается наиболее выраженное уменьшение содержания как зрелых Т-лимфоцитов, так и Т-хелперов, а в особенности Т-цитотоксических/ супрессорных. По всей видимости, имеющийся у больных с инфекционной тугоухостью резкий дефицит цитотоксических клеток является одной из причин недостаточной элиминации инфекционных агентов и свидетельствует о неэффективной противовирусной защите организма. Продолжающаяся персистенция вирусов в организме приводит к развитию осложнений вирусной инфекции в виде токсического поражения волоскового аппарата внутреннего уха и возникновению тугоухости.
Изменения показателей гуморального звена иммунитета выявлены только у больных с сосудистой и идиопатической тугоухостью. Эти формы заболевания протекают на фоне активного аутоиммунного процесса и сопровождаются значительным увеличением концентрации циркулирующих иммунных комплексов. При тугоухости инфекционного генеза изменения гуморального иммунитета отсутствуют, использование глюкокортикоидных гормонов при этой форме тугоухости мы считаем не оправданным.
Для всех больных ОСНТ независимо от причины заболевания характерна повышенная готовность к процессу апоптоза лимфоцитов. Повышение относительного содержания клеток, экспрессирующих рецепторы апоптоза, может свидетельствовать об активной элиминации аутореактивных и активированных Т-клеток у больных с ОСНТ, причем готовность лимфоцитов к апоптозу более выражена у больных с идиопатической и сосудистой тугоухостью. Общее содержание В-клеток при ОСНТ не отличатся от нормы. Содержание основных классов иммуноглобулинов у больных ОСНТ находится в пределах нормы.
Результаты изучения фагоцитарной активности
Нами было изучено состояние поглощающей и переваривающей способности нейтрофилов как в общей группе больных ОСНТ, так и в группах больных с различными этиологическими факторами. При этом были обнаружены весьма существенные нарушения всех изученных показателей, характеризующих процесс фагоцитоза (табл. 4).
Таблица 4
Показатели фагоцитарной активности нейтрофилов периферической крови у больных ОСНТ
| Группы сравнения | Показатели фагоцитарной активности гранулоцитов | |||
| ФИ 30 мин(%) | ФЧ 30 мин | ФЧ 120 мин | ИЗФ | |
| Общая группа | 14,7 ±1,04*** | 3,39 ± 0,24*** | 3,81± 0,25 | 0,96 ± 0,05*** |
| Идиопатическая | 16,90±1,43*** | 3,90±0,71*** | 3,96±0,38 | 1,00±0,08*** |
| Сосудистая | 12,60±1,53*** | 3,72±0,40*** | 3,77±0,36 | 0,88±0,07*** |
| Инфекционная | 11,0±1,33*** | 3,01±0,32*** | 2,03±0,13* | 1,43±0,11* |
| Контрольная группа | 75,78±3,58 | 8,86±1,15 | 4,00± 0,63 | 2,46±0,25 |
* p<0,05;** — p<0,01;*** — p< 0,001 статистически значимые различия по t-критерию Стьюдента в сравнении с контролем
В общей группе больных отмечается резкое снижение числа активно фагоцитирующих гранулоцитов - почти в 4 раза по сравнению с контрольной группой (ФИ через 30 минут 14,7 ±1,04% против 75,78±3,58% р 0,001). Поглотительная способность нейтрофилов в группе больных угнетена в 2,5 раза: показатель фагоцитарного числа через 30 минут 3,39 ± 0,24 по сравнению с контролем, составившим 8,86±1,14. И хотя фагоцитарное число через 120 минут (3,81± 0,25), казалось бы, практически не отличается от контроля (4,00± 1,62), анализ динамики фагоцитарного процесса в течение 120 минут показывает, что переваривающая способность нейтрофилов при ОСНТ крайне низка. Это подтверждает индекс завершенности фагоцитоза: 0,96 ± 0,05 по сравнению с 2,46±0,25 в контрольной группе. Причем, ни у одного из пациентов показатели фагоцитарной активности не достигали нормальных значений.
Таким образом, для больных с ОСНТ характерно нарушение поглотительной способности фагоцитов, угнетение переваривающей способности и незавершенность процесса фагоцитоза. По всей видимости, неэффективность фагоцитоза при ОСНТ неблагоприятным образом сказывается на элиминации циркулирующих иммунных комплексов, уровень которых значительно повышен у большинства больных при этом заболевании
Подобный характер изменений был обнаружен и при анализе фагоцитарной активности во всех группах больных с различными этиологическими факторами (рис. 1, 2).
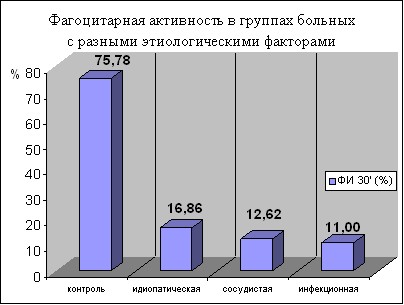
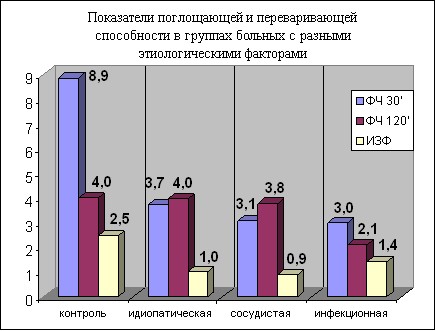
Рисунок 1 Рисунок 2
Так, при идиопатической тугоухости отмечается резкое снижение числа активно фагоцитирующих гранулоцитов (ФИ 16,86±1,43% по сравнению с контрольной группой 75,78±3,58 р0,001). Поглотительная способность нейтрофилов снижена в 2 раза (показатель фагоцитарного числа через 30 минут составляет 3,90±0,71 по сравнению с контролем 8,86±1,14 р0,001). При показателе фагоцитарного числа через 120 минут 3,96±0,38, который не отличался от контроля (4,00± 1,62), процесс фагоцитоза у больных проходил по незавершенному типу (ИЗФ 0,96 ± 0,05 в контрольной группе 2,46±0,25 р0,001).
При сосудистой тугоухости фагоцитарный индекс снижен более чем в 6 раз (12,60±1,53 против 75,78±3,58 в контроле р0,001). Поглотительная функция нейтрофилов также оказалась значительно сниженной (ФЧ 30 мин 3,72±0,40 против 8,86±1,14 в контроле). Фагоцитоз протекал по незавершенному типу (ИЗФ 0,88±0,07 в контрольной группе 2,46±0,25 р0,001).
Наиболее же выраженные изменения фагоцитарной активности наблюдаются при инфекционной тугоухости. При этой форме заболевания установлены самые низкие показатели фагоцитоза: резко, почти в 7 раз, снижено число активно фагоцитирующих нейтрофилов (ФИ 11,0±1,33). При этом отмечается трехкратное снижение их поглотительной способности (ФЧ 30 мин 3,01±0,32), угнетение переваривающей способности (ФЧ 120 мин 2,13±0,13) и незавершенность фагоцитоза (ИЗФ 1,43±0,11).
Подводя итог изучения состояния фагоцитоза при ОСНТ, можно сделать заключение о наличии существенного угнетения функциональной активности нейтрофилов при ОСНТ: резко уменьшено общее число фагоцитирующих клеток, фагоцитоз носит незавершенный характер вследствие значительного угнетения как поглотительной, так и переваривающей активности. Подобные изменения характерны для всех форм тугоухости независимо от этиологического фактора заболевания. Однотипность изменения фагоцитоза у больных с различными этиологическими факторами свидетельствует о том, что фагоцитарная активность является важным патогенетическим звеном развития данного заболевания.
Анализ факторов, влияющих на эффективность лечения
Для установления основных факторов, влияющих на результат лечения ОСНТ, нами были проанализирована эффективность лечения в зависимости от этиологии, сроков начала лечения, возраста, степени первоначальной тугоухости, основных показателей клеточного и гуморального иммунитета, а также различных схем лечения. Положительным эффектом лечения считалось уменьшение порогов по воздушной проводимости на речевые частоты больше чем на 15 дБ.
В результате проведенного исследования установлена зависимость эффективности лечения от этиологического фактора. Наилучшие результаты лечения были достигнуты у больных с идиопатической и сосудистой тугоухостью (83,17% и 80,58% соответственно), и наименее результативно оказалось лечение инфекционной тугоухости, всего в 60% удалось добиться улучшения слуховой функции. Средняя прибавка слуха по воздушной проводимости у больных идиопатической тугоухостью составила 29,40±1,23 дБ, у больных сосудистой тугоухостью 23,07±1,41 дБ, и значительно меньшей прибавки удалось достигнуть у больных в группе инфекционной тугоухости 19,41±2,01 дБ и в группе других причин заболевания 20,21±3,23 дБ. Таким образом, идиопатическая и сосудистая формы внезапной тугоухости лучше поддаются лечению. Возраст и пол больных не оказывают значимого влияния на эффективность лечения.
Установлено, что имеются значительные отличия в степени угнетения клеточного иммунитета между группами больных с различным эффектом от проведенной терапии. Так, в группе больных с неблагоприятным исходом лечения снижение содержания Т-лимфоцитов (CD3 43,81±9,73%) более выражено по сравнению с группой благоприятного исхода заболевания (57,51±1,39 %). В группе неблагоприятного исхода заболевания также оказалось сниженным содержание субпопуляций лимфоцитов с фенотипом CD4 (20,43±4,61%), CD8 (11,96±2,53%) и CD25 (13,67±2,21%) по сравнению с благоприятным исходом заболевания 25,65±1,32%, 18,89±1,00% и 19,53±1,26% соответственно. На основании полученных данных можно сделать заключение о неблагоприятном влиянии боле выраженного дефицита Т-клеток на исход заболевания ОСНТ, при этом не только относительный дефицит Т-клеток, но и степень угнетения иммунитета оказывает неблагоприятное влияние на эффективность лечения. Что касается клеток, готовых к апоптозу, то в группе с положительным исходом заболевания их содержание в 2 раза превышает нормальные значения (27,05±1,26% против 13,25±0,96% в контроле), в то время как в группе неблагоприятного исхода содержание CD95 находится в пределах нормы (13,89±1,80%). По всей видимости, активация апоптоза лимфоцитов при ОСНТ является благоприятным моментом для лечения. Таким образом, на основании полученных данных можно сделать заключение о том, что степень угнетения иммунитета является значимым фактором для прогнозирования эффективности лечения: чем больше выражено угнетение Т-клеточного звена, тем хуже прогноз заболевания. Повышение готовности к апоптозу, наоборот, положительно влияет на исход заболевания.
При изучении влияния показателей гуморального иммунитета на исход заболевания достоверных отличий между группами установлено не было.
Анализ влияния показателей фагоцитоза на исход заболевания выявил, что в группе больных с неэффективным лечением фагоцитарная активность нейтрофилов угнетена значительно в большей степени: фагоцитарный индекс (6,67±0,56%) оказался более чем в 2 раза ниже, чем группе больных с улучшением слуха (15,04±1,05%). Также имеются достоверные отличия между группами в переваривающей способности нейтрофилов: фагоцитарное число в группе больных с отсутствием эффекта от лечения через 120 мин (2,13±0,15) оказалось значительно ниже, чем в группе положительного исхода заболевания (3,49±0,26). На основании полученных данных можно заключить, что степень угнетения процесса фагоцитоза является неблагоприятным прогностическим фактором.
Анализ отдаленных результатов лечения свидетельствует, что с течением времени в дальнейшем не происходит дальнейшего рецидива заболевания, как больное, так здоровое ухо подвержены возрастным изменениям.
Сравнительная эффективность лечения в группах больных, получавших традиционную терапию и с антигипоксантом Томпаслин
В лечении больных с острой и внезапной сенсоневральной тугоухостью применялись две схемы. Традиционную терапию 239 пациентов получали. Полученные экспериментальные данные, свидетельствующие о высокой противогипоксической активности Трисана, позволили использовать этот препарат в комплексном лечении 111 пациентов. Проведенный сравнительный анализ влияния на эффективность лечения сроков начала лечения и применения различных схем терапии установил наиболее значимое влияние этих факторов на исход заболевания.
Наибольшей эффективности в группе традиционного лечения (около 70%) удалось добиться при лечении, начатом в первые 2 недели заболевания, однако в дальнейшем эффективность его значительно снижается и при лечении, начатом на 3 неделе, положительного исхода удается добиться менее чем у половины больных. Таким образом, общая эффективность лечения больных первой группы составляет 59,8%.
В группе из 111 пациентов, получавших антигипоксант Томпаслин (табл.6), наибольшая эффективность (90,6%) наблюдалась при лечении, начатом в первую неделю от развития заболевания, постепенно снижаясь до 75% к 3 недели. Таким образом, общая эффективность в этой группе составила 79,3%.
Таблица 5
Результаты лечения в группе больных, получавших традиционную терапию
| Эффективность | Сроки начала лечения | всего | |||
| 1 неделя | 2 неделя | 3 неделя | больше 3 недель | ||
| Есть эффект %(кол-во) | 73,8 (76) | 70,7 (29) | 45,6 (26) | 31,6 (12) | 59,8 (143) |
| нет эффекта %(кол-во) | 26,2 (27) | 29,3 (12) | 54,4 (31) | 68,4 (26) | 40,2 (96) |
| всего | 103 | 41 | 57 | 38 | 239 |
Таблица 6
Эффективность лечения в группе больных, получавших Томпаслин
| Эффективность | Сроки начала лечения | всего | |||
| 1 неделя | 2 неделя | 3 неделя | больше 3 недель | ||
| есть эффект %(кол-во) | 90,6%(48) | 82,6%(19) | 75,0%(12) | 47,4%(9) | 79,3%(88) |
| Нет эффекта %(кол-во) | 9,4%(5) | 17,4%(4) | 25,0%(4) | 52,6%(10) | 20,7%(23) |
| всего | 53 | 23 | 16 | 19 | 111 |
Проведенный анализ пороговых воздушных аудиограмм, показывает, что в группе больных, получавших традиционную терапию до лечения средние пороги по воздушному проведению составили 62,8±3,3 дБ, а после лечения 40,4±4,3 дБ, то есть в среднем удалось улучшить слуховую функцию только на 22,3±0,9 дБ. У больных, получавших Томпаслин, удалось достичь значительно большей прибавки слуха, чем в группе, лечившихся традиционной терапией: до лечения средняя аудиограмма составила 71,6±0,4 дБ, после лечения 40,8±0,8 дБ, то есть в среднем удалось улучшить слух более чем на 30 дБ. Важным также является тот факт, что в группе больных, получавших Томпаслин, слуховая функция начинала восстанавливаться обычно на 3-4 день, в то время как в группе традиционного лечения на 5-7 день.
Таким образом, антигипоксант Томпаслин является высокоэффективным патогенетическим средством лечения ОСНТ, позволяющим повысить эффективность лечения на 20 % по сравнению с традиционной терапией и достичь большего улучшения слуховой функции в максимально короткие сроки.
Практические рекомендации
Обнаруженные особенности иммуногенетического статуса у больных острой сенсоневральной тугоухостью позволяют рекомендовать метод молекулярно-генетического типирования для углубленной характеристики больных различных групп, прогнозирования характера течения заболевания и отдаленных результатов.
В ходе проведенного исследования получены данные, позволяющие прогнозировать риск развития острой сенсоневральной тугоухости и характер ее дальнейшего течения у больных, что дает возможность рационального решения вопросов лечения и диспансерного наблюдения за больными острой сенсоневральной тугоухостью.
С целью профилактики развития ОСНТ у лиц, работающих в экстремальных отопатогенных условиях целесообразно исследовать иммуногенетический статус.
С целью высокоэффективного лечения ОСНТ рекомендуется использование патогенетической терапии с применением антигипоксанта Томпаслина.
Выводы
- . Основным звеном патогенеза ОСНТ является индивидуальная повышенная чувствительность к гипоксии, которая детерминируется HLA системой и является эндогенным фактором риска в развитии внезапной тугоухости.
- Изучение клинических вариантов заболевания позволило объединить в одну группу внезапной тугоухости больных с идиопатической и сосудистой формами ОСНТ на основании общности иммуногенетических особенностей, локализации поражения, характерному возрасту возникновения заболевания в 40-50 лет, а также большей эффективности лечения
- Внезапная сенсоневральная тугоухость имеет генетическую предрасположенность, о чем свидетельствует положительная ассоциация с ней антигенов системы HLA В 38, В 44, В 51, DRB1*03, DRB1*15. Специфичности В18, DRB1*04, DRB1*13 являются генами-протекторами в развитии этого заболевания. У больных с инфекционной тугоухостью не имеется иммуногенетических отличий от здоровых лиц.
- Внезапная сенсоневральная тугоухость сопровождается умеренно выраженным угнетением Т-клеточного звена иммунитета, которое проявляется угнетением как Т-хелперной, так и Т- цитотоксической/супрессорной субпопуляций лимфоцитов. Значительное повышение содержания циркулирующих иммунных комплексов свидетельствует о наличии выраженного аутоиммунного компонента при этом заболевании.
- Острая сенсоневральная тугоухость инфекционного генеза сопровождается более выраженным угнетением Т-клеточного звена иммунитета, особенно цитотоксической субпопуляции. Имеющийся у больных с инфекционной тугоухостью резкий дефицит цитотоксических клеток CD8+ является причиной неэффективной элиминации инфекционных агентов и свидетельствует о неэффективной противовирусной защите организма. Продолжающаяся персистенция вирусов в организме приводит к развитию осложнений вирусной инфекции в виде токсического поражения волоскового аппарата внутреннего уха.
- Для всех больных ОСНТ характерно резкое снижение фагоцитарной активности, угнетение как поглотительной, так и переваривающей способности и незавершенный процесс фагоцитоза. Наиболее выражены эти изменения у больных с инфекционной тугоухостью.
- В эксперименте установлено, что препарат Томпаслин обладает высокой противогипоксической активностью, которая заключается в увеличении выживаемости экспериментальных животных при действии различных видов гипоксии и действия отопатогенных факторов. Томпаслин проникает через гематолабиринтный и гематоэнцефалический барьер и оказывает непосредственное влияние на периферический отдел слухового анализатора, что позволяет его считать специфическим антисурдитантом и применять его как патогенетическое средство лечения ОСНТ.
- Разработанный патогенетический метод лечения острой и внезапной сенсоневральной тугоухости с применением антисурдитанта Томпаслина является высокоэффективным и позволяет достичь положительного результата в 90% случаев при лечении, начатом в первую неделю от момента возникновения тугоухости при ежедневном пятикратном внутривенном введении препарата.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Беличева Э.Г. Наследственная предрасположенность к развитию острой сенсоневральной тугоухости / Э.Г. Беличева, В.И.Линьков // Материалы IХ съезда оториноларингологов Украины: Тез.докл. – Киев, 2000. – С. 169-170.
- Беличева Э.Г. Эндогенные факторы развития острой сенсоневральной тугоухости / Э.Г. Беличева, В.И.Линьков // Здравоохранение Таджикистана – 2002. -№3. – С. 67.
- Беличева Э.Г. Генетическая обусловленность сосудистого фактора риска развития острой сенсоневральной тугоухости / Э.Г. Беличева, В.И.Линьков // Российская оториноларингология. – 2003. - №2(5). – С. 73-76.
- Беличева Э.Г. Генетическая обусловленность сосудистого фактора риска развития острой сенсоневральной тугоухости / Э.Г. Беличева, В.И.Линьков // Материалы всероссийской конференции с международным участием «Проблемы реабилитации в оториноларингологии»: Тез.докл. – Самара, 2003. – С. 97-98.
- Беличева Э.Г. Связь эндогенных факторов риска развития острой сенсоневральной тугоухости с индивидуальной чувствительностью к гипоксии / Э.Г. Беличева // Российская оториноларингология. – 2004. - №2(9). – С. 30-31.
- Беличева Э.Г. Отягощенная наследственность по сосудистой патологии как фактор риска развития острой сенсоневральной тугоухости / Э.Г. Беличева, П.У.Умаров // Российская оториноларингология. – 2004. - №2(9). –С. 31-33.
- Беличева Э.Г. Влияние различных факторов на эффективность лечения острой сенсоневральной тугоухости / Э.Г. Беличева, П.У. Умаров // Х съезда оториноларингологов Украины: Тез.докл. – Судак, 2005. – С.257.
- Беличева Э.Г. Генетические маркеры индивидуальной чувствительности к гипоксии у больных с острой сенсоневральной тугоухости / Э.Г. Беличева, В.И.Линьков, П.У. Умаров // Материалы юбилейной всероссийской научно-практической конференции с международным участием «Современные аспекты и перспективы развития оториноларингологии»: Тез.докл. – М., 2005. –С.29.
- Беличева Э.Г. Острая сенсоневральная тугоухость и отягощенная наследственность по сосудистой патологии / Э.Г. Беличева, П.У. Умаров // Материалы юбилейной всероссийской научно-практической конференции с международным участием «Современные аспекты и перспективы развития оториноларингологии»: Тез.докл. – М., 2005. – С.29-30.
- Беличева Э.Г. Генетическая обусловленность индивидуальной чувствительности к гипоксии при острой сенсоневральной тугоухости / Э.Г. Беличева // Российская оториноларингология. – 2005. – № 6(19). - С. 15-18.
- Беличева Э.Г. Генетические маркеры индивидуальной чувствительности к гипоксии у больных с острой сенсоневральной тугоухостью/ Э.Г. Беличева, В.И.Линьков, П.У.Умаров // Российская оториноларингология. – 2005. – №3(16). – С. 84-86.
- Беличева Э.Г. Состояние гуморального иммунитета у больных острой сенсоневральной тугоухостью / Э.Г. Беличева, Л.Н.Бубнова, В.И.Линьков // Российская оториноларингология. – 2007. – № 5 (30). – С.32-36.
- Беличева Э.Г. Характеристика иммунокомпетентных клеток у больных острой сенсоневральной тугоухостью / Э.Г. Беличева // Российская оториноларингология. – 2007. – № 6(31). – С. 17-20.
- Беличева Э.Г. Стандарты диагностики острой и внезапной сенсоневральной тугоухости / Э.Г. Беличева, В.И.Линьков // Российская оториноларингология. – 2007. Прилож. – С. 609-613.
- Беличева Э.Г. Фагоцитарная активность гранулоцитов у больных острой сенсоневральной тугоухостью / Э.Г. Беличева, Л.Н.Бубнова // Российская оториноларингология. – 2008. – Прилож. №1. – С. 199-203.
- Беличева Э.Г. Экспериментальное исследование антисурдитантного действия томпаслина и его фармакокинетика / Э.Г. Беличева, В.И.Линьков, А.Б.Томчин // Российская оториноларингология. – 2008. – Прилож. №1. - С. 324-331.
- Томчин А. Б. Синтез, фармакологические и фармакокинетические свойства нового антигипоксанта и антисурдитанта томпаслина / А. Б. Томчин, Л. В. Пастушенков, А. Л. Пастушенков, В. И. Линьков, Э.Г.Беличева, В. Е. Иванов // Химико-фармацевтический журнал – 2008. – Т42, №5. – С. 21-30.

