Ведение женщин группы риска по развитию гиперплазии эндометрия в климактерии
На правах рукописи
Якокутова Мадина Владимировна
ВЕДЕНИЕ ЖЕНЩИН ГРУППЫ РИСКА
ПО РАЗВИТИЮ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ
В КЛИМАКТЕРИИ
14.00.01 – Акушерство и гинекология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
МОСКВА 2008
Работа выполнена в ГОУ ДПО Российская медицинская академия последипломного образования Росздрава
Научный руководитель:
Доктор медицинских наук Кузнецова Ирина Всеволодовна
Официальные оппоненты:
Доктор медицинских наук, профессор Давыдов Александр Ильгизирович
Доктор медицинских наук, профессор Хашукоева Асият Зульчифовна
Ведущее учреждение:
Московский областной научно - исследовательский институт акушерства и гинекологии
Защита диссертации состоится «___» ____________2008г. в ___ часов на заседании диссертационного совета Д.208.040.03 при ГОУ ВПО Московская медицинская академия им. И. М. Сеченова Росздрава
по адресу: 119991, г. Москва, ул. Трубецкая дом.8 стр. 2
С диссертацией можно ознакомиться в Центральной Медицинской Научной Библиотеке ГОУ ВПО ММА им. И.М. Сеченова Росздрава по адресу: 117998, г. Москва, Нахимовский проспект, д.49.
Автореферат разослан «_____»____________2008 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук, профессор Шулутко Александр Михайлович
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Климактерий является периодом наибольшей социальной активности женщины, накопившей определенный жизненный и профессиональный опыт, который она с пользой может отдать семье и обществу. В этот отрезок времени возникают изменения, характеризующиеся постепенным угасанием функции яичников. В процессе угасания сначала выключается овуляторная, а затем снижается и эстрогенпродуцирующая функции. Поэтому патологические процессы, возникающие в климактерии, связаны в более молодых возрастных группах с относительным эстрогенным избытком, а в более старших - с дефицитом эстрогенов. Поскольку гиполютеинизм и ановуляция на разных этапах закономерно сопровождают угасание функции яичников, нет ничего удивительного в частом возникновении рецидивов дисфункциональных маточных кровотечений (ДМК). ДМК в 50% случаев встречаются среди пациентов от 40 до 50 лет [Роузвиа С.К,2004]. Риск гиперплазии эндометрия (ГПЭ) обуславливает необходимость проведения противорецидивной терапии пациенткам с пременопаузальными ДМК. Большие трудности вызывает консервативное лечение больных с ДМК на фоне обменно-эндокринных нарушений. В тех случаях, когда женщине с метаболическим синдромом (МС) требуется гормональная терапия в связи с ГПЭ, выбор препаратов весьма ограничен, поскольку большинство из них не удовлетворяют критерию метаболической инертности и способствуют более быстрому прогрессированию МС во время и после лечения [Топольская И.В., 2002]. Возможно, одним из путей разрешения данной проблемы окажется использование ЛНГ-ВМС, эффективной с позиций лечения ГПЭ и обладающей минимальным влиянием на метаболизм в виду парентерального способа введения левоноргестрела [Wildemeersch D, 2003].
Частота климактерического синдрома (КС) по данным Крымской М. Л. [1989г.] составляет 40-65%. В 35% случаев КС одновременно возникает с наступлением менопаузы [Сметник В. П.,1988]. Высокая распространенность климактерических нарушений, связь эстрогенного дефицита с заболеваниями, являющимися основной причиной смерти в старших возрастных группах, выраженное нарушение качества жизни – все это определяет актуальность проблемы лечения менопаузальных расстройств [Сметник В. П., 2006]. Разные свойства, дозы, режимы, способы применения гормонов отличают их позитивное и негативное влияние на различные органы и ткани, и каждое лекарственное средство должно оцениваться не только по действию на симптомы заболевания, но и по иным параметрам, в частности, влияния на метаболизм и состояние эндометрия [Speroff L.,1998]. Поэтому, среди актуальных вопросов гинекологии в настоящее время имеет большое значение оптимальное проведение гормональной терапии у женщин группы риска по развитию ГПЭ и рака эндометрия.
Цель исследования. Оптимизировать тактику ведения женщин группы риска по развитию ГПЭ и рака эндометрия в климактерии.
Задачи исследования.
1. Определить факторы риска ГПЭ в перименопаузе.
2. Определить показания к проведению гормональной терапии у женщин группы риска по развитию ГПЭ в перименопаузе.
3. Оценить влияние различных видов и режимов гормональной терапии на состояние эндометрия.
4. Оценить влияние различных видов и режимов гормональной терапии на метаболические параметры организма.
5. Обосновать принципы индивидуального подбора гормональной терапии у женщин группы риска по развитию ГПЭ и рака эндометрия в климактерии.
Научная новизна. Подтверждена значимость выявления и коррекции метаболических нарушений как фактора риска развития ГПЭ и рака эндометрия. В работе впервые проведена характеристика состояния эндометрия при наличии или отсутствии МС. Впервые произведена комплексная оценка влияния гормональной терапии на эндометрий и параметры метаболизма у женщин группы риска по развитию ГПЭ в перименопаузе. Обоснованы и разработаны принципы индивидуального подбора препаратов для гормональной терапии при сочетанном риске ГПЭ, рака эндометрия и метаболических нарушений в перименопаузе.
Практическая значимость. Сформулирован принцип выявления и коррекции метаболических нарушений как фактора риска развития ГПЭ и рака эндометрия. Оптимизированы режимы проведения гормональной терапии у женщин с риском ГПЭ и рака эндометрия в перименопаузе. Разработан принцип максимально индивидуального подбора препаратов гормональной терапии при сочетанном риске ГПЭ, рака эндометрия и метаболических нарушений в перименопаузе.
Внедрение результатов исследования в практику: результаты исследования внедрены в практическую работу ГКБ №72, поликлинического отделения клиники акушерства и гинекологии им. В. Ф. Снегирева ММА им. И. М. Сеченова, городской поликлиники № 195 г. Москвы, представлены в методических руководствах и лекционном курсе по гинекологической эндокринологии кафедры акушерства и гинекологии ГОУ ДПО РМАПО Росздрава.
Апробация работы и публикации. Основные положения работы доложены на 7 конгрессе Европейского общества гинекологов (Париж, 2007); на 3-м Международном научном конгрессе «Новые технологии в акушерстве и гинекологии» (Санкт – Петербург, 2007). По результатам исследования опубликовано 11 научных работ. Апробация диссертация прошла на заседании кафедры акушерства и гинекологии ГОУ ДПО РМАПО Росздрава 20 сентября 2007 года.
Положения, выносимые на защиту:
1. Факторы риска ГПЭ должны учитываться при выборе метода гормональной коррекции у женщин в климактерии.
2. При ГПЭ у женщин на фоне избыточной массы тела и/или ожирения, одним из предпочтительных методов гормональной терапии является парентеральный способ введения гормональных препаратов (ЛНГ-ВМС).
3. ЗГТ у женщин группы риска по развитию ГПЭ и рака эндометрия должна учитывать влияние, как на метаболические параметры организма, так и на состояние эндометрия.
Структура и объем диссертации: диссертация выполнена на 159 страницах машинописного текста, состоит из введения, обзора литературы, клинической характеристики пациенток, описания методов исследования, результатов собственных исследований, обсуждения, выводов и практических рекомендаций. Указатель литературы содержит 220 источников (77 отечественных и 143 иностранных авторов). Работа иллюстрирована 39 таблицами и 34 рисунками.
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ И МЕТОДЫ ИССЛЕДОВАНИЯ
Работа выполнялась на кафедре акушерства и гинекологии Российской медицинской академии последипломного образования (зав. кафедрой профессор Н. М. Подзолкова), на базе городской клинической больницы № 72 г. Москвы, клиники акушерства и гинекологии им. В. Ф. Снегирева ММА им. И. М. Сеченова, городской поликлиники № 195 г. Москвы, лаборатории патоморфологии ФГУ НЦАГ и П Росмедтехнологий.
Исследование носило ретроспективный и проспективный характер (рисунок 1). На 1 этапе ретроспективного исследования были выделены факторы риска ГПЭ, а также произведена оценка частоты рецидивов гиперплазии и полипов эндометрия после гормонального лечения. На 2 этапе в исследование были включены 154 пациентки перименопаузального периода в возрасте от 45 до 60 лет, с жалобами на аномальные маточные кровотечения или с подозрением на ГПЭ по данным УЗИ, а также с наличием симптомов КС. Показаниями к гормональной терапии считались: пременопаузальные ДМК; простая ГПЭ; вазомоторная симптоматика КС; остеопения, остеопороз по данным остеоденситометрии; климактерическая миокардиодистрофия. Подбор гормональной терапии осуществлялся дифференцировано, в зависимости от метаболического статуса пациентки, морфологического состояния эндометрия и наличия или отсутствия КС.
В 1-й группе (n=25) - пациенткам с ДМК или морфологически подтвержденным диагнозом простой ГПЭ на фоне избыточной массы тела и/или ожирения была введена ЛНГ-ВМС. Всем пациенткам 2-й группы (n=35) с АМК и симптоматикой эстрогенного дефицита, на фоне нормальных показателей метаболизма назначали комбинированный 2-х фазный препарат для ЗГТ, содержащий 2 мг эстрадиола валерата в 21 таблетке курсового лечения и 0,15 мг левоноргестрела в последних 12 таблетках (E2В+ЛНГ).
3-я группа (n=30) - пациентки, страдавшие КС и имевшие избыточную массу тела, принимали комбинированный 2-х фазный препарат, содержащий 1 мг 17 эстрадиола в 28 таблетках и 10 мг дидрогестерона в последних 14 таблетках(17E2+ДС). Пациентки 4-й группы (n=25) страдали КС и имели ожирение либо повышенный уровень триглицеридов, что явилось показанием к назначению 17 эстрадиола трансдермально в виде пластыря, а прогестагенный компонент терапии был представлен ЛНГ-ВМС (17E2(ТД)+ЛНГ-ВМС). 5-я группа (n=39) - женщины в постменопаузе, страдавшие КС, как с нормальными показателями метаболизма (5а группа), так и с наличием МС (5б группа) получали комбинированный 2-х фазный препарат, содержащий 1 мг эстрадиола и 2 мг дроспиренона в каждой таблетке в непрерывном режиме (17E2+ДС).
Обследование всех больных начиналось с тщательного изучения жалоб, анамнеза, характера менструальной и репродуктивной функции, сопутствующей генитальной и экстрагенитальной патологии, перенесенных оперативных вмешательств. Степень тяжести КС и эффективность проводимого лечения оценивались в баллах модифицированного менопаузального индекса (ММИ) Куппермана – Уваровой. Обследование больных включало общий осмотр с оценкой антропометрических данных (рост, масса тела, ИМТ, отношение ОТ /ОБ) и гинекологическое исследование.
Рисунок 1. Дизайн исследования
Нормальным для женщины считали ИМТ 20-25 кг/м; ИМТ равный и выше 26 кг/м рассматривали как избыточную массу тела, более 30 кг/м - как ожирение. Характер ожирения определяли соотношением окружности талии к окружности бедер (ОТ/ОБ). Если этот показатель был менее 0,85- характер ожирения рассматривался как женский, более 0,85 – мужской. До начала и по окончании гормональной терапии определяли показатели жирового и углеводного обмена. Для оценки состояния липидного и углеводного обменов всем пациенткам забор венозной крови производился натощак, после 12 часового голодания. После центрифугирования в сыворотке крови на автоматическом селективном биохимическом анализаторе «Konelab 60/60i» с использованием реактивов Konelab TM фирмы «Thermo Electron Corporation» (Финляндия) ферментативным методом определяли ОХС, ТГ, ХС ЛПВП. ХС ЛПНП по формуле W.T. Friedewald. Содержание иммунореактивного инсулина и глюкозы в плазме крови исследовали калорометрическим методом на фотометре Stat Fax с использованием набора реагентов «Вектор-Бест» (Россия).
Гормональный статус оценивали на основании определения концентрации ФСГ, эстрадиола, тестостерона, по показаниям - ТТГ, Т3 и Т4 при помощи автоматизированной иммунохемилюминесцентной системы Advia Centaur. Определение уровней инсулина проводили при использовании автоматизированной иммунохемилюминесцентной системы Immulite 2000.
УЗИ органов малого таза проводилось всем пациенткам в начале исследования, перед диагностическим выскабливанием, а также на фоне лечения при помощи приборов Logiq 500 PRO «General Electic», США c использованием абдоминального и влагалищного конвексных датчиков с частотой 3,5 и 7,5 МГц соответственно.
Гистероскопию, раздельное диагностическое выскабливание (РДВ) слизистой матки и цервикального канала проводили всем больным при поступлении в стационар с использованием гистероскопа фирмы «Shtorz». Всем амбулаторным больным в начале и на фоне гормональной терапии, проводился вакуум кюретаж эндометрия с использованием аспирационных одноразовых кюреток «Pipelle de Cornier» (Франция - «Pharma Med. Inc»).
Перед назначением ЗГТ всем женщинам проводилось цитологическое исследование соскобов с поверхности шейки матки и цервикального канала; маммография в двух проекциях - прямой и боковой, на рентгеновской маммографической установке - Mammo diagnost UC, фирмы Philips, Голландия. Женщинам с факторами риска развития остеопороза проводилась рентгеновская 2-х фотонная абсорбциометрия на аппарате DPX-NT(B) Lunar.
Статистическая обработка данных выполнена методом вариационной статистики с помощью «Microsoft Excel», и пакета прикладных программ «Statistica for Windows» v. 6.0, StatSoft Inc. (США). Для сравнения числовых данных использовали метод дисперсионного анализа ANOVA (для нескольких групп) и t-критерий Стъюдента для 2-х независимых выборок. Для сравнения непараметрических данных применяли методы Круаскала-Уоллиса (для нескольких групп), затем проводилось попарное сравнение с помощью критерия Манна-Уитни (для 2-х групп) для несвязанных совокупностей. Статистически значимыми считались отличия при P<0,05 (95%-й уровень значимости).
РЕЗУЛЬТАТЫ СОБСТВЕННОГО ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Согласно нашим данным, большинство факторов риска рака эндометрия было ассоциировано с развитием атипической гиперплазии эндометрия (АГЭ). Так, средний ИМТ в среднем выходил за пределы нормы в обеих группах, но при этом был достоверно выше в группе женщин с АГЭ (p<0,001). Отмечалось достоверно более частое отсутствие родов у женщин 1 группы, по сравнению с пациентками 2 группы (p=0,003). Длительные нарушения менструального цикла встречались достоверно чаще у пациенток с АГЭ (p=0,02). Диагноз СПКЯ в анамнезе чаще встречался в 1-й группе (5,3%) по сравнению со 2 группой (1%) (p=0,05). Прием КОК снижал риск формирования тяжелых форм ГПЭ: КОК в возрасте до 40 лет достоверно чаще пользовались женщины 2 группы (7%) по сравнению с 1 (1,3%) (p=0,04). ИНСД был диагностирован чаще у пациенток 1 группы (n=19) по сравнению со 2-й (n=5) группой (p=0,005).
Из 310 случаев простой ГПЭ в 74,5% была проведена противорецидивная гормональная терапия (МПА в непрерывном режиме, гестагенами норстероидного ряда - норколут, оргаметрил в непрерывном или циклическом 21-дневном режиме, дидрогестероном в циклическом 21-дневном или 12-дневном режиме). Через 4 месяца после ее окончания рецидивы простой ГПЭ были выявлены у 26,0% женщин. Среди 79 пациенток с простой ГПЭ, не получивших лечения, рецидивы заболевания наблюдались у 72,1% женщин. В тоже время, частота рецидивов полипов эндометрия у женщин на фоне проведения гормональной терапии (32,7%) и без нее (29,1%) достоверно не различалась.
В проспективном исследовании было выделено 5 групп женщин. Средний возраст пациенток 1-й группы составил 46±1,6 лет. Нарушения менструального цикла впервые возникли у 15% женщин (n=4), в то время как у 85 % пациенток (n=21) ранее проводилось РДВ цервикального канала и стенок полости матки. Из них у 10 (40%) в анамнезе была диагностирована простая гиперплазия эндометрия, у 6 (24%)- полипы эндометрия.
К моменту поступления в стационар у 49,9% пациенток наблюдались метроррагии, у 26,4% - меноррагии и у 23,7% -менометроррагии. Средняя продолжительность кровотечения составила 9,1±1,5 дня. При морфологическом исследовании эндометрий фазы пролиферации был выявлен у 2 женщин, простая гиперплазия эндометрия – у 19, полипы эндометрия – у 4 пациенток. Среди обследованных в 1 группе, количество женщин с избыточной массой тела составило -17(68%), с ожирением 1 степени -4(16%), 2 степени -2(8%), 3-й -1(4%) и 4-й -1(4%). Среди пациенток с ожирением андроидный тип распределения жировой ткани наблюдался у 6 (75%) женщин.
В ходе лечения межменструальные «мажущие» кровяные выделения в течение первых 3 месяцев ношения ЛНГ-ВМС наблюдались у 90 %, к концу 3 месяца - у 67,7%, к концу 1 года лишь у 2% женщин (рисунок 2). Средняя продолжительность менструального кровотечения после 3 месяцев терапии достоверно уменьшилась до 5,4±1,1 дня (p<0,001), к концу 6 месяца – до 3,2±0,5 (p<0,001), к концу первого года аменорея наблюдалась у 98% пациенток.
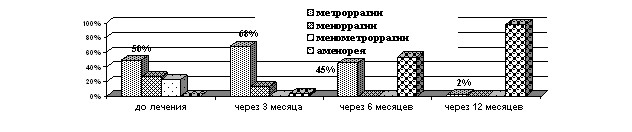 Рисунок 2. Характеристика менструальной функции у женщин 1 группы на фоне ЛНГ-ВМС
Рисунок 2. Характеристика менструальной функции у женщин 1 группы на фоне ЛНГ-ВМС
Размеры М-ЭХО на фоне ЛНГ-ВМС, оказались достоверно меньше по сравнению с данными, полученными накануне выскабливания (p<0,001). При аспирационной биопсии эндометрия, взятой через 6 месяцев на фоне ЛНГ-ВМС, ни в одном случае не было выявлено рецидива ГПЭ. У всех больных была отмечена атрофия желез эндометрия в сочетании с децидуальной реакцией стромы.
В ходе работы мы также оценили динамику изменений размеров узлов миомы в ответ на введение ЛНГ-ВМС. Увеличение диаметра миоматозных узлов через 1 месяц после установления ЛНГ-ВМС наблюдалось у 86% пациенток, что, по- видимому, было связано с отеком миоматозных узлов в ответ на введение ЛНГ-ВМС. В дальнейшем, в 10 случаях отмечался регресс миоматозных узлов, у 9 женщин узлы миомы сохраняли прежние размеры, а у 3 - был отмечен рост узлов. Максимальный рост наблюдался у женщин, имевших изначально наибольший диаметр узлов. Полученные нами результаты относительно роста узлов на фоне ЛНГ-ВМС, согласуются с некоторыми литературными источниками, в которых нашла отражение гипотеза о стимулирующем влиянии прогестерона на рост лейомиомы. Так, например, по данным M.S. Rein [2000], применение прогестинов приводит к соматической мутации клеток и стимуляции роста миоматозных узлов.
Парентеральный путь введения ЛНГ достоверно не влиял на метаболические параметры организма. Отмечалась незначительная тенденция к повышению уровня ОХС, ХС ЛПНП к 6 месяцу терапии и стабилизация указанных показателей до исходных значений к концу 1 года лечения. Также была отмечена положительная тенденция к снижению уровня ТГ на протяжении всего 1 года терапии. Таким образом, использование ЛНГ-ВМС позволило нам эффективно лечить ГПЭ, предотвращая их рецидивирование, при этом, не оказывая существенного влияния на метаболические параметры организма.
Во 2, 3, 4 и 5 группах имелись показания к назначению ЗГТ. У пациенток с избыточной массой тела (3 группа) и, особенно, с ожирением (4 группа) чаще встречались легкие проявления КС, тогда как во 2 и 5 группах их средне тяжелые и тяжелые формы, то есть у женщин с избыточной массой тела и ожирением КС протекал легче (рисунок 3). Длительность течения КС к моменту обследования колебалась от одного года до 5 лет.
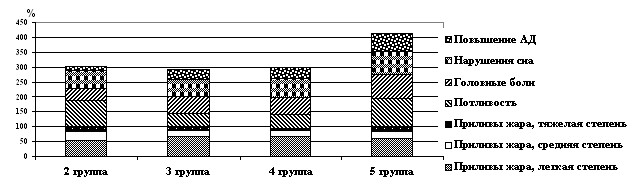 Рисунок 3. Климактерические расстройства у женщин в пре и постменопаузе до начала терапии
Рисунок 3. Климактерические расстройства у женщин в пре и постменопаузе до начала терапии
Средний возраст обследованных женщин во 2 группе составил 46,9±1,6 лет. Метроррагии наблюдались у 18 (50,9%), менометроррагии или меноррагии - у 17(49,1%) больных. Средняя продолжительность менструального кровотечения у женщин с меноррагиями составляла 8,1±1,5 дней. При морфологическом исследовании гипопластичный эндометрий был обнаружен у 3 больных, пролиферативный - у 11, полипы эндометрия - у 8 пациенток, в 13 случаях диагностирована простая ГПЭ. Все женщины данной группы имели нормальные показатели метаболизма.
На фоне терапии E2В+ЛНГ положительный эффект выражался в значительном уменьшении количества и выраженности вазомоторных и психоэмоциональных расстройств (p<0,001), что согласуется с данными Zimmermann и соавторов (2001). В процессе лечения E2В+ЛНГ у 31 женщины (88,7%) наблюдались регулярные МПР во время 7-дневного перерыва в приеме препарата. Субъективно уменьшение количества теряемой крови отметили 28 (81,1%) больных. Продолжительность МПР уменьшилась до 5,4±1,1 дня после 6 месяцев терапии (p<0,001), что согласуется с данными литературы (Rozenbaum H., 1996; Зайдиева Я. З, 2001; Goeretzlehner G., 2001). При индивидуальном анализе результатов УЗИ признаки ГПЭ отмечены у 2 больных. При морфологическом исследовании у этих больных подтвержден рецидив простой ГПЭ (5,7%). Прогрессирования патологического процесса не было отмечено ни в одном случае.
На фоне лечения E2В+ЛНГ не выявлено прибавки массы тела, а также существенных изменений, как антропометрических данных, так и биохимических показателей крови. Наиболее выраженные изменения касались уровня триглицеридов и индекса НОМА, которые достоверно снизились на фоне проведения указанного вида терапии (p<0,001).
Средний возраст обследованных женщин в 3 группе составил 48±0,5 лет. В анамнезе у пациенток 3-й группы АМК в репродуктивном периоде встречались в 16,7% случаев.
На момент обследования 23,3% женщин жаловались на АМК. При анализе морфологических данных у 5 пациенток обнаружены полипы эндометрия (железистые-3, железисто-фиброзные-2), у 17- пролиферативный и у 8- гипопластичный эндометрий.
Исходные антропометрические параметры в 3-й группе превышали аналогичные показатели у женщин 2-й группы (р<0,001). Липидный спектр крови характеризовался достоверно более высокими, по сравнению со 2-й группой, уровнями ОХС и ХС ЛНП наряду со сниженным содержанием ХС ЛВП.
Максимальная редукция патологической симптоматики на фоне терапии 17E2+ДГ наступала, в среднем, на 3-4 недели позже, чем на фоне приема E2В+ЛНГ, что, очевидно, обусловлено меньшей дозой эстрогенного компонента. При морфологическом исследовании эндометрия через 6 месяцев терапии эндометрий фазы пролиферации диагностирован у 18 (60%), неполноценная секреторная трансформация слизистой тела матки - у 3 (10%), гипопластичный эндометрий – у 9 (30%) женщин. Таким образом, лечение КС 17E2+ДГ у женщин с избыточной массой тела и риском ГПЭ в перименопаузе, оказалось безопасным в отношении эндометрия, что согласуется с данными литературы [Van de Weijer PHM,1999].
На фоне терапии 17E2+ДГ была отмечена тенденция к снижению массы тела преимущественно за счет висцерального жира, в результате к 6 месяцу терапии мы констатировали достоверное уменьшение ОТ и ОТ/ОБ (p<0,05). Тенденция к снижению уровня ОХС, повышению ХС-ЛВП, в совокупности с достоверным снижением ХС-ЛНП (р<0,05), стали основой достоверного уменьшения соотношения ХС-ЛНП/ХС-ЛВП (р<0,001) и ОХС/ХС-ЛВП (р<0,05). Мы не выявили существенного повышения уровня триглицеридов, хотя такая тенденция наблюдалась. Полученные результаты согласуются с мнением ряда авторов [Godsland IF,2001; Rubig A.,2003]. В отношении углеводного обмена терапия 17E2+ДГ также продемонстрировала позитивный эффект, что выразилось в достоверном уменьшении уровня инсулина натощак (9,7±1,3 мЕД/л) и индекса НОМА (2,63±0,14) (p<0,001).
Средний возраст обследованных в 4 группе составил 48,7±0,7 лет. АМК в анамнезе отмечались у 13 (52%) пациенток в репродуктивном и у 12 (48%) - в пременопаузальном периоде. К моменту появления КС у 96,6% женщин на фоне ношения ЛНГ-ВМС отмечалась аменорея и лишь у 3,3% - мажущие кровяные выделения из половых путей. При биопсии эндометрия во всех случаях выявлена децидуальная реакция стромы в сочетании с атрофией желез эндометрия. Все пациентки 4 группы страдали ожирением, и средний ИМТ (34,7±2,1кг/м) достоверно превышал соответствующие показатели в других группах, также как ОТ и ОТ/ОБ (р<0,001). Параметры жирового и углеводного обмена характеризовались наиболее выраженными отклонениями по сравнению с другими группами. Достоверное увеличение уровня ХС ЛНП (4,1±0,36 ммоль/л), триглицеридов (2,2±0,31ммоль/л) и снижение уровня ХС ЛВП (1,1±0,19 ммоль/л) по сравнению с соответствующими показателями в других группах (р<0,01) определяло повышенный риск осложнений, связанных с атеросклерозом у данного контингента больных. У 20% пациенток в 4-й группе были выявлены нарушения толерантности к глюкозе, у 13,3% - гликемия натощак, у 83,3% больных – инсулинорезистентность (индекс HOMA 4,79±1,24).
Эффективность терапии КС в 4 группе оказалась высокой, также как и в других группах. Через 6 месяцев терапии 17E2(ТД)+ЛНГ-ВМС у всех больных выявлена атрофия желез и децидуальная реакция стромы. На фоне проводимой терапии не было отмечено существенных колебаний массы тела и антропометрических показателей. Биохимические параметры жирового и углеводного обмена существенно не изменялись, за исключением достоверного снижения среднего значения триглицеридов (р<0,05). Данные литературы подтверждают положительные эффекты парентерального вида терапии у женщин с ожирением, как в отношении эндометрия, так и влияния на биохимические параметры крови [Riphagen FE,2000].
Средний возраст обследованных женщин в постменопаузе (5 группа) составил 53±0,5 года. Длительность постменопаузы в среднем - 3 года. У 31 (80%) обследованных женщин отмечалась аменорея, 8 (20%) пациенток обратились в стационар по поводу кровяных выделений в постменопаузе. При гистологическом исследовании эндометрия у 4 женщин выявлены полипы эндометрия, у 2- простая ГПЭ, у 2 - пролиферативный эндометрий, у всех остальных (n=31) - атрофичный эндометрий. Отличия по антропометрическим показателям в 5 группе были обусловлены выделением в качестве особого объекта исследования пациенток с МС (5б группа).
В результате терапии 17E2+ДС выраженность нейровегетативных и психоэмоциональных расстройств подверглась значительной редукции через 6 месяцев лечения. У 23 (60%) пациенток 5б группы с высоким уровнем АД уже к 3 месяцу терапии отмечалось снижение систолического АД, в среднем на 10 мм рт ст. и диастолического АД, в среднем на 6-7 мм рт. ст.. На фоне лечения 17E2+ДС лишь в 4% случаев наблюдались кровотечения прорыва (гипоплазия эндометрия), в 96% - аменорея. Через 6 месяцев терапии 17E2+ДС мы не наблюдали рецидивов ГПЭ и полипов эндометрия ни в одном случае, что согласуется с данными литературы [Archer D.F., Thorneycroft I.H., Foegh M. et al., 2005]. Снижение массы тела на фоне терапии 17E2+ДС у пациенток 5а группы оказалось незначительным, в среднем 1,2 кг к концу года наблюдения. У больных с МС уменьшение массы тела достигло в среднем 5,9 кг к концу первого года терапии. У всех пациенток 5 группы было отмечено снижение уровней ОХС (р<0,05), ХС ЛНП (р<0,05), ТГ (р<0,0001), индекса НОМА (р<0,0001). У женщин с МС указанные изменения были более выражены; очевидно, из-за большей степени редукции массы тела в данной группе больных. Полученные результаты согласуются с данными литературы [Зайдиева Я. З.,2007; Rubig A.,2003].
Таким образом, проведенное нами изучение ведения женщин группы риска по развитию ГПЭ в климактерическом периоде показало, что лечение должно быть индивидуальным с учетом эстрогенного статуса женщин, морфологической характеристики эндометрия и наличия метаболического синдрома. На основании изучения результатов различных методов лечения менопаузальных расстройств и ГПЭ, нами разработан алгоритм дифференцированного подхода к ведению женщин группы риска по развитию ГПЭ в климактерии (рисунок 4).
Рисунок 4. Алгоритм дифференцированного подхода к ведению женщин группы риска по развитию ГПЭ в климактерии
ВЫВОДЫ:
- В развитии атипической гиперплазии эндометрия факторы риска рака эндометрия имеют достоверно большую значимость, чем в развитии простой ГПЭ. В отношении простой ГПЭ имеют значение такие факторы риска как отсутствие родов в анамнезе, наличие метаболического синдрома, отсутствие приема КОК.
- Достоверно более высокая частота рецидивов простой гиперплазии у пациенток, не получавших гормональной терапии (72,1%), по сравнению с теми, кто получал гормональное лечение (26%) (р<0,001), диктуют необходимость индивидуального подбора гормонального лечения при ГПЭ. Частота рецидивов полипов эндометрия у женщин на фоне проведения гормональной терапии (32,7%) и без нее (29,1%) достоверно не различается.
- У женщин с ДМК и простой ГПЭ в пременопаузе на фоне избыточной массы тела и ожирения использование ЛНГ-ВМС, приводит к снижению длительности менструальной кровопотери (с 9 до 3 дней к концу 6 месяца терапии), вплоть до развития аменореи к концу первого года терапии (p<0,001). Атрофия желез и децидуальная реакция стромы, выявляемые при морфологическом исследовании уже через 6 месяцев терапии, эффективно предупреждают риск возникновения и рецидивирования ДМК и ГПЭ у данной категории женщин. Отсутствие значимого влияния на параметры метаболизма, делает этот вид терапии наиболее приемлемым для женщин с ДМК и ГПЭ на фоне избыточной массы тела и ожирения.
- У женщин с симптомами КС и ДМК использование комбинации эстрадиола валерата и левоноргестрела приводит к уменьшению количества и выраженности вазомоторных и психоэмоциональных симптомов вплоть до полного их исчезновения (p<0,001). Низкая частота рецидивов простой гиперплазии эндометрия (5,7%) (p<0,001) и отсутствие прогрессирования патологического процесса на фоне данного вида терапии, свидетельствуют о безопасности ее использования у пациенток с ДМК и ГПЭ в перименопаузе. У женщин с нормальной массой тела не отмечено негативного влияния комбинации эстрадиола валерата и левоноргестрела на метаболизм.
- У пациенток с симптомами КС на фоне избыточной массы тела применение комбинации 17 эстрадиола и дидрогестерона эффективно купирует симптоматику КС (p<0,001). Отсутствие случаев возникновения и рецидивирования ГПЭ на фоне низкой дозы эстрадиола (1 мг) в сочетании с дидрогестероном, обуславливает безопасность терапии в отношении эндометрия у женщин группы риска по развитию ГПЭ. На фоне данного вида терапии наблюдается тенденция к снижению массы тела, преимущественно за счет висцерального жира (уменьшение ОТ и соотношения ОТ/ОБ (p<0,05)), достоверное уменьшение соотношения ХС-ЛНП/ХС-ЛВП (p<0,001), ОХС/ХС-ЛВП (p<0,05), инсулина натощак и индекса НОМА (p<0,001).
- У женщин с симптоматикой КС на фоне ожирения использование комбинации 17 эстрадиола (трансдермальная форма) и ЛНГ-ВМС приводит к значительному снижению симптоматики климактерических расстройств (p<0,001). Атрофия желез эндометрия и децидуальная реакция стромы, выявляемые на фоне данного вида терапии, обуславливают надежную защиту эндометрия. Отсутствие влияния на показатели жирового и углеводного обмена при проведении парентеральной ЗГТ, за исключением снижения уровня триглицеридов (р<0,05) является ожидаемым и позитивным эффектом терапии у больных, страдающих ожирением.
- У женщин в постменопаузе выраженность нейровегетативных и психоэмоциональных расстройств подвергается значительной редукции через 6 месяцев терапии комбинацией 17 эстрадиола и дроспиренона (p<0,001). Непрерывный режим использования комбинации 17 эстрадиола и дроспиренона приводит к атрофии эндометрия, предотвращая рецидивы ГПЭ у женщин группы риска. На фоне данного вида терапии отмечено достоверное снижение уровней ОХС, ХС - ЛНП (р<0,05), триглицеридов и индекса НОМА (р<0,0001) у женщин, как с нормальными показателями метаболизма, так и с метаболическим синдромом. У пациенток с метаболическим синдромом указанные изменения наиболее выражены, из-за большей степени редукции массы тела на фоне проводимой терапии (р<0,0001).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
- Возникновение ДМК у женщин группы риска по развитию ГПЭ в перименопаузальном периоде требует обязательной гистологической верификации диагноза, и при отсутствии атипии, а также сочетанной маточной патологии, требующей оперативного лечения – назначения гормональной терапии, направленной на предупреждение рецидивов заболевания.
- Выбор препарата и режима терапии ДМК и ГПЭ в перименопаузе зависит от сочетания морфологической характеристики эндометрия, метаболических параметров организма, сопутствующей патологии и противопоказаний.
- У больных с ДМК и ГПЭ, страдающих ожирением, использование ЛНГ–ВМС обеспечивает надежную защиту эндометрия при отсутствии значимого влияния на параметры метаболизма. При этом целесообразно проведение мероприятий, направленных на снижение массы тела и повышение чувствительности тканей к инсулину, снижающих риск развития и рецидивирования ГПЭ.
- Подход к выбору препарата для ЗГТ в перименопаузе у женщин с интактной маткой, должен предусматривать влияние на различные параметры гомеостаза, в том числе, на состояние эндометрия и показатели метаболизма.
- При сочетании ДМК с симптоматикой КС, возможно использование препаратов для ЗГТ, в состав которых входит сильный гестаген – левоноргестрел. При этом происходит купирование симптоматики КС и одновременно, предупреждение развития ГПЭ. Наличие полипов и простой гиперплазии эндометрия не является основанием для отказа от подобного вида терапии. С точки зрения метаболизма, данный вид лечения предпочтителен для женщин с нормальной массой тела и показателями метаболизма, не выходящими за пределы нормы.
- Для лечения КС у женщин с избыточной массой тела и риском ГПЭ более предпочтительно использование комбинации низкой (1 мг) дозы 17 эстрадиола и 10 мг дидрогестерона, которая купирует симптомы КС, эффективно предупреждая развитие ГПЭ. В указанной дозе дидрогестерон не уменьшает положительного влияния эстрогенов на биохимические параметры крови.
- Больным с ожирением, в виду высокого риска тромбоэмболических осложнений и сердечно – сосудистых заболеваний, для лечения КС наиболее эффективно и безопасно применение парентеральных форм гормональных препаратов. Добавление к ЛНГ-ВМС эстроген содержащего пластыря, позволяет эффективно бороться с признаками менопаузального синдрома, не усугубляя метаболических расстройств и предупреждая возможность возникновения патологии эндометрия.
- Для купирования менопаузальных расстройств в постменопаузе оптимально допустимой дозой эстрогена является 1 мг в день. Использование с этой целью комбинации 17 эстрадиола и дроспиренона может оказаться довольно перспективным, учитывая низкую дозировку эстрогенного компонента (1 мг) с одной стороны, и благоприятное влияния как эстрадиола, так и дроспиренона на метаболические параметры крови с другой. Дополнительным преимуществом данной комбинации является надежная защита эндометрия от развития ГПЭ, а также нормализация показателей АД.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Кузнецова И. В., Якокутова М. В. Использование ВМС - Мирены у женщин группы риска по развитию гиперпластических процессов эндометрия в пременопаузальном периоде // Материалы 8-го Всероссийского научного форума. – М.: Меди экспо.- 2006.-с.421-422
2. Кузнецова И. В., Якокутова М. В., Вельхиева Р.А Факторы риска гиперпластических процессов эндометрия в пременопаузе // Проблемы репродукции: Специальный выпуск: Медиа Сфера.- 2006.-с. 118
3. Якокутова М. В. Дифференцированный подход к противорецидивной терапии дисфункциональных маточных кровотечений в пременопаузе // Сборник научных работ молодых ученых Российской медицинской академии последипломного образования.- М., 2006.-с.50-51
4. Якокутова М. В., Кузнецова И. В. Применение Климонорма в качестве противорецидивной терапии дисфункциональных маточных кровотечений в пременопаузе //Проблемы репродукции: Специальный выпуск: Медиа Сфера.- 2006.-с. 260-261
5. Кузнецова И. В., Якокутова М. В. Влияние различных режимов заместительной гормональной терапии на показатели углеводного и липидного обмена // Гинекология.-№5-6.-том 8/2006.- с. 8-11
6. Кузнецова И. В., Якокутова М. В. Применение Климонорма в качестве противорецидивной терапии дисфункциональных маточных кровотечений в пременопаузе // Гинекология.-№2.-том 8/2006.- с. 27-29
7. Кузнецова И. В., Вельхиева Р.А, Якокутова М. В. Рецидивы гиперпластических процессов эндометрия у женщин в пременопаузе (ретроспективное исследование) // Материалы первого регионального научного форума «Мать и дитя» Казань.- 2007.- с.277
8. Кузнецова И. В., Якокутова М. В. Выбор метода лечения менопаузальных расстройств в зависимости от метаболических особенностей организма // Материалы первого регионального научного форума «Мать и дитя». - Казань.- 2007.- с.278-279
9. Якокутова М. В., Кузнецова И. В. Влияние заместительной гормональной терапии на параметры метаболизма и состояние эндометрия у женщин в постменопаузе // Материалы 9-го Всероссийского научного форума «Мать и Дитя». – М.: Меди экспо.- 2007.- с.584-585
10. I.Kuznetsova, M.Yakokutova Differentiated approach to menopausal disorders treatment depending on parameters of metabolism (abstract) // Congress book of 7-th Congress of the European Society of Gynecology.- Paris.- 2007.- p. 121
11. Кузнецова И. В., Якокутова М. В. Комплексный подход к терапии женщин с гиперпластическими процессами эндометрия и ожирением // Акушерство и Гинекология.-2007.-№6.-с. 59-63

