Ранняя диагностика и новые подходы к комплексному лечению злокачественных глиальных опухолей больших полушарий головного мозга
На правах рукописи
БАЛЯЗИН-ПАРФЕНОВ
Игорь Викторович
РАННЯЯ ДИАГНОСТИКА И НОВЫЕ ПОДХОДЫ К КОМПЛЕКСНОМУ ЛЕЧЕНИЮ ЗЛОКАЧЕСТВЕННЫХ ГЛИАЛЬНЫХ ОПУХОЛЕЙ БОЛЬШИХ ПОЛУШАРИЙ ГОЛОВНОГО МОЗГА
14.01.12 – онкология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
г. Ростов-на-Дону - 2011
РАБОТА ВЫПОЛНЕНА В ФЕДЕРАЛЬНОМ ГОСУДАРСТВЕННОМ УЧРЕЖДЕНИИ «РОСТОВСКИЙ НАУЧНО-ИССЛЕДОВАТЕЛЬСКИЙ ОНКОЛОГИЧЕСКИЙ ИНСТИТУТ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РФ
(директор института – д.м.н., профессор О. И. Кит)
Научный консультант: академик РАН и РАМН
доктор медицинских наук,
профессор Ю.С. Сидоренко
Официальные оппоненты: доктор медицинских наук,
профессор Г.К. Максимов
доктор медицинских наук,
профессор В.А. Еремин
доктор медицинских наук,
профессор В.Е. Олюшин
Ведущая организация: Учреждение РАМН Российский
онкологический научный центр
им. Н.Н. Блохина, г. Москва
Защита состоится «____» ________________2011 г. в _____часов на заседании совета по защите докторских и кандидатских диссертаций Д 208.083.01 при Федеральном Государственном Учреждении «Ростовский научно-исследовательский онкологический институт» Минздравсоцразвития Росссии (344037, г. Ростов-на-Дону, ул. 14-я линия, 63).
С диссертацией можно ознакомиться в библиотеке ФГУ «Ростовский научно-исследовательский онкологический институт» Министерства здравоохранения и социального развития РФ.
Автореферат разослан «___ » ______________ 2011 г.
Ученый секретарь совета по защите
докторских и кандидатских диссертаций,
доктор медицинских наук, профессор Л.Ю. Голотина
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Проблема глиальных опухолей (ГО) головного мозга остается далеко не решенной, несмотря на имеющиеся достижения в диагностике, оперативном лечении и химиотерапии.
В последние годы заметное возрастание частоты возникновения глиальных опухолей, до 60% из которых составляют глиобластомы, заставляет продолжать поиск в совершенствовании ранней диагностики и методов лечения злокачественных глиом.
Стандартом в лечении глиальных опухолей на сегодняшний день стало сочетание трех методов лечения: оперативного, лучевого и химиотерапии. Но, несмотря на комплексный подход к решению проблемы, продолжительность жизни этой группы больных и ее качество остаются крайне низкими. Так, средняя выживаемость больных со злокачественными астроцитомами не превышает 2 лет, а продолжительность жизни пациентов с глиобластомами после удаления опухоли и лучевой терапии оказывается не выше 9–10 месяцев (Кобяков Г.Л. и соавт, 2004; Ишматов Р.Ф.,2007; Kanu O.O., Mehta A., Di C. еt al., 2009).
Отсутствие возможности тотального удаления большинства опухолей обусловлено наличием множества опухолевых клеток с высокой пролиферативной активностью даже на расстоянии 4 см от удаленного опухолевого узла (Декан В.С., Парфенов В.Е., Труфанов Г.Е. и соавт., 2010; Birkholz D. еt al., 2005; Rutkauskiene G, Labanauskas L., 2005).
Кроме того, оперативное лечение возможно не у всех пациентов. Вследствие внутримозговой локализации и глубокого инфильтративного роста, вовлечение срединных структур мозга, расположение опухоли в области центральных извилин и речевых зон мозга диктует возникновение интраопера-ционных осложнений, что делает невозможным их радикальное удаление (Олюшин В.Е., 2005).
Эффективность цитостатической терапии не всегда остается высокой, поскольку существует целый ряд факторов, приводящих к низкой чувствительности глиальных опухолей к химиотерапии. Существенным препятствием на пути химиопрепаратов к опухоли является гематоэнцефалический барьер.
Наиболее эффективным является использование препаратов нитрозомочевины, в частности, кармустина, что считается наиболее эффективным методом адъювантной химиотерапии, однако попытка улучшения результатов лечения кармустином методом «ударных доз» препарата усугубляет токсический эффект химиотерапии и оказалась неоправданной (Benouaich-Amiel A. еt al., 2005).
Для решения проблемы лечения опухолей различной локализации уже разработаны и успешно применяются методы воздействия на опухоль введением цитостатиков на естественных средах организма (аутогемо-, аутоплазмохимиотерапия и т.д.). Инкубация препаратов в естественных средах организма снижает токсичность и повышает противоопухолевую активность этих методов лечения, что подтверждено в клинике и экспериментально (Сидоренко Ю.С. и соавт., 2002–2005).
Оптимальные результаты лечения больных с церебральными глиомами обеспечиваются принципами дифференцированного и комбинированного подхода, определяющего объем воздействий с абластической направленностью в рамках анатомической и физиологической дозволенности. Даже внедрение в практику микрохирургической техники, планирования хирургического доступа при удалении внутримозговых опухолей больших полушарий головного мозга с использованием функциональной МРТ, навигационной системы и электрофизиологического мониторинга (Лошаков А.В., Жуков В.Ю., Пронин И.Н. и соавт., 2010), нейроанестезиологического и нейрореанимационного пособий, характер самой операции, направленной на тотальное удаление опухоли, стереотаксической радиотерапии и радиохирургии (Коновалов А.Н., Голанов А.В., Горлачев Г.Е и соавт., 2010) не всегда дают положительный результат в восстановлении качества жизни пациента.
В литературе последних лет встречаются публикации об антипролиферативном действии мелатонина, гормона эпифиза, способного улучшать результаты химиотерапии. Описано ингибирование мелатонином опухолевого роста через включение апоптоза у пролактин-секретирующей аденомы гипофиза крыс путем повреждения митохондрий (Lissoni P., 2007).
Цель исследования. Улучшение результатов лечения больных с глиальными опухолями головного мозга, путем разработки эффективных методов комбинированного лечения и комплекса диагностических скрининговых мероприятий, способствующих раннему их выявлению.
Поставленная цель достигалась решением следующих задач:
1. Исследовать динамику распространенности гистологических типов глиальных опухолей на территории Ростовской области в зависимости от экологических условий жизни среди различных возрастно-половых и социальных групп населения.
2. Использовать компьютерную стабилометрию как метод скрининга в комплексе ранней диагностики глиальных опухолей.
3. Разработать диагностическую карту для врачей поликлинического звена и анкету нейроонкологической настороженности для населения, которые будут способствовать раннему выявлению злокачественных глиальных опухолей головного мозга.
4. Разработать оригинальную методику химиотерапии, обладающую наименьшей токсичностью и большей эффективностью в сравнении с другими методами химиотерапии. Изучить возможности многокурсовой внутриартериальной химиотерапии.
5. Изучить качество, продолжительность жизни и длительность безрецидивного периода больных со злокачественными глиальными опухолями в группах с разработанным методом внутриартериальной химиотерапии на артериальной аутокрови и другими методами химиотерапии на аутологичных средах.
6. Изучить динамику изменений статокинетических показателей пациентов в процессе комбинированного лечения в сопоставлении со шкалой Карновского для объективизации качества жизни больных.
7. Уточнить значимость изменения уровня мелатонина в крови пациентов и 6-сульфатоксимелатонина (6-СОМ) в моче пациентов в качестве диагностического и прогностического фактора у больных со злокачественными глиомами, а также способа прогнозирования выживаемости и длительности безрецидивного периода.
8. Изучить неспецифические реакции адаптации у больных со злокачественными глиомами при использовании адьювантных методов химиотерапии на аутологичных средах организма.
Научная новизна. В диссертационной работе автором впервые
- разработан метод внутриартериальной химиотерапии на артериальной аутокрови в сочетании с лучевой терапией, который может быть использован в качестве основного в лечении неоперабельных больных: в случаях расположения опухолей в функционально значимых зонах, либо глубинном расположении в подкорковых структурах после биопсии опухоли с помощью безрамной системы КТ-навигации или стереоктаксической биопсии для верификации процесса (Патент «Способ диагностики онкологических поражений головного мозга» № 71531, приоритет от 14 декабря 2007).
- доказано, что улучшение результатов комплексного лечения достигается применением метода внутриартериальной химиотерапии на артериальной аутокрови (или аутоплазме) больных с глиальными опухолями головного мозга, с сохранением качества и продолжительности их жизни (Патент на изобретение «Способ лечения больных с глиальными опухолями головного мозга» № 2310479. Приоритет от 03 августа 2006 г.).
- установлено диагностическое и прогностическое значение уровня мелатонина в крови и 6-сульфатоксимелатонина (6-СОМ) в моче больных со злокачественными глиомами в отношении длительности безрецидивного периода и продолжительности жизни (Приоритетная справка на «Способ прогнозирования выживаемости злокачественных глиом», заявка № 2010107100/14 (009922) от 25.02.2010 г.).
- обосновано комбинирование методов химиотерапии на аутологичных средах с приемом мелаксена (мелатонина) как гормона эпифиза и антиоксиданта, подавляющего пролиферацию опухолевых клеток (Приоритетная справка на «Способ адъювантной химиотерапии злокачественных глиом головного мозга», заявка № 2010107099/14 (009921), приоритет от 25.02.2010 г.).
- объективизирована оценка качества жизни больных со злокачественными глиомами с применением метода компьютерной стабилометрии.
Практическая значимость работы
Изучение заболеваемости и смертности при опухолевых поражениях головного мозга, распространенности гистологических типов глиальных опухолей на территориях Ростовской области в зависимости от экологических условий жизни различных возрастно-половых и социальных групп населения, что повысит онкологическую настороженность врачей общелечебной сети и улучшать раннюю диагностику глиальных опухолей головного мозга.
Диагностическая карта для врачей поликлинического звена и анкета нейроонкологической настороженности для населения, разработанные на основе внедрения компьютерной стабилометрии как метода скрининга в ранней диагностике опухолевых поражений головного мозга, что позволит повысить нейроонкологическую настороженность врачей и упорядочить направление больных на обследование методами доказательной нейровизуализации.
Основные положения, выносимые на защиту
- Применение компьютерной стабилометрии как метода скрининга в комплексе ранней диагностики глиальных опухолей с упорядочиванием потока больных на обследование методами нейровизуализации может стать основой раннего выявления опухолевых поражений головного мозга.
- Разработанная оригинальная методика внутриартериальной химиотерапии на аутологичных средах с использованием имплантируемой подкожно внутриартериальной порт-системы - это современный способ улучшения результатов комплексного лечения пациентов со злокачественными глиомами с сохранением качества и продолжительности жизни данной группы больных.
- Изучение уровня мелатонина в крови пациентов и 6-сульфато-ксимелатонина (6-СОМ) в их моче как диагностического и прогностического фактора у больных со злокачественными глиомами является одним из способов оценки эффективности проводимого лечения, прогнозирования выживаемости и длительности безрецидивного периода.
- Методика усиления эффективности химиотерапии с длительным приемом мелаксена (мелатонина) в дозе 18 мг/сутки направлена на увеличение общей и бессобытийной выживаемости данной группы больных.
Внедрение результатов исследования в здравоохранение
Результаты исследования внедрены в учебный процесс кафедры онкологии Ростовского Государственного Медицинского Университета, практическую работу городского онкологического диспансера г. Ростова-на-Дону.
Публикации
По материалам диссертации опубликовано 27 научных работ: 11 статей в журналах, рецензируемых ВАК Минобрнауки РФ.
Апробация диссертации
Апробация диссертации состоялась 17.06.2010 г. на Ученом Совете Ростовского научно-исследовательского онкологического института. Результаты работы доложены научно-практической конференции «Актуальные вопросы неврологии и нейрохирургии» (Ростов-на-Дону, 2008). на Всероссийской научно-практической конференции – Поленовские чтения (Санкт-Петербург, 2009),
Структура и объем диссертации
Диссертация изложена на 246 страницах машинописного текста. Работа иллюстрирована 35 таблицами и 24 рисунками, состоит из введения, 6 глав, заключения, выводов, практических рекомендаций, указателя литературы, содержащего 98 отечественных и 124 зарубежных источников.
СОДЕРЖАНИЕ РАБОТЫ
Характеристика клинического материала и методов исследования
Клиническая часть исследования представлена данными о 291 больном со злокачественными глиомами головного мозга, которым проведено комплексное лечение в объеме костно-пластической или декомпрессивной трепанации черепа с удалением опухоли в пределах здоровых тканей, адъювантной дистанционной гамматерапии и последующих курсов химиотерапии.
Основную группу составили 189 больных (96 мужчин и 93 женщин), из которых аутогемохимиотерапию (АГХТ) получали 156 больных, 17-и больным проводили внутриартериальную высокодозную химиотерапию (ВАХТ) и 16 пациентов получали аутогемохимиотерапию в сочетании с приемом мелаксена (АГХТ+М).
Контрольная группа представлена 102 больными (54 мужчин и 48 женщин), которым проведено стандартное комплексное противоопухолевое лечение, включающее несколько (как правило, от 3 до 6) послеоперационных курсов полихимиотерапии (СПХТ) в стандартных режимах.
Распределение больных в исследуемой и контрольной группах по возрасту представлено в таблице 1.
Таблица 1
Возрастной состав больных со злокачественными глиомами основной и
контрольной групп, абс. число (%)
| Группа больных | Возраст, годы | |||||
| 18–20 | 21–30 | 31–40 | 41–50 | 51–60 | старше 60 | |
| Основная (n=189) | 6 (3,7) | 12 (6,3) | 43 (22,8) | 67 (35,4) | 41 (22,2) | 20 (9,6) |
| Контрольная (n=102) | 4 (4,0) | 10 (9,7) | 25 (24,4) | 34 (33,5) | 18 (17,6) | 11 (10,8) |
Очевидно, что большинство больных основной (79,9%) и контрольной (75,5%) групп находились в возрастном диапазоне от 31 до 60 лет. Медиана возраста больных составила 45,5±2,4 годы.
В основной и контрольной группах было равное количество мужчин и женщин (табл. 2).
Таблица 2
Распределение больных основной и контрольной групп по полу и гистотипу опухоли, абс. число (%)
| Показатель | Основная группа, n=189 | Контрольная группа, n=102 | ||
| Анапластическая астроцитома | Глиобластома | Анапластическая астроцитома | Глиобластома | |
| Мужчины | 37 (19,6) | 59 (31,2) | 26 (25,5) | 33 (32,4) |
| Женщины | 37 (19,6) | 56 (29,6) | 22 ( 21,5) | 21(20,6) |
| Всего: | 74 | 115 | 58 | 54 |
По локализации опухоли больные основной и контрольной групп распределялись следующим образом (табл. 3).
Таблица 3
Локализация опухоли в анатомических отделах головного мозга, абс. число (%).
| Доля головного мозга | Основная группа, n=189 | Контрольная группа, n=102 | ||
| Анапластическая астроцитома | Глиобластома | Анапластическая астроцитома | Глиобластома | |
| Лобная | 25(13,2) | 49(25,9) | 17(16,7) | 19(18,9) |
| Височная | 15 (8) | 33(17,5) | 12(12,3) | 14(13,8) |
| Теменная | 15(8) | 47(24,8) | 17(16,7) | 18(17,8) |
| Затылочная | 2(1,02) | 3(1,58) | 2(1,9) | 2(1,9) |
По степени тяжести состояния больные основной и контрольной групп распределялись следующим образом (табл. 4).
Таблица 4
Распределение больных по степени тяжести общего состояния, абс. ч. (%)
| Группы больных по тяжести состояния | Основная группа, n=189 | Контрольная группа, n=102 |
| Компенсированные | 157 (83,1) | 84 (82,4) |
| Субкомпенсированные | 32 (16,9) | 18 (17,6) |
| Всего | 189 (100,0) | 102 (100,0) |
Все больные находились в состоянии компенсации и субкомпенсации, что позволяло нам провести запланированный объем противоопухолевого лечения.
До его начала определялся объем опухоли путем измерения её размеров по данным компьютерной или магнитно-резонансной томографии, выполненной перед операцией. Субтотальным считалось удаление 95% ткани опухоли, частичным – удаление 50–75%.
Распределение больных в изучаемых группах по объему оперативного вмешательства представлено в таблице 5, из результатов которой видно, что основной массе больных обеих групп было выполнено тотальное и субтотальное удаление злокачественной опухоли головного мозга.
Дистанционную гамма-терапию в обеих группах начинали с 10–11 суток после проведенной операции. Величина полей облучения выбиралась в зависимости от размеров изначально имеющейся или остаточной опухоли и выраженности перифокального отека. Разовые очаговые дозы составляли 2–2,6 Гр, суммарные достигали 60 Гр.
Таблица 5
Распределение больных в исследуемых группах по объему
оперативного вмешательства, абс. ч. (%)
| Объем удаления опухоли | Основная группа n=189 | Контрольная группа n=102 |
| Тотальное | 134 (71) | 78 (76,5) |
| Субтотальное | 35 (18,5) | 10 (9,8) |
| Частичное (от 50 до75%) | 15 (7,9) | 11 (10,8) |
| Биопсия опухоли | 5 (2,6) | 3 (2,9) |
| Всего | 189 (100,0) | 102 (100,0) |
Все пациенты в процессе адъювантного химиолучевого лечения получали базовую противоотечную терапию, включающую кортикостероиды (дексаметазон в дозе 8–16 мг/сут), диуретики (фуросемид, маннитол, диакарб), сульфат магния, антиконвульсанты (карбамазепин, паглюферал, бензонал).
В ближайшем послеоперационном периоде выполнялась повторная магнитно-резонансная томография или мультисрезовая спиральная компьютерная томография (МСКТ). Объективный лечебный эффект со стороны церебральной опухоли оценивался с помощью РКТ и МРТ головного мозга согласно критериям McDonald с соавт. (1980) (Кобяков Г.Л., 2002; Константинова М.М. и соавт., 2002).
Оценку побочных эффектов химиотерапии проводили согласно рекомендациям ВОЗ (по критериям NCI-CTC) (Переводчикова Н.И., 2011).
По вариантам лечения больные основной группы (189 человек) были распределены на 3 подгруппы:
1-я – 156 больным после удаления опухоли и дистанционой гамматерапии проведена многокурсовая аутогемохимиотерапия (АГХТ) по схеме карбоплатин+винкристин+ per os ломустин; разовые дозы рассчитывались по режимам – винкристин 1,5 мг/м2, карбоплатин 100 мг/м2, ломустин 100 мг/м2, то есть разовая доза – карбоплатин 150 мг, винкристин 2 мг, ломустин 200 мг;
2-я – 16 больным проводилась аутогемохимиотерапия (АГХТ+М) кармустином в дозе 200 мг (из расчета 150 мг/м2) в сочетании с приемом мелаксена;
3-я – 17 больным основной группы после имплантации тромборезистентной внутриартериальной порт-системы «Селсайт» выполнена многокурсовая внутриартериальная химиотерапия карбоплатином в дозе 300 мг, введенным иньектоматом в течение 4 часов на фоне гипергидратации и антиэметической терапии, проводилась на артериальной аутокрови.
Оценку эффективности химиотерапии в обеих группах проводили каждые 6 недель, используя КТ или МРТ, измеряя размеры опухоли в 2-х наибольших перпендикулярных диаметрах, а также путем анализа неврологического статуса в динамике, данных клинических и биохимических показателей крови. Объективный лечебный эффект оценивался после первого и шестого курсов терапии путем изучения динамики размеров опухоли по данным компьютерной и магнитно-резонансной томографии согласно критериям McDonald с соавт. – полная ремиссия, частичная ремиссия, стабилизация и прогрессирование опухоли.
Биохимические методы исследования
В крови больных после операции до комплексного лечения определяли содержание гормона эпифиза – мелатонина, а в моче – 6-СОМ (6-сульфато-ксимелатонин) методом иммуно-ферментного анализа (ИФА). Осуществлялся забор крови больных злокачественными глиомами натощак утром в 7.30 при их поступлении, на десятые сутки после операции удаления опухоли, после адъювантной ДГТ и перед каждым курсом химиотерапии с целью исследования уровня мелатонина в динамике проводимого комплексного лечения. Белок S-100 в сыворотке крови определяли методом ИФА с помощью тест-систем фирмы «Хема».
Эпидемиологические методы исследования
Эпидемиологическое исследование распространенности, заболеваемости и клинико-статистической характеристики первичных ОГМ проводилось при учете только гистологически верифицированных (операция, аутопсия) опухолей головного мозга. В изучаемую группу вошли 2056 больных, родившихся и постоянно проживавших на территории Ростовской области, все находились на обследовании и лечении в специализированных (неврологических и нейрохирургических) и неспециализированных (терапевтические, хирургические, инфекционные отделения, родильные дома) отделениях стационаров г. Ростова-на-Дону за период с 1 января 1988 по 31 декабря 2009 гг. Среди них было 27 посмертных диагностических находок первичных ОГМ у жителей Ростовской области за исследуемый 21-летний период.
Компьютерная стабилометрия в ранней диагностике злокачественных глиом головного мозга и как способ объективной оценки качества жизни
Исследование выполняли с помощью компьютерного стабилоанализатора с биологической обратной связью «Стабилан-01-2» и программно-методичес-ком обеспечении StabMed 2.07.
По-прежнему сохраняются трудности ранней диагностики, а с начальными клиническими проявлениями в стационары поступают до 11% больных, в стадии декомпенсации – около 10% больных первичными опухолями головного мозга.
С целью ускоренного выявления нейроонкологических больных, упорядочения их потока на прием к неврологу и направления их на СКТ или МРТ нами использовалась более мобильная система скрининга, направленная на формирование внутреннего желания самого больного явиться на прием к неврологу и включать диагностический алгоритм.
Предлагается система скрининга, состоящая из: 1 – листовки для больных с указанием первых симптомов, с которыми необходимо обратиться на прием к неврологу, 2 – короткого диагностического алгоритма для неврологов первичного контакта с больным и 3 – стабилометрии, простого, неинвазивного в исполнении метода диагностики, выполнимого в неврологическом кабинете.
Листовки для больных находились на стенде в коридоре у кабинета невролога, в аптеках у кассы и т.д. Цель применения листовок – формирование у больных «внутреннего психологического императива» для обращения к неврологу. Содержание листовок следующее:
Если Вас беспокоят:
1. Головная боль длительно не купируемая, на протяжении более двух дней.
2. Приступы потери сознания:
а) с прикусыванием языка;
б) замирание или выключение сознания на несколько секунд (со слов родственников или окружающих);
в) чувство «онемения» или «ползания мурашек» в руке, ноге или обеих конечностях на одной стороне;
г) потеря сознания с поворотом головы и глаз в противоположную сторону.
3. Нарушения речи:
а) с затруднением речевой продукции и написания слов;
б) словесная «окрошка»;
4. Слабость в руке, ноге или обеих конечностях на одной стороне.
5. Шаткость при ходьбе.
6. Если родственники заметили нарушение памяти, внимания, критики, ориентации в окружающем мире
ОБРАТИТЕСЬ НА ПРИЕМ К НЕВРОЛОГУ.
При наличии листовки у пациента его обследование состояло из опроса по диагностическому алгоритму, неврологического осмотра, выполнения стабилометрии, после которой он подлежит направлению на методы нейровизуализации (СКТ, МРТ). Кроме того, необходимо у всех больных, обратившихся на прием к неврологу без листовки с целью повышения нейроонкологической настороженности регистрировать стабилометрические показатели.
Предлагаемый неврологам диагностический алгоритм для нейроонкологических больных короткий и существенно не увеличивает время приема.
Структура его следующая:
При наличии эписиндрома;
очаговой симптоматики;
общемозговой симптоматики;
двигательных нарушений;
нарушений ВНД
или сочетании нескольких из вышеперечисленных симптомов больной подлежит в обязательном порядке направлению на методы нейровизуализации.
Метод компьютерной стабилометрии использовался нами также и как способ объективной оценки качества жизни нейроонкологических больных. Качество жизни больных оценивали как по шкале Карновского, так и с помощью компьютерной стабилометрии, исследованием качества функции равновесия (программа StabMed 2.07) на «очувствленном кресле», исследовалась перед операцией, дистанционной гамматерапией и каждым курсом химиотерапии.
Исследование общей и бессобытийной выживаемости
по Каплану-Майеру
Одними из важных показателей эффективности противоопухолевой терапии являются ближайшие и отдаленные результаты, которые исследованы по общей и бессобытийной выживаемости изучаемых и контрольной групп по Каплану-Майеру. В нашей работе в бессобытийной выживаемости (EFS – event free survival): полное событие – рецидив, продолженный рост и смерть; цензурированное событие – жив пациент или выбыл из-под наблюдения.
Таким образом, полным событием были только продолженный рост и смерть больных. Исследование общей и бессобытийной выживаемости проводили, используя программу STATISTICA 6.0.
Метод исследования адаптационных реакций
Для оценки динамики неспецифических адаптационных реакций проведен сравнительный анализ основного сигнального показателя (Гаркави Л.Х., и соавт. 2003). Сигнальным элементом формулы крови, манифестирующей тип реакции, является число лимфоцитов. Другие интегральные составляющие формулы крови (эозинофилы, моноциты, палочкоядерные и сегментоядерные нейтрофилы) служат уточняющими показателями напряженности реакции и определяют уровень реактивности (Шихлярова А.И., 1985).
Статистическая обработка материала проводилась с использованием компьютерной программы «Statistica-2000». Достоверность различий между двумя выборками, имеющими нормальное распределение значений, проводилось с использованием t-критерия Стьюдента. Сравнение двух выборочных долей, не имеющих нормального распределения, проводили с использованием -преобразования Фишера (Сергиенко В.И. и соавт., 2006). Различие считалось статистически достоверным при вероятности безошибочного прогноза р95% (р0,05).
Результаты исследования
Нами изучены данные 2056 случаев гистологически верифицированных первичных ОГМ зарегистрированных на территории Ростовской области за 1988–2009 гг. Эпидемиологическая картина распространенности глиальных опухолей головного мозга на территории Ростовской области обусловлена экологически неоднородной среды обитания. В городах и сельских районах юго-запада Ростовской области (территориально-промышленный комплекс) среднегодовой уровень распространенности глиальных опухолей в 2–3 раза выше, чем на остальной территории, а неблагоприятные экологические условия отдельных населенных пунктов РО могут считаться потенциально опасными по риску их развития (Сафонова И.А., 2000). В сравнении с прошлыми годами наблюдается заметное увеличение числа больных с глиальными опухолями головного мозга.
Из 2056 случаев гистологически верифицированных первичных ОГМ 1075 (52,3%) составили глиальные опухоли. Причем среди сельского населения глиомы встречались несколько чаще – 55,4% всех ОГМ селян, чем среди городских жителей – 44,6% всех ОГМ горожан.
Наиболее часто глиомы встречались у мужчин: в целом по области – 621 (57,8%) у мужчин и 454 (42,2%) у женщин; среди сельских жителей – 67% у мужчин и 33% у женщин; среди горожан – 58,5% составили мужчины и 41,5% женщины.
Из глиальных опухолей в области преобладали астроцитомы и глиобластомы. Астроцитомы составили 43,7% всех ОГМ (у мужчин – 42,5% и 45,4% у женщин) и глиобластомы – 42,5% всех ОГМ (43,4% у мужчин и 41,3% у женщин), причем злокачественные формы астроцитом преобладали над доброкачественными, особенно среди женщин (табл. 6).
Таблица 6
Распределение различных гистологических типов первичных ОГМ
| Опухоль | Мужчины | Женщины | Оба пола | |||
| абс. ч. | % | абс. ч. | % | абс. ч. | % | |
| Глиальные опухоли: | 621 | 100 | 454 | 100 | 1075 | 100 |
| Глиобластома | 269 | 43,4 | 188 | 41,3 | 457 | 42,5 |
| Астроцитома | 264 | 42,5 | 206 | 45,4 | 470 | 43,7 |
| Олигодендроглиома | 52 | 8,1 | 29 | 6,4 | 81 | 7,5 |
| Медуллобластома | 36 | 6,0 | 31 | 6,9 | 67 | 6,3 |
Анализ процентного состава гистологических типов первичных ОГМ в различных возрастных группах мужчин выявил преобладание глиальных опухолей в структуре ОГМ всех возрастных групп: с 20 до 50-ти летнего возраста – за счет астроцитом. Причем в возрасте 40–49 лет преобладание астроцитом над глиобластомами выражено незначительно (24,69 и 23,05% соответственно всех ОГМ мужчин этого возраста). С 50-летнего возраста в структуре первичных ОГМ преобладают глиобластомы, причем, если в возрасте 50–59 лет соотношение глиобластом и астроцитом составляет примерно 2:1, то в возрасте 60–69 лет уже 6:1, а после 70 лет глиомы представлены исключительно глиобластомами (44,44% всех первичных ОГМ мужчин этого возраста).
Среднегодовой показатель распространенности первичных ОГМ в Ростовской области за изучаемый 21-летний период в городах с многоотраслевой промышленностью (Новочеркасск, Волгодонск, Азов, Ростов-на-Дону, Таганрог) составил 7,72 на 100 тыс. населения. Среди городов с угольной промышленностью (Шахты, Красный Сулин, Зверево, Гуково, Донецк, Новошахтинск, Белая Калитва) – 2,31 на 100 тыс. населения. Среди городов с отраслями легкой промышленности (Сальск, Миллерово, Каменск-Шахтинский, Батайск) – 2,35 на 100 тыс. населения (табл. 7).
Таблица 7
Среднегодовой показатель распространенности первичных ОГМ среди городского
населения Ростовской области в условных группах городов за период 1988-2009 гг.
(на 100 тыс. населения)
| Группы городов | Заболеваемость ОГМ |
| Города с многоотраслевой промышленностью (Новочеркасск, Волгодонск, Азов, Ростов-на-Дону, Таганрог) | 7,72 |
| Города с угольной промышленностью (Шахты, Красный Сулин, Зверево, Гуково, Донецк, Новошахтинск, Белая Калитва) | 2,31 |
| Города с отраслями легкой промышленности (Сальск, Миллерово, Каменск-Шахтинский, Батайск) | 2,35 |
Нами изучена динамика эпидемиологической картины злокачественных глиом в ЮФО и Ростовской области что позволило определить пути улучшения ранней диагностики злокачественных глиом, особенно в регионах экологического неблагополучия.
Учитывая эпидемиологическую картину распространенности первичных опухолей головного мозга в Ростовской области следует предполагать, что она обусловлена экологической неоднородностью среды обитания, так как она в 3–6 раз выше в городах и сельских районах юго-запада Ростовской области, выше в 3–5 раз в районах, приближенных к водным объектам из-за загрязнен ности водоемов, а также в ее территориально-промышленном комплексе, чем на остальной территории.
Существующие в настоящее время методы повышения качества оказания помощи больным с первичными опухолями головного мозга путем улучшения ранней диагностики новообразований с учетом их патогенетических факторов позволяют выявлять нейроонкологических больных на основе уже появившихся клинических симптомов опухоли, когда размеры самой опухоли достаточно большие. Тем не менее, в целях улучшения ранней диагностики ОГМ в каждом конкретном субъекте Российской Федерации необходимо учитывать факторы онкориска, характерные для данной территории.
С целью своевременного выявления нейроонкологических больных, упорядочения их потока на прием к неврологу и на обследования с использованием методов доказательной медицины (СКТ, МРТ) разработана мобильная система диагностики, направленная как на формирование внутреннего желания самого больного явиться на прием к неврологу, так и усовершенствованный диагностический алгоритм и применение неинвазивного метода обследования, позволяющего выявить наличие опухоли до появления ее симптомов.
С помощью системы организации мероприятий скрининга было обследовано 437 больных, в том числе в кабинете нейрохирурга-нейроонколога РНИОИ на «Открытом приеме» с 2007 по 2009 г.г. было принято 420 больных, из которых у 48 диагностированы опухолевые поражения головного мозга. Остальные больные обследовались на приеме нейроонколога в поликлинике РНИОИ, а также для исследования точности, специфичности и чувствительности метода были обследованы пациенты с неопухолевыми объемными образованиями головного мозга (травматические субдуральные гематомы) в БСМП-2.
Для определения чувствительности метода мы также разделили больных по исходным размерам опухолей на 2 подгруппы: I – опухоли до 30 мм в наибольшем диаметре (n=142) и II – опухоли свыше 30 мм в наибольшем диаметре (n=146).
Проведено сравнение рентгенологических данных СКТ (МРТ) размеров опухолей и стабилометрических показателей (теста на устойчивость) у больных с глиальными опухолями головного мозга в обеих группах для уточнения чувствительности метода стабилометрии. В таблице 8 представлены результаты Теста на устойчивость. Отклонение центра равновесия вперед и назад в первой группе (n=142, размер опухоли менее 30 мм в наибольшем диаметре) достоверно меньше, чем во второй (n=146, размер опухоли более 30 мм в наибольшем диаметре). Отклонение вправо, влево и площадь зоны перемещения в первой группе достоверно больше, чем во второй. Отношение «вперед/назад» и «сагитталь-фронталь» достоверно больше во второй группе, а отношение «вправо-влево» – в первой группе (p<0,01). В то же время даже при наименьшем размере опухолей при исследовании теста на устойчивость уже появляются изменения стато-кинетических функций больных, что позволит применять стабилометрическое исследование в скрининге ранней диагностики опухолевых поражений головного мозга. Точность – это доля правильных результатов (сумма истинно-положительных и истинно-отрицательных результатов) в общем количестве результатов:
Точность = (N обсл+ и N обсл) / N все обсл. Точность метода в нашем случае составила 96%.
Чувствительность (частота истинно положительного результата) – это отношение числа обследованных с положительным результатом к числу всех обследованных больных):
Чувст= Nобсл+ / Nвсе обсл. В нашем случае чувствительность была 99%.
Специфичность (частота истинно отрицательного результата) – это отношение числа обследованных с отрицательным результатом к числу всех обследованных здоровых лиц):
Специф = N обсл / N все обсл.
В нашем случае специфичность была 95%.
Таблица 8
Тест на устойчивость
| Показатель | Размер опухоли | |
| <30 mm, n=142 | >30 mm, n=146 | |
| Отклонение вперед | 4 мм | 16 мм |
| Отклонение назад | 76 мм | 96 мм |
| Отклонение вправо | 82 мм | 15 мм |
| Отклонение влево | 86 мм | 58 мм |
| Площадь зоны перемещения | 6720 кв.мм. | 4088 кв.мм. |
| Отношение вперед/назад | 0,05 | 0,17 |
| Отношение вправо/влево | 0,95 | 0,26 |
| Отношение сагитталь/фронталь | 0,48 | 1,53 |
При уменьшении величины девиации центра равновесия в сагиттальной плоскости в 1,27 и более раз и ее увеличении во фронтальной плоскости позволяет предположить о наличии объемного образования головного мозга. За последние два года с помощью компьютерной стабилометрии на методы визуализации (СКТ, МРТ) были направлены 194 человека, среди которых у 85 были выявлены злокачественные глиомы больших полушарий головного мозга. Всего глиальные опухоли диагностированы у 189 больных (96 мужчин и 93 женщин) из 437 обследованных пациентов.
Из полученных результатов компьютерной стабилометрии видно, что даже при наименьшем размере опухолей появляются достоверное cмещение центра равновесия от его нормального положения (p<0,01), что позволит применять стабилометрическое исследование как метод скрининга в ранней диагностике опухолевых поражений головного мозга, как основание для направления на методы визуализации (СКТ, МРТ).
В таблице 9 представлены результаты исследования смещения центра равновесия в зависимости от локализации опухоли.
Таблица 9
Смещение центра равновесия в зависимости от локализации опухоли, мм
| Локализация | Смещение по фронтали | Смещение по сагиттали |
| Лобная доля | Гетеролатерально 97±0,22 | Кзади 38,3±0,16 |
| Теменная доля | Гетеролатерально 20,49±0,15 | Кзади 40,1±0,2 |
| Височная доля | Гомолатерально 10,3±0,16 | Кзади 6,2±0,12 |
| Затылочная доля | Гетеролатерально 9,7±0,16 | Кзади 2,24±0,11 |
| Зрительный бугор | Гетеролатерально 2,2±0,12 | Вперед 29,1±0,15 |
При локализации опухоли в лобной доле центр равновесия сместился гетеролатерально по фронтальной оси на 4,97±0,22 мм и по сагиттальной оси назад на 38,3±0,16 мм. Опухоль теменной доли вызывает смещение по фронтали гетеролатерально на 20,49±0,15 мм, по сагиттали – кзади на 40,1±0,2 мм. Рост опухоли в височной доле вызывает смещение центра равновесия во фронтали гомолатерально на 2,24±0,11 мм и по сагиттали кзади на 6,2±0,12 мм. Рост опухоли в затылочной доле вызывает смещение центра равновесия по фронтали гетеролатерально на 9,7±0,16 мм и по сагиттали кзади на 2,24±0,11 мм. Опухоль зрительного бугра дает смещение во фронтальной плоскости гетеролатерально на 2,2±0,12 мм и в сагиттальной плоскости вперед 29,1±0,15 мм, достоверно отлично (p<0,05)
Компьютерная стабилометрия в комплексе неврологического скрининга дает возможность раннего выявления опухолей головного мозга за счет достоверной (p<0,01) регистрации смещения центра равновесия, что упорядочило поток данной группы больных на методы нейровизуализации, относящиеся к доказательной медицине.
Нами исследована частота и выраженность основных токсических проявлений при проведении химиотерапии. У больных контрольной группы основные токсические проявления были выше по сравнению со всеми подгруппами основной группы. Наиболее часто наблюдались токсические осложнения I и II степени выраженности. По результатам нейротоксических осложнений, связанных с поражением центральной и периферической нервной системы, так и проявления, вызванные поражением других органов и систем, следует отметить, что наиболее часто в изучаемых группах встречались головокружение, головная боль, нарушения зрения, нейроретинит. В частности, при АГХТ головная боль встречалось в 4,1% случаев, в контрольной – в 10,2% случаев; головокружение – 5,02% – в группе АГХТ и 11,1% в контрольной; нейроретинит в группе АГХТ отмечен в 1,28% случаев и в 4,7% – в контрольной группах. В контрольной группе чаще встречались тяжело протекающие осложнения (2 и 3-й степени тяжести) (табл. 10).
Определение уровня мелатонина и белка S100B в сыворотке крови пациентов со злокачественными глиомами больших полушарий головного мозга осуществлялось методом ИФА (табл. 11).
Исходный показатель белка S100 до операции у больных 1 подгруппы, получавших в комплексном лечении АГХТ был 111,9±0,1 нг/л.
Таблица 10
Сравнительная оценка неврологической токсичности изучаемых методов адъювантной
химиотерапии (АГХТ, АГХТ+М, ВАХТ+М) и контрольной групп, абс. ч. (%)
| Побочные проявления | Степень токсичности | 1 группа (АГХТ) (936 курсов) | 2 группа (АГХТ+М) (96 курсов) | 3 группа (ВАХТ+М) (102 курса) | Контрольная группа (612 курсов) |
| Мозжечковые расстройства | 1 | 67 (7,15) | 6 (37,5) | 3 (17,6) | 59 (9,6) |
| 2, 3+4 | – | – | – | – | |
| Всего | 67 (7,15) | 6 (37,5) | 3 (17,6) | 59 (9,6) | |
| Корковые расстройства | 1 | 19 (2,0) | 8 (50) | 2 (11,8) | 31 (5,06) |
| 2 | 1 (0,1) | – | – | 4 (0,65) | |
| 3+4 | – | – | – | – | |
| Всего | 20 (2,1) | 8 (50) | 2 (11,8) | 35 (5,71) | |
| Головокружение | 1 | 47 (5,02) | 2(14,1) | 4 (23,5) | 68 (11,1) |
| 2 | 9 (0,96) | – | – | 14 (2,28) | |
| 3 | – | – | – | 3 (2,2) | |
| Всего | 56 (5,98) | 2(14,1) | 4 (23,5) | 85 (15,58) | |
| Головная боль | 1 | 39 (4,1) | 5(32,85) | 8 (47) | 63 (10,2) |
| 2 | 4 (0,42) | – | 2 (11,8) | 5 (0,81) | |
| 3 | – | – | – | – | |
| Всего | 43 (4,52) | 5(32,85) | 10 (58,8) | 68 (11,01) | |
| Бессонница | 1 | 17 (1,8) | – | 3 (17,6) | 32 (5,2) |
| 2 | 2 (0,21) | – | 2 (11,8) | 3 (0,49) | |
| 3 | – | – | – | – | |
| Всего | 19 (2,01) | – | 5 (29,4) | 35 (5,69) | |
| Экстрапирамидные расстройства | 1 | 15 (1,6) | – | – | 24 (3,92) |
| 2, 3+4 | – | – | – | – | |
| Всего | 15 (1,6) | - | - | 24 (3,92) | |
| Изменение слуха | 1 | 3 (0,32) | 1 (6,25) | 1 (5,9) | 7 (1,14) |
| 2, 3+4 | – | – | – | – | |
| Всего | 3 (0,32) | 1 (6,25) | 1 (5,9) | 7 (1,14) | |
| Сенсорные нарушения | 1 | 11 (1,17) | 1 (6,25) | 2 (11,8) | 18 (2,94) |
| 2 | – | – | – | 1 (0,16) | |
| 3+4 | – | – | – | – | |
| Всего | 11 (1,17) | 1 (6,25) | 2 (11,8) | 19 (3,1) | |
| Нарушения зрения | 1 | 19 (2,02) | 2 (12,5) | 2 (11,8) | 32 (5,2) |
| 2 | 4 (0,42) | – | – | 4 (0,65) | |
| 3+4 | – | – | – | – | |
| Всего | 23 (2,44) | 2 (12,5) | 2 (11,8) | 37 (5,85) | |
| Астенизация | 1 | 7 (0,7) | - | – | 19 (3,1) |
| 2, 3+4 | – | – | – | – | |
| Всего | 7 (0,7) | – | – | 19 (3,1) | |
| Нарушение движений | 1 | 3 (0,32) | – | 1 (5,9) | 13 (2,12) |
| 2, 3+4 | – | – | – | – | |
| Всего | 3 (0,32) | – | 1 (5,9) | 13 (2,12) | |
| Нейроретинит | 1 | 12 (1,28) | – | 1 (5,9) | 29 (4,7) |
| 2, 3+4 | – | – | – | – | |
| Всего | 12 (1,28) | – | 1 (5,9)- | 29 (4,7) |
После операции, перед началом адъювантной ДГТ – 89,7±0,2 нг/л. После первого курса АГХТ он снизился до 80,7±0,2 нг/л, а после второго курса АГХТ повысился до 162,3±0,4 нг/л, что свидетельствует о высокой эффективности АГХТ и лизисе опухоли. После третьего курса АГХТ у больных отмечалось отсутствие продолженного роста опухоли на МРТ, наличие ликворной полости на месте удаленной опухоли и снижение уровня белка S100, что свидетельствует о высокой эффективности метода комплексного лечения – операция + адъювантная ДГТ+АГХТ.
Таблица 11
Динамика уровня мелатонина и белка S100 на этапах лечения
| Показатель | Этап лечения | Вид лечения | ||
| АГХТ, n=156 | АГХТ+М, n=16 | ВАХТ+М, n=17 | ||
| Белок S-100, нг/л | норма | 15,6-90,0 | ||
| до операции | 111,9±0,1 | 150,8±0,1 | 138,1±0,2 | |
| после операции | 89,7±0,2 | 159,6±0,1 | 185,5±0,3 | |
| 1 курс | 80,7±0,2 | 55±0,3 | 50,1±0,3 | |
| 2 курс | 162,3±0,4 | 56,5±0,3 | 83,7±0,2 | |
| 3 курс | 44,4±0,3 | 125±0,1 | 48,7±0,3 | |
| Мелатонин, пг/мл | норма | 4,6 | ||
| до операции | 3,6±0,05 | 5,4±0,05 | 4,8±0,04 | |
| после операции | 2,8±0,02 | 4,1±0,04 | 5,5±0,02 | |
| 1 курс | 2,0±0,02 | 4,2±0,03 | 6,3±0,02 | |
| 2 курс | 2,2±0,04 | 5,1±0,03 | 5,6±0,04 | |
| 3 курс | 2,0±0,05 | 5,9±0,05 | 6,0±0,03 | |
Пациенты 2 подгруппы, получавшие аутогемохимиотерапию в сочетании с пероральным приемом мелаксена (АГХТ+М), до операции имели высокий исходный уровень мелатонина. После операции он снизился до 4,1±0,04 пг/мл, а после третьего курса АГХТ+М отмечается подъем как уровня мелатонина до 5,9±0,05 нм/л, так и уровня белка S100 до 125±0,1 нг/л, что свидетельствует как о более отсроченном распаде опухоли, так и о повышении уровня мелатонина, являющегося антиоксидантом.
У больных 3 подгруппы, получавших внутриартериальную химиотерапию в сочетании с пероральным приемом мелаксена (ВАХТ+М), уровень мелатонина сохранялся повышенный, превышая нормальные показатели (норма 4,6 пг/мл). Однако, на контрольных МРТ и СКТ головного мозга отмечалось отсутствие продолженного роста опухоли. Качество жизни больных по шкале Карновского в пределах 80 баллов, все больные в настоящий момент живы. Период наблюдения составил 15 мес.
На основании вышеизложенного можно предположить, что АГХТ и ВАХТ+М оказывают более быстрое цитостатическое воздействие на злокачественные глиомы головного мозга, что подтверждено интенсивным распадом остаточной ткани опухоли и высоким уровнем белка S100 после оперативного лечения, снижением после первого курса как уровня мелатонина, так и уровня белка S100. После второго курса АГХТ и ВАХТ+М отмечается повторный подъем уровня мелатонина и S100 белка, что можно расценивать как «вторая волна» антибластического воздействия. Признаков продолженного роста на МРТ и СКТ не выявлено, качество жизни больных 70–80 баллов по шкале Карновского.
Методика усиления эффективности химиотерапии приемом мелаксена (мелатонина) в дозе 18 мг/сутки (в 14.00 и в 20.00 по 9 мг) на протяжении 6 месяцев позволила увеличить общую и бессобытийную выживаемость больных и длительность безрецидивного периода.
Изучение уровня мелатонина в крови пациентов и 6-сульфатоксимела-тонина (6-СОМ) в их моче как диагностического и прогностического фактора у больных со злокачественными глиомами позволяет рассматривать данный метод как способ оценки эффективности проводимого лечения, прогнозирования выживаемости и длительности безрецидивного периода, уменьшает токсические побочные проявления неэффективной противоопухолевой терапии.
Нами разработан способ прогнозирования выживаемости больных с низкодифференцированными глиальными опухолями головного мозга. После этапов комплексного лечения нами исследованы как уровень содержания в сыворотке крови пациентов мелатонина методом ИФА, так и метаболита мелатонина 6-сульфатоксимелатонина (6-СОМ) в моче. При превышении нормальных величин в 20 раз и более прогнозируем гибель больных в ближайшие 2–3 месяца.
Результаты ретроспективного анализа показали следующее: при уровне 6-СОМ (6-сульфатоксимелатонин) 292,7 нмоль/мл – прогнозируют выживае-мость больных до 2,3±0,5 месяца, при уровне 6-СОМ 22,4 нмоль/мл – выживаемость более 12 месяцев, после химиотерапии при уровне 6-СОМ 268,2 нмоль/мл, прогнозируют выживаемость до 2,1±0,6 месяца, а при уровне 6-СОМ 32,8 нмоль/мл – более 12 месяцев. Через месяц после лечения при уровне 6-СОМ 479,3 нмоль/мл прогнозируют выживаемость 1,2±0,5 месяца, а при уровне 6-СОМ 37,4 нмоль/мл – выживаемость более 12 месяцев (p<0,01) (табл. 12).
Таблица 12
Содержание 6-СОМ в моче у больных с глиальными опухолями головного мозга
| Группы обследованных | Уровень 6-СОМ в моче, нмоль/мл |
| Здоровые доноры n=20 | 12,16±0,78 |
| После операции до комплексного лечения n=41 | 292,7±27,31,2 (n=12 умерли через 2,3±0,5 мес.) 22,4±2,21 (n=29 живы более 12 мес.) |
| После химиотерапии с положительным клиническим эффектом (n=20 живы более 12 мес.) | 32,8±3,11 |
| После химиотерапии с отрицательным клиническим эффектом (n=14 умерли через 2,1±0,6 мес) | 268,2±25,91,2 |
| Через месяц после лечения. Положительный клинический эффект (n=24 живы более 12 мес.) | 37,4±3,31, |
| Через месяц после лечения. Отрицательный клинический эффект (n=8 умерли через 1,2±0,5 мес) | 479,3±43,11,2 |
Примечание. 1 – достоверно относительно показателя здоровых доноров, p<0,01; 2 – достоверно относительно показателя с положительным эффектом p< 0,01.
В процессе лечения проводилась как оценка качества жизни пациентов исследуемых групп по шкале Карновского, так и качество функции равновесия. Нами изучены средние значения данных качества функции равновесия и показателя шкалы Карновского до начала лечения и после шести курсов химиотерапии в исследуемых и контрольной группах.
До начала лечения средние значения качества функции равновесия в 1 группе соответствовали 63,9%±0,2, среднее значение показателя Карновского составило 60%. После комплексного лечения качество функции равновесия улучшилось до 74,4±0,3, показатель Карновского – до 70% (табл. 13).
Таблица 13
Динамика качества функции равновесия и показателя Карновского
у больных ОГМ в процессе проведения химиотерапии
| Группа больных | Этап лечения | Качество функции равновесия, % | Показатель Карновского, % |
| 1 подгруппа (АГХТ) | До лечения | 63,9%±0,28 | 60 |
| После лечения | 74,4±0,31 | 70 | |
| 2 подгруппа (АГХТ+М) | До лечения | 62,5%±0,35 | 60 |
| После 6 курсов | 70,4%±0,38 | 70 | |
| 3 подгруппа (ВАХТ+ М) | До лечения | 63,2%±0,21 | 60 |
| После 6 курсов | 72,8%±0,26 | 70 |
Во 2 группе до начала лечения средние значения качества функции равновесия соответствовали 62,5%±0,3, среднее значение показателя Карновского составило также 60%. После комплексного лечения качество функции равновесия во 2 группе улучшилось до 70,4%±0,3, показатель Карновского – до 70%.
В 3 группе до начала лечения средние значения качества функции равновесия соответствовали 63,2%±0,2, среднее значение показателя Карновского составило также 60%. После шести курсов ВАХТ+М качество функции равновесия улучшилось до 72,8±0,2, показатель Карновского до 70%. Магнитно-резонансная томография головного мозга исключила наличие продолженного роста опухоли у всех больных этой группы.
Динамика изменений функции равновесия пациентов в процессе комплексного лечения в сравнении с данными шкалы Карновского показала, что исследование функции равновесия с помощью стабилометрии позволяет объективно и достоверно оценивать качество жизни больных. Качество функции равновесия, выраженное в процентах при исследовании «анализа векторов» смещения центра равновесия, соответствует в баллах качеству жизни по шкале Карновского.
Нами исследована динамика неспецифических адаптационных реакций в процессе проведения ВАХТ+М, АГХТ и АГХТ+М у больных злокачественными глиомами. Полученные результаты показывают, что методы лечения, основанные на введении цитостатиков на артериальной аутокрови, аутоплазме и венозной аутокрови не вызывают стрессорных реакций, функционально щадящие и несут биоадаптивный потенциал, тем самым, оказывая благоприятное воздействие на организм нейроонкологического больного.
Исходные значения уровня лимфоцитов были в пределах 22–24%, что соответствует реакция «тренировки». Идентификация адаптационных реакций у больных со злокачественными глиомами больших полушарий головного мозга перед началом проведения адъювантной химиотерапии на аутосредах выявила, что существенных межгрупповых отличий не наблюдалось и доминирующим типом реакции была реакция «тренировки». Учитывая, что диапазон колебаний лимфоцитов при развитии этой реакции составляет 21–27%, можно было судить о формировании реакции «тренировки» неполноценного типа, так как уровень лимфоцитов был в пределах нижних границ этой реакции – 23%, при повышенном содержании эозинофилов и моноцитов – критериев напряженности состояния (рис. 1).
После проведения I курса АГХТ+М и, особенно, ВАХТ+М наблюдалась позитивная динамика формирования устойчивой реакции тренировки с увеличением числа лимфоцитов до верхних границ зоны тренировки. При этом, показатели в 1 группе (АГХТ) оставались на прежнем уровне, приобретая стремительную положительную динамику после 2-го курса. Имеющееся опережение уровня содержания лимфоцитов при АГХТ свыше 28%, свидетельствовало о формировании реакции спокойной активации, которая отличается от реакции тренировки более значительным защитно-компенсаторным потенциалом. Это формирует активный путь повышения резистентности организма.
В течение последующих (с 3-го по 6-й) курсов адъювантной химиотерапии на аутосредах наблюдалась незначительная приграничная (между тренировкой и активацией) колебательная динамика лимфоцитов: от 27 до 29%. При этом, к окончанию лечения наиболее выгодную траекторию изменений демонстрируют показатели при АГХТ+М и ВАХТ+М, несколько снижаются показатели при АГХТ.

Рис. 1. Число лимфоцитов в динамике проводимого комплексного лечения
Сравнительная межгрупповая динамика признаков напряженности и неполноценности физиологических реакций (увеличение числа эозинофилов и моноцитов), указывает на заметное снижение содержания моноцитов и нормализацию уровня эозинофилов при ВАХТ+М, что характеризует данный вид лечения как наиболее сбалансированное антистрессорное воздействие на организм. АГХТ+М и АГХТ также способствуют формированию устойчивых антистрессорных реакций. Поддержание типов реакций тренировки и активации на протяжении всего периода лечения – 6–7 месяцев, обеспечивает более стойкий эффект повышения противоопухолевой резистентности и улучшает качество жизни онкологических больных.
После 1-го курса химиотерапии в группах АГХТ, АГХТ+М и ВАХТ отмечалось повышение содержания лимфоцитов до 26,8, 25,7 и 23,2%, что говорит об отсутствии реакции стресса (отсутствовало снижение уровня лимфоцитов менее 20%). После 2-го курса сохранялось дальнейшее развитие этой тенденции и развитие реакции «спокойной активации» (уровень лимфоцитов 28–33%), которая не менялась на протяжении оставшихся курсов химиотерапии (p<0,01).
Анализ полноценности развивающихся общих адаптационных реакций показал, что в случае применения АГХТ на протяжении всех курсов лечения отмечалась напряженность реакций по эозинофилам и моноцитам, отражающаяся в повышении процентного содержания их в формуле белой крови (рис. 2).
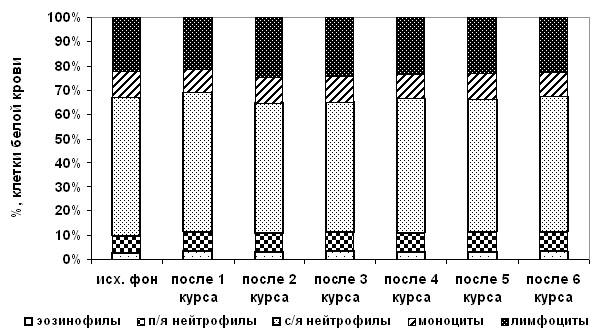
Рис. 2. Динамика изменений в формуле клеточных элементов белой крови
в группе с АГХТ
Аналогичная напряженность развившихся адаптационных реакций отмечена и в группе больных с применением АГХТ+М (рис. 3).
Динамика изменений клеточных элементов в формуле белой крови в группе больных с применением ВАХТ+М демонстрирует наличие напряженности развивающихся адаптационных реакций только по эозинофилам и только после 2–4 курсов лечения (p<0,01). В остальные сроки лечения развивались только полноценные антистрессорные адаптационные реакции (рис. 4).
Полученные результаты исследования динамики неспецифических адаптационных реакций в процессе проведения АГХТ, АГХТ+М и ВАХТ+М у больных злокачественными глиомами показывают, что методы лечения, основанные на введении цитостатиков на венозной аутокрови, венозной аутокрови, усиленные мелаксеном и артериальной аутокрови, усиленные мелаксеном, не вызывают стрессорных реакций, функционально щадящие и несут биоадаптивный потенциал, тем самым, оказывая благоприятное воздействие на организм нейроонкологического больного (p<0,01).
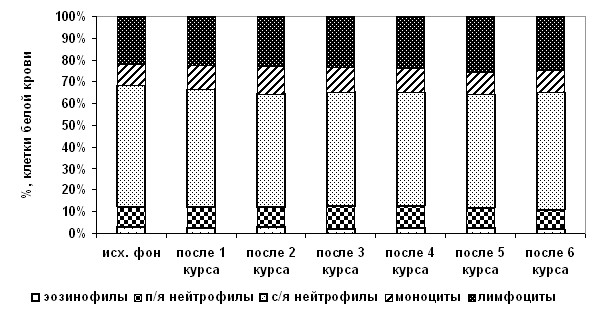
Рис. 3. Динамика изменений в формуле клеточных элементов белой крови
в группе больных с АГХТ+М.

Рис. 4. Динамика изменений в формуле кл. элементов белой крови в группе с ВАХТ+М
При анализе общей и бессобытийной выживаемости по Каплану-Майеру выявлено, что (рис. 5, 6) в контрольной группе у 8 больных отмечен продолженный рост опухоли в первые три месяца с момента окончания операции, в течение шести месяцев умерло еще 15 больных контрольной группы. Продолжительность их жизни не превысила 17 месяцев. Медиана выживаемости в контрольной группе была 9 месяцев.
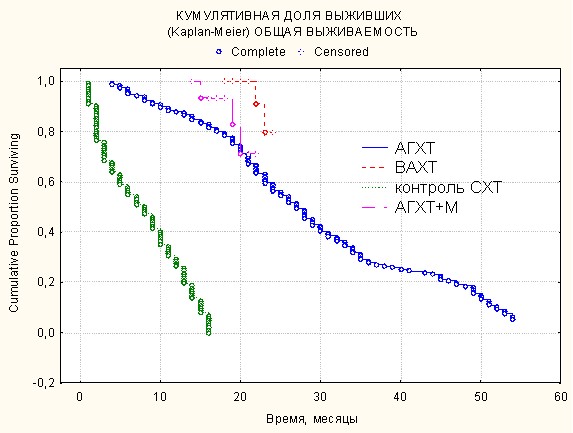
Рис. 5. Сравнение показателей общей выживаемости (оценка Каплана-Мейера)
в группах больных с использованием различных методов химиотерапии.
В 1-й подгруппе основной группы (АГХТ) через шесть месяцев с момента операции и начала комплексного лечения умерло 2 человека вследствие продолженного роста опухоли, за 10 месяцев – 10. До 24 месяцев безрецидивного периода прожили 79 человек. Медиана выживаемости составила 24 месяца.
Во 2-й подгруппе (АГХТ+М) продолженный рост опухоли – у 1 больного через 15 месяцев с момента операции и начала комплексного лечения, у 2-го больного продолженный рост – через 19,5 месяцев, что подтверждено на МРТ, а через 23,5 месяца у третьего больного – продолженный рост и гибель больного. Остальные больные – 13 человек живы в течение 12–18 мес.
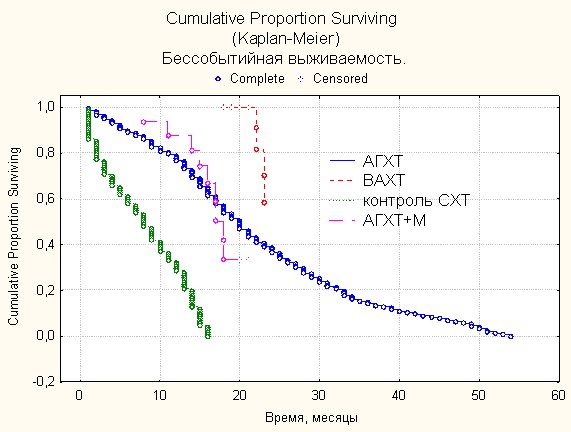
Рис. 6. Показатели бессобытийной выживаемости (оценка Каплана-Мейера)
в группах больных с использованием различных методов химиотерапии.
В 3-й подгруппе основной группы (ВАХТ+М) умерли 2 больных, первый больной умер через 22 месяца от начала лечения, вторая больная погибла через 24,5 месяца от начала комплексного лечения, оба – вследствие появления продолженного роста опухоли. Остальные 15 человек живы по настоящее время, т.е. в течение 13–16 мес.
Очевидно, что наилучшая выживаемость наблюдалась во второй и третьей подгруппах основной группы, в которых цитостатики больным вводили на аутокрови с усилением схемы мелаксеном.
Анализируя полученные результаты в целом, следует заключить, что применение химиотерапии на аутосредах в адъювантном режиме, особенно при сочетании с приемом мелаксена (мелатонина) в дозе 18 мг/сутки, позволяет значимо увеличить продолжительность безрецидивного периода и продлить жизнь больных со злокачественными глиомами головного мозга без ухудшения ее качества.
Методика внутриартериальной химиотерапии на аутологичных средах с использованием имплантируемой подкожно внутриартериальной порт-системы позволяет улучшить результаты комплексного лечения больных со злокачественными глиомами, с сохранением качества и продолжительности жизни данной группы больных. Общая и бессобытийная выживаемость у больных, получавших внутриартериальную химиотерапию и аутогемохимиотерапию, усиленные мелаксеном (мелатонином) в 2,5 раза превышает таковые показатели в контрольной группе (p<0,05).
ВЫВОДЫ
- Изучение динамики распространенности гистологических типов глиальных опухолей в территориях Ростовской области в зависимости от экологических условий жизни по данным планового поступления больных в ОЦНС РНИОИ, позволяет предполагать неблагополучную эколого-эпидемиологическую обстановку в указанных территориях и стремиться улучшать раннюю диагностику опухолевых поражений головного мозга разработанными способами.
- Разработанные и внедренные диагностическая карта для врачей поликлинического звена и анкета нейроонкологической настороженности для населения, способствуют раннему выявлению злокачественных глиальных опухолей головного мозга, поскольку формируют психологический императив, ведущий больного к специалисту для исключения нейроонкологической патологии.
- Компьютерная стабилометрия как метод скрининга в комплексе ранней диагностики глиальных опухолей способствует раннему выявлению опухолевых поражений головного мозга. При уменьшении величины девиации центра равновесия в сагиттальной плоскости в 1,27 и более раз и ее увеличении во фронтальной плоскости позволяет достоверно судить о наличии объемного образования головного мозга.
- Методика внутриартериальной химиотерапии на аутологичных средах с использованием имплантируемой подкожно внутриартериальной порт-системы позволяет достоверно улучшить результаты комплексного лечения больных со злокачественными глиомами, с сохранением качества и увеличением продолжительности жизни данной группы больных. Медиана выживаемости составила 28 месяцев.
- Методика усиления эффективности химиотерапии приемом мелаксена (мелатонина) в дозе 18 мг/сутки в течение 6 месяцев позволила достоверно увеличить продолжительность жизни данной группы больных и длительность их безрецидивного периода. Медиана выживаемости составила 26,5 и 28 месяцев.
- Изучение уровня мелатонина в крови пациентов и 6-сульфатокси-мелатонина (6-СОМ) в моче как диагностического и прогностического фактора у больных со злокачественными глиомами позволяет рассматривать данный метод как достоверный способ оценки эффективности проводимого лечения, прогнозирования выживаемости и длительности безрецидивного периода.
- Динамика изменений функции равновесия пациентов в процессе комплексного лечения в сравнении с данными шкалы Карновского показала, что исследование функции равновесия с помощью стабилометрии позволяет объективно и достоверно оценивать качество жизни больных. Качество функции равновесия, выраженное в процентах при исследовании «анализа векторов» смещения центра равновесия, соответствует в баллах качеству жизни по шкале Карновского.
- Результаты исследования динамики неспецифических адаптационных реакций в процессе проведения ВАХТ+М, АГХТ и АГХТ+М у больных злокачественными глиомами показывают, что методы лечения, основанные на введении цитостатиков на артериальной аутокрови, аутоплазме и венозной аутокрови достоверно не вызывают стрессорных реакций, функционально щадящие и несут биоадаптивный потенциал, тем самым, оказывая благоприятное воздействие на организм нейроонкологического больного.
Практические рекомендации
1. Диагностика злокачественных глиом с целью более раннего их выявления должна включать в себя компьютерную стабилометрию как скриннинговый метод, применимый на «Открытом приеме» и упорядочивающий поток больных на методы визуализации. Исследование функции равновесия с помощью стабилометрии после проведенного лечения позволяет объективно оценивать качество жизни больных.
2. Лечение больных с глиобластомой должно быть комплексным и включать в себя оперативное вмешательство с индивидуализацией радикализма, послеоперационную дистанционную гамматерапию с 10-х суток послеоперационного периода и последующие курсы адъювантной химиотерапии на аутологичных средах.
3. Химиотерапию на аутологичных средах при лечении больных со злокачественными глиомами целесообразно проводить с использованием имплантируемой подкожно внетриартериальной порт-системы «Селсайт».
4. Для улучшения результатов комплексного лечения, увеличения продолжительность жизни и длительности безрецидивного периода у больных со злокачественными глиомами головного мозга целесообразен прием мелаксена (мелатонина) в дозе 18 мг/сутки в течение полугода.
5. Для объективизации оценки эффективности проводимого лечения, прогнозирования выживаемости и длительности безрецидивного периода у больных со злокачественными глиомами, уменьшает токсические побочные проявления неэффективной противоопухолевой терапии, необходимо проводить исследование уровня мелатонина в крови пациентов и 6-сульфатоксимелатонина (6-СОМ) в их моче.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Балязин И.В. К вопросу о комбинированном лечении глиом / С.И. Джинджихашвили, Ю.Н. Коливашко, Е.Д. Быков, И.В. Балязин // Материалы IV съезда нейрохирургов России. – М., 18–22 июня 2006. – С. 163.
- Балязин И.В. Комбинированное лечение церебральных глиом / И.В. Балязин // Избранные вопросы неврологии, нейрохирургии и психиатрии. Издательство Саратовского медуниверситета. – 2007. – С. 18–20.
- Балязин И.В. Способ лечения больных с глиальными опухолями головного мозга / И.В. Балязин – Патент на изобретение №2310479. Бюл. № 32 от 20.11. 2007.
- Балязин И.В. Сопоставление данных СКТ головного мозга и изменений стато-кинетической функции в диагностике глиальных опухолей головного мозга / И.В. Балязин, О.Б. Кучеренко, М.А. Бедрик, Н.В. Тарасова // Известия ЮФУ. – 2008. – Вып. №5. – С. 150–153.
- Балязин И.В. Стабилометрия в функциональной схеме дифференциальной диагностики глиальных опухолей больших полушарий головного мозга / В.П. Омельченко, И.В. Балязин, А.А. Магомадов, Ф. Шарафетдин Карам // Известия ЮФУ. – 2008. – Вып. №6. – С. 173–174.
- Балязин И.В. Стабиография и субпопуляционный спектр крови убольных с глиальными опухолями больших полушарий головного мозга / И.В. Балязин, А.А. Магомадов, Н.Н. Шевченко, Ф. Шарафетдин Карам // Известия ЮФУ. – 2008. – Вып. №5. – С. 174–176.
- Балязин И.В. Ранняя диагностика опухолевых поражений головного мозга. Информационное письмо / С.В. Шлык, И.В. Балязин, А.А. Магомадов, И.Ю. Тринитатский. – 2008. – С.30.
- Балязин И.В. Функциональная схема диагностики опухолей головного мозга / И.В. Балязин, А.А. Магомадов // Актуальные вопросы неврологии и нейрохирургии. – Ростов-на-Дону, 2008. – С. 71.
- Балязин И.В. Ранняя диагностика глиальных опухолей больших полушарий головного мозга с использованием стабилографии / В.П. Омельченко, И.В. Балязин, А.А. Магомадов, Ф. Шарафетдин Карам // Актуальные вопросы неврологии и нейрохирургии. – Ростов-на-Дону, 2008. – С. 74.
- Балязин И.В. Стато-кинетические показатели больных с опухолями головного мозга и размеры опухолей / И.В. Балязин // Актуальные вопросы неврологии и нейрохирургии. – Ростов-на-Дону, 2008. – С. 75.
- Балязин И.В. Способ диагностики онкологических поражений головного мозга / И.В. Балязин, А.А. Магомадов – Патент на полезную модель № 71531. Бюл. № 8 от 20.03. 2008.
- Балязин И.В. Возможности комбинированного лечения неоперабельных опухолей головного мозга / С.В. Григоров, И.В. Балязин, С.Э Кавицкий, Д.О. Рябуха // Материалы V съезда нейрохирургов России. – Уфа, 2009. – С. 249.
- Балязин И.В. Использование внутриартериальной многокурсовой химиотерапии в комбинированном лечении злокачественных глиом / Ю.С. Сидоренко, И.В. Балязин, В.Е. Плотникова // Материалы V съезда нейрохирургов России. – Уфа, 2009. – С. 301.
- Балязин И.В. Компьютерная стабилометрия как метод скрининга в ранней диагностике опухолевых поражений головного мозга и способ объективизации качества жизни нейроонкологических больных / Ю.С. Сидоренко, И.В. Балязин, В.Е. Плотникова, А.А. Магомадов // Материалы V съезда нейрохирургов России. – Уфа, 2009. – С. 301.
- Балязин И.В. Локальная аутоплазмохимиотерапия злокачественных опухолей головного мозга / С.В. Григоров, И.В. Балязин, А.В. Емшанов // Российский нейрохирургический журнал им. проф. А.Л. Поленова. – СПб., 2010. – №1. –С. 42–44.
- Балязин И.В. Активность свободнорадикальных процессов в ткани перифокальной зоны опухолей мозга и метастазов рака различной локализации в головной мозг / Ю.С. Сидоренко, Е.М. Франциянц, И.В. Балязин, Е.Ф. Комарова, Ю.А. Погорелова, Н.Д. Черярина, Т.А. Горбунова // Нейрохирургия. – 2010. – №4. – С. 49–53.
- Балязин И.В. Эпидемиология, заболеваемость и смертность больных со злокачественными глиомами на территории Ростова и области / И.А. Сафонова, И.В. Балязин, В.С. Карнаухова // Известия Высших Учебных Заведений. Северо-Кавказский регион. Клиническая и экспериментальная онкология. Естественные науки. – 2010. Спецвыпуск. – С. 76–82.
- Балязин И.В. Способ прогнозирования выживаемости больных низкодифференцированными глиальными опухолями головного мозга / И.В. Балязин, Д.П. Атмачиди // Известия Высших Учебных Заведений Северо-Кавказский регион. Клиническая и экспериментальная онкология. Естественные науки. – 2010. Спецвыпуск. – С. 9–12.
- Балязин И.В. Стабилометрия в функциональной схеме дифференциальной диагностики глиальных опухолей больших полушарий головного мозга / И.В. Балязин // Известия Высших Учебных Заведений Северо-Кавказский регион. Клиническая и экспериментальная онкология. Естественные науки. – 2010. Спецвыпуск. – С. 13–16.
- Балязин И.В. Адаптационные реакции в динамике комплексного лечения больных со злокачественными глиомами больших полушарий головного мозга с использованием методов адъювантной химиотерапии на аутологичных средах / А.И. Шихлярова, Е.М. Франциянц, И.В. Балязин, О.В. Тарнопольская, В.П. Барсукова, Г.Я. Марьяновская, Д.П. Атмачиди, С.Э Кавицкий, Е.Ф. Комарова // Российский нейрохирургический журнал им. проф. А.Л. Поленова. – СПб., 2010. – №4. – С. 58–62.
- Балязин И.В. Способ прогнозирования выживаемости больных злокачественными глиальными опухолями головного мозга / Ю.С. Сидоренко, Е.М. Франциянц, С.В. Григоров, И.В. Балязин, Д.П. Атмачиди // Международный научно-практич. ж. Неврология и нейрохирургия в Белоруссии. – 2010. – №3(07). – С. 106–112.
- Балязин И.В. Компьютерная стабилометрия в оценке качества жизни пациентов со злокачественными глиомами при их комплексном лечении / Ю.С. Сидоренко, С.В. Григоров, И.В. Балязин // Международный научно-практич. ж. Неврология и нейрохирургия в Белоруссии. – 2010. – №4(08). – С. 17–23.
- Балязин И.В. Комплексное лечение больных со злокачественными глиомами больших полушарий головного мозга с использованием методов адъювантной химиотерапии на аутологичных средах / Ю.С. Сидоренко1, И.В. Балязин-Парфенов1, Е.М. Франциянц1, С.В. Григоров1, Е.Ф. Комарова1, О.В. Тарнопольская1, Д.П. Атмачиди1, С.Э. Кавицкий1, И.А. Сафонова2, Д.В. Кульбаченко2 // Кубанский научный медицинский вестник. – 2010. – №2 (125). – С. 148–151.

