Особенности формирования, прогрессирования и результаты длительной медикаментозной терапии хронической сердечной недостаточности у больных ибс, перенесших инфаркт миокарда, и у пациентов с хобл и хрон
На правах рукописи
Бакаев
Рихард Герасимович
«Особенности формирования,
прогрессирования и результаты длительной медикаментозной терапии хронической сердечной недостаточности у больных ИБС, перенесших инфаркт миокарда, и у пациентов с ХОБЛ и хроническим легочным сердцем»
14.01.05. – Кардиология
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Москва, 2010 г.
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Российский государственный медицинский университет Федерального агентства по здравоохранению
и социальному развитию»
Научный консультант:
доктор медицинских наук,
профессор Струтынский Андрей Владиславович
Официальные оппоненты:
Доктор медицинских наук,
профессор Сидоренко Борис Алексеевич
Доктор медицинских наук,
профессор Люсов Виктор Алексеевич
Доктор медицинских наук,
профессор Рябыкина Галина Владимировна
Ведущая организация:
Государственное образовательное учреждение высшего профессионального образования «Московский государственный медико-стоматологический университет»
Защита диссертации состоится «__»_________2010 г. в 14 часов на заседании диссертационного совета Д 208.072.08 при ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д. 1.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО РГМУ Росздрава по адресу: 117997, г. Москва, ул. Островитянова, д.1.
Автореферат разослан «___» ______________ 2010 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор А.К.Рылова
Общая характеристика работы
Актуальность проблемы: Хроническая сердечная недостаточность (ХСН) в настоящее время занимает одно из ведущих мест среди всех причин смерти в промышленно развитых странах, что подчеркивает большое медико-социальное и экономическое значение этой патологии [Сидоренко Б.А. с соавт., 2002; Беленков Ю.Н. с соавт., 2006; Арболишвили Г.Н., 2006; Оганов Р.Г. с соавт., 2008, 2009; Сторожаков Г.И. с соавт., 2008; Sutton G., 2000]. По данным эпидемиологических исследований в РФ этим заболеванием страдает 8,1 миллионов человек, из которых более 40% имеют терминальную стадию заболевания (III-IV ФК по NYHA) [Агеев Ф.Т. с соавт., 2004; Беленков Ю.Н. с соавт., 2006]. Прогноз у пациентов с ХСН крайне неблагоприятный. Средняя 5-летняя смертность больных с ХСН I-IV ФК остается высокой и составляет 59% у мужчин и 45% у женщин [Даниэлян М.О., 2001; Senni M., 1999; Levy D., 2002].
Наиболее частыми причинами ХСН являются ИБС, в том числе перенесенный инфаркт миокарда (ИМ), артериальная гипертензия (АГ), дилатационная кардиомиопатия, клапанные пороки сердца [Беленков Ю.Н. с соавт., 2006]. Вместе с тем, в последние годы повсеместно отмечается рост числа больных с декомпенсированным хроническим легочным сердцем (ХЛС), развившимся у пациентов с ХОБЛ. По данным Европейского респираторного общества ХОБЛ и декомпенсированное ХЛС занимает в настоящее время 4-5 место среди ведущих причин смерти [Чучалин А.Г., 2008; Vasan R.S., Levy D., 2000; GOLD, NHBI/WHO, 2003]. Примерно 2/3 больных ХОБЛ и ХЛС умирают в течение первых 5 лет после появления признаков декомпенсации кровообращения [Ребров А.П. с соавт., 2002; Кокосов А.Н., 2002; Чучалин А.Г., 2008; WHO, 2005].
Известно, что, независимо от этиологии сердечной недостаточности, в основе ее формирования и прогрессирования лежит сложный процесс структурно-геометрического и функционального ремоделирования левых и правых отделов сердца [Беленков Ю.Н., 2002; Люсов В.А., 2003; Сторожаков Г.И. с соавт., 2008; Pfeffer M.A., Willenheimer R., 2000; Tailor G.J., 2004], основную роль в развитии которого играет длительная гиперактивация нескольких нейроэндокринных систем, важнейшими из которых являются САС, РААС, тканевые РАС, эндотелиальная дисфункция, система провоспалительных цитокинов - ФНО, ИЛ-6, ИЛ-1 и др. [Беленков Ю.Н. с соавт., 2002; Васюк Ю.А. с соавт., 2003, 2006; Ройтберг Г.Е., Струтынский А.В., 2003]. Вместе с тем, непосредственные причины такой гиперактивации могут существенно отличаться у больных с различной этиологией ХСН, что и определяет важные особенности формирования и прогрессирования сердечной недостаточности, например у больных ИБС, перенесших ИМ, и у пациентов с ХОБЛ и декомпенсированным ХЛС [Беленков Ю.Н. с соавт., 2006].
В настоящее время процесс ремоделирования ЛЖ и формирования ХСН наиболее подробно изучен у больных, перенесших трансмуральный Q-образующий ИМ («Q-ИМ») [Белов Ю.В., Вараксин В.А., 2002; Бокерия Л.А., Бузиашвили Ю.И., 2002; Blaufarb I.S., Sonnenblick E.H., 1996; Blum A., Miller H. 1998; Faster V., Badimon L., Cohen M, et al., 1998; Bachetti T., 2000]. Вместе с тем, литературные сведения, касающиеся оценки постинфарктного и ишемического ремоделирования ЛЖ и возможного влияния этого процесса на ближайшие и отдаленные исходы заболевания у пациентов с «не-Q-ИМ», крайне скудны и противоречивы [Тамберелла М.Р., Уорнер Дж. Дж., 2000; Boden W.E. et al, 2003]. Между тем, в последние годы повсеместно отмечен рост заболеваемости именно этой формой ИМ, удельный вес которой достигает 50% и более от всех случаев ИМ [Ройтберг Г.Е., Струтынский А.В., 2003; Каллаева А.Н., 2005; Ventura S.J. et al., 1997; Тамберелла М.Р., Уорнер Дж. Дж., 2000]. Мало изучены общие закономерности формирования и прогрессирования ХСН у больных, перенесших «не-Q-ИМ», хотя все чаще встречаются сообщения, в которых подчеркивается, что отдаленный период «не-Q-ИМ» нередко отличается столь же высокой летальностью, частотой развития повторных нарушений коронарного кровотока, клинических проявлений ХСН и снижением физической активности больных, что и отдаленный период трансмурального Q-ИМ [Каллаева А.Н., 2005]. Тем не менее, прямые сопоставления тяжести течения постинфарктного периода и формирующейся ХСН у больных, перенесших трансмуральный и нетрансмуральный ИМ в современной литературе отсутствуют. Неясным остается вопрос, под действием каких факторов в одних случаях у больных с мелкоочаговым кардиосклерозом наблюдается вполне благоприятное течение ИБС, а в других быстро прогрессирует процесс ремоделирования сердца и формирования ХСН. Недостаточно изучены влияние на прогноз особенностей ЭПС, выраженности асинхронизма деполяризации ЛЖ и локализации постинфарктного рубца, наличия или отсутствие признаков гибернирующего миокарда и т.д.
Еще меньше изучены особенности процесса ремоделирования правых отделов сердца и формирования сердечной недостаточности у больных ХОБЛ и ХЛС, хотя по определению механизмы этих нарушений существенно отличаются от таковых у больных, перенесших ИМ [Беленков Ю.Н. с соавт., 2006; Чучалин А.Г., 2008; Сивцева А.И., 2009]. Недостаточно изучены факторы повышенного риска неблагоприятного течения заболевания, в частности взаимосвязь прогноза заболевания с выраженностью бронхообструктивного синдрома и ДН, а также с вовлечением в патологический процесс ЛЖ. Кроме того, отсутствуют сравнительные исследования роли повышенной активности системы провоспалительных цитокинов в прогрессировании процесса ремоделирования сердца и формировании ХСН у больных, перенесших ИМ, и у пациентов с ХОБЛ и ХЛС [Беленков Ю.Н. с соавт., 2002; Васюк Ю.А. с соавт., 2006; Корочкин И.М. с соавт., 2000; Кубышева Н.И. с соавт., 2007; Прибылов С.А., 2007].
Своевременная диагностика отдельных компонентов ремоделирования сердца и факторов, определяющих возникновение этих компонентов, имеет значение для разработки индивидуальных программ лечения и вторичной профилактики ХСН как у больных ИБС, перенесших ИМ, так и у пациентов с ХОБЛ и ХЛС [Национальные рекомендации ВНОК и ОССН по диагностике и лечению ХСН, 2007]. Между тем, несмотря на достигнутые в последние годы успехи в лечении больных ХСН, перенесших ИМ, связанные, прежде всего, с внедрением в широкую клиническую практику комплексной терапии нейрогормональными модуляторами [Сидоренко Б.А., 2001; Беленков Ю.Н. с соавт. 2006; Cleland JG et al. 2003; Fox KM.. 2003], многие проблемы длительного лечения этими препаратами до сих пор мало изучены. Так, не совсем ясен вопрос о сравнительной эффективности длительной терапии больных ХСН ингибиторами АПФ и блокаторами рецепторов к ангиотензину II (БРА), о целесообразности применения БРА у пациентов с начальными проявлениями ХСН и сохраненной систолической функцией ЛЖ [Pitt B, Poole-Wilson PA et al. t. 2000; Yusuf S, Pfeffer MA et al.. 2003] и об эффективности сочетанного применения БРА и -адреноблокаторов [Беленков Ю.Н. с соавт., 2006].
Кроме того, в сравнительном аспекте недостаточно изучено влияние селективных 1-адреноблокаторов или неселективного карведилола в сочетании с иАПФ на процесс постинфарктного ремоделирования ЛЖ и состояние интактного и гибернирующего миокарда у больных ХСН, перенесших различные формы ИМ [Каллаева А.Н., 2005; Gheorghiade M., Schultz L. et al., 1990; Bellenger N.G. et al., 2000].
Еще более сложной является проблема лечения больных ХОБЛ и декомпенсированным ХЛС. Несмотря на то, что эффективность лечебных мероприятий по прекращению или замедлению прогрессирования ХОБЛ и легочного сердца в полной мере зависит от возможности длительного лечения хронического воспаления дыхательных путей [Шмелев Е.И., 2002; Сивцева А.И., 2009], предупреждения процесса ремоделирования правых отделов сердца и снижения гиперактивации нейрогормональных систем организма [Дитятков А.Е. с соавт., 2001; GOLD, 2003], терапевтические подходы к медикаментозному лечению больных ХОБЛ и ХЛС до недавнего времени концентрировались главным образом на облегчении симптомов бронхообструктивного синдрома преимущественно с помощью бронходилататоров короткого действия, не обладающих прямым противовоспалительным действием и не влияющих на процесс ремоделирования ПЖ [Сивцева А.И., 2009].
В последние годы опубликовано лишь несколько сообщений [Балясинская Г.Л. с соавт., 2000; Венгеров Б.Б., 2000; Куницына Ю.Л., Шмелев Е.И., 2002; Чучалин А.Г., 2005; Шахурдина С.В., 2009], об эффективном применении у больных ХОБЛ и ХЛС нескольких современных препаратов, обладающих отчетливым противовоспалительным действием на слизистую дыхательных путей: высокоселективного агониста 2-адренорецепторов пролонгированного действия салметерола (серевента), комбинированного препарата серетида (салметерол + ингаляционный глюкокортикостероид флутиказон), а также фенспирида, которые оказывают положительное влияние на выраженность клинических симптомов заболевания и качество жизни больных, улучшение бронхиальной проходимости, значительное снижение частоты обострений заболевания [Венгеров Б.Б., 2000; Сивцева А.И., 2009] и, вероятно, увеличивают выживаемость больных ХОБЛ и ХЛС [Crockett AJ, 2001; Fishman A, 2003]. Тем не менее, опубликованные по этой проблеме работы ограничиваются лишь относительно кратковременным использованием этих препаратов (3-12 мес), а сведения о результатах длительного (более 1-2 лет) целенаправленного лечения салметеролом, серетидом и фенспиридом больных ХОБЛ и ХЛС представлены лишь в единичных исследованиях [Светайло И.П., 2005; Шахурдина С.В., 2009]. Мало того, до сих пор остается неясным, влияет ли прием этих препаратов на процесс ремоделирования правых и левых отделов сердца и формирование правожелудочковой сердечной недостаточности [Сивцева А.И., 2009].
Кроме того, в литературе до сих пор не решен вопрос о целесообразности длительного применения у больных ХОБЛ и ХЛС, в том числе у пациентов с компенсированным легочным сердцем, ингибиторов АПФ, поскольку в некоторых случаях существует риск ухудшения вентиляционно-перфузионных соотношений в легких, усугубления артериальной гипоксемии и активации механизмов гипоксической легочной вазоконстрикции [Ройтберг Г.Е., Струтынский А.В., 2005; Чучалин А.Г., 2008]. Лишь в единичных работах [Дягтерева с соавт., 2000; Сивцева А.И., 2009], результаты которых достаточно противоречивы, оценивалась эффективность лечения больных ХОБЛ и ХЛС ингибиторами АПФ нового поколения (периндоприлом, лизиноприлом и др.).
Наконец, мало изучен вопрос о клинической эффективности длительного применения у больных ХСН, перенесших ИМ, и у пациентов с ХОБЛ и ХЛС пентоксифиллина, обладающего отчетливым антицитокиновым действием [Васюк Ю.А., 2006; Fishman A. et al. 2003; Waag A., 1995; Feldman A., Young J. et al.. 1997; Torre-Amione G. 1999], и влиянии этого препарата на скорость прогрессирования отдельных признаков ХСН и уровень ФНО-, ИЛ-6 и других цитокинов [Беленков Ю.Н. с соавт., 2002; Корочкин И.М. с соавт., 2007].
Цель исследования: В сравнительном аспекте изучить основные закономерности процесса ремоделирования левых и правых отделов сердца и формирования и прогрессирования ХСН у больных, перенесших различные формы ИМ, и у пациентов с ХОБЛ и декомпенсированным ХЛС, оценить прогностическое значение некоторых факторов повышенного риска неблагоприятного течения заболевания и летальных исходов, а также разработать оптимальные схемы длительной комплексной медикаментозной терапии ХСН в зависимости от этиологии сердечной недостаточности.
Задачи исследования:
1. Изучить особенности формирования и прогрессирования ХСН и постинфарктного ремоделирования левых и правых отделов сердца у больных, перенесших различные формы ИМ (Q-образующий и не-Q-образующий ИМ).
2. Оценить прогностическое значение некоторых ФР и разработать оптимальный алгоритм прогноза неблагоприятного течения постинфарктного периода у больных ХСН, перенесших различные формы ИМ.
3. На основе анализа сегментарной электрической активности ЛЖ с использованием методики многополюсного ЭКГ-картирования сердца изучить особенности ЭПС у больных, перенесших Q-образующий и не-Q-образующий ИМ.
4. Оценить патогенетическое и прогностическое значение повышенной концентрации провоспалительных цитокинов (ФНО- и ИЛ-6) в сыворотке крови у больных, перенесших различные формы ИМ, и определить взаимосвязь концентрации цитокинов в крови с систолической и диастолической функцией ЛЖ и характером дальнейшего течения заболевания.
5. Сравнить клиническую эффективность длительного (на протяжении 2-х послеинфарктных лет) лечения больных ХСН, перенесших ИМ, иАПФ периндоприлом или БРА кандесартаном в сочетании с селективными 1-адреноблокаторами и оценить влияние терапии на процесс постинфарктного и ишемического ремоделирования ЛЖ и ПЖ, состояние ишемизированного и «интактного» миокарда и уровень провоспалительных цитокинов.
6. Оценить клиническую эффективность длительной терапии больных, перенесших ИМ, неселективным 1-, 1,2-адреноблокатором карведилолом или карведилолом и пентоксифиллином в сочетании с иАПФ периндоприлом.
7. На основании результатов длительного (в течение 2-х лет) наблюдения за больными ХОБЛ и ХЛС контрольной группы изучить общие закономерности прогрессирования ХЛС, процесса ремоделирования правых и левых отделов сердца и формирования правожелудочковой ХСН.
8. Оценить прогностическую ценность отдельных клинических и инструментальных признаков, ассоциированных с повышенным риском неблагоприятного течения заболевания, летальными исходами и прогрессированием правожелудочковой ХСН у больных ХОБЛ и ХЛС и разработать оптимальный алгоритм прогноза характера дальнейшего течения заболевания.
9. Оценить зависимость уровня ФНО- и ИЛ-6 от наличия обострений ХОБЛ, тяжести течения заболевания и выраженности ДН и ХСН и определить патогенетическое и прогностическое значение повышенной концентрации провоспалительных цитокинов у больных ХОБЛ и ХЛС контрольной группы.
10. Провести сравнительный анализ эффективности различных вариантов комплексной медикаментозной терапии больных ХОБЛ и ХЛС с использованием селективных 2-адреномиметиков пролонгированного действия (салметерола), противовоспалительных препаратов (фенспирида или ингаляционного ГКС флутиказона), иАПФ (периндоприла или лизиноприла) и пентоксифиллина.
11. В сравнительном аспекте оценить влияние длительной терапии бронхолитиками, противовоспалительными препаратами, иАПФ и пентоксифиллином на динамику показателей ФВД, эхокардиографические признаки ремоделирования правых и левых отделов сердца и концентрацию в крови провоспалительных цитокинов (ФНО- и ИЛ-6).
Научная новизна:
1. Впервые в сравнительном аспекте на протяжении 5 послеинфарктных лет изучены особенности формирования и прогрессирования ХСН и процесса ремоделирования левых и правых отделов сердца у больных, перенесших различные формы ИМ (Q-образующего и не-Q-образующего ИМ).
2. Впервые изучена зависимость характера дальнейшего течения заболевания (благоприятного или неблагоприятного) и скорости прогрессирования сердечной недостаточности у больных, перенесших различные формы ИМ, от степени структурно-функциональных изменений ЛЖ, выявляемых при первичном исследовании, локализации и распространенности постинфарктного рубца, выраженности ЭКГ-картографических признаков преходящей посленагрузочной ишемии, состояния жизнеспособного миокарда, а также от концентрации провоспалительных цитокинов (ФНО- и ИЛ-6) в плазме крови.
3. Впервые на основании результатов длительного (на протяжении 2-х лет) наблюдения за больными ХОБЛ и ХЛС контрольной группы изучены общие закономерности прогрессирования ХЛС, процесса ремоделирования правых и левых отделов сердца и формирования правожелудочковой ХСН, а также оценена прогностическая значимость отдельных клинико-лабораторных и инструментальных признаков, включая повышенный уровень провоспалительных цитокинов, ассоциированных с повышенным риском неблагоприятного течения заболевания, высокой частотой летальных исходов и быстрым прогрессированием сердечной недостаточности.
4. Впервые проведена сравнительная оценка эффективности различных вариантов длительного (на протяжении 2-х лет) лечения больных, перенесших ИМ, с использованием ингибитора АПФ периндоприла или блокатора рецепторов к АII кандесартана, селективных 1-адреноблокаторов или неселективного вазодилатирующего 1-, 1,2-адреноблокатора карведилола, а также пентоксифиллина и показано положительное влияние этих препаратов на процесс постинфарктного и ишемического ремоделирования ЛЖ и ПЖ, скорость прогрессирования ХСН и активность системы провоспалительных цитокинов. Продемонстрирован высокий антиишемический и антицитокиновый эффект комбинированного лечения периндоприлом, карведилолом и пентоксифиллином, способствующий замедлению процесса ремоделирования сердца, прогрессирования сердечной недостаточности и снижению летальности.
5. Впервые продемонстрированы существенные преимущества длительного лечения больных ХОБЛ и ХЛС 2-адреномиметиком пролонгированного действия салметеролом в сочетании с приемом ингибиторов АПФ (периндоприла и лизиноприла), противовоспалительной терапией фенспиридом (у пациентов с ХОБЛ I-II стадии) или ингаляционным ГКС флутиказоном (у больных ХОБЛ III-IV стадии), а также пентоксифиллином и оценено положительное влияние такого лечения на клинические проявления бронхообструктивного синдрома, скорость процесса ремоделирования ПЖ и ЛЖ, прогрессирование правожелудочковой сердечной недостаточности, а также на уровень провоспалительных цитокинов.
Практическая значимость
1. На основании динамического наблюдения за больными ХСН, перенесшими различные формы ИМ, разработан алгоритм ориентировочного прогноза неблагоприятного дальнейшего течения заболевания, характеризующегося быстрым прогрессированием ХСН, частым возникновением повторных ИМ и высоким риском летальных исходов, основанный на клинических данных, результатах оценки шкалы ШОКС, теста 6-минутной ходьбы, данных ХМ ЭКГ и некоторых ЭхоКГ-изменениях, а также результатах анализа сегментарной электрической активности ЛЖ и значениях концентрации провоспалительных цитокинов ФНО- и ИЛ-6 в плазме крови. Вероятность правильного прогноза у больных ХСН, перенесших различные формы ИМ, достигает 80-85%.
2. На основе модифицированной методики многополюсного ЭКГ-картирования сердца впервые разработан способ анализа сегментарной электрической активности ЛЖ, который у больных, перенесших ИМ, позволяет точно оценивать локализацию и распространенность постинфарктного рубца, определять признаки компенсаторной гиперфункции отдельных сегментов ЛЖ, выявлять преходящую посленагрузочную ишемию миокарда и феномен «электрической гибернации» сегментов, косвенно отражающий наличие жизнеспособного (гибернирующего) миокарда, а также оценивать степень асинхронизма возбуждения сегментов ЛЖ, что может быть использовано в качестве дополнительных критериев прогноза неблагоприятного течения заболевания у больных ХСН, перенесших ИМ.
3. Доказано, что количественная оценка тяжести течения ХОБЛ и индивидуальных значений показателя ОФВ1, вместе с выявлением эхокардиографических признаков структурно-функциональных нарушений правых отделов сердца (в виде увеличения размеров ПЖ и ПП, повышения давления в ЛА или/и наличия парадоксального диастолического движения МЖП или трикуспидальной регургитации II-III степени) и оценкой некоторых клинических и электрокардиографических данных позволяет выделить группу больных ХОБЛ и ХЛС с повышенным риском дальнейшего неблагоприятного течения заболевания, характеризующегося быстрым прогрессированием ДН и правожелудочковой сердечной недостаточности и высокой частотой внеплановых госпитализаций и летальных исходов. Вероятность правильного прогноза достигает 80%.
4. Доказаны преимущества длительного (на протяжении 2-х лет) лечения больных, перенесших различные формы ИМ, ингибитором АПФ периндоприлом, неселективным вазодилатирующим 1-, 1,2-адреноблокатором карведилолом и пентоксифиллином, применение которых оказывает максимальное положительное действие на процесс постинфарктного и ишемического ремоделирования ЛЖ, приостанавливая процесс дальнейшего прогрессирования ХСН, снижая летальность, число повторных ИМ и частоту достижения комбинированной конечной точки, что во многом связано с выраженным антиишемическим действием карведилола и периндоприла, способствующих восстановлению функции жизнеспособного миокарда, ограничению активности нейрогормональных систем и провоспалительных цитокинов и улучшению коронарного кровотока.
5. Разработана оптимальная методика длительного комплексного медикаментозного лечения больных ХОБЛ и ХЛС, включающая иАПФ (периндоприл или лизиноприл), высокоселективный 2-адреномиметик пролонгированного действия салметерол (серевент) и противовоспалительные препараты: фенспирид (у больных ХОБЛ I-II стадии и компенсированным ХЛС) или ингаляционный ГКС флутиказон (у пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС). Доказано, что систематическое применение комбинированной терапии сопровождается наиболее выраженным бронхолитическим и противовоспалительным эффектом и не только способствует уменьшению клинических признаков бронхообструктивного синдрома и ДН и улучшению показателей ФВД, но и оказывает положительное действие на процесс ремоделирования правых и левых отделов сердца, замедляет формирование и прогрессирование сердечной недостаточности и способствует небольшому снижению летальности пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС.
Положения, выносимые на защиту
1. Независимо от формы перенесенного ИМ (крупно- или мелкоочаговой), у значительной части больных ХСН контрольной группы на протяжении 5 послеинфарктных лет наблюдается неуклонное прогрессирование сердечной и коронарной недостаточности, снижение толерантности к физической нагрузке, высокая частота повторных ИМ (31-36%) и летальных исходов (34-36%). Эти изменения ассоциируются с прогрессированием признаков постинфарктного и ишемического ремоделирования ЛЖ: увеличением систолического МС, ММЛЖ, сферизацией желудочка, расширением его полости и формированием умеренной систолической и выраженной диастолической дисфункции ЛЖ и ПЖ. На протяжении первых 2-х послеинфарктных лет летальные исходы, случаи выявления тяжелой ХСН III-IV ФК, снижения толерантности к физической нагрузке, а также диастолической и систолической дисфункции ЛЖ чаще наблюдаются у больных, перенесших «Q-ИМ», тогда как частота приступов стенокардии и число повторных ИМ выше у больных, перенесших «не-Q-ИМ». К концу 2-3-го года после ИМ разница в частоте выявления этих признаков у больных обеих подгрупп резко уменьшается, а к концу 4-5-го года наблюдения полностью нивелируется.
2. У больных ХСН, перенесших ИМ, быстрое прогрессирование ХСН, частое возникновение повторных ИМ и высокий риск летальных исходов, независимо от формы перенесенного ИМ (крупно- или мелкоочагового), ассоциированы с локализацией инфаркта или преходящей посленагрузочной ишемии миокарда в передней стенке ЛЖ, с отсутствием или малой выраженностью признаков «электрической гибернации» в сегментах, непосредственно граничащих с рубцовой зоной, и увеличением асинхронизма возбуждения сегментов передней стенки. Важными факторами, определяющими неблагоприятный прогноз заболевания, являются также III-IV ФК ХСН или ФВлж меньше 45%, выявляемые в первые 1-2 месяца после инфаркта, возраст больных старше 70 лет, наличие сопутствующих СД или АГ III степени, а также результаты оценки шкалы ШОКС, теста 6-минутной ходьбы, данных ХМ ЭКГ, и повышенная концентрация провоспалительных цитокинов в крови. Вероятность правильного прогноза с учетом приведенных признаков достигает 80-85%.
3. Высокий риск прогрессирования правожелудочковой ХСН и летальных исходов у больных ХОБЛ и ХЛС ассоциирован с наличием при первичном обследовании признаков выраженного бронхообструктивного синдрома и ДН, снижением ОФВ1 ниже 50%, увеличением СрДЛА > 24 мм рт. ст., возрастом больных старше 60 лет, а также с клиническими и ЭхоКГ-признаками систолической и диастолической дисфункции ПЖ, наличием эксцентрической ГПЖ и/или полной БПНПГ и повышенным уровнем провоспалительных цитокинов (ФНО- и ИЛ-6). Положительная предсказательная ценность перечисленных критериев неблагоприятного прогноза достигает 73-90%.
4. Всем больным ХСН, перенесшим ИМ, независимо от его формы (крупно- или мелкоочаговой) показано длительное медикаментозное лечение иАПФ или БРА в сочетании с блокаторами адренергических рецепторов. Наибольшим клиническим эффектом обладает сочетанное применение иАПФ (например, периндоприла) и вазодилатирующего 1-1,2-адреноблокатора карведилола, длительное применение которых оказывает максимальное положительное влияние на процессы постинфарктного ремоделирования ЛЖ и ПЖ и прогноз заболевания и отличается более выраженным антиишемическим эффектом по сравнению с терапией иАПФ или БРА и селективными 1-адреноблокаторами, что способствует достоверному уменьшению риска неблагоприятного течения заболевания и снижению летальности.
5. У больных ХОБЛ III-IV стадии и декомпенсированным ХЛС наибольшим клиническим эффектом обладает длительная медикаментозная терапия иАПФ (периндоприлом или лизиноприлом) и комбинированным препаратом серетидом, которая обеспечивает максимальный бронходилатационный и противовоспалительный эффект, способствует уменьшению признаков ДН, снижению СрДЛА, скорости дальнейшего прогрессирования процесса ремоделирования ПЖ и ЛЖ и клинических признаков ХСН и сопровождается снижением общей летальности и частоты достижения 2-й комбинированной конечной точки на 28-25% по сравнению с контрольной группой. У больных ХОБЛ I-II стадии и компенсированным ХЛС показана длительная терапия иАПФ в сочетании с селективным 2-адреномиметиком пролонгированного действия салметеролом и противовоспалительным препаратом фенспиридом, применение которых приостанавливает процесс ремоделирования сердца и препятствует появлению первых признаков правожелудочковой ХСН.
6. У больных ХСН, у которых определяется повышенный уровень провоспалительных цитокинов (ФНО- >10 пг/мл и ИЛ-6 >12,0 пг/мл), в первую очередь у пациентов с ХОБЛ и ХЛС (независимо от стадии заболевания) и у пациентов, перенесших ИМ и имеющих признаки ХСН III-IV ФК по NYHA, дополнительное назначение пентоксифиллина в дозе 800 мг в сутки, обладающего выраженным антицитокиновым действием, способствует заметному улучшению качества жизни и еще большему уменьшению клинических симптомов ДН и ХСН, снижению давления в ЛА и улучшению диастолической функции ПЖ и ЛЖ, но не влияет на летальность больных и частоту достижения ими комбинированных конечных точек.
Внедрение в практику
Полученные результаты внедрены в практику лечебно-диагностической работы терапевтических отделений ГКБ №31 г. Москвы, ГЛПУ «Поликлиника 209» г. Москвы и в практику научной и учебной деятельности кафедры пропедевтики внутренних болезней лечебного факультета ГОУ ВПО «РГМУ Росздрава».
Апробация диссертации
Результаты работы доложены и обсуждены на объединенной научно-практической конференции сотрудников кафедры пропедевтики внутренних болезней лечебного факультета РГМУ, и сотрудников терапевтических отделений ГКБ № 31 9 апреля 2010 г. Материалы исследования были доложены также на Всероссийской конференции с международным участием «Факторы риска, адаптация, первичная и вторичная профилактика хронических неинфекционных заболеваний» (г. Иваново, 2001), на Всероссийской ежегодной научной конференции «Спорные и нерешенные вопросы сердечной недостаточности» (М., 2003), на международной научно-практической конференции, посвященной памяти Маймонида (М., 2005), на Российском национальном конгрессе кардиологов и конгрессе кардиологов стран СНГ (М., 2007), на 1Х Всероссийском конгрессе Российского общества холтеровского мониторирования и неинвазивной электрокардиологии (РОХМИНЭ) «Неинвазивная электрокардиология в клинической медицине» (М., 2008), на научно-практической конференции, посвящённой 40-летию ГКБ №31 г. Москвы. (М., 2010).
Публикации
Всего по теме диссертации опубликована 31 печатная работа, в том числе 18 – в журналах, рекомендованных ВАК РФ.
Структура и объем работы
Диссертация состоит из введения, 7-ти глав, выводов, практических рекомендаций и списка литературы. Текст изложен на 368 страницах машинописи, иллюстрирован 25 рисунками и 134 таблицами. Список литературы содержит 471 российских и иностранных источников.
Содержание работы
Материал и методы исследования и лечения
В основу работы положены результаты длительного динамического клинико-инструментального наблюдения за 459 больными ХСН различной этиологии.
Исследование состояло из двух этапов. На первом этапе изучали основные закономерности формирования и прогрессирования ХСН и процесса ремоделирования левых и правых отделов сердца у 276 больных ИБС, перенесших различные формы ИМ (Q-образующего и не-Q-образующего ИМ), а также эффективность различных способов дифференцированной медикаментозной терапии сердечной недостаточности. «Q-ИМ» перенесли 130 чел., «не-Q-ИМ» - 146. Во всех случаях диагноз ИБС и перенесенного ИМ подтверждался документированными анамнестическими и клиническими данными, а также результатами ЭКГ- и ЭхоКГ-исследования. Диагноз ХСН ставился в соответствии с Национальными рекомендациями ВНОК/ОССН по диагностике и лечению ХСН 2006 г.
Критерии включения: 1) перенесенный за 1-2,5 месяца до включения в исследование первичный ИМ; 2) наличие у больных клинических и инструментальных признаков ХСН I-IV ФК по NYHА; 3) возраст от 45 до 75 лет; 4) наличие информированного согласия на продолжение исследования.
Критерии исключения: 1) повторный ИМ; 2) мозговой инсульт, перенесенный менее 6 месяцев назад; 3) тяжелые обструктивные заболевания легких с прогрессирующей ДН; 4) наличие органических поражений клапанов и врожденных заболеваний сердца, ГКМП, ДКМП или РКМП; 5) сахарный диабет I типа; 6) отказ больных от продолжения исследования и лечения после первичного обследования.
В зависимости от характера дальнейшей медикаментозной терапии, назначаемой после первичного обследования, все больные были разделены на 5 групп: больным 1-й (основной) группы (48 человек) в составе комплексной терапии назначался иАПФ периндоприл и один из селективных 1-адреноблокаторов; больным 2-й основной группы (40 человек) – БРА кандесартан в сочетании с одним из селективных 1-адреноблокаторов; больным 3-й основной группы (50 человек) назначали иАПФ периндоприл и неселективный 1-1,2-адреноблокатор карведилол; больным 4-й основной группы (28 человек) назначали иАПФ периндоприл и карведилол в сочетании с пентоксифиллином (тренталом).
Контрольную группу составили 110 больных ХСН (52 пациента, перенесших «Q-ИМ» и 58 больных - «не-Q-ИМ»), которые по разным причинам, не зависящим от исследователей, не получали адекватного лечения современными ЛС, отказываясь от систематического лечения нейрогормональными препаратами и предпочитая «лечиться самостоятельно».
Таблица 1.
Сравнительная клиническая характеристика больных ХСН, перенесших ИМ
Признаки | Контроль n=110 | 1-я группа n=48 | 2-я группа n=40 | 3-я группа n=50 | 4-я группа n=28 |
| Мужчины | 87 (79,1%) | 34(70,8%) | 31(77,5%) | 37 (74%) | 23 (82,1%) |
| Женщины | 23 (20,9%) | 14(29,2%) | 9 (22,5%) | 13 (26%) | 5 (17,9%) |
| Ср. возраст, лет | 64,6±3,0 | 65,2±3,6 | 64,5±3,2 | 66,4±3,5 | 67,2±3,7 |
| «Q-ИМ» | 52 (47,3%) | 22(45,8%) | 18(45,0%) | 24 (48%) | 14 (50,0%) |
| «Не-Q-ИМ» | 58 (52,7%) | 26(54,2%) | 22(55,0%) | 26 (52%) | 14 (50,0%) |
| Передний ИМ | 64 (58,2%) | 26(54,2%) | 17(42,5%) | 25 (50%) | 12 (42,9%) |
| Задний ИМ | 46 (41,8%) | 22(45,8%) | 23(57,5%) | 25 (50%) | 16 (57,1%) |
| Ср. длит-ть ИБС, лет | 6,9±2,3 | 6,2±2,4 | 7,0±1,6 | 6,3±1,4 | 7,4±1,5 |
| До ИМ ХСН I-II ФК | 13 (11,8%) | 6 (12,5%) | 5 (12,5%) | 5 (10%) | 3 (10,7%) |
| До ИМ ХСН III-IV ФК | 7 (6,4%) | 4 (8,3%) | 3 (7,5%) | 4 (8%) | 2 (7,1%) |
| АГ (всего) | 47 (42,7%) | 18(37,5%) | 16(40,0%) | 18 (36%) | 12 (42,9%) |
| СД II типа | 16 (14,5%) | 6 (12,5%) | 4 (10,0%) | 6 (12%) | 4 (14,3%) |
| Абдомин. ожирение | 44 (40,0%) | 17(35,4%) | 13(32,5%) | 19 (38%) | 11 (39,3%) |
| ОХС >6,2 ммоль/л | 54 (49,1%) | 21 43,7%) | 17(42,5%) | 23 (46%) | 12 (42,9%) |
| Инсульт в анамнезе | 7 (6,4%) | 2 (4,2%) | 2 (5,0%) | 2 (4%) | 2 (7,1%) |
| Атерос-з сос/н/кон. | 5 (4,5%) | 1 (2,1%) | 1 (2,5%) | 2 (4%) | 1 (3,6%) |
| Атерокальциноз аорты | 18 (16,4%) | 10(20,8%) | 7 (17,5%) | 8 (16%) | 4 (14,3%) |
| ПМК | 19 (17,3%) | 10(20,8%) | 9 (22,5%) | 12 (24%) | 7 (25,0%) |
| Аритмии | 34 (30,9%) | 16(33,3%) | 11(27,5%) | 17 (34%) | 10 (35,7%) |
| ФП | 12 (10,9%) | 4 (8,3%) | 5 (12,5%) | 5 (10%) | 3 (10,7%) |
| Блокады | 9 (8,2%) | 3 (6,25%) | 2 (5,0%) | 3 (6%) | 1 (3,6%) |
Примечание: разница всех показателей между группами статистически недостоверна (р >0,05)
По основным клиническим характеристикам больные 5 групп практически не отличались друг от друга (табл. 1).
На втором этапе исследования изучали основные закономерности формирования и прогрессирования ХСН у 183 больных ХОБЛ и ХЛС, а также эффективность длительной (на протяжении 2-х лет) дифференцированной медикаментозной терапии этих больных. Основными критериями включения больных в эту часть исследования явилось [GOLD, 2003; Чучалин А.Г., 2008]: 1) наличие достоверных клинических и инструментальных признаков ХОБЛ; 2) ОФВ1/ФЖЕЛ меньше 70% от должных величин; 3) наличие клинических и ЭхоКГ-признаков ХЛС; 4) информированное согласие пациента. Тяжесть течения заболевания оценивалась по классификации GOLD, пересмотра 2003 г. Критериями диагностики ХЛС являлись: 1) oбщепринятые клинические и инструментальные признаки ГПЖ и/или расширения полости ПЖ [GOLD, 2003]; 2) ЭхоКГ-признаки повышения СрДЛА >20 мм рт.ст.; 3) клинические признаки «застоя» в большом круге кровообращения; 4) ЭхоКГ-признаки систолической дисфункции ПЖ. В каждом конкретном случае клинико-инструментальная диагностика ХЛС основывалась на выявлении 2-х и более критериев, описанных выше.
Критериями исключения пациентов из исследования явились: 1) бронхиальная астма с частыми приступами удушья; 2) наличие сопутствующей тяжелой АГ. 3) мозговой инсульт, перенесенный менее 6-ти месяцев назад; 4) сопутствующее органическое поражение клапанов; 5) миокардит, перикардит или кардиомиопатии; 6) отказ больного от продолжения исследования.
Все больные были разделены на 4 группы. Больные 1-й группы (46 человек) в составе комплексной терапии регулярно получали высокоселективный 2-адреномиметик пролонгированного действия салметерол (серевент фирмы Glaxo Wellcome, Великобритания) в дозе 50 мкг 2 раза в сутки, а также противовоспалительные препараты: фенспирид (эреспал фирмы Servier, Франция) в дозе 80 мг 2 раза в день (пациенты с ХОБЛ I-II стадии и компенсированным ХЛС) или ингаляционный ГКС флутиказон (в составе комбинированного препарата серетида фирмы Glaxo Wellcome) в дозе 250 мкг 2 раза в сутки (больные ХОБЛ III-IV стадии и декомпенсированным ХЛС). Больные 2-й группы (50 человек) лечились комбинацией из 3-х препаратов: бронхолитика салметерола, противоспалительных препаратов (фенспирида или флутиказона), а также ингибитора АПФ – периндоприла (престариума фирмы Servier, Франция) в дозе 4 мг в сутки или лизиноприла (диротона фирмы Gedeon Richter, Венгрия) в дозе 10 мг 1 раз утром.
Пациенты 3-й группы (42 человека) в составе комплексной терапии получали выше описанную комбинацию салметерола и противовоспалительных препаратов (фенспирида или флутиказона) в сочетании с иАПФ (периндоприлом или лизиноприлом), а также дополнительно - пентоксифиллин (трентал фирмы Sanofi Aventis) в дозе 400 мг 2 раза в день. Трентал назначался курсами по 4-6 недель с перерывом 2 недели. При необходимости все больные периодически, особенно в начале исследования, дополнительно получали селективные 2-симпатомиметики короткого действия, М-холинолитики (атровент) или теопэк, а в период обострения заболевания – антибиотики и муколитические средства, а пациенты с декомпенсированным ХЛС - мочегонные средства и сердечные гликозиды.
В контрольную группу включены 45 больных ХОБЛ и ХЛС, лечение которых по разным причинам, не зависящим от исследователей, не включало длительного регулярного приема салметерола, флутиказона, фенспирида и/или ингибиторов АПФ, а также пентоксифиллина.
По основным клиническим характеристикам в момент первичного обследования больные всех 4-х групп мало отличались друг от друга (табл. 2).
Длительность наблюдения больных ХСН, перенесших ИМ, контрольной группы составила 5 лет, а остальных пациентов, в том числе больных ХОБЛ и ХЛС, - 2 года. У всех обследованных больных оценивалась частота достижения нескольких конечных точек: летального исхода, внеплановой госпитализации в связи с повторным ИМ, обострением ХОБЛ или усугублением признаков ХСН, а также комбинированных конечных точек (летальный исход или/и внеплановая госпитализация). Тяжесть клинических проявлений ХСН у больных, перенесших ИМ, оценивали с использованием шкалы ШОКС [Мареев В.Ю., 2004], а клинической симптоматики ХОБЛ - по бальной системе, предложенной Е.И.Шмелевым (2002).
Таблица 2.
Сравнительная клиническая характеристика больных ХОБЛ и ХЛС
| Клинические признаки, факторы риска и сопутствующие заболевания и синдромы | Больные ХОБЛ и ХЛС | |||
| Контроль n=45 | 1-я группа n=46 | 2-я группа n=50 | 3-я группа n=42 | |
| 1 | 2 | 3 | 4 | |
| Средний возраст, лет | 58,8±2,4 | 57,4±2,5 | 59,7±2,5 | 60,6±3,2 |
| Средняя длит-ть ХОБЛ,лет | 12,2±2,2 | 11,3±2,6 | 10,9±2,7 | 12,1±3,2 |
| ХОБЛ I-II стадии | 23 (51,1%) | 23 (50,0%) | 26 (52,0%) | 19 (45,2%) |
| ХОБЛ III-IV стадии | 22 (48,9%) | 23 (50,0%) | 24 (48,0%) | 23 (54,8%) |
| Ср. кол-во обостр. в год | 2,36±0,15 | 2,24±0,17 | 2,28±0,23 | 2,21±0,21 |
| Затяжное течение обострен. | 21 (46,7%) | 22 (47,8%) | 22 (44,0%) | 17 (40,5%) |
| Курение | 30 (66,7%) | 29 (63,0%) | 32 (64,0%) | 26 (61,9%) |
| АГ | 10 (22,2%) | 10 (21,7%) | 9 (18,0%) | 10 (23,8%) |
| ИБС | 7 (15,5%) | 8 (17,4%) | 7 (14,0%) | 7 (16,7%) |
| Аритмии (всего) | 14 (31,1%) | 13 (28,3%) | 14 (28,0%) | 10 (23,8%) |
| Фибрилляция предсердий | 4 (8,9%) | 3 (6,5%) | 3 (6,0%) | 2 (4,8%) |
| Желудочковая ЭС | 5 (11,1%) | 4 (8,7%) | 4 (8,0%) | 3 (7,1%) |
| БПНПГ | 17 (37,8%) | 16 (34,8%) | 17 (34,0%) | 13 (30,9%) |
| СрДЛА, мм рт.ст. | 25,2±2,3 | 24,5±2,8 | 24,4±2,3 | 25,6±2,3 |
| ЖЕЛ | 64,2±2,6 | 67,3±2,7 | 67,0±3,1 | 66,8±2,8 |
| ОФВ1 | 49,7±2,8 | 50,5±3,3 | 48,2±2,7 | 48,7±2,6 |
| ОФВ1/ЖЕЛ | 59,5±3,2 | 59,1±3,5 | 53,6±3,0 | 54,7±2,7 |
| СОС 25-75 | 31,9±2,5 | 36,3±3,6 | 34,7±3,3 | 32,3±2,9 |
| ПОС выд | 48,8±3,0 | 49,9±3,5 | 49,4±3,0 | 49,8±3,4 |
Примечание: Разница всех показателей 4-х групп статистически
недостоверна (р >0,05).
В работе использовалась стандартная методика ЭхоКГ-исследования на аппаратах «Acuson-128 XP» (США) и Sonoage 4800 (Ю.Корея) с определением общепринятых показателей, характеризующих систолическую и диастолическую функцию ЛЖ и ПЖ [Рыбакова М.К., Алехин М.Н., Митьков В.В., 2008; Струтынский А.В., 2008 и др.], а также СрДЛА по методике A. Kitabatake. Суточное мониторирование ЭКГ по Холтеру проводили на приборе «Schiller CS-100» по общепринятой методике [Аронов Д.М., Лупанов В.П., 2003]. Толерантность к физической нагрузке определяли по результатам теста 6-минутной ходьбы и на велоэргометре фирмы «Schiller CH-6340 BAAR»(Швейцария). Исследование ФВД у больных ХОБЛ и ХЛС проводили на компьютерном спирографе «Master Sereen» фирмы Erich Jaeger (Германия) с автоматическим определением основных параметров кривой зависимости «поток/объем» и расчетом общепринятых показателей ФВД. Для определения обратимости бронхиальной обструкции у больных ХОБЛ использовали бронходилатационный тест с сальбутамолом. Многополюсное автоматическое ЭКГ-картирование сердца выполнялась на аппарате PREDICTOR BSM-32 (США). У части больных ХСН, перенесших ИМ, проводилась селективная КАГ по Сельдингеру и нагрузочная сцинтиграфия миокарда с 201Тl. Количественное определение провоспалительных цитокинов (ФНО- и ИЛ-6) в плазме крови определяли методом твердофазного иммуноферментного анализа на спектрофотометре типа Multiskan (ThermoLabSystems, Германия) с использованием реактивов BioSourse.
Статистическая обработка полученных результатов производилась в программной среде Microsoft Excel (2003) и включала в себя определение средних значений параметров (М), среднего квадратичного отклонения (±), ошибки средней (±m), критерия Стьюдента (t), коэффициента достоверности отличий групп (р <0,05) и коэффициента парной корреляции (r).
Результаты исследования
- Основные закономерности прогрессирования ХСН у больных, перенесших Q-образующий и не-Q-образующий ИМ
Основные закономерности прогрессирования ХСН и ИБС после перенесенного ИМ были изучены нами у 110 больных ХСН контрольной группы, из которых 52 пациента перенесли «Q-ИМ» и 58 - «не-Q-ИМ».
Рис. 1. Летальность(%) Рис. 2. Повторные ИМ (%) Рис. 3. Длит-ть ишемии (ХМ)
В течение первого послеинфарктного года недостоверно (р >0,1) преобладала летальность больных, перенесших «Q-ИМ», однако уже через 2 года число умерших в обеих подгруппах выравнивалось, а на протяжении 4-5-го года летальность больных, перенесших «не-Q-ИМ», даже несколько превышала таковую у пациентов с крупноочаговым ПИКС (рис. 1). Существенной разницы в общей 5-летней летальности и причинах смерти больных обеих подгрупп выявлено не было (36,5% и 34,5%), хотя повторные ИМ как причина смерти преобладали в подгруппе больных, перенесших «не-Q-ИМ» (рис. 2), у которых на протяжении 5 лет повторные ИМ развивались несколько чаще (36,2%), чем у больных, перенесших «Q-ИМ» (30,8%) (р >0,05). По данным ХМ ЭКГ вскоре после выписки из стационара число эпизодов болевой и безболевой ишемии миокарда и их средняя длительность были значительно более выражены у больных, перенесших «Q-ИМ», что отражало тяжесть исходного нарушения коронарного кровотока и значительное снижение коронарного резерва у этих больных. Однако уже через 1 год после ИМ у пациентов, перенесших «не-Q-ИМ», опережающими темпами нарастали все признаки преходящей ишемии, так что к концу 5-летнего периода наблюдения происходило полное нивелирование первоначальной разницы в тяжести нарушений коронарного кровотока у больных обеих подгрупп (рис. 3).
К моменту выписки больных из стационара у больных, перенесших «Q-ИМ», средние значения ФК ХСН по НИХА (2,21±0,3) в 1,2 раза превышали таковые у пациентов с мелкоочаговым кардиосклерозом (1,84±0,2) (р >0,05). Однако уже в конце 2-го года наблюдения разница значений ФК резко уменьшалась, а к концу 4-5-го года наблюдения средние значения ФК ХСН (2,48±0,2 и 2,55±0,3), значения шкалы ШОКС (6,7±0,5 бал. и 6,6±0,4 бал.), результаты нагрузочных тестов (табл. 3) и частота достижения комби-
Рис.4. Динамика ФК ХСН нированной конечной точки у больных, перенесших раз-
личные формы ИМ (98,1% и 96,4%), практически не отличались друг от друга.
Таблица 3.
Динамика результатов теста 6-минутной ходьбы у больных ХСН
| Показатели | «Q-ИМ» n=29 | «не-Q-ИМ» n=35 | ||||
| Исходные данные | Через 2 года | Через 5 лет | Исходные данные | Через 2 года | Через 5 лет | |
| Дистанция 6 ходьбы (м) | 341,5±13 | 304,8+14* | 280,9±15* | 378,1±16 | 316,7+15* | 290,8±16* |
| %± прироста | 10,8±5,3% | 17,9±5,0% | 16,4±5,3% | 23,3±5,2% | ||
Примечание: * и штриховкой обозначены статистически достоверные отличия (р <0,05) с исходными данными.
Таким образом, в целом тяжесть течения ИБС и ХСН у пациентов, перенесших «не-Q-ИМ», немногим отличалась от таковой у больных с крупноочаговым рубцовым поражением ЛЖ. Можно предположить, что во многом это связано с многососудистым атеросклеротическим поражением КА [Каллаева А.Н., 2005], а также со своеобразной незавершенностью окклюзионного процесса в КА, которая характерна для «не-Q-ИМ» [Ройтберг Г.Е., Струтынский А.В., 2003;. Park S.E. et al. 1990; Cools F.J., 1992; Braunwald E. 2000], что сопровождается выраженной нестабильностью коронарного кровотока в инфаркт-связанной КА и приводит, по меньшей мере, к более частому возникновению повторных ИМ или эпизодов нестабильной стенокардии [Тамберелла М.Р. с соавт., 2000].
Таблица 4.
Сравнение результатов первичного и повторного (через 5 лет после ИМ) ЭхоКГ-исследования ЛЖ у б-ных контрольной группы, перенесших различные формы ИМ
| Показатели | Первичное исследование | Исследование через 5 лет | ||||
| «Q-ИМ» n=34 | «Не-Q-ИМ» n=40 | Р1-2 | «Q-ИМ» n=34 | «Не-Q-ИМ» n=40 | Р3-4 | |
| 1 | 2 | 3 | 4 | |||
| иММЛЖ г/м2 | 112±2,7# | 106,1±2,5# | - | 142,7±2,4 | 138,8±3,1 | - |
| иКДО,мл/м | 91,5±2,0# | 75,6±1,5# | <0,001 | 100,1±2,3 | 102,7±1,3 | - |
| иКСО, мл/м | 44,8±1,1# | 37,8±0,8# | <0,01 | 54,5±2,6 | 56,4±1.6 | - |
| КДР, мм | 58,4±1,4# | 54,2±1,3# | <0,05 | 72,2±1,8 | 67,4±1,5 | <0,05 |
| КСР, мм | 42,2±1,3# | 35,3±1,2* | <0,01 | 53,2±2,2 | 49,6±1,3 | - |
| ФВ, % | 48,7±1,4# | 51,0±1,3# | - | 45,5±2,9 | 46,7±1,5 | - |
| S% ЛЖ | 28,7±1,3# | 34,8±1,4* | <0,01 | 26,3±1,5 | 26,1±1,4 | - |
| ЛП, мм | 38,3±3,6* | 36,1±3,4* | - | 49,3±3,3 | 46,2±3,1 | - |
| ИС | 0,73±0,01# | 0,67±0,01* | <0,001 | 0,87±0,03 | 0,84±0,01 | - |
| 2H/D | 0,34±0,02 | 0,36±0,01 | - | 0,29±0,02 | 0,29±0,01 | - |
| МС, г/см | 159±4,2# | 144±4,0* | <0,05 | 181,6±4,3 | 180,3±3,0 | - |
| DT, мс | 238±5,5# | 233±5,6# | - | 199±5,1 | 206±5,1 | - |
| IVRT, мс | 108±2,1# | 103±2,0# | - | 88±2,8 | 94±2,3 | - |
| Peak E,м/с | 0,54±0,02# | 0,58±0,02# | - | 0,60±0,03 | 0,62±0,02 | - |
| PeakA,м/с | 0,58±0,02# | 0,51±0,01# | <0,01 | 0,44±0,03 | 0,46±0,02 | - |
| E/A | 0,93±0,02# | 1,14±0,02# | <0,001 | 1,36±0,03 | 1,35±0,01 | - |
| СрДЛА | 22,4±1,4# | 20,6±1,4* | - | 25,6±1,4 | 24,6±1,6 | - |
Примечание: знаками * и #, а также штриховкой обозначены статистически достоверные отличия (р <0,05 и р <0,01) от нормы при первичном исследовании.
Эти данные подтверждались результатами динамического ЭхоКГ-исследования. Так, при первичном исследовании у пациентов контрольной группы выявлялось статистически значимое увеличение ММЛЖ, индекса сферичности и размеров ЛЖ, систолического МС и признаки выраженной диастолической дисфункции ЛЖ, преимущественно по типу замедленной релаксации (табл. 4). Наблюдалось также небольшое, но достоверное увеличение СрДЛА, размеров полости ПЖ и ПП и признаки диастолической дисфункции ПЖ I типа. При этом у больных, перенесших «Q-ИМ, выявлялись наиболее значительные нарушения, сформировавшиеся в остром и подостром периодах ИМ [Белов Ю.В., Вараксин В.А., 2002; Васюк Ю.А., 2003; Рябова Т.Р. с соавт., 2003; Беленков Ю.Н. с соавт., 2006].
В процессе 5-летнего наблюдения практически у всех больных контрольной группы выявлялось прогрессирование ГЛЖ, выраженный процесс сферизации, постепенное увеличение систолического и диастолического размеров ЛЖ, а также систолического МС, который, как известно, является ключевым фактором, инициирующим процессы ремоделирования ЛЖ [Беленков Ю.Н. с соавт., 2002; Бокерия Л.А. с соавт., 2002; Ускова О.В., 2003] и стимулирующим активацию тканевых нейрогормональных систем и выработку эффекторов, «запускающих» длительный процесс структурно-функционального ремоделирования сердца [Blaufarb I.S., Sonnenblick E.H., 1996]. Прогрессировала также диастолическая дисфункция ЛЖ, причем у части больных обеих подгрупп признаки диастолической дисфункции ЛЖ I типа трансформировались в более неблагоприятную в прогностическом отношении дисфункцию II (рестриктивного) типа [Васюк Ю.А., 2003], отражая увеличение числа пациентов с признаками ХСН III ФК. При этом различия между двумя подгруппами больных к концу 5-летнего периода наблюдения почти полностью нивелировались.
В связи с этим большой интерес представляло изучение наиболее значимых факторов риска дальнейшего неблагоприятного течения у больных ХСН, перенесших различные формы ИМ. Было показано, что независимо от формы перенесенного ИМ, неблагоприятное течение заболевания (летальные исходы и/или внеплановые госпитализации в связи с усугублением признаков ХСН или повторными ИМ) достоверно чаще (в 70,4% случаев; р <0,05-0,01) выявлялось у пациентов с признаками ХСН III-IV ФК по NYHA во время первичного исследования, более высокими значениями ШОКС (>4,5 баллов), низкими показателями теста 6-минутной ходьбы (дистанция <300 м), мощности нагрузки при ВЭП (<100 Вт), сниженной ФВлж (<45%) и при суммарной длительности преходящей ишемии миокарда во время ХМ ЭКГ более 12 мин в сутки. Отрицательное влияние на прогноз оказывали также возраст > 70 лет, передняя локализация инфаркта, наличие у больных до возникновения ИМ СД II типа, тяжелой АГ III степени, стенокардии напряжения или ХСН III-IV ФК и другие ФР. Однако несмотря на высокую положительную предсказательную ценность (от 73% до 100%) и специфичность перечисленных ФР (от 81 до 100%), их чувствительность (частота выявления признака в группе больных с неблагоприятным течением заболевания) составила у больных с «Q-ИМ» - 30,7±4,5%, а у пациентов с «не-Q-ИМ» - 34,4±4,6%. Иными словами, примерно у 65-70% больных, перенесших ИМ, двухлетний прогноз зависел от действия других факторов, которые со временем оказывались решающими в определении характера течения заболевания и прогрессирования сердечной и коронарной недостаточности.
Одним из важнейших из этих факторов явились особенности ишемического повреждения сердечной мышцы, которые были изучены с помощью оригинальной методики количественной оценки сегментарной электрической активности ЛЖ, разработанной нами совместно с сотрудниками кафедры (профессором А.В.Струтынским, доцентом А.Б.Глазуновым, ассистентом Е.Н.Банзелюком) и основанной на данных, получаемых с помощью системы для многополюсного ЭКГ-картирования сердца Predictor BSM-32 (США). С этой целью на поверхности грудной клетки выделялись области, которые отражали процесс возбуждения 7 сегментов ЛЖ: верхней и нижней частей МЖП, заднедиафрагмального (нижнего), переднебазального, верхушечного, бокового и заднебазального сегментов (рис. 5). В результате компьютерной процедуры сложения положительных электрических потенциалов в проекции каждого сегмента через каждые 2 мс желудочковой деполяризации были получены кривые формирования положительных потенциалов, характеризующие последовательную активацию сегментов.

Рис. 5. Проекции 7 сегментов ЛЖ на поверхность грудной клетки:
Количественный анализ сегментарной электрической активности ЛЖ в покое и при физической нагрузке у больных ХСН, перенесших ИМ, позволял точно оценивать локализацию и распространенность постинфарктного рубца, определять признаки компенсаторной гиперфункции миокарда отдельных сегментов ЛЖ, выявлять признаки преходящей посленагрузочной ишемии миокарда, а также косвенно оценивать наличие или отсутствие признаков «электрической гибернации» - ЭКГ-картографического «эквивалента» жизнеспособного (гибернирующего) миокарда, чаще расположенного в области постинфарктного рубца. При этом характер этих изменений и их выраженность зависели, прежде всего, от локализации перенесенного ИМ, формы инфаркта («Q-ИМ» или «не-Q-ИМ») и ассоциировались с вариантом дальнейшего течения заболевания и скоростью прогрессирования ХСН.
Практически у всех больных ХСН, перенесших ИМ (в том числе «не-Q-ИМ»), в области постинфарктных рубцов, а также в участках миокарда, непосредственно граничащих с рубцовой зоной, в покое наблюдалось существенное локальное снижение электрической активности и замедление деполяризации сегмента, обусловленное наличием невозбудимой рубцовой ткани и окружающего ее ишемизированного, но жизнеспособного миокарда. В большинстве случаев на фоне небольшой физической нагрузки в этих участках наблюдались разнонаправленные изменения электрической активности и скорости деполяризации ишемизированных сегментов ЛЖ. Так, независимо от формы перенесенного ИМ, у больных с благоприятным дальнейшим течением заболевания (отсутствие летального исхода, повторных ИМ и быстрого прогрессирования ХСН) на фоне небольшой физической нагрузки чаще наблюдалось достоверное увеличение электрической активности и ускорение деполяризации ранее ишемизированного сегмента (с исходно сниженной амплитудой положительного потенциала в покое), что, на наш взгляд, косвенно отражало «благоприятную» реакцию жизнеспособного (гибернирующего) миокарда на небольшую нагрузку, умеренную активацию САС и адекватное увеличение коронарного кровотока. Этот ЭКГ-картографический феномен мы обозначали как «электрическую гибернацию» миокарда [Strutynsky A.V. et al., 2009].
В противоположность этому, у больных с неблагоприятным течением заболевания, относительно быстрым прогрессированием ХСН или возникновением повторных ИМ на фоне небольшой нагрузки чаще происходило еще большее снижение амплитуды сегмента и значительное замедление его деполяризации, отражавшее, вероятно, резкое ухудшение кровотока в инфаркт-связанной КА и дальнейшее снижение метаболизма пораженного сегмента [Бокерия Л.А., Бузиашвили Ю.И. и др., 2002].
Кроме того, практически у всех больных, перенесших ИМ, в «интактных» сегментах ЛЖ, расположенных вне области постинфарктного рубца, на фоне нагрузки выявлялось умеренное локальное увеличение максимальной амплитуды положительного потенциала вместе с еще большим замедлением деполяризации сегмента, отражающее, согласно работам [Струтынский А.В. с соавт, 2004; Strutynsky A.V. et al., 2009] возникновение преходящей ишемии миокарда, индуцированной физической нагрузкой. Важно отметить, что у пациентов с неблагоприятным дальнейшим течением заболевания и прогрессированием ХСН и КН такие признаки преходящей ишемии миокарда выявлялись в 2-х и более сегментах, свидетельствуя о наличии многососудистого поражения КА, тогда как при благоприятном течении заболевания - не более чем в одном сегменте ЛЖ (не считая области постинфарктного рубца).
Существование в ЛЖ различных в функциональном отношении участков миокарда способствовало формированию более или менее выраженного асинхронизма возбудительного процесса, что не могло не сказаться на синхронности сокращения и расслабления отдельных сегментов ЛЖ [Шумаков В.И., Остроумов Е.Н., 2003]. Интересно, что у большинства больных с неблагоприятным течением болезни на фоне нагрузки наблюдалось достоверное увеличение (>12 мс), а у пациентов с благоприятным течением - существенное уменьшение асинхронизма деполяризации сегментов (табл. 5).
Таблица 5.
Изменение показателей сегментарной электрической активности ЛЖ во время нагрузочного теста у больных ХСН, перенесших «не-Q-ИМ» заднедиафрагмальной (нижней) стенки с относительно благоприятным и неблагоприятным течением постинфарктного периода
| Показатели | Неблагоприятный вариант | Благоприятный вариант | ||
| До нагрузки | После нагрузки | До нагрузки | После нагрузки | |
| Аmах нижнего сегмента, мм (рубец) | 6,2±1,2 | 3,1±1,0 | 5,3±1,2 | 6,1±1,1 |
| Средняя Аmах перед. стенки,мм | 16,0±1,9 | 16,1±1,7 | 10,3±0,8 | 10,4±1,0 |
| Среднее tmах передн.стенки,мс | 53,7±1,5 | 58,7±1,5 | 51,4±1,6 | 47,8±1,5 |
| Асинхронизм возбуждения 3-х сегментов передней стенки ЛЖ, мс | 8,6±1,2 | 12,3±1,4 | 6,5±0,8 | 4,3±0,7 |
| Ср. число ишемизир. сегментов ЛЖ | 1,9±0,5 | 0,8±0,3 | ||
| Среднее число сегментов с признаками «эл./гибернации» | 0,4±0,09 | 2,9±0,5 | ||
| Площадь постинфарктного рубца,% | 10,3±2,5 | 9,7±3,4 | ||
Примечание: штриховкой обозначены показатели, достоверно отличающиеся от исходных значений (до нагрузки) или по сравнению с пациентами с неблагоприятным течением заболевания.
При изучении изменений сегментарной электрической активности ЛЖ у пациентов с различной локализацией постинфарктного рубца было показано, что у больных, перенесших заднедиафрагмальный (нижний) ИМ, независимо от его формы (крупно- или мелкоочаговой), характер дальнейшего течения заболевания, по крайней мере, на протяжении первых 2-х лет после инфаркта, во многом определяется наличием или отсутствием признаков посленагрузочной ишемии миокарда передней стенки ЛЖ, выполняющей основную роль в компенсации насосной функции сердца, а также сохранением в сегментах, непосредственно граничащих с рубцовой зоной, ЭКГ-картографических признаков «электрической гибернации», что свидетельствовало об относительно удовлетворительном состоянии коронарного кровотока в инфаркт-связанной КА и частичной обратимости функции жизнеспособного миокарда.
У больных, перенесших крупноочаговый «Q-ИМ» передней стенки ЛЖ характер дальнейшего течения ИБС и скорость прогрессирования ХСН в постинфарктном периоде в большей степени, чем у пациентов с заднедиафрагмальной локализацией инфаркта, определялась распространенностью рубцовой зоны. Неблагоприятное течение заболевания было характерно для больных со значительной распространенностью как рубцового, так и ишемического повреждения сегментов передней стенки, а также с малой выраженностью или отсутствием ЭКГ-картографических признаков «электрической гибернации» в области постинфарктных рубцов, что определяло возникновение выраженного асинхронизма возбуждения, снижение насосной функции сердца и быстрое прогрессирование ХСН.
В отличие от этого, характер течения постинфарктного периода у больных, перенесших передний мелкоочаговый «не-Q-ИМ», почти полностью определялся не столько размерами интрамурального постинфарктного рубца, сколько распространенностью и степенью ишемического повреждения сегментов передней стенки ЛЖ, а также наличием или отсутствием ЭКГ-картографических признаков «электрической гибернации» миокарда в области постинфарктных рубцов.
Было показано, что важным дополнительным фактором, определяющим характер дальнейшего течения постинфарктного периода и скорость прогрессирования ХСН, является повышение активности системы провоспалительных цитокинов, что закономерно приводит к ремоделированию сердца [Bozkurt B. 1998] и способствует возникновению и прогрессированию ХСН [Насонов Е.Л. с соавт., 1999; Васюк Ю.А. с соавт., 2006]. В нашем исследовании концентрация ФНО- и ИЛ-6, независимо от формы перенесенного ИМ, достоверно отличалась от нормы (р <0,01) и существенно возрастала по мере нарастания признаков сердечной недостаточности (табл. 6). При этом коэффициент парной корреляции (r) между функциональным классом ХСН и уровнем ФНО- и ИЛ-6 составил, соответственно, +0,54±0,02 и +0,48±0,02 (р <0,05). Высокая степень корреляции отмечена также между значениями ФНО- и МС (r = +0,56±0,02), а также отношением пиков диастолического наполнения ЛЖ Е/А (r = 0,49±0,02).
Таблица 6.
Исходный уровень ФНО- и ИЛ-6 у пациентов с ХСН и благоприятным и неблагоприятным дальнейшим течением постинфарктного периода
| Цитокины | Норма | Благоприят-ное течение | Неблагоприят-ное течение | Р2-3 |
| 1 | 2 | 3 | ||
| Больные ХСН I-II ФК по NYHA | ||||
| ФНО, пг/мл | 4,6±0,3 | 7,5±1,2# | 10,3±1,0# | - |
| ИЛ-6, пг/мл | 6,2±0,4 | 11,2±1,4# | 14,2±1,2# | - |
| Больные ХСН III ФК по NYHA | ||||
| ФНО, пг/мл | 4,6±0,3 | 8,3±0,8# | 15,7±1,2# | <0,001 |
| ИЛ-6, пг/мл | 6,2±0,4 | 10,2±1,1# | 29,8±2,3# | <0,001 |
Примечание: знаком # и штриховкой отмечены показатели, достоверно отличающиеся от нормы (р <0,01)
При этом у больных с признаками ХСН III ФК и неблагоприятным дальнейшим течением заболевания уровень ФНО- и ИЛ-6 в момент первичного исследования был почти в 2-3 раза выше, чем у пациентов с относительно благоприятным течением болезни (р <0,001), что доказывало роль повышенного уровня цитокинов в механизмах дальнейшего прогрессирования систолической дисфункции ЛЖ и повышении риска летальных исходов у этих больных [Васюк Ю.А. с соавт., 2006; Blum A., Miller H. 1998]. Аналогичная зависимость у пациентов с ХСН I-II ФК оказалась менее выраженной и недостоверной (р >0,05).
Предсказательная ценность двух выделенных нами дополнительных прогностических критериев неблагоприятного течения заболевания (ФНО- >10,0 пг/мл ИЛ-6 >12,0 пг/мл) достигала 86-74%, специфичность - 90-84% и чувствительность - 82-63% (р <0,01).
На основании полученных результатов был разработан алгоритм ориентировочного прогноза неблагоприятного течения заболевания у больных ХСН, перенесших различные формы ИМ, основанный на клинических данных, некоторых ЭхоКГ-изменениях, результатах анализа сегментарной электрической активности ЛЖ и значениях концентрации провоспалительных цитокинов ФНО- и ИЛ-6 (рис. 6 и 7). Достоверность правильного прогноза достигает 80-85%.
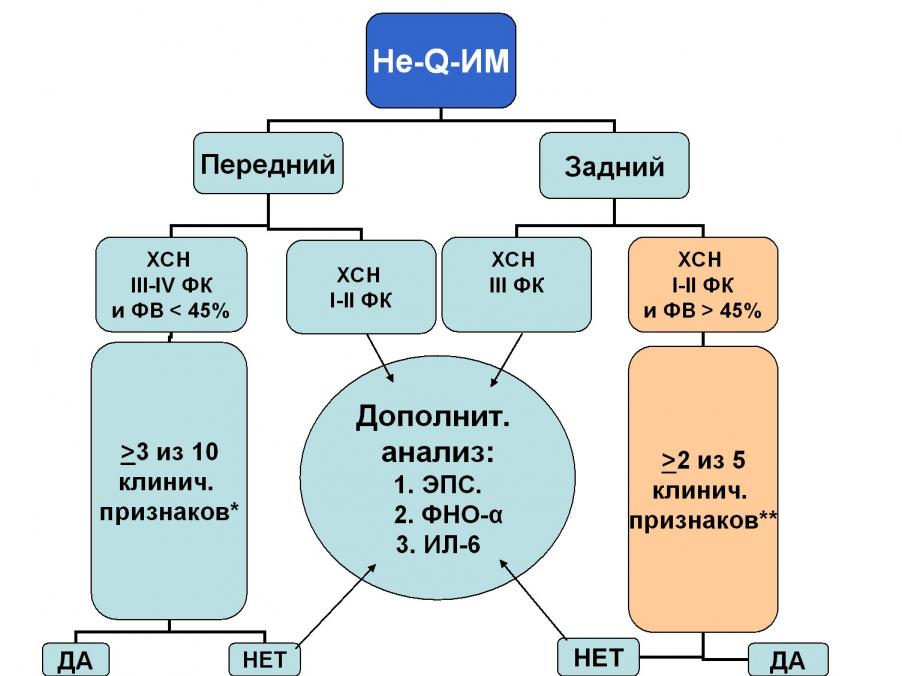
| Неблагоприятный вариант | Благоприятный вариант |
Рис. 6. Алгоритм прогноза неблагоприятного и благоприятного течения заболевания у больных ХСН, перенесших «не-Q-ИМ»:
* - Возраст > 70 лет; СД; стенокардия или/и ХСН III-IV ФК или/и АГ III степени до возникновения ИМ; левожел. нед-ть в остром периоде ИМ; ранняя постинфарктная стенокардия; ШОКС > 4,5 баллов; дистанция 6-мин. ходьбы < 300 м; признаки ишемии миокарда типа «Н» (по данным ХМ ЭКГ).
** - Возраст < 60 лет; ШОКС < 4,5 баллов; дистанция 6-мин. ходьбы > 425 м; длительность ишемии < 12 мин/сут. (по данным ХМ ЭКГ); ИМ на фоне чрезмерной физической или эмоциональной нагрузки.

| Неблагоприятный вариант |
Рис. 7. Алгоритм прогноза неблагоприятного течения заболевания у больных ХСН, перенесших «Q-ИМ» (* - Перечень клинических признаков, ассоциированных с неблагоприятным течением заболевания тот же, что и на рис. 6).
2. Эффективность длительного амбулаторного
лечения больных ХСН, перенесших ИМ
Лечение иАПФ периндоприлом или БРА кандесартаном
в сочетании с селективными 1-адреноблокаторами
Длительное лечение больных ХСН, перенесших ИМ, иАПФ периндоприлом (1-я группа) или БРА кандесартаном (2-я группа) в сочетании с 1-адреноблокаторами оказывало существенное влияние на скорость прогрессирования ХСН и процесс постинфарктного ремоделирования ЛЖ и ПЖ (табл. 7). Так, летальность уменьшилась на 31,3-17,6%%, а число повторных ИМ - на 26% по сравнению с контрольной группой (р >0,05). К концу 2-го года лечения число больных ХСН III-IV ФК в 1-й и 2-й группах было в 1,8-2,2 раза меньше, а частота достижения комбинир. конечной точки в 1,3 раза меньше, чем в группе контроля (р >0,05).
Снижение (по сравнению с контрольной группой) числа госпитализаций в связи с обострением ХСН под влиянием терапии иАПФ составило 21,7%, а на фоне лечения кандесартаном - 25,8% (р <0,05). Достоверно снизились также средние значения ФК ХСН и шкалы ШОКС и увеличилась дистанция 6-минутной ходьбы, особенно у больных 2-й группы, лечившихся кандесартаном и 1-адреноблокаторами ( р <0,05). Следует отметить, что при лечении больных ХСН кандесартаном было особенно заметно быстрое (в течение 1,5-2-х месяцев от начала терапии) уменьшение одышки, мышечной слабости, быстрой утомляемости больных и отеков. Не исключено, что это связано с более полной и селективной блокадой рецепторов АТ1, которую (в отличие от иАПФ) обеспечивают БРА, сохраняя доступность рецепторов АТ2, через которые реализуются позитивные защитные антипролиферативные и вазодилатирующие свойства ангиотензина, препятствующие патологическому ремоделированию органов-мишеней [Беленков Ю.Н. с соавт., 2006].
Таблица 7.
Основные клинические показатели тяжести течения постинфарктного периода в конце 2-го года наблюдения и лечения
| Показатели | Группы больных ХСН, перенесших ИМ | ||||
| Контроль n = 110 | 1-я группа n = 48 | 2-я группа n = 40 | 3-я группа n = 50 | 4-я группа n = 28 | |
| Летальн-ть/ССЗ | 20 (18,2%) | 6 (12,5%) | 6 (15,0%) | 4 (8,0%*) | 3 (10,7%) |
| ПовторныеИМ | 17 (15,4%) | 6 (12,5%) | 5 (12,5%) | 4 (8,0%) | 2 (7,1%) |
| ХСН III-IV ФК | 42 (38,2%) | 10(20,8%)* | 7 (17,5%)* | 6(12,0%)* | 3 (10,7%) |
| ШОКС, баллы | 5,70±0,2 | 4,92±0,3 | 4,62±0,3* | 4,56±0,3* | 4,28±0,3* |
| ФК ХСН | 2,38±0,2 | 1,90±0,2 | 1,80±0,2* | 1,73±0,2* | 1,72±0,2* |
| Тест 6 ходьбы | 310±15 | 385±15* | 396±14* | 412±16* | 438±13* |
| Госпит-я(ХСН) | 26 (23,6%) | 9 (18,7%) | 7 (17,5%) | 6 (12,0%*) | 3 (10,7%)* |
| Комбинир.кон. | 46 (41,8%) | 15 (31,2%) | 13 (32,5%) | 12 (24,0%* | 6 (21,4%*) |
Примечание: Знаком * и штриховкой отмечены показатели, достоверно отличавшиеся от таковых в группе контроля (р <0,05).
ММЛЖ МС ИС
СрДЛА КДО Е/А
Рис. 8. Динамика основных ЭхоКГ-показателей у больных ХСН, перенесших ИМ,
Эти данные были полностью подтверждены результатами повторного ЭхоКГ-исследования больных. Как видно на рисунке 8, уже через год от начала лечения у пациентов обеих групп выявлялась отчетливая и достоверная тенденция к менее значительному, чем у пациентов контрольной группы, увеличению ММЛЖ, систолического МС, индекса сферичности, КДО и КСО ЛЖ (р <0,05-0,01), а также тенденция к небольшом увеличению ФВлж (р >0,05). У пациентов 1-й группы, лечившихся периндоприлом и 1-адреноблокаторами, происходило также значительное улучшение диастолической функции ЛЖ и ПЖ в виде достоверного увеличения отношения Е/А (р <0,01). На фоне лечения кандесартаном этот эффект был менее заметным. Кроме того, под влиянием лечения иАПФ или БРА в сочетании с 1-адреноблокаторами существенно замедлялся процесс постинфарктного увеличения размеров ПЖ и ПП. У пациентов 2-й группы, лечившихся кандесартаном и 1-адреноблокаторами, наблюдалось также достоверное снижение СрДЛА (р <0,05), тогда как на фоне лечения периндоприлом и 1-адреноблокаторами этот эффект был менее выраженным и стойким (р >0,05).
Следует подчеркнуть, что максимальные положительные сдвиги эхокардиографических показателей, отражающих функцию ЛЖ и ПЖ, наблюдались через год от начала систематической терапии, тогда как в конце 2-го года лечения эффект терапии заметно ослабевал, по крайней мере, у части больных 1-й и 2-й групп (см. рис 8).
Таким образом, длительное лечение больных ХСН, перенесших ИМ, иАПФ периндоприлом или БРА кандесартаном в сочетании с 1-адреноблокаторами оказывает положительное влияние на процессы постинфарктного ремоделирования ЛЖ и ПЖ, замедляя дальнейшее увеличение ММЛЖ, изменение геометрии ЛЖ, расширение полостей и снижение систолической и диастолической функции желудочков, а также способствует недостоверному уменьшению летальности, частоты повторных ИМ и скорости прогрессирования ХСН, снижая риск неблагоприятного течения заболевания на 22-25% (р >0,05). При этом эффект лечения кандесартаном вполне сопоставим с эффектом терапии периндоприлом, за исключением меньшего влияния препарата на диастолическую функцию ЛЖ и ПЖ и сердечно-сосудистую летальность. В то же время лечение кандесартаном способствует более выраженному и стойкому уменьшению СрДЛА и клинических проявлений ХСН, заметно повышая качество жизни больных, перенесших ИМ.
Лечение иАПФ периндоприлом и карведилолом
Было показано, что длительное лечение больных 3-й группы иАПФ периндоприлом и карведилолом, обладающим, как известно, отчетливым вазодилатирующим, антиоксидантным и антипролиферативным действием оказывало наиболее существенное положительное влияние на процессы постинфарктного ремоделирования ЛЖ и ПЖ, способствуя не только замедлению увеличения (как у больных 1-й и 2-й групп), но и достоверному уменьшению (р <0,05) ММЛЖ (на 6,3% по сравнению с исходным уровнем), систолического МС (на 14,0%), ИС (на 7,3%), КСОлж (на 7,7%), СрДЛА (на 19,8%), а также увеличению ФВлж (на 11,9%) и отношения Е/Алж (на 24,7%) (рис. 8). Одновременно по сравнению с исходными данными на 14,4% уменьшились средние значения КДРпж и на 14,8% - КСРпж (р <0,05). Отмечалось также увеличение на 20,8% отношения Е/Апж (р <0,001), что свидетельствовало о существенном улучшении диастолической функции ПЖ. Следует подчеркнуть, что положительные сдвиги эхокардиографических показателей на фоне лечения иАПФ и карведилолом заметно превышали таковые у больных 1-й и 2-й групп и сохранялись на протяжении всех 2-х лет лечения (р <0,05).
При этом двухгодичная смертность от сердечно-сосудистых осложнений и частота повторных ИМ у больных 3-й группы (8,0%) по сравнению с группой контроля (18,2 и 15,4%) снизились соответственно на 56% и 48% (р <0,05), и оказались в 1,5 раза меньше аналогичных показателей у пациентов 1-й и 2-й групп, лечившихся периндоприлом или кандесартаном в сочетании с 1-адреноблокаторами (табл. 7).
К концу 2-го года лечения карведилолом и периндоприлом число больных 3-й группы с признаками ХСН III-IV ФК по NYHA (12,0%) было в 3 раза меньше, чем в контрольной группе (38,2%) (р <0,05) и в 1,7-1,5 раз меньше, чем у пациентов 1-й и 2-й групп, что свидетельствовало о существенном замедлении прогрессирования ХСН (табл.7). Сравнительно быстро уменьшались клинические проявления сердечной недостаточности (одышка, отеки ног, мышечная слабость и быстрая утомляемость), что подтверждалось достоверным снижением по сравнению с группой контроля средних значений шкалы ШОКС (р <0,01) и ФК ХСН (р <0,05) и увеличением толерантности к физической нагрузке (р <0,001). Усугубление клинических признаков сердечной недостаточности, потребовавшее внеплановых госпитализаций, отмечено всего в 12,0%, что в 1,5 раза меньше, чем у пациентов 1-й и 2-й групп и в 2 раза меньше, чем у пациентов контрольной группы (р <0,05). За 2 года лечения комбинированную конечную точку достигли 24,0% пациентов 3-й группы, что достоверно отличалось от соответствующего показателя в группе контроля (41,8%; р <0,05) и было в 1,3 раза меньше, чем в 1-й и 2-й группах (р >0,05).
Таким образом, длительное амбулаторное лечение иАПФ и карведилолом оказывало наиболее выраженное положительное влияние на все основные показатели постинфарктного периода и процесс ремоделирования ЛЖ и ПЖ, уменьшая риск неблагоприятного течения заболевания в целом за 2 года на 42,6% по сравнению с группой контроля (р <0,05). Важно отметить, что в отличие от пациентов 1-й и 2-й групп, высокая эффективность терапии иАПФ и карведилолом сохранялась на протяжении всех 2-х лет лечения.
Лечение периндоприлом, карведилолом и пентоксифиллином
В нашем исследовании эффективность длительного лечения 28 больных ХСН, перенесших ИМ, периндоприлом, карведилолом и пентоксифиллином (4-я группа) в целом оказалась столь же высокой, что и терапия иАПФ и карведилолом (3-я группа). На 54,7% по сравнению с группой контроля уменьшалась частота внеплановых госпитализаций в связи с усугублением признаков ХСН и на 48,8% частота достижения комбинированной конечной точки (р <0,001) (табл. 7). Эти результаты оказались чуть высокими, чем результаты лечения больных 3-й группы карведилолом и иАПФ, хотя разница была статистически незначимой (р >0,05).
Вместе с тем, добавление пентоксифиллина к терапии иАПФ и карведилолом сопровождалось более быстрым и выраженным уменьшением клинических проявлений сердечной недостаточности (одышки, мышечной слабости, быстрой утомляемости), особенно у больных ХСН III ФК, что подтверждалось результатами оценки шкалы ШОКС, динамики ФК по НИХА и данными теста 6-минутной ходьбы (табл. 7). При этом улучшение ряда ЭхоКГ-показателей, отражающих положительные сдвиги систолической и диастолической функции ЛЖ, также происходило в более ранние сроки после ИМ, чем у больных, лечившихся только иАПФ и карведилолом (см. рис. 8). Кроме того, на фоне лечения пентоксифиллином отмечалось более выраженное снижение СрДЛА и улучшение диастолической функции ЛЖ и ПЖ, что могло объяснить быстрое уменьшение клинических проявлений ХСН у пациентов 4-й группы. Следует подчеркнуть, что улучшение клинической картины заболевания и ЭхоКГ-показателей происходило преимущественно у больных с более тяжелым течением сердечной недостаточности (ХСН III ФК по NYHA), тогда как у больных ее начальными проявлениями (ХСН I-II ФК) эффект был менее заметным.
Выявленные нами дополнительные эффекты пентоксифиллина были обусловлены, вероятно, как основным хорошо известным действием препарата на микроциркуляторное сосудистое русло, реологические свойства крови, агрегацию тромбоцитов и ОПСС, так и возможным влиянием пентоксифиллина на уровень провоспалительных цитокинов [Беленков Ю.Н. с соавт., 2002; Васюк Ю.А., 2006].
Влияние длительной терапии больных ХСН, перенесших ИМ,
на концентрацию ФНО- и ИЛ-6
Особый интерес представлял анализ влияния различных вариантов длительной терапии больных ХСН, перенесших ИМ, на уровень некоторых провоспалительных цитокинов (табл. 8). У больных контрольной группы с ХСН III ФК уровень ФНО- и ИЛ-6, существенно повышенный уже при первичном исследовании (р <0,01), к концу 2-го года повысился на 26,4% и 25,6% по сравнению с исходными данными (р <0,001), тогда как у больных ХСН I-II ФК - всего на 5,8% и 4,1% (р >0,05).
Таблица 8.
Снижение уровней ФНО- и ИЛ-6 под влиянием длительной терапии иАПФ, БРА и блокаторами адренорецепторов по сравнению с контрольной группой (в %)
| Цитокины | Группы больных | Через 1 год | Через 2 года |
| Больные ХСН I-II ФК по NYHA | |||
| ФНО- | 1-адреноблокаторы (1+2 группы) | 7,6% | 5,8% |
| Карведилол (3-я группа) | 11,3% | 13,2% | |
| Карведилол + трентал (4-я гр.) | 12,8% | 14,5% | |
| ИЛ-6 | 1-адреноблокаторы (1+2 группы) | 3,8% | 6,1% |
| Карведилол (3-я группа) | 8,4% | 10,0% | |
| Карведилол + трентал (4-я гр.) | 10,7% | 14,1% | |
| Больные ХСН III ФК по NYHA | |||
| ФНО- | 1-адреноблокаторы (1+2 группы) | 9,8% | 12,7% |
| Карведилол (3-я группа) | 20,5% | 29,0% | |
| Карведилол + трентал (4-я гр.) | 27,1% | 37,8% | |
| ИЛ-6 | 1-адреноблокаторы (1+2 группы) | 6,9% | 14,1% |
| Карведилол (3-я группа) | 15,8% | 28,3% | |
| Карведилол + трентал (4-я гр.) | 23,7% | 36,8% | |
Примечание: штриховкой выделены проценты снижения цитокинов, превышающие 20% (р <0,05).
Как видно из таблицы 8, длительная терапия больных ХСН, перенесших ИМ, селективными 1-адреноблокаторами в сочетании с иАПФ или БРА сопровождалась небольшим замедлением возрастания уровня цитокинов по сравнению с группой контроля. Лечение с использованием карведилола (3-я группа) и особенно карведилола и пентоксифиллина (4-я группа) у больных с более тяжелым течением ХСН III ФК оказывало достоверно более выраженный антицитокиновый эффект (р <0,05), чем терапия 1-адреноблокаторами. При этом к концу 2-го года лечения у пациентов 3-й и 4-й групп уровень ФНО- снижался по сравнению с контрольной группой соответственно на 29,0-37,8%, а уровень ИЛ-6 - на 28,3-36,8% (р <0,05), тогда как у пациентов, лечившихся селективными 1-адреноблокаторами, только на 12,7-14,1%. У больных с начальными проявлениями ХСН I-II ФК уменьшение концентрации ФНО- и ИЛ-6 в крови ненамного отличалось от соответствующей динамики цитокинов у пациентов, лечившихся 1-адреноблокаторами.
Эти данные позволяют предположить, что высокая эффективность применения карведилола и карведилола с пентоксифиллином у больных с ХСН III ФК во многом определяется наличием «субстрата» для действия этих препаратов в виде значительно повышенного исходного уровня цитокинов, которые именно у больных с более тяжелым течением сердечной недостаточности приобретают, вероятно, существенно большее патогенетическое значение в дальнейшем прогрессировании ХСН, чем у пациентов с начальными проявлениями сердечной недостаточности.
3. Основные закономерности формирования и
прогрессирования ХСН у пациентов контрольной
группы с ХОБЛ и ХЛС
Основные закономерности формирования и прогрессирования ХСН у больных ХОБЛ и ХЛС были изучены нами у 45 пациентов контрольной группы (длительность наблюдения 2 года). Было показано, что наиболее общей закономерностью течения заболевания ХОБЛ и ХЛС у значительной части больных контрольной группы, по разным причинам не получавших адекватного и систематического лечения заболевания, является относительно быстрое прогрессирование бронхообструктивного синдрома и ДН, увеличение числа обострений ХОБЛ, ухудшение показателей ФВД и снижение толерантности больных к физической нагрузке, особенно выраженное у пациентов с ХОБЛ III-IV стадии и исходно декомпенсированным ХЛС.
Так, к концу 2-х летнего периода наблюдения суммарный индекс, интегрально отражающий тяжесть клинической симптоматики ХОБЛ, возрастал в среднем на 35,6% (с 1,60±0,15 усл. ед. до 2,17±0,16 усл.ед.; р <0,05), среднее число обострений ХОБЛ - на 11,0% (с 2,36±0,15 в год до 2,62±0,14 в год; р >0,05), а толерантность к физической нагрузке снижалась на 20,9% (с 306±17 м до 242±23 м за 6 мин; р <0,05).
Через 2 года наблюдения достоверно снижались по сравнению с исходными данными (р <0,05) ОФВ1, СОС25-75 и ПОСвыд (в среднем, на 9-11% у больных ХОБЛ I-II стадии и на 14-22% у пациентов с ХОБЛ III-IV стадии и исходно декомпенсированным ХЛС).
На протяжении 2-х лет наблюдения почти у 3/4 пациентов с ХОБЛ III-IV стадии и признаками ХЛС (72,7%) отмечено усугубление клинических проявлений ХСН (табл. 9). Признаки правожелудочковой ХСН появились также у 34,8% пациентов с ХОБЛ I-II стадии и исходно компенсированным ХЛС. При этом двухгодичная летальность больных ХОБЛ III-IV стадии достигала 40,9%, превышая смертность пациентов с ХСН, перенесших ИМ (18,2%). Первую комбинированную конечную точку (летальные исходы или/и госпитализация в связи с обострением ХОБЛ) за 2 года наблюдения достигли 63,6% больных с тяжелым течением ХОБЛ III-IV стадии и 30,4% пациентов с ХОБЛ I-II стадии (р <0,05). Вторую комбинированную точку (летальные исходы или/и госпитализация в связи с усугублением или появлением признаков ХСН) достигли 81,8% больных ХОБЛ III-IV стадии и 39,1% пациентов с ХОБЛ I-II стадии (р <0,05).
Таблица 9.
Число больных ХОБЛ и ХЛС, достигших в течение 2-х лет наблюдения
конечных точек
| Группы | n | Летальные исходы от любых причин | Госпитализация из-за обострения ХОБЛ | Госпитали-зация при ухудшении (или появ-лении) ХСН | Достижение 1-й комбиниро-ванной конечной точки | Достижение 2-й комбиниро-ванной конечной точки |
| Больные ХОБЛ I-II стадии и компенсированным ХЛС | ||||||
| Контроль | 23 | 1 (4,3%) | 7 (30,4%) | 8 (34,8%) | 7 (30,4%) | 9 (39,1%) |
| 1-я группа | 23 | - | 3 (13,0%) | 5 (21,7%) | 3 (13,0%) | 5 (21,7%) |
| 2-я группа | 26 | - | 3 (11,5%) | 3 (11,5%) | 3 (11,5%) | 3 (11,5%) |
| 3-я группа | 19 | - | 2 (10,5%) | 2 (10,5%) | 2 (10,5%) | 2 (10,5%) |
| Больные ХОБЛ III-IV стадии и декомпенсированным ХЛС | ||||||
| Контроль | 22 | 9 (40,9%) | 14 (63,6%) | 16 (72,7%) | 14 (63,6%) | 18 (81,8%) |
| 1-я группа | 23 | 9 (39,1%) | 11 (47,8%) | 14 (60,9%) | 12 (52,2%) | 18 (78,3%) |
| 2-я группа | 24 | 7 (29,2%) | 8 (33,3%) | 12 (50,0%) | 10 (41,7%) | 14 (58,3%) |
| 3-я группа | 23 | 7 (30,4%) | 6 (26,1%) | 10 (43,8%) | 9 (39,1%) | 13 (56,5%) |
Примечание: штриховкой отмечены показатели, достоверно отличавшиеся от аналогичных показателей контрольной группы (р <0,05).
В целом неблагоприятное дальнейшее течение заболевания с высоким риском летального исхода и внеплановых госпитализаций за 2 года наблюдалось у 95,6% больных ХОБЛ III-IV стадии с исходно декомпенсированным легочным сердцем и у 43,5% больных ХОБЛ II стадии и исходно компенсированным ХЛС.
Данные, полученные при оценке клинической картины заболевания, подтверждались при анализе динамики основных ЭхоКГ-показателей и процесса ремоделирования правых и левых отделов сердца. Было показано, что у большинства пациентов контрольной группы с ХОБЛ I-II стадии и исходно компенсированным ХЛС уже через год после первичного обследования нарастают, а к концу 2-го года наблюдения становятся максимальными, признаки диастолической дисфункции ПЖ по типу замедленной релаксации (табл. 10). Через 2 года от начала исследования достоверно увеличиваются размеры ПЖ, ПП, уровень СрДЛА, снижается продолжительность изгнания ПЖ (RVET), амплитуда Vmax ЛА, что указывает на появление у части из этих больных умеренно выраженных признаков систолической дисфункции ПЖ, соответствующих начальным проявлениям правожелудочковой ХСН.
У пациентов контрольной группы с ХОБЛ III-IV стадии и исходно декомпенсированным ХЛС через 1 год от начала исследования наблюдается еще более выраженное, чем у пациентов с ХОБЛ I-II стадии, усугубление признаков диастолической дисфункции ПЖ преимущественно по рестриктивному типу, а также значительное и достоверное увеличение размеров ПП и ПЖ. К концу 2-го года эти изменения существенно возрастают и сопровождаются дальнейшим снижением продолжительности изгнания ПЖ (RVET), S% и ростом СрДЛА, что соответствует постепенному увеличению функционального класса ХСН у этих больных.
У части больных ХОБЛ и ХЛС с выраженной эксцентрической ГПЖ, а также у лиц с полной БПНПГ или/и наличием парадоксального диастолического движения МЖП в сторону ЛЖ за время наблюдения появлялись и/или возрастали признаки диастолической дисфункции ЛЖ преимущественно по рестриктивному типу, умеренно увеличивались размеры ЛЖ и ЛП, систолический МС, ММЛЖ, а у пациентов с исходной правожелудочковой декомпенсацией - признаки умеренно выраженной систолической дисфункции ЛЖ в виде снижения ФВлж.
Таким образом, отсутствие систематического и адекватного лечения больных ХОБЛ и ХЛС контрольной группы в большинстве случаев сопровождалось неуклонным прогрессированием не только бронхообструктивного синдрома и ДН, но и процесса ремоделирования правых и левых отделов сердца и усугублением (или появлением) признаков сердечной недостаточности.
Таблица 10.
Динамика систолической и диастолической функции ПЖ у больных ХОБЛ и ХЛС
| Показатели | Группа | ХОБЛ I-II стадии и компенсир. ХЛС | ХОБЛ III-IV стадии и декомпенсир. ХЛС | ||
| Исходные данные | Через 2 года | Исходные данные | Через 2 год | ||
| СрДЛА, мм рт.ст. | Контроль | 23,3±1,0 | 26,1±1,0 | 27,2±1,3 | 30,8±1,2 |
| 1-я группа | 23,7±1,4 | 20,0±1,2 | 25,2±1,3 | 28,0±1,1 | |
| 2-я группа | 22,8±1,3 | 18,5±1,2 | 28,2±1,0 | 25,1±1,2 | |
| 3-я группа | 22,4±1,4 | 16,8±1,3 | 27,9±1,3 | 24,1±1,1 | |
| КДРпж, мм | Контроль | 24,6±0,5 | 28,1±0,6 | 30,7±0,8 | 34,6±1,0 |
| 1-я группа | 26,0±1,3 | 25,2±1,2 | 29,4±1,0 | 32,1±0,9 | |
| 2-я группа | 26,0±1,3 | 23,5±1,2 | 32,2±0,9 | 29,8±0,6 | |
| 3-я группа | 28,2±1,5 | 25,3±1,4 | 33,6±1,0 | 29,6±0,8 | |
| S% | Контроль | 26,2±2,1 | 25,6±2,2 | 17,1±2,0 | 14,7±1,4 |
| 1-я группа | 25,0±2,2 | 24,8±1,3 | 18,7±1,1 | 17,1±1,2 | |
| 2-я группа | 23,6±1,7 | 27,6±1,3 | 15,3±1,4 | 16,2±1,5 | |
| 3-я группа | 24,8±1,5 | 26,7±1,2 | 15,5±1,4 | 16,0±1,3 | |
| TV E/A | Контроль | 1,07±0,02 | 0,86±0,01 | 1,20±0,02 | 2,00±0,03 |
| 1-я группа | 0,98±0,02 | 1,05±0,02 | 1,36±0,02 | 1,75±0,02 | |
| 2-я группа | 0,98±0,02 | 1,12±0,02 | 1,23±0,02 | 1,28±0,01 | |
| 3-я группа | 0,94±0,02 | 1,17±0,02 | 1,15±0,02 | 1,27±0,01 | |
Примечание: штриховкой обозначены данные, достоверно отличающиеся от исходных значений (р <0,05-0,001).
В результате сравнительного анализа информативности клинических проявлений заболевания, показателей ФВД, ЭКГ12, ЭхоКГ и толерантности к физической нагрузке у пациентов с ХОБЛ и ХЛС было показано, что неблагоприятный вариант течения заболевания с высоким риском летальных исходов и быстрым прогрессированием сердечной недостаточности ассоциирован, прежде всего, с тяжестью бронхообструктивного синдрома и ДН, а также с отдельными признаками ремоделирования ПЖ и ЛЖ и некоторыми изменениями ЭКГ12, выявляемыми при первичном обследовании больных.
Рис. 9. Алгоритм ориентировочной диагностики повышенного риска неблагоприятного течения ХЛС и прогрессирования ХСН у больных ХОБЛ.
* - дополнительные признаки представлены в тексте.
Это позволило разработать оригинальный алгоритм ориентировочного прогноза неблагоприятного течения заболевания у больных ХОБЛ и ХЛС (рис. 9). Было доказано, что при ОФВ1 <30% от должных величин (ХОБЛ IV стадии) риск неблагоприятного течения заболевания достигает 100%, при ОФВ1 от 49% до 30% (ХОБЛ III стадии) 88%, а при ОФВ1 50-79% (ХОБЛ II стадии) около 33%. Для уточнения прогноза у пациентов с тяжелым (ХОБЛ III стадии) и среднетяжелым (ХОБЛ II стадии) течением заболевания следует ориентироваться на ряд дополнительных клинических и инструментальных признаков, которые достоверно чаще встречаются именно у больных с неблагоприятным прогнозом. К числу таких дополнительных признаков относятся: 1) возраст старше 60 лет; 2) дистанция 6-минутной ходьбы < 300 м; 3) одышка в покое; 4) отеки, не поддающиеся лечению диуретиками; 5) затяжное течение обострений ХОБЛ; 6) парадоксальное движение МЖП; 7) S% < 25%; 8) КДРпж >33 мм; 9) КДРпп >35 мм; 10) трикуспидальная регургитация II-III ст.; 11) СрДЛА > 24 мм рт. ст.; 12) Р-pulmonale; 13) полная БПНПГ; 14) стойкие суправентркулярные или/и желудочковые аритмии. При наличии у больного 3-х и более дополнительных признаков вероятность неблагоприятного прогноза достигает 80%.
Важным фактором, определяющим характер дальнейшего течения заболевания и скорость формирования и прогрессирования ХСН у больных ХОБЛ и ХЛС, явилась концентрация в крови провоспалительных цитокинов ФНО- и ИЛ-6 [Кубышева Н.И., Постникова Л.Б., 2007; Takabatake N., 2000; Dentener M.A.,. 2001; Debigare R., 2003; Godoy I. 2003; Hageman G.J. J. 2003]. В наших исследованиях повышенный уровень ФНО- и ИЛ-6 у больных ХОБЛ и ХЛС (табл. 11) был ассоциирован со степенью тяжести основного заболевания и выраженностью ДН и ХСН и тесно коррелировал с индивидуальными значениями ОФВ1 (rФНОа = 0,60±0,02 и rИЛ 6 = 0,51±0,02), КДРпж, (rФНОа = +0,43±0,03 и rИЛ 6 = +0,39±0,03), СрДЛА (rФНОа = +0,32±0,02 и rИЛ 6 = +0,30±0,03) и дистанцией 6-минутной ходьбы (rФНОа = 0,56±0,02). Таким образом, была подтверждена взаимосвязь клинических признаков ДН и ХСН с повышенным содержанием в крови цитокинов ФНО- и ИЛ-6.
Таблица 11.
Исходный уровень ФНО- и ИЛ-6 у пациентов с ХОБЛ и ХЛС и благоприятным и неблагоприятным дальнейшим течением заболевания
| Цитокины | Норма | Благоприят-ное течение | Неблагоприят ное течение | Р2-3 |
| 1 | 2 | 3 | ||
| Больные ХОБЛ II стадии и компенсированным ХЛС | ||||
| ФНО, пг/мл | 4,6±0,3 | 6,5±0,4# | 15,4±1,1# | <0,01 |
| ИЛ 6, пг/мл | 6,2±0,4 | 9,6±1,3# | 17,8±1,2# | <0,05 |
| Больные ХОБЛ III-IV стадии и декомпенсированным ХЛС | ||||
| ФНО, пг/мл | 4,6±0,3 | 9,3±1,1# | 23,4±1,4# | <0,01 |
| ИЛ 6, пг/мл | 6,2±0,4 | 12,5±1,4# | 24,3±2,0# | <0,001 |
Примечание: # и штриховка - показатели, достоверно отличающиеся от нормы (р <0,01)
При неблагоприятном течении заболевания средние значения ФНО- и ИЛ-6 превышали аналогичные показатели у больных с относительно благоприятным течением болезни в 2,4-2,5 раза и в 1,8-1,9 раза, соответственно (р <0,01), причем эти отличия были выражены в равной степени как у больных с умеренными клиническими проявлениями ХОБЛ II стадии и компенсированным легочным сердцем, так и у пациентов с тяжелым течением ХОБЛ III-IV стадии и декомпенсированным ХЛС. Иными словами, в отличие от больных ХСН, перенесших ИМ, у больных ХОБЛ и ХЛС влияние цитокинов на характер течения заболевания прослеживается уже на относительно ранних стадиях формирования легочного сердца, по крайней мере, у пациентов с ХОБЛ II стадии и компенсированным легочным сердцем, что связано, вероятно, с влиянием на систему цитокинов сохраняющегося в бронхолегочной системе хр. воспаления.
Таким образом, индивидуальные значения провоспалительных цитокинов, у больных ХОБЛ и ХЛС могут быть использованы в качестве дополнительных маркеров неблагоприятного прогноза заболевания, который у больных с ХОБЛ II стадии и компенсированным легочным сердцем ассоциирован с уровнем ФНО- выше 9,5 пг/мл и ИЛ-6 - выше 12,5 пг/мл. У пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС прогностически значимое содержание ФНО- составляет больше 14,2 пг/мл, а ИЛ-6 - больше 15,8 пг/мл. Вероятность правильного прогноза на основании приведенных критериев составляет 70-77%.
4. Эффективность длительного комбинированного
лечения больных ХОБЛ и ХЛС
Лечение салметеролом в сочетании с противовоспалительной
терапией фенспиридом или флутиказоном
Под влиянием комбинированной терапии салметеролом (серевентом) и фенспиридом у больных ХОБЛ I-II стадии и компенсированным ХЛС наблюдалось быстрое и значительное уменьшение суммарного индекса клинических симптомов заболевания на 35,9%, числа обострений ХОБЛ на 51,1% и увеличение толерантности больных к физической нагрузке на 14,3% и ОФВ1 на 13,1% (р <0,05-0,01), что сопровождалось к концу 2-го года лечения снижением в 2,3-1,8 раза по сравнению с группой контроля частоты достижения 1-й и 2-й комбинированных конечных точек (см. табл. 9).
Менее значимые результаты были получены у больных 1-й группы с исходно тяжелым течением заболевания (ХОБЛ III-IV стадии и декомпенсированным ХЛС), у которых положительный клинический эффект комбинированной терапии салметеролом и флутиказоном был менее выраженным. Так, суммарный индекс клинических симптомов заболевания через 2 года лечения недостоверно уменьшился на 13,2%, число обострений ХОБЛ – на 5,4%, толерантность к физической нагрузке возросла на 10,3%, а ОФВ1 на 11,9% и (р >0,05). Следует добавить, что у больных ХОБЛ III-IV стадии частота достижения 1-й и 2-й комбинированных конечных точек (52,2% и 78,3%) и летальность (39,1%) мало отличались от аналогичных показателей в группе контроля.
На фоне комбинированной терапии у значительной части больных наблюдалось увеличение (или появление) признаков сердечной недостаточности. Только у пациентов с ХОБЛ I-II стадии и компенсированным легочным сердцем выявлялась слабо выраженная и недостоверная тенденция (р >0,05) к уменьшению этого показателя, а также частоты достижения 2-й комбинированной конечной точки (21,7%) по сравнению с контрольной группой больных (34,8% и 39,1%). При исходно тяжелом течении заболевания (ХОБЛ III-IV стадии) почти у 60,9% больных 1-й группы происходило усугубление клинических признаков сердечной декомпенсации.
По данным ЭхоКГ-исследования у большинства больных ХОБЛ I-II стадии и компенсированным ХЛС к концу 2-го года лечения салметеролом и фенспиридом наблюдалось достоверное снижение уровня СрДЛА (р <0,05), а также некоторая стабилизация остальных морфофункциональных показателей ПЖ (см. табл. 10), что можно расценить как небольшое положительное влияние комбинированной терапии на систолическую и диастолическую функцию ПЖ, обусловленную, вероятно, уменьшением вентиляционных нарушений, гипоксической вазоконстриции и СрДЛА у больных ХОБЛ I-II стадии и компенсированным ХЛС. Совершенно иные данные были получены при анализе ЭхоКГ-показателей у больных с тяжелым течением ХОБЛ III-IV стадии. За время наблюдения у большинства больных происходило ухудшение систолической и диастолической функции ПЖ (увеличение КДРпж и КСРпж, отношения Е/Апж, уменьшение RVET), а также повышение уровня СрДЛА, хотя скорость подобных изменений оказалась несколько меньше, чем у пациентов контрольной группы с тяжелым течением заболевания.
Таким образом, комбинированная терапия салметеролом и фенспиридом у больных с легким и среднетяжелым течением заболевания оказывала определенное положительное влияние на морфофункциональные показатели правых и левых отделов сердца. У пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС комбинации салметерола и флутиказона было недостаточно для того, чтобы приостановить процесс ремоделирования ПЖ и ЛЖ и прогрессирование ХЛС и ХСН, хотя это не исключает временного улучшения качества жизни больных и уменьшения клинических признаков бронхообструктивного синдрома и ДН.
Лечение салметеролом в сочетании с противовоспалительной
терапией фенспиридом или флутиказоном и иАПФ
периндоприлом или лизиноприлом
Под влиянием комбинированной терапии салметеролом, фенспиридом и иАПФ у больных ХОБЛ I-II стадии наблюдалось сравнительно быстрое и значительное уменьшение всех симптомов заболевания (уменьшение суммарного индекса на 44,7%), достоверное увеличение толерантности больных к физической нагрузке (на 19,7%) и уменьшение числа обострений ХОБЛ (на 50%). В отличие от пациентов 1-й основной группы, терапия с использованием серетида и иАПФ дополнительно увеличивала положительный противовоспалительный эффект у больных с тяжелым течением заболевания (ХОБЛ III-IV стадии и декомпенсированным ХЛС), у которых существенно снижались суммарный индекс клинических симптомов (на 36,9%), частота обострений ХОБЛ (на 17,3%) и достижения 1-й комбинированной конечной точки (41,7%), а также на 37% увеличивалась толерантность к физической нагрузке.
Под влиянием терапии с использованием иАПФ уже на протяжении 1-го года лечения наблюдался выраженный бронходилатационный эффект, который выражался в достоверном увеличении ОФВ1 (на 19,0%), индекса Тиффно, СОС25-75, и ПОСвыд, причем не только у больных с легким и среднетяжелым течением заболевания (ХОБЛ I-II стадии), но и у пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС.
У большинства больных ХОБЛ в течение 1-го и 2-го года лечения удалось приостановить или существенно снизить скорость дальнейшего прогрессирования процесса ремоделирования сердца и падения систолической и диастолической функции правых и левых отделов сердца (табл. 10), а также уменьшить СрДЛА, что коррелировало с улучшением клинической картины заболевания. В отличие от пациентов 1-й группы, комбинированное лечение с использованием иАПФ приводило к более выраженному и достоверному снижению СрДЛА (на 11,0%), КДРпж (на 7,4%), КСРпж (на 8,7%) и размеров ПП на 10,8% (р <0,05) и тенденции к нормализации диастолической функции ПЖ (р <0,001), в том числе у больных ХОБЛ III-IV стадии и декомпенсированным ХЛС, у которых была отмечена недостоверная тенденция к снижению летальности и частоты достижения 2-й комбинированной конечной точки (на 25,6% и 25,5% по сравнению с пациентами 1-й группы).
Таким образом, длительная комбинированная терапия иАПФ, салметеролом и флутиказоном больных ХОБЛ III-IV стадии и декомпенсированным ХЛС позволяет несколько снизить тяжесть клинических проявлений правожелудочковой сердечной недостаточности, а у пациентов с легким и среднетяжелым течением ХОБЛ I-II стадии и компенсированным ХЛС терапия иАПФ дает возможность «отсрочить» возникновение декомпенсации ХЛС и появления первых клинических признаков сердечной недостаточности.
Лечение салметеролом, ингибиторами АПФ и
пентоксифиллином в сочетании с противовоспалительной
терапией
Как видно из таблицы 9, клиническая эффективность длительной терапии больных ХОБЛ и ХЛС с использованием иАПФ, салметерола, противовоспалительных ЛС и пентоксифиллина (3-я группа) в целом оказалась столь же высокой, как и у пациентов 2-й группы, хотя у части больных некоторые критерии такой эффективности были выше, чем у пациентов 2-й группы. Так, к концу 2-го года лечения суммарный индекс клинических симптомов у больных 3-й группы с ХОБЛ I-II стадии (0,62±0,06 усл. ед.) и III-IV стадии (0,74±0,08 усл. ед.) был на 25,3% и 28,8% меньше, толерантность к физической нагрузке - на 6,3% и 10,1% выше, а показатель ОФВ1 - на 12,0% и 23,8% больше, чем у пациентов 2-й группы (р <0,05-0,01). Выявлялась также недостоверная тенденция к уменьшению числа обострений ХОБЛ (на 8,9% и 13,5%) и частоты усугубления (или появления) признаков ХСН (на 8,7% и 13,0%) по сравнению с пациентами 2-й группы. Таким образом, клинический эффект включения в состав комбинированной терапии пентоксифиллина был отмечен и у больных с тяжелым течением заболевания и исходно декомпенсированным ХЛС. Тем не менее, это не сопровождалось сколько-нибудь существенным снижением летальности этих больных и частоты достижения комбинированных конечных точек по сравнению с пациентами 2-й группы.
Следует подчеркнуть, что дополнительный прием пентоксифиллина у больных 3-й группы оказывал заметное положительное действие на диастолическую функцию ПЖ и ЛЖ, существенно превышавшее аналогичное влияние комбинированной терапии без использования пентоксифиллина у больных 2-й группы (табл. 10). В то же время достоверное уменьшение СрДЛА, размеров ПЖ и ПП, снижение систолического МС и ИС и увеличение ФВлж (у больных ХОБЛ III-IV стадии и декомпенсированным ХЛС), отражавшее в основном улучшение систолической функции обоих желудочков, практически не отличалось у больных 2-й и 3-й групп, и являлось следствием положительного эффекта иАПФ, включенных в состав терапии обеих сравниваемых групп.
Влияние длительной комбинированной терапии на
концентрацию ФНО- и ИЛ-6 у больных ХОБЛ и ХЛС
У пациентов с ХОБЛ и ХЛС контрольной группы уровень ФНО- к концу двухлетнего периода наблюдения увеличился на 27,6-30,8%% по сравнению с исходным уровнем (р <0,05). Ту же динамику претерпевал уровень ИЛ-6, средние значения которого возросли за 2 года наблюдения на 21,2-25,9%.
Длительное лечение больных 1-й группы салметеролом в сочетании с противовоспалительной терапией фенспиридом (у пациентов с ХОБЛ I-II стадии) и флутиказоном (у больных ХОБЛ III-IVстадии) независимо от исходной тяжести заболевания сопровождалась некоторым замедлением возрастания концентрации ФНО- (недостоверное увеличение показателя на 8,8-9,3%), а у пациентов 2-й группы, получавших комбинированную терапию с использованием иАПФ, уровень ФНО-а уменьшился и оказался на 20-21% меньше, чем у пациентов контрольной группы (р <0,05), что свидетельстовало о выраженном антицитокиновом эффекте, обусловленном применением иАПФ.
Максимальное антицитокиновое действие комбинированной терапии было выявлено при включении в ее состав систематического приема пентоксифиллина в дозе 800 мг в сутки (3-я группа). При этом к концу 2-го года лечения содержание ФНО- у больных ХОБЛ I-II стадии с компенсированным ХЛС снизилось на 15,9% (р >0,05), а у пациентов с исходно тяжелым течением заболевания (ХОБЛ III-IV стадии) и декомпенсированным легочным сердцем - на 16,5% (р <0,05), что было на 24-27% меньше, чем у больных группы контроля (р <0,05). Аналогичную динамику претерпевал уровень ИЛ-6.
Таким образом, включение в состав комбинированной терапии больных 3-й группы пентоксифиллина сопровождалось наиболее выраженным антицитокиновым действием, причем не только у больных ХОБЛ III-IV стадии и декомпенсированным ХЛС, (как у пациентов с ХСН III-IV ФК, перенесших ИМ, но и у больных с легкой и умеренной тяжестью заболевания и компенсированным легочным сердцем. На наш взгляд, это является косвенным подтверждением того, что формирование и прогрессирование ХЛС и сердечной недостаточности, даже на самых ранних этапах этого процесса у больных ХОБЛ I-II стадии в значительной степени связано с высоким уровнем цитокинов, обусловленным хроническим воспалением в бронхолегочной системе и последствиями постоянной или преходящей гипоксемии.
Выводы
- Независимо от формы перенесенного ИМ (крупно- или мелкоочаговой) у значительной части больных контрольной группы на протяжении 5 послеинфарктных лет наблюдается неуклонное прогрессирование ХСН, признаков хронической КН, снижение толерантности к физической нагрузке, высокая частота повторных ИМ (31-36%) и летальных исходов (34-36%). Эти изменения ассоциируются с прогрессированием признаков постинфарктного и ишемического ремоделирования ЛЖ, который максимально выражен на протяжении первого года после инфаркта и характеризуется постепенным увеличением систолического МС, индекса ММЛЖ, сферизацией желудочка, расширением его полости и формированием умеренной систолической и выраженной диастолической дисфункции ЛЖ и ПЖ.
- На протяжении первых 2-х послеинфарктных лет летальные исходы, случаи выявления тяжелой ХСН III-IV ФК, снижения толерантности к физической нагрузке, а также диастолической и систолической дисфункции ЛЖ чаще наблюдаются у больных, перенесших «Q-ИМ», тогда как частота приступов стенокардии эпизодов болевой и безболевой ишемии миокарда и число повторных ИМ выше у больных, перенесших «не-Q-ИМ». К концу 2-3-го года после ИМ разница в частоте выявления этих признаков у больных обеих подгрупп резко уменьшается, а к концу 4-5-го года наблюдения средние значения ФК ХСН, шкалы ШОКС, результаты нагрузочных тестов, частота достижения комбинированной конечной точки, а также признаки систолической и диастолической дисфункции ЛЖ и ПЖ у больных, перенесших различные формы ИМ, не отличались друг от друга.
- К числу прогностически значимых ФР неблагоприятного дальнейшего течения ИБС и ХСН у больных, перенесших ИМ, относятся возраст больных >70 лет, наличие СД, АГ III степени или ХСН III ФК, ранняя постинфарктная стенокардия, наличие болевой или безболевой ишемии миокарда длительностью 22 мин/с при ЧСС < 96 уд./мин и/или снижение дистанции 6-минутной ходьбы <300 м, а у больных, перенесших «не-Q-ИМ» (дополнительно) уменьшение ФВлж <45% и увеличение индивидуальных значений шкалы ШОКС больше 4,5 баллов. Несмотря на высокую положительную предсказательную ценность перечисленных ФР (73-100%), их использование для 2х-летнего прогноза заболевания ограничено в связи с относительно низкой чувствительностью (частотой выявления в группе больных с неблагоприятном течением заболевания), не превышающей 64%.
- Разработанный нами анализ сегментарной электрической активности ЛЖ в покое и при физической нагрузке у больных, перенесших ИМ, позволяет точно оценивать локализацию и распространенность постинфарктного рубца, определять признаки компенсаторной гиперфункции отдельных сегментов ЛЖ, выявлять преходящую посленагрузочную ишемию миокарда, а также феномен «электрической гибернации» сегментов, косвенно отражающий наличие жизнеспособного (гибернирующего) миокарда преимущественно в области постинфарктного рубца. Эти признаки, а также степень асинхронизма возбуждения отдельных сегментов ЛЖ могут быть использованы в качестве дополнительных критериев прогноза неблагоприятного течения заболевания у больных, перенесших ИМ.
- Независимо от формы перенесенного ИМ, важным ФР, определяющим 2х-летний прогноз ХСН, является концентрация провоспалительных цитокинов в крови (ФНО- и ИЛ-6), исходный уровень которых у пациентов с неблагоприятным течением заболевания в 1,5-3,0 раза выше, чем при благоприятном течении. Индивидуальные значения цитокинов тесно коррелируют с систолическим МС, выраженностью диастолической дисфункции ЛЖ (отношением Е/Алж) и ФК ХСН.
- Длительное лечение больных ХСН, перенесших ИМ, иАПФ периндоприлом или БРА кандесартаном в сочетании с 1-адреноблокаторами оказывает положительное влияние на процессы постинфарктного ремоделирования ЛЖ и ПЖ, замедляя дальнейшее увеличение ММЛЖ, изменение геометрии ЛЖ, расширение полостей и снижение систолической и диастолической функции желудочков, а также недостоверно уменьшает летальность, частоту повторных ИМ и скорость прогрессирования ХСН, снижая риск неблагоприятного течения заболевания на 22-25%. Эффект лечения кандесартаном вполне сопоставим с эффектом терапии периндоприлом, за исключением меньшего влияния препарата на диастолическую функцию ЛЖ и ПЖ и летальность. В то же время кандесартан способствует более выраженному уменьшению СрДЛА и клинических проявлений ХСН.
- Длительное лечение больных ХСН иАПФ и карведилолом оказывает максимальное положительное влияние на процессы постинфарктного ремоделирования ЛЖ и ПЖ и прогноз заболевания, способствуя достоверному уменьшению риска неблагоприятного течения заболевания на 42,6% и летальность от сердечно-сосудистых осложнений и ХСН на 55%. Добавление к терапии периндоприлом и карведилолом пентоксифиллина сопровождается, прежде всего, более быстрым и выраженным уменьшением клинических проявлений ХСН, особенно у больных ХСН III ФК, что коррелирует с более выраженным снижением СрДЛА и признаков систолической и диастолической дисфункции ЛЖ и ПЖ.
- Комбинированная терапия больных ХСН, перенесших ИМ, с использованием карведилола обладает более выраженным антиангинальным и антиишемическим эффектом, чем терапия селективными 1-адреноблокаторами, и сопровождается достоверным уменьшением ЭКГ-картографических признаков преходящей посленагрузочой ишемии миокарда ЛЖ и увеличением сегментарной электрической активности и скорости активации жизнеспособного миокарда, расположенного в непосредственной близости от постинфарктного рубца, что приводит к уменьшению асинхронизма возбуждения сегментов ЛЖ, снижению систолического МС и возрастанию ФВлж. Аналогичная динамика на фоне лечения 1-адреноблокатором менее выражена и не достоверна.
- Длительное применение иАПФ или БРА в сочетании с селективными 1-адреноблокаторами позволяет несколько замедлить прогрессирующее увеличение ФНО- и ИЛ-6, характерное для больных контрольной группы, тогда как терапия карведилолом и иАПФ сопровождается значительно более выраженным и достоверным снижением уровней провоспалительных цитокинов, преимущественно у пациентов с ХСН III ФК. Добавление пентоксифиллина к терапии карведилолом и иАПФ на 30% увеличивает антицитокиновый эффект комбинированной терапии, но только у больных с более тяжелым течением ХСН III ФК, у которых повышение концентрации ФНО- и ИЛ-6 имеет, вероятно, существенно большее патогенетическое значение в прогрессировании ХСН, чем у больных с начальными проявлениями сердечной недостаточности.
- Наиболее общей закономерностью течения ХОБЛ и ХЛС у значительной части больных контрольной группы является дальнейшее прогрессирование бронхообструктивного синдрома и ДН, ухудшение показателей ФВД и снижение толерантности больных к физической нагрузке, что сопровождается также усугублением или появлением симптомов правожелудочковой сердечной недостаточности. Такое неблагоприятное течение заболевания с высоким риском летального исхода и внеплановых госпитализаций, связанных с прогрессированием ХСН и/или ДН, наблюдается у подавляющего большинства больных ХОБЛ III-IV стадии с исходно декомпенсированным ХЛС, двухгодичная летальность которых достигает 41%, и у 43,5% больных ХОБЛ II стадии с исходно компенсированным ХЛС.
- У большинства пациентов с ХОБЛ и ХЛС контрольной группы на протяжении 2-х лет наблюдения быстро нарастают признаки диастолической дисфункции ПЖ по I или II типу, достоверно увеличиваются размеры ПЖ, ПП, уровень СрДЛА, снижается продолжительность изгнания ПЖ (RVET), амплитуда Vmax ЛА и величина S%, что указывает на появление или прогрессирование признаков систолической дисфункции ПЖ. У части больных ХОБЛ и ХЛС с выраженной эксцентрической ГПЖ, а также у лиц с полной БПНПГ за время наблюдения появляются и/или возрастают признаки диастолической дисфункции ЛЖ, умеренно увеличиваются размеры ЛЖ и ЛП, систолический МС, ММЛЖ, а у пациентов с исходной правожелудочковой декомпенсацией - признаки умеренно выраженной систолической дисфункции ЛЖ в виде снижения S% и ФВлж.
- Высокий риск прогрессирования правожелудочковой ХСН и летальных исходов у больных ХОБЛ и ХЛС ассоциирован с наличием при первичном обследовании признаков выраженного бронхообструктивного синдрома и ДН, снижением ОФВ1 ниже 50%, увеличением СрДЛА > 24 мм рт. ст., возрастом больных старше 60 лет, а также с клиническими и ЭхоКГ-признаками систолической и диастолической дисфункции ПЖ, наличием эксцентрической ГПЖ и/или полной БПНПГ и повышенным уровнем провоспалительных цитокинов (ФНО- и ИЛ-6), влияние которых на характер течения заболевания прослеживается уже на относительно ранних стадиях формирования ХЛС у больных с ХОБЛ II стадии и компенсированным ХЛС. Положительная предсказательная ценность перечисленных критериев неблагоприятного прогноза достигает 73-90%.
- Концентрация ФНО- и ИЛ-6 у больных ХОБЛ и ХЛС коррелирует с выраженностью хронического воспалительного процесса в бронхолегочной системе, степенью ДН, а также с выраженностью ХСН, толерантностью к физической нагрузке, индивидуальными значениями ОФВ1, S%, КДРпж и СрДЛА. При этом отсутствие адекватной систематической терапии больных ХОБЛ и ХЛС контрольной группы в большинстве случаев сопровождается неуклонным увеличением ФНО- и ИЛ-6, отражая влияние цитокинов на характер течения заболевания и скорость прогрессирования сердечной недостаточности не только у больных с исходно тяжелым течением заболевания, но и у пациентов с ХОБЛ II стадии и компенсированным ХЛС.
- Эффективным способом медикаментозного лечения больных ХОБЛ и ХЛС является комбинированная терапия салметеролом и ингибитором АПФ в сочетании с фенспиридом (у пациентов с ХОБЛ I-II стадии и компенсированным ХЛС) или флутиказоном (у пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС), которая отличается выраженным бронходилатационным и противовоспалительным эффектом, уменьшением частоты обострений ХОБЛ и достижения 1-й комбинированной конечной точки, слабо выраженной тенденцией к уменьшению концентрации ФНО- и ИЛ-6, что сопровождается снижением СрДЛА, скорости дальнейшего прогрессирования процесса ремоделирования и падения систолической и диастолической функции ПЖ и ЛЖ и коррелирует с увеличением толерантности к физической нагрузке, тенденцией к небольшому снижению общей летальности и частоты прогрессирования (или появления) признаков ХСН. Эффект наблюдается не только у больных с легким и среднетяжелым течением заболевания, но и у пациентов с ХОБЛ III-IV стадии и декомпенсированным ХЛС.
- Включение пентоксифиллина в состав комбинированного лечения больных ХОБЛ и ХЛС сопровождается выраженным антицитокиновым действием, дополнительным уменьшением клинических проявлений бронхообструктивного синдрома и ДН, тенденцией к уменьшению частоты обострений заболевания, еще большим увеличением толерантности больных к физической нагрузке, показателей ФВД, некоторым уменьшением симптомов сердечной недостаточности и улучшением диастолической функции ПЖ и ЛЖ, хотя и не оказывает влияния на общую летальность и частоту достижения больными комбинированных конечных точек.
Практические рекомендации
1. При подборе индивидуальных схем лечения больных ХСН с постинфарктным кардиосклерозом следует учитывать, что у значительной части больных контрольной группы, перенесших мелкоочаговый «не-Q-ИМ», отдаленный прогноз заболевания ничуть не лучше, чем у пациентов, перенесших крупноочаговый «Q-ИМ». На протяжении 2-х послеинфарктных лет у 36% больных с мелкоочаговым кардиосклерозом сохраняется высокий риск летальных исходов, повторных ИМ, быстрого прогрессирования сердечной недостаточности и снижения систолической и диастолической функции ЛЖ. Через 4-5 лет после ИМ риск неблагоприятного течения заболевания, летальных исходов и тяжести сердечной недостаточности практически не зависит от формы перенесенного ИМ.
2. У больных ХСН, перенесших различные формы ИМ, целесообразно использовать разработанный нами алгоритм прогноза, основанный на клинических данных, некоторых ЭхоКГ-изменениях, результатах анализа сегментарной электрической активности ЛЖ и значениях концентрации провоспалительных цитокинов ФНО- и ИЛ-6. При этом определяющими факторами неблагоприятного прогноза являются передняя локализация ИМ, высокий ФК ХСН, возраст больных старше 70 лет, наличие сопутствующих СД или АГ III степени, а также результаты оценки шкалы ШОКС, теста 6-минутной ходьбы, данных ХМ, толерантность к физической нагрузке, ФВлж и др. При отсутствии у больных перечисленных признаков или задней локализации инфаркта необходим дополнительный анализ нарушений сегментарной электрической активности ЛЖ и уровня цитокинов, что позволяет повысить достоверность правильного прогноза до 80-85%.
3. При проведении анализа сегментарной электрической активности ЛЖ с использованием методики многополюсного ЭКГ-картирования сердца у больных ХСН, перенесших ИМ, критериями неблагоприятного прогноза заболевания и быстрого прогрессирования ХСН являются:
- У больных, перенесших заднедиафрагмальный (нижний) ИМ, независимо от его формы (крупно- или мелкоочаговой) - а) наличие ЭКГ-картографических признаков посленагрузочной ишемии миокарда передней стенки ЛЖ, б) малая выраженность признаков «электрической гибернации» в сегментах, непосредственно граничащих с рубцовой зоной (< 1), и в) асинхронизм деполяризации сегментов передней стенки ЛЖ после физической нагрузки >13 мс, г) среднее время активации сегментов передней стенки > 52 мс
- У больных, перенесших передний ИМ, - а) значительная распространенность постинфарктного рубца передней стенки (более 18% от площади картограммы у больных - при крупноочаговом ПИКС), б) ишемия сегментов передней стенки ЛЖ, в) асинхронизм возбуждения сегментов передней стенки ЛЖ после физической нагрузки > 15 мс г) малая выраженность признаков «электрической гибернации».
4. Для ориентировочного прогноза неблагоприятного течения заболевания у больных ХОБЛ и ХЛС, можно воспользоваться разработанным нами алгоритмом, основанным на оценке изменений показателей ФВД (ОФВ1), клинических данных и некоторых ЭхоКГ- и ЭКГ-изменений. Для уточнения прогноза у пациентов с тяжелым (ХОБЛ III стадии) и среднетяжелым (ХОБЛ II стадии) течением заболевания следует ориентироваться на ряд дополнительных клинических и инструментальных признаков, которые достоверно чаще встречаются именно у больных с неблагоприятным прогнозом. К числу таких дополнительных признаков относятся: 1) возраст старше 60 лет; 2) дистанция 6-минутной ходьбы < 300 м; 3) одышка в покое; 4) отеки, не поддающиеся лечению диуретиками; 5) затяжное течение обострений ХОБЛ; 6) парадоксальное движение МЖП; 7) S% < 25%; 8) КДРпж >33 мм; 9) КДРпп >35 мм; 10) трикуспидальная регургитация II-III ст.; 11) СрДЛА > 24 мм рт. ст.; 12) Р-pulmonale; 13) полная БПНПГ; 14) стойкие суправентркулярные или/и желудочковые аритмии. При наличии у больного 3-х и более дополнительных признаков вероятность неблагоприятного прогноза - 80%.
5. Содержание провоспалительных цитокинов ФНО- и ИЛ-6 у больных ХСН различного генеза, может служить независимым маркером дальнейшего неблагоприятного течения заболевания, в том числе прогрессирования сердечной недостаточности и повышенного риска летальных исходов. При этом у больных ХСН, перенесших ИМ, предсказательная ценность ФНО- >10 пг/мл достигает 86%, а ИЛ-6 >12,0 пг/мл 74%. Прогноз неблагоприятного течения заболевания у больных ХОБЛ и ХЛС превышает 70% при концентрации ФНО- >9,5 пг/мл и ИЛ-6 >12,5 пг/мл у больных с компенсипрованным ХЛС и ФНО- >14,2 пг/мл и ИЛ-6 >15,8 пг/мл - у пациентов с декомпенсированным легочным сердцем.
6. Всем больным ХСН I-IV ФК по NYHA, перенесшим ИМ, независимо от его формы (крупно- или мелкоочаговой) показано длительное медикаментозное лечение иАПФ или БРА в сочетании с блокаторами адренергических рецепторов. Наибольшим клиническим эффектом обладает сочетанное применение иАПФ и 1-1,2-адреноблокатора карведилола, длительное применение которых оказывает максимальное положительное влияние на процессы постинфарктного ремоделирования ЛЖ и ПЖ и прогноз заболевания, способствуя достоверному уменьшению риска неблагоприятного течения заболевания и снижению летальности.
7. С целью повышения эффективности длительного медикаментозного лечения больных ХОБЛ и ХЛС в состав комплексной терапии необходимо включать иАПФ периндоприл или лизиноприл в сочетании с высокоселективным 2-адреномиметиком пролонгированного действия салметеролом (серевентом) по 50 мкг 2 раза в день, противовоспалительными препаратами: фенспиридом (у больных ХОБЛ II стадии и компенсированным ХЛС) по 80 мг 2 раза в день или ингаляционным ГКС флутиказоном (комбинированный препарат серетид) по 250 мкг 2 раза в день (у больных с ХОБЛ III-IV стадии и декомпенсированным ХЛС).
8. Добавление пентоксифиллина в дозе 800 мг в сутки к комбинированной терапии больных с сердечной недостаточностью показано у пациентов с ХСН III-IV ФК, перенесших различные формы ИМ, а также у больных ХОБЛ и ХЛС, причем в последнем случае независимо от стадии ХОБЛ и наличия или отсутствия признаков декомпенсированного ХЛС. Систематическое применение пентоксифиллина сопровождается у этих больных выраженным антицитокиновым эффектом, что способствует дополнительному уменьшению клинических проявлений ДН и ХСН, увеличению толерантности к физической нагрузке, улучшению диастолической функции ПЖ и ЛЖ, хотя и не оказывает влияния на летальность и частоту достижения больными комбинированных конечных точек.
Список работ, опубликованных по теме диссертации:
1. Садовникова И.И., Бакаев Р.Г. Сивцева А.И. // Эффективность курсового лечения больных с декомпенсированным легочным сердцем изосорбид-5-мононитратом и периндоприлом // В книге: Факторы риска, адаптация, первичная и вторичная профилактика хронических неинфекционных заболеваний. Материалы Всероссийской конференции с международным участием 14–15 июня 2001 г. – Иваново, 2001. –С. 193–195.
2. Струтынский А.В., Глазунов А.Б., Бакаев Р.Г., Сивцева А.И. // Влияние изосорбид-5-мононитрата и периндоприла на гемодинамику малого и большого кругов кровообращения у больных с легочным сердцем // В книге: Реабилитология. Сборник научных трудов. М., 2003. – С. 238–242
3. Струтынский А.В., Глазунов А.Б., Сивцева А.И., Бакаев Р.Г. // Изменение систолической и диастолической функции правого желудочка у больных ХОБЛ и хроническим легочным сердцем под влиянием длительного лечения периндоприлом // В книге: Спорные и нерешенные вопросы сердечной недостаточности. Материалы Всероссийской ежегодной научной конференции – М., 2003 – С. 43
4. Сивцева А.И, Струтынский А.В., Глазунов А.Б., Бакаев Р.Г. // Динамика систолической и диастолической функции ПЖ у больных ХОБЛ и ХЛС под влиянием длительного лечения периндоприлом и эреспалом.// В книге: Актуальные проблемы современной медицины. Материалы международной научно-практической конференции, посвященной памяти Маймонида 30-31 мая 2005 г. – М., 2005. - С. 69
5. Струтынский А.В., Сивцева А.И., Бакаев Р.Г. // Систолическая и диастолическая функция левого желудочка у больных хроническим легочным сердцем.// В книге: Материалы Российского национального конгресса кардиологов и конгресса кардиологов стран СНГ, М., 2007. – С.73.
6. Струтынский А.В., Бакаев Р.Г., Сивцева А.И // Эффективность длительной терапии бронхолитиками, фенспиридом и ингибитором АПФ периндоприлом больных с хроническим легочным сердцем // В книге: Материалы Российского национального конгресса кардиологов, М., 2007. – С.86.
7. Струтынский А.В., Глазунов А.Б., Бакаев Р.Г., Сивцева А.И. // Особенности ремоделирования правых и левых отделов сердца у больных ХОБЛ и легочным сердцем // Сердечная недостаточность, 2007. – Т. 8. - №6. – С. 284-288.
8. Струтынский А.В., Сивцева А.И., Бакаев Р.Г. // Эффективность длительной терапии фенспиридом и ингибитором АПФ периндоприлом больных ХОБЛ и ХЛС // Врач, 2007. - №8. – С. 56-61.
9. Кучеренко В.З., Струтынский А.В., Бакаев Р.Г. // Клинико-экономическое обоснование длительной дифференцированной терапии больных, перенесших инфаркт миокарда без зубца Q, ингибитором АПФ периндоприлом и неселективным блокатором адренорецепторов карведилолом. // Проблемы управления здравоохранением, 2007. № 5. С. 74-79.
10. Глазунов А.Б., Струтынский А.В., Бакаев Р.Г. // Возможности выявления электрической негомогенности миокарда у больных ХСН и желудочковыми аритмиями с помощью поверхностного многополюсного ЭКГ-картирования сердца. // В книге: Материалы 1Х Всероссийского конгресса РОХМИНЭ «Неинвазивная электрокардиология в клинической медицине» 13-15 мая 2008 г. – М., 2008. – С. 60.
11. Глазунов А.Б., Струтынский А.В., Бакаев Р.Г., Сивцева А.И. // Особенности ЭПС при синдроме Бругада и блокадах правой ножки пучка Гиса // Там же. - С. 64.
12. Струтынский А.В., Сивцева А.И., Бакаев Р.Г. // Особенности ремоделирования ЛЖ у женщин раннего постменопаузального периода с сердечной недостаточностью, АГ и ИМТ // Вестник новых медицинских технологий, 2008. - №3. – С. 53-55.
13. Струтынский А.В., Сивцева А.И., Бакаев Р.Г. // Информативность клинических и инструментальных критериев диагностики легочного сердца у больных ХОБЛ // Клиническая медицина, 2008. - №10. – С. 45-49.
14. Струтынский А.В., Сивцева А.И., А.Б. Глазунов, Р.Г. Бакаев, Е.Н. // Особенности ремоделирования левых отделов сердца у больных ХОБЛ и легочным сердцем // Вестник новых медицинских технологий, 2008. - №4. – С. 42-44.
15. Струтынский А.В., Глазунов А.Б., Бакаев Р.Г // Возможности многополюсного ЭКГ-картирования сердца в выявлении электрической негомогенности миокарда у больных ИБС и ХСН с желудочковыми аритмиями // Сердце, 2008. Т. 7. № 5. С. 294-298.
16. Бакаев Р.Г., Банзелюк Е.Н., Борискина Т.В. // Особенности ремоделирования ЛЖ у больных с ХСН в зависимости от наличия избыточной массы тела и АГ // Вестник новых медицинских технологий, 2008. Т. 15. № 03. С. 53-55.
17. Струтынский А.В., Бакаев Р.Г., Банзелюк Е.Н. // Особенности ремоделирования левых отделов сердца у больных ХОБЛ и ХЛС // Вестник новых медицинских технологий, 2008. Т. 15. № 03. С. 188-190.
18. Струтынский А.В., Бакаев Р.Г., Сивцева А.И. // Эффективность длительной терапии бронхолитиками, фенспиридом и ингибитором АПФ периндоприлом больных с хроническим легочным сердцем // Кардиоваскулярная терапия и профилактика, 2008. Т. 7. № S22. С. 354a-354.
19. Глазунов А.Б., Струтынский А.В., Вахромеева М.Н., Бакаев Р.Г. // ЭКГ-картографическое выявление очаговых нарушений перфузии и жизнеспособного миокарда у пациентов с различными формами ишемической болезни сердца. Кардиоваскулярная терапия и профилактика, 2008. Т. 7. № S2. С. 89a-89.
20. Струтынский А.В., Каллаева А.Н., Бакаев Р.Г. // Влияние длительной терапии на постинфарктное ремоделирование. // Врач, 2008; 9: 72-74.
21. Струтынский А.В., Кочетова С.И., Бакаев Р.Г., Глазунов А.Б. // Взаимосвязь процессов ремоделирования ЛЖ и избыточной массы тела, АГ и расстройств вегетативной регуляции // Врач, 2008; 6: 77-80.
22. Струтынский А.В., Сивцева А.И., Бакаев Р.Г. // Информативность клинических и инструментальных критериев диагностики легочного сердца у больных ХОБЛ // Клиническая медицина, 2008; 10: 45-49.
23. Струтынский А. В., Бакаев Р. Г., Сивцева А. И. // Диагностика легочного сердца у больных ХОБЛ // Клиническая медицина, 2009. - №2 - 56-60
24. Струтынский А.В., Бакаев Р.Г., Кочетова С.И. // Терапия лизиноприлом больных с артериальной гипертензией и ХСН.// Врач, 2010; 5: 17-20.
25. Бакаев Р.Г., Струтынский А.В., Каллаева А.Н. // Периндоприл и 1-адреноблокаторы у больных ХСН, перенесших «Не-Q-инфаркт миокарда», с сохраненной систолической функцией. // Врач, 2010; 5: 58-61.
26. Бакаев Р.Г., Струтынский А.В., Глазунов А.Б., Воронина М.А., Пехтерева Д.А., Каракин А.А. // Экватор у больных с гипертонической болезнью, сочетающейся с ИБС и хронической сердечной недостаточностью. // Врач, 2010; 2: 44-47.
27. Бакаев Р.Г., Струтынский А.В. // Закономерности прогрессирования ХСН в зависимости от формы инфаркта миокарда. // Врач, 2010; 2: 67-70.
28. Бакаев Р.Г., Струтынский А.В., Сивцева А.И., Воронина М.А. // Эффективность длительной терапии бронхолитиками, фенспиридом и иАПФ периндоприлом больных ХОБЛ и ХЛС // Кардиоваскулярная терапия и профилактика, 2010, 5, 66-73.
29. Струтынский А.В., Рейснер А.А., Мошкова Н.К. // Результаты комплексной терапии бронхолитиками, фенспиридом и иАПФ периндоприлом больных с хроническим лёгочным сердцем// В книге: Научно-практическая конференция, посвящённая 40-летию городской клинической больницы №31.- М., 2010-С. 141-142.
30. Струтынский А.В. Бакаев Р.Г. Глазунов А.Б. // Особенности прогрессирования сердечной недостаточности у больных ИБС перенёсших различные формы инфаркта миокарда.// Там же, С. 146-147.
31. Струтынский А.В. Глазунов А.Б. Бакаев Р.Г. // Сегментарная электрическая активность миокарда левого желудочка у больных с сердечной недостаточностью, перенесших инфаркт миокарда// Там же С. 149-150.
Список основных сокращений
АГ – артериальная гипертензия;
БРА - блокаторы рецепторов к ангиотензину II;
ВЭП - велоэргометрическая проба;
ГКС – глюкокортикостероиды;
ГЛЖ – гипертрофия ЛЖ;
ГПЖ – гипертрофия ПЖ;
ДН – дыхательная недостаточность;
ИЛ-6 – интерлейскин 6;
ИМ – инфаркт миокарда;
Q-ИМ – ИМ с зубцом Q;
Не-Q-ИМ – ИМ без зубца Q;
ИМТ – индекс массы тела;
ИС – индекс сферичности;
КА – коронарная артерия;
КДО – конеч. диастолический объем;
КСО – конеч. систолический объем;
ЛА – легочная артерия;
ЛАГ – легочная АГ;
ЛЖ – левый желудочек;
ЛП – левое предсердие;
ЛС – лекарственные средства;
МЖП – межжелудочк. перегородка;
ММЛЖ – масса миокарда ЛЖ;
ИММЛЖ – индекс ММЛЖ;
МС – миокардиальный стресс;
ПЖ – правый желудочек;
ПП – правое предсердие;
ПИКС - постинфарктн. кардиосклероз;
РААС – ренин-ангиотензин-альдостероновая система;
САС – симпатико-адренал. система;
СрДЛА – среднее давление в ЛА;
ФВлж и ФВпж – фракция выброса;
ФВД – функция внешнего дыхания;
ФК – функциональный класс;
ФНО- – фактор некроза опухолей ;
ФР - факторы риска;
ХЛС – хроническое легочное сердце;
ХМ - Холтеровское мониторир. ЭКГ;
ХОБЛ – хр. обструкт. б-нь легких;
ХСН – хр. сердечная недостаточность;
ЭхоКГ – эхокардиография;
ЭПС – электрическое поле сердца;

