Поражение почек при наследственных и приобретенных тромбофилиях
На правах рукописи
Боброва
Лариса Александровна
ПОРАЖЕНИЕ ПОЧЕК ПРИ НАСЛЕДСТВЕННЫХ И ПРИОБРЕТЕННЫХ ТРОМБОФИЛИЯХ
14.01.29 – нефрология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2010
Работа выполнена в ГОУ ВПО Первый Московский государственный медицинский университет имени И.М. Сеченова
Минздравсоцразвития России
Научный руководитель:
доктор медицинских наук, профессор Наталья Львовна Козловская
Официальные оппоненты:
доктор медицинских наук, профессор Елена Ивановна Прокопенко
доктор медицинских наук, профессор Алексей Юрьевич Николаев
Ведущее учреждение:
Федеральное Государственное Учреждение «Учебно-научный медицинский центр» Управления делами Президента Российской Федерации
Защита диссертации состоится «___»___________2010г. в ___часов
на заседании диссертационного совета Д.208.040.05 при ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России (119991, Москва, ул. Трубецкая, д.8, строение 2)
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО Первый МГМУ им. И.М. Сеченова Минздравсоцразвития России (117998, Москва, Нахимовский проспект, д.49)
Автореферат разослан «___»_________2010г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Елена Васильевна Волчкова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В последние годы неуклонно возрастает интерес к изучению различных форм сосудистой патологии почек. Наряду с атеросклерозом, васкулитами, гипертонической болезнью к таковым относят и тромботическое поражение почечных сосудов. Несмотря на многообразие причин тромбозов, наиболее изучена иммунная форма тромбофилии – антифосфолипидный синдром (АФС), хотя сегодня в качестве еще одной причины тромботического поражения сосудов рассматривают также генетические формы тромбофилии.
В настоящее время появились данные о важной роли наследственной тромбофилии (НТФ) в патогенезе микроциркуляторных тромбозов. Доказана взаимосвязь генетический тромбофилии с повышенным риском развития ишемического инсульта, ишемической болезни сердца, акушерской патологии [Adamski M.G. et al., 2009; Макацария А.Д., Бицадзе В.О., 2006]. Однако вклад этой формы тромбофилии в развитие тромбозов почечных сосудов, в том числе микроциркуляторного русла изучен недостаточно. В последние годы появились немногочисленные исследования, в которых показано влияние НТФ на риск развития классических форм тромботической микроангиопатии (ТМА) [Suker C., et al., 2009], а также ее роль в формировании нефросклероза у больных в отсутствие ХГН, сахарного диабета и АГ [Goforth R.L. et al., 2006].
До недавнего времени ТМА как морфологическая основа патологии почек была изучена только при гемолитико-уремическом синдроме и тромботической тромбоцитопенической пурпуре. В последние годы доказана принадлежность к группе ТМА АФС-нефропатии (АФСН) [Nochy D et al,. 1999; Козловская Н.Л., 2006]. Принимая во внимания схожесть тромботических проявлений при АФС и НТФ, установленный факт прокоагулянтного влияния последней, оправдано предположение о возможности развития новой формы ренальной ТМА, обусловленной генетической тромбофилией. В связи с этим изучение ее вклада в формирование поражения сосудов почек приобретает большое значение для клинической практики, позволяя определить взаимосвязь между гемокоагуляционными нарушениями и тромбоокклюзивным поражением микроциркуляторного русла почек, выявить характерные клинические и морфологические признаки этой патологии.
Цель работы: установить возможность развития и охарактеризовать клинические проявления поражения почек при наследственной тромбофилии; оценить ее влияние на течение и прогрессирование хронического гломерулонефрита.
Задачи исследования:
- Изучить клинические проявления нефропатии при наследственных тромбофилиях;
- Сравнить клинико-морфологические проявления и характер течения нефропатии при наследственной и приобретенной (АФС) тромбофилиях;
- Оценить особенности течения и темп прогрессирования ХГН в зависимости от генотипов полиморфных маркеров генов гемостаза.
Научная новизна
Впервые в клинической практике на достаточно большом клиническом материале проведено комплексное изучение наиболее распространенных форм гематогенных тромбофилий у больных с нефропатиями. Исследована роль наследственной тромбофилии в развитии патологии почек и ее влияние на течение и прогрессирование нефропатии. Установлена возможность развития нефропатии у больных с определенными «протромбогенными генотипами» генов MTHFR C677T, PAI-1 -675 4G/5G, FGB-455 G/A, ITGB3 L33P. Охарактеризованы особенности клинико-морфологической картины поражения почек в зависимости от носительства полиморфных маркеров генов гемостаза. Установлено ее сходство с АФСН. Доказано, что мультигенная тромбофилия (МТФ) является фактором риска развития тромбозов в микроциркуляторном русле почек. Показано, что морфологической основой поражения почек при данной патологии является ТМА, аналогичная таковой у больных АФСН. Продемонстрировано неблагоприятное влияние МТФ на течение ХГН. Установлено, что наличие МТФ способствует более быстрому прогрессированию нефропатии.
Практическая значимость
Результаты проведенного исследования позволяют выделить МТФ в самостоятельный фактор риска развития сосудистой патологии почек и могут способствовать разработке дополнительных критериев для выделения групп больных ХГН с высоким риском прогрессирования почечной недостаточности. Полученные данные дают основания разработать подходы к профилактике и лечению пациентов с почечной ТМА, обусловленной генетической тромбофилией, а также больных ХГН с МТФ. Результаты работы обосновывают необходимость расширенного анализа показателей гемостаза с определением параметров, характеризующих активацию внутрисосудистого свертывания крови, у больных - носителей нескольких «протромбогенных» аллелей с целью определения объема лечебных и профилактических мероприятий.
Внедрение результатов работы в практику
Результаты настоящего исследования используются при обследовании и лечении больных в Университетской клинической больнице № 3 Первого МГМУ им. И.М.Сеченова, основные положения диссертации включены в лекционный курс на кафедре нефрологии и гемодиализа ФППОВ ГОУ ВПО Первый МГМУ им. И.М. Сеченова.
Публикации
По теме диссертации опубликовано 15 печатных работ.
Апробация работы
Апробация работы проведена 04 июня 2010 года на совместном заседании кафедры нефрологии и гемодиализа ФППОВ, отдела нефрологии НИЦ и кафедры терапии и профессиональных заболеваний ММА им. И.М. Сеченова, кафедры внутренних болезней факультета фундаментальной медицины МГУ им. М.В. Ломоносова. Материалы работы доложены и обсуждены на 7-ом Международном конгрессе по системной красной волчанке (Амстердам, май 2008г.), Московском городском обществе терапевтов (Москва, ноябрь 2008г.), Всемирном конгрессе нефрологов (Милан, май 2009г.), XLVII Европейском конгрессе нефрологов (ERA-EDTA Мюнхен, июнь 2010г.), VII Съезде Научного общества нефрологов России (Москва, октябрь 2010г.)
Основные положения, выносимые на защиту:
1. Наличие мультигенной тромбофилии приводит к развитию клинических проявлений, аналогичных симптомам АФС
2. У больных как с наследственной, так и приобретенной тромбофилиями развивается активация внутрисосудистого свертывания крови, вносящая вклад в формирование ренальной дисфункции
3. Мультигенная тромбофилия может быть причиной поражения почек, характеризующегося, как и АФСН, клинико-морфологической картиной ТМА и является неблагоприятным фактором, способствующим ухудшению «почечной выживаемости»
4. У пациентов с ХГН, имеющих множественные полиморфизмы генов гемостаза, возможно развитие острой ТМА. Тромбофилия независимо от ее природы способствует прогрессированию хронического гломерулонефрита за счет развития ТМА, присоединившейся к активному иммунному воспалению.
Объем и структура диссертации
Диссертация состоит из введения, 4 глав, заключения и выводов. Текст изложен на 230 страницах машинописного текста, включает 59 таблиц, 72 рисунков, 7 клинических наблюдений. Библиографический указатель содержит 49 отечественных и 296 зарубежных источников.
Автор выражает глубокую благодарность научному руководителю – д.м.н., профессору Н.Л.Козловской за помощь в работе над диссертацией, а также коллективам кафедры нефрологии и гемодиализа ФППОВ, отдела нефрологии НИЦ, клиники нефрологии, терапии и профессиональных заболеваний ММА им. И.М. Сеченова. Автор признателен д.м.н М.В.Немцовой и н.с. В.В. Шкарупо за помощь в проведении генетических исследований. Автор особенно признателен д.м.н., профессору В.А.Варшавскому и в.н.с. Е.П.Голицыной за помощь в проведении морфологического исследования.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Материалы и методы исследования
Было обследовано 313 человек с признаками поражения почек: 194(62%) женщины и 119 (38%) мужчин в возрасте от 16 до 70 лет (Ме 35 [27;48]), наблюдавшихся в клинике с 1998 по 2009 гг.
Критериями отбора пациентов для проведения исследования маркеров наследственной и приобретенной тромбофилии были:
- Тромбозы различной локализации;
- Признаки поражения почек:
- артериальная гипертензия (АГ);
- нарушение функции почек (снижение СКФ изолированное или в сочетании с повышением уровня сывороточного креатинина (Скр);
- мочевой синдром разной степени выраженности;
- синдром потери плода у женщин: привычные выкидыши, ранняя преэклампсия (до 34 недели беременности), с сохраняющимися более 6 месяцев после родов изменениями в анализах мочи и АГ.
У всех пациентов были определены лабораторные маркеры АФС (АКЛ, ВА), у 255 из них также исследованы полиморфизмы генов гемостаза, у 58 человек были исследованы только маркеры АФС. Затем, в соответствии с разработанными критериями, из исследования исключены 111 пациентов с системными (системная красная волчанка, ANCA - ассоциированный васкулит), инфекционными (инфекционный эндокардит, туберкулез) и лимфопролиферативными заболеваниями, интерстициальным нефритом любого генеза (лекарственный, уратная нефропатия), поликистозом почек, ожирением (ИМТ более 30), в возрасте старше 55 лет, женщины с нормализацией уровня АД и исчезновением мочевого синдрома к 6 месяцу после перенесенной нефропатии беременных.
Для окончательного анализа было отобрано 202 пациента с тромбофилией и поражением почек: 122 (60%) женщины и 80 (40%) мужчин в возрасте от 16 до 55 лет (средний возраст 34,8± 11 лет). У 154 были определены АФА и проведено генетическое исследование. У 115 из них выявлены только мутации в генах гемостаза, что позволило отнести этих пациентов в группу «изолированной» наследственной тромбофилии. У 39 больных наряду с мутациями обнаружены и положительные АФА, что дало основание выделить их в группу комбинированной тромбофилии. У них и у 48 больных с положительными АФА, которым генетическое исследование не выполнялось, согласно критериям Sapporo c дополнениями 2004г диагностирован ПАФС. Все больные ПАФС имели признаки поражения почек, которые рассматривали как АФСН: мочевой синдром, сочетание АГ с ренальной дисфункцией, представленной изолированным нарушением фильтрационной функции почек с эпизодами транзиторной гиперкреатининемии или стойким повышением уровня Скр, признаки острой или хронической ТМА по данным морфологического исследования, нарушение внутрипочечной гемодинамики в виде обеднения почечного кровотока в режиме ЦДК, начиная с уровня дуговых сосудов, и снижение скоростных показателей кровотока в сегментарных и междолевых артериях (дистальный тип ишемии) по данным УЗДГ сосудов почек.
Группы больных
В I –ую - основную группу вошли 100 пациентов с клиническими проявлениями тромбофилии (тромбозы различной локализации, синдром потери плода) и поражением почек. На основании выявленных маркеров тромбофилии пациенты были разделены на две подгруппы:
- подгруппу больных с комбинированной тромбофилей, (КТФ) - составили 35 человек, 10 (29%) мужчин и 25 (71%)женщин, средний возраст 36,8 ± 11,5 лет, у которых наличие полиморфных маркеров генов гемостаза сочеталось с положительными серологическими маркерами АФС. У всех больных диагностирован ПАФС.
- подгруппу больных с наследственной тромбофилией, (НТФ) – составили 65 пациентов, 28(44%) мужчин и 37 (56%)женщин, средний возраст 33 ± 10 лет, с отрицательными серологическими маркерами АФС.
Во II-ую группу (ХГН +ТРФ) вошли 56 больных: 25(45%) мужчин и 31 (55%) женщина, средний возраст 35± 11 лет с различными формами ХГН. Клинические варианты нефрита оценены в соответствии с классификацией Е.М. Тареева (1972г.) на момент первого обследования в клинике. Распределение их было следующим: ХГН латентного типа диагностирован у 8% больных, гематурического типа – у 38 %, нефротического типа – у 40% и смешанного типа – у 14% больных. У 6 больных была выявлена комбинированная тромбофилия, у 2 – АФА и генетическое исследование не проводилось, у остальных - наследственная. При анализе влияния тромбофилии на показатели функции почек больные были разделены на две подгруппы с учетом длительности заболевания: до 24 мес. включительно, которую составили 20 больных (36%) и более 24 мес. - 36 больных (64%). Больные с давностью нефрита более 24 мес. были старше (40± 11 лет vs 33 ± 10 лет; р<0,05), но не различались по частоте выявления у них «протромбогенных» генотипов всех исследованных генов.
Контрольную ретроспективную группу составили 46 больных с первичным АФС (29 (63%) женщин и 17 (37%) мужчин, средний возраст 36± 10 лет), у которых не определяли маркеры наследственной тромбофилии. У всех пациентов этой группы инструментально или морфологически подтверждена АФСН.
Дизайн исследования
Исследование состояло из двух частей. В первой части изучали значение «изолированной» генетической тромбофилии как возможного самостоятельного фактора, приводящего к поражению почек. С этой целью мы сравнили клинико-морфологические проявления нефропатии у больных с генетической тромбофилией (подгруппа НТФ, n=65) и у больных ПАФС, имеющих комбинированную тромбофилию (подгруппа КТФ, n=35), а затем – больных ретроспективной группы (группа АФСН, n=46). Во второй части исследования мы проанализировали связь тромбофилии с клиническими проявлениями ХГН и оценили ее влияние на «почечную» выживаемость.
Поражение почек было представлено АГ, мочевым синдромом, признаками нарушения функции в различных сочетаниях. Критериями АГ являлись уровень систолического АД 140 мм рт.ст. и/или уровень диастолического АД 90 мм. рт. ст. до назначения антигипертензивных препаратов. Протеинурию определяли как суточную экскрецию белка не менее 0,1 г/сут. (при значениях 0,1-0,4 г/сут – минимальная, 0,5-3,0 г/сут –умеренная, более 3 г/сут – выраженная). Гематурию считали минимальной при количестве эритроцитов до 5 в п/зр, умеренной - от 6 до 15 в п/зр., более 15 в п/зр – выраженной. Нарушение функции почек определяли при значении скорости клубочковой фильтрации (СКФ) по методу Реберга-Тареева ниже 80 мл/мин и/или уровне Скр выше1,4мг/дл. Указанные биохимические показатели регистрировались на момент поступления в клинику (до начала лечения) и в конце периода наблюдения. «Почечным исходом» считали стабильное повышение уровня Скр > 1,4 мг/дл в течение не менее 6 месяцев. Длительность нефропатии определяли как время от появления первых документированных признаков поражения почек до окончания наблюдения в месяцах. Для обследования больных использовали общеклинические и специальные методы (Схема 1).

Схема 1. Специальные методы обследования
Идентификация аллелей полиморфных маркеров генов MTHFR, FV Leiden, PTG, PAI-1, FGB, ITGB3
В работе исследован аллельный полиморфизм 6-ти различных генов, кодирующих разные звенья системы гемостаза, которые условно можно разделить на 4 группы:
- гены, кодирующие факторы плазменного каскада коагуляции (факторы I, II, V);
- гены, кодирующие факторы фибринолиза (ингибитор активатора
плазминогена типа I – PAI-1);
- гены, кодирующие компоненты рецепторов тромбоцитов, опосредующих процессы их адгезии и агрегации (гликопротеин IIIa);
- гены факторов, вовлеченных в патогенез эндотелиальной дисфункции (метилентетрагидрофолатредуктаза (MTHFR).
Все 6 полиморфизмов генов гемостаза исследованы у 221 больного, у 92 больных – 3 генов (MTHFR C677T, FV Leiden и PTG G 20210A). Из 202 больных, вошедших в основное исследование, у 146 определены все 6 полиморфных маркеров.
Методы статистического анализа
Статистический анализ проводился с использованием ПСП SPSS 11.5. При описании количественных данных использовались следующие расчетные показатели: медиана, 25-й и 75-й квартили – Me [25%, 75%], либо среднее арифметическое и стандартное отклонение – m±, в зависимости от соответствия данных нормальному распределению. Достоверность различий средних оценивали методом Mann-Whitney или с помощью t-теста. При сравнении частотных показателей для оценки достоверности использовали точный критерий Fisher. Для выявления и оценки связей между исследуемыми показателями применялся непараметрический корреляционный анализ по методу Spearman и метод логистической регрессии. Частоту встречаемости генотипов определяли прямым подсчетом. Частоту аллелей вычисляли по формуле: F = n/2N, где n – количество раз встречаемости аллеля (у гомозигот он учитывался дважды). Учитывая, что различные комбинации генотипов формируют сходный фенотип, для
| Суммарный балл генетического профиля | ||||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| Все больные, включенные в исследование | ||||||
| n= 146 | 13 | 40 | 50 | 31 | 10 | 2 |
| % | 9 | 27 | 34 | 21 | 7 | 2 |
определения связи между полиморфными маркерами генов гемостаза и различными признаками была введена шкала «протромбогенных» аллелей (табл.1). При использовании кодировки каждому аллелю присваивался один балл. Включали 6 полиморфизмов: гомозиготная замена - 2 балла, гетерозиготная – 1 балл. Данная шкала введена и использована в анализе только для больных, у которых исследованы все 6 генов гемостаза (n=146). Отношение шансов (OR) рассчитывали с помощью логистической регрессии и оценивали по Exp(B). Почечную выживаемость оценивали методом Cox- регрессии с учетом времени от начала заболевания (соответствует моменту появления мочевого синдрома) до исхода. Кривые выживаемости разных групп больных сравнивали с помощью теста log rank.
Результаты исследования
Частота полиморфных маркеров генов гемостаза у больных с поражением почек Сравнительный анализ распределения генотипов полиморфных маркеров генов гемостаза в исследуемой популяции больных и здоровой популяции выявил преобладание частоты «протромбогенных» генотипов в группе больных (табл. 2).
Таблица 2. Частота встречаемости генотипов изученных генов у обследованных больных и здоровых лиц, проживающих на европейской территории РФ (по данным литературы)
| Ген | Генотип | СД % | ЛД % | р | Ген | Генотип | СД % | ЛД % | р |
| MTHFR C677T | C/C | 40 | 52,4 | FGB G(-455)A | G/G | 50 | 56,5 | ||
| C/T | 45 | 39,1 | G/A | 43 | 39,5 | ||||
| T/T | 15 | 8,5 | A/A | 7 | 4 | ||||
| Аллель Т (доля) | 0,38 | 0,28 | 0,05 | Аллель А (доля) | 0,29 | 0,26 | н/д | ||
| FV Leiden G1691A | G/G | 90,4 | 97,4 | ITGB3 С 176Т (L33P) | L/L | 70 | 69,7 | ||
| G/A | 9,0 | 2,6 | L/P | 27 | 8,6 | ||||
| A/A | 0,6 | 0 | P/P | 3 | 1,7 | ||||
| Аллель А(доля) | 0,05 | 0,013 | <0,05 | Аллель Р(доля) | 0,16 | 0,16 | н/д | ||
| PTG G 20210А | G/G | 94 | 98,3 | PAI-1 4G (675)5G | 5G/5G | 15 | 35,5 | ||
| G/A | 6 | 1,7 | 4G/5G | 56 | 46,9 | ||||
| A/A | 0 | 0 | 4G/4G | 29 | 17,6 | ||||
| Аллель А (доля) | 0,03 | 0,009 | <0,05 | Аллель 4G (доля) | 0,57 | 0,41 | 0,08 |
СД- собственные данные, ЛД- данные литератуы
Таблица 3.Количество выявленных мутаций у больных ХГН и ССН
| Количество мутаций | Группа I n =100 | Группа II n =54 |
| 1 | 19 (19%) | 8 (16%) |
| 2 | 34 (34%) | 20 (37%) |
| 3 | 36 (36%) | 19 (34%) |
| 4 и более | 12(12%) | 7 (13%) |
МТФ (наличие замен в двух и более генах) выявлена у 128 (82%) из 156 обследованных больных с равной частотой в обеих группах (табл.3).

Значение «изолированной» генетической тромбофилии как возможного самостоятельного фактора поражения почек Анализ распределения маркеров генов гемостаза в I группе показал преобладание МТФ у больных с «изолированной» НТФ (90% vs 66%, р < 0,05) по сравнению с пациентами, имеющими КТФ (рис.1). Более чем у половины больных с НТФ выявлено не менее 3 мутаций (56% vs 29% p<0,05), причем чаще встречалось одновременное носительство мутантных аллелей генов MTHFR, PAI-1 и FGB.
Экстраренальные проявления у больных с тромбофилиями

Тромбозы различных локализаций развились у 40% больных с обеими формами тромбофилии, причем в структуре тромбозов преобладали артериальные (рис.2).
Акушерская патология у больных с КТФ и «изолированной» НТФ
отмечена с равной частотой (68% и 62% соответственно), однако в подгруппе КТФ преобладали выкидыши (56% vs 20%, р= 0,02), а в подгруппе НТФ - ранняя преэклампсия (71% vs 56%, р> 0,05).
Свертывающая система крови у больных с НТФ и КТФ Исследуемые показатели гемостаза были сопоставимы в обеих подгруппах больных. Однако у больных с комбинированной тромбофилией чаще выявлялось повышение уровня Д-димеров (85% vs 57%, p<0,05) (табл.4).
Таблица 4. Лабораторные показатели гемостаза у больных с тромбофилией
| Показатели гемостаза | I-ая группа | p | |
| КТФ | НТФ | ||
| АЧТВ, с | 1,02 ±0,15 | 1,01±0,11 | н/д |
| Протромбиновый индекс, % | 104±7,2 | 102 ±6,3 | н/д |
| Тромбиновое время, с | 29,5±3,0 | 29±5,0 | н/д |
| Фибриноген, г/л | 3,7±1,02 | 3,5±1,06 | н/д |
| Повышенный уровень фибриногена, (%) | 13 (38%) | 15 (27%) | н/д |
| РКФМ, ед.экстинкции | 0,500 [0,443;0,600] | 0,480 [0,420;0,580] | н/д |
| Частота повышения РКФМ (%) | 16 (73%) | 17 (55%) | н/д |
| Д-димер (<0,5; 0,5-3,0; >3,0), мкг/мл | 15%; 65%; 20% | 43%;46%;11% | |
| Повышение Д-димеров, (%) | 17 (85%) | 20 (57%) | < 0,05 |
| Тромбоциты, х109 /л | 241±68,5 | 237±63 | н/д |
Средние значения, медиана АЧТВ и ПИ определялись до назначения антикоагулянтной терапии и без учета больных с циркулирующим ВА
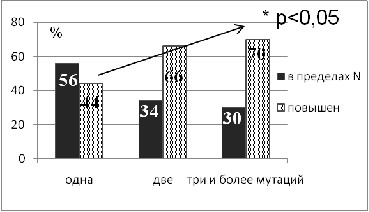
У пациентов с КТФ и НТФ значения РКФМ были практически одинаковыми (табл.4). Частота выявления «гиперРКФМ-емии» нарастала по мере увеличения количества мутаций в генах гемостаза (рис. 3). У больных с НТФ и КТФ средние значения фибриногена не превышали норму (табл.2). Частота выявления гиперфибриногенемии в группах была сходной (p > 0,05) (рис. 4).

Гиперфибриногенемия чаще выявлялась у больных с носительством аллеля А гена -цепи фибриногена, чем у больных, имеющих нормальный генотип (65% vs 41%, p=0,05). Средние значения фибриногена были наименьшими у больных с нормальным генотипом гена –цепи фибриногена и максимальными – у больных с гомозиготной мутацией как в группе в целом, так и в подгруппах (рис. 5 и 6). Выявлена прямая регрессионная связь концентрации фибриногена и числа «протромбогенных» аллелей при обеих формах тромбофилии (R = 0,5; p< 0,01 при КТФ и R=0,4 p<0,01 при НТФ).


Характеристика поражения почек у больных с тромбофилиями
Мы проанализировали основные проявления нефропатии - особенности АГ, мочевого синдрома и показателей функции почек, параметров внутрипочечной гемодинамики, оцененной с помощью УЗДГ, и морфологической картины у больных с КТФ и НТФ и сравнили их с проявлениями нефропатии у пациентов из ретроспективной группы с доказанной АФСН.
Частота АГ и степень ее тяжести не различались у больных с КТФ и «изолированной» НТФ, а также у больных из ретроспективной группы (табл.5). У пациентов с МТФ почти в два раза чаще регистрировалась тяжелая АГ, в то время как при наличии одной замены она либо отсутствовала, либо была транзиторной (p<0,05). У больных с тяжелой АГ в половине случаев (53%) выявлено наличие трех и более мутаций, две мутации обнаруживались у 33%, одна – у 14% пациентов. Уровень как САД, так и ДАД был выше при МТФ, при этом значения ДАД (112±23 мм рт. ст. vs 103±19 мм рт.ст; р=0,04) и ср.динам. АД (125±25 мм рт. ст. vs 136±28 мм рт.ст.; р=0,05) были достоверно выше у больных, имеющих три и более мутации.
Частота выявления мочевого синдрома и величина протеинурии были
одинаковыми у больных с НТФ и КТФ и не отличались от таковых у больных группы контроля (табл.5). У большинства пациентов I группы, имевших мочевой синдром, протеинурия носила изолированный характер (85%) и лишь у 15% больных сочеталась с микрогематурией.
Таблица 5. Клинико-лабораторные показатели, характеризующие поражение почек при тромбофилиях
| Группа I | Контрольная группа | ||||
| Показатель | НТФ n=65 | КТФ n=35 | Р1 | АФСН n=46 | Р2 |
| Артериальная гипертензия, n(%) | 61(94%) | 29(83%) | 0,09 | 43(94%) | нд |
| Тяжелая | 38(62%) | 18 (62%) | нд | 27 (63%) | нд |
| Умеренная | 15(25%) | 7(24%) | нд | 12(28%) | нд |
| Мягкая | 8(13%) | 4(14%) | нд | 4 (9%) | нд |
| САД мм рт. ст. | 179±38 | 170± 42 | нд | 174±36 | нд |
| ДАД мм рт. ст. | 109±20 | 102± 21 | 0,07 | 108±21 | нд |
| Ср. динам. АД мм рт. ст. | 133±25 | 125 ±27 | нд | 130±25 | нд |
| Нарушение функции почек | 57(87%) | 29(83%) | нд | 40 (89%) | нд |
| Изолированное снижение СКФ (<80мл/мин), % | 33(49%) | 16(46%) | нд | 17 (42%) | нд |
| Гиперкреатининемия (>1,4мг/дл),% | 25(37%) | 13(38%) | нд | 23(50%) | нд |
| СКФ, мл/мин | 58 ±23 | 56± 21 | нд | 52±21 | нд |
| Скр, мг/дл | 1,3[1,04;1,7] | 1,2 [1,0;1,9] | нд | 1,4 ±0,89 | нд |
| Мочевой синдром, n (%) | 51 (79%) | 31 (86%) | нд | 40 (87%) | н/д |
| Ме СПУ г/сут | 0,2 [0,1;0,6] | 0,3 [0,1;0,7] | нд | 0,6 [0,15;1,3] | 0,07* 0,1** |
| Микрогематурия, n (%) | 7 (11%) | 5 (14%) | нд | 14(36%) | 0,01* 0,01** |
| Минимальная (0-5 в п/зр), n (%) | 58 (89%) | 30 (86%) | нд | 27 (59%) | 0,05** |
| Умеренная (6-15 в п/зр), n (%) | 5 (8%) | 2 (6%) | нд | 10(22%) | 0,05* 0,06** |
| Выраженная (>15 в п/зр), n (%) | 2 (3%) | 3(8%) | нд | 9 (19%) | 0,01* |
| Макрогематурия, n (%) | 3 (5%) | 1 (3%) | нд | 7(15%) | нд |
| Нефротический синдром, n (%) | 5(8%) | 4(11%) | нд | 7(15%) | нд |
| Остронефритический синдром, n (%) | 11(17%) | 8 (23%) | нд | 11(24%) | нд |
| УЗДГ признаки ишемиии, n (%) | 38 (84%) | 25 (89%) | нд | 34(87%) | нд |
Р 1 – различия между подгруппами НТФ и КТФ; Р2 – различия между НТФ и АФСН; * p< 0,05; **p < 0,01
Характеристика функции почек представлена в таблице 5. Выявлено существенное снижение СКФ у больных с КТФ и НТФ (58 ± 23 мл/мин и 56 ± 21 мл/мин соответственно). Снижение СКФ (< 80мл/мин) отмечено у 86% больных с тромбофилией с равной частотой в подгруппах: у 29(83%) больных с КТФ и 57 (87%) - с НТФ (р=0,5). У 13 (38%) больных из подгруппы КТФ и у 24 (37%) больных - НТФ снижение СКФ сочеталось с нарушением азотвыделительной функции почек. Средний уровень креатинина в обеих подгруппах не различался. Сходными были показатели функционального состояния почек и у больных из ретроспективной группы (табл.5). У 36 больных I группы отмечалась транзиторная гиперкреатининемия, встречавшаяся с равной частотой (37%) в обеих подгруппах (p>0,05). «Почечного исхода» достигли 30 больных, в том числе 9 с транзиторным повышением Скр в анамнезе. У больных с тромбофилией при низкой СКФ чаще выявлялись признаки активации внутрисосудистого свертывания крови
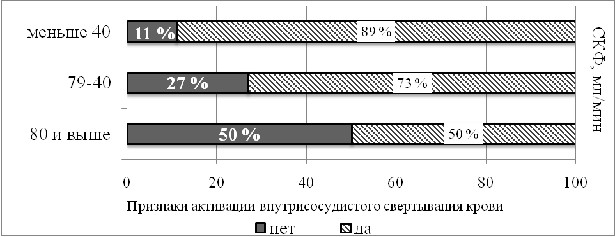
(рис.7) и, обратно, при высоком уровне Д-димеров и РКФМ чаще отмечалось снижение СКФ (рис.8а,б).
Рисунок 7. Взаимосвязь показателей внутрисосудистого свертывания крови и СКФ


Рисунок 8. Взаимосвязь между СКФ и Д-димером (А), между СКФ и РКФМ (Б)
Практически одинаковые показатели функции почек, АД и протеинурии у больных с «изолированной» НТФ, КТФ и больных с достоверной АФСН дают основание полагать, что у больных с НТФ может развиться поражение почек, проявляющееся, как и АФСН, АГ, ренальной дисфункцией и умеренным мочевым синдромом.
Линейный регрессионный анализ не выявил связи между длительностью нефропатии и СКФ (r=0,18; p>0,05), обнаружена слабая связь с тенденцией к достоверности между уровнем Скр и длительностью поражения почек (r = 0,2; p=0,06). По-видимому, отсутствие связи между длительностью поражения почек и их функциональным состоянием обусловлено волнообразным течением тромботического процесса, зависящим от частоты рецидивов тромбозов в микроциркуляторном русле почек. Выявлена корреляционная связь числа «протромбогенных» аллелей с уровнем АД и
показателями активации внутрисосудистого свертывания крови, которые в свою очередь коррелировали с частотой ишемии паренхимы почек по данным УЗДГ (рис. 9).
Мы сравнили гистологические изменения в биоптатах почек пациентов первой и контрольной групп, которую составили больные с достоверным ПАФС и морфологически доказанной АФСН. Морфологические признаки хронической ТМА обнаружены у 6(85%)больных из подгруппы КТФ и у 20 (90%) - из подгруппы НТФ, сочетающиеся у половины больных в обеих подгруппах с признаками острой ТМА. Частота острых микроциркуляторных тромбозов была недостоверно выше у больных с КТФ (43% vs 30%, p> 0,05).
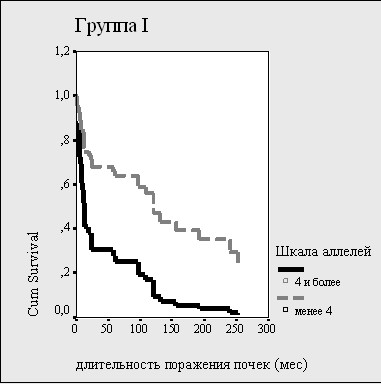
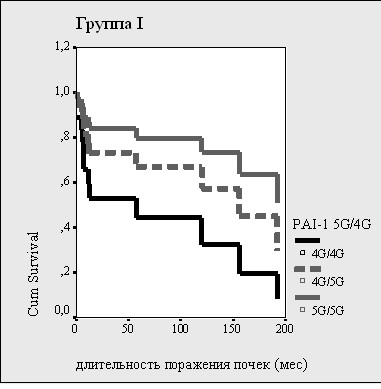
Рисунок 10. Влияние полиморфизма гена PAI-1и числа «протромбогенных» аллелей на почечную выживаемость
В целом по группе «почечная» выживаемость оказалась хуже у больных с носительством 4 и более «протромбогенных» аллелей и у больных, имеющих генотип 4G/4G гена PAI-1 (рис.10).
Влияние НТФ на прогрессирование ХГН
Учитывая широкую распространенность генетической тромбофилии, мы проанализировали ее влияние на течение ХГН у 56 больных с различными формами болезни. Клинико-лабораторные данные представлены в таблице 6.
Таблица 6. Клинико-лабораторная характеристика больных
ХГН с тромбофилиями
| Показатель | Значение |
| Возраст, лет | 35 ± 11 |
| Пол м/ж | 25 (45%)/ 31 (55%) |
| АГ: нет/мягкая/умер/тяж., n (%) | 11(20%)/ 10 (18%)/ 18 (32%)/17(30%) |
| САД мм рт.ст. | 160 [140; 174] |
| ДАД мм рт.ст. | 100 [90; 110] |
| Артериальные тромбозы, n (%) | 4 (7%) |
| Венозные тромбозы, n (%) | 4 (7%) |
| Сочетанные тромбозы, n (%) | 2 (3%) |
| Синдром потери плода, n ( %) | 14 (45%) |
| СПУ, г/сут | 1,43 [0,4; 4,5] |
| ГУ мин/умер/выр, n (%) | 19 (34%) / 4 (7%)/ 33 (59%) |
| Макрогематурия, % | 10 (18%) |
| Креатинин, мг/дл | 1,3 [1,0; 2,1] |
| СКФ, мл/мин | 62 ± 23 |
| Снижение СКФ, n (%) | 43 (77%) |
| Повышение Скр >1,4 мг/дл, n (%) | 23 (41%) |
| Достижение «почечного исхода», n (%) | 18 (32%) |
| Фибриноген,г/л | 4,2 ± 1,5 |
| РКФМ ед.экст. | 0,520 [0,420; 0,680] |
| Д-димер <0.5/0.5-3/>3, n (%) | 5 (19%)/ 15 (58%)/ 6 (23%) |
| УЗДГ признаки ишемии (n=25), % | 15 (65%) |
Длительность нефрита колебалась от 2 мес. до 30 лет (Ме 4,5 года [1год; 8лет]). Тромбозы раз-личной локализации от- мечены у 18% больных с ХГН и тромбофилией, акушерская патология - у 45% пациенток. Величина САД и ДАД у больных ХГН прямо зависела от числа «протромбоген-ных» аллелей (рис. 11).
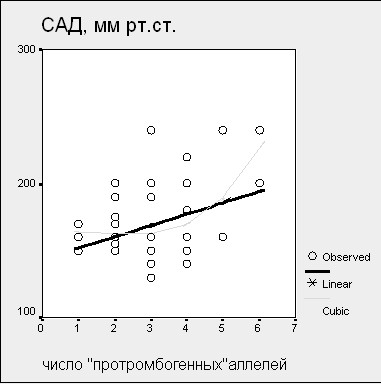

Рисунок 11. Регрессионная связь САД и ДАД с числом «протромбогенных» аллелей у больных ХГН
Средний уровень протеинурии был более высоким у больных с МТФ по сравнению с больными, имеющими мутацию в одном гене гемостаза (3,2 г/сут vs 0,6 г/сут, p = 0,07). Выявлена корреляционная связь величины протеинурии и числа «протромбогенных» аллелей с Д-димером, РКФМ и фибриногеном, что свидетельствует о возможном вкладе генетической ТРФ у больных ХГН в процесс активации внутрисосудистого свертывания крови (рис. 12). Выявлена прямая регрессионная связь между числом «протромбогенных» аллелей и Скр (r= 0,3; p<0,05) (рис. 13) и обратная со СКФ (r = - 0,2; p= 0,08) (рис. 14). При анализе показателей функции почек в зависимости от давности нефрита выявленные связи сохранялась у больных с длительностью нефрита менее 2-х лет. «Почечный» исход наступил у 18 (29%) больных ХГН: у 12(33%) из 36 больных с длительностью ХГН >24 мес. и у 6 (30%) из 20 - с давностью ХГН 24мес. У больных с количеством «протромбогенных» аллелей более 3 «почечный исход» отмечен почти вдвое чаще, чем у больных, имеющих менее 3 замен в генах гемостаза (50% vs 26%;
р>0,05). При длительности нефрита 24мес. различия были достоверными (у больных с числом «протромбогенных» аллелей более 3 «почечный исход» развился в 75% случаев против 12% у больных с меньшим их числом (p<0,05).
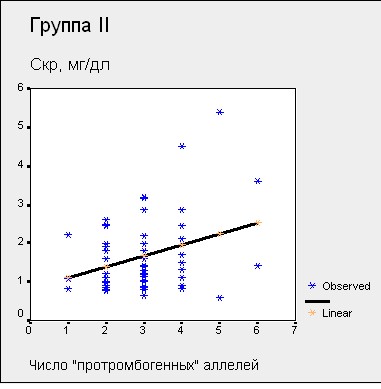


Рисунок 13. Зависимость Скр от количества «протромбогенных» аллелей у больных ХГН с тромбофилией


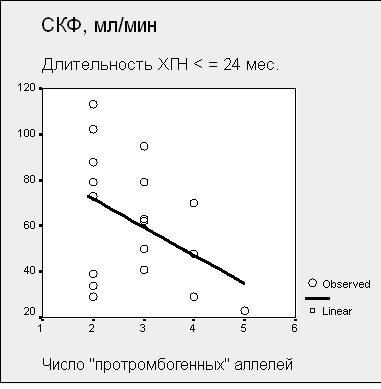 Рисунок 14. Зависимость СКФ от количества «протромбогенных» аллелей у больных ХГН с тромбофилией
Рисунок 14. Зависимость СКФ от количества «протромбогенных» аллелей у больных ХГН с тромбофилией
Таблица 7. Факторы, влияющие на «почечный исход» у больных ХГН с тромбофилией
| Фактор | ОR | P |
| 4G/4G+ аллель Т | 14,6 | 0,02 |
| Наличие трех и более «протромбогенных» аллелей | 2,7 | 0,08 |
| Наличие артериальных тромбозов | 7,4 | 0,057 |
| Эпизоды транзиторного повышения Скр | 12,5 | 0,027 |
| Наличие тяжелой АГ | 8,4 | 0,001 |
| Д-димер более 3 | 12 | 0,02 |
Вероятность развития почечного исхода была значимо выше при наличии тяжелой АГ, эпизодов артериальных тромбозов и транзиторной гиперкреатининемии, сочетания генотипа 4G/4G гена PAI-1 с аллелем Т гена MTHFR, высокого уровеня Д-димеров (табл. 7). «Почечная» выживаемость оказалась достоверно хуже при носительстве генотипа 4G/4G гена PAI-1 (р = 0,03) (рис. 15а), при его сочетании с носительством аллеля Т гена MTHFR C677T (р =0,006) (рис. 15б). Влияния других полиморфизмов на «почечную выживаемость» не выявлено.
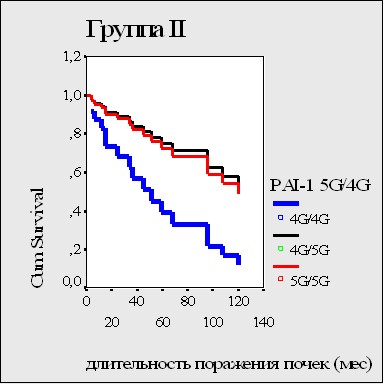

Рисунок 15. Влияние полиморфизма гена PAI-1 (а), сочетания генотипа 4G/4G гена PAI-1 с аллелем Т гена MTHFR (б) на почечную выживаемость
Признаки острой ТМА с положительной окраской на фибриноген были обнаружены у 10(30%) больных независимо от морфологического варианта нефрита, во всех случаях в сочетании с изменениями, характерными для хронической ТМА. У остальных 23 больных ХГН в биоптатах почек обнаружены неспецифические склеротические изменения различной выраженности, которые могут быть связаны как с хронической ТМА, так и с течением ХГН.
Все 10 больных ХГН с признаками острой ТМА в биоптате почки имели МТФ, причем у 9 из них выявлены три и более «протромбогенных» аллеля (90%). В отсутствие острой ТМА три и более замены обнаружены вдвое реже (47%) (р<0,05). Вероятность развития острой ТМА у больных ХГН при наличии трех и более «протромбогенных» аллелей была значимо выше (OR=9,9; CI 1,1-93; p<0,05). По–видимому, прогрессирующее течение ХГН у больных с ТРФ можно объяснить неадекватным гемостатическим ответом на локальное иммунное воспаление в почке при наличии генетической предрасположенности к тромбообразованию, что проявляется избыточной активацией свертывающей системы крови и в свою очередь приводит к развитию микроциркуляторных тромбозов, превращающихся в дополнительный фактор прогрессирования нефропатии.
Выводы:
- У больных с мультигенной тромбофилией (комбинация нескольких протромбогенных генотипов генов гемостаза) могут развиваться клинические проявления, сходные с признаками АФС: периферические тромбозы (40%) и синдром потери плода (62%).
- Активация внутрисосудистого свертывания крови при тромбофилии проявляется повышением уровня РКФМ и зависит от числа «протромбогенных» мутаций (0,52 ед.экст у больных с тремя и более мутациями vs 0,46 ед.экст у больных с заменой в одном гене, р=0,001). Концентрация фибриногена связана с количеством «протромбогенных» аллелей (r=0,4; p <0,05) и носительством мутантного аллеля А гена -цепи фибриногена (3,2±0,9 г/л при носительстве «дикого» G/G генотипа гена FGB -455 G/A vs 3,5± 1,2 г/л - при гетерозиготной замене (генотип G/A) vs 4,3± 1,1 г/л - при гомозиготной (генотип А/А) (р<0,05).
- У пациентов с МТФ поражение почек может развиваться как единственное проявление тромбофилического состояния. Морфологической основой нефропатии, как и при АФСН, является ТМА с развитием тромбозов мелких гломерулярных и внегломерулярных сосудов в 27% случаев. Клинические признаки в виде тяжелой АГ (62%), ренальной дисфункции (83%) и изолированной протеинурии (84%) аналогичны таковым при АФСН.
- У больных ХГН, независимо от его морфологического варианта, наличие тромбофилии сопровождается развитием острой ТМА в 30% случаев. При этом число «протромбогенных» аллелей прямо коррелирует с уровнем креатинина (г = 0,3, р<0,05) и обратно – с СКФ ( г = -0,4, р<0,05).
- Носительство генотипа 4G/4G гена PAI-1 и носительство 4х и более «протромбогенных» аллелей ухудшают «почечную» выживаемость у больных с нефропатией, ассоциированной с тромбофилией. У больных ХГН наличие МТФ повышает риск развития «почечного исхода» (ОR = 2,7; р=0,08), особенно при сочетании носительства генотипа 4G/4G гена PAI-1 с аллелем Т гена MTHFR (ОR = 14,6; р<0,05). Гены PAI-1 и MTHFR обладают синергичным влиянием на риск развития «почечного исхода» как при ХГН, так и нефропатии, ассоциированной с тромбофилией.
Практические рекомендации:
- Проведение генетического обследования показано всем больным с поражением почек, перенесшим тромбозы различной локализации, для выявления НТФ, служащей фактором риска прогрессирования нефропатии.
- Наличие МТФ у пациентов с нефропатией должно служить показанием к определению маркеров активации внутрисосудистого свертывания крови (Д-димер, РКФМ).
- У больных ХГН с морфологическими признаками ТМА в биоптатах почек необходимо исследование маркеров тромбофилии и показателей активации внутрисосудистого свертывания крови для обоснования необходимости назначения антикоагулянтной терапии с целью предупреждения прогрессирования нефрита и развития почечной недостаточности.
Список работ, опубликованных по теме диссертации:
- Козловская Н.Л., Боброва Л.А., Шилов Е.М., Сафонов В.В. Поражение почек у больных тромбофилиями: новая проблема в нефрологии. Российская научно-практическая конференция «Актуальные проблемы современной нефрологии (сборник тезисов). М., 2007; с. 41-43
- Козловская Н.Л., Боброва Л.А., Захарова Е.В., Хафизова Е.Ю., Гагарина Н.В., Мирошниченко Н.Г. Двусторонний стеноз почечных артерий у больного первичным антифосфолипидным синдромом, перенесшего гемолитико-уремический синдром (описание случая и обзор литературы). Терапевтический архив 2008; № 6: 69-73
- Боброва Л.А., Козловская Н.Л., Немцова М.В. Наследственная тромбофилия как фактор риска тромботического микроагиопатического поражения почек. Сборник тезисов конференции молодых ученых, посвященной 250- летию ММА, 2008, с.57.
- Козловская Н.Л., Котлярова Г.В., Боброва Л.А., Сафонов В.В., Кушнир В.В., Фоминых Е.В., Казаков С.В. Двусторонняя окклюзия почечных артерий с восстановлением функции почек после длительной терапии программным гемодиализом у пациента с генетической формой тромбофилии. Нефрология и диализ 2008; 2(10): 151-159
- Козловская Н.Л., Боброва Л.А., Кирсанова Т.В., Шахнова Е.А., Шилов Е.М. Ультразвуковая допплерография внутрипочечного сосудистого русла как метод диагностики тромботической микроангиопатии при первичном антифосфолипидном синдроме. Сборник статей под ред. Акад.РАМН, проф. Н.А.Мухина «Инновационные технологии и прогресс терапевтической клиники» М.2008, с.129-138
- Bobrova L., Kozlovskaya N., Varshavsky V., Meteleva N. Renal sclerotic lesions in nephropathy associated with primary antiphospholipid syndrome (PAPS) and lupus nephritis (LN) with and without APS. Abstracts of XLV ERA-EDTA Congress, Stockholm, Sweden, May 10-13,2008. Nephrology Dialysis Transplantation Plus 2008 1(Supplement 2): ii85-ii86
- Bobrova L.A, Kozlovskaya N.L., Meteleva N.A., Shakhnova E.A., Miroshnichenko N.G. Renal artery occlusion (RAO) in antiphospholipid syndrome (APS). Lupus 2008; 17: 477. Abstracts of 7th European lupus meeting, Amsterdam, The Netherlands, May 7-10, 2008, p.477
- Боброва Л.А., Козловская Н.Л., Варшавский В.А., Шкарупо В.В. Наследственная тромбофилия как причина развития тромботической микроангиопатии (ТМА) почек у пациентов с хроническим гломерулонефритом (ХГН). Материалы к Юбилейной конференции «30 лет Факультета послевузовского профессионального образования врачей» ГОУ ВПО ММА им. И.М.Сеченова. Спец. выпуск журнала Антибиотики и химиотерапия 2009; 3-4 (54): 118-119 (тезисы)
- Козловская Н.Л., Боброва Л.А., Шкарупо В.В., Варшавский В.А., Мирошниченко Н.Г. Клинико-морфологические особенности поражения почек у больных с генетической формой тромбофилии. Терапевтический архив 2009; № 8: 30-36
- Козловская Н.Л., Боброва Л.А. Генетическая тромбофилия и почки. Клиническая нефрология 2009; 3: 23-34
- Козловская Н.Л., Боброва Л.А., Кирсанова Т.В., Шахнова Е.А., Метелева Н.А. Тромбоз/стеноз почечных артерий как проявление антифосфолипидного синдрома (АФС). Сборник тезисов всероссийской конференции с международным участие «Тромбозы, кровоточивость, ДВС-синдром: современные подходы к диагностике и лечению». М., 2009; приложение №7, с.51-52
- Bobrova L.A, Kozlovskaya N.L., Nemtsova M.V., Varshavsky V.A. Hereditary thrombophilia (HT) as a cause of renal thrombotic microangiopathy (TMA) in chronic glomerulonephritis (CGN) patients. Abstracts of World Congress of Nephrology in collaboration with ISN May 22-26, 2009 Milan, Italy: Sa 378
- Боброва Л.А., Козловская Н.Л., Шкарупо В.В., Варшавский В.А., Столяревич Е.С. Влияние генетической формы тромбофилии на клинико-морфологические проявления и характер течения хронического гломерулонефрита. Нефрология и диализ 2010; 1(12): 25- 33
- Боброва Л.А., Козловская Н.Л., Хафизова Е.Ю., Котлярова Г.В., Кирсанова Т.В., Шкарупо В.В. Тромбофилия и окклюзия почечных артерий. Врач 2010; 5: 12-16
- Bobrova L., Khafizova E., Kozlovskaya N.1, Varshavsky V., Stoliarevich E., Shkarupo V. ADAMTS13 activity in biopsy proven thrombotic microangiopathy (TMA) patients with thrombophilia. XLVII ERA-EDTA CONGRESS -II DGfN CONGRESS June 25-28, 2010, Munich, Germany. Nephrology Dialysis Transplantation Plus 2010 1(Supplement 2): ii85-ii86
Список сокращений
АГ – артериальная гипертензия
АД – артериальное давление
АТ – антитела
АКЛ – антитела к кардиолипину
АФА –антифосфолипидные антитела
АФС – антифосфолипидный синдром
АФСН – АФС –ассоциированная нефропатия
ВА – волчаночный антикоагулянт
ИГХ – иммуногистохимическое исследование
КТФ – комбинированная тромбофилия (НТФ + АФА)
МТФ – мультигенная тромбофилия
НТФ – наследственная тромбофилия
ПАФС – первичный антифосфолипидный синдром
РКФМ – растворимые комплексы фибрин - мономеров
Скр –креатинин сыворотки
СКФ – скорость клубочковой фильтрации
СПУ – суточная протеинурия
ТМА – тромботическая микроангиопатия
УЗДГ – ультразвуковая доплерография
ХГН – хронический гломерулонефрит

