Клинико – морфологические особенности инфаркта миокарда у больных сахарным диабетом 2 типа и оценка эффективности тромболитической терапии
На правах рукописи
Кузнецов Дмитрий Николаевич
КЛИНИКО – МОРФОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ИНФАРКТА МИОКАРДА У БОЛЬНЫХ САХАРНЫМ
ДИАБЕТОМ 2 ТИПА И ОЦЕНКА ЭФФЕКТИВНОСТИ
ТРОМБОЛИТИЧЕСКОЙ ТЕРАПИИ
14.01.05 – кардиология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Ижевск – 2013
Работа выполнена в Государственном бюджетном образовательном учреждении высшего профессионального образования «Ижевская государственная медицинская академия» Министерства Здравоохранения Российской Федерации
Научный руководитель
Казакова Ирина Александровна доктор медицинских наук, доцент
Официальные оппоненты:
Ежов Андрей Владимирович доктор медицинских наук, доцент
ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава РФ, профессор кафедры врача общей практики и внутренних болезней с курсом скорой медицинской помощи
Ховаева Ярослава Борисовна доктор медицинских наук, профессор ГБОУ ВПО «Пермской государственной медицинской академии им. академика Е.А. Вагнера» Минздрава РФ, заведующая кафедрой терапии и семейной медицины ФПК и ППС
Ведущая организация
ГБОУ ВПО «Нижегородская государственная медицинская академия» Минздрава РФ
Защита состоится «19» декабря 2013 г. в 12:30 часов на заседании диссертационного совета Д 208.029.01 при ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава РФ (426034, г. Ижевск, ул. Коммунаров, д. 281).
С диссертацией можно ознакомиться в библиотеке ГБОУ ВПО «Ижевская государственная медицинская академия» Минздрава РФ (426034, г. Ижевск, ул. Коммунаров, д. 281), с авторефератом на сайте ВАК МЗ http: // vak.ed.gov.ru, на сайте академии www. igma.ru.
Автореферат разослан « 15 » ноября 2013 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук Шкатова Елена Юрьевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Сердечно-сосудистые заболевания являются одной из главных проблем медицины XXI века (Российский статистический ежегодник. 2009, сайт Росстата – www.gks.ru, 2010). Это связано с несколькими причинами: высокой распространённостью, неуклонным ростом числа случаев сердечно-сосудистых заболеваний, высокой смертностью (Оганов Р.Г. 2006, Сердечно-сосудистые заболевания Информационный бюллетень №317 ВОЗ 2011, Какорин С.В. и соавт. 2013, Ringleb P.A., et al. 2008).
Среди общей смертности в России сердечно-сосудистые заболевания составляют 57,1% (в Удмуртской республике – 52,5%) (сайт Росстата – www.gks.ru, 2009, Гасников В.К. и соавт. 2011). Ежегодные затраты, связанные с ишемической болезнью сердца (ИБС), занимают первое место среди всех заболеваний, для которых проводился сравнительный анализ (Воробьев П.А. и соавт. 2004, Кэмм А.Д. и соавт. 2011).
В течение последних 10 – 15 лет сахарный диабет (СД) так же стал одной из актуальных проблем здравоохранения в большинстве развитых стран мира. Количество пациентов СД непрерывно растет, по расчётам специалистов к 2025 году будет насчитываться более 438 миллионов больных (около 5% населения земного шара) (Дедов И.И., Шестакова М.В. 2010, Бокарев И.Н. и соавт. 2010, Shaw J.E. et al. 2010, Radermecker R.P. et al. 2008). В Российской Федерации численность больных СД составляет около 9,6 миллионов человек (Информационный бюллетень №317 ВОЗ 2011, Diabetes Atlas. Four edition. International Diabetes Federation, 2009). В Удмуртской Республике за СД так же занимает лидирующее положение в структуре эндокринной патологии – 53,1% от всего количества диспансерных больных на 2010 год (Гасников В.К. и соавт. 2011). Проблема сердечно-сосудистых осложнений при СД является одной из самых актуальных в клинической кардиологии (Дедов И.И., Шестакова М.В. 2010, Александров А.А. и соавт. 2011, Какорин С.В. и соавт. 2013). Сочетание двух грозных заболеваний, СД и острого инфаркта миокарда (ОИМ), создаёт огромные трудности при лечении данной группы пациентов. Пациенты требуют дополнительного контроля и больших экономических затрат на лечение.
Реперфузионная терапия – наиболее важная составляющая стратегии лечения острого коронарного синдрома с подъёмом сегмента ST. Тромболитическая терапия остается наиболее доступным способом лечения, обязательным при отсутствии противопоказаний или недоступности черезкожного коронарного вмешательства (ВНОК 2007, Eagle K.A. et al. 2008, Danchin N. et al. 2008, Van de Werf F. et al. 2008, O'Connor R.E. et al. 2010). У пациентов с СД данные об эффективности проведения тромболитической терапии не многочисленны, исследования носят разрозненный и часто противоречивый характер.
Если учесть недоступность хирургических методик лечения ОИМ для большинства граждан Российской Федерации, то использование и развитие терапевтических методик и в частности тромболитической терапии становится одним из перспективных направлений.
Цель исследования
Изучить клинико-морфологические особенности ИБС, ассоциированной с СД на территории Удмуртской республики по результатам протоколов патологоанатомического исследования и оценить эффективность тромболитической терапии при ОИМ у больных с СД 2 типа.
Задачи исследования
1. Определить частоту встречаемости и структуру сердечно-сосудистой патологии у больных с СД в Удмуртской Республике по результатам протоколов патологоанатомического исследования.
2. Выявить особенности патологии сердца, ассоциированной с СД, в зависимости от пола, возраста пациентов, типа СД.
3. Установить некоторые особенности разрыва сердца у больных с ОИМ, ассоциированного с СД 2 типа, по результатам протоколов патологоанатомического исследования.
4. Проанализировать влияние тромболитической терапии препаратом «Алтеплаза» на клиническое течение ОИМ, ассоциированного с СД 2 типа, показатели маркеров некроза миокарда, изменение системной и внутрисердечной гемодинамики.
5. Изучить показатели электрокардиографии при тромболитической терапии препаратом «Алтеплаза», встречаемость ранних и поздних осложнений ОИМ, ассоциированного с СД 2 типа.
Научная новизна
Впервые определены частота встречаемости и структура сердечно-сосудистой патологии, ассоциированной с СД на территории Удмуртской республики по результатам протоколов патологоанатомического исследования; клинико-морфологические особенности ИБС, в частности ОИМ, ХСН, разрыва сердца.
Получены новые данные об особенностях разрыва сердца при ОИМ у больных СД 2 типа; установлена взаимосвязь от времени суток, пола, физической активности пациентов; выявлены различия по глубине поражения миокарда, морфологические особенности некроза сердечной мышцы, площади разрыва и объёму гемоперикарда.
Впервые изучена клиническая эффективность тромболитической терапии препаратом «Алтеплаза» у больных с ОИМ, ассоциированного с СД 2 типа.
Впервые определены особенности влияния тромболитической терапии на системную и внутрисердечную гемодинамику, электрокардиографические показатели сердца при ОИМ у больных с СД 2 типа.
Доказана эффективность и безопасность проведения тромболитической терапии препаратом «Алтеплаза», уменьшение количества ранних осложнений у больных с ОИМ, ассоциированного с СД 2 типа по выбранной схеме.
Практическая значимость работы
Представлены данные о частоте встречаемости, структуре заболеваемости ИБС и в частности ОИМ, ХСН у больных СД, которые позволяют улучшить оказание медицинской помощи и внести коррективы в систему диспансерного наблюдения у лиц с СД. Выявленные особенности разрыва сердца могут быть учтены при лечении пациентов с ОИМ. Совокупность полученных клинических, лабораторных и инструментальных данных позволяет расширить и углубить представления о возможностях тромболитической терапии у пациентов ОИМ и СД 2 типа. Схема проведения тромболитической терапии может быть использована у больных с СД 2 типа в практическом здравоохранении. Выбранная схема позволяет уменьшить количество ранних осложнений ОИМ и сократить время нахождения пациентов в палатах интенсивной терапии и реанимации.
Основные положения, выносимые на защиту
- В Удмуртской республике заболевания сердечно-сосудистой системы находятся на первом месте в структуре причин смерти больных СД 1 и 2 типа. У больных с СД 1 типа основной причиной смерти являются острые и инфекционные осложнения СД. У больных с СД 2 типа преобладают сердечно-сосудистые заболевания. ОИМ и ХСН чаще встречаются у больных СД 2 типа.
- Острый инфаркт миокарда у больных СД является причиной смерти у мужчин чаще, чем у женщин. У женщин частота встречаемости ХСН выше. ХСН чаще обусловлена атеросклеротическим кардиосклерозом. При морфологическом изучении сердца, у большинства пациентов с СД, выявляются разнообразные патологические изменения коронарных артерий и стенки левого желудочка. Диабетическая нефропатия 1 – 3 стадии влияет на течение сердечнососудистой патологии у больных СД, что является морфологическим проявлением кардиоренального синдрома.
- У пациентов с ОИМ, ассоциированным с СД 2 типа разрыв сердца встречается чаще, имеет свои клинико-морфологические особенности, влияет на течение и исход ОИМ.
- Применение тромболитической терапии препаратом «Алтеплаза» при ОИМ у больных СД 2 типа способствует улучшению клинико-функциональных показателей при ОИМ, положительно влияет на системную и внутрисердечную гемодинамику, позволяет сохранить насосную функцию левого желудочка, уменьшает QTd и QTcd, ограничивает зону и уменьшает массу некроза миокарда.
- Проведение ТЛТ препаратом «Алтеплаза», по выбранной схеме, у больных СД 2 типа, безопасно и эффективно, позволяет уменьшить количество ранних осложнений ИМ, сократить время нахождения пациентов в палатах реанимации.
Внедрение результатов исследования
Результаты исследования внедрены в практику кардиологического отделения для больных с инфарктом миокарда, отделения анестезиологии-реанимации №2 БУЗ ГКБ №6 г.Ижевска, БУЗ УР "Республиканский клинико-диагностический центр МЗ УР" отделения анестезиологии-реанимации №2. Материалы диссертации используются в учебном процессе на терапевтических кафедрах ГБОУ ВПО «Ижевская государственная медицинская академия».
Апробация работы
Основные положения диссертации доложены и обсуждены на межвузовской научной конференции «Актуальные медико-биологические проблемы» (Ижевск, 2007, 2009 – 2011); III общероссийской научной конференции «Современные проблемы науки и образования» (Москва, 2008); межрегиональной межвузовской научной конференции, посвященная 85-летию со дня рождения профессора Л.А. Лещинского «Опыт учителей в науке для решения проблем здоровья нации» (Ижевск, 2010); VI Международном конгрессе «Здоровье, демография, экология финно-угорских народов» (Ижевск, 2010), V Национальном конгрессе терапевтов (Москва, 2010), межрегиональной научно-практической конференции «Организационные аспекты модернизации здравоохранения и подготовки медицинских кадров в Российской Федерации» (Ижевск, 2011).
Публикации
По материалам работы опубликовано 18 печатных работ в сборниках и журналах, в том числе 3 статьи в журналах, рекомендованных Высшей аттестационной комиссией Министерства образования и науки Российской Федерации для публикаций основных научных результатов диссертаций по медицине.
Объем и структура диссертации
Диссертация изложена на 160 страницах машинописного текста. Состоит из введения, обзора литературы, главы материалов и методов исследования, двух глав собственных исследований, заключения, выводов, практических рекомендаций, списка литературы, который содержит 197 источников, из них отечественных – 112 и иностранных – 85. Работа иллюстрирована 37 таблицами, 24 рисунками и 2 клиническими примерами.
Личный вклад автора выразился в определении цели и задач исследования, выборе методов его выполнения, организации и проведении клинического обследования, анализе данных лабораторного и инструментального исследования, проведения лечения больных по выбранной методике, статистической обработке и оценке полученных материалов, обобщении результатов, подготовке публикаций и оформлении диссертации.
СОДЕРЖАНИЕ РАБОТЫ
Клинический материал, дизайн и методы исследования
Представленная работа состоит из двух частей.
Первая часть работы основана на результатах изучения материалов 323 протоколов вскрытия умерших больных города Ижевска и Удмуртской республики в кардиологическом отделения ГУЗ Республиканского клинико-диагностического центра Министерства здравоохранения Удмуртской республики, БУЗ ГКБ №6, отделения взрослой патологии республиканского патологоанатомического бюро за период с 2007 по 2011 год. Основную группу составили пациенты с СД (250 человек).
Во второй части работы проведено обследование и лечение 98 больных с ОИМ, находящихся на лечении в Кардиологическом отделении для больных с инфарктом миокарда БУЗ ГКБ №6 за период 2007-2011гг. Среди всех пациентов с ОИМ было 50 женщин (51,1%) и 48 мужчин (48,9%). Средний возраст обследуемых составил 64,1±5,6 лет.
Больные были рандомизированы в 3 группы.
Первая (1) – группа исследования (И), (29 человек) составили пациенты с СД 2 типа, доставленные в стационар в первые 6 часов от начала ОИМ. Данной группе была проведена тромболитическая терапия. (11 – мужчин и 18 – женщин). Возраст больных 63±2,6 лет.
Во вторую (2) группу сравнения (С) включены пациенты (32 человека) с СД 2 типа, доставленные в стационар в первые 6 часов от начала ОИМ (12 мужчин и 20 женщин). Возраст больных составил 68,5±7,4 лет. Тромболитическая терапия не проводилась из-за наличия противопоказаний.
Третья (3) контрольная (К) состояла из 37 пациентов не имеющие в анамнезе СД, получившие стандартную тромболитическую терапию (26 мужчин и 11 женщин). Возраст больных 61,6±5,5 года.
Пациенты, вошедшие в исследование, были уравновешены по полу, возрасту, а также – по имевшимся в анамнезе заболеваниям.
Все пациенты 1 и 2 группы находились в компенсированном и субкомпенсированном состоянии по показателям углеводного обмена на фоне приёма сахароснижающих препаратов (Манинил 1,75 и 3,5; Диабетон МВ). У всех пациентов с СД уровень HbA1c был ниже 7,5 %. Эндокринолог осматривал всех пациентов с СД в первые сутки госпитализации и проводил коррекцию инсулинотерапии. Пациенты с СД с первых суток нахождения в стационаре и в течение последующих 7-10 дней, с целью контроля гликемии, получали короткие инсулины, в индивидуально подбираемых дозах.
Тромболитическая терапия проводилась в 1 и 3 группе препаратом "Алтеплаза" по схеме: 15мг. препарата внутривенно болюсом, затем по 0,75мг/кг. в течение одного часа внутривенно за 30 мин, далее 0,5мг/кг в течение 1 часа; общая доза составляла до 100мг. Параллельно вводился гепарин внутривенно через инфузомат со скоростью 1тыс. Ед/час в течение 48 часов (под контролем АЧТВ). До начала тромболизиса все пациенты получали нагрузочную дозу клопидогреля 300 мг. и ацетилсалициловой кислоты 0,5 г. Все пациенты, в последующем, получали лечение согласно рекомендациям (ВНОК 2007, ЕОК 2008): антикоагулянты, антиагреганты, бета-блокаторы, ингибиторы АПФ, нитраты по потребности, статины.
Исследование проведено с получением добровольного информированного согласия больных в соответствии с требованиями Хельсинской декларации прав пациента (2008).
Критерием исключения из исследования являлось наличие противопоказаний к ТЛТ в соответствии с рекомендациями (ВНОК 2007, ЕОК 2008). Не включались в исследование больные с особенностями ЭКГ, затрудняющими оценку динамики конечной части желудочкового комплекса.
Больные наблюдались в стационаре в течение всего времени госпитализации (палаты интенсивной терапии, палаты реанимации, реабилитация проводилась в кардиологическом отделении).
При поступлении больного под наблюдение определялись данные клинического статуса: жалобы и анамнез заболевания, проводился объективный осмотр. При поступлении в стационар всем пациентам проводилась оценка тяжести и степени острой сердечной недостаточности по Killip и Kimball (1967).
Оценка тяжести развивающейся ХСН после ОИМ и функциональных возможностей (состояния) пациентов проводилась на основании функционального класса и стадии ХСН, шкалы оценки клинического состояния (ШОКС), теста шестиминутной ходьбы.
Общеклиническое обследование включало: общий анализ крови, биохимические анализы крови с определением: липидного спектра – общий холестерин (ОХ), триглицериды (ТГ), липопротеиды высокой плотности (ЛПВП) проводилось спектрофотометрическим методом; липопротеиды низкой плотности (ЛПНП) расчитывались по формуле Friedward (1972), проводилась оценка активности ферментов КФК-МВ, качественное определение суммарной фракции тропонинов Т и I, ферментов общей ЛДГ, АСТ, АЛТ спектрофотометрическим методом на автоматическом анализаторе FP-901-М со встроенным микропроцессором «LabSystems» (Финляндия 2004); показатели свёртываемости крови: АЧТВ, ПТИ, фибриноген на коагулометре «CORMAY KG4» (Польша 2004).
Для оценки состояния углеводного обмена определялся уровень глюкозы крови в 8 часов утра (натощак), 11 часов (до обеда) и 16 часов (до ужина). Для определения уровня глюкозы использовали цельную кровь обследуемых больных с применением глюкозооксидазного метода на анализаторе глюкозы "Эксан-Г" (Литва 2005).
Проводилось инструментальное обследование. ЭКГ: ежедневно в первые трое суток и на 5, 7, 10 день исследования на многоканальном электрокардиографе «Альтон» (Россия 2007). Об эффективности проводимой ТЛТ судили по динамике сегмента ST на ЭКГ через 90 и/или 180 минут от начала ТЛТ.
Оценивалась масса некроза миокарда по методу Wagner c соавт. (1982): по ЭКГ, записанной на 10 день заболевания. ЭХОКГ: на 2 день исследования и при выписке на аппарате Philips HD7XE (США 2008). Рентгенологическое исследование лёгких. Суточное мониторирование ЭКГ («Холтер») на мониторе МЭКГ-НС-2с (Россия 2009). Артериальное давление (АД) регистрировалось по методу Короткова. Рассчитывался индекс пульсового давления (ИПД) по формуле: ИПД = САД ЧСС/100.
Диагностику ОИМ проводили согласно рекомендациям (ВНОК 2007).
В качестве конечных точек исследования использовались: клинические исходы заболевания (смертность, выписка из стационара).
Статистическая обработка данных проводилась с использованием пакета прикладных программ Statistica V.6 и Excel (2007). Определялись основные статистические характеристики: среднее значение (М), ошибка среднего (m), стандартное отклонение (SD). В зависимости от типа распределения использовались параметрические (критерий t Стьюдента) и непараметрические (критерий хи-квадрат) методы статистического анализа. При сравнении вариационных рядов о достоверности количественных различий судили по вероятности возможной ошибки (р), которая определялась программой и критерия согласия (критерий ). Достоверным считались различия при уровне вероятности менее 5% (р<0,05). Проводился однофакторный корреляционный анализ (Pearson). Характер и сила линейной связи определялись с помощью коэффициента корреляции (r). Корреляция считалась достоверной при уровне значимости р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Как показали результаты нашего исследования, больные с СД на протяжении последних лет (2007-2011гг.) стабильно составляют большую группу умерших, в среднем до 7,2% от общего числа патологоанатомических исследований в Удмуртской республике. СД 2 типа встречался у 204 (81,6%) человек, СД 1 типа – 46 (18,4%) человек (=26,74, p < 0,001). У мужчин частота встречаемости СД 1 типа (27,0%), была выше, чем у женщин (14,7%). СД 2 типа чаще встречался у женщин (85,3%), чем у мужчин (73,0%). Средний возраст, умерших с диагнозом СД 1 типа был 43,0±5,6 года, с СД 2 типа – 66,3±1,4 лет (p<0,001). Продолжительность жизни больных с СД 2 типа была выше в 1,5 раза. Смертность в молодом возрасте больных с СД 1 типа была обусловлена развитием почечной недостаточности (37,1±10,2 лет.) и инфекционными осложнениями (гангрена, диабетическая стопа, сепсис) (31,1±5,5 года.).
Основной причиной смерти при СД 1 и 2 типа были сердечно-сосудистые и цереброваскулярные заболевания (149 человек – 59,7%) (рис.1). У больных с СД 1 типа, в качестве причины смерти, преобладали острые и инфекционные осложнения (22 человек – 48,6%). У больных с СД 2 типа преобладали сердечно-сосудистые заболевания, которые и были основной причиной смерти (133 человек – 65,2%). При СД 1 типа сердечно-сосудистые заболевания стали причиной смерти 14 (30,4%) человек.

Рис.1. Структура причин смерти больных с сахарным диабетом.
От патологии сердца (инфаркт миокарда и ХСН) умерло 74 человека, что составило 29,5% от общего числа пациентов. ОИМ стал причиной смерти 33 (13,2%) больных ХСН – 41 (16,4%). От патологии сердца (инфаркт миокарда и ХСН) при СД 1 типа умерло 7 (15,2%) человек, при СД 2 типа – 67 (32,8%). Возраст больных с СД 1 и 2 типа при ОИМ и ХСН не имел достоверных различий.
ОИМ был причиной смерти у мужчин (15 человек – 62,5%) чаще, чем у женщин (18 человек – 36%) (=4,14, p < 0,05). Среди больных преобладала переднебоковая локализация инфаркта миокарда (22 человек – 66,7%). У женщин частота встречаемости ХСН была выше (женщины – 64,0%, мужчины – 37,5%) (=4,31, p < 0,05). ХСН чаще была обусловлена атеросклеротическим кардиосклерозом (23 человек – 56,1%).
При морфологическом изучении сердца фиброзные изменения в миокарде (56,0%), атеросклеротическое поражение коронарных артерий (55,2%) и гипертрофия миокарда (33,2%) наблюдались у большинства пациентов СД. Фиброзные изменения миокарда у 102 (72,8%) человек были следствием атеросклеротического кардиосклероза, у 38 (27,2%) – постинфарктного кардиосклероза. Атеросклеротический кардиосклероз встречался при СД 1 типа у 11 (23,9%) человек, при СД 2 типа у 91 (44,6%). Постинфарктный кардиосклероз встречался при СД 1 типа у 4 (8,6%) больных, при СД 2 типа у 34 (16,6%). Гипертрофия миокарда, вследствие сопутствующей артериальной гипертонии наблюдалось у 82 (33,2%) человек: при СД 1 типа у 6 (13,1%) человек, при СД 2 типа у 76 (37,3%). Масса миокарда составила 514,2±33,1 грамм (норма – до 185 грамм), толщина стенки левого желудочка – 2,15±0,1 см. (норма – до 1,2 см.). Поражение коронарных артерий при СД 1 и 2 типа наблюдалось у 138 (55,2%) человек. У пациентов с СД 1 типа поражение коронарных артерий было у 18 (41,3%) человек, при СД 2 типа у 120 (58,8%). Осложненная фиброатерома являлась наиболее часто встречающимся типом поражения коронарных артерий (57 человек – 41%) (рис.2).
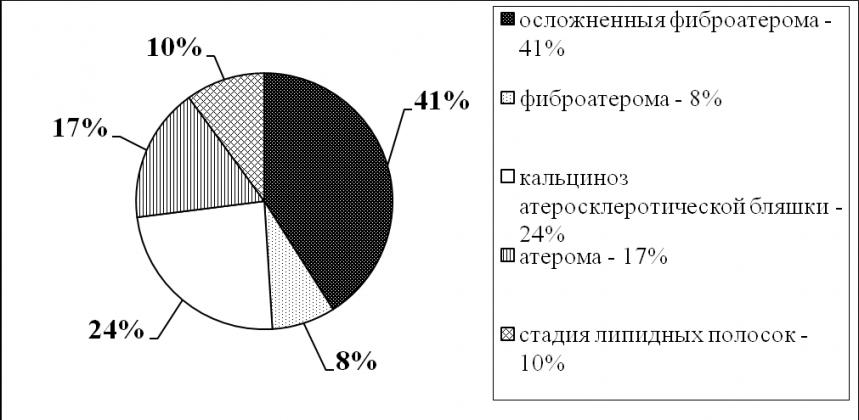
Рис. 2. Наблюдаемые типы атеросклеротического поражения артерий.
Диабетическая нефропатия 1 – 3 стадии наблюдалась у 95 (38%) больных СД. При СД 1 типа диабетическая нефропатия наблюдалась у 21 (45,6%) человек, при СД 2 типа у 74 (36,3%). У больных с СД 1 типа и диабетической нефропатией чаще встречалась ХСН (ХСН была у 57,1% пациентов с СД и диабетической нефропатией, у 12% пациентов без диабетической нефропатии) (=21,12, p<0,001), что являлось проявлением кардиоренального синдрома. ОИМ встречался чаще у больных с СД 1 типа при сочетании с диабетической нефропатией (ОИМ был у 14,2% пациентов с диабетической нефропатией; при отсутствии диабетической нефропатии ОИМ не встречался).
Нами была изучена частота встречаемости и особенности разрыва сердца у больных СД 2типа.
Как следует из данных нашего исследования, разрывы миокарда чаще всего происходили в первые 7 суток госпитализации в стационар (90,1%). Среднее время госпитализации составило 4,8±3,8дней у пациентов с СД 2 типа, у пациентов без СД – 4,3±4,2дней (p>0,05). Все исследованные случаи разрыва миокарда при ОИМ были внешними и закончились летальным исходом. Разрыв миокарда происходил чаще в утренние и вечерние часы суток (с 7 до 11 часов утра – 31% и с 16 до 21 часов – 31%), во время увеличения физической активности пациентов. Количество разрывов миокарда уменьшалось в период сна пациентов в стационаре (тихий час – с 13 по 16 часов и ночной сон с 22 по 6 часов). Разрыв сердца встречался у пациентов с СД 2 типа чаще в 1,8 раза (33,3% – с СД 2 типа, 18,2% – без СД) (=4,47, p < 0,05). У женщин (женщины – 60,3%, мужчины – 39,7%) (=4,55, p < 0,05) с ОИМ без СД разрыв миокарда встречался чаще, тогда как среди пациентов с СД 2 типа и разрывом сердца преобладали мужчины (мужчины – 63,6%, женщины – 36,4%) (=5,29, p < 0,05). Средний возраст умерших с ОИМ без СД составил 67,2±8,4 года, с СД 2 типа – 69,0±2,6 года и не имел существенных различий (p>0,05).
Разрыв миокарда чаще был осложнением острого первичного инфаркта миокарда (пациенты с СД 2 типа – 72,7%, пациенты без СД – 75,3%), что вероятно связано с отсутствием развитого коллатерального кровообращения и большей глубиной поражения стенки миокарда. Трансмуральный инфаркт миокарда был у 90,9% пациентов с СД 2 типа и 47,9% – без СД (=7,51, p < 0,01). У пациентов с СД 2 типа наблюдалось более глубокое поражение стенки миокарда, что напрямую было связано с частотой встречаемости разрыва миокарда при ОИМ. Инфаркт миокарда и разрыв сердца чаще локализовались на передней стенке ЛЖ в обеих группах пациентов (пациенты с СД 2 типа – 63,6%, пациенты без СД – 54,8%). Морфологические особенности, обнаруженные при патологоанатомическом исследовании, были представлены: гипертрофией стенки ЛЖ, увеличением массы миокарда, гипертрофией кардиомиоцитов, стромальным отёком, лимфо-лейкоцитарной инфильтрацией в зоне инфаркта миокарда. У пациентов с СД 2 типа при микроскопии мышцы сердца преобладали: лимфо-лейкоцитарная инфильтрация, стромальный отек, замещение миоцитов жировой тканью (табл. 1).
Размер разрыва сердца у пациентов с СД 2 типа был больше и составил 2,8±0,5 см., у больных без СД – 1,5±0,3см. (p < 0,05). У всех пациентов в нашем исследовании сформировался гемоперикард, объём гемоперикарда в среднем составил 351,0±20,5 мл. у пациентов с СД 2 типа и 270,7±26,8 мл. у пациентов без СД (p < 0,05).
Локализация и механизм разрыва сердца при ОИМ не имел существенных различий между группами, что говорит за однотипность процессов некроза в мышце сердца.
Таблица 1.
Морфологические особенности при патологоанатомическом исследовании сердца.
| Признак | Пациенты с СД чел. (%) | Пациенты без СД чел. (%) | |
| гипертрофия кардиомиоцитов | 6 (54,5%) | 39 (53,4%) | 0,15 |
| стромальный отек | 6 (54,5%) | 18 (24,7%) | 5,35* |
| лейкоцитарная инфильтрация | 4 (36,4%) | 26 (35,6%) | 0,07 |
| лимфо-лейкоцитарная инфильтрация | 6 (54,5%) | 15 (20,5%) | 7,24** |
| участки грануляции и соединительной ткани | 2 (18,2%) | 15 (20,5%) | 0,03 |
| замещение миоцитов жировой тканью | 4 (36,4%) | 4 (5,5%) | 10,58*** |
Примечание: *p < 0,05, **p < 0,01, ***p < 0,001
Особенностью разрыва сердца у пациентов с СД 2 типа стали: большая частота встречаемости среди больных, связанная с выраженностью поражения коронарных артерий, глубоким поражением стенки миокарда, выраженностью воспалительных и деструктивных явлений вследствие отсутствия компенсаторных механизмов; частое выявление данного осложнения у мужчин, большая площадь разрыва и объём гемоперикарда.
Во второй части нашего исследования, после проведения лечения 98 больных ОИМ, мы получили следующие результаты.
При проведении лечения в первые сутки, количество пациентов с болевым синдромом уменьшилось во всех группах: 1 группа % – на 69,6%, 2 группа % – на 52%, 3 группа % – на 83,3%. Более выраженное уменьшение количества пациентов с болевым синдромом наблюдалось в 1 и 3 группе, где проводилась тромболитическая терапия. Ранняя постинфарктная стенокардия встречалась чаще во 2 группе пациентов в период с 1 суток госпитализации и до момента выписки (1 группа – 6,9% пациентов, 2 группа – 25% пациентов, 3 группа – 5,4% пациентов) (рис. 3). В период с момента поступления до 3 суток госпитализации количество пациентов с жалобами на одышку в покое, чувством нехватки воздуха во всех группах пациентов уменьшилось соответственно: 1 группа % – на 71,4%, 2 группа % – на 37,5%, 3 группа % – на 80,0%. Количество пациентов с жалобами на одышку в период с 3 суток до момента выписки из стационара уменьшилось соответственно: 1 группа % – на 25%, 2 группа % – на 40%, 3 группа % – на 66,7% (рис. 4).

Рис. 3. Динамика болевого синдрома при различных вариантах терапии.

Рис. 4. Динамика жалоб среди пациентов на общую слабость и чувство нехватки воздуха, одышку.
Для качественного, объективного анализа и оценки синдрома сердечной недостаточности использовалась шкала ШОКС. Количество баллов по ШОКС в первые сутки у пациентов 1 группы было – 10,5±0,3, во 2 группе – 10,2±0,5, 3 группе – 10,1±0,4 (p>0,05). Выраженное уменьшение количества баллов по шкале ШОКС наблюдалось в первые трое суток в 1 и 3 группе (% – на 21,9%, % – на 21,7%) и было обусловлено проведением тромболитической терапии препаратом «Алтеплаза». В 2 группе пациентов количество баллов по ШОКС уменьшилось на 9,8%. Количество баллов по ШОКС при выписке у пациентов 1 группы было – 6,9±0,4, во 2 группе – 8,3±0,2, в 3 группе – 6,3±0,3 (p<0,05). Проведение тромболитической терапии в 1 и 3 группе пациентов позволило достоверно уменьшить количество баллов по ШОКС при выписке из стационара.
С целью оценки динамики ФК ХСН проводился тест дистанции 6-минутной ходьбы. Значения теста 6-минутной ходьбы на 10-12 сутки госпитализации составили в 1группе – 215,7±15,6 м; во 2 группе – 184,9±21,2 м; в 3 группе – 211,8±24,4 м. (p>0,05). В процессе терапии наблюдался достоверный рост дистанции 6-минутной ходьбы в 3 (298,5±25,7 м.) ( %=+40,9, p<0,05) группе наблюдения. В 1 (254,6±22,4 м.) ( %=+18, p>0,05) и 2 (203,8±13,7 м.) ( %=+10, p>0,05) группах дистанция 6-минутной ходьбы имела лишь тенденцию к росту.
У всех пациентов проводилась оценка маркёров некроза миокарда в первые 48 часов нахождения в стационаре. По результатам нашего исследования, пациенты с ОИМ и СД 2 типа имеют достоверно высокий уровень кардиоспецифических маркеров некроза миокарда: высокий уровень лейкоцитов и ЛДГ. У пациентов с СД 2 типа при консервативном методе лечения (2 группа) наблюдался достоверно высокий уровень КФК-МВ фракции и чаще встречался положительный результат суммарной фракции тропонинов T и I, что свидетельствовало о большей площади поражения сердечной мышцы (табл. 2).
Таблица 2.
Биохимические показатели маркеров некроза миокарда у больных острым инфарктом миокарда на второй день госпитализации.
| Маркеры | Группа 1 | Группа 2 | Группа 3 | Нормальные значения показателя |
| Лейкоциты 109л. | 11,8±2,2 | 13,4±2,5 | 8,2±2,1* | До 10 |
| ACT Ед/л. | 159,2±3,8 | 163,9±3,5 | 162,5±4,3 | < 40 |
| АЛТ Ед/л. | 41,5±6,1 | 58±4,2 | 45,1±5,2 | < 40 |
| ЛДГ общая фракция Ед/л. | 948±52,4 | 745±25,3 * | 657±45,4 * | 225-450 |
| КФК Ед/л. | 610 ±54,8 | 718±76,2 | 570±52,7 | 24-190 |
| КФК-МВ Ед/л. | 54,1±5,4 | 75,3 ±3,8 * | 51,3 ±5,1 | < 25 |
| суммарная фракция тропонинов Т и I (положит.) | 26% | 40% * | 30% | отрицательно 0% |
Примечание: *p < 0,05 разница между группами.
Оценка параметров системной гемодинамики проводилась на основании контроля АД и ЧСС. Исходно, во всех группах имелась артериальная гипертония (САД: 1 группа – 151,2±10,5мм.рт.ст., 2 группа – 146,5±12,7 мм.рт.ст., 3 группа – 131,6±16,6 мм.рт.ст.; ДАД: 1 группа – 88,7±8,9 мм.рт.ст., 2 группа – 82,5±11,5 мм.рт.ст., 3 группа – 80,6±6,6 мм.рт.ст.) и синусовая тахикардия (1 группа – 86,2±1,4 в мин., 2 группа – 86,3±2,3 в мин., 3 группа – 86,4±2,4 в мин.) (p>0,05 разница между группами). При проведении тромболитической терапии в 1 группе наблюдалась выраженная положительная динамика нормализации пульса (с 86,2±1,4 в мин. до 74,2±1,2 в мин.; % на -13,9%) и ИПД (с 130,3±4,7 до 102,5±1,6; % на -21,3%)(p<0,05). Во 2 (ИПД снизился с 126,4±6,4 до 119,4±2,1; % на - 5,5%), и 3 (ИПД снизился с 115,7±4,6 до 106,3±5,5; % на - 8,1%), группе разница была менее выраженной и не достигла критериев достоверности (p>0,05).
При проведении Эхо-КГ на 10 сутки госпитализации выявлена статистически достоверная разница показателей ФВ между пациентами при проведении тромболитической терапии (группы 1 и 3) и без неё (группа 2), КДР, ИКДР, КДО и ИКДО. В 1 и 3 группе пациентов наблюдалась положительная динамика показателей: ФВ левого желудочка и МО кровообращения; уменьшились показатели КСР, КДР ЛЖ, ИКДР. Во 2 группе пациентов выявлено ухудшение показателей КСР, КДР, ИКДР, МОК, ФВ, КДО и ИКДО, что свидетельствовало о выраженном и прогрессирующем снижении функции левого желудочка при проведении консервативной терапии инфаркта миокарда. В 1 и 3 группе пациентов наблюдалось достоверное уменьшение массы миокарда. Во 2 группе пациентов было увеличение массы миокарда за счет повышения КДР (табл. 3).
В начале терапии во всех группах наблюдался гипертрофический тип ремоделирования левого желудочка (ИОМ: 1 группа – 0,6±0,07 мл/г., 2 группа – 0,6±0,06 мл/г., 3 группа – 0,5±0,06 мл/г.). В динамике в 1 и 2 группе пациентов наблюдался рестрективный тип ремоделирования ЛЖ (ИОМ: 1 группа – 0,7±0,06 мл/г., 2 группа – 0,7±0,07 мл/г., 3 группа – 0,6±0,07 мл/г.) за счет увеличения КДО ЛЖ.
Таблица 3.
Изменение внутрисердечной гемодинамики в группах пациентов с острым инфарктом миокарда при различных вариантах терапии.
| Параметры | Группа 1 (n=29) чел.(%) | Группа 2 (n=32) чел.(%) | Группа 3 (n=37) чел.(%) | |||||||
| на 2 сутки | на 10 сутки | % | на 2 сутки | на 10 сутки | % | на 2 сутки | на 10 сутки | % | ||
| ЛП (см.) | 4,3±0,6 | 4,4±0,7 | 2,3 | 4,5±0,6 | 4,4±0,8 | -2,3 | 4,6±0,8 | 4,5±0,7 | -2,2 | |
| КСР (см.) | 4,2±0,6 | 3,7±0,9 | -11,9 | 3,8±0,41 | 3,9±0,4 | 2,6 | 3,8±0,8 | 3,1±0,4 | -18,4 | |
| КДР (см.) | 4,5±0,8 | 4,2±0,9 | -6,7 | 4,6±0,8 | 5,2±0,6* | 13,1 | 4,3±0,7 | 4,1±0,5 | -4,6 | |
| ИКДР (мм/м.) | 33,7±0,6 | 31,4±0,5 | -6,7 | 33,8±0,5 | 38,2±0,6* | 13,1 | 33,6±0,6 | 34,3±0,5 | -4,6 | |
| КСО (мл.) | 101±5,6 | 102±6,1 | 1,3 | 102±4,7 | 106±6,7 | 3,9 | 102±5,8 | 103±5,9 | 0,9 | |
| КДО (мл.) | 131±8,4 | 127±7,5 | -3,5 | 141±8,6 | 161±12,0* | 14,2 | 113±9,6 | 109±8,6 | -3,5 | |
| ИКСО (мл/м.) | 44,8±3,4 | 45,7±4,2 | 2,1 | 45,3±4,1 | 47,1±3,4 | 3,9 | 45,3±3,5 | 45,7±4,1 | 0,9 | |
| ИКДО (мл/м.) | 58,2±6,2 | 56,4±7,2 | -3,1 | 62,7±7,1 | 71,5±6,7* | 14,1 | 50,3±5,3 | 48,4±4,7 | -3,6 | |
| УО (мл.) | 65±5,6 | 62±7,1 | -4,6 | 61±3,4 | 57±5,4 | -6,6 | 59±6,3 | 64±6,1 | 8,5 | |
| МОК (л/мин.) | 4,9±0,4 | 5,8±0,3 | 18,4 | 5,1±0,4 | 4,5±0,5* | -11,8 | 4,6±0,9 | 5,3±0,7 | 15,2 | |
| ФВ % | 59±6,4 | 67±9,3 | 13,6 | 61±8,6 | 48±11,2* | -21,3 | 52±5,7 | 63±8,4 | 21,2 | |
Примечание: *p < 0,05 разница показателей между группами на 10 день госпитализации.
Успешный тромболизис по электрокардиографическим критериям проведен в 1 группе у 12 (41,2%) пациентов и в 3 группе у 19 (51,4%) пациентов. Тромболизис с положительной динамикой по ЭКГ наблюдался у 23 (79,3%) больных – 1 группы, 27 (72,7%) больных – 3 группы. Динамика сегмента ST во 2 группе пациентов была замедленной и на 3 сутки госпитализации, подъём сегмента ST сохранялся у 16 (50%) больных.
При изучении динамики показателей реполяризации желудочков у больных с ИМ (дисперсия интервала QT – QTd и корригированного QT – QTcd) отмечено, что у всех больных с ОИМ при поступлении наблюдалась выраженная дисперсия интервала QT и корригированного интервала QT. За период лечения в стационаре во всех 3-х группах пациентов наблюдалось уменьшение дисперсии интервала QT и корригированного интервала QT. Изменения были более выражены в 1 (% – 16,7%) и 3 (% – 23,8%) группе пациентов в первые трое суток госпитализации (табл. 4).
Таблица 4.
Показатели QTd и QTcd.
| Признак | Группа 1 | Группа 2 | Группа 3 | ||||||
| при поступлении | на 3 сутки | на 7-10 сутки | при поступлении | на 3 сутки | на 7-10 сутки | при поступлении | на 3 сутки | на 7-10 сутки | |
| QTd мс. | 61,5±2,4 | 51,2±1,8* | 48,1±2,2 | 60,0±2,1 | 53,3±1,7 * | 50,2±2,1 | 58,2±2,9 | 44,3±2,9 * | 36,2±2,4 * * |
| QTcd мс. | 67,8±3,8 | 56,1±2,4* | 53,1±2,1 | 67,3±2,4 | 60,1±2,5* | 56,9 ±3,8 | 67,2 ±2,5 | 52,2 ±3,2 * | 43,3±2,5 * * |
Примечание : *p<0,05 достоверность между показателями на 1 и 3 сутки госпитализации, **p<0,05 достоверность между показателями на 3 и 7 сутки госпитализации
У пациентов 2 группы масса некроза миокарда была достоверно выше (1 группа – 21,5±2,0%, 2 группа – 26,5±2,5%*, 3 группа – 20,0±1,5%) (*p<0,05). В 3 группе пациентов наблюдались наименьшая масса некроза миокарда, дисперсия интервала QTd, QTcd и гипертрофический тип ремоделирования левого желудочка. Во все группах пациентов имелась достоверная прямая корреляционная зависимость между массой некроза миокарда и КДО левого желудочка и обратная корреляционная зависимость показателей массы некроза миокарда и дисперсии интервала QT (табл. 5).
Таблица 5.
Корреляционная связь между массой некроза миокарда и электрокардиографическими, эхокардиографическими параметрами.
| Признак | Группа 1 | Группа 2 | Группа 3 | |||
| r | p | r | p | r | p | |
| КДО | 0,54 | < 0,05 | 0,74 | < 0,05 | 0,58 | < 0,05 |
| ИОМ (мл/г.) | 0,24 | > 0,05 | 0,58 | < 0,05 | 0,68 | < 0,05 |
| QTd мс. | – 0,64 | < 0,05 | – 0,6 | < 0,05 | – 0,68 | < 0,05 |
| QTcd мс. | – 0,64 | < 0,05 | – 0,6 | < 0,05 | – 0,68 | < 0,05 |
Примечание: r – коэффициент корреляции, p – достоверность корреляции.
Общая продолжительность госпитализации пациентов не имела различий (1 группа – 24,6±4,5 дней, 2 группа – 25,6±4,5 дней, 3 группа – 24,7±5,1 дней) (p>0,05); длительность нахождения в отделение реанимации: в 1 группе была – 4,5±0,5 дней, во 2 группе была продолжительнее – 6,7±0,6 дней (p<0,05 в сравнении с 1 и 3 группой), в 3 группе – 4,2±0,4 дней.
Проведение тромболитической терапии уменьшало количество ранних осложнений ИМ: общего количества осложнений, количество рецидивов ИМ, АВ-блокад II - III степени, количество случаев синдрома Фредерика; что сокращало время нахождения пациентов в палатах интенсивной терапии и реанимации (табл. 6).
Таблица 6.
Ранние осложнения инфаркта миокарда.
| Осложнение | Группа 1 | Группа 2 | Группа 3 | |
| Всего пациентов чел. | 29 (100%) | 32 (100%) | 37 (100%) | --- |
| Всего, абс. (%) | 19 (65,5%) | 26 (81,3%) | 20 (54,1%) | 4,83* |
| экстрасистолия, абс. (%) | 9 (31,0%) | 10 (33,3%) | 12 (32,4%) | --- |
| повышение температуры, абс. (%) | 5 (17,2%) | 3 (9,4%) | 5 (13,5%) | --- |
| АВ-блокада I степени, абс. (%) | 5 (17,2%) | 0 | 2 (5,4%) | --- |
| АВ-блокада II - III степени, абс. (%) | 0 | 4 (12,5%) | 0 | 9,43** |
| фибрилляция предсердий, абс. (%) | 2 (6,9%) | 4 (12,5%) | 0 | --- |
| синдром Фредерика, абс. (%) | 0 | 3 (9,4%) | 1 (2,7%) | 6,74** |
| рецидив ИМ, абс. (%) | 0 | 2 (6,3%) | 0 | 4,91* |
Примечание: *p < 0,05, **p < 0,01 разница между группами.
Наличие сопутствующего СД 2 типа приводило к большему количеству поздних осложнений ИМ: общего количества осложнений, случаев перикардита, пневмонии, блокад ножек пучка Гиса; в 1 и 2 группе больных за период госпитализации не зависимо от проведения тромболитической терапии (табл. 7).
Таблица 7.
Поздние осложнения инфаркта миокарда.
| Осложнение | Группа 1 | Группа 2 | Группа 3 | |
| Всего пациентов чел. | 29 (100%) | 32 (100%) | 37 (100%) | --- |
| Всего, абс (%) | 14 (48,3%) | 19 (59,4%) | 6 (16,2%) | 17,22*** |
| Перикардит, абс. (%) | 5 (17,2%) | 6 (18,8%) | 1 (2,7%) | 10,15*** |
| Пневмония, абс. (%) | 3 (10,3%) | 4 (12,5%) | 1 (2,7%) | 6,43** |
| синдром Дресслера, абс. (%) | 2 (6,8%) | 1 (3,1%) | 2 (5,4%) | --- |
| блокада ножек пучка Гиса, абс. (%) | 3 (10,4%) | 4 (12,5%) | 1 (2,7%) | 10,15*** |
| АВ-блокада II степени, абс. (%) | 0 | 0 | 1 (2,7%) | --- |
| Стенокардия при выписке, абс. (%) | 1 (3,4%) | 4 (12,5%) | 0 | 9,43** |
Примечание: **p < 0,01, ***p < 0,001 разница между группами.
Во время нашего исследования не возникло осложнений (геморрагический инсульт, желудочно-кишечное кровотечение, кровоизлияние в сетчатку глаза, аллергические реакции), вызванных применением тромболитического препарата «Алтеплаза».
ВЫВОДЫ
- В Удмуртской республике в структуре причин смерти больных СД 1 и 2 типа на первом месте находятся заболевания сердечно-сосудистой системы (59,7%). У больных с СД 1 типа основной причиной смерти являются острые и инфекционные осложнения (диабетическая стопа, гангрена, сепсис) (48,6%). У больных с СД 2 типа преобладают сердечно-сосудистые заболевания (65,2%). От патологии сердца (ИМ и ХСН) умерло 29,5% пациентов. ОИМ и ХСН встречаются в 2,2 раза чаще у больных СД 2 типа (СД 2 типа – 32,8%, СД 1 типа – 15,2%).
- ОИМ у больных СД является причиной смерти у мужчин (62,5%) чаще, чем у женщин (36%). Среди больных преобладает переднебоковая локализация ИМ (66,7%). У женщин частота встречаемости ХСН выше (женщины – 64,0%, мужчины – 37,5%). ХСН чаще обусловлена атеросклеротическим кардиосклерозом (56,1%). При морфологическом изучении сердца у большинства пациентов с СД выявляются множественные патолого-морфологические изменения. Поражение коронарных артерий при СД 1 и 2 типа наблюдается у большинства пациентов (55,2%) и наиболее часто представлено осложненной фиброатеромой (41%). Диабетическая нефропатия 1 – 3 стадии наблюдается у 38% больных СД. У больных с СД 1 типа и диабетической нефропатией чаще встречается ХСН и ОИМ, что является морфологическим проявлением кардиоренального синдрома.
- Разрыв сердца является ранним летальным осложнением инфаркта миокарда у больных СД 2 типа, встречается чаще в 1,8 раза (33,3% – с СД 2 типа, 18,2% – без СД), преобладает среди мужчин (мужчины – 63,6%, женщины – 36,4%), происходит в первые семь суток стационарного лечения (90,1%), в утренние и вечерние часы суток (с 7 до 11 часов утра – 31% и с 16 до 21 часов – 31%), во время увеличения физической активности пациентов.
- У пациентов СД 2 типа наблюдается большая глубина и площадь поражения стенки миокарда. У пациентов СД 2 типа при микроскопии мышцы сердца преобладают воспалительные и некротические изменения: лимфо-лейкоцитарная инфильтрация (пациенты с СД – 54,5%, пациенты без СД – 20,5%), стромальный отек (пациенты с СД – 54,5%, пациенты без СД – 24,7%), замещение жировой тканью (пациенты с СД – 36,4%, пациенты без СД – 5,5%). Размер разрыва сердца и объём гемоперикарда у пациентов с СД 2 типа больше.
- Применение тромболитической терапии препаратом «Алтеплаза» при ОИМ у больных СД 2 типа, улучшает клиническое состояние пациентов, уменьшает количество случаев ранней постинфарктной стенокардии, уменьшает проявления и замедляет прогрессирование ХСН, улучшает переносимость физической нагрузки пациентов в раннем периоде госпитализации, усиливает клинический эффект стандартной терапии, положительно влияет на системную и внутрисердечную гемодинамику, уменьшает QTd и QTcd, снижает уровень кардиоспецифических маркеров, ограничивает зону и уменьшает массу некроза миокарда.
- Проведение ТЛТ препаратом «Алтеплаза», по выбранной схеме, у больных СД 2 типа безопасно, эффективно, позволяет уменьшить количество ранних осложнений ИМ (общего количества осложнений, количество рецидивов ИМ, АВ-блокад II - III степени, количество случаев синдрома Фредерика) и сократить время нахождения пациентов в палатах реанимации на 2 дня (на 33%).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
В остром периоде инфаркта миокарда у больных с СД рекомендуется проведение тромболитической терапии в первые 6 часов заболевания препаратом «Алтеплаза». Схема проведения тромболитической терапии: 15мг. препарата «Алтеплаза» внутривенно болюсом, затем по 0,75 мг/кг. в течение одного часа внутривенно за 30 минут, далее 0,5 мг/кг. в течение 1 часа, общая доза составляет до 100 мг. за 1,5 часа; параллельно вводится нефракционированный гепарин внутривенно через инфузомат со скоростью 1тыс. Ед/час. в течение 48 часов (под контролем АЧТВ), до начала тромболитической терапии все пациенты получают двойную антиагрегантную терапию, в виде нагрузочной дозы клопидогреля 300 мг. и ацетилсалициловой кислоты 0,5 г. Коррекция гипергликемии проводится короткими инсулинами, в индивидуально подбираемых дозах. Выбранная схема позволяет улучшить клиническое состояние пациентов, уменьшить проявления и замедлить прогрессирование ХСН, количества ранних осложнений ИМ, усиливает клинический эффект стандартной терапии.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Кузнецов Д.Н. Причины смерти больных сахарным диабетом / Д.Н. Кузнецов, Е.А. Черниенко // Актуальные медико-биологические проблемы: материалы III межрегиональной межвузовской научной конференции (24-27 апреля 2006г., Ижевск). – Ижевск., 2006. – С. 146-149.
- Кузнецов Д.Н. Роль поражения сердечно-сосудистой системы в структуре непосредственных причин смерти больных сахарным диабетом по данным Удмуртской Республики / Д.Н. Кузнецов, И.А. Казакова // Актуальные вопросы биологии и медицины: материалы IV межрегиональной межвузовской научной конференции (23-27 апреля 2007г., Ижевск).– Ижевск., 2007. – С. 183-186.
- Трусов В.В. Динамика функциональных изменений микроциркуляторного русла у больных СД типа 1под влиянием патогенетического лечения / В.В. Трусов, Л.В. Голубева, И.Б. Руденко, И.А. Казакова, Д.Н. Кузнецов // Морфологические ведомости. – 2007. – №3-4. – С. 291-292.
- Трусов В.В. Острый инфаркт миокарда, осложненный разрывом сердца: особенности клиники, течения / В.В. Трусов, Д.Н. Кузнецов, И.А. Казакова // Современные наукоемкие технологии. – 2008. – №5. – С. 24-26.
- Кузнецов Д.Н. Ишемическая болезнь сердца, ассоциированная с сахарным диабетом, клинико-морфологические особенности разрыва сердца при инфаркте миокарда / Д.Н. Кузнецов, И.А. Казакова, В.В. Трусов // Успехи современного естествознания. – 2008. – №5. – С. 117.
- Кузнецов Д.Н. Клинико-морфологические особенности инфаркта миокарда, ассоциированного с сахарным диабетом, осложненного разрывом сердца / Д.Н. Кузнецов, И.А. Казакова, В.В. Трусов // Морфологические ведомости. – 2008. – №1-2. – С. 262-264.
- Кузнецов Д.Н. Клинические особенности течения острого инфаркта при проведении тромболитической терапии / Д.Н. Кузнецов, Ю.Г. Портнова // Современные аспекты медицины и биологии: материалы IX межрегиональной межвузовской научной конференции (20-23 апреля 2009г., Ижевск). – Ижевск., 2009. – С. 252-254.
- Казакова И.А. Инфаркт миокарда осложненный разрывом сердца и сопутствующая патология, ее влияние на прогноз / И.А. Казакова, Д.Н. Кузнецов, Е.Н. Иевлев // Актуальные вопросы терапии и восстановительной медицины: материалы межрегиональной научно-практической конференции, посвященной 80-летию профессора А.М. Корепанова. – Ижевск., 2009. – С. 208-211.
- Кузнецов Д.Н. Тромболитическая терапия при остром инфаркте миокарда в практике кардиологического отделения / Д.Н. Кузнецов, А.П. Черепанов, С.Г. Меньшиков, Л.В. Губинская // Материалы научно-практической конференции, посвященной 70-летию МСЧ «Ижмаш». – Ижевск., 2009. – С. 267-268.
- Черепанов А.П. Характеристика электрической систолы желудочков как предикторы исходов у кардиологических больных / А.П. Черепанов, Л.В. Губинская, Д.Н. Кузнецов, Б.Л. Мультановский // Материалы научно-практической конференции, посвященной 70-летию МСЧ «Ижмаш». – Ижевск., 2009. – С. 361-363.
- Кузнецов Д.Н. Анализ признаков ремоделирования сердцапри инфаркте миокарда, осложненного разрывом сердца / Д.Н. Кузнецов, Е.Н. Иевлев // Современные аспекты медицины и биологии: материалы X межрегиональной межвузовской научной конференции (26-29 апреля 2010г., Ижевск). – Ижевск., 2010. – С. 256-258.
- Казакова И.А. Характеристика структурных изменений инфаркта миокарда, осложненного разрывом сердца: особенности возникновения / И.А. Казакова, Д.Н. Кузнецов, Е.Н. Иевлев // Материалы VI международного конгресса «Здоровье, демография, экология финно-угорских народов». – Ижевск., 2010. – С. 38.
- Кузнецов Д.Н. Результаты проведения тромболитической терапии препаратом Актилизе в кардиологическом отделении первичного сосудистого центра МУЗ МСЧ «Ижмаш» / Д.Н. Кузнецов, О.В. Швецов, С.Г. Козырев, С.М. Котков // Опыт учителей в науке для решения проблем здоровья нации: материалы научно-практической конференции, посвященной памяти профессора Л.А. Лещинского, в связи с его 85-летием. – Ижевск., 2010. – С. 154-157.
- Казакова И.А. Особенности возникновения разрыва сердца и морфологические изменения при инфаркте миокарда / И.А. Казакова, Д.Н. Кузнецов, Е.Н. Иевлев // Пятый Национальный конгресс терапевтов (24-26 ноября 2010г., Москва). – М., 2010. – С. 114-115.
- Казакова И.А. Характеристика анатомо-морфологических изменений разрыва сердца при инфаркте миокарда / И.А. Казакова, Е.Н. Иевлев, А.Н. Попова, Д.Н.Кузнецов // Опыт учителей в науке для решения проблем здоровья нации: материалы научно-практической конференции, посвященной памяти профессора Л.А. Лещинского, в связи с его 85-летием (14 декабря 2010г., Ижевск). – Ижевск., 2010. – С. 171-172.
- Кузнецов Д.Н. Клиническая эффективность тромболитической терапии препаратом алтеплаза и двойной антитромбоцитарной терапии при остром инфаркте миокарда / Д.Н. Кузнецов, В.В. Трусов, И.А. Казакова // Кардиоваскулярная терапия и профилактика. – 2011. –№10/6. – С. 59-63.
- Кузнецов Д.Н. Организация медицинской помощи пациентам с сердечно-сосудистой патологией в первичном сосудистом центре МУЗ МСЧ «Ижмаш» г.Ижевск / Д.Н. Кузнецов, О.В. Швецов, И.А. Казакова // Организационные аспекты модернизации здравоохраненияи подготовки медицинских кадров в РФ: материалы межрегиональной научно-практической конференции. – Ижевск., 2011. – С. 187-190.
- Трусов В.В. Анализ работы первичного сосудистого центра на базе МУЗ МСЧ «Ижмаш» / В.В. Трусов, И.А. Казакова, Д.Н. Кузнецов // Проблемы экспертизы в медицине. – 2011. – том 11. – №3-4. – С. 20-22.
СПИСОК СОКРАЩЕНИЙ
АВ – атриовентрикулярная блокада
АД – артериальное давление
АЧТВ – активированное частичное тромбопластиновое время
ВНОК – Всероссийское научное общество кардиологов
ДАД – диастолическое артериальное давление
ИПД – индекс пульсового давления
ЕОК- европейское общество кардиологов
КФК-МВ – МВ-фракция креатинфосфокиназы
КДР – конечный диастолический размер
КСР – конечный систолический размер
КДО – конечный диастолический объём
ЛДГ – лактатдегидрогиназа
ЛПНП – липопротеиды низкой плотности
ЛПВП – липопротеиды высокой плотности.
ЛЖ – левый желудочек
МНО – международное нормализованное отношение
МО – минутный объём
ОИМ – острый инфаркт миокарда
ОХ – общий холестерин
ПТИ – протромбиновый индекс
САД – систолическое артериальное давление
СД – сахарный диабет
ТГ – триглицериды
ТЛТ – тромболитическая терапия
ТМЖП – толщина межжелудочковой перегородки
УО – ударный объём
ФК – функциональный класс
ФВ – фракция выброса
ХСН – хроническая сердечная недостаточность
ЧСС – частота сердечных сокращений
ШОКС – шкала оценки клинического состояния
QTd – дисперсия интервала QT
QTcd – дисперсия корригированного интервала QТ

