Роль фенотипической экспрессии в стратификации риска жизнеугрожающих аритмий и оптимизация терапии у детей с различными молекулярно-генетическими вариантами синдрома удлиненного интервала qt у детей
На правах рукописи
Ильдарова Рукижат Абдул-Гафуровна
Роль фенотипической экспрессии в стратификации риска жизнеугрожающих аритмий и оптимизация терапии у детей с различными молекулярно-генетическими вариантами синдрома удлиненного интервала QT у детей
14.01.08 - педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата
медицинских наук
Москва - 2013 год
Работа выполнена в Федеральном государственном бюджетном учреждении «Московский научно-исследовательский институт педиатрии и детской хирургии» Министерства здравоохранения Российской Федерации
Научный руководитель:
доктор медицинских наук, профессор Школьникова Мария Александровна
Официальные оппоненты:
ЛЕОНТЬЕВА Ирина Викторовна, доктор медицинских наук, профессор, ФГБУ «МНИИ педиатрии и детской хирургии» Минздрава России, отделение патологии сердечно-сосудистой системы, заведующий
КОТЛУКОВА Наталья Павловна, доктор медицинских наук, профессор, ГБОУ ВПО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» Минздрава России, кафедра госпитальной педиатрии № 1, профессор
Ведущая организация:
ФГБУ «Научный центр здоровья детей» Российской академии медицинских наук
Защита диссертации состоится «___» ________________ 2013 г. в 13 часов на заседании диссертационного совета Д-208.043.01 в ФГБУ «МНИИ педиатрии и детской хирургии» Минздрава России по адресу 125412 город Москва, улица Талдомская, дом 2.
С диссертацией можно ознакомиться в библиотеке ФГБУ «МНИИ педиатрии и детской хирургии» Минздрава России
Автореферат разослан «___» ________________ 2013 г.
| Ученый секретарь диссертационного совета, кандидат медицинских наук | З. К. Землянская |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Одной из наиболее важных нерешенных проблем современной кардиологии является проблема внезапной сердечной смерти (ВСС) у лиц молодого возраста (Школьникова М. А., 2006, 2008; Бокерия Л. А., 2004). В возрасте до 35 лет частота ВСС составляет около 1:100000, при этом у лиц, занимающихся спортом высоких достижений, риск повышается более чем в 2 раза (С. Basso и соавт., 2001). Согласно данным C.Antzelevich (2001) на долю ВСС приходится 19% от всех случаев внезапной смерти у детей в возрасте от 1 до 13 лет и более 30% - у детей старшего возраста. При этом 10% случаев ВСС в молодом возрасте развивается у лиц, не имеющих структурных изменений со стороны сердца (D. Corrado и соавт., 2001). Согласно современным данным большинство случаев внезапной смерти в молодом возрасте обусловлено злокачественными желудочковыми аритмиями, в качестве причины которых все чаще диагностируются первичные электрические заболевания сердца, в том числе врожденный синдром удлиненного интервала QT.
Синдром удлиненного интервала QT (СУИQT) является наследственным заболеванием с высоким риском ВСС, характеризующимся удлинением интервала QT на ЭКГ, приступами потери сознания на фоне эпизодов жизнеугрожающих желудочковых аритмий, наиболее часто – желудочковой тахикардией типа «пируэт». В ряде случаев, первым проявлением синдрома может служить ВСС. Частота синдрома по разным данным составляет от 1:2000 до 1:3000 (Schwartz P., 2006, 2008). Тяжесть этой наследственной патологии обусловлена жизнеугрожающими аритмиями и высокой летальностью, которая в отсутствие лечения достигает 40-70% в течение первого года после клинической манифестации (Schwartz P., 1985).
Клинически выявляют два основных варианта синдрома: наиболее распространенный в популяции синдром Романо-Уорда с аутосомно-доминантным типом наследования и синдром Джервелла-Ланге-Нильсена с аутосомно-рецессивным. С момента первого исследования, доказавшего генетическую природу синдрома в 1997 году, выявлено более 400 мутаций в 10 генах, ответственных за развитие синдрома, проявляющихся нарушением функции сердечных ионных каналов. При этом до настоящего времени в большинстве стран мутации в известных генах выявляются только у 50-75% пробандов (Crotti L. и соавт., 2008), что диктует необходимость дальнейшего изучения генетических механизмов заболевания.
Установлено, что клинические проявления заболевания и эффективность лечения больных зависят от конкретного молекулярно-генетического варианта синдрома (Priori S., 2004). До 80% случаев СУИQT обусловлены тремя основными молекулярно-генетическими вариантами, клинико-электрофизиологическая диагностика которых до настоящего времени недостаточно разработана. Степень поражения ионных каналов, а, следовательно, выраженность нарушения функции сердечных ионных каналов зависит от вида и локализации мутации и обусловливает тяжесть заболевания (Moss A., 2010).
Несмотря на успехи, достигнутые в понимании патофизиологических механизмов развития синдрома, его клинической интерпретации, до настоящего времени не решены проблемы ранней диагностики, недостаточно изучены факторы и маркеры риска ВСС при различных молекулярно-генетических вариантах синдрома, необходима разработка более эффективных методов лечения и профилактики ВСС. Наиболее остро эти проблемы затрагивают пациентов детского возраста, так как имеются лишь единичные специальные исследования синдрома удлиненного интервала QT у детей (Школьникова М., 2001, Goldenberg I. и соавт., 2008).
Актуальными являются исследования по идентификации новых генов и мутаций, ответственных за развитие синдрома удлиненного интервала QT, выявление корреляций между молекулярно-генетическими вариантами и характером течения заболевания в детском возрасте. Для повышения эффективности первичной и вторичной профилактики ВСС у детей необходимо совершенствование системы мониторинга детей с синдромом удлиненного интервала QT на основании динамического контроля установленных и вновь выявленных факторов и маркеров риска ВСС.
Общепринятый подход к лечению синдрома удлиненного интервала QT (Moss A., 2000) в настоящее время недостаточно эффективен и заключается в назначении бета-адреноблокаторов (ББ). Необходимо на основании анализа эффективности применения новых медицинских технологий, включая имплантацию антиаритмических устройств у детей с СУИQT, разработать дифференцированную тактику медикаментозного и немедикаментозного (интервенционного и хирургического) лечения различных молекулярно-генетических вариантов синдрома с учетом специфических для каждого варианта электрофизиологических механизмов развития злокачественных желудочковых аритмий.
Цель: Разработать систему стратификации риска внезапной сердечной смерти, динамического контроля факторов риска и дифференцированную тактику антиаритмического и интервенционного лечения детей с различными молекулярно-генетическими вариантами врожденного синдрома удлиненного интервала QT
Задачи:
- Установить распространенность врожденного синдрома удлиненного интервала QT среди детей с нарушениями ритма сердца и оценить зависимость его клинических проявлений от возраста и пола.
- Разработать алгоритм неинвазивной диагностики молекулярно-генетических вариантов врожденного синдрома удлиненного интервала QT у детей и усовершенствовать план клинико-инструментального обследования больных с целью выявления факторов риска внезапной сердечной смерти.
- Установить особенности сократительной функции миокарда желудочков, специфические для больных с врожденным синдромом удлиненного интервала QT и их взаимосвязь с тяжестью течения заболевания.
- Усовершенствовать систему мониторинга больных с врожденным синдромом удлиненного интервала QT с динамическим контролем индивидуальных факторов и маркеров риска развития синкопальных состояний.
- Разработать дифференцированную тактику ведения и оценить эффективность медикаментозных и немедикаментозных методов терапии у детей с различными молекулярно-генетическими вариантами синдрома удлиненного интервала QT.
Научная новизна
Впервые определена распространенность врожденного синдрома удлиненного интервала QT среди детей с нарушениями ритма сердца и установлена лидирующая роль данного синдрома среди показаний к имплантации кардиовертера-дефибриллятора у детей. Установлена зависимость клинического течения врожденного синдрома удлиненного интервала QT у детей от возраста.
Установлена фенотипическая экспрессия клинико-электрокардиографических проявлений синдрома удлиненного интервала QT при различных молекулярно-генетических вариантах синдрома. Характерные особенности электрической нестабильности миокарда, включая трансмуральную дисперсию реполяризации, а также различие в адаптации электрической систолы желудочков к физической нагрузке отражают специфику нарушения функции ионных каналов.
Патофизиологические механизмы синдрома удлиненного интервала QT включают аномалию электро-механического сопряжения в миокарде желудочков, степень которой достоверно ассоциируется с неблагоприятным прогнозом.
Впервые установлено, что наиболее значимыми маркерами риска рецидивов синкопе у детей с синдромом удлиненного интервала QT являются: ранняя до 6-летнего возраста манифестация синкопе, рецидивирующие синкопальные состояния в анамнезе, увеличенная трансмуральная дисперсия реполяризации и выраженное удлинение QTc по данным автоматического анализа 24-часового ЭКГ мониторирования.
Показано, что выраженность клинико-электрокардиографических проявлений синдрома зависит от количества мутаций, что позволяет считать наличие комбинированных мутаций дополнительным немодифицируемым фактором риска синкопе и внезапной сердечной смерти у детей с синдромом удлиненного интервала QT.
Разработана и научно обоснована трехэтапная схема терапии больных с различными молекулярно-генетическими вариантами синдрома удлиненного интервала QT, позволяющая снизить летальность с 12% до 1,5%, включающая медикаментозные и немедикаментозные методы, целесообразность применения которых обусловлена индивидуальным профилем риска больного с данным заболеванием.
Показано, что ИКД-терапия у детей с врожденным синдромом удлиненного интервала QT является безопасным и эффективным методом лечения, позволяющим предотвратить развитие ВСС у 43% детей из группы высокого риска в течение 5 лет после имплантации.
Практическая значимость.
Разработан алгоритм неинвазивной диагностики основных генетических вариантов СУИQT, основанный на их специфической фенотипической экспрессии и включающий оценку геноспецифических триггеров, морфологии зубца Т на ЭКГ, динамики реполяризации (QTc и QTpc) при физической нагрузке, особенностей де- и реполяризации миокарда желудочков по данным поверхностного картирования. Точность диагностики с применением данного алгоритма достигает 92%.
Разработан протокол эхокардиографического обследования сердца у больных с СУИQT, включающий определение соотношения электрической и механической систол желудочков, времени изоволюметрического расслабления и анализ сегментарной деформации миокарда.
Разработана шкала индивидуального риска синкопе, включающая оценку характерных клинических симптомов и семейного анамнеза, модифицируемых электрокардиографических и эхокардиографических маркеров риска, позволяющая выявить группы низкого, умеренного и высокого риска синкопе и определить тактику мониторинга больных.
Для определения показаний к имплантации кардиовертера-дефибриллятора усовершенствована и модифицирована для детского возраста шкала экстремального риска внезапной сердечной смерти, позволяющая прогнозировать риск развития фибрилляции желудочков у больных с СУИQT.
Внедрение в практику. Полученные в ходе исследования результаты внедрены в практику: Детского научно-практического центра нарушений сердечного ритма, отделении патологии сердечно-сосудистой системы ФГБУ «Московский НИИ педиатрии и детской хирургии» МЗ РФ; ГБУЗ «Тушинская детская городская больница Департамента здравоохранения города Москвы»; Аритмологического центра ГБУЗ «Детская областная клиническая больница» Тверской области; Детской городской больницы N13 имени М. Ф Филатова.
Материалы диссертации используются в учебном процессе и включены в программу последипломного образования в рамках тематического усовершенствования по специальности «Детская кардиология» на базе ФГБУ "МНИИ педиатрии и детской хирургии" МЗ РФ.
Апробация диссертации.
Материалы диссертации доложены и обсуждены на 7 международных научных конференциях и конгрессах: IХ Международный Конгресс «Кардиостим 2010» (Санкт-Петербург, 2010 г.); III Всероссийская научно-практическая конференция с международным участием "Некоронарогенные заболевания сердца: диагностика, лечение, профилактика" (Санкт-Петербург, 2011 г.); 38th International Congress on Electrocardiology (Онтарио, 2011 г.); ESC Congress 2011 (Париж, 2011 г.); XV Конгресс педиатров России с международным участием «Актуальные проблемы педиатрии» (Москва, 2011 г.); X Международный славянский конгресс по электростимуляции и клинической электрофизиологии сердца «Кардиостим» (Санкт-Петербург, 2012 г.); ESC Congress 2012 (Мюнхен, 2012 г.). Материалы диссертации доложены на Всероссийских Конгрессах «Детская кардиология 2010 и 2012» (Москва, 2010, 2012 гг.); IV Всероссийском съезде аритмологов (Москва, 2011 и 2013 гг.).
Публикации. По теме диссертации опубликовано 26 печатных работ, в том числе 6 статей в отечественных и 1 статья в международном рецензируемых изданиях.
Исследование выполнено в Детском научно-практическом центре нарушений сердечного ритма (руководитель – доктор медицинских наук, профессор М.А. Школьникова) на базе ФГБУ МНИИ педиатрии и детской хирургии МЗ РФ (директор – доктор медицинских наук, профессор А.Д. Царегородцев, главный врач – доктор медицинских наук Г. Г. Осокина).
Структура и объем диссертации. Диссертация изложена на 150 страницах машинописного текста и состоит из введения, обзора литературы, характеристики больных и методов исследования, трех глав собственных исследований, заключения, выводов, практических рекомендаций. Работа иллюстрирована 47 рисунками и 1 приложением. Список литературы включает 195 источников (30 отечественных и 165 зарубежных авторов).
СОДЕРЖАНИЕ РАБОТЫ
Характеристика больных и методы исследования. Для решения поставленных задач с мая 2003 года по декабрь 2012 года было обследовано 173 больных из 119 неродственных семей с первичным синдромом удлиненного интервала QT (59% лица мужского пола). Возраст больных на момент выявления заболевания составил 8,8±4,3 года (от 0 до 15 лет). Больные с синкопальной формой синдрома составили 57%. Диагноз установлен на основании общепринятых критериев (P. Schwartz). В зависимости от клинических проявлений больные разделялись на подгруппы с синкопальной (95 больных) и бессинкопальной (78 больных) формами СУИQT. Фенотип синдрома Романо-Уорда имели 167 больных и синдрома Джервелла-Ланге Нильсена – 6 больных (3,5%). В зависимости от молекулярно-генетического варианта заболевания больные были разделены на 4 основные подгруппы (рис. 1): I подгруппу составили 106 больных с LQT1 (69 пробандов и 37 членов их семей). В группе несколько преобладали мальчики (54%) и больные с синкопальной формой синдрома (53%). II подгруппу составили 43 больных с LQT2 (31 пробанд и 12 членов их семей). Синкопальную форму имели 63%, преобладали лица мужского пола (56%). III составили 16 больных с LQT3 (11 пробандов и 5 членов их семей). Распределение по полу в группе было равным, синкопальные состояния имели место у 38% больных. В IV подгруппу вошли 6 детей (4 девочки и 2 мальчика) с комбинированными мутациями (КМ), имеющие тяжелую синокпальную форму синдрома.
Дети с другими молекулярно-генетическими вариантами СУИQT (2 ребенка) не были включены в описанные выше подгруппы, а их клинико-электрокардиографические характеристики учитывались в анализе факторов риска и эффективности терапии.
Рисунок 1. Распределение больных с СУИQT в зависимости от фенотипических проявлений и молекулярно-генетических вариантов.
Применялись клинико-анамнестический и генеалогический методы обследования, электрокардиография, 24-часовое ЭКГ мониторирование, стресс-тест, поверхностное ЭКГ картирование и молекулярно-генетический анализ.
При составлении генеалогического дерева у родственников 1 и 2 степени родства оценивалось ЭКГ и наличие приступов потери сознания и/или случаев внезапной смерти. При сборе анамнеза обращали внимание на возраст манифестации и частоту синкопе, клиническую характеристику приступов потери сознания, анализ провоцирующих факторов. Приступ потери сознания, протекавший с признаками глубокой гипоксии мозга (судороги, непроизвольное мочеиспускание, дефекация), потребовавший проведения реанимационным мероприятий определялся как внезапная остановка кровообращения.
ЭКГ регистрировалась в 12 отведениях на аппарате FCP – 4101 (Fukuda denshi inc. Япония). У пациентов получавших антиаритмическую терапию анализировались данные ЭКГ как до лечения и на фоне антиаритмической терапии. Отмечались наличие брадикардии менее 2 перцентиля, продолжительность интервалов QT и QTp (от начала зубца QT до пика зубца T), трансмуральной дисперсии реполяризации (QTd и интервал TPE – от пика до окончания зубца Т), морфология зубца Т. Коррекция интервалов QT и QTp по ЧСС проводилась с применением формулы Базетта (QTc=QT/RR; QTрc=QTр/RR).
Данные 24-часового ЭКГ мониторирования анализировались на системах OXFORD MEDILOG (Schiller, Швейцария), MARS (GE, США) и "КАРДИОТЕХНИКА-04-8 (M)" (Инкарт, РФ). Протокол исследования включал оценку средних значений ЧСС в дневное, ночное время; минимальной и максимальной ЧСС; морфологии зубца Т, признаков электрической нестабильности миокарда (альтернация зубца Т, желудочковые нарушения ритма). Продолжительность интервала QT исследовалась путем мануального анализа с оценкой QT и QTc на минимальной и максимальной ЧСС, а также автоматического анализа с оценкой среднего и максимального QTc, дисперсии интервала QT.
Эхокардиография выполнялась на аппарате VIVID7 Dimention (GE, США). Протокол включал измерение морфометрических и гемодинамических показателей при синхронной регистрации ЭКГ; спектральную, тканевую допплерографию, анализ деформации миокарда методом 2D speckle tracking. Протокол выполнялся совместно с врачом функциональной диагностики Детского научно-практического центра нарушений сердечного ритма, к.м.н. Верченко Е. Г. Группу эхокардиографического контроля составили 40 детей со структурно нормальным миокардом, не имеющих нарушений ритма сердца, сопоставимых по возрасту и ЧСС с основной группой.
Проба с дозированной физической нагрузкой (тредмил-тест) проводилась на беговой дорожке системы нагрузочных тестов «CardioSoft» (GE, США) с применением стандартного протокола Bruce. ЭКГ регистрировалась постоянно в течение всей пробы и в течение 5 минут в положении стоя в периоде восстановления на скорости 50 мм/с с усилением 0,1 мВ/мм. Протокол анализа ЭКГ включал оценку динамики ЧСС и интервалов QT, QTp, QTd, TPE на нагрузке. Группу контроля составили 15 здоровых детей, сопоставимых по возрасту.
Поверхностное ЭКГ картирование (ПК) проводилось с применением компьютерной системы «Cardiag-112.2» (Чехия) и при регистрации 80 отведений с поверхности грудной клетки, 12 стандартных и 3 ортогональных отведений с последующей компьютерной обработкой. По характеристиками поверхностных карт оценивались особенности распространения волн ре- и деполяризации. Исследование выполнялось совместно с зав. отделением функциональной диагностики Детского научно-практического центра нарушений сердечного ритма, к.м.н. Калинина Л. А.
Молекулярно-генетический анализ проведен 124 больным из 75 неродственных семей с клинически установленным диагнозом врожденного СУИQT. Поиск мутация осуществлялся в 13 генах ответственных за развитие синдрома. Исследование проведено в рамках утвержденного МЗ РФ договора с Департаментом кардиологии Университета Павии (Италия) и в лаборатории ДНК-диагностики ГУ Медико-генетический научный центр РАМН.
Алгоритм неинвазивной диагностики молекулярно-генетических вариантов СУИQT формировался на основании оценки геноспецифических паттернов у 43 больных с генетически подтвержденным вариантом СУИQT. Оценивались: чувствительность (Se), специфичность (Sp), положительная прогностическая значимость (ППЗ) и отрицательная прогностическая значимость (ОПЗ) разработанных диагностических паттернов. Эффективность предложенного диагностического алгоритма оценивалась с использованием показателя «диагностическая точность» в выборке из 73 больных с генетически подтвержденным СУИQT.
Математическая обработка данных проведена с применением программы “STATISTICA” (StatSoft Inc, США) и статистического пакета STATA 8.2. Сравнение клинических и электрокардиографических параметров в группах проводилось с использованием тестов Стьюдента и Манна-Уитни. Данные представлены в форме «среднее ± стандартное отклонение» (Mean±SD). Различие считалось статистически значимым при p < 0,05. Для изучения ассоциаций между факторами риска ВСС и неблагоприятными исходами (внезапная остановка кровообращения в анамнезе и/или внезапная смерть) применялись линейная регрессионная модель (методом наименьших квадратов) и логистическая модель (метод максимума правдоподобия). Для анализа взаимосвязей факторов риска ВСС с клинико-электрокардиографическими характеристиками применялись регрессионные модели пропорционального риска Кокса. Построены кривые Каплана-Майера. Регрессионный анализ выполнялся с участием руководителя Центра демографии РЭШ, к.м.н. Школьниковым В. М.
Результаты и обсуждение.
При анализе госпитализаций за период с 2004 по 2012 годы было установлено, что доля больных с синдромом удлиненного интервала QT составляет 5% среди всех детей с нарушениями сердечного ритма, при этом доля первичных госпитализаций составляет 56%. Среди больных, оперированных по поводу нарушений ритма сердца, на долю больных с СУИQT приходится 1% и 50% среди больных с имплантированными кардиовертерами-дефибрилляторами (ИКД).
Характеристика синкопальных состояний. У 67% детей с LQT1 и всех больных с комбинированными мутациями манифестация синкопе отмечена в возрасте до 6 лет (рис. 2), в то время как у 74% детей с LQT2 синкопе манифестировали в возрасте 7 лет (p > 0,001).
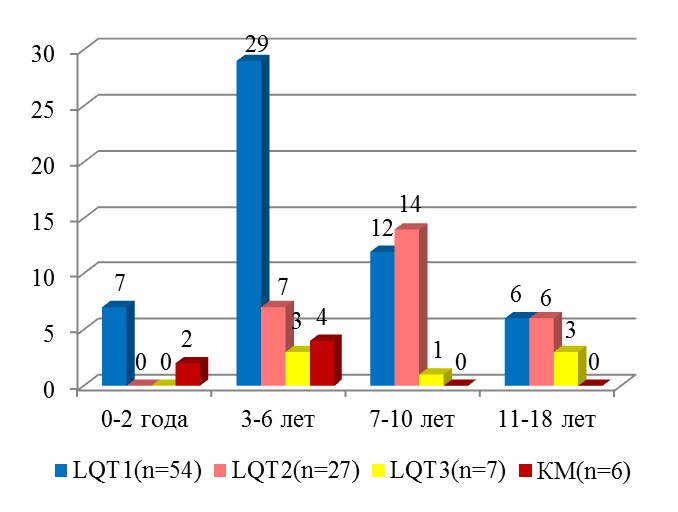
Рисунок 2. Распределение детей в зависимости от возраста первого синкопе.
У 41% больных синкопе провоцировались одним, у 44% - двумя и у 16% - тремя триггерами. Преобладающим провоцирующим фактором были физическая нагрузка (60%) и эмоциональный стресс (48%). При этом физическая нагрузка как триггер была типична для LQT1 (чувствительность 74% и специфичность 80%), а эмоции для больных с LQT2 (чувствительность 71%; специфичность 51%). Приступы потери сознания во сне или в состоянии покоя имели место реже (7%) и регистрировались только у больных с LQT2 и LQT3. Абсолютной специфичностью обладали следующие триггеры: для больных с LQT1 плавание и/или пребывание в воде; для больных с LQT2 - резкий звук и пробуждение.
Электрокардиографические характеристики основных молекулярно-генетических вариантов СУИQT. Брадикардия менее 2 перцентиля (возрастного распределения ЧСС) в отсутствие терапии имела место у 23 детей (21%), в том числе у 12 больных с синкопальной формой синдрома. Дисперсия интервала QT (QTd) была достоверно больше у больных с синкопе (66,8±38,6) чем у больных без синкопе (43,98±29,5), р=0,003. У больных без синкопе значения интервалов на ЭКГ достоверно не изменялись при назначении бета-блокаторов (таб. 1), в то время как у больных с синкопе интервал QTc был достоверно больше до назначения этих препаратов.
Таблица 1. Значения интервалов QT, QTp, TPE и их производных у детей с синкопальной и бессинкопальной формами СУИQT на стандартной ЭКГ до и после назначений бета-блокаторов.
| Дети с синкопе (n=95) | Дети без синкопе (n=78) | p-value | ||||||
| I | II | p-value | I | II | p-value | I | II | |
| QT, мс | 450±70 | 464±50 | НД | 422±59 | 448±44 | 0,02 | 0,02 | 0,09 |
| QTc, мс | 497±66 | 476±44 | 0,03 | 460±38 | 450±40 | НД | 0,0002 | 0,004 |
| QTp, мс | 362±53 | 377±49 | НД | 345±44 | 365±40 | НД | НД | НД |
| QTpc, мс | 396±43 | 385±43 | НД | 369±32 | 366±41 | НД | 0,002 | 0,04 |
| TPE, мс | 79±26 | 87±34 | НД | 76±26 | 84±27 | НД | НД | НД |
| QTc, мс ортостаз | 518±42 | 509±46 | НД | 496±43 | 490±54 | НД | 0,02 | 0,05 |
| QTc, мс нагрузка | 516±40 | 524±48 | НД | 502±40 | 492±39 | НД | НД | 0,006 |
Примечание: I – ЭКГ до лечения; II – ЭКГ на лечении бета-блокаторами.
Больные с LQT1 по сравнению с больными LQT2 и LQT3 имели достоверно более низкие значения продолжительности QT (таб. 2). Среди больных с мономутациями QTc > 500 мс достоверно чаще встречался в группе больных с LQT2. Представленность детей с более выраженным удлинением QTc (>550 мс) в группах достоверно не различалась. У детей с КМ значения QTc на ЭКГ покоя были достоверно выше, чем у детей с мономутациями. Всех детей с КМ отличали значения QTc > 500 мс. На ЭКГ в ортостазе и после физической нагрузки, средние значения QTc во всех группах превышали 500 мс, при этом у больных с КМ QTc в ортостазе и после нагрузки был достоверно выше, чем у больных с мономутациями (таб. 2).
Таблица 2. Электрокардиографические характеристики больных с СУИQT в зависимости от молекулярно-генетического варианта.
| Параметры | LQT1 n=106 | LQT2 n=43 | LQT3 n=16 | КМ n=6 | p-value | ||
| LQT1-КМ | LQT2-КМ | LQT3-КМ | |||||
| QT, мс | 445±62*& | 472±44 | 478±59 | 495±55 | 0,05 | НД | НД |
| QTc, мс | 473±55 | 486±38 | 487±42 | 536±71 | 0,009 | 0,01 | 0,057 |
| QTp, мс | 368±50 | 369±44 | 383±62§& | 370±59 | НД | НД | НД |
| QTpc, мс | 384±41 | 377±42 | 394±41 | 396±77 | НД | НД | НД |
| TPE, мс | 82±22* | 114±49 | 85±31 | 130±71 | 0,001 | НД | НД |
| QTd, мс | 44,7±25 | 93±44*§ | 48±28 | 55±19 | НД | 0,04 | НД |
| QTc_ортостаз, мс | 501±47 | 524±40 | 510±37 | 567±44 | 0,001 | 0,02 | 0,008 |
| QTc_нагрузка, мс | 509±41 | 528±47 | 516±43 | 562±58 | 0,006 | НД | НД |
| QTc>500 мс, % | 29 | 47* | 38 | 100 | 0,0005 | 0,02 | 0,02 |
| QTc>550 мс, % | 12 | 7 | 13 | 50 | НД | 0,004 | НД |
Примечание: * - p < 0,05 при сравнении групп LQT1 и LQT2; # - p < 0,05 при сравнении групп LQT1 LQT2; § - p < 0,05 при сравнении групп LQT2 и LQT3; & - p < 0,05 при сравнении групп LQT1 и LQT3.
Наибольшие значения интервала TPE регистрировались у больных с LQT2 и КМ (таб. 2). Значение этого интервала было достоверно выше у пациентов с LQT2 в сравнении с больными с LQT1 и у больных с КМ в сравнении с больными с LQT1 (p<0,0001). Дисперсия интервала QT (QTd) была достоверно выше у больных с LQT2 и достоверно превышала таковую у детей с LQT1 и LQT3. Обращает внимание отсутствие различий в значениях QTd у больных с LQT1/LQT3 и КМ.
При 24-часовом мониторировании ЭКГ синусовая брадикардия со снижением средней суточной ЧСС на 10% от возрастной нормы регистрировалась у 27% больных. При этом резкая брадикардия со снижением средней суточной ЧСС от 10 до 20% от возрастной нормы отмечалась у 4%. Желудочковые аритмии достоверно чаще имели место у больных с LQT2 (33%), чем у больных с LQT1 (3,8%; p<0,0001). Они регистрировались на фоне синусовой тахикардии во время физической нагрузки или эмоционального стресса, что свидетельствовало о выраженной стресс-индуцируемой электрической нестабильности миокарда. Макроальтернация зубца Т регистрировалась у 5 детей (1,2%), четверо из которых имели фенотип синдрома Джервелла-Ланге-Нильсена. Альтернация зубца Т сохранялась на фоне антиаритмической терапии. Больные с синкопальной формой СУИQT демонстрировали достоверно большие значения максимальной продолжительности интервала QTс (566,2±45мс против 550,2±37 мс у больных без синкопе, р<0,05) по данным автоматического анализа. У них достоверно выше были значения QTc на максимальной ЧСС (525,4±54 мс против 493,3±46 мс; р<0,05).
Таким образом, больные с синкопальной формой СУИQT характеризуются большей продолжительностью интервала QTc как по данным стандартной ЭКГ, так и по данным 24 часового мониторирования ЭКГ. При этом антиаритмическая терапия ББ не влияет на продолжительность QT. Трансмуральная дисперсия реполяризации была достоверно выше у больных с LQT2, что позволяет использовать этот признак для дифференциальной диагностики.
Особенности динамики процесса реполяризации миокарда желудочков на пробе с физической нагрузкой. Толерантность к физической нагрузке соответствовала возрасту у 67% в группе LQT1, 22% – в группе LQT2 и 87% – в контрольной группе. Средние значения ЧСС в покое у больных были достоверно меньше, чем в контроле (p<0,001). Максимальные значения ЧСС на нагрузке в группе LQT1 и LQT2 были ниже, чем в группе контроля (p<0,05). На ЭКГ в исходе у больных с LQT2 значения QTd и TPE были достоверно выше, чем у больных с LQT1 (таб. 3).
Таблица 3. Сравнительные характеристики показателей ЭКГ в ходе пробы с физической нагрузкой у больных с LQT1 и LQT2.
| Параметры | LQT1 (n=45) | LQT2 (n=29) | p |
| ЭКГ преднагрузка | |||
| ЧСС, уд/мин | 73±12 | 73±19 | НД |
| QTc, мс | 457±39 | 474±24 | 0,005 |
| QTpc, мс | 378±36 | 377±39 | НД |
| QTd, мс | 41±28 | 95±41 | <0,001 |
| TPE, мс | 74±27 | 92±37 | 0,009 |
| ЭКГ нагрузка | |||
| ЧСС, уд/мин | 125±22 | 133±22 | |
| QTc, мс | 490±34 | 439±37 | <0,001 |
| QTpc, мс | 394±41 | 327±45 | <0,001 |
| QTd, мс | 31±16 | 28±12 | НД |
| TPE, мс | 69±19 | 73±29 | НД |
| QTc1, мс | 33±39 (+20 - +54) | -35±45 (-68 - +4) | <0,001 |
| ЭКГ восстановление | |||
| ЧСС, уд/мин | 82±13 | 82±14 | НД |
| QTc, мс | 476±33 | 395±41 | НД |
| QTpc, мс | 396±30 | 341±42 | 0,01 |
| QTd, мс | 45±37 | 69±38 | 0,004 |
| TPE, мс | 69±16 | 78±27 | НД |
Примечание: НД – недостоверная разница в группах.
Продолжительность интервала QT на нагрузке была значительно выше в группах с СУИQT (330,7±37 мс при LQT1 и 314,4±53 мс при LQT2 в сравнении с 243,9±5мс в группе контроля; p<0,05). На максимуме нагрузки абсолютные и корригированные значения интервалов QT и QTp были больше при LQT1. При снижении ЧСС в период восстановления QTd у больных с LQT2 увеличивался, тогда как остальные параметры по группам не различались. Динамика интервалов QTc и QTpc на нагрузке в группах LQT1 и LQT2 была разнонаправленной: у детей с LQT1 эти интервалы достоверно увеличивались, в то время как у больных с LQT2 они достоверно уменьшались (таб. 3). Увеличение QTс на нагрузке (delta QTc1 > 6мс) было характерно для больных с LQT1 (чувствительность 90%; специфичность 72%).
Дети с LQT1 и синкопе имели достоверно большие значения интервалов QT преднагрузка, QT нагрузка, QTс нагрузка, QTd нагрузка, QT восстановление в сравнении с больными из той же группы без синкопе (p < 0,05).
Таким образом, динамика реполяризации на пробе с нагрузкой различна у больных с LQT1 и LQT2, что важно для дифференциальной диагностики.
Особенности сократительной функции миокарда желудочков. Структурной патологии сердца у больных с СУИQT выявлено не было. Обращали на себя внимание (таб. 4) более высокие чем в группе контроля показатели ФВ ЛЖ (р<0,001) и глобального индекса продольной систолической деформации (p<0,02).
Таблица 4. Сравнительные ЭКГ и эхокардиографические характеристики больных с СУИQT и детей из группы контроля.
| Параметры | СУИQT (n=100) | Контроль (n=40) |
| Возраст, лет | 13,9±4 | 12,3±2 |
| ЧСС, уд/мин | 62,5±11 | 62,1±14 |
| QT, мс | 480±61 | 380±31* |
| QTc, мс | 485±46 | 382±25* |
| ФВ, % | 72,8±4 | 69,6±4* |
| КДД ЛЖ, % | 96,6±5,4 | 96,1±5,6 |
| ЭМД (SpD), мс ЭМД (ТД), мс | 97,8±45,8 95,9±1,2 | 0,8±6,5* 2,7±12,1* |
| ВИР (SpD), мс ВИР (ТД), мс | 63,9±12 74,3±13 | 49,2±9* 61,1±8* |
| Глобальный индекс ПСД, % | -25,0±2,3 | -22,1±1.9* |
Примечание: * - достоверная разница при сравнении больных СУИQT и группы контроля (p<0,001); ЭМД – электро-механическая диссоциация; ПСД – продольная систолическая деформация; ВИР – время изоволюметрического расслабления.
Для больных с СУИQT характерно несоответствие продолжительности электрической систолы механической систоле желудочков (таб. 4). Продолжительность ЭМД по данным спектрального и тканевого допплера у больных с СУИQT была достоверно больше. ВИР левого желудочка у больных с СУИQT был также достоверно больше, при этом дисперсия ВИР не имела значимых различий в группах. Изменение продольной деформации левого желудочка в пяти и более сегментах в виде плато или двойного пика систолической деформации было зарегистрировано у 52% больных и не регистрировалось в контрольной группе. При этом больных с СУИQT и измененной продольной деформацией отличали: достоверно более низкая ЧСС и достоверно более высокие значения дисперсии интервала QT по данным стандартной ЭКГ, а также достоверно более высокие значения интервалов QT и QTс, ЭМД, ВИР и дисперсии ВИР по данным эхокардиографии (таб. 5).
Таблица 5. Сравнительные клинико-электрокардиографические и эхокардиографические характеристики больных СУИQT с измененной и нормальной продольной систолической деформацией левого желудочка.
| Нормальная деформация n=48 | Измененная деформация n=52 | p-value | |
| ЭКГ параметры | |||
| RR, мс | 897±188 | 1040±154 | 0,0004 |
| QTc, мс | 479±44 | 489±46 | НД |
| QTd, мс | 51±35 | 69±43 | 0,048 |
| QTc>500 | 32% | 52% | 0,05 |
| Клинические показатели | |||
| Синкопе, % | 32% | 73% | <0,001 |
| ИКД, % | 24,4% | 40,4% | НД |
| ВСС, n | 0 | 4 | <0,05 |
| ЭхоКГ параметры | |||
| ЧСС, уд/мин | 65±13 | 58±9 | 0,008 |
| RR, мс | 0,957±0,185 | 1,055±0,157 | НД |
| QT, мс | 459±66 | 503±48 | 0,001 |
| QTc, мс | 471±38 | 493+47 | 0,033 |
| ЭМД (SpD), мс | 86±49,8 | 117±35,0 | 0,002 |
| ЭМД (ТД), мс | 77±51,5 | 113±43,5 | 0,001 |
| ВИР(SpD), мс | 58±10,6 | 69±9,2 | 0,000 |
| ВИР (ТД), мс | 67±11,1 | 80±9,3 | 0,000 |
| Глобальный индекс ПСД, % | -25,0+2,2 | -25,0±2,3 | НД |
Регрессионный анализ с контролем по возрасту и полу показал, что измененная продольная деформация левого желудочка в совокупности с увеличением ЭМД достоверно ассоциируется с синкопе [ОР=4,6 (1,9-11,5; p<0,01)], с внезапной остановкой кровообращения [ОР=1,28 (1,06-1,54; p<0,01)], а также с высоким индивидуальным риском ВСС по данным шкалы индивидуального риска [ОР=1,51 (1,08-2,10; p<0,05)].
Таким образом, удлинение электрической систолы у детей с СУИQT сопровождается развитием выраженного несоответствия электрической систолы механической систоле, удлинением времени изоволюметрического расслабления и изменением продольной систолической деформации. При этом степень нарушения электро-механического сопряжения не является геноспецифической, но достоверно ассоциируются с неблагоприятным прогнозом.
Алгоритм неинвазивной диагностики молекулярно-генетических вариантом синдрома. Высокую чувствительность и специфичность в диагностике вариантов синдрома демонстрирует генспецифические триггеры синкопе и электрокардиография (таб. 6). Характерную морфологию зубца Т в виде широкого основания, симметричной формы с косовосходящей элевацией сегмента ST имели 86% больных с LQT1. Двугорбый зубец Т не менее, чем в трех отведениях (преимущественно в правых грудных), характерен для больных с LQT2 и регистрировался у 92% больных. Удлинение сегмента ST – патогномоничный симптом для больных с LQT3 регистрировался в 78% случаев.
Таблица 6. Чувствительность, специфичность и прогностическая значимость диагностических критериев при различных вариантах СУИQT.
| N | Диагноз и метод | Se (%) | Sp (%) | ППЗ (%) | ОПЗ (%) |
| 1 | ЭКГ паттерн LQT1 | 86 | 94 | 96 | 25 |
| 2 | ЭКГ паттерн LQT2 | 92 | 91 | 75 | 2,5 |
| 3 | ЭКГ паттерн LQT3 | 78 | 98 | 78 | 2 |
| 4 | ТТ: QTc=+6мс (LQT1) | 90 | 72 | 85 | 19 |
| 5 | ТТ: QTc=-5мс (LQT2/LQT3) | 67 | 90 | 80 | 18 |
| 6 | LQT1/ПК | 51 | 86 | 85 | 47 |
| 7 | LQT2/ПК | 73 | 72 | 50 | 18 |
| 8 | LQT1* | 91 | 93 | 96 | 16 |
| 9 | LQT2* | 90 | 90 | 76 | 3 |
| 10 | LQT3* | 71 | 99 | 83 | 2,5 |
Примечание: * - комбинация из всех геноспецифических признаков для каждого больного (триггер синкопе+ЭКГ+тредмил-тест+поверхностное картирование).
По данным ПК у больных с LQT1 регистрировалось дополнительные отрицательные экстремумы в ходе деполяризации и дополнительные положительные экстремумы в ходе реполяризации. Данный паттерн обладает высокой специфичностью (таб. 6). Для больных с LQT2 характерно увеличение площади отрицательных потенциалов в проекции правых отделов сердца, что имело место в 73% случаев. При комплексной оценке вышеперечисленных паттернов в 88% случаев неинвазивная диагностика варианта СУИQT и данные молекулярно-генетического исследования совпали. На основании чувствительности и специфичности критериев диагностики разработан алгоритм неинвазивной диагностики СУИQT (рис. 3).
Рисунок 3. Алгоритм дифференциальной догенетической диагностики молекулярно-генетических вариантов СУИQT.

Алгоритм продемонстрировал высокую диагностическую точность в контрольной выборке. Она составила 97% для больных с LQT1, 96% для больных с LQT2 и 99% для больных с LQT3.
Оценка влияния молекулярно-генетического варианта и локализации мутации на характер клинического течения заболевания. Больные с LQT1 и LQT2, имеющие мутации в порообразующей части белка, не имели отличий в клинико-электрокардиографических характеристиках от больных, имеющих мутации в С-терминальной и N-терминальной частях белка. В то же время, больных, имевших две и более мутаций, отличало от больных, имевших одиночную мутацию, достоверно более высокая частота встречаемости синкопальной формы синдрома, тенденция к манифестации синкопе в более раннем возрасте и большие значения QTc (таб. 7).
Таблица 7. Клинико-электрокардиографические характеристики больных СУИQT в зависимости от количества мутаций.
| Показатели | Мономутации n=116 | Комбнированные мутации, n=6 |
| Синкопе, n (%) | 58 (50%) | 6 (100%)* |
| ВОК, n (%) | 27 (23%) | 2 (33%) |
| Возраст 1-го синкопе, лет | 6,3±3 | 3,4±2* |
| ЭКГ: QTc, мс | 477±58 | 536±71,0* |
| ЭКГ: QTc > 500мс, n (%) | 38 (33%) | 6 (100%)* |
| ЭКГ: QTc > 550мс, n (%) | 14 (12%) | 3 (50%)* |
| ЭКГ: QTd, мс | 58±39 | 55±19 |
| ЭКГ: QTpc, мс | 381±41 | 396±78 |
Примечание: ** - достоверная разница между группами (p < 0,05); ВОК – внезапная остановка кровообращения.
Таким образом, на прогноз заболевания при СУИQT не влияния локализация мутаций, а наличие более одной мутации является достоверным маркером тяжелого течения заболевания.
Немодифицируемые и модифицируемые факторы риска ВСС у детей с СУИQT. Возраст первого синкопе < 6 лет и частые синкопе в анамнезе достоверно ассоциировались с ВСС и ВОК (p < 0,005). Регрессионный анализ с контролем по возрасту и полу не выявил значимой связи определенных молекулярно-генетических вариантов СУИQT с неблагоприятным прогнозом. Для оценки индивидуального риска развития синкопе и внезапной сердечной смерти была разработана шкала индивидуального риска (таб. 8).
Таблица 8. Шкала индивидуального риска (ИР) развития жизнеугрожающей аритмии у больных с СУИQT.
| Факторы риска | Баллы |
| Синкопе, провоцированный нагрузкой, эмоциями, звуковым раздражителем, плаванием Синкопе без определенного триггера | 1 0,5 |
| Первый синкопе в возрасте до 6 лет | 1 |
| QTc 500 мс QTc = 460 – 499 мс | 1 0,5 |
| Альтернация зубца Т | 1 |
| Желудочковая экстрасистолия | 0,5 |
| Синусовая брадикардия менее 2‰ | 0,5 |
| Внезапная остановка кровообращения в анамнезе | 1 |
| ВСС в возрасте до 40 лет родственника I степени | 0,5 |
| Максимальный суммарный риск | 7,5 |
Прогнозируемый риск имеет 3 градации: низкий риск – суммарный балл < 3 (61 ребенок с СУИQT; 35%); умеренный риск – суммарный балл 3 и <6 (74 ребенка с СУИQT; 43%), а также высокий риск – суммарный балл 6 (33 ребенка с СУИQT; 19%). QTc>500мс на стандартной ЭКГ, QTс max по данным 24-часового ХМ>550мс при автоматическом анализе, QTс средний по данным 24-часового ХМ>480мс при автоматическом анализе и QTd более 50 мс (LQT1/LQT3) или QTd более 100 мс (LQT2) на стандартной ЭКГ достоверно ассоциировались с внезапной остановкой кровообращения и с высоким индивидуальным риском ( 6 баллов). По данным регрессионного анализа по Коксу с контролем по возрасту и полу была выявлена достоверная ассоциация синкопе в анамнезе (p<0,001) и внезапной остановки кровообращения в анамнезе (p<0,0001) с неэффективностью антиаритмической терапии бета-блокаторами.
Рисунок 4. Анализ зависимости рецидивов синкопе на антиаритмической терапии бета-блокаторами от суммарного риска по шкале индивидуального риска (Каплана-Майера).
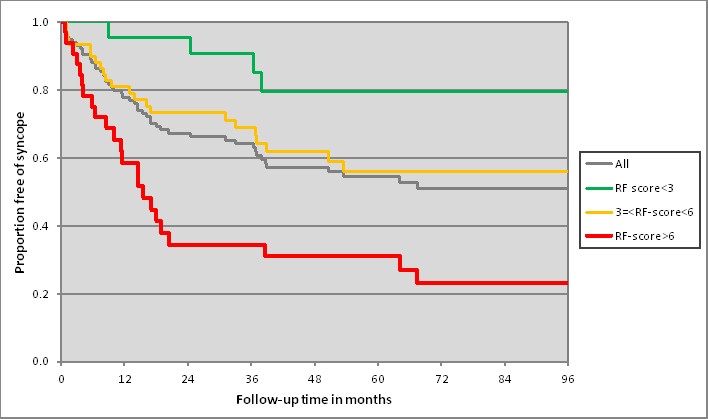
Примечание. А - по оси абсцисс – длительность катамнеза (мес); по оси ординат - частота рецидивов синкопе на терапии (%); 1- суммарный балл < 3; 2 – суммарный балл 3 и < 6; 3 – все больные; 4 - суммарный балл 6. Б – ассоциации между рецидивами синкопе и индивидуальным суммарными риском; ИР – индивидуальный риск; ОР – отношение рисков.
Анализ рецидивов синкопе (рис. 4) на фоне терапии был в 5 раз выше у детей с высоким индивидуальным риском. Более 65% больных с этим уровнем риска (против 27% среди детей с умеренным и 3% - среди детей с низким риском) имели рецидивы синкопе на фоне регулярной антиаритмической терапии за период наблюдения 18 месяцев.
Эффективность антиаритмической терапии и мониторинг больных с СУИQT. Лечение больных с СУИQT назначалось с учетом варианта синдрома и индивидуального профиля риска пациента (таб. 9).
Таблица 9. Эффективность бета-блокаторов в зависимости от дозы у больных с различными вариантами СУИQT в зависимости от эффективной дозы бета-блокатора.
| Препарат | LQT1 (n=106) | LQT2 (n=43) | LQT3 (n=16) | КМ (n=6) |
| Бета-блокаторы, n (%) | 70 (66%) | 35 (80%) | 8 (50%) | 6 (100%) |
| Дозы, мг/кг | 0,93±0,4 (0,4-2,3) | 1,1±0,5 (0,4-2,0) | 0,95±0,6 (0,5-2,0) | 1,8±0,8 (0,4-2,5) |
| Рецидивы: ББ1,0 мг/кг | 35 (50%) | 14 (40%) | 3 (37,5%) | 5 (83%) |
| Рецидивы: ББ>1,0 мг/кг | 13/29 (45%) | 7/19 (37%) | 0/3 | 4/6 (67%) |
В случае низкого ИР был рекомендован мониторинг факторов риска ВСС не реже 1 раза в год. 119 больным (69%) с синкопе в анамнезе и/или умеренным и высоким ИР ВСС при первичном обследовании была назначена антиаритмическая терапия бета-блокаторами в начальной дозе от 0,5 до 0,9 мг/кг/сут. У 57 больных (60%) имели место рецидивы синкопе на дозе бета-блокатора <1,0 мг/кг имели место. В связи с рецидивом синкопе и/или сохраняющимся высоким ИР 57 больным СУИQT доза бета-блокатора была увеличена и составила от 1,1 до 2,5 мг/кг при этом рецидивы синкопе достоверно уменьшились (p < 0,0001). Таким образом, эффективность ББ в предотвращении рецидивов синкопе при условии регулярного приема адекватной дозы составила для больных с LQT1 - 81%, для больных с LQT2 – 80% и для больных с LQT3 – 62%. Четверо больных с LQT3 и 7 больных с LQT2 получали комбинированную антиаритмическую терапию бета-блокаторами в сочетании с блокатором натриевых каналов аллапинином в дозе 0,8-1,0 мг/кг/сут. Показанием к назначению блокатора натриевых каналов у больных LQT3 были внезапная остановка кровообращения в анамнезе в 1 случае и синкопе в анамнезе в 3-х случаях. За период наблюдения 4,25±0,5 лет рецидивов синкопе нет. Показанием к назначению блокатора натриевых каналов у больных с LQT2 послужили желудочковые нарушения ритма (таб. 10). В 4-х случаях желудочковые аритмии ассоциировались с рецидивами фибрилляции желудочков, в 3-х случаях – были расценены как проявление электрической нестабильности миокарда. На фоне увеличения дозы ББ желудочковая аритмия сохранялась, а после присоединения к терапии блокатора натриевых каналов во всех случаях была успешно подавлена. На фоне комбинированной терапии также отмечалась тенденция к уменьшению продолжительности QT и QTс. Рецидив синкопе на фоне регулярного приема комбинированной терапии имел место в одном случае.
Таблица 10. Эффективность сочетанной терапии бета-блокаторами и блокатором натриевых каналов (аллапинин) у больных с LQT2.
| Пациент #n | Длительность наблюдения, месяцы | QT, мс | QTc, мс | Подавление ЖА | Синкопе до|после |
| #1 | 19 | -12 | -39 | + | нет|нет |
| #2 | 24 | -70 | -35 | + | есть|нет |
| #3 | 30 | -40 | -32 | + | нет|нет |
| #4 | 127 | -120 | -72 | + | есть|нет |
| #5 | 58 | -60 | -80 | + | нет|нет |
| #6 | 41 | -10 | -60 | + | есть|есть |
| #7 | 48 | -40 | -40 | + | нет|нет |
Примечание: ЖА – желудочковые аритмии.
Таким образом, исходя из индивидуального профиля риска, показано назначение бета-блокаторов в первоначальной дозе не менее 1,0 мг/кг/сут. При этом больным с LQT3 с высоким рисков ВСС и в случаях регистрации желудочковых нарушений ритма у больных с LQT2 рекомендована комплексная антиаритмическая терапия блокатором натриевых каналов.
Оценка эффективности ИКД-терапии у детей с СУИQT. У 44 (25%) потребовалась имплантация кардиовертера-дефибриллятора (22 мальчика, 50%). Распределение больных в зависимости от варианта СУИQT представлено в таблице 11. Как видно из таблицы больных с ИКД было достоверно больше среди детей с LQT2 (37%) и LQT3 (37,5%) в сравнении с детьми с LQT1 (17%), p < 0,05. Среди детей с комбинированным мутациями ИКД был имплантирован в 67% случаев. Средний возраст имплантации составил 12±5 лет (от 3 до 26 лет) и не различался в зависимости от варианта синдрома. Основным показанием к имплантации ИКД у больных с LQT1 и LQT2 явилась неэффективность бета-адреноблокаторов, тогда как у детей с LQT3 основным показанием к имплантации была высокая концентрация факторов риска ВСС. У детей с комбинированными мутациями основным показанием к имплантации ИКД послужили эпизоды ВОК в анамнезе.
Таблица 11. Клинико-электрокардиографические характеристики пациентов с ИКД в зависимости от варианта СУИQT.
| Показатели | Общая n=44 | LQT1 n=18 | LQT2 n=16 | LQT3 n=6 | КМ n=4 |
| Мальчики, n (%) | 22 (50%) | 8 (44%) | 10 (63%) | 3 (50%) | 1 (25%) |
| QTc, мс | 500,4±47 | 489,8±45 | 499,7±35 | 498,5±43 | 543,7±89 |
| ВСС в семье, n (%) | 21 (48%) | 10 (56%) | 9 (56%) | 1 (17%) | 1 (25%) |
| Синкопе до ИКД, n (%) - ВОК, n (%) | 40 (91%) 24 (55%) | 18 (100%) 10 (56%) | 15 (94%) 8 (50%) | 3 (50%) 2 (33%) | 4 (100%) 4 (100%) |
| ААТ1, n (%) | 41 (93%) | 18 (100%) | 14 (88%) | 5 (83%) | 4 (100%) |
| Возраст 1-го синкопе, лет | 6,7±4 | 4,6±3 | 9,1±3 | 10,2±4 | 2,8±1,4 |
| Возраст имплантации, лет | 12±5 (3-26) | 11±5 (4-26) | 13±4 (9-24) | 14±5 (5-17) | 10±6 (3-17) |
Примечание: ВОК – внезапная остановка кровообращения, 1 – наличие антиаритмической терапии до имплантации.
Интервал QTc был достоверно длиннее у больных с ИКД в сравнении с больными не имеющими показаний к ИКД-терапии (500,4±47 против 472,8±52 мс; р=0,003). Немотивированные срабатывания были зарегистрированы у 4-х детей с СУИQT и ИКД (9%). Их причинами стали подизоляционный перелом электрода, суправентрикулярная тахикардия и гипервосприятие Т волны. Желудочковые тахиаритмии при ИКД мониторинге зарегистрированы у 19 пациентов и включали эпизоды устойчивой фибрилляции желудочков (19 больных; 43%), купированные разрядом ИКД, и эпизоды неустойчивой фибрилляции желудочков (12 больных; 27%), купировавшиеся самопроизвольно. Дети с мотивированными срабатываниями характеризовались большими значениями QTc и чаще имели ВОК в анамнезе. Эпизоды неустойчивой желудочковой тахикардии были зарегистрированы у 63% детей с мотивированными шоками и не регистрировались у детей, не имевших срабатываний за период наблюдения. Кроме того, мотивированные шоки чаще имели место у детей с LQT2 и КМ. С целью оценки риска ФЖ и мотивированных срабатываний у больных с ИКД была разработана шкала экстремального риска (таб. 12). Прогнозируемый риск, рассчитанный по данной шкале имеет три градации: крайне низкий – суммарный балл < 1 (10 больных – 23%); умеренный – суммарный балл 1 и < 3 (19 больных; 43%) и высокий – суммарный балл 3 (15 больных; 34%).
Таблица 12. Шкала экстремального риска для больных с ИКД.
| Факторы и маркеры риска | -1 | 0 | 1 | 2 |
| Синкопе за период наблюдения в 5 лет* | нет | да | ||
| QTc, мс | <500 | 500-550 | >550 | |
| Возраст имплантации ИКД, лет* | 10+ | <10 | ||
| Аритмические события на ББ | нет | да | ||
| ВОК в анамнезе | нет | да |
Примечание: * - модифицированные параметры; ** - внезапная остановка кровообращения.
Рисунок 5. Анализ зависимости наличия мотивированных срабатываний у больных с ИКД от суммарного риска по шкале экстремального риска (Каплана-Майера).

Примечание. А - по оси абсцисс – длительность катамнеза (мес); по оси ординат - частота мотивированных срабатываний; 1- суммарный балл <1; 2 – все больные; 3 – суммарный балл 1; 4 - суммарный балл 2; 5 – суммарный балл 3. Б – ассоциации между мотивированными шоками и суммарными риском; ЭР – экстремальный риск; ОР – отношение рисков.
Анализ Каплана-Майера (рис. 5) показал, что увеличение индивидуального суммарного риска на 1 балл увеличивает вероятность мотивированных срабатываний в 2 раза. Вероятность мотивированных срабатываний была в 14 раз выше у больных с суммарным риском 1 в сравнении с больными с суммарными риском < 1 (p=0,011). За период наблюдения 5 лет среди больных с риском 3 мотивированные шоки имели место в 100% случаев.
C учетом индивидуального профиля риска разработана трехэтапная схема лечения, представленная (рис. 6).
Анализ летальности показал, что в подгруппе детей для которой ИКД терапия не рассматривалась в связи с отсутствием данного метода в общедоступной медицинской практике (период наблюдения с 1998 по 2003 гг.) летальность составила 12%. Внедрение трехэтапной терапии позволило снизить летальность детей с СУИQT до 1,5%.
Рисунок 6. Трехэтапная схема терапии больных с СУИQT в зависимости от молекулярно-генетического варианта.
Примечание: ИР – суммарный балл по шкале индивидуального риска; ЭР – суммарный балл по шкале экстремального риска.
Выводы.
- Специфическая фенотипическая экспрессия основных молекулярно-генетических вариантов СУИQT служит основой их ранней неинвазивной диагностики.
- Возраст оказывает модулирующий эффект на клиническое течение врожденного СУИQT у детей. При этом ранняя манифестация клинических симптомов с развитием первого синкопе в возрасте до 6 лет характерна для больных с LQT1 и при всех молекулярно-генетических вариантах СУИQT ассоциируется с высоким риском внезапной сердечной смерти.
- Удлинение электрической систолы желудочков у больных СУИQT приводит к развитию выраженного электромеханического несоответствия с аномальной продольной систолической деформацией миокарда левого желудочка и достоверно ассоциируется с аритмогенными жизнеугрожающими состояниями независимо от молекулярно-генетического варианта СУИQT.
- Повторные синкопе в анамнезе до начала терапии наряду с выраженными удлинением электрической систолы желудочков по данным ЭКГ и 24-часового мониторирования ЭКГ и удлинением трансмуральной дисперсии реполяризации являются значимыми предикторами развития жизнеугрожающих аритмий.
- У больных с СУИQT наличие двух и более мутаций достоверно ассоциируется с тяжестью течения синдрома, что позволяет считать комбинированные мутации дополнительным немодифицируемым фактором риска синкопе.
- Применение трехэтапной схемы лечения у детей с СУИQT, включающей антиаритмическую терапию, левостороннюю симпатэктопию и имплантацию кардиовертера-дефибриллятора, эффективно позволяет снизить летальность в этой группе больных с 12% до 1,5%.
- На долю больных с СУИQT приходится до 50% имплантаций кардиовертеров-дефибрилляторов у детей. Она эффективна для вторичной профилактики ВСС у 43% детей с СУИQT из группы высокого риска в течение первых 5 лет после имплантации.
Практические рекомендации
- Для ранней диагностики СУИQT рекомендуется использовать алгоритм, который включает анализ клинических и электрокардиографических симптомов с учетом их доказанной значимости для каждого из молекулярно-генетических вариантов синдрома: оценку геноспецифических триггеров, в отсутствие которых решающее значение имеет выявление типичного ЭКГ паттерна и/или характерной динамики реполяризации (QTc и QTpc) на тесте с физической нагрузкой.
- Больным с СУИQT рекомендовано проведение спектрального и тканевого допплеровского исследования сердца по специальному протоколу, включающему определение соотношения времени электрической и механической систолы желудочков, времени изоволюметрического расслабления, анализ сегментарной деформации миокарда методом 2D speckle tracking.
- Всем больным с врожденным СУИQT для стратификации риска и определения тактики ведения рекомендована оценка индивидуального профиля риска развития жизнеугрожающих аритмии по разработанной шкале, включающей немодифицируемые и модифицируемые факторы и маркеры риска в соответствии с их прогностической значимостью.
- Детям с СУИQT из группы высокого риска рекомендовано применение трехэтапной схемы лечения, включающей антиаритмическую терапию на первом этапе, левостороннюю симпатэктопию и имплантацию кардиовертера-дефибриллятора на втором и третьем этапах.
- Всем больным с врожденным СУИQT, получающим антиаритмическую терапию, рекомендована оценка риска развития фибрилляции желудочков по разработанной шкале экстремального риска для оптимизации показаний и определения сроков имплантации кардиовертера-дефибриллятора.
- Имплантация кардиовертера-дефибриллятора показана всем больным с СУИQT, перенесшим внезапную остановку кровообращения; имеющим рецидивы синкопе на фоне антиаритмической терапии или после проведения левосторонней симпатэктомии, а также больным с критическими брадиаритмиями, нуждающимся в назначении адекватной для контроля факторов риска дозы бета-блокаторов.
Список научных работ, опубликованных по материалам диссертационного исследования:
- Ильдарова Р.А., Школьникова М.А. Врожденный синдром удлиненного интервала QT как проявление первичной электрической патологии сердца // Российский вестник перинатологии и педиатрии. – 2010. – №2. – Том 55. С.42-49.
- Школьникова М.А., Харлап М.С., Ильдарова Р.А., Березницкая В.В., Калинин Л.А. Диагностика, стратификация риска внезапной смерти и лечение молекулярно-генетических вариантов синдрома удлиненного интервала QT // Кардиология. – 2011. – №5. – С.50-61.
- Школьникова М.А., Харлап М.С., Ильдарова Р.А. Генетически детерминированные нарушения ритма сердца //Российский кардиологический журнал. – 2011. – №1 (87). – С.8-25.
- Калинин Л.А., Ильдарова Р.А., Школьникова М.А. Влияние пробы с дозированной физической нагрузкой на функцию синусового узла и реполяризацию у детей с наследственным синдромом удлиненного интервала QT // Кардиология. – 2011. – №9. – С.49-56.
- Школьникова М.А., Кравцова Л.А., Березницкая В.В., Харлап М.С., Ильдарова Р.А. Эпидемиология, особенности клинического течения и общие принципы медикаментозной терапии тахиаритмий у детей раннего возраста. Часть 1. Пароксизмальные и непароксизмальные тахикардии у детей раннего возраста. Анналы аритмологии. 2011г. – №4. – С.5-14.
- Школьникова М.А., Кравцова Л.А., Березницкая В.В., Харлап М.С., Ильдарова Р.А. Эпидемиология, особенности клинического течения и общие принципы медикаментозной терапии тахиаритмий у детей раннего возраста. Часть 2. Клиническая характеристика и принципы лечения первичных электрических заболеваний сердца у детей раннего возраста. Анналы аритмологии. 2011г. – №4. – С.15-19.
- Ильдарова Р.А., Школьникова М.А., Харлап М.С., Березницкая В.В., Калинин Л.А.. Sodium-chennel blockers might contribute to the prevention of ventricular tachycardia in patients with long QT syndrome type 2: a description of 4 cases. J. Electrocardiology. 2012 May; Volume 45, Issue 3. Р. 237-243.
- Ильдарова Р.А., Школьникова М.А., Березницкая В.В., Калинин Л.А. Роль неинвазивных методов в диагностике молекулярно-генетических вариантов синдрома удлиненного интервала QT и дифференцированная тактика ведения // Материалы III Всероссийского съезда аритмологов, 08-10 июня 2009 г. – М. 2009. – С. 106.
- Ильдарова Р.А., Школьникова М.А., Харлап М.С. Современные методы лечения жизнеугрожающих аритмий // Тезисы докладов VII Всероссийского Семинара памяти проф. Белоконь Н.А. «Фармакотерапия в детской кардиологии», 18-19 сентября 2009 г. – Смоленск. 2009 – С. 60-61.
- Ильдарова Р.А., Калинин Л.А., Харлап М.С., Березницкая В.В., Школьникова М.А. Диагностическое значение проб с физической нагрузкой у детей с 1 и 2 вариантами синдрома удлиненного интервала QT. // Тезисы VI Всероссийского Конгресса «Детская кардиология 2010», Москва, 1-3 июля 2010 г. –N142 – С. 273-274.
- Ильдарова Р.А., Харлап М.С., Березницкая В.В., Школьникова М.А. Современные подходы к лечению различных вариантов синдрома удлиненного интервала QT//Тезисы VI Всероссийского Конгресса «Детская кардиология 2010», Москва, 1-3 июля 2010 г.–N39-С.74-76.
- Ильдарова Р.А., Березницкая В.В., Школьникова М.А. Электромеханическая функция сердца у детей при синдроме удлиненного интервала QT (СУQT) // Материалы Четвертого Всероссийского съезда аритмологов, Москва, 16-18 июня 2011г. – №2. – С.37.
- Калинин Л.А., Ильдарова Р.А., Школьникова М.А. Оценка функции синусового узла при пробе с физической нагрузкой у детей с синдромом удлиненного интервала QT // Материалы Четвертого Всероссийского съезда аритмологов. Анналы аритмологии, Москва, 16-18 июня 2011, – №2 (приложение) – С.49.
- Калинин Л.А., Ильдарова Р.А., Школьникова М.А. Диагностическое значение процесса реполяризации при физической нагрузке у детей с синдромом удлиненного интервала // Материалы Четвертого Всероссийского съезда аритмологов. Анналы аритмологии, Москва, 16-18 июня 2011г. – №2 – С.50.
- Калинин Л.А., Ильдарова Р.А., Школьникова М.А. Динамика интервала QT при физической нагрузке у детей с различными вариантами синдрома удлиненного интервала QT // Материалы Четвертого Всероссийского съезда аритмологов. Анналы аритмологии, Москва, 16-18 июня 2011г. – №2. – С.50.
- Ильдарова Р.А., Школьникова М.А., Березницкая В.В., Харлап М.С., Калинин Л.А., Cuoretti A., Insolia R., Crotti L., Schwartz P. Эффективность аллапинина в профилактике желудочковой тахикардии у пациентов с СУИQTII // Материалы Четвертого Всероссийского съезда аритмологов, Москва, 16-18 июня 2011г. – №2. – С.159.
- Верченко Е.Г., Березницая В.В., Ильдарова Р.А., Школьникова М.А. Electromechanical phenomena associated with congenital long QT syndrome in children // European Heart Journal 2011; Vol. 32 (Abstract Supplement):1114, Abstracts ESC Congress 2011, 27-31 Aug 2011, Paris, France. – P5867.
- Школьникова М.А., Миклашевич И.М., Калинин Л.А., Ильдарова Р.А. Pediatric criteria for bradycardia and QTc limits established in a population study. // Abstracts 38th International Congress on Electrocardiology, 8-11 June, 2011 Ontario, Canada – Р. 602.
- Ильдарова Р.А., Калинин Л.А., Школьникова М.А. The diagnostic value of stress-test in children with LQT1 and LQT2. // Abstracts 38th International Congress on Electrocardiology, 8-11 June, 2011 Ontario, Canada – Р. 595.
- Ильдарова Р.А., Школьникова М.А., Березницкая В.В., Харлап М.С., Калинин Л.А., Cuorettic, R. Insoliac, L. Crottic, P. J. Schwartzc. Effectiveness of sodium channel blockers for preventing ventricular tachycardia in patients with LQT2. // Abstracts 38th International Congress on Electrocardiology, 8-11 June, 2011 Ontario, Canada – Р. 595.
- Верченко Е.Г., Ильдарова Р.А., Березницкая В.В., Школьникова М.А. Электромеханическая функция сердца у детей при синдроме удлиненного интервала QT (СУИQT). Вестник аритмологии. Тезисы 2012, приложение А – С.90.
- Ильдарова Р.А., Школьникова М.А., Березницкая В.В. Особенности диагностики и лечения синдрома удлиненного интервала QT у детей раннего возраста. Вестник аритмологии. Тезисы. 2012, приложение А, стр.90.
- Ильдарова Р.А. Школьникова М.А. Березницкая В.В. Термосесов С.А. Эффективность ИКД терапии у больных молодого возраста с тяжелым течением синдрома удлиненного интервала QT. VII Всероссийский конгресс «Детская кардиология 2012». Тезисы – С.123-124.
- Ильдарова Р.А. Школьникова М.А. Березницкая В.В. Особенности клинического течения и варианта синдрома удлиненного интервала QT в зависимости от локализации мутации. VII Всероссийский конгресс «Детская кардиология 2012». Тезисы.
- Верченко Е.Г., Ильдарова Р.А., Березницкая В.В., Школьникова М.А. Электромеханическая функция сердца у детей при синдроме удлиненного интервала QT. VII Всероссийский конгресс «Детская кардиология 2012». Тезисы. С.251-252.
- Ильдарова Р.А. Школьникова М.А. Березницкая В.В. Термосесов С.А. Efficacy of ICD therapy in high-risk children with Long QT syndrome. European Heart Journal 2012; Vol.33 (Abstract Supplement) – P. 4102. ESC Congress 2011, 25-29.08.2012, Munich.
Премии
Первая премия на IX Международном конгрессе «Кардиостим 2010» (Санкт-Петербург, 2010 г.).
Вторая премия на 38-м Международном конгрессе по электрокардиографии (Кингстон, Канада, 2012г.).
Третья премия на IV Всероссийском съезде аритмологов (Москва, 2012 г.).
Список принятых в тексте сокращений
LQT1 – первый молекулярно-генетический вариант синдрома удлиненного интервала QT
LQT2 – второй молекулярно-генетический вариант синдрома удлиненного интервала QT
LQT3 – третий молекулярно-генетический вариант синдрома удлиненного интервала QT
LQT5 – пятый молекулярно-генетический вариант синдрома удлиненного интервала QT
ББ - бета-адреноблокаторы
ВИР – время изоволюметрического сокращения
ВОК – внезапная остановка кровообращения
ВСС – внезапная сердечная смерть
ИКД – имплантируемый кардиовертер-дефибриллятор
ИР – индивидуальный риск
ПК – поверхностное ЭКГ картирование
ПСД – продольная систолическая деформация
СУИQT – синдрома удлиненного интервала QT
ХМ – холтеровское мониторирование ЭКГ
ЧСС – частота сердечных сокращений
ЭКГ - электрокардиограмма
ЭМД – электро-механическая диссоциация
ЭхоКГ - эхокардиография

