Оптимизация методов профилактики, диагностики и лечения резус сенсибилизации
На правах рукописи
МИТРЯ ИННА ВАЛЕРИЕвна
ОПТИМИЗАЦИЯ МЕТОДОВ ПРОФИЛАКТИКИ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ РЕЗУССЕНСИБИЛИЗАЦИИ
14.01.01 – акушерство и гинекология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2010
Работа выполнена в Федеральном государственном учреждении
«Научный центр акушерства, гинекологии и перинатологии
им. академика В.И. Кулакова» Министерства здравоохранения и социального развития Российской Федерации в отделении гравитационной хирургии крови
Научные руководители:
доктор медицинских наук, Т.А. ФЕДОРОВА
профессор
доктор медицинских наук, С.И. ДОНСКОВ
профессор
Официальные оппоненты:
доктор медицинских наук А.А.АГАДЖАНОВА
(ФГУ «НЦ АГ и П им. В.И. Кулакова»Минздравсоцразвития России)
доктор медицинских наук, А.А. РАГИМОВ
профессор (ГУ РНЦХ им. Б.В. Петровского РАМН)
Ведущее учреждение:
Московский областной научно-исследовательский институт акушерства и гинекологии
Защита диссертации состоится « 19 » октября 2010г. в 13 часов на заседании Диссертационного совета Д.208.125.01 при ФГУ «Научный Центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздравсоцразвития России, по адресу: 117997, г. Москва, ул. Акад. Опарина, д.4
С диссертацией можно ознакомиться в библиотеке ФГУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздравсоцразвития России
Автореферат разослан «___» _____________2010 г
Ученый секретарь
диссертационного совета
доктор медицинских наук Е.А.КАЛИНИНА
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Несмотря на успехи, достигнутые в изучении патогенеза и клиники гемолитической болезни плода (ГБП) и новорожденного (ГБН), проблема иммунологических отношений плода и материнского организма и в настоящее время продолжает оставаться актуальной и требует поиска новых методов профилактики, диагностики и лечения резус – сенсибилизации (Rh-сенсибилизации). В развитых странах мира удалось снизить количество женщин c Rh-сенсибилизацией до 0,2-0,1%, благодаря внедрению в клиническую практику специфической профилактики, путем введения антирезусного иммуноглобулина несенсибилизированным резус-отрицательным женщинам. Однако в России процент Rh–сенсисибилизированных женщин остается по-прежнему высоким - 1,2% (Сидельникова В.М. и соавт.2004; Савельева Г.М. и соавт.2006).
Наиболее иммуногенным среди всех эритроцитарных антигенов системы Резус является антиген D, который в 80% случаев является причиной тяжелого течения ГБП и ГБН. Вероятность появления антител у матери зависит от различных факторов: фенотипа плода, иммуногенности эритроцитарного антигена, объема трансплацентарного кровотечения, а также от иммунологической способности матери к выработке антител (Донсков С.И. 2005; Минеева Н.В. 2004).
Основное значение в развитии ГБП и ГБН имеют антитела, относящиеся к иммуноглобулинам класса G (IgG). Антитела связываются с антигеном эритроцитов, образуя комплекс, который распознается Fc-рецепторами эффекторных клеток (моноциты, макрофаги, лимфоциты) ретикуло-эндотелиальной системы, которые посредством фагоцитоза лизируют эритроциты плода. Этот гемолитический процесс зависит от типа субклассов IgG (Beliard R. et al. 2008; Heyman B. et al. 2000).
По данным литературы существует 4 подкласса IgG: IgG1, IgG2, IgG3, IgG4. Все 4 субкласса IgG активно переносятся к плоду и увеличивают уровень материнских антител в кровотоке плода. Однако IgG1 и IgG3 намного легче взаимодействуют с Fc-рецепторами клеток, чем IgG2 и IgG4. Поэтому диагностическое значение имеют только IgG1 и IgG3. Это различие в функции субклассов IgG делает необходимым их дифференциацию. Именно их количество будет определять степень риска гемолиза эритроцитов. Для определения титра резус-антител, субклассов иммуноглобулинов IgG, титра IgG1 и IgG3 используют гелевые тест-системы (Минеева Н.В. 2004; Iida Sh. et al. 2006).
В настоящее время существуют неинвазивные методы лечения - десенсибилизирующая терапия другими антигенами, лимфоцитоиммунотерапия и другие методы, направленные на лечение гипоксии, уменьшение проницаемости плаценты, но они не являются патогенетически обоснованными и достаточно эффективными. Среди инвазивных методов терапии ГБП применяют внутриутробное переливание эритромассы плоду, однако, потери плода от самой процедуры при каждом переливании составляют 6%, а 5% из выживших новорожденных остаются инвалидами (Сидельникова В.М. и соавт. 2004; Hudon L. et al. 1998).
Одним из методов снижения титра Rh-антител и уменьшения Rh-сенсибилизации является лечебный плазмаферез (ПА). Известно, что ПА позволяет снизить уровень циркулирующих антител, предупреждает развитие фетоплацентарной недостаточности, улучшает микроциркуляцию в системе мать-плацента-плод за счет нормализации реологических и коагуляционных свойств крови (Рогачевский О.В., 2000).
В комплексное лечение Rh-сенсибилизации, после проведения ПА, целесообразно включать иммуноглобулинотерапию (Ig-терапию). Применение иммуноглобулина патогенетически обосновано тем, что, по данным ряда авторов, он, будучи введенным в больших дозах, обладает способностью ингибировать продукцию антител (Антонов А.Г., Им В.Л. 2006). Вместе с тем многие аспекты применения ПА с последующей Ig-терапией при Rh-сенсибилизации не изучены. До настоящего времени не определенно место ПА в комплексе мероприятий подготовки Rh- сенсибилизированных женщин к беременности, а также не отработана методика его проведения у данного контингента больных. Не изучена эффективность и влияние комплексной терапии с применением ПА и Ig-терапии у беременных с Rh-сенсибилизацией в качестве профилактики развития ГБП и ГБН.
Цель исследования
Повышение эффективности подготовки к беременности и ведения беременных с резус–сенсибилизацией на основе применения современных методов профилактики, диагностики и лечения.
Задачи исследования
- Провести анализ течения и исходов беременности в зависимости от методов терапии женщин с Rh-сенсибилизацией и определить оптимальные сроки и способы родоразрешения.
- Изучить взаимосвязь между титром резус- антител и типом субклассов IgG и оценить диагностическую значимость метода титрования IgG1 и IgG3 с использованием гелевых тест-систем для определения степени риска гемолиза эритроцитов плода.
- Изучить динамику основных параметров гемостаза и показателей периферической крови у женщин с Rh-сенсибилизацией, которым проводилась комплексная терапия с использованием лечебного плазмафереза и иммуноглобулинотерапии.
- Изучить диагностическую значимость определения максимальной скорости кровотока среднемозговой артерии плода у женщин с Rh-сенсибилизацией для определения степени тяжести анемии.
- Изучить целесообразность использования лечебного плазмафереза с последующей иммуноглобулинотерапией в качестве подготовки к беременности и лечения женщин с Rh-сенсибилизацией.
- Провести сравнительную оценку состояния новорожденных, родившихся у матерей с Rh-сенсибилизацией, в зависимости от методов проводимой терапии.
- Разработать оптимальный алгоритм обследования и лечения женщин с Rh-сенсибилизацией, направленный на профилактику развития тяжелых форм гемолитической болезни плода и новорожденного с применением современных методов диагностики и лечения.
Научная новизна
Впервые изучена роль субклассов иммуноглобулинов IgG1 и IgG3, и проведен корреляционный анализ между концентрацией титра Rh-антител и титром IgG1 и IgG3, что дало возможность провести оценку степени риска гемолиза эритроцитов плода и на основании полученных данных определить степень Rh-сенсибилизации, вероятность развития ГБП и оптимизировать комплексную терапию женщин с Rh- сенсибилизацией. Изучено влияние лечебного плазмафереза и иммуноглобулинотерапии на динамику титра Rh-антител и течение беременности у сенсибилизированных женщин. Изучено состояние новорожденных в зависимости от проводимой терапии Rh-сенсибилизации. Проведенное исследование дает возможность предотвратить развитие тяжелых форм гемолитической болезни плода и новорожденного и, тем самым, улучшить перинатальные исходы.
Практическая значимость
Разработан алгоритм диагностики Rh-сенсибилизации с учетом определения субклассов IgG, их концентрации и оценки степени риска гемолиза эритроцитов плода и схема комплексного лечения женщин с Rh-сенсибилизацией с использованием лечебного плазмафереза с последующей иммуноглобулинотерапией. Использование данного алгоритма в профилактике и лечении Rh-сенсибилизации позволяет уменьшить частоту преждевременных родов, предупредить развитие тяжелых форм гемолитической болезни плода и новорожденного, уменьшить количество операций заменного переливания крови и сократить продолжительность фототерапии. Разработанный алгоритм обследования и лечения может быть использован в практическом здравоохранении для подготовки и ведения беременных женщин с Rh-сенсибилизацией.
Основные положения, выносимые на защиту:
- Изучение субклассов IgG1 и IgG3 позволяет определить степень риска гемолиза эритроцитов, направленное на выявление степени сенсибилизации и раннюю диагностику гемолитической болезни плода. Независимо от величины титра резус-антител, степень риска гемолиза эритроцитов плода может быть высокой как при самых высоких титрах, так и при самых низких.
- Комплексное лечение Rh-сенсибилизации с использованием курса лечебного плазмафереза с последующей Ig-терапией является эффективным методом подготовки к беременности и лечения женщин с Rh-сенсибилизацией, приводящим к достоверному снижению и стабилизации титра резус-антител, нормализации коагуляционных и реологических свойств крови. В случае возникновения rebound-эффекта необходимо проведение повторного курса плазмафереза и Ig-терапии.
- Включение в комплексную терапию лечебного плазмафереза в сочетании с иммуноглобулинотерапией беременным с Rh-сенсибилизацией позволяет пролонгировать беременность до оптимального срока родоразрешения, снизить процент рождения недоношенных новорожденных, предупредить развитие тяжелых форм ГБП и ГБН, в 2 раза уменьшить частоту заменного переливания отмытых эритроцитов у новорожденных и как следствие улучшить перинатальные исходы.
Внедрение результатов исследования:
Полученные результаты исследования внедрены в клиническую практику акушерских отделений и отделения гравитационной хирургии крови ФГУ «Научного центра акушерства, гинекологии и перинатологии им. В.И. Кулакова» Минздравсоцразвития России. Данные диссертации используются в лекционном материале на семинарах, симпозиумах, форумах.
Апробация диссертационного материала:
Материалы диссертации доложены на Всероссийской научно-практической конференции «Нерешенные проблемы перинатальной патологии» (Нижневартовск, 7 - 8 декабря 2005), семинаре «Новые медицинские технологии в акушерстве, гинекологии и неонатологии» (Москва, 23-25 мая 2005), семинаре «Методы гемафереза и квантовая терапия в клинической медицине» (Москва, 27-28 мая 2008), на VI Всероссийской междисциплинарной конференции «Критические состояния в акушерстве и неонатологии» (Петрозаводск, 20-24 мая 2008), на II Всероссийском конгрессе «Анестезия и реанимация в акушерстве и неонатологии (Москва, 24-27 ноября 2009). Основные положения диссертации доложены и обсуждены на заседании межклинической конференции 01.04.2010 и на заседании апробационной комиссии ФГУ «НЦ АГ и П им. В.И. Кулакова» Минздравсоцразвития России 24.05.2010.
Публикации:
По теме диссертации опубликовано 16 печатных работ.
Структура и объем диссертации:
Диссертационная работа изложена на 149 страницах печатного компьютерного текста, состоит из введения, 4 глав, выводов и практических рекомендаций. Диссертация иллюстрирована 20 таблицами и 16 рисунками. Библиографический указатель содержит перечень 171 работу: 75 отечественных и 96 зарубежных авторов.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы исследования
Для выполнения цели и задач исследования нами было отобрано 147 женщин с Rh-сенбилизацией, находившихся на обследовании и лечении в акушерских отделениях ФГУ «НЦ АГ и П им В.И. Кулакова» Минздравсоцразвития России за период времени с 2000 по 2009 годы.
I группу – основную, составили 87 женщин с Rh-сенсибилизацией, которым с целью лечения данной патологии и профилактики развития ГБП и ГБН применялась терапия с использованием лечебного ПА с последующей Ig-терапией (количество процедур ПА и дозы иммуноглобулина зависели от титра Rh-антител, титра IgG1 и IgG3, степени риска гемолиза эритроцитов, данных ультразвукового исследования состояния плода, допплерометрии и кардиотокографии. Данная группа была разделена на две подгруппы: I–A – 30 небеременных женщины с Rh-сенсибилизацией и I–Б – 57 беременных женщин, обратившихся на разных сроках беременности с Rh-антителами.
Отбор пациенток в основную группу проводили по следующим критериям: подготовка к беременности женщин с Rh-антителами и отягощенным акушерским анамнезом (тяжелая форма ГБН, антенатальная гибель плода от ГБ в анамнезе, среднетяжелые формы ГБП в анамнезе); исходно высокий уровень титра Rh-антител (1:32 и выше); наличие Rh-антител в начале беременности и рост их титра по мере прогрессирования беременности.
Критериями исключения являлись: анемия (гемоглобин <80 г/л); гипокоагуляционный синдром; гипоальбуминемия (белок <55 г/л); имеющаяся тяжелая форма ГБ (ультразвуковые признаки отечной формы ГБП); тяжелые экстрагенитальные заболевания в стадии декомпенсации.
II группа – сравнения, составили 60 женщин, с Rh-сенсибилизацией, которым проводилась стандартная неспецифическая терапия Rh-сенсибилизации (иммуносупрессивная, десенсибилизирующая, инфузионно-трансфузионная терапия).
Методика проведения плазмафереза
87 беременным основной группы проводились сеансы прерывистого ПА в условиях отделения гравитационной хирургии крови. Беременные укладывались на функциональную кровать в положении «на боку» с целью предотвращения синдрома «нижней полой вены». Прерывистый ПА проводился следующим образом: эксфузия крови производилась путем пункции локтевой вены в сдвоенные пластикатные контейнеры «Гемакон 500/300». После тщательного перемешивания кровь помещали в рефрижераторную центрифугу «Bеchman» и центрифугировали со скоростью 3000 оборотов в минуту при 220С в течение 6 минут. Плазму, отделившуюся от клеточной массы, удаляли с помощью плазмоэкстрактора. Оставшиеся клетки разбавляли 150 мл физиологического раствора и реинфузировали пациентке.
За один сеанс производили 1 - 2 забора крови в зависимости от состояния больной, веса пациентки, переносимости процедуры. Плазмоэксфузия производилась от 20 до 25 % объема циркулирующей плазмы. Плазмовозмещение осуществлялось препаратами гидроксиэтилированного крахмала (ГЭК 6 % или 10%), кристаллоидными растворами в соотношении к удаляемой плазме 2:1. Введение гиперонкотического раствора альбумина 10% или 20% (100 мл, 50 мл) проводилось при показателях альбумина в крови ниже 30 г/л. Всем пациенткам назначалась диета с повышенным содержанием белка. Стабилизацию крови осуществляли за счет гемоконсерванта типа ACD, находящегося в контейнере, а также гепарина, который вводился внутривенно в начале процедуры в дозе 2500-5000 ЕД в зависимости от показателей гемостазиограммы.
Аппаратный ПА проводили на аппарате «MCS+» или «PCS2» фирмы «Haemonetics» (США). Сборка систем магистралей осуществлялась в асептических условиях непосредственно перед процедурой. В качестве антикоагулянта использовали раствор АСД-А (кислая декстроза), подаваемый автоматически в соотношении к крови 1/12. Перед началом процедуры пациентке вводили внутривенно гепарин из расчета 50 ЕД на кг/массы тела. Проведение лечебного ПА осуществлялось с подачей крови в аппарат со скоростью 25-40 мл в минуту в зависимости от пропускной способности катетера и возможности вены. Скорость вращения центрифуги «MCS+» или «PCS2» 7500 оборотов в минуту, плазма удалялась со скоростью 15-30 мл мин в зависимости от скорости подачи крови. Одновременно с забором крови и удалением плазмы производилось плазмозамещение. Плазмовозмещение осуществлялось препаратами ГЭК 6 % или 10%, кристаллоидными растворами в соотношении к удаляемой плазме 2:1. Введение гиперонкотического раствора альбумина 10% или 20% (100 мл, 50 мл) проводилось при показателях альбумина в крови ниже 30 г/л.
Для расчета объема удаляемой плазмы определяли объем циркулирующей крови (ОЦК) с учетом массы тела, роста, конституционального типа по таблице Moore:
ОЦК= М х Кк;
где М – масса тела в кг; Кк – количество крови в мл на кг массы тела в зависимости от пола и типа телосложения (от 55 до 70 мл/кг). Затем по расчетному ОЦК и гематокриту определяли ОЦП:
ОЦП = ОЦК х (100 % - Ht)
Динамика учитываемых показателей определяла число процедур и интервал между ними (в среднем 3,2±0,5 процедуры с интервалом 1-2 дня). Объемы удаляемой плазмы и плазмозамещение проводилось согласно рекомендациям, разработанным в отделении гравитационной хирургии крови ФГУ «НЦ АГиП им. В.И. Кулакова» Минздравсоцразвития России (руководитель – профессор Т.А. Федорова).
Методика проведения иммуноглобулинотерапии
После каждого курса ПА через 2-3 дня в комплексную терапию включали Ig-терапию. Противопоказаниями для проведения данной терапии являлись аллергические реакции на введение иммуноглобулинов. Внутривенное введение иммуноглобулина проводили в дозе 5,0 грамм в количестве 2 трансфузий с интервалом 1-2 дня или 2,5 грамм в количестве 3 трансфузий. Для проведения Ig-терапии использовались следующие препараты: «нормальный человеческий иммуноглобулин человека для внутривенного введения». Начальная скорость трансфузии составляла 1,4 мл/кг массы тела/час, через 10 минут при хорошей переносимости препарата скорость постепенно увеличивали максимум до 1,9 мл/кг массы тела/час и сохраняли ее до конца введения. Внутривенное введение иммуноглобулина проводили под контролем АД, ЧСС.
Общеклинические методы исследования включали анализ данных соматического и акушерско-гинекологического анамнезов. Учитывали течение и исходы предыдущих беременностей, наличие трансфузий, несовместимых по резус-принадлежности, и профилактики антрирезусным-иммуноглобулином Особое внимание уделяли течению данной беременности, наличию титра Rh-антител до беременности, появлению Rh-антител на ранних сроках беременности, развитию плацентарной недостаточности, обострение герпес- и цитомегаловирусной инфекции, проведение инвазивных методов диагностики, таких как амниоцентез и кордоцентез, биопсии хориона и редукции эмбрионов.
Проводилось исследование крови пациенток на наличие ВИЧ, гепатитов В и С, сифилиса. Определялась групповая принадлежность и резус-фактор крови пациентки.
Помимо общеклинических методов исследования, для определения влияния терапии на параметры гомеостаза обследуемым женщинам проводились следующие специальные методы исследования:
определение гемоконцентрационных показателей крови: гемоглобина, гематокрита, количества эритроцитов, тромбоцитов, лейкоцитов.
биохимические методы исследования: определение общего белка, мочевины, креатинина, уровней прямого и непрямого билирубина, глюкозы.
гемостазиологические методы: определение активированного частичного тромбопластинового времени, тромбинового времени, тромбоэластография цельной крови (ТЭГ) с оценкой хронометрической (r+k) и структурной коагуляции (ma), количество и агрегация тромбоцитов, определение концентрации фибриногена по Рутберг, протромбинового индекса, концентрации и активности антитромбина III, растворимых комплексов мономеров фибрина (РКМФ), продуктов
деградации фибрина и фибриногена (ПДФ).
серологическая диагностика: определение резус-принадлежности, определение титра Rh-антител и определение субклассов иммуноглобулинов G (IgG). Для типирования антигенов эритроцитов, определения антиэритроцитарных антител, определения субклассов иммуноглобулинов IgG (IgG1, IgG2, IgG3, IgG4) использовали диагностические карты микротипирующей гелевой технологии Диамед-DiaMed-ID Micro Typing System (Швейцария). Для дальнейшей оценки степени риска гемолиза выполнялось титрование IgG с использованием ID картах «DAT IgG-Dilution» (1:10,1:30, 1:100,1:300,1:1000).
иммунологические методы: Диагностику вирусной инфекции (цитомегаловируса и вируса герпеса) проводили с помощью стандартных иммуноферментных наборов фирмы Abbot (США), основанных на измерении специфических классов IgG (анамнестических) и IgМ (острых) антител к антигенам цитомегаловируса и вируса герпеса.
Состояние 147 новорожденных оценивали с помощью общепринятых методов обследования, кроме того определяли концентрацию билирубина, проводили пробы Кумбса, Розенфельда, ультразвуковое исследование головного мозга и внутренних органов, кардиореспираторный мониторинг, анализ методов лечения ГБН (количество операций заменного переливания отмытых эритроцитов, сеансов фототерапии, введение внутривенного иммуноглобулина).
Ультразвуковое обследование плода
Ультразвуковое обследование плода проводилось по стандартной методике, разработанной в Центре при помощи прибора «Aloka SSD-065» (Япония) в режиме реального времени. Использовали трансабдоминальный конвексный датчик с частотой 3,5 МГц. Особое значение уделялось выявлению ультразвуковых признаков тяжелой формы ГБП: плацентомегалии, гепато- и спленомегалии, жидкости в брюшной полости и в перикарде, повышению эхогенности кишечника, отека подкожной клетчатки в области головы и конечностей плода, увеличению количества околоплодных вод.
Кардиотокографическое исследование состояния плода
Кардиотокографическое исследование проводили с помощью прибора “Sonicaid FM -7” по общепринятой методике всем беременным после 34 недель гестации. Анализ КТГ проводился с использованием классических подходов, оценивая показатели базальной частоты, вариабельность базальной частоты, амплитуду и продолжительность акцелераций и децелераций по формуле Фишера.
Допплерометрическое исследование состояния плода
Допплерометрическое исследование кровотока проводили при помощи диагностического прибора “Ultra Mark - 9”, снабженного допплеровским блоком пульсирующей волны и функцией ЦДК. В ходе исследования производили ультразвуковую фетометрию, плацентографию и оценку количества околоплодных вод. При изучении маточно-плацентарной, плодово-плацентарной и внутриплацентарной гемодинамики регистрировали скорости кровотока в маточных артериях, артерии пуповины плода. Оценка кривых скоростей кровотока проводилась путем анализа максимальной систолической (МССК) и конечной диастолической скоростей кровотока (КДСК) с расчетом уголнезависимых показателей: систоло-диастолического отношения, индекса резистентности (ИР) Pourcelot по формуле.
Статистическая обработка результатов исследования
Статистическая обработка, графики, слайды и анализ результатов выполнены на компьютере Pentium III 1 ГГц Intel с использованием программ “Winword”, “Excel”, “PowerPoint”. Статистическая обработка полученных результатов выполнена с использованием стандартных программ, вычисления критерия Стьюдента и определения достоверных различий между группами по этому критерию. Различия между сравниваемыми величинами признавались статистически достоверными при уровне значимости р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В соответствии с поставленными задачами, нами было проведено комплексное клинико-лабораторное обследование 147 беременных женщин. Анализ клинико-анамнестических данных показал, что в у 90% обследованных была выявлена экстрагенитальная патология. Обращает на себя внимание высокая частота носительства вируса герпеса 62% и 78% в группах соответственно. Анализ гинекологической заболеваемости у женщин обследуемых групп показал высокий процент хронических воспалительных заболеваний половых органов. Так, эндометрит встречается в 10,3% в основной группе и 11,6% в группе сравнения, сальпингооофорит в 23% в основной и 31,6% в группе сравнения.
Оценка генеративной функции показала, что 96 % женщин обеих групп были повторнобеременными, процент повторнородящих составил 62% и 46,4% по группам соответственно. При оценке исходов предыдущих беременностей у 26,4% женщин основной группы и 25% группы сравнения отмечена тяжелая и среднетяжелая форма ГБН, антенатальная гибель плода от ГБП встречалась в 2,5% и 4% соответственно, смерть новорожденных в результате ГБ в 10% в основной группе и в 12% в группе сравнения. Анализ причины развития Rh-сенсибилизации показал, что у 97,1% женщин обеих групп сенсибилизация возникла в результате отсутствия профилактики антирезусным иммуноглобулином во время предыдущей беременности и только в 2,9% в результате гемотрансфузии несовместимых по Rh-принадлежности.
Анализ течения данной беременности показал, что наиболее частыми осложнениями у пациенток обеих групп явились ранний токсикоз, который встречался у каждой третьей женщины и преэклампсия, которая осложнила течение беременности у каждой четвертой женщины. Обострение вирусной инфекции встречалось у 46% беременных основной группы и у 40% группы сравнения. В обеих группах отмечался высокий процент развития фетоплацентарной недостаточности, который составил в среднем 28%.
Критерием активности Rh-сенсибилизации является титр Rh-антител. До беременности Rh-антитела выявлены у половины обследованных женщин. Известно, что Rh-антитела представлены 4 субклассами иммуноглобулинов (IgG1, IgG2, IgG3, IgG4), из которых только IgG1 и IgG3 вызывают гемолиз эритроцитов плода. В связи с чем, определение их титра является необходимым диагностическим критерием риска развития ГБП. Концентрация субкласса IgG1 и IgG3 в титре 1:1 определялась у 24% и 34% беременных соответственно, степень риска гемолиза интерпретировалась как средняя. Концентрация субклассов IgG1 и IgG3 в титре 1:100 выявлена 12% и 31% женщин соответственно. Данные концентрации титра 1:100 IgG1 и IgG3 характеризуют высокий риск гемолиза эритроцитов. Важным аспектом данного исследования явилось изучение соотношения титра Rh-антител и титра подклассов IgG1 и IgG3. Каждая вторая женщина имела высокий риск гемолиза, так как титры IgG1 и IgG3 определялись во всех группах. У беременных c уровнем титра Rh-антител 1:32 субклассы IgG1 в титре 1:100 определялись у 27% и у 30% IgG3. Результаты исследования соотношения представлены на рисунке 1.
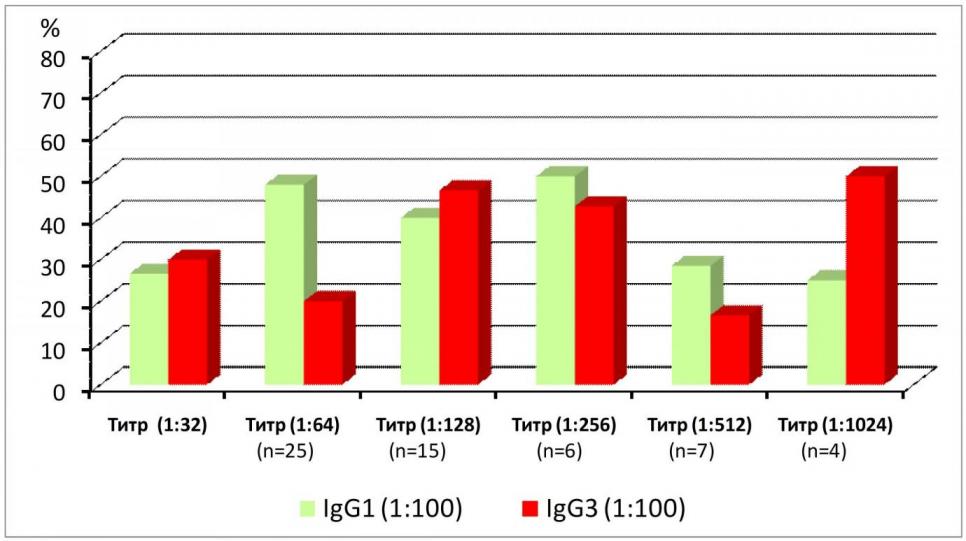
Рис. 1. Соотношение между титрами Rh-Ат и подклассами
IgG1 и IgG3
У всех обследованных исходный уровень титра Rh-антител варьировал от 1:32 и до 1:1024. Пациенткам основной группы проводили комплексную терапию, включающую лечебный ПА и введение иммуноглобулина. Курс лечебного ПА состоял из 3-5 процедур, после каждого курса проводили Ig-терапию. У 37,9% женщин основной группы и у 35% в группе сравнения женщины титра Rh-антител был высоким 1:256. У 2 небеременных женщин, имеющих в анамнезе трансфузии, несовместимые по Rh-принадлежности, уровень титра Rh-антител в первом случае достигал 1:1024, во втором случае титр Rh-антитела равнялся 1:512. Этим женщинам в качестве подготовки к беременности был проведен курс лечебного ПА, который состоял из 5 сеансов с последующей Ig-терапией. После данной комплексной подготовки уровень титра антител снизился в обоих случаях до 1:256.
Проведенное исследование показало, что титры Rh-антител у беременных основной группы до проведения курса лечебного ПА распределились следующим образом: у 13,8% женщин уровень титра антител составил 1:32, у 23% женщин - 1: 64 и у 23% - 1:128, у 40,2% женщин титр достигал 1:256. После проведения курса лечебного ПА и Ig-терапии произошло снижение титра Rh-антител: у 17,2% женщин до 1:64, у 45% до 1:32 и у 34,4% женщин до 1:16. Беременных женщин с уровнем титра 1:256 после проведения ПА и Ig-терапии не было. У 3,4% женщин, у которых титр Rh-антител снизился до 1:128, был проведен повторный курс лечебного ПА, после которого цифры Rh-антител снизились до 1:32-1:64. Данные представлены на рисунке 2.



Рис. 2. Динамика титра Rh- антител после проведения лечебного плазмафереза
При проведении контрольного анализа титра Rh-антител через 2 недели после окончания курса ПА данные показатели в 80% случаев оставались стабильными. У 18,3% женщин наблюдалось повышение титра Rh-антител, так называемый синдром рикошета (rebound эффект) им был назначен повторный курс ПА и Ig-терапии. После проведения повторного курса у 81,2% женщин титры антител снизились в 2 раза и только у 18,7% оставались стабильными, что потребовало дополнительного курса терапии.
В нашей работе в качестве профилактики эффекта «рикошета» проводилась Ig-терапия сразу после проведенного курса ПА. Механизм эффективности Ig-терапии заключается в том, что происходит ингибирование продукции собственных антител при избытке вводимого иммуноглобулина и соревнование за макрофаги или Fc-рецепторы клеток-мишеней и, тем самым происходит, блокада Fc-связанных антител при плацентарном транспорте (Минеева Н.В. 2004; Iida Sh. et al. 2006).
Таким образом, анализ динамики титра Rh-антител у беременных женщин, которым было проведено комплексное лечение с использованием ПА с последующей Ig-терапией, показал достоверное снижение и стабилизацию уровня титра Rh-антител. Для коррекции гипериммунных нарушений у женщин с высокой степенью Rh-сенсибилизацией имеет значение количество процедур лечебного ПА, курс должен состоять минимум из 3 процедур, если контрольный уровень титра Rh-антител выше 1:32, необходимо проведение повторного курса, общий объем эксфузии плазмы должен составлять 20-25% ОЦП. В случае возникновения rebound-эффекта, повторные курсы ПА и Ig-терапии приводят к временному истощению продукции антител и, как следствие, уменьшение их титра.
Одним из дополнительных показаний для проведения лечебного ПА у беременных с Rh-сенсибилизацией явились нарушения в системе гемостаза, проявляющиеся в наличии гиперкоагуляции и развитии хронической формы ДВС - синдрома. Данные нарушения являются одним из важнейших звеньев патогенеза развития плацентарной недостаточности, которая приводит к нарушению барьерной функции плаценты и, как следствие, связывания резус-антител, что способствует их прохождению через трансплацентарный барьер в кровоток плода.
Анализ результатов гемостазиограммы у больных основной группы до начала лечения выявил наличие высокой степени структурной и хронометрической гиперкоагуляции. Так, ИТП в среднем составил 20,8±0,5, r + k и ma 14,6±0,2 и 50,1±1,1 соответственно. Следует отметить, что в обеих группах обследованных женщин выявлен высокий процент активации внутрисосудистого свертывания крови, проявляющийся наличием в плазме высокомолекулярных растворимых фибрин-мономерных комплексов (РКМФ) и продукты деградации фибрина и фибриногена (ПДФ), являющихся маркерами ДВС – синдрома. Так, положительные тесты на РКМФ имели 95,5% женщин основной группы и 88,9% группы сравнения. После проведения лечебного ПА в основной группе уровень фибриногена достоверно снизился на 23,5% и в среднем составил 2,38+0,06 г/л (р<0,05). В группе сравнения отмечено недостоверное снижение фибриногена на 6,7% (2,8+1,3 г/л). Показатели r + k увеличились в основной группе на 31,1%, в группе сравнения на 16,1% соответственно. В обеих группах произошло снижение ИТП. Однако в основной группе, показатель ИТП достоверно снизился на 30% и составил 14,6+0,8 усл. ед., тогда как в группе сравнения снижение произошло лишь на 10% и составил 19,8+1,2 усл. ед.
Таким образом, включение ПА в комплексную терапию Rh-сенсибилизации приводит к коррекции коагуляционного потенциала крови за счет плазменного и тромбоцитарного звеньев гемостаза и купированию процессов внутрисосудистого свертывания. Этот факт весьма важен в лечении беременных с Rh-сенсибилизацией.
Анализ основных параметров биохимического статуса в условиях лечебного ПА не выявил достоверных изменений уровня общего белка, мочевины, креатинина, билирубина прямого и общего, АЛТ, АСТ, глюкозы. Необходимо отметить, что у 37,9% пациенток перед проведением ПА и Ig-терапией отмечалась гипопротеинемия (уровень общего белка от 60 г/л до 63 г/л). В связи с этим, при проведении ПА у этих пациенток в состав плазмозамещающих растворов был включен альбумин 10% или 20 % - 100,0 или 50,0 мл. После ПА уровень белка в среднем составил 63,96±3,14 г/л и достоверно не отличался от исходных показателей.
Анализ исходных показателей состава периферической крови в основной группе до и после лечебного ПА не отличался между собой. При детальном анализе гемоконцентрационных показателей после курса ПА выявлено снижение уровня Ht: до ПА составил 0,41±0,004 л/л, после ПА гематокрит снизился до 0,36±0,002* л/л. Достоверным оказалось уменьшение показателя скорости оседания эритроцитов (СОЭ) у беременных основной группы: до проведения ПА 26,±0,9 мм/час; после окончания курса ПА 21,1±0,7* мм/час. Снижение показателей Ht и СОЭ связано, на наш взгляд, с гемодилюцией в результате проведения лечебного ПА и является благоприятным для улучшения кровообращения и микроциркуляциии и в том числе в плаценте (Федорова Т.А.1999). Содержание количества тромбоцитов до ПА в среднем составило 227,44±63,45х109/л. После курса ПА обращает на себя внимание достоверное увеличение уровня тромбоцитов 241±15,2x109/л и 312±10,1x109/л соответственно, что является компенсаторной реакцией показателей периферической крови на проведение лечебного ПА. Показатели Hb и количества эритроцитов после лечебного ПА у беременных основной группы исследования не снижались и оставались на уровне 120,4±1,2 г/л, 3,9±0,2х1012/л соответственно. Таким образом, анализ показателей гемограммы выявил снижение показателей Ht и СОЭ, увеличение уровня тромбоцитов, что объясняется основными эффектами ПА. Основные параметры биохимического статуса у беременных после проведения лечебного ПА достоверно не изменялись. Полученные данные подтверждают безопасность лечебного ПА для беременных.
В нашей работе ультразвуковое исследование (УЗИ) плода проводили, начиная с 20 недели беременности. Сроки повторных сканирований определяли индивидуально для каждой беременной, учитывая акушерский анамнез. С 32-й недели УЗИ осуществлялось каждые 14 дней, при подозрении на тяжелую форму ГБП – каждые 3 дня. Сроки появления ультразвуковых признаков ГБП варьировали во всех группах от 20 до 39 недель гестации. В основном повторное УЗИ производили на сроках 24-26, 30-32, 34-36 недель беременности и непосредственно перед родоразрешением. При необходимости интервал сокращали до 1-2 недель. Следует отметить, что 83,9% у пациенток УЗИ - признаки ГБП впервые выявились до 36 недель беременности, после 36 недель у 16,1 %. При ультразвуковом обследовании у 86,2% всех обследованных беременных были выявлены различные признаки ГБП: плацентомегалия, увеличение окружности живота, многоводие, гепатоспленомегалия, асцит. У всех обследованных, родивших детей с отечной формой ГБН, в 100% отмечалось сочетание многоводия, утолщения плаценты, гепатомегалия, а в 82% - асцит у плода. У 4,6% беременных, родивших детей с тяжелой и среднетяжелой желтушной формой ГБН, не было выявлено ультразвуковых маркеров заболевания. Однако у 14% пациенток, несмотря на рождение здоровых детей, были выявлены ультразвуковые признаки ГБП в различных сочетаниях. Также у 8,9% обследованных, дети, которых перенесли легкое течение ГБН, имели сочетание плацентомегалии и гепатомегалии по данным УЗИ.
Для подтверждения клинического эффекта лечебного ПА на состояние фетоплацентарного (ФПК) и маточно-плацентарного кровотока (МПК) проведено допплерометрическое исследование беременных обеих групп. У беременных основной группы исследование проводили до и через 7-10 дней после курса лечебного ПА. До проведения лечебного плазмафереза МПК и ФПК был в пределах нормы у 75,8% беременных основной группы. Снижение ФПК и МПК наблюдалось у 24,1% беременной. Из них у 19,5% беременных имело место снижение ФПК при сохраненном МПК, а у 4,6% женщин отмечено снижение как ФПК, так и МПК. В группе сравнения такие нарушения были отмечены у 20%, из них сочетанное снижение ФПК и МПК было у 8,3%, а у 11,6% было отмечено только снижение ФПК при сохраненном МПК. После курса лечебного ПА из 21 женщин основной группы с нарушением ФПК и МПК, положительная динамика была отмечена у 80% беременных, из них у 23,8% произошло улучшение ФПК, однако показатели оставались ниже нормативных. В группе сравнения после проведения терапии нормализация ФПК произошла только у 6,6% беременных, положительная динамика показателей ФПК отмечена у 33,3% беременных, у 42,2% беременных показатели ФПК остались без изменений, и у 17,7% беременных наблюдалась отрицательная динамика ФПК. Из представленных данных можно сделать вывод, что ПА оказывает положительное влияние на МПК и ФПК беременных с Rh-сенсибилизацией и способствует улучшению барьерной функции плаценты, тем самым уменьшая переход Rh-антител в кровоток плода.
Одним из наиболее информативных показателей, отражающих состояние плода при ГБП, является выраженность его анемии. В настоящее время из неинвазивных тестов в качестве основного критерия оценки выраженности анемии используют показатели максимальной скорости кровотока в средней мозговой артерии (CMA) плода.
Так, из данных, приведенных на рисунке 3., видно, что только в 20% у беременных, родивших новорожденных без ГБН, показатели максимальной скорости кровотока СМА соответствовали зоне А по шкале Mari, при отечной форме данный показатель не встречался ни в одном случае. Показатели максимальной скорости СМА, соответствующие зоне В, только в 32,4% случаев встречались у новорожденных с легким течением и в 20,6% со среднетяжелым течением ГБН. Таким образом, в ходе нашего исследования выявлена прямая зависимость между пиком систолической скорости кровотока в CMA и степенью тяжести ГБ (Mandic V. et al. 2005; Mari G. et al. 2005; Lubusky M. et al. 2006). Несомненно, максимальная скорость кровотока в CMA плода, как предиктор степени выраженности анемии плода, является перспективным в отношении тяжести и прогноза ГБП и, возможно, в будущем позволит полностью заменить инвазивные методы диагностики, такие как амниоцентез, кордоцентез, осложнения, после которые составляют от 0,8 до 15,6% (Huber et al. 2006; F. Rahimi-Sharbaf et al. 2007).
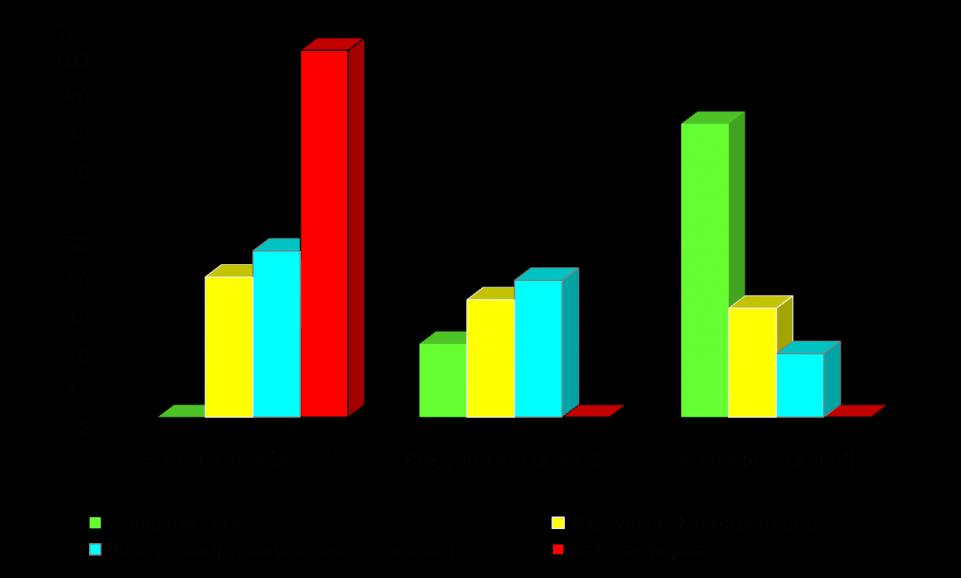
Рис.3. Зависимость тяжести анемии новорожденных от показателя максимальной скорости кровотока среднемозговой артерии (СМА) у обследоанных женщин (n=147)
Проведение кардиотокографии (КТГ) при ГБП позволяет оценить функциональное состояние плода и своевременно выявить его гипоксию. Так, в основной группе аритмия диагностирована у 8%, синусоидальный ритм ЧСС у 3,4%, брадикардия до 110 ударов в минуту у 8%. Наличие подобных изменений у плодов с отечной формой ГБ объясняется выраженными дистрофическими изменениями в миокарде, обусловленными кислородной недостаточностью. Согласно данным антенатальной КТГ до ПА в основной группе у 6,9 % выявлены начальные признаки внутриутробного страдания плода, показатель состояния плода (ПСП) в среднем составил 1,49± 0,46; в группе сравнения у 5,7%, ПСП в среднем составил 1,52 ±0,62. После проведения лечебного ПА уровень ПСП снизился и в среднем составил 0,75±0,13 (р<0,05). Данные результаты свидетельствуют о положительном влиянии лечебного ПА на кровоток, благодаря реокорригирующему и детоксикационному механизмам, в сочетании с гемодилюционным воздействием плазмозамещающих растворов.
Применяя неинвазивный метод диагностики, определение максимальной скорости кровотока CMA плода, нам удалось определить оптимальные сроки родоразрешения. Проведенное нами исследование показало, что в основной группе, где использовался лечебный ПА и Ig-терапия, процент срочных родов был достоверно выше и составил 55,6%, в группе сравнения 31,3%, благодаря этому процент досрочных родов был достоверно ниже и составил 44,4%, в группе сравнения 68,7% (p<0,05). У всех наблюдаемых, родивших здоровых детей, роды произошли через естественные родовые пути в 38-40 недель беременности. В группе женщин, у которых родились дети с легким течением желтушной формы ГБН, преждевременные роды были у 31% на сроках 32-37 недель беременности.
При анализе течения родов у наблюдаемых пациенток выявлено преобладание абдоминального родоразрешения. Первое месте в структуре показаний к абдоминальному родоразрешению заняли показания со стороны плода (внутриутробная гипоксия плода, ультразвуковые признаки ГБП, наличие крупного плода при сужении таза, высокие цифры максимальной скорости кровотока СМА, срок беременности больше 33-34 недель беременности). В основной группе у 69,8% пациенток беременность закончилась операцией кесарево сечение из них у 67,9% в плановом порядке, 25,3% в экстренном порядке. В группе сравнения 73,1% беременных родоразрешены абдоминальным путем, из них в плановом порядке родоразрешено 75% беременных, в экстренном 23,3%. Высокий процент экстренного родоразрешения в основной группе связан с тем, что данная терапия проводилась у беременных с выраженной степенью Rh-сенсибилизации и диагностикой тяжелой формы ГБП в 80% случаев и, следовательно, не исключена была вероятность их гибели при пролонгировании беременности. Данные представлены на рисунке 4.
Рис. 4. Исходы беременности у женщин с резус-сенсибилизацией
Разработанная схема диагностики и профилактики развития ГБП у беременных с Rh-сенсибилизацией позволила пролонгировать беременность до оптимального срока родоразрешения, который в среднем составил 38,1±0,2 недели и обойтись без такого инвазивного метода терапии во время беременности, как внутриутробное переливание отмытых эритроцитов.
С целью изучения состояния новорожденных нами было обследовано 147 детей, из них в основной группе 87 и в группе сравнения 60. В основной группе 72,4% детей родились доношенными и 27,5% недоношенными. В группе сравнения данный показатель составил 35% и 65% соответственно. Таким образом, в основной группе число доношенных детей родилось в 2 раза больше, чем в группе сравнения. Средняя масса доношенных новорожденных в основной группе составила 3010,2±117,6 гр., в группе сравнения 2725,1+116,7 гр. соответственно, причем в основной группе достоверно меньше детей родилось с массой тела 2500-2999 гр.. Новорожденных с массой от 2000-2499 гр. в основной группе родилось 16%, что достоверно меньше, чем в группе сравнения – 28,8%. По нашему мнению, это связано с тем, что, благодаря использованию лечебного ПА и Ig-терапии, нам удалось пролонгировать беременность до оптимального срока родоразрешения. Средняя масса тела недоношенных новорожденных в основной группе составляла 2301,4±90,2 гр., в группе сравнения 2145±91,2 гр. (р<0,05). Заслуживает внимание тот факт, что недоношенных детей с массой тела от 1000 до 2499 гр. в основной группе было достоверно меньше – 18,3%, по сравнению с группой сравнения – 25%. Недоношенные новорожденные родились в среднем на сроках 35,5±2,6 в основной группе и 34,6±3,3 в группе сравнения (р<0,05). Сроки гестации в основной группе новорожденных, родившихся у женщин, которым проводилась терапия с использованием лечебного ПА и Ig-терапия, были выше, чем и объясняются более высокие массоростовые показатели. Оценка новорожденных по шкале Апгар на 1 и 5 минутах после рождения составила в среднем в основной группе 8,1+0,1 балла, в группе сравнения 7,2+0,2 соответственно. Без асфиксии родился 70,1% ребенок в основной группе и 58,3% новорожденных в группе сравнения. В асфиксии легкой степени в основной группе родилось 29,8% детей и 25% в группе сравнения. Новорожденных, родившихся в асфиксии тяжелой и средней степени, в основной группе не было, тогда как в группе сравнения, данный процент составил 16,6%, что было обусловлено тяжестью ГБН и синдромом дыхательных расстройств (СДР) у недоношенных.
При анализе течения раннего неонатального периода у новорожденных исследуемых групп, в основной группе выявлен достоверно более высокий процент анемичной и легкой формы ГБН в основной группе. По нашему мнению, это связано с тем, что беременным основной группы проводилась комплексная терапия с использованием лечебного ПА и Ig-терапия. Клинический анализ показал, что у 35,6% новорожденного основной группы была диагностирована легкая степень ГБН, у 25,2% среднетяжелая, требующая лечения в раннем неонатальном периоде, и в 39% случаев у плода диагностирована тяжелая анемия, требующая инвазивных методов терапии с использованием ЗПК. Отечная форма ГБН выявлена только в группе сравнения у 8,3% новорожденных. При легком течении анемической и желтушной формы ГБ новорожденным основной группы проводили короткий курс фототерапии (32,7±11,4).
У новорожденных при непрямой гипербилирубинемии, обусловленной ГБН и резистентной к фототерапии, с положительными пробами Кумбса, Розенфельда, отсутствием клинических признаков в первые 10 часов жизни для предупреждения возникновения клинических признаков и прогрессирования заболевания проводили внутривенную Ig-терапию в дозе 800 мг/кг, кратность введения была различной и определялась почасовым приростом концентрации билирубина. Раннее введение иммуноглобулинов при среднетяжелом течении ГБН предотвращает дальнейший гемолиз эритроцитов, что снижает прогрессирование ГБН (Антонов А.Г., Им В.Л., 2005).
Продолжительность фототерапии у новорожденных основной группы была достоверно (p<0,004) короче в 1,4 раза (67,2±22,2 часа) по сравнению с новорожденными группы сравнения (95,5±18,5). Операции гемотрансфузии подверглись 31% детей основной группы со средне-тяжелым и тяжелым течением желтушной формы ГБН, из них: 9,2% новорожденным ЗПК осуществлялось дважды, 2,3% – трижды, остальным 17,2% новорожденным проведено только одно ЗПК. Всего в основной группе проведено 41 ЗПК. Тогда как в группе сравнения у 36,6% новорожденных со среднетяжелым и тяжелым течением ГБН было проведено 34 ЗПК: одна процедура осуществлена у 20%, дважды ЗПК – 13,3% новорожденным, трижды – 3,3%. В основной группе 58,7% новорожденных, перенесших среднетяжелое и тяжелое течение желтушной формы ГБ, были выписаны домой на 9-12 сутки в удовлетворительном состоянии. Показатели Hb при выписке, в среднем, составляли 145,4±5,4 г/л. На второй этап выхаживания переведен 40,3% ребенок. У 8,3% новорожденных из группы сравнения диагностирована отечная форма ГБ. По данным нейросонографии, внутрижелудочковые кровоизлияния (ВЖК) II-IV степени были обнаружены у 40% новорожденных с отечной формой ГБ из группы сравнения. У детей, родившихся на 31-32 недели беременности, ВЖК выявлено не было. Следовательно, важным является расширение показаний к кесареву сечению при тяжелых формах ГБП и пролонгация беременности по возможности до 33-34 недель с целью предупреждения различных неврологических нарушений связанных с длительным воздействием патологических факторов на ЦНС. В основной группе умерших новорожденных не было, в группе сравнения было двое. В обоих случаях состояние новорожденных оценивалось как крайне тяжелое вследствие отечной формы ГБ, кроме того, один из них – был глубоко недоношенным (28 недель гестации). После проведения комплексной терапии и купирования признаков ГБН 51,7% новорожденных были выписаны домой, 48,2% в связи с недоношенностью переведены на второй этап выхаживания.
В проведенном исследовании выявлена зависимость степени тяжести ГБН от уровня титра Rh-антител и срока их появления во время беременности. Так, среднетяжелая ГБН в 64,4% и отечная формы ГБН в 100% диагностированы у беременных, титры Rh-антител у которых появлялись до 20 недель. Из чего можно сделать вывод, что необходимо раннее начало проведения терапии в случае появления титра Rh-антител выше 1:32 до 20 недель беременности.
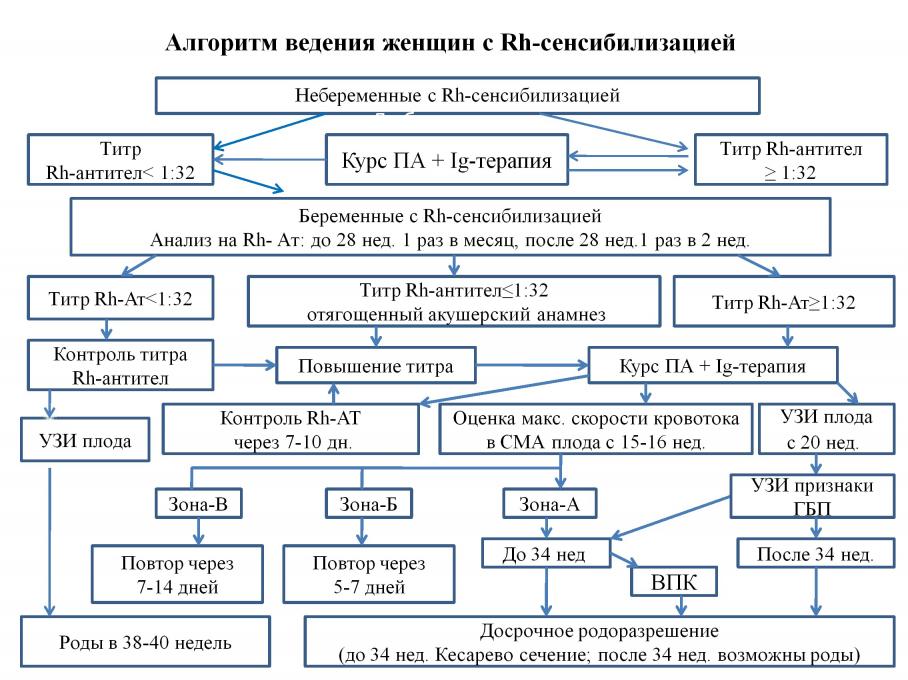
Обобщая полученные данные, можно сделать вывод о том, что применение комплексного лечения с использованием курса лечебного ПА с последующей Ig-терапией существенно снижает титры Rh-антител, тем самым, предупреждая развитие тяжелых форм ГБП и ГБН, позволяет довести беременность до срока родов с благоприятными исходами для матери и новорожденного. Вышеизложенные результаты обследования 147 женщин позволили разработать алгоритм обследования женщин с резус-сенсибилизацией, на основании которого можно точно поставить диагноз ГБП и определить тактику ведения пациентки (приложение 1).
ВЫВОДЫ
- Причинами развития гемолитической болезни плода и новорожденного является резус-сенсибилизация у женщин, развивающаяся у 2,9% после переливания в анамнезе несовместимой по резус-принадлежности крови и у 97,1% в результате отсутствия профилактики антирезусным иммуноглобулином. Факторами риска, предрасполагающими к активации выработки антител и утяжеляющими течение резус-сенсибилизации, у 45,9% беременных женщин являются обострение герпес - и цитомегаловирусной инфекции, в 28,7% развитие плацентарной недостаточности.
- Определение субклассов IgG1 и IgG3, с целью оценки степени риска гемолиза эритроцитов, позволяет прогнозировать вероятность развития и степень тяжести гемолитической болезни плода. Высокая степень риска гемолиза эритроцитов определялась у 62% беременных, средняя степень у 19,5% женщин и низкая у 18,4%.
- Усиление максимальной скорости кровотока среднемозговой артерии при допплерометрии является предиктором степени тяжести анемии плода и прогностическим фактором в отношении тяжести гемолитической болезни плода, позволяя определить дальнейшую тактику ведения беременности и сроки родоразрешения.
- У женщин с высокими титрами резус-антител и отягощенным акушерским анамнезом проведение лечебного плазмафереза и иммуноглобулинотерапии в качестве предгравидарной подготовки позволило предотвратить развитие тяжелой гемолитической болезни плода и улучшить перинатальные исходы у 80% пациенток.
- Резус-сенсибилизация у 18,4% обследованных женщин сопровождается изменениями в системе гемостаза, выражающимися в развитии гиперкоагуляции, протекающей на фоне активации внутрисосудистого свертывания крови. Лечебный плазмаферез с последующей иммуноглобулинотерапией способствует уменьшению процессов внутрисосудистого свертывания, нормализации коагуляционного потенциала крови за счет снижения уровня фибриногена на 23,5% и содержания РКМФ.
- У беременных с резус-сенсибилизацией при проведении лечебного плазмафереза не происходит достоверных изменений основных параметров биохимического статуса (общий белок, глюкоза, билирубин прямой и общий, креатинин, мочевина) и показателей гемограммы, что свидетельствует о безопасности данного метода лечения.
- Лечебный плазмаферез является патогенетически обоснованным методом лечения резус-сенсибилизации, приводя к достоверному снижению титра резус-антител (р<0,01), а последующая иммуноглобулинотерапия позволяет снизить вероятность развития ребаунд-эффекта, предотвращая, тем самым, развитие гемолитической болезни плода и позволяет пролонгировать беременность в среднем на 4,5±0,1 недель, снижает частоту преждевременных родов с 69 до 44%.
- Разработанный алгоритм ведения женщин с резус-сенсибилизацией с включением в комплексную терапию лечебного плазмафереза с последующей иммуноглобулинотерапией позволяет пролонгировать беременность до оптимального срока родоразрешения у 59% беременных, снизить частоту рождения детей с тяжелой формой гемолитической болезни в 2,4 раза, в 2 раза уменьшить частоту заменного переливания отмытых эритроцитов и в 1,5 раза количество сеансов фототерапии у новорожденных.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для диагностики резус-сенсибилизации у женщин необходимо проведение скрининга резус-антител, определение титра субклассов IgG1 и IgG3 в крови. При наличии резус-сенсибилизации контроль титра резус-антител целесообразно проводить каждые 4 недели до 24 недель беременности, после 24 недель каждые 2 недели.
- У женщин с титром резус-антител более 1:32 с отягощенным акушерским анамнезом (гибель плода и новорожденного от гемолитической болезни, тяжелые формы гемолитической болезни новорожденного) целесообразно проводить предгравидарную подготовку с использованием лечебного плазмафереза в количестве 3-5 процедур на курс в зависимости от тира резус-антител и последующей иммуноглобулинотерапией.
- С целью диагностики гемолитической болезни плода необходимо проводить ультразвуковое обследование плода. С 15-16 недель беременности проводить контроль максимальной скорости кровотока среднемозговой артерии при допплерометрии. С 33-34 недели беременности, с целью определения состояния плода и метода родоразрешения, используется кардиотокография.
- В случае выявления титра резус-антител ниже критического уровня (1:32) и определении низкой степени риска гемолиза эритроцитов, в качестве лечебно-профилактических мероприятий проводится только иммуноглобулинотерапия в дозе 2,5 г. №3 или 5,0 г. №2 внутривенно капельно с интервалом 2-3 дня.
- Показаниями для проведения лечебного плазмафереза с последующей иммуноглобулинотерапией у беременных с резус-сенсибилизацией являются: титр резус-антител выше критического уровня (1:32), средняя и высокая степень риска гемолиза эритроцитов, отсутствие ультразвуковых признаков гемолитической болезни плода, максимальная скорость кровотока среднемозговой артерии ниже зоны А по шкале Marri, ПСП плода по кардиотографии ниже 1, обострении вирусной инфекции и развитие плацентарной недостаточности, наличие синдрома диссеминированного внутрисосудистого свертывания крови по данным гемостазиограммы.
- Противопоказаниями для проведения лечебного плазмафереза являются со стороны матери: наличие гипокоагуляции, тяжелая анемия, тяжелая экстрагенитальная патология, гипопротеинемия, со стороны плода: тяжелая анемия по данным максимальной скорости кровотока среднемозговой артерии и ультразвуковые признаки гемолитической болезни плода.
- Количество сеансов плазмафереза должно быть не менее трех, с интервалом в 2-4 суток. Объем плазмоэксфузии должен составлять за один сеанс не менее 25 % объема циркулирующей плазмы. Плазмозамещение проводится растворами гидроксиэтилированного крахмала, кристаллоидами, по показаниям раствором альбумина (при снижении уровня альбумина ниже 30 г/л) в соотношении к плазмоэксфузии 2:1. Курс лечения можно повторить через две недели в случае развития «синдрома рикошета» (rebaund effect). Контроль за эффективностью проводимой терапии осуществлять по уровню снижения титра резус-антител, отсутствия появления признаков гемолитической болезни плода по данным УЗИ и допплерометрии.
- После проведения комплексного лечения с использованием плазмафереза и иммуноглобулинотерапии, через 7-10 дней необходимо проводить контроль титра резус-антител, ультразвуковое обследование, определение максимальной скорости кровотока среднемозговой артерии по допплерометрии, кардиомониторный контроль, с целью оценки состояния плода и решения вопроса о необходимости проведения повторного курса.
- В случае отсутствия эффективности от проводимой терапии: определения тяжелой анемии плода по данным максимальной скорости кровотока среднемозговой артерии и появления ультразвуковых признаков гемолитической болезни плода на сроках менее 33-34 недель беременности необходимо своевременно решить вопрос о проведении внутриутробного переливания отмытых эритроцитов, при сроке 33-34 недель беременности показано досрочное родоразрешение.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
1. Митря И.В. Плазмаферез в профилактике и лечении гемолитической болезни плода и новорожденного / И.В. Митря, Т.А.Федорова, Т.С. Фотеева, Е.В. Стрельникова // Труды XII конференции московского общества гемафереза, 25-26 мая.- 2004.- С.70.
2. Митря И.В. Возможности применения методов гемафереза в профилактике и лечении гемолитической болезни плода и новорожденного / И.В. Митря, Т.А. Федорова, Т.С. Фотеева, О.В. Рогачевский, Э.М. Бакуридзе // Материалы 36-го ежегодного Конгресса Международного общества по изучению патофизиологии беременности организации гестоза.-М.-2004.- С.258.
3. Митря И.В., Федорова Т.А., Аппалуп М.В. Динамика титра Rh-антител у беременных женщин с резус-сенсибилизацией под влиянием плазмафереза // Труды тринадцатой конференции Московского общества гемафереза.-М.-2005.- С.27-28.
4. Федорова Т.А., Митря И.В., Донсков С.И. Оптимизация методов диагностики, профилактики и лечения резус-сенсибилизации // «Новые медицинские технологии в акушерстве, гинекологии и перинатологии» Материалы конференции.- М.- 2005.-С.69-73.
5. Митря И.В., Рогачевский О.В. Эффективность плазмафереза в комплексном лечении женщин с резус-сенсибилизацией // Международного Конгресса «Практическая гинекология: от новых возможностей к новой стратегии».- М.- 2006.- С.120.
6. Митря И.В., Федорова Т.А., Рогачевский О.В. Оптимизация методов диагностики, профилактики и лечения резус-сенсибилизации // Вестник службы крови России.- М.- 2006.- № 1.- С. 7-10.
7. Митря И.В., Федорова Т.А. Резус-сенсибилизация: оптимизация методов диагностики, профилактики и лечения // Материалы XIV конференции московского общества гемафереза «Трансфузионная и дезинтоксикационная терапия при неотложных состояниях».- М.- 2006.- С.24-25.
8. Митря И.В., Федорова Т.А., Рогачевский О.В. Резус-сенсибилизация: оптимизация методов диагностики, профилактики и лечения // Материалы IV Всероссийской междисциплинарной научно-практической конференции, посвященной памяти выдающегося акушера-гинеколога Кёртиса Лестера Мендельсона (1913-2002). Санкт-Петербург.- 2006.- С. 473-480.
9. Митря И.В., Федорова Т.А. Резус-сенсибилизация: оптимизация методов диагностики, профилактики и лечения // Проблемы репродукции (специальный выпуск).-Материалы первого Международного конгресса по репродуктивной медицине. - М.-2006.- С. 213-214.
10. Митря И.В., Федорова Т.А., Донсков С.И. Экстракорпоральные методы лечения резус-сенсибилизации // Актуальные вопросы экстракорпоральной терапии: /материалы научно-практической конференции.- М.- 2007.- С.79-80.
11. Федорова Т.А., Рогачевский О.В., Фотеева Т.С., Бакуридзе Э.М., Очан А.С., Стрельникова Е.В., Аппалуп М.В., Митря И.В. Современные технологии в акушерстве и гинекологии // Здравоохранение и медицинские технологии.-2008.-№2.- С.40-41.
12. Митря И.В., Федорова Т.А. Современный метод комплексного лечения резус-сенсибилизации // Методы гемафереза и квантовая терапия в клинической медицине: материалы 16-ой научно-практической конференции общества гемафереза.- М.- 2008.- С.54.
13. Митря И.В., Федорова Т.А. Комплексное лечение резус-сенсибилизации // Вестник новых медицинских технологий.- 2008.- Т. XV, №4.- С.226-227.
14. Митря И.В., Федорова Т.А., Умбрумянц Д.В. Эфферентные методы в терапии Rh-сенсибилизации // Сб. тез. Всерос. междисцип. научно-практической конференции «Амбулаторно-поликлиническая практика-платформа женского здоровья».- М.- 2009.- С.280.
15. Митря И.В., Федорова Т.А. Плазмаферез и иммуноглобулинотерапия в комплексном лечении резус-сенсибилизации Материалы II Всероссийского конгресса» Анестезия и реанимация в акушерстве и неонатологии».- М.- 2009 г.- С.176-179.
16. Митря И.В., Федорова Т.А., Рогачевский О.В. Плазмаферез и иммуноглобулинотерапия в комплексном лечении резус-сенсибилизации // Акушерство и гинекология.- 2010.- №1.- С.38-42.
СПИСОК СОКРАЩЕНИЙ:
| АЛТ | – аланинаминотрансфераза |
| АСТ | – аспартатаминотрансфераза |
| АТ | – антитела |
| ВЖК | – внутрижелудочковое кровоизлияние |
| ВПК | – внутриутробное переливание крови плоду |
| ГБН | – гемолитическая болезнь новорожденных |
| ГБП | – гемолитическая болезнь плода |
| ГЭК | – гидроксиэтилированный крахмал |
| ДВС | – диссеминированное внутрисосудистое свертывание |
| ЗПК | – заменное переливание крови новорожденному |
| ИВЛ | – искусственная вентиляция легких |
| ИТП | –индекс тромбоэластического потенциала |
| КТГ | – кардиотокограмма |
| МПК | – маточно-плацентарный кровоток |
| ОПБ | – оптическая плотность билирубина |
| ОЦК | – объем циркулирующей крови |
| ОЦП | – объем циркулирующей плазмы |
| ПА | – плазмаферез |
| ПДФ | – продукты деградации фибрина и фибриногена |
| ПСП | – показатель состояния плода |
| ПЦР | – полимеразная цепная реакция |
| РКМФ | – растворимые комплексы мономеров фибрина |
| СДР | – синдром дыхательных расстройств |
| УЗИ | – ультразвуковое исследование |
| ФПК | – фетоплацентарный кровоток |
| ЧСС | – частота сердечных сокращений |
| CMA | – среднемозговая артерия |
| Ig | – иммуноглобулин |
| IgG | – иммуноглобулины подкласса G |
| Hb | – гемоглобин |
| Ht | – гематокрит |
| Rh | – резус |