Клинико-морфологические особенности сепсиса в родах и послеродовом периоде
На правах рукописи
МИХАНОШИНА Нина Алексеевна
КЛИНИКО-МОРФОЛОГИЧЕСКИЕ
ОСОБЕННОСТИ СЕПСИСА В РОДАХ И
ПОСЛЕРОДОВОМ ПЕРИОДЕ
14.00.15 – патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва
2009
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательском институте морфологии человека РАМН и ГУЗ Ростовской области " Патологоанатомическое бюро»
Научный руководитель:
Заслуженный деятель науки РФ, доктор медицинских наук, профессор
Милованов Андрей Петрович
Официальные оппоненты:
доктор медицинских наук, профессор Пархоменко Юрий Георгиевич
доктор медицинских наук, профессор Титова Галина Павловна
Ведущее учреждение: ГОУ ВПО «Московский государственный медико-стоматологический университет» Росздрава.
Защита диссертации состоится «_____» _______________ 2009г. в ____ часов на заседании диссертационного совета Д 001.004.01. УРАМН Научно-исследовательском институте морфологии человека РАМН по адресу: 117418, Москва, ул. Цюрупы, д.3.
С диссертацией можно ознакомиться в библиотеке института.
Автореферат разослан «___» ________________ 2009г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук Л.П. Михайлова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Среди основных причин материнской смертности (МС) в Российской Федерации за 1992-1997 годы гнойно-септические заболевания составили от 28,0% до 32,0%, но большинство из них приходилось на посткриминальный абортный сепсис, в то время как септические состояния в послеродовом периоде регистрировались реже, с колебаниями их частоты в отдельных регионах (Кулаков В.И. и соавт., 1998). Так, в Санкт-Петербурге за 1988-2003 годы послеродовый сепсис составил от 10,0% до 17,5% в структуре материнской смертности (Репина М.А., 2005), а в Москве в эти же годы – всего 3,3% (Милованов А.П., 2008).
В ныне действующей Международной статистической классификации болезней 10-го пересмотра (МКБ-10) фигурируют три пуэрперильных формы сепсиса: септицемия в родах (код О75.3), послеродовый сепсис (О85) и инфекция хирургической акушерской раны или акушерский перитонит (О86.0). Однако отечественные акушеры редко дифференцируют первые две нозологические формы. Сепсис (септицемию) в родах фиксируют в заключительном клиническом диагнозе как синдром амниотической инфекции, эндометрит в родах или обозначают общим термином – послеродовый сепсис. Такая же практика существует в отношении основного диагноза в патологоанатомических заключениях. Вместе с тем, по началу этих заболеваний и клиническим особенностям сепсис в родах и в послеродовом периоде существенно отличаются друг от друга (Серов В.Н. и соавт., 1997).
Интерес к дифференциальной диагностике данных форм акушерского сепсиса определяется идущей в настоящее время дискуссией о введении новых клинических критериев сепсиса как системной воспалительной реакции (англ. SIRS) на инвазию микроорганизмов, где на первый план выходят цитокиновый каскад и повреждающее действие экзо- и эндотоксинов. Они объясняют тяжелый и часто необратимый характер генерализации инфекции, то есть переход SIRS в тяжелую стадию сепсиса или септический шок (Савельев В.С., Гельфандт Б.Р., 2006).
Кроме того, среди патологоанатомов развернулась полемика о правомочности термина «септицемия», о наличии или отсутствии гнойных очагов, морфологических эквивалентах SIRS и, наконец, как формулировать основной патологоанатомический диагноз в связи с новыми представлениями о сепсисе (Пархоменко Ю.Г., 2005; Пауков В.С., 2007; Гринберг Л.М, Руднов В.А., 2007; Савельев В.С. и соавт., 2007). Все эти вопросы актуальны и в оценке акушерского сепсиса.
Для «стыковки» этапов SIRS, в частности цитокинового каскада, с патоморфологической картиной акушерского сепсиса необходим современный иммуногистохимический анализ состава клеток-продуцентов цитокинов в местах внедрения инфекции, регионарных лимфатических узлах и селезенке. Особый интерес представляет выявление в гистологических срезах клеток, синтезирующих фактор некроза опухоли (TNF-), как провоспалительного цитокина, запускающего механизмы генерализации инфекции (Пауков В.С., 2007).
Отмеченные выше проблемы послужили основанием для выбора цели и задач данного диссертационного исследования.
Цель работы - выявить клинико-морфологические и иммуногистохимические критерии диагностики акушерского сепсиса, развивающегося в родах и послеродовом периоде.
Задачи исследования:
1. Определить удельный процент сепсиса в структуре материнской смертности в Ростовской области за 10 лет (1997-2006 г.).
2. Выявить клинико-микробиологические различия данных форм акушерского сепсиса.
3. Установить патоморфологические особенности входных ворот септического процесса.
4. Изучить патоморфологические особенности селезенки и висцеральных лимфатических узлов, в том числе малого таза.
5. Провести иммуногистохимический анализ клеточного состава воспалительных инфильтратов, в том числе клеток, синтезирующих TNF-.
Научная новизна работы:
Впервые проведена клинико-морфологическая, микробиологическая и иммуногистохимическая оценка пуэрперильного сепсиса с выделением двух основных его нозологических форм – сепсиса в родах с антенатальным воспалительным поражением плодных оболочек, плаценты и послеродового сепсиса с первичным очагом в эндо- и миометрии матки.
Иммуногистохимическая визуализация воспалительных клеток в области входных ворот (в последе) при сепсисе в родах показала преобладание гранулоцитов, макрофагов и плазматических клеток; при послеродовом сепсисе в матке доминировали децидуальные макрофаги, плазматические клетки и в меньшей степени – гранулоциты и Т-лимфоциты. При обеих формах сепсиса в части макрофагов во входных воротах выявлена иммуноэкспрессия TNF-.
Впервые динамика патоморфологических изменений в области входных ворот, селезенки, висцеральных лимфатических узлов и внутренних органов при сепсисе в родах и послеродовом периоде сопоставлены с этапами SIRS; в частности, на 3-ем ее этапе при обеих формах диагностированы тяжелый сепсис с инфекционно-токсическим шоком, ДВС-синдромом и полиорганной недостаточностью.
Практическая значимость
Выделение у родильниц двух самостоятельных форм сепсиса с разными входными воротами и темпами развития воспалительного процесса позволит с одной стороны, усовершенствовать раннюю клиническую их диагностику и предупредить развитие генерализованных форм, с другой - сблизить оценки акушеров и патологоанатомов при формулировке заключительного клинического и патологоанатомического диагнозов.
Внедрение в практику
Результаты данной работы и основные рекомендации используются в практической деятельности ГУЗ Ростовской области «Патологоанатомическом бюро», а также основные положения диссертации включены в лекции и семинарские занятия слушателей курсов повышения квалификации, клинических ординаторов кафедры акушерства и гинекологии №3 ФПК ГОУ ВПО Ростовского государственного медицинского университета Федерального агентства по здравоохранению и социальному развитию.
Апробация работы
Результаты исследования доложены и обсуждены на II Съезде Российского общества патологоанатомов (Москва, 2006); конгрессе Европейской ассоциации патологов (Стамбул, 2007); конференции по актуальным проблемам акушерства, гинекологии и перинатологии (Ростов-на-Дону, 2007); научно-практической конференции по инфекционной патологии (Москва, 2007); конгрессе патологов (Барселона, 2008); межлабораторной конференции в ГУ НИИ морфологии человека РАМН (Москва, ноябрь 2008);
Публикации
По материалам данного исследования опубликовано 6 работ, в том числе одна статья в журнале, рекомендованном ВАК РФ.
Структура и объем диссертации
Диссертация изложена на 128 страницах текста и состоит из введения, обзора литературы, 3 глав собственных исследований, заключения, выводов и практических рекомендаций. Список литературы включает 67 работ, из них 43 источника отечественных авторов и 28 зарубежных. Диссертация иллюстрирована 14 таблицами и 36 рисунками.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Настоящая работа выполнена за период с 1997 по 2006 гг. на базе УРАМН Научно-исследовательского института морфологии человека (директор – профессор, член-корреспондент РАМН Л.В.Кактурский) и ГУЗ Ростовской области «Патологоанатомическое бюро» (главный врач – к.м.н. Г.Л.Резникова). За эти годы среди 110 аутопсий беременных женщин отобраны 24 родильницы, умершие от сепсиса, из них 15 случаев - от сепсиса, развившегося в родах и 9 - в послеродовом периоде. Все эти случаи исследованы одновременно с последами. Из истории родов выписаны клинические данные: акушерский анамнез, температурная реакция, уровень артериального давления, и др. Кроме того, оценивали длительность течения заболевания, состояние рожденных детей (живорожденные или мертворожденные). Во время вскрытия осуществлялся забор органов для гистологического исследования (матка, легкие, почки, печень, селезенка, лимфатические узлы, головной мозг). Для бактериологического исследования в асептических условиях производили взятие крови из полостей сердца. Особое внимание уделялось изучению матки, селезенки и лимфатических узлов (паратрахеальных, бифуркационных, в области ворот печени, малого таза), а также последа. В протоколах вскрытий проанализированы заключительный клинический и патологоанатомический диагнозы.
Для гистологического исследования материал фиксировали в 10% нейтральном забуференном фосфатным буфером формалине. Серийные срезы толщиной 3 мкм изготавливались на микротоме (MR 2055, Leiсa, Германия). Полученные срезы окрашивали гематоксилином и эозином, проводили ШИК- реакцию с использованием реагентов Sigma Diagnostic Periodic Acid-Schiff (PAS); соединительную ткань выявляли методом окраски по Массону, используя набор реагентов Sigma Diagnostic Trichrom Stains (Masson).
Для иммуногистохимического метода использовались срезы из парафиновых блоков толщиной 3 мкм. Иммунореактивность первичных антител фирмы Dako обнаруживалась с помощью вторичных антител, конъюгированных с пероксидазной системой, составляющих набор реактивов En Vision TM + System, и систему визуализации фирмы Dako.
Для выявления гранулоцитов использовались поликлональные антитела Myeloperoxidase, макрофагов – моноклональное антитело CD68 (клон KP1), плазматических клеток – моноклональное антитело Plasma cell (клон VS38c), Тлимфоцитов – моноклональное антитело CD45RO (клон OPD4), Влимфоцитов – моноклональное антитело CD20 (клон L26) производства фирмы Dako. Для выявления фактора некроза опухоли (TNF-) взяты первичные антитела клона E8-G6 производства фирмы Santa Cruz (США). Срезы докрашивали гематоксилином Майера. Все буферные растворы, используемые в работе, готовили на деионизированной воде.
При интерпретации результатов распределения продуктов иммуногистохимической реакции учитывали локализацию и интенсивность окрашивания, которую оценивали полуколичественным методом по следующим критериям: () реакция отсутствует, (+ или 1 балл) слабая реакция в 2-5 клетках при увеличении х200, (++, 2 балла) умеренная реакция в 5-10 клетках, (+++, 3 балла) выраженная реакция в более 10 клетках (Dabbs D., 2006).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Пуэрперильный сепсис – серьезная проблема отечественного акушерства. По нашим данным, в Ростовской области за последние 10 последних лет зарегистрировано 24 случая смерти родильниц от послеродового сепсиса, что составило 16,2% от общей МС, то есть этот показатель был меньше, чем общероссийский (в среднем 20-25%). Соответственно, показатель материнской смертности (ПМС) от послеродового сепсиса, рассчитанный на 100000 живорожденных детей, в среднем за 10 последних лет в Ростовской области составил 10,15 с ежегодными колебаниями от 4,8 до 19,4.
В результате изучения анамнеза и клинических данных 15 случаев женщин, умерших от сепсиса в родах, были выявлены следующие особенности: преобладали женщины в возрасте 30-40 лет – 6 случаев (40,0%), в анамнезе – 3 беременности – 10 (66,6%), 3-и роды – 7 (46,6%). В 9 случаях (60,0%) отмечался преждевременный разрыв плодных оболочек с длительностью безводного периода в среднем 25-35 часов. Самостоятельные роды были в 11 случаях (73,3%), в 5 (33,3%) - наблюдалась первичная слабость родовой деятельности. В 6 случаях (40,0%) отмечалось плотное прикрепление плаценты, что потребовало ее ручного отделения и последующего кюретажа полости матки. Мертворождения встретились в 8 случаях (53,3%), в 50% из них диагностирована асфиксия с выраженной мацерацией кожных покровов. Начало и продолжительность заболевания представлены на рис. 1.
Клиника характеризовалась следующими симптомами - в 8 случаях (53,5%) был подъем температуры (от 37,6°С до 39,5°С). В 10 случаях (66,6%) отмечена гипотония (55/10-80/50 мм рт. ст.), гипертензия (20,0%) и нормальное артериальное давление (13,4%).
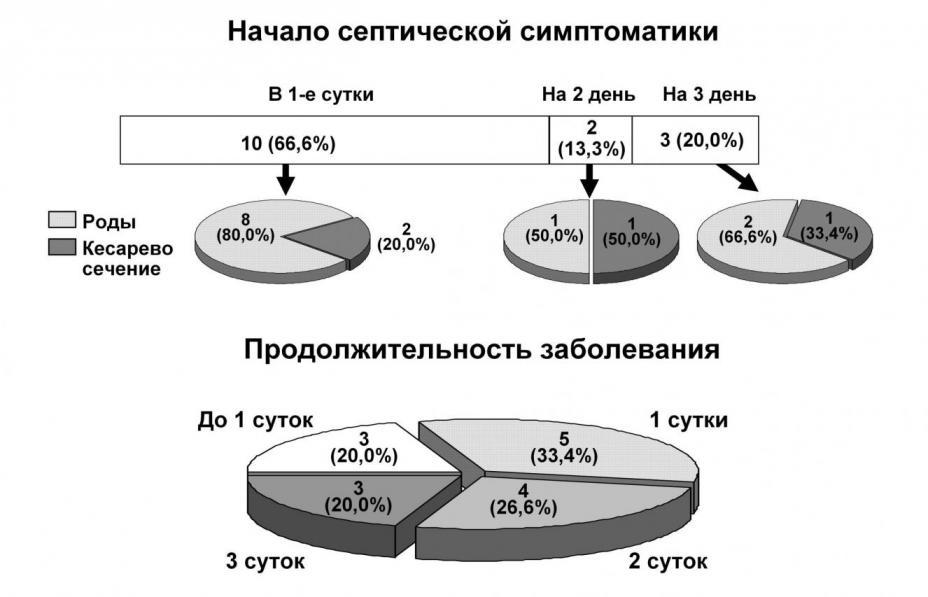
Рис. 1. Сроки начала и развития сепсиса в родах
Проведенная оценка заключительного клинического диагноза установила, что в большинстве случаев не был поставлен диагноз «сепсис в родах», в 10 случаях (67,0%) фигурировал диагноз «септический метроэндометрит», «послеродовый сепсис»; а в 5 случаях (33,0%), гнойно-септические заболевания вообще не упоминались.
При аутопсийном исследовании в посевах крови из полости сердца в 15 случаях была подтверждена септицемия: в 11 случаях (73,3%) - кишечная палочка, в 11 (73,3%) - энтеробактерии, в 9 (60,0%) неклостридиальные анаэробы, в 4 (26,6%) - стрептококки; следует отметить 100% встречаемость ассоциированной микробной флоры.
При патоморфологическом изучении всех компонентов репродуктивной системы мать – плацента – плод, а именно, матки и последа были выявлены разнообразные изменения. В 13 случаях (86,6%) матка была обычных размеров, эндометрий - бурый, рыхлый с диффузно-очаговыми кровоизлияниями. С учетом послеродовой инволюции матки обнаруженная поверхностная воспалительная инфильтрация базального слоя расценена как «физиологический воспалительный валик». В 9 случаях (60,0%) в эндометрии и миометрии отмечалась очаговая, слабо выраженная, инфильтрация гранулоцитами (1,20±0,10 балла), Тлимфоцитами (1,20±0,10), макрофагами (1,13±0,09). В воспалительном инфильтрате отсутствовали плазматические клетки, В-лимфоциты и фактор некроза опухоли (TNF-).
Напротив, в плодных оболочках во всех случаях было отмечено обострение хронического мембранита в виде васкулитов, очагов склероза децидуальной оболочки (при окраске по Массону), разнокалиберных кальцификатов и неравномерной толщины компактного слоя. При иммуногистохимическом исследовании воспалительный инфильтрат был представлен большим количеством гранулоцитов (2,86±0,09 балла), макрофагов (2,86±0,09), плазматических клеток (1,93±0,12), единичными Т-лимфоцитами (1,06±0,06). В макрофагах отмечалась положительная реакция на TNF- (1,86±0,09). В-лимфоциты в воспалительном инфильтрате отсутствовали. В межворсинчатом пространстве плаценты в инфильтрате преобладали гранулоциты, макрофаги, единичные Влимфоциты, а в децидуальной пластинке наблюдалась очаговая инфильтрация гранулоцитами, макрофагами, Тлимфоцитами.
При аутопсийном исследовании селезенка в 10 случаях (66,6%) имела нормальную массу и на разрезе отмечен умеренно-выраженный соскоб пульпы, а также неравномерное полнокровие, стирание рисунка, опустошение белой пульпы с уменьшением диаметров светлых центров лимфоидных фолликулов. Выявлен дефицит В-лимфоцитов (1,13±0,09 балла) в маргинальной зоне фолликулов с преобладанием здесь гранулоцитов (2,73±0,12) и макрофагов (2,80±0,10). Т лимфоциты (1,13±0,09) и В-лимфоциты (1,13±0,08) сохранялись лишь вокруг артериол. Иммуногистохимическое исследование селезенки не выявило клеток с позитивной реакцией к TNF-.
Висцеральные лимфатические узлы увеличены в размерах (2х1,5х1 см), на разрезе однородные, серовато-розового цвета. Микроскопически отмечалось неравномерное полнокровие, нарушение структуры. Во всех случаях обнаружены лимфоидные фолликулы с редуцированным скоплением В-лимфоцитов (1,13±0,09 балла), а в парафолликулярной зоне - уменьшение Тлимфоцитов (1,13±0,09). При иммуногистохимическом исследовании висцеральных лимфатических узлов выявлены макрофаги (2,93±0,06) и гранулоциты (2,80±0,10) с некоторой концентрацией их в паракортикальной зоне при отсутствии плазматических клеток и клеток, иммунопозитивных к TNF-.
Таким образом, по нашим данным, которые в целом соответствовали уже известным фактам в акушерстве, сепсису в родах или «синдрому амниотической инфекции» предшествовал преждевременный разрыв плодных оболочек и длительный безводный период, способствующий восходящему антенатальному инфицированию родовых путей (Серов В.Н. и соавт., 1997).
Закономерно возникает вопрос, в какой степени внутриутробное инфицирование организма беременной женщины соотносится с этапами системной воспалительной реакции (SIRS). Если сопоставить явные патоморфологические признаки хориоамнионита и интервиллузита, то они соответствуют 1-му этапу системной воспалительной реакции, а именно, локальной агрессии микроорганизмов с восходящим или гематогенным проникновением их в послед. Картина обострения хориоамнионита обусловлена наличием, в основном, гранулоцитов, макрофагов и, в меньшей степени, плазматических клеток. Дополнительным показателем хронического, то есть длительного, существовавшего еще в антенатальном периоде, воспалительного процесса в плодных оболочках, является большой процент мертворожденных (53,3%), порой с выраженной мацерацией кожных покровов. Этому соответствуют данные R.Romero et al. (2007), который показал, что восходящее инфицирование плода происходит достаточно часто, примерно в 10% всех беременностей, когда после возникновения интраамниальной инфекции фиксируется избыток провоспалительных цитокинов (TNF-, IL-1). Следовательно, обнаружение антенатально возникших хориоамнионита, децидуита и плацентита у всех родильниц, погибших от сепсиса в родах, доказывает, что именно вышеуказанные компоненты последа являются входными воротами для инфекционного поражения организма матери. Новым, подтверждающим это важное положение, фактом является иммуногистохимическая визуализация клеток-макрофагов, продуцирующих TNF-, среди воспалительного инфильтрата плодных оболочек, в то время как во всех других исследованных органах он отсутствовал. Это обстоятельство позволяет высказать гипотезу о том, что выявление макрофагов, продуцирующих TNF-, можно считать клеточным маркером входных ворот или первичного очага септического процесса.
При дальнейшем развитии воспалительного процесса в репродуктивной системе «мать-плацента-плод» 1-й этап SIRS последовательно переходит во 2ой, когда воспалительный процесс выходит за пределы первичного очага (послед) и, с учетом большой площади плодовместилища в конце беременности, возникают условия для продукции макрофагами такого количества TNF-, которое способно проникать в материнскую циркуляцию крови наряду с инвазией туда микроорганизмов из первичного очага. Об этом свидетельствует микробный пейзаж в крови из полостей сердца, где доминировали кишечная палочка, энтеробактерии, неклостридиальные анаэробы и, в меньшей степени, стрептококки, то есть преобладали грамотрицательные микроорганизмы. Следовательно, возникала развернутая клиника сепсиса в родах, которая уже соответствовала 3-му этапу SIRS.
Существенным механизмом, резко отягощающим и ускоряющим течение сепсиса в родах (продолжительность 1-3 суток) является опустошение белой пульпы в селезенке и редукция Т- и В- зон висцеральных лимфатических узлах с замещением их гранулоцитами и макрофагами. В связи с этим можно предположить, что в инфицированном материнском организме начинают рано функционировать те воспалительные клетки, которые располагают Toll-рецепторами типа TLR4, «узнающими» главным образом грамотрицательные бактерии. Сохранение небольшого количества Т- и В-лимфоцитов и отсутствие плазматических клеток в селезенке и лимфатических узлах свидетельствуют о слабой роли приобретенного «адаптационного» иммунитета. Это соответствует конечному этапу системной воспалительной реакции, обозначенному как период «иммунного паралича», возникающего под влиянием эндо- и экзотоксинов (Мороз В.В. и соавт., 2004, Савельев В.С., 2004).
Вышепредставленные особенности инициальных механизмов возникновения сепсиса в родах и сопоставление их с этапами SIRS представлены в отдельной схеме (рис. 3).
Рис. 2. Патогенез сепсиса в родах в сопоставлении с этапами SIRS
Послеродовый сепсис существенно отличается по многим клиническим и патоморфологическим особенностям, главным образом, иными входными воротами, от сепсиса в родах. В нашем исследовании по возрасту преобладали женщины до 20 лет - 5 случаев (55,5%); в анамнезе чаще была одна беременность - 5 случаев (55,5%), первые роды – 6 (66,6%). Как по данным других авторов (Novak T. at al., 1979, Кулаков В.И. и соавт., 1984, Абрамченко В.В. и соавт., 2002) в дородовом анамнезе умерших родильниц, наряду с некоторым количеством разрыва плодных оболочек, на первое место выходили ранее существовавшие пиелонефрит - 6 случаев (66,6%) и воспалительные гинекологические заболевания - 7 случаев (77,7%) (сальпингит, цервицит, кольпит и эндометрит). Самостоятельные роды были в 4 случаях (44,4%), затяжные роды с первичной слабостью родовой деятельности и повторными стимуляциями обнаружены в 5 случаях (55,5%). Дородовое излитие околоплодных вод с безводным промежутком выявлены у 5 женщин (55,5%), плотное прикрепление плаценты - в 3 случаях (33,3%); мертворождение - у одной женщины (11,1%).
Начало септической симптоматики у родильниц разворачивалось на несколько суток позже, чем при сепсисе в родах (рис. 3).
Рис. 3. Начало заболевания у родильниц с послеродовым сепсисом
У этих женщин были отмечены следующие симптомы: повышение температуры до 37,6°-39,5°С – у 6 женщин (66,6%), субфебрилитет (22,2%), гипотермия (11,1%). Артериальное давление характеризовалось тенденцией к гипотонии (55/10-80/50 мм рт.ст.) в 5 случаях (55,5%), но у 3 женщин отмечена гипертензия (33,3%), а у одной – нормальное давление (11,1%).
В заключительных клинических диагнозах ни в одном из 9 случаев не был поставлен диагноз «послеродовый сепсис», чаще фигурировал диагноз «септический метроэндометрит», а в 5 случаях (55,5%), гнойно-септические заболевания вообще не упоминались.
При аутопсийном исследовании в стерильных условиях была взята кровь из полости сердца для бактериологической идентификации возбудителей. Во всех 9 случаях (100%) выделены идентичные инфекционные агенты: в 6 случаях (66,6%) – стафилококки, в 4-х (44,4%) – стрептококки, дрожжеподобные грибы рода Candida и синегнойная палочка, в 3-х (33,3%) –кишечная палочка и в 1-ом (11,1%) неклостридиальные анаэробы. Следует отметить высокую частоту встречаемости ассоциированной микробной флоры.
Наиболее выраженные воспалительные изменения были выявлены в матках, где диагностирована типичная картина эндомиометрита. Матка во всех случаях была увеличена в размерах, эндометрий - рыхлый с наложениями желтоватого цвета, миометрий бурый, в 5 случаях (55,5%) в сосудах миометрия были обнаружены красноватые шероховатые тромбы. В матках учитывалась продолжительность послеродового периода, то есть этапы ее инволюции; в большинстве случаев (8 из 9) она составила 4- 6 суток. Главным признаком гнойного эндомиометрита, отличающим его от «физиологического воспалительного валика», являлась глубина и выраженность инфильтрации в прилежащем миометрии. В обширном воспалительном инфильтрате основными воспалительными клетками стали множественные децидуальные макрофаги и плазматические клетки. Максимальная концентрация макрофагов (2,77±0,14 балла) и плазматических клеток (2,85±0,14) определялась как в пределах плацентарной площадки, так и по ходу соединительнотканных прослоек между мышечными пучками. В меньшей степени выявлялись гранулоциты (1,22±0,14 балла), которые формировали небольшие скопления в плацентарной площадке или в виде отдельных клеток определялись среди мышечных пучков. Т-лимфоциты (1,77±0,14) составляли небольшие скопления среди миометрия или отдельные клетки на границе отторгнутого эндометрия и миометрия.
У всех женщин, умерших от послеродового сепсиса, в плодных оболочках выявлено минимальное количество иммуногистохимически верифицированных макрофагов (0,11±0,05 балла), Т- и В-лимфоцитов (0,22±0,04) при полном отсутствии плазматических клеток. Иными словами, в тех случаях, когда у родильниц, умерших от послеродового сепсиса, удавалось исследовать послед, то он оказывался интактным.
При изучении органов иммуногенеза обнаружено, что во всех 9 случаях масса селезенки увеличена до 400-600г, на ее разрезе наблюдался обильный соскоб пульпы. Лимфатические узлы (висцеральные) увеличены (2,0х0,6х0,6 см), серо-розового цвета, дрябловатой консистенции. В селезенке микроскопически при окраске гематоксилином и эозином в 9 случаях отмечалось стирание рисунка, гипоплазия лимфоидных фолликулов, гиперплазия ретикулярных клеток. При иммуногистохимическом типировании в белой пульпе отмечалось небольшое количество Т-лимфоцитов (1,66±0,16 балла) в сохранившихся фолликулах, истощение В-лимфоцитов (1,11±0,09) с некоторой их концентрацией в периартериолярных зонах. Отмечена диффузная инфильтрация макрофагов (2,55±0,17) и плазматических клеток (2,77±0,14). Они в небольшом количестве визуализированы в редуцированных фолликулах, но большинство их было сконцентрировано в составе красной пульпы. Вместе с тем, в селезенке не выявлено клеток, положительных к фактору некроза опухоли, как это было обнаружено в матке.
В висцеральных лимфатических узлах на микропрепаратах, окрашенных гематоксилином и эозином, констатирована полная дискомплексация их на Т- и В-зоны с потерей рисунка фолликулов: уменьшение количества Т-(1,22±0,14) и В-лимфоцитов (1,11±0,05 балла)). Однако иммунораспределение лимфоидных клеток было иным, чем в селезенке. Так, отмечена минимальная иммуноэкспрессия гранулоцитов (1,22±0,14), которые выявлялись главным образом в мозговых синусах. Там же фиксируется небольшое количество макрофагов (1,11±0,03). Заслуживает особого внимания факт иммуновизуализации макрофагов, положительных к TNF-, в лимфатических узлах, ближайших к матке (малый таз, ворота печени), где экспрессия TNF- выявлена в клетках, расположенных в краевом синусе, в промежуточных и мозговых синусах лимфатических узлов (2,88±0,11 балла).
Если оценивать этапы SIRS, то для послеродового сепсиса свойственны иные инициальные морфологические эквиваленты. Так, для 1-го этапа характерно инфицирование родовых путей в ближайшем послеродовом периоде, чаще всего после разрывов шейки матки и промежности, что способствует восходящему инфицированию, либо через обширную раневую поверхность матки после отделения плодных оболочек и плаценты. Именно в этом отрезке пуэрперия выявляются характерные для 1-го этапа SIRS локальная агрессия и первоначальная продукция цитокинов. В тех случаях, когда возникает явный эндомиометрит, следует констатировать 2 –ой этап, то есть формирование первичного очага с выбросом цитокинов в системный кровоток матери. Вероятно, на 1-ом и 2-ом этапах SIRS в родовых путях и матке возможно выздоровление женщин при своевременном и адекватном их лечении. В этом убеждают высокий процент послеродового эндометрита (Швец В.Н., 2004), который, однако, лишь в редких случаях становится входными воротами для послеродового сепсиса. У отдельных, ослабленных родильниц возникает 3-ий этап SIRS с мощным выбросом цитокинов из воспалительных клеток эндомиометрия и лимфатических узлов малого таза в кровь матери. Происходит перенос циркулирующих в ней микроорганизмов с формированием «метастатических» гнойных очагов во внутренних органах. В нашем материале это были микроабсцессы в легких (44,4%), почках (33,3%), печени (11,1%), головном мозге (22,2% случаев). Иными словами, собственно морфологически подтвержденная септикопиемия, выявленная примерно в половине случаев, не объясняла нарастающей тяжести течения послеродового сепсиса. Вероятно, здесь главную роль играли экзотоксины, выделяемые грамположительной флорой (стафилококки и стрептококки), которые вызывают паралич сосудов и артериальную гипотензию по изоволемическому типу. Нельзя исключить и влияние грамотрицательных бактерий, при разрушении которых из клеточных мембран выделяется эндотоксин (липид А), который поступает в кровь и активирует сегментоядерные лейкоциты, нейтрофилы и макрофаги (Пархоменко Ю.Г., 2005).
По данным В.С. Паукова (2007), многие специфические особенности сепсиса в целом объясняются именно доминирующей ролью эндо- и экзотоксинов, которые обладают способностью быстро и резко менять гомеостаз организма и его отдельных систем, органов. С одной стороны, токсемия активирует выделение большого количества провоспалительных цитокинов и создает так называемый, «цитокиновый хаос», с другой стороны, влияет на сердце и систему циркуляции крови. Финальные стадии послеродового сепсиса протекали примерно также, как и при сепсисе в родах, то есть они соответствовали 3-ему этапу системной воспалительной реакции (гипервоспаление, «иммунный паралич»), обусловленные снижением клеточного иммунитета в селезенке и лимфатических узлах с явной заместительной плазматизацией. По нашим данным выраженность инфекционно-токсического шока и ДВС-синдрома (100% случаев) была больше, чем при сепсисе в родах. Формирование пиемических очагов во многих внутренних органах ускоряло наступление у родильниц полиорганной недостаточности. Все приведенные выше особенности патогенеза при сопоставлении их с этапами системной воспалительной реакции приведены на рис. 4.
Таким образом, между представленными выше нозологическими формами акушерского сепсиса (рис. 2 и 4) наиболее существенная разница выявляется в отношении входных ворот или первичного очага инфекции. Если для сепсиса в родах характерна выраженная картина воспаления в последе (децидуит - 60%, мембранит - 33,3%, амнионит - 6,7%) при минимальных аналогичных изменениях в матке, то у женщин с послеродовым сепсисом компоненты последа были относительно интактны, и, напротив, максимальные воспалительные изменения обнаружены во внутренней оболочке и в прилежащем миометрии (100%).
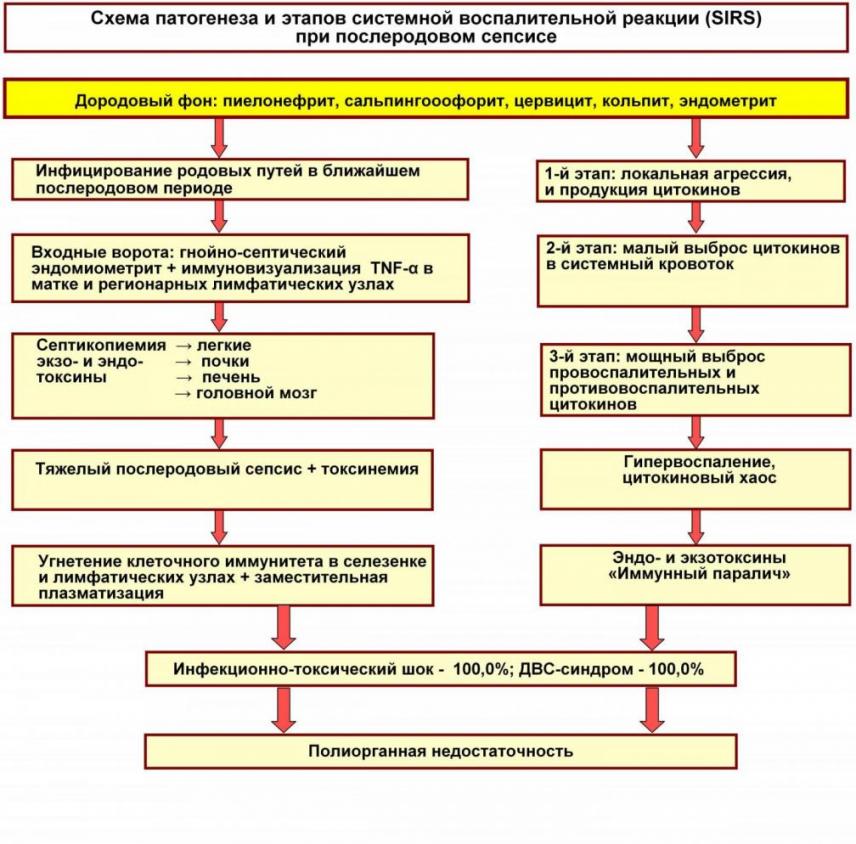
Рис. 4. Схема патогенеза и этапов SIRS при послеродовом сепсисе.
В целом для родильниц, погибших от сепсиса в родах и послеродовом периоде, свойственно истощение лимфоидной ткани в селезенке и висцеральных лимфатических узлах с той лишь разницей, что при первой нозологической форме лимфоидная ткань замещается макрофагами и гранулоцитами, а при второй форме – преобладает выраженная ее плазматизация. Вероятно, изменившиеся соотношения воспалительных агентов (преобладание грамположительной флоры) и воспалительных клеток (плазматизация селезенки и лимфатических узлов) являются отражением большего участия в SIRS механизмов приобретенного иммунитета, чем при сепсисе в родах.
Столь же демонстративна разница в наличии вторичных, метастатических гнойных очагов: они отсутствовали при сепсисе в родах и диагностированы примерно в 30,0-44,0% у женщин, умерших от послеродового сепсиса.
Для финальной стадии обеих форм характерны патоморфологические проявления ДВС-синдрома и инфекционно-токсического шока, регистрируемых в 100% случаев при послеродовом сепсисе и в меньшей степени у женщин, погибших от сепсиса в родах (ДВС-синдром - 73,3%, инфекционно-токсический шок - 26,6%).
Все представленные выше клинико-морфологические материалы убеждают в необходимости дифференциального диагноза сепсиса в родах и послеродового сепсиса, как в клинической практике, так и при патологоанатомическом анализе причин материнских смертей.
В заключение следует подчеркнуть, что своевременная дифференциальная диагностика сепсиса в родах с послеродовым сепсисом позволит клиницистам раньше реализовать главный терапевтический принцип – локализовать системную воспалительную реакцию на этапе первичного очага, то есть до перехода в 3- ий этап SIRS. Выделение этих двух форм пуэрперильного сепсиса в клинике позволит акушерам «найти общий язык» для обсуждения летальных исходов, так как и патологоанатомы в соответствии с требованиями МКБ-10 будут выявлять те же самые нозологические формы акушерского сепсиса на аутопсиях.
ВЫВОДЫ
1. В Ростовской области за 1997-2006 годы среди материнских смертей акушерский сепсис диагностирован у 24 женщин (16,2%); по МКБ-10 он обозначен как септицемия (или сепсис) в родах и послеродовый сепсис. Статистический показатель материнской смертности от пуэрперильного сепсиса, рассчитанный 100000 живорожденных детей, составил в среднем 10,1, с ежегодными колебаниями от 4,8 до 19,4.
2. Сепсис в родах характеризуется инициальными изменениями в последах по типу обострения хронического амнионита, децидуита и интервиллузита с бактериологическим выявлением в крови из полостей сердца преимущественно грамотрицательной микрофлоры. Иммуногистохимическим методом в составе воспалительного инфильтрата выявлено доминирование гранулоцитов и макрофагов, продуцирующих фактор некроза опухоли (TNF-).
3. Раннее антенатальное инфицирование последа и материнского организма обусловливает молниеносное течение сепсиса в родах, частые мертворождения (53,4% случаев), а также быстрое развитие ДВС-синдрома (73,3%), инфекционно-токсического шока (26,6%). При изучении органов выявлены относительная интактность эндо- и миометрия матки, а также отсутствие метастатических гнойных очагов.
4. Выраженность клинико-морфологических проявлений сепсиса в родах обусловлена обеднением белой пульпы в селезенке, редукцией фолликулов в висцеральных лимфатических узлах, общим снижением популяции Т- и Влимфоцитов, с замещением их диффузной инфильтрацией гранулоцитами и макрофагами.
5. Послеродовый сепсис возникает у более молодых родильниц с предшествующей гинекологической, почечной патологией и акушерскими осложнениями. С 4-6 суток пуэрперия развивается гнойный эндомиометрит с достоверным увеличением числа плазматических клеток, Т- и В-лимфоцитов, а также макрофагов, экспрессирующих TNF-. В последующем формируются пиемические очаги (55,5% случаев). В крови из полостей сердца преобладает грамположительная флора, грибы рода Candida и синегнойная палочка. В последах этих женщин признаки воспаления отсутствуют.
6. В увеличенной селезенке (масса 500-600г) и висцеральных лимфатических узлах констатировано уменьшение числа макрофагов, Т- и В-лимфоцитов при диффузной плазматизации. В лимфатических узлах малого таза выявлены макрофаги с выраженной иммуноэкспрессией TNF-.
7. Сопоставление динамики системной воспалительной реакции с клинико-морфологическими проявлениями сепсиса в родах и в послеродовом периоде показало фактическое сходство их инициальных стадий 1-ому и 2ому этапу и общий характер финальных изменений, соответствующих 3ему этапу SIRS – тяжелому сепсису с исходом в инфекционно-токсический шок, ДВС-синдром и полиорганную недостаточность.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
При патологоанатомическом анализе пуэрперильного сепсиса следует изучать все компоненты репродуктивной системы «мать- плацента- плод», в частности, в обязательном порядке оценивать плодные оболочки, плаценту и при мертворождении – плода, что необходимо для морфологической идентификации входных ворот сепсиса в родах. В случаях послеродового сепсиса основным объектом изучения становится инфицированная матка (первичный очаг) с последующим распространением воспалительного процесса на регионарные, висцеральные лимфоузлы и селезенку. В соответствии с МКБ- 10 патологоанатом должен дифференцировать на аутопсиях сепсис в родах и послеродовый сепсис, поскольку они имеют разные коды для обозначения материнских смертей.
СПИСОК НАУЧНЫХ РАБОТ,
ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Бактериально-вирусный пейзаж в крови и органах родильниц, умерших от гнойно-септических заболеваний. // Материалы II Съезда Российского общества патологоанатомов. – Москва, 2006. – С. 280-282 (соавт. А.П.Милованов, А.Э.Мационис).
- Роль антенатального воспалительного поражения плодных оболочек в развитии септицемии в родах // Материалы итоговой научной конференции по актуальным проблемам акушерства, гинекологии и перинатологии. – Ростов-на-Дону, 2007. – С.14-15 (соавт. А.П.Милованов, А.Э.Мационис).
- Морфологические особенности септицемии в родах.// Материалы научно-практической конференции и школы по инфекционной патологии. – Москва, 2007. – С.71-72 (соавт. А.П.Милованов).
- Клинико-морфологические особенности сепсиса в родах как самостоятельной нозологической формы. // Архив патологии. – М., 2008.- №2. – С.9-11 (соавт. А.П.Милованов, А.Э.Мационис).
- Clinico-morphological peculiarities of septicemia in labor as a separate nosological form among the causes of maternal death. //Virchows Archiv.- V.451. - Number 2-August. - 2007. - P.494-495 (al. A.Milovanov, A.Matsionis).
- Clinico-morphological criteria for differential diagnosis of septicemia in labor and puerpperal sepsis. //Virchows Archiv.- V.452. – Supplement 1 – May.- 2008. P.109-110 (al. A.Milovanov, A.Matsionis, G.Reznikova).
Соискатель Миханошина Н.А.

