Органосохраняющее лечение раннего рака молочной железы с применением интраоперационной электронной и дистанционной гамма-терапии
На правах рукописи
ДОРОШЕНКО АРТЕМ ВАСИЛЬЕВИЧ
ОРГАНОСОХРАНЯЮЩЕЕ ЛЕЧЕНИЕ РАННЕГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ С ПРИМЕНЕНИЕМ ИНТРАОПЕРАЦИОННОЙ ЭЛЕКТРОННОЙ И ДИСТАНЦИОННОЙ ГАММА-ТЕРАПИИ
14.01.12 – Онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Томск - 2011
Работа выполнена в Учреждении Российской академии медицинских наук Научно-исследовательский институт онкологии Сибирского отделения РАМН.
Научный руководитель:
доктор медицинских наук, профессор Слонимская Елена Михайловна
Научный консультант:
доктор медицинских наук, профессор Мусабаева Людмила Ивановна
Официальные оппоненты:
доктор медицинских наук, профессор Тузиков Сергей Александрович
доктор медицинских наук, профессор Тихонов Виктор Иванович
Ведущая организация: РОНЦ имени Н.Н.Блохина РАМН г. Москва
Защита состоится «___»___________2011 г. в ___ часов на заседании Диссертационного совета Д 001.032.01 при НИИ онкологии СО РАМН (634009, г. Томск, пер Кооперативный, 5.)
С диссертацией можно ознакомиться в научной библиотеке
НИИ онкологии СО РАМН.
Автореферат разослан «___»___________2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук,
профессор Фролова Ирина Георгиевна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. В структуре онкологической заболеваемости женского населения, как в мире, так и в России, рак молочной железы устойчиво занимает лидирующие позиции. Аналогичная ситуация наблюдается и в отношении показателей смертности (Давыдов М. И., Аксель Е.М., 2007). В России ежегодно отмечается увеличение количества больных, у которых злокачественные новообразования в молочной железе выявляются на ранних стадиях заболевания. Так, в 1997 году удельный вес пациентов с I – II стадиями РМЖ составил 56,8%, а в 2010 году - 63,6% (Чиссов В.И., Старинский В.В., Петрова Г.В., 2009, 2011). Увеличение числа больных с ранними формами привело к росту количества органосохраняющих операций, что позволило обеспечить улучшение качества жизни этого контингента пациенток (Ohsumi S., Shimozuma K., Morita S., et al., 2009).
Одной из основных проблем органосохраняющего лечения является более высокий риск развития местных рецидивов опухоли (8 – 39 %), по сравнению с радикальной мастэктомией (1 – 12%) (Blichert-Toft M., et al., 1992, Fisher B., et al., 2002, Veronesi U., et al, 2002). Рецидивы рака молочной железы преимущественно диагностируются в области послеоперационного рубца в 44% - 86% наблюдений и значительно реже в других квадрантах (Sanders M.E., 2007).
Известно, что проведение адъювантной лучевой терапии позволяет существенно снизить частоту рецидивирования после органосохраняющих операций, что подтверждено результатами рандомизированных исследований (Портной С.М., 2010, Ткачев С.И. и др, 2004, Трофимова О.П., 2010, Чуприк-Малиновская Т.П. и др, 2004, Mai G.T., et al., 2007,). По данным Fisher B. с соавт. (2002), проведение в послеоперационном периоде дистанционной лучевой терапии в 3 раза уменьшает риск возникновения местных рецидивов опухоли при органосохраняющих операциях по сравнению с пациентками, которым облучение не проводилось, и результаты лечения сопоставимы с выполнением радикальной мастэктомии.
Традиционно курс адьювантной лучевой терапии включает в себя проведение дистанционной гамма-терапии на область оставшейся молочной железы разовой очаговой дозой 1,8 - 2 Гр, 5 раз в неделю до СОД 50 – 55 Гр и курса электронной терапии на ложе опухоли РОД 2 – 4 Гр, СОД – 10 – 16 Гр (Елова Т.И., 2002, Пирогова М.С, и др, 2008, Veronesi U., et al.,2001). Облучение зон регионарного лимфооттока выполняется по показаниям - при метастатическом поражении аксиллярных лимфоузлов.
Несмотря на доказанную эффективность, проведение адъювантной лучевой терапии в ряде случаев может сопровождаться развитием осложнений со стороны здоровых органов и тканей (Лобанова Л.Н. 2005, Должанский О.В., 2007, Ozcinar B., et al, 2009, Reitsamer R., et al., 2009, Powell S., 2010, Schnur J., et al., 2011,). Так, нередко в зоне облучения наблюдается гиперпигментация и атрофия кожи, развивается фиброз, что в последующем сопровождается деформацией органа и ухудшением эстетических результатов лечения. Со стороны легких возникают пульмониты, фиброз, которые могут приводить к нарушению функции дыхания (Osako T., et al., 2008, Recht A., et al., 2009). Рядом исследователей было отмечено возрастание частоты рака легких после проведения дистанционной лучевой терапии на область оставшейся молочной железы (Kirova Y.M. et al., 2007, Spyropoulou D., et al., 2009). Имеются сообщения о влиянии облучения на сердечную мышцу (Bouillon K., et al., 2011, Valachis A., et al., 2011). Именно эти обстоятельства определяют целесообразность поиска новых, более эффективных и безопасных методов локального воздействия, одним из которых, является интраоперационная лучевая терапия (ИОЛТ).
Очевидным преимуществом ИОЛТ является то, что во время проведения хирургического вмешательства источник излучения можно более точно подвести непосредственно к ложу опухоли, вследствие чего удается избежать воздействия облучения на кожу, подкожную клетчатку и, соответственно, уменьшить риск развития фиброза, а также сохранить косметический результат (Gatzemeier W., et al, 2001, Kimple R.J., et al., 2011, Lilla C., et al., 2007, Luini A., et al., 2005, Orecchia R., et al., 2005, Veronesi U.,2001,). Кроме этого, ИОЛТ позволяет несколько сократить сроки проведения АЛТ.
Для проведения ИОЛТ используют как энергию электронов, так и рентгеновское излучение в дозах 50 – 200 kV, которое нередко применяют в качестве единственного вида лучевой терапии у больных РМЖ после выполнения органосохраняющей операции (Baum M., et al., 2010, Ciocca M., et al, 2009, Keshtgar M.R., et al., 2005, Orecchia R., et al., 2006, Paganelli G., et al., 2010, Vaidya J., et al, 2010,Veronesi U., et al, 2010). Считается, что доза облучения 21 Гр (фотонэквивалентная доза - 60 Гр) является достаточной для осуществления местного контроля и не сопровождается развитием серьезных послеоперационных осложнений. При этом сами исследователи отмечают, что частота развития фиброза в области послеоперационного рубца может достигать 20% (Intra M., et al., 2005, Veronesi U., et al., 2005).
Значительный интерес представляют публикации, в которых есть указание на возможное снижение не только уровня рецидивирования, но и метастазирования РМЖ у больных, которым выполнялась ИОЛТ (Sedlmayer F., et al., 2007).
Однако, несмотря на накопленный в мире опыт по использованию этого метода и полученные результаты, единой точки зрения в отношении определения показаний, выбора вида и дозы интраоперационной лучевой терапии, возможности ее сочетания с ДЛТ, оценки характера осложнений до настоящего времени нет (Dubois J.B., et al., 2009 de Lorenzi F., 2010, Haviland J.S., et al., 2010, Keshtgar M.R., et al., 2005, Reitsamer R.,et al., 2006, Smith B.D., et al., 2010, Welzel G., et al., 2007, Willett C.G., et al., 2007., Wasser K., et al., 2011, Wenz F., et al., 2008, Van Limbergen E., et al., 2006, Veronesi U., et al., 2010).
В НИИ онкологии СО РАМН ИОЛТ более 20 лет успешно применяется в комбинированном лечении различных злокачественных новообразований: рака желудка, легкого, опухолях головы и шеи, опорно-двигательного аппарата. С 2005 года эта методика стала использоваться и при лечении больных с операбельными формами рака молочной железы.
С представленных позиций, разработка и внедрение нового способа органосохраняющего лечения больных РМЖ с использованием интраоперационной электронной и дистанционной гама-терапии, направленных на улучшение результатов лечения у данного контингента больных, является своевременным и актуальным.
Цель исследования. Оценить эффективность органосохраняющего лечения с применением смешанной интраоперационной электронной и дистанционной гамма-терапии у больных операбельным раком молочной железы.
Задачи исследования.
- Разработать и провести клиническую апробацию способа органосохраняющего лечения больных РМЖ с использованием ИОЛТ и ДГТ.
- Исследовать влияние ИОЛТ на особенности выполнения оперативного вмешательства, частоту и характер ближайших и отдаленных послеоперационных осложнений.
- Изучить частоту и выраженность лучевых изменений в ткани молочной железы при применении смешанной интраоперационной электронной и дистанционной гамма-терапии в сравнении с адъювантной гамма- и электронной терапией.
- Оценить косметический эффект у пациенток, перенесших органосохраняющее лечение с применением ИОЛТ и ДГТ в сравнении с больными, получившими в адьювантном режиме гамма-электронную терапию.
- Провести анализ 5- летней безрецидивной, безметастатической и общей выживаемости у больных РМЖ после выполнения комбинированного лечения в зависимости от используемого вида лучевой терапии.
Научная новизна.
Разработан новый способ органосохраняющего лечения больных операбельным раком молочной железы с применением смешанной интраоперационной электронной терапии и дистанционной гамма-терапии (патент № 2372858).
Показано, что ИОЛТ пучком быстрых электронов 6 МэВ малогабаритного бетатрона однократной дозой 10 Гр на ложе удалённой опухоли не оказывает отрицательного влияния на ход оперативного вмешательства, характер послеоперационных осложнений и не увеличивает их частоту.
Впервые показана принципиальная возможность выполнения реконструктивно-пластического замещения дефекта молочной железы в сочетании с ИОЛТ при органосохраняющих операциях (патент № 2349264).
Впервые отмечено, что использование ИОЛТ и ДГТ позволяет значимо уменьшить частоту и выраженность ранних и поздних лучевых реакций по сравнению с адъювантной гамма- и электронной терапией, и у достоверно большего количества пациентов достигнуть хороших и отличных косметических результатов, чем при проведении ДГТ и ЭТ.
Доказано значимое снижение частоты возникновения местных рецидивов опухоли, а также увеличение 5-летней безрецидивной выживаемости у больных РМЖ, перенесших органосохраняющее лечение с применением смешанной ИОЛТ и ДГТ, по сравнению с больными, получавшими в послеоперационном периоде ДГТ+ЭТ или ДГТ по стандартной методике.
Выявлено, что использование ИОЛТ и ДГТ у больных РМЖ сопряжено с меньшим количеством летальных исходов и более высокими показателями общей 5-летней выживаемости, чем у пациенток, получавших только дистанционную гамма-терапию на оставшуюся молочную железу.
Практическая значимость.
Разработан и внедрен в клиническую практику новый способ органосохраняющего лечения больных раком молочной железы I – II стадий с применением смешанной интраоперационной электронной и дистанционной гамма-терапии, который существенно не увеличивает время выполнения операции, не ухудшает ее течение и позволяет добиваться адекватных эстетических результатов.
Возможность выполнения реконструктивно-пластических вмешательств в условиях проведения ИОЛТ позволяет увеличить контингент пациенток, для которых могут быть определены показания к органосохраняющим операциям.
По результатам выполненного исследования создана новая медицинская технология (ФС № 2010/386 от 26.10.10). Полученные данные могут быть использованы при чтении лекционного курса и проведении практических занятий на кафедрах онкологии, лучевой диагностики и лучевой терапии ВУЗов медицинского профиля.
Основные положения, выносимые на защиту.
- Применение ИОЛТ в органосохраняющем лечении больных РМЖ T1-2 N0-1M0 хорошо переносится, не оказывает отрицательного влияния на ход оперативного вмешательства и течение послеоперационного периода.
- Использование смешанной интраоперационной электронной и дистанционной гамма терапии позволяет уменьшить частоту развития ранних и поздних местных лучевых реакций и повреждений и у большинства больных получить отличные и хорошие косметические результаты.
- Органосохраняющее лечение больных РМЖ с применением ИОЛТ и ДГТ достоверно снижает частоту возникновения местных рецидивов опухоли, увеличивает показатели безрецидивной выживаемости по сравнению с пациентками, которым проводилась гамма- и электронная терапия или облучение молочной железы по стандартной методике, а так же общей 5-летней выживаемости по сравнению с ДГТ.
Апробация работы.
Основные положения диссертации были доложены на конференциях молодых учёных «Актуальные вопросы экспериментальной и клинической онкологии» в 2006, 2007, 2008, 2009 г.г., Томск; III, V, VII международных ежегодных конференциях «Проблемы диагностики и лечения рака молочной железы», Белые ночи Санкт-Петербурга, 2006, 2008, 2011 г.; на XI Российском Онкологическом Конгрессе в рамках сателитного симпозиума, Москва 2007; на конференции «European Breast Cancer Conference», Берлин, март 2008 г;
Публикации
Результаты исследования опубликованы в 27 печатных работах, отражающих основные положения диссертации. Из них 3 статьи в журналах, рекомендованными ВАК.
Объем и структура диссертации
Диссертационная работа изложена на 97 страницах машинописного текста, состоит из введения, 3 глав, заключения, выводов, списка литературы, включающего 155 источников, в том числе 13 отечественных и 142 зарубежных публикации. Работа иллюстрирована 14 таблицами и 15 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ.
В исследование было включено 529 больных раком молочной железы со стадией процесса T1-2N0-1M0, проходивших лечение в отделении общей онкологии НИИ онкологии СО РАМН за период с 1986 по 2010 гг. Возраст пациенток варьировал от 20 до 70 лет (средний возраст составил 48±5,8 лет). У всех больных диагноз РМЖ был верифицирован морфологически.
В плане комбинированного лечения всем пациенткам были выполнены органосохраняющие операции. Радикальная резекция проведена 256 больным, 256 - секторальная резекция с аксиллярной лимфаденэктомией, 17 пациентам выполнены органосохраняющие операции с одновременным проведением реконструктивно-пластических вмешательств. Для закрытия дефектов использовались перемещенные (TRAM, ТДЛ) и свободные (DIEP, GAP) лоскуты.
У 235 (44,4%) больных лечение начиналось с проведения 2-4 курсов неоадъювантной химиотерапии по схемам CMF, FAC, CAF, CAX, CMX. Показанием к проведению НАХТ являлись размеры опухоли более 2 см (T2), наличие поражённых лимфоузлов, отрицательный рецепторный статус. По показаниям в адъювантном режиме 242 (45,7%) пациентки получали химиотерапию по схемам CMF, FAC, а 408 (77,1%) гормонотерапию.
Всем больным, включенным в исследование, проводилось облучение. В зависимости от применяемой методики лучевой терапии было сформировано три группы пациенток (рис. 1). Больным I – исследуемой группы, в которую вошли 252 пациентки, во время проведения оперативного вмешательства на «ложе» удаленной опухоли проводилась ИОЛТ с последующей ДГТ на область оставшейся молочной железы. Вторую группу – сравнения – составили 159 больных, которым после оперативного вмешательства проводили ДГТ на молочную железу и дополнительно электронную терапию на область послеоперационного рубца. В третью – контрольную – группу вошло 118 пациенток, которым проводилась ДГТ по стандартной методике. По основным клинико-морфологическим параметрам, а так же по объёму выполненного лечения сформированные группы были соотносимы.
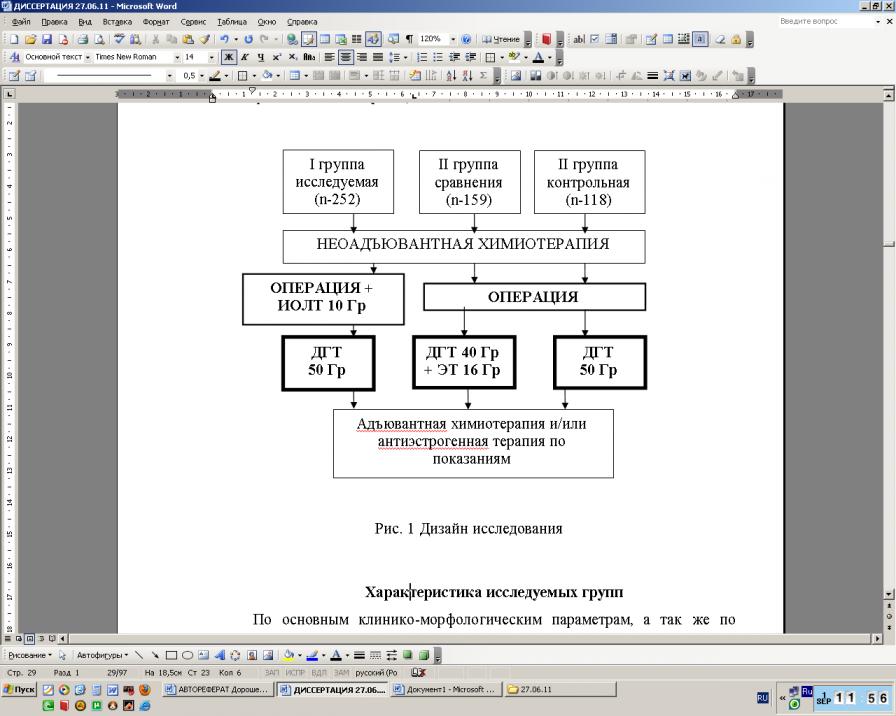
Рисунок 1. Дизайн исследования
Методики проведения лучевой терапии
Больным исследуемой (I) группы проводилась ИОЛТ на малогабаритном бетатроне МИБ-6Э, установленном в операционной, в наборе которого имеются коллиматоры с различной формой тубусов (круглой, овальной, прямой, скошенной под углом) и разных размеров (4 см, 7х9см, 9х11см). Однократная доза ИОЛТ на ложе удаленной опухоли составила во всех случаях 10 Гр (24,8 Гр по изоэффекту). В послеоперационном периоде всем пациенткам осуществлялось дистанционная гамма - терапия на оставшуюся молочную железу. Режим фракционирования был стандартным: разовая очаговая доза 2 Гр, 5 фракций в неделю. Если больным было показано проведение в послеоперационном периоде адъювантной химиотерапии, то ДГТ выполнялась после 2-х курсов АХТ. Расчет необходимого числа сеансов и курсовой дозы смешанного облучения проводили по специально разработанной формуле в зависимости от интервала между ИОЛТ и началом ДЛТ (патент № 2372858). Средняя величина суммарной очаговой дозы гамма – терапии на оставшуюся молочную железу составляла - 46±8,1 Гр, курсовая доза смешанного облучения в области «ложа» удаленной опухоли после проведения ИОЛТ и ДГТ составляла 60 изоГр (100 усл.ед ВДФ).
В группе сравнения (II) ДГТ на оставшуюся молочную железу проводилась в СОД – 40 - 44 Гр. Дополнительно на область рубца выполняли электронную терапию средней энергией 7-8 МэВ на малогабаритном бетатроне в режиме: РОД - 3,0-4,0 Гр, 3 фракции в неделю, СОД-15-18 изоГр. Курсовая доза в области ложа удаленной опухоли составляла 58 изоГр.
В контрольной (III) группе гамма-терапия проводилась в стандартном режиме фракционирования дозы: РОД 2 Гр 5 раз в неделю до величины СОД 50 – 55 Гр.
При наличии метастатического поражения лимфоузлов больным всех групп на зоны регионарного лимфооттока выполнялась гамма-терапия по стандартной методике СОД - 40 - 44Гр. Облучение было проведено соответственно - 91 (36,1%) пациентке первой, 62 (39%) второй и 45 (38,1%) больным третьей группы.
Методы обследования
До начала лечения всем больным проводилось полное клинико–инструментальное обследование, включающее общеклинические анализы, рентгенографию легких, маммографию, УЗИ молочной железы, печени, остеосцинтиграфию, биопсию опухоли (тонкоигольную или трепан-биопсию).
Стадия опухолевого процесса определялась по международной классификации TNM (2002 г). Морфологическому исследованию подвергался биопсийный и операционный материал. Характер лучевых повреждений оценивался по шкале RTOG/EORTC. Косметические результаты лечения оценивали по изменению объема молочной железы до и после операции. Для этого использовались маммограммы кранио-каудальной проекции. Объем рассчитывался по формуле расчета объема конуса (формула 1):
![]() (1),
(1),
где V – объем молочной железы, h – расстояние от середины «основания» молочной железы до наивысшей точки на снимке, r – радиус «основания» молочной железы.
Сроки наблюдения за больными составили от 1 года до 5 лет.
Продолжительность жизни больных без признаков рецидива, метастазов заболевания и общая выживаемость высчитывалась моментным методом по Kaplan-Meier с применением log-rank-теста. Для статистической обработки данных использовалась программа «Statistica 6.0».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Разработка способа органосохраняющего лечения больных операбельным раком молочной железы с использованием ИОЛТ и ДГТ
Проведение ИОЛТ при органосохраняющих операциях на молочной железе предполагает выполнение нескольких основных этапов.
Вначале удаляется сектор молочной железы с опухолью в пределах здоровых тканей с подлежащей фасцией большой грудной мышцы. Если опухоль располагалась в верхне-наружном квадранте, то выполнялось оперативное вмешательство в объеме радикальной резекции, при которой единым блоком удалялся сектор молочной железы с клетчаткой аксиллярной области. В тех случаях, когда новообразование локализовалось в других квадрантах, секторальная резекция и аксиллярная лимфаденэктомия выполнялись из двух различных операционных доступов. Для исключения наличия остаточной опухоли по линии резекции в молочной железе, с краев раны делали мазки-отпечатки и проводили срочное цитологическое исследование.
Следующим этапом была подготовка операционной раны к проведению ИОЛТ. После иссечения сектора молочной железы края раны представлены подкожно-жировой клетчаткой и тканью самого органа, а дном является большая грудная мышца. Проведение же интраоперационого облучения, в первую очередь, должно быть направлено на ткани, которые непосредственно прилежали к иссеченному сектору с опухолью. Именно с этой целью формировалось поле облучения. Для этого, нижние края раны, прилежащие к большой грудной мышце, стягивались лигатурами, закрывая ее и выводя из зоны ИОЛТ, а также создавая достаточно равномерную поверхность. Далее в рану устанавливался коллиматор, размер которого подбирался в зависимости от объема выполненной резекции и площади поля облучения. С целью придания определенной «жесткости» этой конструкции, верхний кожный край раны фиксировали к тубусу, подшивая его через отверстия, просверленные по нижнему краю (патент на полезную модель № 71074). Верхняя часть коллиматора стандартно фиксировалась к бетатрону.
Затем проводили сеанс ИОЛТ в дозе 10 Гр (24,8 Гр по изоэффекту), который длился по времени 2 – 3 минуты. На время проведения облучения медицинский персонал покидает операционную. Контроль над состоянием пациентки осуществляется при помощи аппаратуры слежения.
Четвертым, завершающим, этапом этого метода является выполнение аксиллярной лимфаденэктомии, дренирование, ушивание раны.
Было показано, что подготовка операционной раны, установка коллиматора, а также проведение непосредственно самого сеанса облучения, увеличивают продолжительность оперативного вмешательства не более чем на 15 мин. Каких-либо осложнений, связанных с проведением сеанса ИОЛТ не наблюдалось.
У 17 больных РМЖ, после выполнения секторальной резекции и проведения сеанса ИОЛТ, образовался такой дефект молочной железы, ушивание которого просто местными тканями, привело бы к выраженной деформации органа и потере эстетического результата. Поэтому этим пациенткам одномоментно были выполнены реконструктивно-пластические вмешательства с использованием различных лоскутов – перемещенных (TRAM, ТДЛ) и свободных (DIEP, GAP). И при этих объемах операции каких-либо осложнений, реакций со стороны окружающих тканей в ответ на проведение облучения выявлено не было. Послеоперационной период протекал также без особенностей (патент №2349264).
После заживления раны, удаления дренажа, снятия швов, прекращения лимфореи всем пациенткам проводилась дистанционная гамма – терапия. ДЛТ осуществлялась на оставшуюся часть молочной железы, а при метастатическом поражении аксиллярных лимфатических узлов на зоны регионарного лимфооттока. Режим фракционирования гамма-терапии был стандартным: разовая очаговая доза 2 Гр, 5 фракций в неделю.
Расчет необходимого числа сеансов ДГТ и курсовой дозы смешанного облучения, в зависимости от длительности интервала между ИОЛТ и ДЛТ проводили по формуле, разработанной проф. В.А. Лисиным:
![]() (2),
(2),
где Du – однократная доза ИОЛТ, Гр; Т – временной интервал между ИОЛТ и ДГТ в сутках; dф и tф – соответственно однократная доза и средний временной интервал для выбранного фракционированного режима облучения.
Среднее время от момента операции с ИОЛТ до начала курса ДГТ составило 56 дней. Такой срок был обусловлен проведением у части пациентов курсов адьювантной химиотерапии перед проведением лучевой терапии.
Средняя величина суммарной очаговой дозы (СОД) гамма – терапии на оставшуюся молочную железу составляла - 46±8,1 Гр, на зоны регионарного лимфооттока СОД - 40 Гр. Курсовая доза смешанного облучения в мишени (ИОЛТ и ДГТ) – 60 изоГр (100 усл.ед ВДФ).
Разработанный способ органосохраняющего лечения больных РМЖ с использованием смешанной интраоперационной электронной и дистанционной гамма-терапии успешно прошел клиническую апробацию, при которой было показано, что в техническом отношении он выполним, хорошо переносится пациентами, не оказывает отрицательного влияния на ход оперативного вмешательства (патент № 2372858).
Анализ частоты и характера послеоперационных осложнений при органосохраняющих операциях у больных РМЖ в условиях применения ИОЛТ
Особенности течения раннего послеоперационного периода
Проведение ИОЛТ не привнесло какого-либо негативного влияния на течение послеоперационного периода. Так, развитие умеренного отека в области послеоперационного рубца было отмечено у 59 пациенток (23,4%) в группе с ИОЛТ, который самостоятельно проходил через 2 – 4 недели и у 42 (26,4%) больных, которым на первом этапе выполнялось хирургическое вмешательство и затем проводились адъювантная гамма- и электронная терапия. Умеренные проявления гиперемии кожных лоскутов наблюдались у 44 (17,4%) пациенток, получивших ИОЛТ у и 28 (17,6%) больных группы сравнения. Эти изменения сохранялись на протяжении 2 – 3 недель и не требовали проведения дополнительной коррекции. Только у одной пациентки (0,4%) исследуемой группы наблюдалось развитие резко выраженного отёка и гиперемии кожных покровов, по поводу чего с эффектом проводилась магнито-лазерная терапия.
К наиболее значимым хирургическим осложнениям можно отнести развитие кровотечений, которые были диагностированы у 3 (1,9%) пациенток исследуемой группы и у 2-х (1,2%) в группе сравнения. Во всех случаях источником кровотечения были сосуды аксиллярной области, которые располагались вне зоны проведения ИОЛТ, выполнялась ревизия раны, гемостаз. При оценке объема и характера раневого отделяемого также каких-либо особенностей и различий выявлено не было.
Течение позднего и отдалённого послеоперационного периода
В позднем послеоперационном периоде (7 – 30 сутки) у 14 (5,56%) больных, которым проводилась ИОЛТ, в области послеоперационного рубца развились лигатурные свищи. В группе сравнения подобное осложнение было отмечено у 8 (5,06%) пациенток. Всем больным проводились санационные мероприятия. Образование свищей, по нашему мнению, сложно связать с проведением ИОЛТ, это в большей степени обусловлено реакцией организма пациенток на шовный материал.
У ряда пациенток наблюдались гнойные осложнения. Однако ни у одной больной не было отмечено воспалительных изменений в области проведения ИОЛТ. У 8 (3,82%) пациенток, получавших ИОЛТ и 14 (8,8%) в группе сравнения было выявлено нагноение аксилярной серомы. Такая ситуация связана с длительно существующей аксилярной серомой. По мере необходимости проводилась медикаментозная и хирургическая коррекция развившихся осложнений.
Лимфорея наблюдалась у 223 (89,3%) пациенток исследуемой группы и 155 (97,4%) группы сравнения. Длительность ее составляла от 1 недели до 4 месяцев. Длительная лимфорея (продолжительностью более 1 месяца) в исследуемой группе встречалась достоверно ниже, чем в сравниваемой – 24,5% и 30,1% соответственно (p=0,046).
В группе больных, которым выполнялась ИОЛТ, была проведена оценка влияния характера оперативного вмешательства на сроки лимфореи. Выявлено, что более продолжительное время она наблюдается при радикальных резекциях, когда единым блоком удаляется часть молочной железы с клетчаткой подключично-подмышечно-подлопаточной областей. У таких пациентов среднее время лимфореи составило 27 суток. При выполнении секторальной резекции и аксиллярной лимфаденэктомии из двух разных доступов, продолжительность лимфореи была несколько короче, в среднем 23 дня, а минимальное время было отмечено после органосохраняющего лечения с одномоментной пластикой молочной железы – 18 дней.
Полученные данные позволяют полагать, что проведение операции на первичном опухолевом очаге и зонах регионарного лимфооттока из двух доступов способствует уменьшению размеров операционной раны, объема удаляемых тканей, поскольку, при этом не происходит сообщения двух полостей – непосредственно в молочной железе и аксилярной области. Минимальные сроки лимфореи при выполнении реконструктивно - пластических операций, вероятно, обусловлены резорбтивными свойствами аутотрансплантатов.
Анализ полученных результатов свидетельствует о том, что ИОЛТ не оказывает какого-либо отрицательного воздействия на течение послеоперационного периода, у ряда пациенток наблюдались типичные для хирургических вмешательств послеоперационные осложнения, и при этом частота их проявления была относительно невысока.
Особенности лучевых повреждений в ткани молочной железы, наблюдаемые при применении смешанной ИОЛТ и ДГТ по сравнению с адъювантной гамма- и электронной терапией.
Результаты оценивались у больны РМЖ, получивших органосохраняющее лечение с использованием ИОЛТ и ДГТ и адъювантной гамма- и электронной терапией. Для проведения сравнительного анализа эти две группы были выбраны как наиболее сопоставимые по объёму проведённой лучевой терапии в области оперативного вмешательства на молочной железе.
Ранние лучевые повреждения.
Наиболее часто встречающимися лучевыми реакциями у больных обеих групп были проявления слабо выраженной эритемы и сухого эпидермита – повреждения I степени. Они возникли у 140 (55,5%) пациенток в группе, кому проводился ИОЛТ и ДГТ и несколько реже наблюдались у больных, получавших гамма-электронную терапию – у 71 (44,6%). Выявленные различия не имеют статистической значимости (р=0,2).
Лучевые повреждения II степени, проявляющиеся развитием умеренного отёка, островкового влажного эпидермита, достоверно чаще отмечались среди пациенток, получавших ДГТ и ЭТ: у 26 (10,3%) и 43 (27%) больных соответственно (p=0,0002).
Развитие влажного эпидермита на фоне выраженного отёка ткани молочной железы (III степень по шкале RTOG) был отмечен у 7 (2,7%) больных, получивших ИОЛТ и ДГТ, и 9 (5,7%) пациенток, которым в послеоперационном периоде проводили гамма- и электронную лучевую терапию. Однако, выявленные различия оказались статистически не значимыми (р=0,1).
С целью коррекции развившихся ранних лучевых реакций, больным со II – III степенью местных повреждений проводилась магнито-лазерная терапия, мазевые аппликации («Колагель», гель «Тизоль») с достижением положительного эффекта.
Поздние лучевые реакции.
Эти изменения были более характерны для пациенток, получавших ДГТ и ЭТ (табл. 1). Именно у этого контингента больных, достоверно чаще выявлялась пигментация кожи молочной железы: у 23 (14,5%) и 18 (7,2%) пациенток соответственно (р = 0,03).
Наиболее часто встречающимися изменениями была лёгкая индурация подкожно-жировой клетчатки в области послеоперационного рубца (I степень). Такие повреждения были отмечены у 83 (32,9 %) больных, получивших ИОЛТ и ДГТ, они самостоятельно купировались через 6-12 месяцев. В группе сравнения аналогичные проявления лучевых реакций в области поля облучения быстрыми электронами выявлялись достоверно чаще - в 78 (49%) наблюдений (p=0.003).
Развитие умеренного фиброза, относящегося ко II степени выраженности поздних лучевых повреждений, чаще проявлялось у больных РМЖ, которым в послеоперационном периоде проводилась гамма- и электронная терапия – в 21,3% наблюдений. В группе пациенток, получивших ИОЛТ и ДГТ, подобные изменения отмечены лишь в 12,6% случаях. Выявленные различия статистически значимы (р = 0,04).
Лучевые реакции III степени наблюдались крайне редко. Так, выраженный фиброз в области послеоперационного рубца развился у 1 (0,3%) пациентки в группе с ИОЛТ и у 3 (1,8%) больных, получавших ДГТ и ЭТ. Эти изменения сохранялись практически на протяжении 2-х летнего периода наблюдения. В сложившейся ситуации с целью исключения местного рецидива опухоли иссечение послеоперационного рубца потребовалось у одной пациентки, получившей ИОЛТ и ДГТ, и у 2-х больных, которым проводилась адъювантная гамма- и электронная терапия. По результатам выполненного морфологического исследования операционного материала данных за рецидив получено не было.
Таблица № 1
Частота и степень выраженности поздних лучевых повреждений по шкале RTOG/EORTC у больных РМЖ в зависимости от вида лучевой терапии
| Степень и вид лучевых повреждений | Количество больных, абс. ч. (%) | p | ||
| I группа ИОЛТ+ДГТ | II группа ДГТ+ЭТ | |||
| I степень | Кожа (пигментация) | 18 (7,2%) | 23 (14,5%) | 0,03 |
| Подкожная клетчатка (лёгкая индурация) | 83 (32,9%) | 78 (49%) | 0,03 | |
| II степень | Подкожная клетчатка (умеренный фиброз) | 32 (12,6%) | 34 (21,3%) | 0,04 |
| III степень | Подкожная клетчатка (выраженный фиброз) | 1 (0,3%) | 3 (1,8%) | 0,1 |
Таким образом, полученные нами данные свидетельствуют о том, что проведение смешанной интраоперационной электронной и дистанционной гамма-терапии, характеризуется меньшей частотой развития как ранних, так и поздних лучевых реакций и повреждений тканей молочной железы, по сравнению с с больными, которым проводилась ДГТ и ЭТ.
Оценка косметического эффекта органосохраняющего лечения больных РМЖ при использовании различных видов облучения
Анализ косметических результатов показал, что отличный (уменьшение объема железы – менее чем на 10%) и хороший (уменьшение объема железы в пределах 10% - 15 %) косметический результат значительно чаще отмечался у пациенток, которым была выполнена ИОЛТ и ДГТ – в 78,6% наблюдений. В группе сравнения аналогичные результаты были достигнуты лишь у 45,0% больных (табл. 2).
Таблица 2
Изменение объёма молочной железы при проведении органосохраняющего лечения у больных РМЖ в зависимости от вида лучевой терапии
| Изменение объёма молочной железы (%) (косметический эффект) | Количество пациенток, абс.ч. (%) | p | |
| I группа ИОЛТ+ДГТ n=150 | II группа ДГТ+ЭТ n=80 | ||
| < 10 % (отличный) | 14 (9,3%) | 3 (3,7%) | 0,1 |
| 10% < 15 % (хороший) | 104 (69,3%) | 34 (42,5%) | 0,04 |
| 15% < 20% (удовлетворительный) | 31 (20%) | 36 (45%) | 0,02 |
| > 20 % (неудовлетворительный) | 2 (1,3%) | 7 (8,8%) | 0,01 |
Лучшие косметические результаты, достигнутые у пациенток исследовательской группы, обусловлены не только применением различных видов лучевой терапии. Определенную роль в этом отношении сыграл и тот факт, что в последние годы отмечена устойчивая тенденция к уменьшению объема удаляемых тканей (выполнение лампэктомии). Тем не менее, проведение ИОЛТ, безусловно, имеет ряд преимуществ, позволяя подвести источник излучения непосредственно к ложу опухоли, вследствие чего удается избежать воздействия облучения на кожу, подкожную клетчатку, уменьшить риск развития фиброза и получить достойный косметический результат.
Оценка отдаленных результатов органосохраняющего лечения больных РМЖ в зависимости от применяемых курсов лучевой терапии
Сроки наблюдения за больными, вошедшими в исследование, составили от 1 года до 5 лет. За этот период времени рецидивы РМЖ были диагностированы у 6 (2,38%) больных, получивших ИОЛТ и ДГТ, у 13 (8,2%) пациенток, которым проводилась адъювантная гамма- и электронная терапия и 13 (11%) – только ДГТ по стандартной методике. Оказалось, что при использовании интраоперационной электронной и дистанционной гамма-терапии рецидивы опухоли наблюдались достоверно реже, чем при применении ДГТ и ЭТ (р=0,009) и дистанционной гамма-терапии (р=0,001). В зоне проведения ИОЛТ (область послеоперационного рубца) рецидивы опухоли возникли только у 3 больных (1,19%), у остальных пациенток рост новообразований наблюдалось в других квадрантах молочной железы, что в большей мере обусловлено мультицентрическим характером роста опухоли, который не был выявлен на этапах диагностики. У больных, получавших ДГТ+ЭТ и ДГТ, рецидивы РМЖ в области послеоперационного рубца наблюдались значительно чаще – в 8 (5,03%) и 10 (8,4%) случаях соответственно (р=0,02). Эти данные отразились на показателях 5-летней безрецидивной выживаемости. Так, в исследуемой группе они оказались достоверно выше и составили 97,3 ± 1,08%, тогда как у больных, получавших ДГТ и ЭТ 88,96±2,8 %, а при применении только ДГТ - 86,7±3,5% (р=0,02) (рис.2).
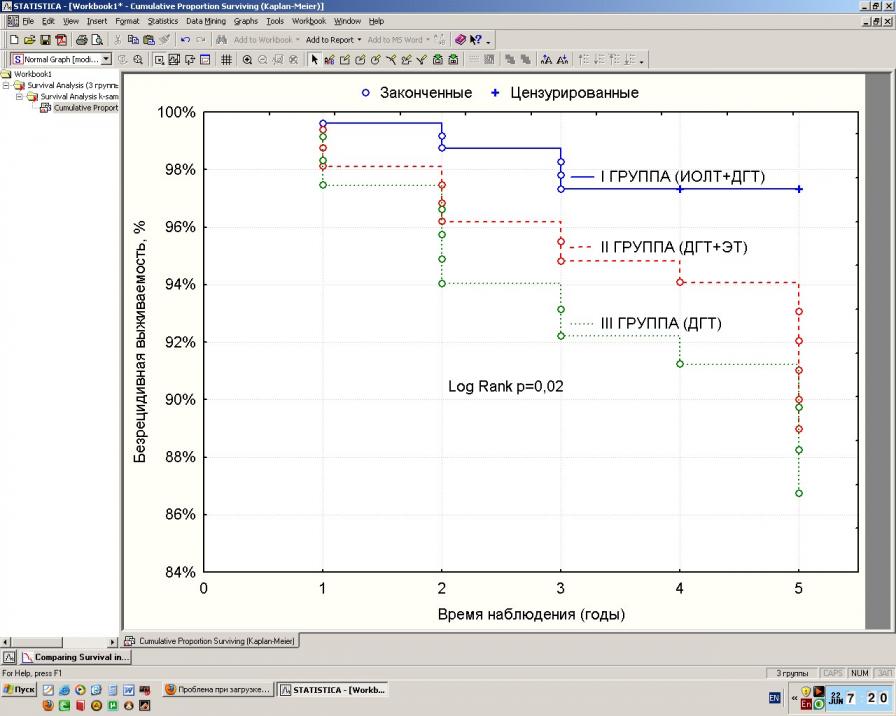
Рис. 2. Безрецидивная выживаемость больных РМЖ в зависимости от вида лучевой терапии (по методу Каплан-Майера).
Развитие гематогенных метастазов у больных, которым проводилась ИОЛТ и ДГТ, выявлено в 14 (5,56%) наблюдениях. Среди пациенток, получивших адъювантную гамма- и электронную лучевую терапию аналогичный показатель был несколько выше и составил 8,17%. Самая высокая частота развития отдалённых метастазов наблюдалась в группе с ДГТ – 13,5%, что было значимо больше, чем в исследуемой группе (р=0,01).
При этом показатели 5-летней безметастатической выживаемости также оказались несколько выше в исследуемой группе относительно группы сравнения и контроля и составили 92,18 ± 2,1 %, 90,46 ± 2,5 % и 86,3±3,1% соответственно (рис. 3). Однако выявленные различия были статистически не достоверны (р>0,05).
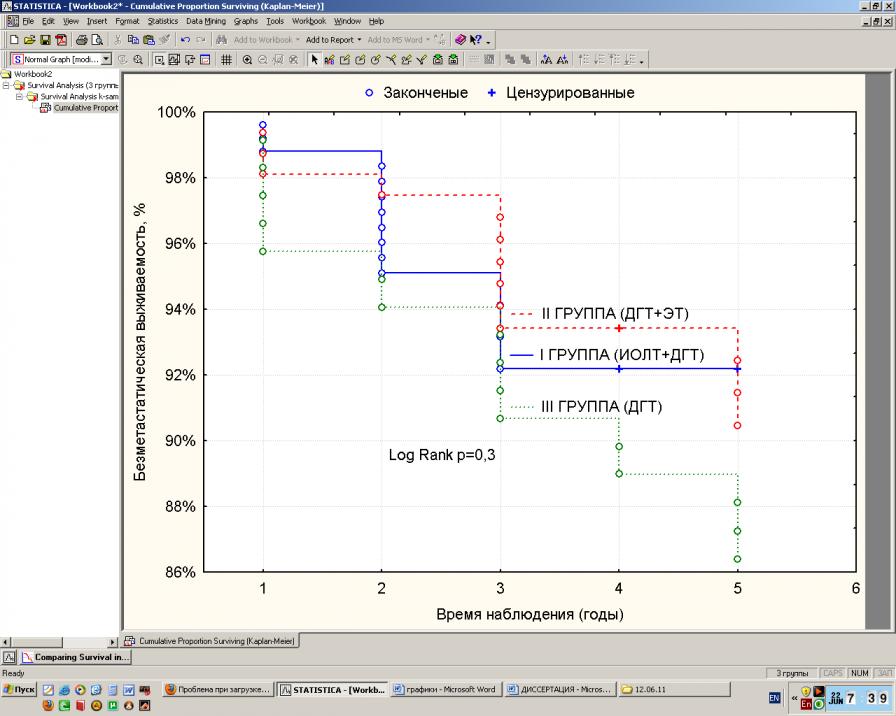
Рис. 3. Безметастатическая выживаемость больных РМЖ в зависимости от вида лучевой терапии (по методу Каплан-Майера)
От прогрессирования заболевания погибли 5 (2,4%) пациенток, получивших смешанную интраоперационную электронную и дистанционную гамма-терапию, 7 (4,4%) больных, комбинированное лечение которых включало адъювантную гамма- и электронную терапию и 12 (10,1%) – облучение молочной железы которым проводилось по стандартному режиму. При этом, летальные исходы достоверно чаще наблюдались у пациенток, получавших только ДГТ (р<0,05).
Аналогичная закономерность выявлена и в отношении показателей общей 5-летней выживаемости, которые составили 95±2,3%, 93,6±2,4% и 89,7±2,7% соответственно (р=0,03) (рис. 4).
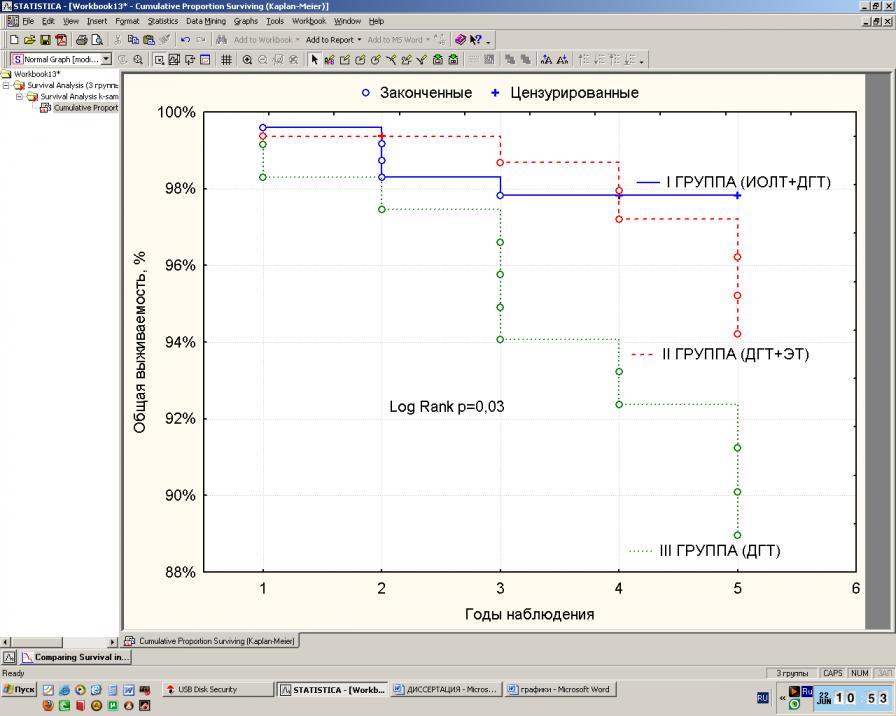
Рис. 4. Общая выживаемость больных РМЖ в зависимости от вида лучевой терапии (по методу Каплан-Майера)
Таким образом, полученные данные свидетельствуют о том, что новый способ органосохраняющего лечения больных раком молочной железы, включающий проведение ИОЛТ и ДГТ позволил значимо уменьшить частоту возникновения местных рецидивов опухоли и увеличить показатели безрецидивной выживаемости, по сравнению с пациентками, которым в послеоперационном периоде проводилась гамма- и электронная терапия или облучение по стандартной методике. Кроме этого, применение интраоперационной электронной и дистанционной гамма-терапии у больных РМЖ позволило достоверно снизить частоту летальных исходов, а соответственно и увеличить показатели 5-летней общей выживаемости по сравнению с больными, получавшими лучевую терапию по стандартной методике. Все это позволяет считать ее применение целесообразным при проведении органосохраняющего лечения у больных раком молочной железы.
ВЫВОДЫ
- Разработан новый способ органосохраняющего лечения операбельного рака молочной железы с применением смешанной интраоперационной электронной и дистанционной гамма-терапии. Показана принципиальная возможность одномоментного выполнения реконструктивно-пластических операций в условиях ИОЛТ.
- Проведение ИОЛТ в дозе 10 Гр на бетатроне МиБ 6 Э на ложе удалённой опухоли не оказывает отрицательного влияния на ход оперативного вмешательства, частоту и характер ранних и поздних послеоперационных осложнений.
- Использование интраоперационной электронной и дистанционной
гамма-терапии способствует снижению частоты и выраженности
лучевых реакций по сравнению с адъювантной дистанционной гамма- и электроной терапией. Реже проявляются ранние лучевые
повреждения II степени (умеренный отёк, островковый влажный
эпидермит) в 10,3% и 27% (р=0,0002), поздние лучевые изменения со стороны кожи (пигментация) в 7,2% и 14,5% (р=0,03), подкожной
клетчатки II степени (умеренный фиброз) в 12,6% и 21,3% (р=0,04)
наблюдений соответственно. - Проведение органосохраняющего лечения больных РМЖ с
использованием ИОЛТ и ДГТ позволило получить отличные и
хорошие косметические результаты в 78,6% наблюдений тогда как в группе сравнения этот показатель составил 46,3% (р=0,02). Уменьшение объема молочной железы более чем на 15% чаще наблюдалось у больных, получивших в адъювантном режиме гамма- и электронную терапию: в 53,75% и 21,4% соответственно (р=0,001). - Применение интраоперационной электронной лучевой терапии в дозе 10 Гр и дистанционной гамма-терапии при проведении органосохраняющего лечения у больных РМЖ значимо уменьшило частоту развития местных рецидивов опухоли по сравнению с адъювантной дистанционной гамма- и электронной терапией: 2,38% и 8,2% (р=0,01), и дистанционной гамма-терапией по стандартной методике – 11%. При этом отмечено увеличение показателей 5-летней безрецидивной выживаемости 97,3 ± 1,08%, 88,96 ± 2,8% и 86,7±3,5% соответственно (р=0,02).
- Органосохраняющее лечение больных РМЖ с использованием дополнительного лучевого воздействия (ИОЛТ + ДГТ или ДГТ + ЭТ) обеспечивает снижение количества летальных исходов и увеличение общей 5-летней выживаемости по сравнению с пациентками, получавшими ДГТ по стандартной методике: 97,8 ± 0,9 %, 94,2 ± 2, 1% и 89,7±2,7% соответственно (р=0,03).
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- С целью сокращения местного рецидивирования при выполнении органосохраняющих операций у больных операбельным раком молочной железы I – II стадиями рекомендуется проведение интраоперационной лучевой терапии в дозе 10 Гр на ложе удалённой опухоли с последующей дистанционной гамма-терапией. Определение необходимого числа сеансов ДГТ и курсовой дозы смешанного облучения следует проводить с учетом длительности интервала между ИОЛТ и ДЛТ.
- В случае формирования больших дефектов после выполнения секторальных резекций молочной железы и проведения сеанса ИОЛТ возможно выполнение одномоментной реконструкции молочной железы свободными либо перемещёнными кожно-жировыми лоскутами. Это позволяет получить хорошие косметические результаты.
- При выполнении органосохраняющих операций у больных РМЖ, независимо от локализации опухоли, оперативное вмешательство на молочной железе и зонах регионарного лимфооттока следует выполнять из двух раздельных доступов, что позволяет сократить объём и продолжительность лимфореи.
Список использованных сокращений
АЛТ адъювантная лучевая терапия
АХТ адъювантная химиотерапия
Гр Грей – единица ионизирующего излучения
ДГТ дистанционная гамма-терапия
изоГр изоэффективная единица дозы
ИОЛТ интраоперационная лучевая терапия
НАХТ неоадъювантая химиотерапия
ОСЛ органосохраняющее лечение
ОСО органосохраняющая операция
РОД разовая очаговая доза
РМЖ рак молочной железы
СОД суммарная очаговая доза
ЭТ терапия быстрыми электронами
Список работ, опубликованных по теме диссертации.
- Дорошенко А.В. Интраоперационная лучевая терапия при органосохраняющем лечении рака молочной железы [текст] / Е. М. Слонимская, Л.И. Мусабаева, В.А. Лисин, и др.// Материалы II Международной ежегодной конференции Проблемы диагностики и лечения рака молочной железы «Белые ночи Санкт-Петербурга». - СПб., 2005. - С. 137.
- Дорошенко А.В. Органосохраняющее лечение больных раком молочной железы с применением ИОЛТ [текст] / Дорошенко А.В., Слонимская Е.М., Е.Ю. Гарбуков и др.// Сборник статей научно-практической конференции «60 лет онкологической службе красноярского края». Красноярск, - 2005. – С. 260.
- Дорошенко А.В. Методика смешанного облучения (ИОЛТ и ДГТ) в комплексном лечении больных раком молочной железы [текст] / Ю. Н. Струков, А. В. Дорошенко // Материалы II научной-практической конференции молодых специалистов-онкологов «Лечение рака в ХХI веке». Челябинск,2006. - С. 75.
- Дорошенко А.В. Первый опыт применения интраоперационной лучевой терапии при органосохраняющих операциях у больных раком молочной железы [текст] / А. В. Дорошенко, Ю. Н. Струков.// Материалы II научнопрактической конференции молодых специалистов-онкологов «Лечение рака в ХХI веке». Челябинск, 2006. -С.35 – 36.
- Дорошенко А.В. Интраоперационная лучевая терапия (ИОЛТ) при органосохраняющих операциях у больных раком молочной железы [текст] / Е. М.Слонимская, А. В.Дорошенко, Л. И.Мусабаева и др. // материалы IV съезда онкологов и радиологов СНГ. Баку, 2006. - С.334
- Дорошенко А.В. Первые результаты применения интраоперационной лучевой терапии (ИОЛТ) у больных раком молочной железы (РМЖ) [текст] /Е.М. Слонимская, А.В. Дорошенко и др. // Материалы III международной ежегодной конференции «Проблемы диагностики и лечения рака молочной железы». Санкт-Питербург, 2006.- С 88.
- Дорошенко А.В. Первые результаты применения интраоперационной лучевой терапии при органосохраняющих операциях у больных раком молочной железы [текст] / Дорошенко А.В., Гарбуков Е.Ю., Красулина Н.А., Кокорина Ю.Л.// сборник материалов региональной конференции молодых ученых Актуальные вопросы экспериментальной и клинической онкологии. Томск, 2006. – С. 23-24
- Дорошенко А.В. Первые результаты применения интраоперационной лучевой терапии у больных раком молочной железы [текст] / Е. М.Слонимская, А. В.Дорошенко, Е. Ю. Гарбуков и др. // Маммология. - 2006. - N 4. - С. 69.
- Дорошенко А.В. Осложнения после проведения органосохраняющего лечения рака молочной железы с применением интраоперационной и дистанционной лучевой терапии [текст] / А. В.Дорошенко, Е. Ю.Гарбуков, Н. А. Красулина и др. // сборник материалов региональной конференции молодых ученых им. Академика РАМН Н. В. Васильева «Актуальные вопросы экспериментальной и клинической онкологии». - Томск, 2007. - С. 36-37.
- Дорошенко А.В. Острые лучевые реакции при комбинированном лечении с ИОЛТ и ДГТ больных раком молочной железы [Текст] : сборник научных трудов [текст] / Ю. Н. Струков, А. В. Дорошенко // Материалы научно-практической конференции «Профилактика и лечение злокачественных новообразований в современных условиях». – Барнаул, 2007. - С. 94-95.
- Дорошенко А.В. Интраоперационная лучевая терапия (ИОЛТ) при органосохраняющем лечении (ОСЛ) больных раком молочной железы (РМЖ) [текст] / Е. М. Слонимская, А. В. Дорошенко, Е. Ю. Гарбуков и др. // Материалы Одиннадцатого Российского онкологического конгресса. - Москва, 2007. - С. 139
- Дорошенко А.В. Осложнения после проведения органосохраняющего лечения рака молочной железы с применением интраоперационной и дистанционной лучевой терапии [текст] / А. В. Дорошенко, Е. Ю. Гарбуков, Н. А. Красулина и др. // Сибирский онкологический журнал. - 2007. - № 2. - С. 44-45.
- Дорошенко А.В. Сочетанная интраоперационная и дистанционная лучевая терапия в органосохраняющем лечении рака молочной железы [текст] /Е.М. Слонимская, А.В. Дорошенко, Е.Ю. Гарбуков и др. // Опухоли женской репродуктивной системы. - 2007. Т. 1. № 3. С. 26-28.
- Дорошенко А.В. Влияние различных видов органосохраняющих операции на длительность лимфореи у больных раком молочной железы [текст] / А. В. Дорошенко, Е. Ю. Гарбуков, Ю. Л. Кокорина, Н. А. Тарабановская // Сибирский онкологический журнал. - 2008. - N 1. - С. 41.
- Дорошенко А.В. Возможность выполнения одномоментной реконструкции при проведении органосохраняющих операций (ОСО) у больных раком молочной железы (РМЖ) с применением интраоперационной лучевой терапии (ИОЛТ): сборник научных трудов [текст] / Е. Ю. Гарбуков, Е. М. Слонимская, А. В. Дорошенко и др. // Сборник научных трудов Пятого съезда онкологов и радиологов СНГ. - Ташкент, 2008. - С. 231-232
- Дорошенко А.В. Возможность проведения органосохраняющего лечения у больных раком молочной железы с использованием неадъювантной химиотерапии и интраоперационной лучевой терапии [текст] / Е. Ю. Гарбуков, Е. М. Слонимская, А. В. Дорошенко, и др. // Сибирский онкологический журнал. - 2008. - N 2. - С. 33.
- Дорошенко А.В. Интраоперационная лучевая терапия (ИОЛТ) в органосохраняющем лечении рака молочной железы. Ближайшие и отдаленные результаты [текст] / Е. М. Слонимская, Дорошенко А. В. // Сибирский онкологический журнал. - 2008. - N 2. - С. 78-79.
- Дорошенко А.В. Непосредственные и отдаленные результаты органосохраняющего лечения РМЖ с применением ИОЛТ [текст] / А. В. Дорошенко, Е. М. Слонимская // Материалы 12 Российский онкологического конгресса.- Москва, 2008. - С. 156.
- Дорошенко А.В. Отдаленные результаты после проведения органосохраняющих операций с интраоперационной лучевой терапией у больных раком молочной железы [текст] / Дорошенко, А. В., Гарбуков, Е. Ю., Кокорина, Ю. Л., Красулин, Н. А. // Сибирский онкологический журнал. - 2009. - N 1. - С. 62-63.
- Дорошенко А.В. Сочетанная интраоперационная и дистанционная лучевая терапия при органосохраняющем лечении больных раком молочной железы [текст] / Е. М. Слонимская, А. В.Дорошенко, Е.Ю. Гарбуков и др.// Сибирский онкологический журнал. - 2009. - N 4. - С. 18-22.
- Дорошенко А.В. Органосохраняющие операции и интраоперационной лучевой терапией у больных раком молочной железы [текст] / А. В. Дорошенко, Е.М. Слонимская, Л.И. Мусабаева и др. // Сибирский онкологический журнал. - 2009. - N 2. - С. 65.
- Дорошенко А.В. Пятилетние результаты органосохраняющего лечения больных раком молочной железы с применением интраоперационной лучевой терапии [текст] / А. В. Дорошенко [и др.] //
Материалы VII международной конференции "Проблемы диагностики и лечения рака молочной железы". СПб.- 2010. - С. 30-31 - Дорошенко А.В. Интраоперационная электронная терапия в комплексном лечении больных злокачественными новообразованиями [текст] / Л. И. Мусабаева, Е.М. Слонимская, Ж.А. Жогина и др. // Материалы 17-й Межрегиональной научно-практической конференции с международным участием, посвященной 60-летию организации онкологической службы в Якутии.- 2010. - С. 89-91.
- Дорошенко А.В. Результаты органосохраняющего лечения больных РМЖ T1-2 N0-1 M0 и смешанной лучевой терапии (ИОЛТ ДГТ) [текст] / Л. И. Мусабаева, Ж.А. Жогина, В.А. Лисин и др. // Сборник материалов 3 Евразийского конгресса по медицинской физике и инженерии. - М., 2010. - С. 316-317
- Дорошенко А.В. Интраоперационная лучевая терапия в комплексном лечении больных раком молочной железы T1-2N0-1M0 [текст] / Л. И. Мусабаева Е.М. Слонимская, Ж.А. Жогина и др.// Материалы VI съезда онкологов и радиологов стран СНГ. - Душанбе, 2010. - С. 151
- Дорошенко А.В. Интраоперационная электронная терапия в комплексном лечении больных злокачественными новообразованиями [текст] / Л. И. Мусабаева Е.М. Слонимская, Ж.А. Жогина и др. // Шестьдесят лет онкологической службе республики Тыва. - Кызыл, 2010. - С. 121-123
- Дорошенко А.В. Интраоперационная электронная и дистанционная гамма-терапия в органосохраняющем лечении больных раком молочной железы [текст] /Л.И. Мусабаева, Ж.А. Жогина, В.А. Лисин и др./Медицинская радиология и радиационная безопасность. -2010. - Т55. -№5. -С42-47.
Патенты и разрешения.
- Способ лечения рака молочной железы // Патент № 23728558, от 20.11.2009. Бюлл. № 2, от 20.11.2009 (по заявке № 2007129245, приоритет от 30.07.2007) (в соавт. со Слонимской Е.М., Мусабаевой Л.И., Лисиным В.А. и др.)
- Коллиматор для облучения мягких тканей и молочной железы // Патент № 71074, от 27.02.08 (по заявке № 2007129351/22, приоритет от 30.07.2007) (в соавт. со Слонимской Е.М., Мусабаевой Л.И., Лисиным В.А. и др.)
- Способ лечения рака молочной железы // Патент № 2349264, от 20.03.2009. Бюлл. № 8, от 20.03.2009 (по заявке № 2007129247, приоритет от 30.07.2007) (в соавт. со Слонимской Е.М., Мусабаевой Л.И., Лисиным В.А. и др.)
- Разрешение на применение новой медицинской технологии ФС № 2010/386 от 26.10.2010 // Комплексное лечение больных раком молочной железы с применением интраоперационной электронной и дистанционной гамма-терапии при органосохраняющих операциях (в соавт. с Мусабаевой Л.И., Жогиной Ж.А., Слонимской Е.М, Лисиным В.А.).

