Cовременные подходы к диагностике гиперпластических процессов эндометрия на основе молекулярно-биологических исследований
На правах рукописи
АСАТУРОВА
Александра Вячеславовна
CОВРЕМЕННЫЕ ПОДХОДЫ К ДИАГНОСТИКЕ ГИПЕРПЛАСТИЧЕСКИХ ПРОЦЕССОВ ЭНДОМЕТРИЯ НА ОСНОВЕ МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
14.03.02. –патологическая анатомия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2011
Работа выполнена в ФГУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздравсоцразвития России,
Учреждении Российской академии медицинских наук НИИ морфологии человека РАМН
Научный руководитель:
| Заслуженный деятель науки РФ, доктор медицинских наук, профессор | Н.И. Кондриков |
| Официальные оппоненты: | |
| Доктор медицинских наук, профессор | И.Н. Волощук |
| Доктор медицинских наук, профессор | Л.М. Михалева |
Ведущая организация:
Российский онкологический научный центр им. Н.Н. Блохина РАМН
Защита диссертации состоится «29» сентября 2011 года в 12 часов на заседании диссертационного совета (Д 001.004.01) Учреждении Российской Академии медицинских наук НИИ морфологии человека РАМН по адресу: 117418, г. Москва, ул. Цюрупы, д.3
С диссертацией можно ознакомиться в библиотеке Учреждения Российской Академии медицинских наук НИИ морфологии человека РАМН
Автореферат разослан «__» __________ 2011 г.
| Ученый секретарь Диссертационного Совета Доктор медицинских наук | Л.П. Михайлова |
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Гиперплазия эндометрия (ГЭ) представляет собой гетерогенную группу патологических изменений слизистой тела матки, часть которых является предшественником аденокарциномы эндометрия (АКЭ).
Актуальность проблемы диагностики и лечения ГЭ в настоящее время связана с ростом заболеваемости гиперплазии эндометрия и аденокарциномы. ГЭ диагностируется у 6 - 50% женщин (Насырова И. Н., 2007; Чернуха Г.Е.; 2009; Кузнецова И.В., 2010), а заболеваемость АКЭ составляет более 24,8 на 100 000 человек (Табакман Ю.Ю., 2009). По данным патологоанатомического отделения Научного центра акушерства, гинекологии и перинатологии за последние 5 лет также наблюдался рост заболеваемости ГЭ (для простой ГЭ - с 45 случаев до 72, для сложной ГЭ – с 10 до 29, для простой атипической – с 4 до 7, для сложной атипической с 5 до 18), а также АКЭ (с 3 до 8 случаев). При этом известно, что риск развития АКЭ на фоне ГЭ выше, чем в популяции, и он увеличивается с усилением тяжести ГЭ. Таким образом, выявление ГЭ на ранних этапах развития является одним из главных мероприятий, позволяющих снизить заболеваемость и выживаемость при АКЭ. Кроме того, актуальность проблемы связана с нередким рецидивирующем течением ГЭ, дифференциально-диагностическими трудностями, возникающими в отношении некоторых вариантов данной патологии, а также большим числом женщин репродуктивного возраста, страдающих ГЭ и нуждающихся в сохранении репродуктивной функции.
Известно, что «золотым стандартом» диагностики ГЭ является гистологическое исследование, однако эффективность верификации ГЭ остается невысокой. В настоящее время в качестве наиболее эффективных методов улучшения диагностики ГЭ рассматриваются модификация действующей классификационной системы (ВОЗ, 2003) и внедрение в практику молекулярных и иммуногистохимических (ИГХ) методов исследования.
На основании нескольких крупных исследований, проведенных в Европе и США (Skov B., 1997; Bergeron C. 1999; Zaino R., 2006; Narges I., 2009) показано, что наиболее приемлемым было бы введение двух групп вместо четырех, что не только облегчило бы диагностику среди патологов и повысило бы воспроизводимость их диагнозов, но и привело бы к улучшению взаимопонимания между клиницистами и патологами, в большей мере структурировало бы тактику ведения пациенток с ГЭ.
В настоящее время известно, что экспрессия маркеров, которые предложены для улучшения диагностики ГЭ, изменяется уже на ранних этапах канцерогенеза (при развитии ГЭ без атипии), хотя наиболее выраженной она становится при атипической ГЭ. Согласно данным литературы, при развитии предраковых состояний слизистой тела матки изменяется экспрессия рецепторов к стероидным гормонам, генов-супрессоров опухолевого роста (PTEN, p53), генов-регуляторов клеточного цикла (Cyclin Dl), факторов роста (IGF I, EGF) и их рецепторов, вторичных мессенджеров сигнальных путей (PI3K, Akt) (Lax S., 2007; Banzal N.,2009; Llobet D., 2009). Также установлено, что при прогрессии ГЭ изменяется пролиферативная активность клеток и их запрограммированная гибель (Risberg B., 2002; Altaner S., 2006;Horre N., 2007). Однако, эффективность применения отдельных маркеров и их сочетаний для диагностики ГЭ все еще остается недостаточно изученной, как и молекулярно-биологические механизмы, которые способствуют развитию ГЭ без атипии, атипической ГЭ и АКЭ.
Цель исследования состояла в улучшении диагностики гиперпластических процессов и предраковых состояний эндометрия на основании модификации действующей классификационной системы гиперплазии эндометрия (ВОЗ, 2003) и молекулярно-биологические аспектов ее патогенеза
Для осуществления цели были поставлены следующие задачи:
1. Определить воспроизводимость современной классификации гиперплазии эндометрия (ВОЗ, 2003).
2.Определить воспроизводимость модифицированной бинарной классификационной системы гиперплазии эндометрия.
3. Изучить показатели экспрессии рецепторов к стероидным гормонам и соотношение процессов пролиферации и апоптоза при различных формах гиперплазии эндометрия и аденокарциномы эндометрия.
4. Изучить экспрессию компонентов сигнального пути рецептора к инсулиноподобному фактору роста первого типа (PTEN, IGF I и его рецептор) на разных этапах канцерогенеза в эндометрии.
5. Сравнить экспрессию иммуногистохимических маркеров в различных вариантах гиперплазии эндометрия, выяснить молекулярно-биологические особенности канцерогенеза в эндометрии и на их основании предложить диагностическую панель гиперплазии эндометрия.
Научная новизна.
Впервые оценена воспроизводимость бинарной системы классификации ВОЗ, предполагающей объединение простой и сложной ГЭ без атипии, а также простой и сложной атипической ГЭ. Установлены молекулярно-биологические особенности вариантов ГЭ и АКЭ и на их основе разработаны механизмы канцерогенеза в эндометрии. Выявлены достоверные различия в экспрессии рецепторов к стероидным гормонам между гиперпластическими изменениями и предраковыми состояниями слизистой тела матки, а также отмечено более плавное усиление процессов пролиферации, а также резкое снижение апоптоза при предраковых состояниях слизистой тела матки. Отмечается важная роль снижения апоптоза при увеличении тяжести ГЭ по сравнению с усилением интенсивности процессов пролиферации. Впервые показано, что совместное определение числа PTEN-позитивных эндометриальных желез, интенсивности экспрессии PTEN и локализации его распределения повышает эффективность диагностики патологических изменений в слизистой тела матки. Выделены группы маркеров, экспрессия которых коррелирует друг с другом и таким образом повышает чувствительность применения предложенной диагностической иммуногистохимической (ИГХ)-панели для верификации ГЭ.
Практическая значимость
Применение модифицированной (бинарной) классификации ГЭ позволяет существенно повысить воспроизводимость патологоанатомических диагнозов и оптимизировать тактику ведения пациенток с ГЭ клиническими специалистами.
Использование ИГХ-панели, включающей определение рецепторов к стероидным гормонам, Ki-67, Bcl-2, PTEN и рецептора к IGF-I дает возможность более точно верифицировать варианты ГЭ. Снижение экспрессии ER-, PgR, Ki-67, Bcl-2, PTEN по сравнению с неизмененным эндометрием характерно для о ГЭ низкой степени тяжести; усиление экспрессии ER-, Ki-67, Bcl-2, IGF-IR и снижение экспрессии PgR и PTEN по сравнению с доброкачественными изменениями слизистой тела матки– свидетельствует о ГЭ высокой степени риска развития АКЭ.
Результаты исследования могут быть использованы в педагогическом процессе в соответствующих разделах курсов патологической анатомии и гинекологии для студентов медицинских ВУЗов и в постдипломном обучении патологоанатомов и гинекологов.
Положения выносимые на защиту
- Воспроизводимость современной классификации (ВОЗ, 2003), выделяющей четыре варианта гиперплазии эндометрия, существенно ниже (на 18%), чем предполагающей выделение двух вариантов гиперплазии эндометрия бинарной модифицированной классификационной системы, что позволяет рекомендовать последнюю для улучшения эффективности диагностики ГЭ.
- Гиперплазия эндометрия без атипии отличается от атипической гиперплазии эндометрия рецептивностью слизистой тела матки в отношении стероидных гормонов: атипической гиперплазии эндометрия свойственна повышенная экспрессия эстрогеновых рецепторов типа альфа и снижение экспрессии прогестероновых рецепторов. При развитии аденокарциномы эндометрия отмечается снижение экспрессии как эстрогеновых, так и прогестероновых рецепторов.
- Гиперпластически измененная слизистая тела матки, предраковые состояния эндометрия и аденокарцинома эндометрия отличаются между собой нарушениями баланса между процессами пролиферации и апоптоза.
- Развитие последовательных стадий канцерогенеза в эндометрии сопровождается нарушением регуляции сигнального пути рецептора к инсулиноподобному фактору роста первого типа, что выражается в:
- постепенном снижение экспрессии опухолевого супрессора PTEN от простой к сложной гиперплазии эндометрия и далее к атипической гиперплазии эндометрия и аденокарциноме эндометрия, уменьшении интенсивности окрашивания, а также в изменении локализации экспрессии PTEN с ядерной, характерной для нормальной слизистой тела матки и гиперплазии эндометрия на цитоплазматическую в клетках аденокарицномы эндометрия,
- отсутствии различий в экспрессии инсулиноподобного фактора роста первого типа между вариантами гиперплазии эндометрия и усилении его экспрессии при аденокарциноме эндометрия по сравнению с атипической гиперплазией эндометрия,
- усилении экспрессии рецептора к инсулиноподобному фактору роста первого типа при атипической гиперплазии эндометрия по сравнению с гиперплазией эндометрия без атипии.
Апробация работы
Материалы и основные положения диссертации были доложены и обсуждались на V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» (май 2008), X международном форуме «Мать и дитя» (Москва, октябрь 2009), IV международном конгрессе по репродуктивной медицине (январь 2010), межлабораторной концеренции Учреждения Российской академии медицинских наук «Научно-исследовательский институт морфологии человека РАМН» (ноябрь 2010).
Публикации
По материалам диссертации опубликовано 10 печатных работ, из них 3 в журналах, рекомендованных ВАК РФ.
Объем и структура диссертации
Работа состоит из введения, обзора литературы, описания материала и методов исследования, изложения результатов исследования и их обсуждения, заключения, выводов и списка литературы. Работа содержит 115 страниц машинописного текста, а также 27 страниц списка литературы. В работе приведены 22 таблицы, 9 гистограмм, 15 рисунков. Список литературы содержит 253 источника, в том числе 35 отечественных.
СОДЕРЖАНИЕ РАБОТЫ
Материал и методы. Для исследования были использованы 60 образцов эндометрия, полученного при выскабливании слизистой тела матки у женщин в возрасте от 18 до 60 лет, средний возраст 41,5. При их гистологическом исследовании диагностированы: нормальная слизистая тела матки стадии пролиферации (n=12) и секреции (n=10), простая (n=8) и сложная ГЭ (n=8), простая атипическая (n=6) и сложная атипическая ГЭ (n=8), АКЭ (n=8). Гистологические препараты были дважды пересмотрены ведущими патологами профильных лечебных учреждений г. Москвы с использованием классификации ВОЗ (2003) и модифицированной бинарной классификации, согласно которой простая и сложная ГЭ составили группу ГЭ низкой степени тяжести патологического процесса, а простая и сложная атипическая ГЭ – высокой степени тяжести (риска развития АКЭ). Исследуемые образцы эндометрия (гистологические препараты) явились основой для оценки воспроизводимости обеих классификаций. Для иммуногистохимического исследования были отобраны 50 образцов с эндометрием стадии пролиферации (n=12), простой ГЭ (n=8), сложной ГЭ (n=8), атипической ГЭ (n=14), АКЭ (n=8). Средний возраст пациенток составил 44,7 лет (=5,3).
Материал для исследования ИГХ методами фиксировали в 10% нейтральном формалине течение 24 ч., заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и высушивали при температуре 37°С в течение 18 часов. Восстановление антигенной активности проводили в миниавтоклаве «2100Retrieval» («Pick Cell») при температуре 121°С в течение 20 мин. с последующим остыванием на протяжении 90 мин. Остывшие стекла помещали во влажные камеры (для предотвращения высыхания срезов) и инкубировали 15 мин. с 3% раствором перекиси водорода. Восстановление проводили в цитратном буфере с рН 6,0. В качестве детекционной системы применяли систему «EnVision» («Dako Cytomation»), в качестве хромогена – диаминобензидин (LSAB, Dako Cytomation) и АЕС (LSAB, Dako Cytomation). Для получения результатов пригодных для количественной обработки реакции проводили с помощью автоматического иммуногистостейнера «Autosteiner Dako».
Для ИГХ-реакций ставили положительные (в соответствии с рекомендациями фирмы-производителя) и отрицательные (без первичных антител) контроли.
Для оценки показателя воспроизводимости диагнозов были применены следующие критерии: 0,00-0,20–очень низкая, 0,21-0,40–низкая, 0,41-0,60–средняя, 0,61-0,80–высокая, 0,81-1,00–очень высокая; для конкордантности: 0-20%-очень низкая, 21-40%-низкая, 41-60%-средняя, 61-80%-высокая, 81-100%-очень высокая.
Оценка результатов ИГХ-исследования проводилась несколькими способами: интенсивность реакций с цитоплазматической экспрессией (Bcl-2, IGF I, IGF-IR, PTEN) оценивали полуколичественным способом по балльной шкале от О до 3 (0-отсутсвие экспрессии, 1-слабая экспрессия, 2 – умеренная экспрессия, 3 – сильная экспрессия), экспрессию Ki 67 – методом подсчета количества окрашенных ядер на 100 клеток в 3 полях зрения, результат выражали в процентах и оценивали по стандартной шкале. Экспрессию рецепторов к стероидным гормонам определяли с помощью вычисления показателя H-score, рассчитанного по формуле: H-score=1а+2b+3c, где а – процент клеток со слабо окрашенным ядром, b- с умеренной окраской ядра и с – с интенсивной окраской ядра среди 500 клеток. Оценку H-score производили по следующей шкале: 0-50 баллов – отрицательная, 51-100 баллов – низкая, 101-200 баллов – умеренная, 201-300 баллов – высокая экспрессия. Определяли также локализацию экспрессии PTEN (ядерная или цитоплазматическая), интенсивность экспрессии и процент наблюдений, в которых экспрессия маркера отмечалась в эпителиальных клетках более чем в половине маточных желез.
Статистическую обработку результатов исследования проводили с помощью пакета программного обеспечения Statistica 6.0 (StatSoft Inc., США). Для определения воспроизводимости диагнозов использовали вычисление взвешенной каппы Коэна и ее стандартной ошибки. Для обработки результатов ИГХ исследований и выявления корреляционных связей использовали непараметрические критерии: критерий Крускала-Уоллиса и коэффициент ранговой корреляции Спирмена.
При оценке достоверности выявленных различий между средними значениями выборок и достоверности выявленной корреляции рассчитывали параметр р, вероятность справедливости нулевой гипотезы была принята равной 5% (р < 0,05)
Результаты собственного исследования и их обсуждение
Оценка воспроизводимости диагнозов ГЭ
В результате пересмотра отобранных гистологических препаратов патологами экспертной группы и сравнительной оценки поставленных ими диагнозов оказалось, что степень тяжести патологического процесса по итоговой панели диагнозов выше, чем при оценке тех же препаратов каждым из исследователей, при этом всего из 60 диагнозов полное согласие патологов наблюдалось в отношении 31, в остальных случаях один или два патолога ставили либо более легкий диагноз (24 препарата), либо более тяжелый (9 препаратов). При этом согласие патологов при попарном сравнении было более высоким (на 8% между А и В, на 23% между А и Б и на 23% между Б и В.).
Показатель воспроизводимости диагнозов по классификации ВОЗ между исследователями А и В был равен 0,57, между А и Б – 0,60, между Б и В – 0,61. Среднее значение для данной классификации составило 0,59. Показатель воспроизводимости диагнозов по модифицированной классификации между исследователями А и В был равен 0,68, между А и Б – 0,74, между Б и В – 0,74. Среднее значение для данной классификации составило 0,72. Сравнительная оценка воспроизводимости обеих классификаций представлена на рис. 1.
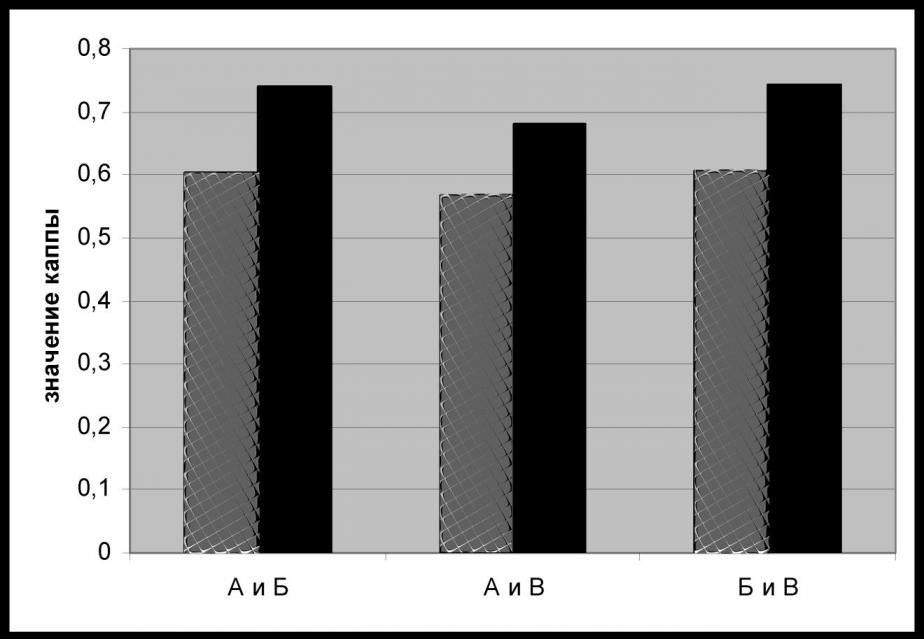
Рис.1 Воспроизводимость диагнозов ГЭ по классификации ВОЗ (![]() ) и модифицированной (бинарной) классификации (
) и модифицированной (бинарной) классификации (![]() ). (А, Б, В – исследователи).
). (А, Б, В – исследователи).
Полученные нами результаты в первой части исследования показывают, что воспроизводимость диагнозов, поставленных с использованием классификации ВОЗ (1994) находится на невысоком уровне. Особенно это касается сложной ГЭ и простой атипической ГЭ (средние значения конкордантности 26% и 7%, соответственно). Эти данные согласуются с результатами, которые были получены другими исследователями при изучении воспроизводимости диагнозов по данной классификации, показатель которой был оценен как низкий (Skov B, 1997) или средний (Bergeron C. 1999; Zaino R., 2006; Narges I., 2009). Следует отметить, что в некоторых исследованиях показатель воспроизводимости классификации ВОЗ был достаточно высоким (Kendall S., 1998; Sherman M., 2008; Horn L., 2004). Однако большинство исследователей придерживаются мнения, что современная классификация нуждается в реформации. Для ее улучшения предлагаются различные наименования, указывается на целесообразность введения двух классификационных групп вместо четырех. Проверка воспроизводимости модифицированной (бинарной) классификации как в нашем, так и в других схожих по дизайну исследованиях (B. Skov, 1997, C. Bergeron, 1999), привела к существенному повышению показателя воспроизводимости гистологического диагноза. Кроме того, такой подход позволяет устранить необходимость верификации простой атипической ГЭ, воспроизводимость которой в нашем исследовании была самой низкой (7%). На трудности в постановке данного диагноза указывают и другие исследователи (N. Terakawa, 1997; S. Kendall, 1997; О.Ф. Чепик, 2005), включая автора классификации ВОЗ (S. Silverberg, 2003). Однако, несмотря на полученные результаты, свидетельствующие об эффективности бинарной классификации, существуют и иные взгляды в отношении пересмотра классификации ВОЗ. Они обусловлены тем, что часто наблюдается ошибочная постановка и смешение диагнозов, которые в модифицированной системе отнесены к разным группам (в нашем исследовании это относится к сложной ГЭ, которую часто диагностировали как сложную атипическую ГЭ и наоборот), а также недостаточной согласованностью модифицированной классификации с классификациями Международной федерации гинекологов и акушеров (FIGO) (Prat J., 2004). Тем не менее, в условиях необходимости четкого понимания гистологического диагноза клиницистами и отсутствия единых критериев, которые регламентировали бы постановку диагноза ГЭ в рамках существующей классификации, на наш взгляд бинарная система, хотя и не лишенная недостатков, в настоящее время имеет определенные преимущества.
Иммуногистохимическое исследование гиперпластических изменений и предраковых состояний эндометрия.
- Иммуногистохимические показатели экспрессии рецепторов к стероидным гормонам представлены в таблице.
Таблица. Показатель H-score экспрессии ER- и PgR в неизмененной и патологически измененной слизистой тела матки.
| H-score ( в баллах) | Эндометрий стадии пролифера-ции | ГЭ ГЭ | АКЭ | |||
| Простая | Сложная | Атипическая | ||||
| ER- | Железистый эпителия | 270,0±14,3 | 219,5±10,9* | 215,4±13,2 | 256,6±20,0* | 193,7±9,3* |
| Строма | 216,2±8,7 | 177,0±9,3* | 171,8±7,7 | 207,9±11,2* | 150,1±8,3* | |
| PgR | Железистый эпителий | 292,2±10,9 | 273,0±13,3* | 270,1±12,4 | 245,2±11,1* | 219,3±10,2* |
| Строма | 278,1±9,9 | 252,3±11,3* | 253,8±10,0 | 228,7±9,1* | 182,4±11,4* | |
*-достоверность различий (p<0, 05)
Экспрессия рецепторов к стероидным гормонам отмечалась в ядрах клеток железистого эпителия эндометрия, притом уровень экспрессии был высоким или умеренным. Экспрессия эстрогеновых и прогестероновых рецепторов в плоскоклеточных морулах отсутствовала. Согласно данным литературы, достоверные различия в экспрессии рецепторов к стероидным гормонам обнаружены между нормальным эндометрием, ГЭ и АКЭ (Самойлова А.В., 2009; Bircan S,, 2005; Witek A., 2007) или между нормальным эндометрием и эндометрием с признаками неоплазии (Т.В. Шигорева, 2008; Fukuda K., 1998; Snchez Anguiano L., 2007). Однако достоверные различия выявлены также между ГЭ без атипии и атипической ГЭ. Различия в отношении рецепторов к стероидным гормонам между всеми группами были статистически значимыми (p<0,05), за исключением простой и сложной ГЭ (p>0,05). Этот факт может быть объяснен использованием показателя H-score, позволяющего учитывать не только число окрашенных ядер клеток, но и интенсивность экспрессии маркера в них. Кроме того, H-score характеризуется значительным интервалом баллов (от 0 до 300 баллов вместо обычно используемых от 0 до 3). Исходя из полученных нами данных, можно предположить, что хотя определение экспрессии рецепторов к стероидным гормонам и не позволяет различать варианты ГЭ, их нельзя исключить из потенциальных маркеров в диагностической панели для верификации ГЭ. Кроме того, значение определения рецепторов к стероидным гормонам возрастает при исследовании образцов эндометрия с использованием модифицированной (бинарной) классификации, так как экспрессия эстрогеновых и прогестероновых рецепторов достоверно отличается при атипической ГЭ от аналогичных показателей при ГЭ без атипии, а по бинарной системе простая и сложная ГЭ, при которых достоверных отличий в экспрессии данных маркеров не было обнаружено, объединяются в одну диагностическую группу. Нельзя забывать и о большом значении ИГХ исследований рецепторов к стероидным гормонам как маркеров-показателей эффективности лечения ГЭ.
- Результаты ИГХ-исследования процессов пролиферации и апоптоза в слизистой тела матки стадии пролиферации, при ГЭ и АКЭ на основании экспрессии Ki-67 и Bcl-2 представлены на рисунке 2.
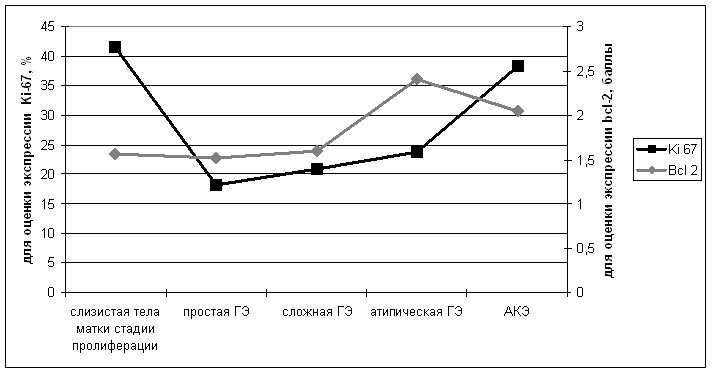
Рис. 2. Показатели пролиферативной активности (Ki 67) и апоптоза в неизмененном и патологически измененном эндометрии (Bcl 2).(1-слизистая тела матки стадии пролиферации, 2 – простая ГЭ, 3-сложная ГЭ, 4 – атипическая ГЭ, 5 – АКЭ)
Наиболее интенсивная экспрессия Ki-67 отмечалась в неизмененной слизистой тела матки. При ГЭ экспрессия данного маркера была ниже, хотя и имела тенденцию к возрастанию с увеличением ее тяжести. Статистически значимые различия между вариантами ГЭ отсутствовали. Достоверная разница в отношении экспрессии Ki-67 наблюдалась между слизистой тела матки стадии пролиферации и вариантами ГЭ, а также между атипической ГЭ и АКЭ (p<0,05). Статистически значимые различия в экспрессии Bcl-2 наблюдались между сложной ГЭ и атипической ГЭ, а также между атипической ГЭ и АКЭ (р<0,05). Другими словами, установленная тенденция к повышению пролиферативного индекса по мере увеличения тяжести ГЭ. Это согласуются с молекулярно-биологическими особенностями, лежащими в основе развития патологического процесса, которые известны нам из литературы и были установлены при проведении настоящего исследования (усиление реализации IGF-I контролируемых сигнальных путей (MAPK-киназного и Akt/PI3K-зависимых), снижение экспрессии PTEN и повышение экспрессии ER-). Однако отсутствие статистической значимости в повышении экспрессии Ki-67 от простой ГЭ к сложной ГЭ и атипической ГЭ не позволяет рекомендовать определение данного маркера без совместного использования других, в частности, характеризующих процессы апоптоза. Что же касается экспрессии Bcl-2, то более выраженная его экспрессия при атипической ГЭ по сравнению с другими вариантами ГЭ позволяет предположить, что при развитии атипической ГЭ на фоне ГЭ без атипии существенное значение имеет не усиление процессов пролиферации, а уменьшение гибели клеток путем апоптоза. Таким образом, результаты исследования экспрессии Ki-67 и Bcl-2, особенно с использованием модифицированной (бинарной) классификации, при которой наиболее значимыми являются достоверные различия между атипической ГЭ, ГЭ без атипии и АКЭ, позволяют предложить совместное использование Ki-67 и Bcl-2 в качестве диагностических маркеров функционального состояния эндометрия.
- Иммуногистохимическое исследование экспрессии компонентов IGF-IR-зависимого сигнального пути.
Супрессор опухолевого роста PTEN. Экспрессия фосфатазы PTEN выявлялась преимущественно в ядрах клеток железистого эпителия и стромы эндометрия. В PTEN – положительных образцах с морфологическими признаками АКЭ отмечалась окраска цитоплазмы. В атипической ГЭ экспрессия PTEN была достоверно ниже (p<0,05), чем при других вариантах ГЭ. Экспрессия PTEN была статистически значимой между неизмененной слизистой тела матки, простой и сложной ГЭ и атипической ГЭ (р < 0,05), различия между атипической ГЭ и АКЭ отсутствовали. Интенсивность окрашивания была наибольшей в неизмененной слизистой тела матки и постепенно снижалась в патологически измененном эндометрии, наименьшая интенсивность окрашивания наблюдалась в АКЭ. (рис. 3).
Иммунореактивность PTEN была гетерогенной, некоторые эпителиальные клетки в железах, а также отдельные железы при сложной ГЭ и атипической ГЭ были негативными в отношении PTEN.
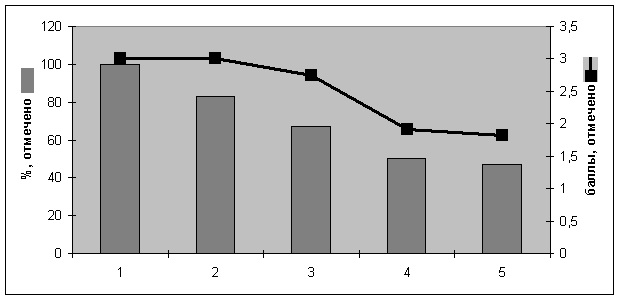
Рис. 3. Иммуногистохимическая экспрессия PTEN в неизмененном и патологически измененном эндометрии).(1-слизистая тела матки стадии пролиферации, 2 – простая ГЭ, 3-сложная ГЭ, 4 – атипическая ГЭ, 5 – АКЭ)
Результаты нашего исследования, связанные со снижением экспрессии PTEN на ранних этапах канцерогенеза в эндометрии, согласуются с данными о наиболее распространенной мутации гена PTEN при ГЭ (M. Sherman, 2000; J. Hecht, 2006; S. Lax, 2007; N. Banzal, 2009,). Достоверные различия в проценте эндометриальных желез, экспрессирующих PTEN и интенсивности его экспрессии позволяет рекомендовать данный маркер в качестве одного из основных для верификации ГЭ. Кроме того, была отмечена важная особенность экспрессии PTEN при АКЭ. В отличие от ГЭ, при которой экспрессия PTEN наблюдается преимущественно в ядрах клеток, при АКЭ она отмечается в цитоплазме. Эти данные отражают особенности канцерогенеза в эндометрии, так как усиление пролиферации (при АКЭ экспрессия Ki-67 была достоверно выше (p<0,05), чем при атипической ГЭ) приводит к увеличению активно делящихся неопластических клеток, находящихся в S–фазе, в которых усиливается цитоплазматическая экспрессия PTEN. Последнее может служить дополнительным источником информации при дифференциальной диагностике ГЭ и АКЭ.
Особое внимание следует уделить тем случаям, которые были диагностированы как простая и сложная ГЭ, не имели признаков атипии и имели высокую экспрессию PTEN, но, тем не менее, в данных образцах эндометрия выявлялись отдельные железы без экспрессии маркера. Учитывая тот факт, что такие патологические процессы связаны с повышенной эстрогенной стимуляцией эндометрия, а также эпидемиологические исследования об увеличении риска прогрессии их в АКЭ в 3-7 раз (W. Finkle, 1995; P. Kenemans, 2005,) можно предположить, что эпителиальные клетки этих желез могут стать источником моноклонального предракового поражения.
IGF I и IGF-IR. Экспрессия IGF I и IGF-IR в эндометрии была представлена окрашиванием цитоплазмы клеток. Наиболее выраженное окрашивание IGF I наблюдается в нормальном эндометрии стадии пролиферации. В гиперплазированном эндометрии экспрессия IGF I была ниже, чем в нормальном, и значительно увеличивалась при АКЭ. Статистически значимые различия в отношении экспрессии IGF I были выявлены между атипической ГЭ и АКЭ (p<0,05), она отсутствовала между вариантами ГЭ и эндометрием стадии пролиферации (рис. 4, А). Экспрессия IGF-IR в последнем и в гиперпластически измененной слизистой тела матки была слабой или умеренной, наиболее сильное окрашивание наблюдали в атипической ГЭ и АКЭ. Статистически значимые различия обнаружены только между экспрессией IGF IR в сложной ГЭ и атипической ГЭ (p<0,05) (рис 4, Б).
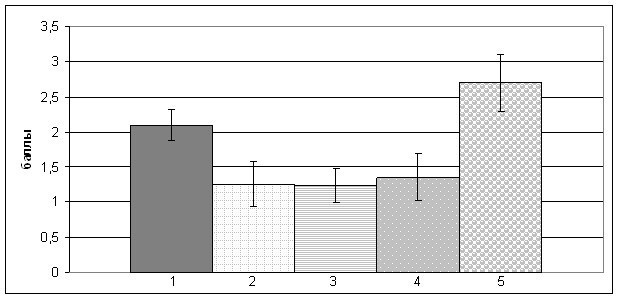
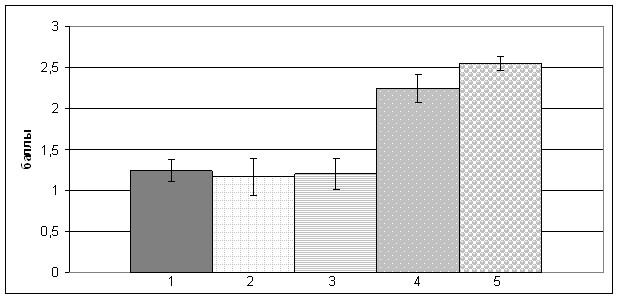
Рис.4. Иммуногистохимическая экспрессия IGF I (А) и IGF-IR (Б)
неизмененном и патологически измененном эндометрии. (* p4-5<0,05, ** р3-4 <0,05).
Несмотря на то что механизмы регуляции и действия IGF I, его высокая аффинность к IGF IR, эстрогеновая зависимость и многие другие аспекты позволяли предположить, что IGF I может стать одним из маркеров выбора в диагностике ГЭ, достоверных различий в экспрессии IGF I между вариантами ГЭ выявлено не было. В то же время экспрессия IGF IR была статистически выше при атипической ГЭ по сравнению с ГЭ без атипии (p<0,05), сохраняется и выраженная тенденция в усилении экспрессии данного маркера и при АКЭ. Это согласуется с представлениями о нарушении механизмов обратной связи в регуляции осуществляемых через IGF IR сигнальных путей, и со снижением экспрессии PTEN, который имеет основное значение в регуляции синтеза вторичных мессенжеров IGF-IR зависимого пути. Нельзя исключить, что изучение компонентов данного сигнального пути в будущем имеет большой потенциал для поиска как диагностических, так и прогностических маркеров для ГЭ.
Таким образом, рекомендовать к включению в диагностическую панель IGF I не представляется возможным, поскольку его экспрессия между различными вариантами ГЭ достоверно не различалась. Выявленное нами и другими исследователями (Чернышова А.Л., 2009; Maiorano, E., 1999;) повышенная экспрессия IGF I в АКЭ, позволяет предположить, что при развитии неопластического процесса нарушается регуляция экспрессии
IGF I, осуществляемая различными агентами на более ранних этапах реализации сигнального пути IGF-IR и влияющими на экспрессию IGF I по механизму обратной связи.
Что касается маркера IGF-IR, то достоверные различия в его экспрессии между ГЭ без атипии и с атипией согласуются с предложенной нами бинарной классификацией ГЭ, что является молекулярно-биологическим обоснованием для выделения ГЭ с низкой и высокой степенями тяжести патологического процесса. В связи с этим целесообразность определения экспрессии IGF-IR в диагностической панели ГЭ не вызывает сомнений.
Таким образом, в предлагаемую нами диагностическую панель предраковых состояний эндометрия следует включить определение рецепторов к стероидным гормонам (ER, PgR), маркеров пролиферации и апоптоза (Ki-67, Bcl-2), компонентов IGF-IR-зависимого сигнального пути (PTEN и IGF-IR). Следует отметить, что компоненты предложенной нами диагностической панели не только охватывает «серые зоны», представляющие трудности при верификации различных вариантов ГЭ, но и включает различные звенья единой цепи развития патологического процесса в эндометрии.
На основании полученных данных можно заключить, что изменение экспрессии исследуемых маркеров в зависимости от морфологической картины патологического процесса в эндометрии, являются молекулярно-биологическим основанием для введения модифицированной бинарной системы, поскольку предложенные к объединению варианты ГЭ, принятые в настоящее время, имеют близкие молекулярно-биологические характеристики (рис. 6)


ВЫВОДЫ
- Воспроизводимость классификационной системы гиперплазии эндометрия ВОЗ (2003) находится на среднем уровне (=0,59). Для бинарной модифицированной системы, которая предполагает объединение простой и сложной гиперплазии эндометрия в поражения с низкой степенью тяжести патологического процесса и простой и сложной атипической гиперплазии эндометрия в поражения высокой степени тяжести (риска развития аденокарциномы эндометрия), данный показатель был высоким (=0,74). Это отражает большую эффективность диагностики гиперплазии эндометрия с использованием последней.
- Развитие атипической гиперплазии эндометрия сопровождается усилением экспрессии эстрогеновых рецепторов типа альфа и снижением экспрессии прогестероновых рецепторов, что является следствием митогенных и мутагенных эффектов эстрадиола и обусловлено накоплением генетических мутаций в сигнальных путях внегормональной регуляции синтеза стероидных гормонов.
- Гиперпластические изменения слизистой тела матки, предраковые состояния эндометрия и аденокарциномы эндометрия отличаются нарушением баланса между процессами пролиферации и апоптоза. Сочетанное исследование обоих маркеров позволяет составить представление о функциональном состоянии эпителиального компонента в патологически измененном эндометрии.
- Снижение экспрессии фосфатазы PTEN приводит к нарушению функционирования сигнального пути рецептора к инсулиноподобному фактору роста I типа, усилению процессов пролиферации, снижению апоптоза, нарушению дифференцировки клеток эндометрия с повышением степени тяжести патологического процесса в слизистой тела матки.
- Одним из дифференциально-диагностических признаков, позволяющих отличить предраковые состояния эндометрия от аденкарциномы эндометрия может служить особенность распределения PTEN в патологически измененной ткани: для гиперпластического процесса характерна ядерная локализация, для аденокарциномы эндометрия - цитоплазматическая.
- Отличие гиперплазии эндометрия без атипии от атипической гиперплазии эндометрия характеризуется повышением экспрессии рецептора к инсулинопобному фактору роста I типа (IGF-IR), а атипической гиперплазии от аденокарциномы эндометрия – повышением экспрессии инсулинопобного фактора роста I типа, что свидетельствует о нарушении регуляции IGF-IR сигнального пути.
- Для улучшения качества диагностики гиперплазии эндометрия рекомендуется сформировать иммуногистохимическую панель, включающую следующие маркеры: эстрогеновый рецептор типа альфа, прогестероновый рецептор, Ki-67, Bcl-2, PTEN и рецептор к IGF-I.
- Каждый из этапов канцерогенеза в эндометрии характеризуется специфическим сочетанием молекулярно-биологических особенностей. Общность таковых для простой и сложной гиперплазии без атипии служит основанием для объединения этих двух форм в ГЭ низкой степени тяжести патологического процесса, в то время как атипическая гиперплазия представляет собой патологический процесс, характеризующийся высокой степенью риска развития аденокарциномы.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для диагностики ГЭ рекомендуется использовать модифицированную бинарную классификацию, на основании которой предполагается объединение простой и сложной ГЭ без атипии в поражение низкой степени тяжести, а простой и сложной атипической ГЭ в поражение высокой степени риска развития АКЭ.
- Для улучшения качества диагностики ГЭ рекомендуется использовать диагностическую ИГХ-панель, в которую должны быть включены рецепторы к стероидным гормонам (ER, PgR), маркеры пролиферации и апоптоза (Ki-67, Bcl-2), компоненты IGF-IR-зависимого сигнального пути (PTEN и IGF-IR).
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Г.Е. Чернуха, О.А. Могиревская, Т.В. Шигорева, А.В. Силакова (Асатурова). Внутриматочная левоноргестрел-рилизинг система: альтернативный подход к терапии различных форм гиперплазии эндометрия.// Сибирский онкологический журнал– 2007. - С. 110-115.
- Н. И. Кондриков, А.В. Силакова (Асатурова). Гиперпластические изменения предраковые состояния эндометрия: вопросы терминологии и классификации// Архив патологии – 2010. – Т. 72, №1 – С. 60-62
- Н.И. Кондриков, А.В. Асатурова, О.А. Могиревская, И.В. Баринова, А.И. Андреев, В.П. Нажимов. Воспроизводимость диагнозов гиперплазии эндометрия по классификации ВОЗ и по модифицированной (бинарной) классификации//Акушерство и гинекология – 2011. - №3 – С.42-46
- Силакова А.В. (Асатурова), Шигорева Т.В. Гиперплазии эндометрия при лечении ЛНГ-ВМС: эстрогеновые и прогестероновые рецепторы (иммуногистохимическое исследование).//Материалы V Конференции молодых ученых России с международным участием «Фундаментальные науки и прогресс клинической медицины» - М.: 2008 – С. 403
- Н.И.Кондриков, О.А.Могиревская, А.В.Силакова (Асатурова). Дискуссионные аспекты диагностики предраковых состояний эндометрия.// Материалы X юбилейного Всероссийского научного форума «Мать и Дитя» - М: 2009 - С. 330
- Н.И.Кондриков, О.А. Могиревская, А.В. Асатурова. Гиперпластические изменения эндометрия с плоскоклеточной метаплазией: иммуногистохимическое исследование экспрессии рецепторов к стероидным гормонам и маркеру пролиферацтивной активности Ki-67// Материалы IV международного конгресса по репродуктивной медицине – М: 2010 – С.192-193
- Е.А. Коган, Н.И. Кондриков, А.В. Асатурова, Н.М. Файзуллина, О.А. Могиревская. Экспрессия рецептора к инсулиноподобному фактору роста I типа и фосфатазы PTEN в нормальном эндометрии, при гиперплазии эндометрия и при эндометриоидной аденокарциноме (иммуногистохимическое исследование)//Материалы XI Всероссийского научного форума «Мать и Дитя» - М: 2010 - С. 401.
- Е.А. Коган, Н.И. Кондриков, А.В. Асатурова, О.А. Могиревская,. Н.М. Файзуллина. Определение экспрессии PTEN в качестве диагностического маркера в норме, при гиперплазии эндометрия и при аденокарциноме эндометрия (иммуногистохимическое исследование)// Материалы IV регионального форума «Мать и Дитя» - М: 2010 - С. 146.
- Asaturova AV, Mogirevskaya OA, Kondrikov. The efficacy of PTEN expression assessment in endometrial hyperplasia and other possible markers for endometrial precancerous identification and prediction//14th World Congress of gynecological endocrinology II. CD-abstract book (2010)
- E. Kogan, N. Faizullina, Z. Glinkina, T. Demura, A. Asaturova, L. Ezhova, O. Magirevskaya. Morphological, molecular and genetic characteristics of endometrial malignant transformation stages: endometrial hyperplasia(EH), intraepithelial neoplasia (EIN), endometrial adenocarcinoma (EAC)// Int. J. Gynecol. Cancer - 2010 – Vol. 20, Supp.2.(on-line version)
| Соискатель | А.В. Асатурова |

