Роль фетоплацентарной недостаточности в развитии гестоза
На правах рукописи
ГАСАНОВА САИДА РАБАЗАНОВНА
РОЛЬ ФЕТОПЛАЦЕНТАРНОЙ НЕДОСТАТОЧНОСТИ
В РАЗВИТИИ ГЕСТОЗА
14.01.01 – Акушерство и гинекология
АВТОРЕФЕРАТ
на соискание ученой степени
кандидата медицинских наук
Москва – 2011
Работа выполнена на кафедре акушерства и гинекологии факультета послевузовского профессионального образования врачей ГОУ ВПО «Первый Московский государственный медицинский университет им. И.М. Сеченова».
Научный руководитель:
доктор медицинских наук, профессор Макаров Игорь Олегович
Официальные оппоненты:
доктор медицинских наук, профессор Ляшко Елена Сергеевна
доктор медицинских наук Новикова Светлана Викторовна
Ведущее учреждение: ГОУ ВПО «Московский государственный медико-стоматологический университет».
Защита диссертации состоится «___ » _________2011 г. в ____ часов на заседании диссертационного совета Д 208.048.01 при ГУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии».
С диссертацией можно ознакомиться в библиотеке ГУЗ «Московский областной научно-исследовательский институт акушерства и гинекологии» по адресу: 101000, г. Москва, ул. Покровка, д. 22а.
Автореферат разослан «___» _____________ 2011 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Я.З. Зайдиева
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Фетоплацентарная недостаточность представляет собой одно из наиболее распространенных осложнений беременности. Несмотря на успехи современного акушерства и перинатологии, она занимает одно из ведущих мест в структуре перинатальной заболеваемости и смертности. Фетоплацентарная недостаточность также является одной из наиболее частых причин нарушения адаптации новорожденных. Плацентарная дисфункция, является основной причиной внутриутробной гипоксии плода и синдрома задержки роста плода (СЗРП),что обусловливает высокую заболеваемость новорожденных. Одним из важнейших патофизиологических механизмов формирования плацентарной недостаточности является плацентарная ишемия и генерализованная дисфункция эндотелия, приводящая к гиповолемии. При этом снижается перфузия органов с увеличением чувствительности сосудов к прессорным агентам, и с уменьшением поступления кислорода к плоду.
Первоначально снижение плацентарной перфузии имеет локальный характер, затем эндотелиальная дисфункция приобретает генерализованный характер, вызывая гипоксические изменения в органах, приводящие к образованию активных форм кислорода, активации перекисного окисления липидов, оксидантному стрессу, что является характерным для гестоза.
Частота фетоплацентарной недостаточности (ФПН) при гестозе составляет 22–67%. Клинические проявления фетоплацентарной недостаточности пропорциональны тяжести гестоза. Так, СЗРП при легкой, среднетяжелой и тяжелой степенях гестоза встречается соответственно в 16,2, 46,8 и 62%, а гипоксия плода, соответственно в 39,5, 58,3 и 71,4% наблюдений. Антенатальная гибель плода имеет место у 29,6% беременных с гестозом (Сидорова И.С., 2008; Стрижаков А.Н., 2009).
С другой стороны, ФПН играет важную роль в развитии гестоза. В основе данной проблемы лежит нарушение инвазии цитотрофобласта. Большинство исследователей считают, что гестоз – это реакция системного воспалительного ответа в результате поражения эндотелия и эндотелиальной дисфункции (В.Н. Серов, 2006; М.А. Репина, 2005; И.С. Сидорова, 2003, Л.А Иванова, 2003; Н.Н. Петрищев, 2003).
До настоящего времени четко не определена взаимосвязь между проницаемостью гематоэнцефалического и плацентарного барьеров, что позволило бы выделить основные патогенетические звенья развития фетоплацентарной недостаточности и гестоза. В этой связи предоставляется целесообразным определение маркеров проницаемости этих структур.
Отсутствует также единство взглядов на ведение беременных с данной патологией, особенно с точки зрения состояния фетоплацентарной системы. Актуальным остается изучение адаптационных и компенсаторных изменений в плаценте на ультраструктурном уровне с последующей разработкой подходов к коррекции этих процессов. В соответствии с изложенным, актуальность изучения особенностей течения беременности при гестозе и фетоплацентарной недостаточности, перинатальных исходов при данной патологии, а также с разработка адекватной акушерской тактики, комплексной диагностической программы, оптимальных сроков и методов родоразрешения, не вызывают сомнений.
Цель исследования: оценка взаимосвязи плацентарной недостаточности с развитием и характером течения гестоза путем определения состояния гематоэнцефалического и плацентарного барьеров.
Задачи исследования:
- Провести анализ клинического течения беременности, осложненной фетоплацентарной недостаточностью и гестозом, и исходов родов при данной патологии.
- Изучить в динамике изменения нейроспецифических белков в сыворотке крови беременных с фетоплацентарной недостаточностью и с гестозом.
- Оценить состояние эндотелия в сосудах пуповины плода у беременных с фетоплацентарной недостаточностью и с гестозом.
- Определить уровень нейроспецифических белков (нейроспецифической енолазы) в тканях плаценты у беременных с фетоплацентарной недостаточностью и с гестозом.
- Сопоставить результаты проведенных иммунохимических исследований с клиническим течением фетоплацентарной недостаточности и гестоза у обследованных беременных.
Научная новизна
Выявлена прямая взаимосвязь между повышением концентрации нейроспецифических белков (NSE и GFAP) в сыворотке крови беременных при гестозе с развивающейся плацентарной недостаточностью, а так же с дисфункцией эндотелия, подтвержденной с помощью электронной микроскопии. Определены прямые причинно-следственные связи между повреждением эндотелиоцитов матери с развитием гестационных осложнений.
На основе сопоставление клинических данных, нарушений со стороны сосудистой стенки пуповины и результатов функциональных методов пренатальной диагностики дана характеристика этапов изменений в системе мать–плацента–плод при плацентарной недостаточности и гестозе.
Практическая значимость
Полученные данные об особенностях течения гестоза в сочетании с плацентарной недостаточностью позволяют провести дифференцированное выделение беременных групп высокого риска, а также определить адекватные меры профилактики и лечения данных акушерских осложнений.
Исследование NSE и GFAP в сыворотке крови беременных группы высокого риска по развитию гестоза позволяет своевременно диагностировать возникновение этого осложнения, выработать тактику ведения беременности, а также прогнозировать степень тяжести гестоза при содержании NSE и GFAP выше нормативных значений.
Критериями тяжелого гестоза являются: наличие фетоплацентарной недостаточности, манифестация гестоза до 32 недель беременности, длительность его течения свыше 7 недель и более; повышение концентрации NSE в 1,6 раза и GFAP в 2,8 раза по сравнению с нормальными значениями указанных маркеров, а также максимальная выраженность одного из клинических симптомов гестоза (отеки, протеинурия, гипертензия).
Повышение NSE и GFAP до критических значений (23,3±0,5 нг/мл и 11,8±0,8 нг/мл) однозначно свидетельствует о наличии тяжелого гестоза.
Доказана целесообразность проведения допплерометрического исследования в сроки стандартного скринингового УЗИ (20–24 недели) для определения прогноза течения настоящей беременности, оценки состояния фетоплацентарной системы.
Основные положения, выносимые на защиту
- Развитие и течение гестоза и фетоплацентарной недостаточности тесно взаимосвязаны между собой. Тяжесть проявления этих осложнений взаимопропорциональна. Достоверно чаще отмечены такие осложнения, как преждевременные роды, отслойка плаценты, в 2,5–3 раза повышается риск развития СЗРП.
- Течение фетоплацентарной недостаточности и гестоза характеризуется повышением проницаемости гематоэнцефалического и плацентарного барьера, что проявляется повышением в сыворотке крови небеременных и в плаценте нейроспецифических белков (NSE и GFAP).
- Нарастание тяжести гестоза и фетоплацентарной недостаточности сопровождается дезорганизацией эндотелия и усилением процессов апоптоза в сосудах пуповины.
Внедрение результатов исследования в практику
Полученные результаты используются в педагогическом процессе на сертификационных циклах и циклах тематического усовершенстования на кафедре акушерства и гинекологии ФППОВ ГОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздравсоцразвития России, а также в практической работе на клинических базах кафедры в Родильных домах № 11 и № 27 г. Москвы.
Публикации
По теме диссертации опубликовано 5 научных работ, в том числе 4 — в ведущих рецензируемых научных журналах, определенных ВАК РФ.
Апробация работы
Материалы диссертации доложены на XVI и XVII Российском национальном конгрессе «Человек и лекарство», Москва (2009, 2010), X Всероссийском научном форуме «Мать и дитя», Москва (2009 г.), IV Международном конгрессе по репродуктивной медицине (Москва, 2010), XI Всероссийском научном форуме «Мать и дитя» (Москва, 2010), на заседании кафедры акушерства и гинекологии ФППОВ ГОУ ВПО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздравсоцразвития России 29 октября 2010 года.
Структура и объем диссертации
Структура диссертации традиционна, ее текст изложен на 116 страницах машинописного текста и состоит из введения, обзора литературы, 2 глав, посвященных материалам и методам исследования и результатам собственных данных, обсуждения полученных результатов, выводов, практических рекомендаций и списка литературы. Библиография включает 111 отечественных и 72 иностранных авторов. Текст диссертации проиллюстрирован 24 таблицами, 5 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Обследованы 80 беременных с различной степенью тяжести гестоза и с фетоплацентарной недостаточностью, которые составили основную группу.
Степень тяжести гестоза оценивали по шкале Goecke в модификации Г.М.Савельевой (2000 г.).
Обследованные беременные разделены на три подгруппы в зависимости от тяжести гестоза: 1-я подгруппа – 25 (31,3%) беременных с легким гестозом, 2-я подгруппа – 27 (33,7%) беременных с гестозом средней тяжести, 3-я подгруппа – 28 (35%) беременных с тяжелым гестозом.
В контрольную группу вошли 30 здоровых беременных с физиологически протекающей беременностью.
Критерии включения беременных в основную группу: отсутствие нейроинфекций, черепно-мозговых травм в анамнезе, нейродегенеративных заболеваний, опухолей головного мозга, наличие факторов риска возникновения гестоза: сердечно-сосудистые заболевания (гипертоническая болезнь, вегето-сосудистая дистония), нейрообменно-эндокринные заболевания, заболевания печени и почек.
Критерии включения беременных в контрольную группу: срок беременности 12 недель и более, физиологическое течение беременности, отсутствие нейроинфекций, черепно-мозговых травм, нейродегенеративных заболеваний, опухолей головного мозга.
Для оценки влияния беременности на уровень NSE и GFAP сформирована группа из 20 здоровых небеременных женщин репродуктивного возраста.
Критериями включения пациенток в группу здоровых небеременных явилось отсутствие в анамнезе нейроинфекций, черепно-мозговых травм, нейродегенеративных заболеваний, опухолей головного мозга.
Здоровые беременные и небеременные женщины сопоставимы по возрасту, паритету.
У 30 (37,5%) беременных основной группы в анамнезе имели место заболевания сердечно-сосудистой системы, у 42 (52,5%) – нейрообменно-эндокринные заболевания, у 14 (17,5%) – заболевания почек и мочевыводящих путей, что достоверно отличало их от беременных контрольной группы и здоровых небеременных женщин.
У пациенток контрольной группы и у беременных с гестозом разной степени тяжести в анамнезе отмечались различные гинекологические заболевания. Достоверно чаще у беременных с гестозом выявлены эктопия шейки матки у 38,8% (в контрольной группе 3,3%), хронический сальпингоофорит у 41,3% (в контрольной группе 6,7%) и урогенитальные инфекции у 32,5% (в контрольной группе 6,7%).
Анамнез у обследованных женщин основной и контрольной групп был отягощен искусственными абортами (у 28, 25,9 и 28,6% соответственно по подгруппам основной группы, и у 6,7% – в контрольной группе).
Самопроизвольное прерывание беременности в анамнезе имели место у 3,3% женщин контрольной группы и у 16, 14,8 и 17,9% в подгруппах с гестозом соответственно.
Оперативное родоразрешение во время предыдущих родов в основной группе проводилось чаще (8, 7,4 и 7,2% соответственно по подгруппам) по сравнению с женщинами контрольной группы (3,3%).
Показаниями к кесареву сечению в предыдущих родах в основной группе были следующие: в 1-й подгруппе – упорная слабость родовой деятельности (4%) и анатомически узкий таз (4%); во 2-й подгруппе – отсутствие биологической готовности организма к родам и миома матки (3,7%) и тяжелый гестоз (3,7%); в 3-й подгруппе – тяжелый гестоз и эклампсия (7,2%).
В контрольной группе показаниями к абдоминальному родоразрешению были несостоятельный рубец на матке и анатомически узкий таз в 1 наблюдении (3,3%).
Гестоз во время предыдущей беременности отмечен у 1 (8%) беременной в 1-й подгруппе, у 2 (7,4%) – во 2-й подгруппе и у 2 (7,2 %) – в 3-й подгруппе.
Методы исследования
Комплексное обследование беременных включало: сбор анамнеза соматического здоровья женщин, менструальной, репродуктивной функции, особенностей течения предыдущих беременностей.
Общеклиническими методами оценено состояние сердечно-сосудистой системы, системы органов дыхания, системы органов пищеварения, мочевыводящей системы. Лабораторная диагностика включала следующие методы: клинический анализ крови, биохимический анализ крови, коагулограмма, общий анализ мочи (в т.ч. исследование суточной потери белка). Ультразвуковое исследование во II и III триместрах беременности осуществлялось с применением стандартных методик эхографии – трансабдоминального сканирования и допплерометрического исследования кровотока в маточных артериях и в артериях пуповины (Медведев М.В., 1998).
Иммунохимическое исследование. Оценка состояния гематоэнцефалического барьера (ГЭБ) осуществлялась на основании исследования концентрации в сыворотке крови нейроспецифических белков (НСБ) – глиофибриллярного кислого протеина (GFAP) и нейроспецифической енолазы (NSE), являющихся маркерами патологических процессов в ткани головного мозга.
Определение NSE и GFAP в сыворотке крови беременных основной группы проводили в день госпитализации до начала инфузионной и гипотензивной терапии.
Концентрацию нейроспецифических белков NSE и GFAP в сыворотке крови беременных основной группы определяли с 12 до 20 недель ежемесячно, а с 20 недель – 1 раз в 2 недели.
В контрольной группе нейроспецифические белки определяли в сыворотке крови с 12 недель беременности 1 раз в месяц до родоразрешения.
В группе здоровых небеременных женщин концентрацию NSE и GFAP определяли однократно в 1-й фазе менструального цикла.
Количественное определение концентраций НСБ в сыворотке крови осуществлялось при помощи «сэндвич» – варианта (Voller A. et all., 1976) иммуноферментного анализа в модификации (Чехонин В.П. и соавт., 1988). Данное исследование проводилось в лаборатории иммунохимии Отдела биологической психиатрии ФГУ «ГНЦССП им. В.П. Сербского» (руководитель отдела – академик РАМН, д.м.н., профессор Чехонин В.П.). Исследование NSE и GFAP в сыворотке крови пациенток проводили методом твердофазного иммуноферментного анализа (ELISA). В качестве твердой матрицы применялся 96-луночный полистирольный планшет фирмы «Costar» (USA).
Проведение иммуноферментного анализа включало несколько этапов, необходимых для экспериментального подбора оптимальных концентраций «посадочных» антител и стандартных проб с заданной концентрацией антигена для построения калибровочной кривой. Конечный расчет концентрации NSE, GFAP производили по стандартной для ИФА технологии.
Морфологическое исследование. Проведено морфологическое исследование пуповин новорожденных с гестационным сроком 32–40 недель методом электронной микроскопии.
Для минимизации внешних воздействий пуповины были получены в течение первых 10 минут после родов. Из каждой пуповины ближе к плаценте выделен участок длиной 3 см, отмыт физиологическим раствором, затем вырезан круговой сегмент толщиной 3 мм (содержащий 2 артерии и вену) и помещен во флакон с глицерофосфатом. Кусочки ткани величиной 311 мм фиксировались забуференным 2% глютаровым альдегидом при 4С не менее 48 часов, далее промывались в 0,1 М какодилатном буфере в течение 1 часа. Кусочки ткани обезвоживали этанолом повышающейся концентрации, переводили в абсолютный ацетон и заливали в смесь смол эпон-аралдит 1:2. По окончании полимеризации из залитой в смолу ткани приготовляли полутонкие срезы толщиной 1–1,5 мкм. Срезы окрашивали трехцветным методом метиленовый синий – азурII – основной фуксин. При светооптическом просмотре полутонких срезов прицельно выбирали участок стенки пуповинной артерии и приготовляли ультратонкие срезы толщиной 25 нм на ультрамикроскопе LKB (Швеция). Ультратонкие срезы контрастировали 4% спиртовым раствором уранилацетата и 0,4% водным раствором цитрата свинца. Препараты исследовали под электронным микроскопом Philips (Нидерланды) при различном увеличении.
Исследование уровня NSE в плаценте. В процессе исследования определен уровень NSE в тканях плаценты у пациенток с гестозом тяжелой и средней степени тяжести и у здоровых беременных. Исследование проводили методом иммуноблоттинга.
Для этого 15 мкл растворимой фракции белков, полученных из гомогената плаценты, разделяли по стандартной методике Laemmli в полиакриламидном геле (ПААГ). Далее проводили электроперенос белков на нитроцеллюлозную мембрану Hybond с последующей гибридизацией с антителами кролика к человеческой нейрон-специфической енолазе (Sigma). В качестве положительного контроля использовали коммерческий препарат NSE (Sigma), полученный из тканей мозга человека. В качестве отрицательного контроля использовали гомогенат плаценты, полученный от пациентки без патологий. Степень проявления интенсивности окрашивания оценивали в условных единицах, с помощью коммерческой Т-системы Sigma, USA.
Статистическую обработку полученных данных производили по общепринятому методу вариационной статистики с вычислением средней арифметической (М), ошибки средней арифметичеаской (m), стандартного отклонения (SD). Различия считали достоверными при значениях параметра р<0,05.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
И ИХ ОБСУЖДЕНИЕ
I триместр настоящей беременности протекал без осложнений у 16 (64%) беременных контрольной группы и у 21 (30,9%) – основной (p<0,05).
У остальных пациенток основной группы I триместр беременности достоверно чаще был осложнен ранним токсикозом в 48,8% (в контрольной – у 20%; р<0,05); угрозой прерывания беременности в 27,5% (в контрольной – у 10%; р<0,05); анемией в 15% (в контрольной группе – у 3,3%; р<0,05).
В контрольной группе чаще имели место ОРВИ и ранний токсикоз.
Течение II триместра настоящей беременности было неосложненным в основной группе у 17 (22%) и у 21 (70%) беременных контрольной группы (p<0,05).
Угроза прерывания беременности отмечена у 25% женщин основной группы во II триместре, что в 7 раз превышает те же показатели в контрольной группе (3,3%). Анемия у беременных данной группы выявлена в 4,5 раза чаще, чем в контрольной группе (15 и 3,3% соответственно).
У беременных контрольной группы III триместр протекал без осложнений в 82,5% случаев. Угроза преждевременных родов в контрольной группе встречалась в 4,5 раза реже, чем в основной группе (3,3 и 15% соответственно).
Клинические проявления ФПН (СЗРП и нарушений гемодинамики в фетоплацентарном комплексе во II и в III триместрах беременности) в основной группе выявлены у 53 (66,3%) беременных.
Все беременные с указанными нарушениями были госпитализированы для стационарного лечения.
Во II триместре в 1-й подгруппе у 4-х пациенток (18%) в фетоплацентарном комплексе были нарушения гемодинамики IА степени. У 2 из них гемодинамические нарушения носили стойкий, но не прогрессирующий характер, что было подтверждено при динамическом наблюдении и в III триместре. У 2 пациенток в III триместре беременности после проведенного стационарного лечения нарушений гемодинамики не наблюдались. В III триместре нарушение кровотока IA степени выявлено еще у 8 (32%) женщин. Задержка роста плода по асимметричному типу в данной подгруппе была выявлена у 7 (28%) беременных: у 1 (4 %) во II триместре и у 6 (24%) – в III триместре. Отставание фетометрических данных от гестационного срока не превышало 2 недели. Маловодие было диагностировано у 4 (16%), многоводие – у 9 (36%).
Нарушение гемодинамики в фетоплацентарном комплексе во 2-й подгруппе выявлялось у 19 (70,4%) беременных: IА степени у 11 (40,7 %) и IБ – у 8 (29,6%). Во II триместре нарушение кровотока IА зарегистрировано у 4 (14,8%) беременных. В 2 наблюдениях (7,4%) эти нарушения были транзиторныи и после курса стационарного лечения не выявлялись.У 2 (7,4%) беременных гемодинамические нарушения носили стойкий характер. Нарушение гемодинамики в фетоплацентарном комплексе в III триместре диагностировано еще у 15 (55,6%) беременных: у 7 (25,9%) IА степени и у 8 (29,6%) IБ степени.
Синдром задержки роста плода (СЗРП), в общей сложности, выявлен у 12 (44,4%): у 3 (11,1%) во II триместре и у 9 (33,3%) – в III триместре. Асимметричная форма отмечена у 11 женщин, у 1-й симметричная форма. Во всех случаях СЗРП отставание размеров плода не превышало 2–3 недели по сравнению с нормативными показателями.
Маловодие выявлено у 9 (33,3%), выраженное маловодие у 1 (3,7%), многоводие – у 8 (29,6%) беременных.
В 3-й подгруппе нарушения гемодинамики выявлены у 24 (85,7%) пациенток: в 7 (25%) случаях во II триместре. При этом у 5 из них (7,9%) нарушение носило стойкий характер: IА степень у 2 беременных и IБ у 3 беременных. У 17 (60,7%) беременных нарушения гемодинамики были выявлены в III триместре: IА степень – у 5 (17,9%) женщин и IБ – у 9 (32,1%). Гемодинамические нарушения II степени имели место у 2 (7,1%) беременных и III степени – у 1 (3,6%) беременной.
Признаки СЗРП в 3-й подгруппе выявлены в 19 (67,9%) наблюдениях: 4 (14,3%) во II триместре, 15 (53,6%) – в III триместре. При этом СЗРП носил более тяжелый характер по сравнению с 1-й и 2-й подгруппами: 1 степени тяжести в 13 (46,4%) наблюдениях, 2 степени – в 6 (21,4%) наблюдениях. У 4 (14,3%) женщин отмечена симметричная форма, у 15 (53,6%) ассиметричная форма СЗРП. Маловодие выявлено у 8 (28,6%), выраженное маловодие – у 4 (14,3%), многоводие – у 7 (25%).
Компенсированная форма плацентарной недостаточности в основной группе отмечена у 12 (15%) беременных.
При этом нарушение кровотока IА степени отмечено у 12 (15%). Синдром задержки роста плода по ассиметричному типу I степени выявлен у 7 (8,8%) беременных. Маловодие в данной группе выявлено у 5 (6,3%), многоводие – у 9 (11,3%) беременных.
Субкомпенсирпеованная форма ФПН отмечена у 39 (48,8%) пациенток, что сопровождалось сочетанным нарушением маточно-плацентарного и плодового кровотока у 1 (1,3%) беременной, а у 38 (47,5%) беременных только нарушением плодово-плацентарного или маточно-плацентарного кровотоков. При этом у 18 (22,5%) беременных выявлены нарушения IА степени, а у 20 (25%) беременных – IБ степени. Синдром задержки роста плода I степени диагностирован у 25 (31,3%) женщин, II степени – у 4 (5%). По ассиметричному типу СЗРП выявлена у 26 (32,5%), по симметричному типу – у 3 (3,8%). Маловодие в данной группе было обнаружено у 16 (20%). Выраженное маловодие отмечено у 3 (3,8%), многоводие – у 15 (18,8%) беременных.
Декомпенсированная форма плацентарной недостаточности в данной группе выявлена у 2 (2,5%) женщин, у которых отмечены нарушения кровотока II и III степени, а у плодов выявлен СЗРП II степени по симметричному типу. В обоих случаях выявлено истончение плаценты и выраженное маловодие.
Время начала гестоза и длительность его течения находились в прямой зависимости от степени тяжести данного осложнения беременности. В 1-й подгруппе гестоз в среднем начинался в 35,2±1,1 недель беременности, во 2-й – в 32,8±1,6 недели, в 3-й – в 28,5±2,7 недель.
Длительность течения гестоза от момента появления первых его клинических признаков до родоразрешения составила 3,4±1,02, 4,8±1,02 и 7,1±2,3 недель соответственно.
Систолическое АД в контрольной группе составило в среднем 111±7,9 мм рт. ст., в 1-й подгруппе – 127,1±9,0 мм рт. ст., во 2-й – 143,5±11,3 мм рт. ст., в 3-й – 167,9±7,7 мм рт. ст. Диастолическое АД составило соответственно 71±5,4; 80,2±5,2; 92,5±5,8 и 100,5±6,2 мм рт. ст. соответственно.
Однако выраженность артериальной гипертензии в подгруппах имела большой диапазон колебаний: в 1-й подгруппе от 115/70 до 140/90 мм рт. ст., во 2-й подгруппе – от 120/80 до 160/100 мм рт. ст., в 3-й подгруппе – от 155/95 до 180/110 мм рт. ст.
В контрольной группе в общем анализе мочи протеинурии ни в одном наблюдении не отмечено.
В основной группе протеинурия отсутствовала только в 7 (28%) наблюдениях в 1-й подгруппе и в 5 (18,5%) случаях во 2-й подгруппе. Уровень протеинурии варьировал в значительных пределах: в 1-й подгруппе от 0,033 до 0,066 г/л, во 2-й подгруппе – от 0,033 до 1,6 г/л, в 3-й подгруппе – от 0,033 до 5 г/л.
В 1-й подгруппе отеки 1 степени выявлены у 16 (64%), 2 степени – у 9 (36%). Во 2-й подгруппе отеки 1 степени были у 7 (25,9%), 2 степени – у 15 (55,6%), 3 степени – у 5 (18,5%). В 3-й подгруппе отеки 1 степени выявлены у 8 (28,6%), 2 степени – у 5 (17,9%), 3 степени – у 11 (39,3%), 4 степени – у 4 (14,2%).
Классическая триада симптомов гестоза (отеки, протеинурия, гипертензия) была выявлена у 9 (36%), 21 (77,7%) и 28 (100%) пациенток соответственно подгруппам (p<0,05).
В контрольной группе своевременно при доношенной беременности родоразрешены 100% пациенток.
В 1-й подгруппе основной группы роды в срок произошли у 84% обследуемых женщин, во 2-й у 74%, в 3-й – лишь у 35,7%. Соответственно, с нарастанием тяжести гестоза беременность закончилась преждевременными родами: в 1-й подгруппе у 1 (4%), во 2-й – у 5 (18,5%), в 3-й – у 18 (64,3%).
Через естественные родовые пути родоразрешены 27 (90%) пациенток контрольной группы.
В основной группе роды через естественные родовые пути произошли у 21 (84%), 14 (51,9%) и 2 (7,2%) пациенток соответственно в подгруппах.
Абдоминальным путем родоразрешены 3 (10%) беременных контрольной группы. При этом оперативное родоразрешение во всех случаях было плановое, основными показаниями явились миопия высокой степени – у 2 (10%) и несостоятельный рубец на матке после предыдущих оперативных родов – у 1 (4%).
Кесарево сечение в основной группе выполнено у 4 (16%) беременных с гестозом легкой степени, у 13 (48,1%) – с гестозом средней степени тяжести и у 26 (92,9%) – с тяжелым гестозом.
В 1-й подгруппе в 1 (4%) наблюдении кесарево сечение выполнено в экстренном порядке в связи с дородовым излитием околоплодных вод при ножном предлежании плода, в 3 (12%) наблюдениях в плановом порядке по сочетанным показаниям (рубец на матке в сочетании с крупным плодом, ножным предлежанием плода и возрастом беременной 40 лет).
Во 2-й подгруппе в экстренном порядке путем кесарева сечения родоразрешены 9 (33,3%) пациенток: 4 (14,8%) – в связи с нарастанием тяжести гестоза и отсутствием биологической готовности организма к родам, 5 (18,5%) – в связи с дородовым излитием околоплодных вод, неготовности организма к родам. В плановом порядке оперативно родоразрешены 4 (14,8%) пациентки: 2 (7,4%) – по поводу рубца на матке, 1 (3,7%) – по поводу полного предлежания плаценты и в 1 (3,6%) – в связи с нарастанием степени тяжести гестоза.
В 3-й подгруппе оперативное родоразрешение было предпринято у 24 (85,7%) в связи с прогрессирующим тяжелым гестозом, у 1 (3,6%) – с преждевременной отслойкой плаценты, у 1 (3,6%) – по поводу тяжелого гестоза и начальными признаками декомпенсации маточно-плацентарного кровотока.
Масса новорожденных в контрольной группе и в 1-й подгруппе достоверно не различалась, а во 2-й и 3-й подгруппах была достоверно ниже по сравнению в контрольной группой (р<0,05). Гипотрофия различной степени выявлена у 7 (28%) новорожденных в 1-й подгруппе, у 12 (44,4%) – во 2-й подгруппе и у 19 (67,9%) – в 3-й подгруппе.
Обращает на себя внимание высокая частота гипоксически-ишемического поражения ЦНС при тяжелом гестозе у 18 новорожденных (64,3%), что превышает аналогичные показатели в 1-й и 2-й подгруппах. Так же высока частота синдрома дыхательных расстройств (СДР) – 1 (3,7%) и 11 (39,3%) наблюдений – во 2-й и 3-й подгруппах при отсутствии таковых в 1-й подгруппе. При этом во 2-й подгруппе СДР купировался уже в 1–2-е сутки, а в 3-й подгруппе – только к 3–5 суткам.
В 1 (3,6%) случае в 3-й подгруппе отмечено развитие аспирационного синдрома и аспирационной пневмонии новорожденного, во 2-й подгруппе так же отмечено 1 (3,7%) аналогичное осложнение.
Проведение реанимационных мероприятий потребовалось у 7 (25%) новорожденных 3-й подгруппы, что в 3 раза чаще, чем во 2-й у 2 (7,4%; р<0,05). В 1-й подгруппе реанимационные мероприятия не проводились.
Учитывая тяжелое состояние новорожденных, недоношенность, морфофункциональную незрелость 18 (64,3%) детей 3-й подгруппы переведены на II этап выхаживания, что превышает тот же показатель во 2-й подгруппе в 4 раза (2 детей – 7,4%; р<0,05). В контрольной группе и 1-й подгруппе все дети выписаны домой.
В группе здоровых беременных концентрации NSE и GFAP достоверно не отличались от показателей у здоровых небеременных женщин и не зависели от возраста и срока беременности, что свидетельствует об отсутствии влияния физиологических изменений при беременности на проницаемость ГЭБ и активацию эндотелия.
После обработки данных о концентрации NSE и GFAP у беременных контрольной группы в разные сроки беременности получена средняя величина, принятая за норму у здоровых беременных женщин с физиологически протекающей беременностью – 10,2±0,2 нг/мл для NSE и 3,2±0,2 нг/мл для GFAP.
В сыворотке крови беременных с гестозом средние концентрации GFAP и NSE были достоверно выше, чем в сыворотке крови здоровых беременных (p<0,05). Чем тяжелее протекал гестоз, тем выше концентрации НСБ в сыворотке крови.
У беременных с легким гестозом уровень GFAP составил 4,8±0,1 нг/мл, с гестозом средней степени тяжести отмечалось нарастание концентрации до 7,3±0,2 нг/мл. У беременных с тяжёлым гестозом уровень GFAP составлял 11,8±0,8 нг/мл. Уровень NSE у беременных с легким гестозом был равен 14,1±0,1 нг/мл, с гестозом средней степени тяжести отмечалось нарастание концентрации до 15,8±0,3 нг/мл, а у беременных с тяжёлым гестозом уровень NSE составлял 20,3±0,5 нг/мл (таблица 1).
Таблица.
Уровни НСБ в сыворотке крови (нг/мл) у обследуемых пациенток
| Средние концентрации НСБ в сыворотке крови (нг/мл) у обследуемых пациенток | ||||
| Нейроспеци-фические белки | Здоровые беременные | Беременные с гестозом | ||
| легкой степени | средней степени | тяжелой степени | ||
| GFAP | 3,1±0,2 | 4,8±0,1 | 7,3±0,2 | 11,8±0,8 |
| NSE | 10,4±0,1 | 14,1±0,1 | 15,8±0,3 | 20,3±0,5 |
p<0,05 – различия статистически достоверны в показателях контрольной группы и в группах с гестозом, для – p<0,05-NSE и для – p<0,05GFAP показателей.
Данные о повреждении эндотелия сосудов плаценты и системы микроциркуляции в организме матери при гестозе, известные изменения в плаценте при гестозе, обнаружение нейроспецифических антигенов и антител в сыворотке крови, как матери, так и плода, диктуют необходимость изучения состояния эндотелия и в сосудах пуповины.
В контрольной группе у здоровых беременных по данным морфологического исследования во всех наблюдениях выявлялась однотипная картина. Эндотелиальные клетки артерий пуповины нормально организованы в виде монослоя клеток, в основном, кубической формы. Клетки на большем протяжении имеют равную высоту и плотно контактируют друг с другом, образуя простые плотные контакты. Ядра эухроматические, маргинальная концентрация хроматина и умеренные инвагинации ядер единичны. Большинство митохондрий обычного строения, имеют хорошо развитые кристы и гомогенный митохондриальный матрикс умеренной электронной плотности. Эндоплазматический ретикулум в основном гладкий, аппарат Гольджи представлен плотно упакованными цистернами. Хорошо развит цитоскелет, представленный в основном многочисленными актиновыми микрофиламентами. Цитоплазматические вакоули редки.
Эндотелиальные клетки пуповинной вены в контрольной группе также организованы в виде монослоя клеток в основном кубической, изредка поперечно вытянутой и полигональной формы. В целом, по сравнению с контрольным артериальным эндотелием клетки более гетероморфны по виду, однако на большем протяжении выстилки имеют равную высоту и плотно контактируют друг с другом, также образуя простые плотные межклеточные контакты. В большинстве клеток эндотелия имеется умеренно выраженная инвагинация ядерной оболочки. В ядрах белковый ядерный матрикс умеренной электронной плотности с диффузным хроматином. Маргинальная конденсация хроматина и глубокие инвагинации ядер незначительны. Большинство митохондрий обычного строения, имеют хорошо развитые пластинчатые кристы и гомогенный миохондриальный матрикс умеренной электронной плотности. Однако доля нарушенных митохондрий (с начальными изменениями в сторону их набухания и уменьшения крист) больше, чем в артериальном эндотелии. Хорошо развит цитоскелет, представленный в основном многочисленными актиновыми микрофиламентами. Эндоплазматический ретикулум, в основном гладкий, развит слабо или умеренно. Аппарат Гольджи представлен плотно упакованными цистернами. В ряде случаев в клетках встречаются пиноцитозные пузырьки, вакуолизация частичная и незначительная.
В обеих группах беременных с гестозом отмечаются резкие нарушения морфологического строения эндотелия как артерий, так и вены пуповины отмечаются явления апоптоза. Степень выраженности этих изменений прямо коррелирует со степенью тяжести гестоза у матери.
Эндотелиоциты пуповинной артерии при гестозе разделены увеличенными межклеточными промежутками, крайне гетероморфны (округлой, полигональной, вытянутой и плоской формы), клетки сильно вытянуты перпендикулярно эластической мембране и выбухают в просвет сосуда. Ядра в большинстве случаев неправильной формы, образуют глубокие инвагинации, в ряде случаев отмечается примембранная конденсация хроматина, сегментация ядер и апоптотические изменения ядер (кариорексис и кариопикноз). Отмечается набухание митохондрий, просветление матрикса (разрушение), частичная или полная потеря крист. Имело место расширение цистерн и канальцев эндоплазматического ретикулума с образованием вакуолей и «лабиринтов». В целом отмечается просветление цитоплазмы эндотелиоцитов за счет обеднения ее органеллами, потери рибосом, частичной дезорганизации и утраты микрофиламентов цитоскелета, с явлениями апоптоза. В группе с тяжелым гестозом практически все эндотелиоциты вакуолизированы, объем гигантских вакуолей достигает половины объема цитоплазмы. Явления апоптоза резко усилены.
Таким образом, результаты электронной микроскопии свидетельствуют о том, что при развитии гестоза возникают выраженные нарушения морфологического строения эндотелия, как артерий, так и вены пуповины, набухание и эдематозные изменения клеток, предапоптотические изменения ядер и внутриклеточных органелл эндотелиоцитов, вплоть до полного разрушения и слущивания клеток эндотелия при тяжелом течении гестоза.
Следующим этапом исследование было определение уровня NSE в тканях плаценты у пациенток с гестозом различной степени тяжести и у здоровых беременных женщин. Исследование проводили методом иммуноблоттинга (рисунок 1).
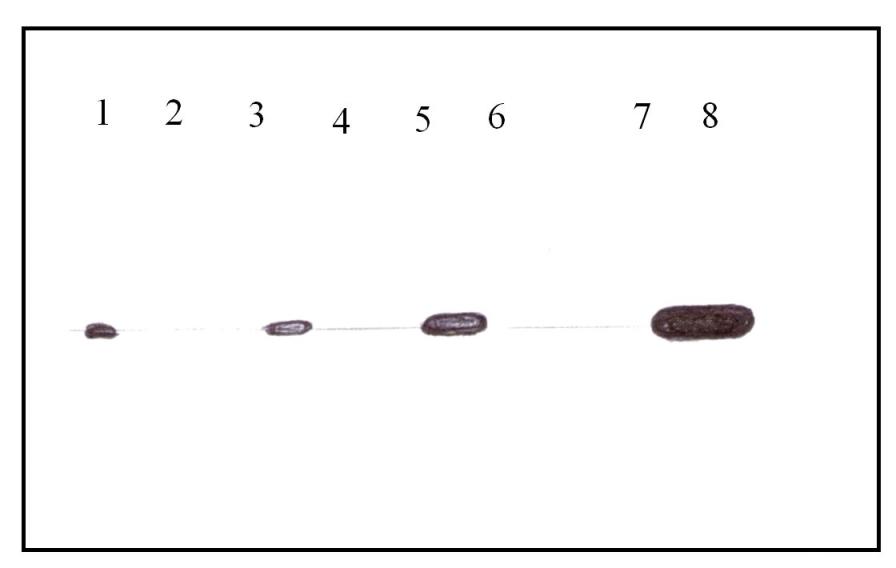
Рисунок. Результаты иммуноблотинга растворимых фракций белков
плаценты пациенток с гестозом различной степени тяжести в основной и контрольных группах.
Результаты исследования, представленные на рисунке, свидетельствуют о присутствии NSE во всех изученных образцах при гестозе различной степени тяжести и в группе контроля. Однако можно констатировать различную степень выраженности белковой полосы и, соответственно, различный уровень NSE в представленных образцах у пациенток с гестозом в зависимости от степени тяжести осложнения. Так, степень выраженности белковой полосы, отражающей степень концентрации NSE в плаценте выше при гестозе средней и тяжелой степени, чем при гестозе легкой степени в контрольной группе.
Повышение уровня NSE в тканях плаценты при гестозе может быть обусловлено, с одной стороны, повышенным внутриплацентарным уровнем экспрессии (биосинтеза) белка под влиянием гипоксии, что сопутствует гестозу. С другой стороны, увеличение уровня NSE в плаценте может носить эндогенный характер вследствие прорыва гематоэнцефалического и плацентарного барьеров.
ВЫВОДЫ
- Беременные с гестозом и с фетоплацентарной недостаточностью имеют отягощенный соматический и акушерско-гинекологический анамнез, более частые осложнения беременности (угроза прерывания беременности – 25%, анемия – 27,5%, задержка роста плода – 47,5%).
- Стабильное повышение концентраций NSE до 14,1±0,1 нг/мл и более и GFAP 4,8±0,1 нг/мл в сыворотке крови матери, свидетельствуют о возникновении и прогрессировании гестоза и ФПН, а уровень NSE 20,3±0,5 нг/мл и GFAP 11,8±0,8 нг/мл указывает на тяжелую степень гестоза, что требует экстренного родоразрешения. Отмечается прямая взаимосвязь между длительностью течения гестоза и повышением концентрации NSE и GFAP в сыворотке крови беременных.
- Наличие растворимых фракций белков плаценты, определяемых методом иммуноблоттинга, обусловлено повышенным внутриплацентарным уровнем биосинтеза белка под влиянием гипоксии, а также связана с нарушением проницаемости гематоэнцефалического и плацентарного барьеров. Повышение уровня NSE в ткани плаценты коррелирует со степенью тяжести гестоза, что подтверждает роль фетоплацентарной недостаточности в его развитии.
- При наличии фетоплацентарной недостаточности в сочетании с гестозом имеет место иммунокомплексное поражение сосудов пуповины, что сопровождается процессами дезорганизации клеток эндотелия, резким усилением процессов апоптоза в сосудах пуповины. Нарушение проницаемости плацентарного барьера обуславливает тяжесть течения гестоза.
- Нарушение маточно-плацентарного и плодово-плацентарного кровотока является значимым фактором риска развития гестоза, СЗРП и поражения эндотелия сосудов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Беременным, входящим в группу высокого риска по развитию гестоза или уже имеющимся гестозом целесообразно определять уровни NSE и GFAP в сыворотке крови для прогнозирования развития или для оценки тяжести данного осложнения беременности.
- Начало гестоза до 30–32 недель беременности, длительность его течения более 7–8 недель независимо от степени выраженности отеков, протеинурии и гипертензии, максимальная выраженность одного из клинических симптомов (отеков, протеинурии, гипертензии), наличие признаков фетоплацентарной недостаточности, тромбоцитопения, признаки выраженной гемоконцентрации, лабораторные признаки нарушения функций печени, почек, уровни NSE свыше 20,3±0,5 нг/мл, GFAP свыше 11,8±0,8 нг/мл являются критериями тяжелого гестоза, требующими срочного родоразрешения.
- Повышение уровней NSE до 14,1 нг/мл и выше, GFAP до 4,8 нг/мл и выше свидетельствуют о начальных этапах развития гестоза и требует повторного исследования уровня НСБ через 2 недели. За это время у беременной следует провести функциональную оценку фетоплацентарной системы, мероприятия направленные на компенсацию соматического заболевания, санацию очагов инфекции, исключить факторы, способствующие прогрессированию фетоплацентарной недостаточности.
Список работ, опубликованных по теме диссертации
1. Сидорова И.С., Макаров И.О., Гасанова С.Р. Изменение уровней нейроспецифических белков в сыворотке крови и плаценте у беременных с гестозом // Российский вестник акушера-гинеколога. — 2009. — Т. 9. — №6. — С. 4–5.
2. Гасанова С.Р., Макаров И.О., Солоницин А.Н. Прогностические критерии тяжести гестоза // Материалы III регионального научного форума «Мать и дитя». – Саратов, 2009. – С. 62–63.
3. Макаров И.О., Шеманаева Т.В., Гасанова С.Р., Попова О.П. Гестоз как проявление иммунного эндотелиоза // Вопросы гинекологии, акушерства и перинатологии. – 2009. – Т.8. – №6. – С. 17–22.
4. Сидорова И.С., Макаров И.О., Шеманаева Т.В., Гасанова С.Р. Роль фетопцентарной недостаточности в развитии гестоза // Вопросы гинекологии, акушерства и перинатологии. – 2009.– Т.8. – №4. – С. 45–49.
5. Макаров И. О., Шеманаева Т.В., Гасанова С.Р. Значение эндотелиоза в развитии гестоза // Российский вестник акушера-гинеколога. – 2010. – Т.10. – №2. – С.16–19.

