Влияние модифицированных витаминов с антиоксидантным действием на эффективность и токсичность противоопухолевой терапии в эксперименте
На правах рукописи
ИВАНОВА АННА АЛЕКСАНДРОВНА
ВЛИЯНИЕ МОДИФИЦИРОВАННЫХ ВИТАМИНОВ
С АНТИОКСИДАНТНЫМ ДЕЙСТВИЕМ НА ЭФФЕКТИВНОСТЬ И ТОКСИЧНОСТЬ ПРОТИВООПУХОЛЕВОЙ ТЕРАПИИ В ЭКСПЕРИМЕНТЕ
14.00.14 – онкология
14.00.16 – патологическая физиология
Автореферат
Диссертации на соискание ученой степени
кандидата медицинских наук
Томск – 2009
Работа выполнена в Учреждении Российской Академии медицинских наук
НИИ онкологии Сибирского отделения РАМН
Научные руководители:
доктор биологических наук,
профессор Чердынцева Надежда Викторовна
кандидат биологических наук Иванов Владимир Владимирович
Официальные оппоненты:
доктор медицинских наук, профессор,
заслуженный деятель науки РФ Удут Владимир Васильевич
доктор медицинских наук, профессор Кологривова Елена Николаевна
Ведущая организация:
ФГУ НИИ онкологии им. Н.Н. Петрова, г. Санкт-Петербург
Защита состоится «___» _____________2009г. в ________ часов на заседании диссертационного совета Д 001.32.01 при НИИ онкологии СО РАМН
(634050, г. Томск, пер. Кооперативный, 5)
С диссертацией можно ознакомиться в библиотеке НИИ онкологии СО РАМН
Автореферат разослан «_____» ___________________ 2009 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук, профессор Фролова И.Г.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
В последние годы достигнуты определенные успехи в лечении больных со злокачественными новообразованиями, связанные с внедрением в клиническую практику новых противоопухолевых препаратов и схем их введения, созданием принципиально новых подходов на основе таргетных (специфически нацеленных на определенную мишень на клеточной мембране или в цитоплазме опухолевой клетки) препаратов (Imyanitov E.N., Hanson K.P., 2004; Sawyers C., 2004). Однако в подавляющем большинстве в качестве противоопухолевой терапии используется комплексное лечение, включающее химио-, радиотерапию и оперативное вмешательство. Химио- и лучевая терапия используются как в неоадъювантном режиме для перевода опухолевого процесса в операбельное состояние или возможности осуществления органосохранной операции, так и в адъювантном режиме с целью предотвращения рецидивирования и метастазирования (Семиглазов В.Ф. и др., 2003; Kautmann M. et al., 2006). Главным препятствием в достижении желаемого эффекта являются врожденная или приобретенная резистентность опухолей к лекарственным препаратам и лучевому воздействию, а также высокая токсичность этих воздействий, нередко ограничивающая проведение интенсивной противоопухолевой терапии (Богуш Т.А. и др., 2000; Жданова О.С. и др., 2005; Карпинская Н.П., Чубик М.В., 2006; King P., Perry M., 2001; Walker M., Ni O., 2007). Возникновение побочных эффектов при проведении химиотерапии и радиотерпии онкологических больных обусловлено самим принципом их повреждающего действия в основном на активно пролиферирующие клетки путем нарушения процессов деления или запуска апоптоза (Гольдберг В.Е. и др.,1999; Дарьялова С.Л., 2000; Гольдберг Е.Д. и др., 2001; Птушкин В.В., 2002; Поддубная И.В. и др., 2003; Удут Е.В. и др., 2008; Park S-J. et al., 2008; Chabner B.A., Roberts T.G., 2005). Поэтому эти виды противоопухолевого воздействия являются токсичными для систем, функционирование которых связано с высокой пролиферативной активностью клеток – костного мозга, иммунной системы, слизистых оболочек, детоксицирующих органов, таких как печень, почки, а также головного мозга и сердца (Богуш Т.А., Богуш Е.А. 1995; Кондратьев В.Б., Карасева Н.А., 2000; Поддубная И.В. и др., 2000; Heinrich E., Getoff N., 2000; Mackall C. et al, 1995; Sharma S. et al., 1999; Schwartz R., 2000). Побочное действие лекарственных препаратов и лучевой терапии, таким образом, связано с их низкой избирательностью, необходимостью поддерживать достаточно высокую терапевтическую дозу, длительностью лечения.
В структуре осложнений большинства цитостатических агентов основное место занимает супрессивное влияние на костномозговое кроветворение (Гольдберг В.Е. и др., 1999; Гольдберг Е.Д, Дыгай А.М., 2001; Гершанович М.Л. идр., 2001), гепатотоксичность, приводящая к снижению противоопухолевого эффекта и увеличению токсичности препаратов, метаболизирующихся в печени (Богуш Т.А., Богуш Е.А. 1995, Mackall C. et al, 1995). Одним из специфических осложнений противоопухолевой терапии является нейротоксичность, которая характерна для производных платины (цисплатин), таксанов (паклитаксел), метотрексата (Кондратьев В.Б., Карасева Н.А., 2000; Поддубная И.В. и др., 2000, Walker M., Ni O., 2007), а также широко используемых в настоящее время целого ряда радиосенсибилизаторов (Барсуков Ю.А. и др., 2005; Heinrich E., Getoff N., 2000). При этом установлено, что снижение дозы препарата или дозы облучения вызывает также и снижение терапевтического эффекта, однако на токсичность практически не влияет (Богуш Т.А. и др., 2000). При использовании комбинации 2-х и более препаратов с целью повышения эффективности лечения токсичность полихимиотерапии возрастает (Переводчикова Н.И., Горбунова В.А., 2001; Дельгадо Ф.Г., 2002; Баранова О.Ю. и др., 2003; Богданов А.Н. и др., 2004). Достижение максимальной терапевтической эффективности цитостатических методов лечения злокачественных опухолей может быть связано с использованием новых средств, блокирующих или замедляющих развитие токсических повреждений, но не снижающих противоопухолевых свойств цитостатиков (Богуш Т.А. и др., 2000; Гольдберг Е.Д., Зуева Е.П., 2000; Немцова Е.Р. и др., 2003; Птушкин В.В., 2004). Все это делает актуальным разработку средств и способов снижения токсического действия специфического противоопухолевого лечения и защиты жизненно важных органов и тканей, способствующих высокой эффективности цитостатической терапии.
Основным механизмом повреждающего действия на нормальные клетки и ткани при химиотерапии и лучевом воздействии является избыточное накопление активных форм кислорода в результате активации микросомального окисления и радиолиза воды соответственно (Меньщикова Е.Б. и др., 2006). Следствием этого является повреждение функционирования системы антиоксидантной защиты (включая ее ферментативное и неферментативное звенья), нарушение иммунологических механизмов, участие которых также чрезвычайно важно в процессах детоксикации и регуляции гемопоэза (Якубовская Р.И., 2002; Aboud M. et al., 1993; Hung K. et al., 1998; Sharma S. et al., 1999).
В процессе решения данной задачи было разработано и обосновано применение большого числа различных модифицирующих воздействий, направленных на снижение токсичности и/или усиление терапевтического эффекта малотоксичных доз цитостатических и лучевых воздействий (Deng G., 2005; Kontogiorgis А.С., 2005). Среди средств, предупреждающих повреждение нормальных тканей, достаточно широко представлены природные соединения (церулоплазмин, лактоферрин), колониестимулирующие факторы (ленограстим, филграстим, молграмостим, пегфилграстим, эритропоэтин) (Bauvet F. et al., 2008), тиоловые соединения (амифостин) (Богуш Т.А. и др., 2000; Немцова Е.Р. и др., 2003; Stolarska M. et al., 2006; Batista C.K.L. et al., 2007). Однако узкая направленность действия корректоров токсичности, наличие побочных эффектов или высокая стоимость ограничивают их применение (Птушкин В.В., 2004; Машковский М.Д., 2007; Othieno-Abinya N.A. et al., 2007). В качестве сопровождения химиотерапии достаточно широко используются природные антиоксиданты с неферментативным действием, в частности, -токоферол и аскорбиновая кислота (Меньщикова Е.Б. и др., 2006; Немцова Е.Р. и др., 2003; Птушкин В.В., 2002; Бишоп Д.М., 1991; Fang Y-Z., et al, 2002). Показано, что защитные эффекты антиоксидантов в определенной мере селективны для нормальных клеток и могут уменьшать токсичность противоопухолевого лечения без снижения эффективности. Более того, есть данные, что антиоксиданты могут способствовать повышению эффективности химио- и лучевых воздействий (Nair C. C. K., 2001; Prasad K., 2004).
Однако, есть литературные данные о том, что антиоксиданты могут защищать и раковые клетки, снижая тем самым эффективность противоопухолевой терапии (D'Andrea G.M., 2005). Аскорбиновая кислота имеет ряд недостатков: во-первых, это достаточно нестабильное соединение, которое разрушается под действием тепла, света, ионов тяжелых металлов и при нейтральном значении pH (Птушкин В.В., 2002), и, во-вторых, способное становиться мощным прооксидантом в присутствии ионов железа или меди, что особенно нежелательно и даже опасно в клинической ситуации (Clement M.V. et al., 2001; Lesperance M.L. et al., 2002; Song J.H. et al., 2003; D'Andrea G.M., 2005; Chen Q. et al. 2008). Кроме того, липофильные свойства витамина Е (-токоферола), которые обеспечивают его тропность к липидному слою клеточных мембран, существенно ограничивают радиус его действия в живой клетке, не позволяя проявлять активность в водной фазе (Brigelius-Flohe R. et al., 2002).
В последние годы создан ряд новых форм витаминов-антиоксидантов путем модификации их структуры, приводящей к изменению свойств по сравнению с указанными природными витаминами (Петрова Г.В., Донченко Г.В., 2005; Austria R. et al., 1997; Kunitsa N.I. et al., 1993; Yamamoto I. et al., 1990). Японскими учеными разработаны и изучаются оригинальные модифицированные антиоксиданты - гликозид витамина С (2-O– –D-глюкопиранозил-L-аскорбиновая кислота) (Fujinami Y. et al., 2001; Kumano Y. et al., 1998) и гликозид витамина Е (2-(-D-глюкопиранозил) метил-2,5,7,8-тетраметилхроман-6-ол) (Murase H. et al., 1997). Благодаря наличию глюкозы в своей структуре гликозид витамина Е (tocopherol monoglucosid – TMG) приобретает способность растворяться в воде (>1х103 мг/мл) и проявлять антирадикальную активность не только в липидной фазе биологических мембран, но и в цитоплазме клеток, в отличие от его прототипа -токоферола (Murase H. et al., 1998).
Экспериментальные исследования показали, что гликозид витамина С (ascorbic acid glucoside – AAG) in vitro проявляет меньшую цитотоксичность в высоких концентрациях, чем аскорбиновая кислота (Fujinami Y. et al., 2001; Muto N., Nakamura T., 1990). Кроме того, AAG более стабилен и обеспечивает накопление аскорбиновой кислоты в организме в более высоких концентрациях и, таким образом, может оказывать более выраженный защитный эффект. Одним из основных отличий в механизме антиоксидантного действия AAG по сравнению с аскорбиновой кислотой является то, что он обладает выраженным инактивирующим эффектом по отношению к высокореактивному ОН- радикалу. Это обусловлено тем, что образующиеся при взаимодействии AAG с ОН- радикалом аддукты обладают более низкой способностью к генерации АФК, в отличие от немодифицированного витамина (Mathew D. et al., 2007; Rajagopalan R. et al., 2002; El-Nahas S.M. et al., 1993).
Японскими и индийскими исследователями получены данные о том, что TMG оказывает радиопротекторное действие, эффективно защищает ДНК нормальных клеток от повреждающего действия -излучения, а также защищает нормальные ткани при действии -излучения у мышей опухоленосителей, не снижая его противоопухолевой эффективности (Satiamitra et al., 2001, 2003; Shimanskaya et al., 2001; Nair et al, 2004; Salvi V.P. et al., 2001).
Показано, что AAG защищает ткань печени от повреждающего действия гамма-излучения в эксперименте (Mathew et al, 2007), а в клинических условиях при применении до облучения у больных со злокачественными новообразованиями существенно снижает проявление таких побочных эффектов радиотерапии как тошнота и диарея (Koizumi et al., 2005).
Все вышесказанное делает целесообразным исследование эффективности названных соединений в защите жизнедеятельности и обеспечении полноценного функционирования критических органов и тканей, повреждаемых при цитостатической терапии, и механизмов действия с целью патогенетического обоснования их использования в качестве сопровождающей терапии на фоне комплексного противоопухолевого лечения. Чрезвычайно важной является проблема улучшения качества жизни онкологических больных, получающих цитостатическое лечение, за счет снижения побочных токсических реакций (Чойнзонов Е.Л. и др., 2008). При этом важное значение может иметь аспект повышения эффективности противоопухолевой терапии под влиянием антиоксидантных агентов, которые по механизму действия являются модификаторами биологических реакций и способны регулировать взаимоотношение опухоли и организма, особенно в условиях специфической антибластомной терапии (Якубовская Р.И., 2000; Rozenberg, 1999; Schrimacher P. et al., 2001; Zitvogel L., Kroemer G., 2008).
Цель исследования: изучить влияние гликозида витамина С и гликозида витамина Е на эффективность и токсические эффекты химиотерапии и лучевого воздействия и выявить механизмы их действия.
Задачи исследования:
- Изучить способность гликозидов витамина С и витамина Е повышать противоопухолевую и антиметастатическую эффективность циклофосфана у мышей с перевиваемой опухолью карциномой легких Льюис (LLC).
- Исследовать влияние модифицированных витаминов на показатели системы иммунитета в условиях иммунодепрессии, вызванной введением противоопухолевого цитостатика циклофосфана в высокой дозе.
- Оценить способность гликозидов витамина С и витамина Е снижать нейротоксичность, индуцированную химиопрепаратами.
- Изучить влияние гликозидов витамина С и витамина Е на показатели гемопоэза у мышей после рентгеновского облучения в сублетальной дозе.
- Исследовать защитный эффект гликозида витамина С на пролиферативную активность клеток селезенки мышей при действии гамма-излучения.
- Оценить участие системы глутатиона в защитном действии гликозида аскорбиновой кислоты в условиях окислительного стресса, индуцированного действием радиации и химиотерапии.
Научная новизна
В экспериментальных исследованиях установлено, что модифицированные витамины: гликозид витамина С и гликозид витамина Е, в сравнении с аскорбиновой кислотой и альфа-токоферолом, оказывают более выраженное действие на повышение эффективности и снижение токсичности противоопухолевой терапии.
Впервые показана способность гликозидов витамина С и витамина Е повышать эффективность цитостатической терапии экспериментальных опухолей. Установлено, что введение AAG или TMG потенцирует антиметастатическое действие циклофосфана в низких терапевтических дозах.
Установлено, что гликозиды витамина С и витамина Е способны снижать токсическое действие высоких доз циклофосфана на тимус и селезенку у мышей, а также способствуют более быстрому восстановлению уровня лейкоцитов периферической крови и клеток костного мозга в условиях циклофосфан-индуцированной иммунодепрессии.
Получены новые данные о способности гликозидов витамина С и витамина Е снижать одно из специфических осложнений химиотерапии – нейротоксичность. Приоритет полученных данных подтвержден патентом РФ №2286777 от 10 октября 2006 г “Способ снижения нейротоксичности радиосенсибилизатора саназола в эксперименте”.
Впервые показано, что введение гликозидов витамина С и витамина Е мышам, облученным в сублетальной дозе, умеренно защищает клетки костного мозга и крови в острый период радиационного воздействия и стимулирует процессы восстановления кроветворения, что можно рассматривать как один из основных механизмов радиопротекторного и антитоксического действия изучаемых агентов.
Получены оригинальные данные о том, что гликозид витамина С препятствует ингибированию спонтанной пролиферации лимфоцитов в условиях окислительного стресса in vivo и in vitro.
Установлено, что защитное действие гликозида витамина С в условиях окислительного стресса, индуцированного радио- и химиотерапией, обусловлено нормализацией редокс состояния глутатиона.
Теоретическая и практическая значимость исследования
Полученные результаты расширяют представление о механизмах антитоксического действия модифицированных витаминов - гликозидов витамина С и витамина Е при химиотерапии и лучевом воздействии.
Они могут явиться основой для разработки новых методов коррекции побочных эффектов лекарственной и лучевой терапии, что позволит повысить качество жизни и эффективность лечения онкологических больных.
Полученные результаты позволяют рекомендовать проведение клинической апробации гликозида витамина С в комплексной терапии больных со злокачественными новообразованиями для снижения побочных эффектов химио- и радиотерапии.
Положения, выносимые на защиту:
Гликозиды витамина С и витамина Е способны повышать эффективность терапии злокачественных опухолей циклофосфаном и снижать выраженность токсических проявлений химио- и радиотерапии.
В основе радиопротекторного и антитоксического действия модифицированных витаминов лежит их способность стимулировать восстановление кроветворения и функциональной активности клеток иммунной системы.
Антитоксическое действие гликозида витамина С при противоопухолевой терапии обусловлено его способностью ингибировать процессы перекисного окисления липидов и нормализовать редокс состояние глутатиона.
Апробация работы
Материалы диссертационной работы доложены и обсуждены на ежегодных отчетных конференциях молодых ученых НИИ онкологии СО РАМН в 2003, 2005, 2006, 2009 гг, конференции, посвященной 70-летию биолого-почвенного факультета ТГУ (Томск, 2003), V и VI конгрессе молодых ученых и специалистов “Науки о человеке” (Томск, 2004, 2005), 10, 12, 13-ой международной конференции по повышению эффективности противоопухолевого лечения “Annual meeting on the sensitization of cancer treatment”(Киото, Япония, 2004, 2006, 2007), 13 международном конгрессе по приполярной медицине “Проблемы фундаментальной и прикладной медицины” (Новосибирск, 2006), VII международной конференции “Биоантиоксидант” (Москва, 2006), 1 и 2-ой конференции японского общества по радиопротекции “Radioprotection (Human-Defense) Society” (Киото, Япония, 2007, 2008).
Публикации
По материалам диссертации опубликована 21 работа, в том числе 2 – в центральных журналах, рекомендуемыми “Перечнем…” ВАК Минобрнауки. Получен патент на изобретение №2286777 от 10 ноября 2006 г “Способ снижения нейротоксичности радиосенсибилизатора саназола в эксперименте”.
Объем и структура работы
Диссертационная работа изложена на 171 странице машинописного текста и состоит из введения, 3 глав, заключения, выводов, списка использованной литературы, содержащего 268 источников, из них российских 81, иностранных 185. Работа иллюстрирована 9 таблицами и 21 рисунком.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проводились в рамках проекта международного агентства по атомной энергетике (МАГАТЭ).
Экспериментальные животные
Эксперименты выполнены на 1134 мышах I категории разводки лаборатории экспериментального биомоделирования НИИ фармакологии Сибирского отделения РАМН (сертификат имеется) обоего пола в возрасте 8-14 недель, массой 18-24 г. Используемые линии мышей С57Bl/6J (H-2b), (CBAxС57Bl/6J)F1 (H-2b/k). Животных содержали на стандартном рационе вивария со свободным доступом к воде в соответствии с Правилами Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Лаб. Животные, 2004).
Для получения исследуемого материала мышей забивали методом цервикальной дислокации под эфирным наркозом. Каждый эксперимент был проведен, по крайней мере, дважды.
Препараты, используемые в работе
Гликозид аскорбиновой кислоты (2-O-a -D-глюкопиранозил-L-аскорбиновая кислота) или AAG (Hayashibara Company, Япония) был синтезирован из аскорбиновой кислоты и мальтозы или олигосахаридов путем трансгликозилирования ферментов (Yamamoto I. et al., 1990; Yamamoto I. et al., 1990; Aga H. et al., 1991; Mandai T. et al., 1992) и любезно предоставлен профессором В.Т. Кагией (Health Research Foundation), Киото, г. Япония. Экспериментальные данные in vitro показали, что AAG проявляет меньшую цитотоксичность, чем аскорбиновая кислота в высоких концентрациях (более 0,5 мМ) (Fujinami Y., Tai A., Yamamoto J., 2001).
Водорастворимый витамин Е (TMG), гликозид витамина Е (ССI Company, Япония) был синтезирован из 2-гидроксиметил-2,5,7,8-тетраметилхроман-6-ол и мальтозы в растворе с содержанием DMSO путем трансгликозилирования с -гликозидазой из Saccaromyces species. Гликозилированный продукт был идентифицирован как 2- (-D-глюкопиранозил)метил-2,5,7,8-тетраметилхроман-6-ол. В отличие от витамина Е TMG обладает высокой растворимостью в воде (>1х103 мг/мл), проявляет более высокую антирадикальную активность по сравнению с -токоферолом и его водорастворимым аналогом - тролоксом (Murase H. et al., 1997).
В качестве препаратов сравнения использовали аскорбиновую кислоту и витамин Е (Sigma).
Циклофосфан – N`-бис-(-Хлорэтил)-N`-O-триметиленовый эфир диамида фосфорной кислоты «ЛенсФарм», Москва). Сам циклофосфан не обладает цитотоксическим действием. В результате биотрансформации в печени из него образуются активные метаболиты (фосфамид и акролеин), которые оказывают противоопухолевое действие, атакуя нуклеофильные центры белковых молекул, образуя поперечные сшивки между молекулами ДНК и блокируя митоз в опухолевых клетках (Kehrer J., Biswal S., 2000). Препарат обладает иммунодепрессивным действием (Cupps T. et al., 1982; Ballas Z., 1986).
Саназол (АК-2123) [(N-2’-(метоксиэтил)-2-(3’-нитро-1’-триазолил)ацетамид] - был любезно предоставлен проф. Кагией, Киото, Япония. Саназол – гипоксический радиосенсибилизатор из класса соединений нитротриазолов, полученный в Киотском университете (Япония), преимущество которого по сравнению с его аналогом мисонидазолом заключается в практическом отсутствии токсичности терапевтических доз (Sakano K. et al., 1986). В то же время положительные результаты по эрадикации солидных опухолей при интенсивном режиме введения высоких доз саназола нередко приводят к проявлению нейротоксичности (Kagiya V.T., 2006).
Дизайн экспериментов
Способность модифицированных антиоксидантов модулировать эффективность цитостатической терапии экспериментальных злокачественных новообразований изучали на мышах с гематогенно-метастазирующей в легкие карциномой легких Льюис (LLC), полученной из банка опухолевых штаммов РОНЦ РАМН (г. Москва). Данная опухолевая модель является адекватной для изучения противоопухолевой и антиметастатической активности препаратов (Методические рекомендации по доклиническому изучению средств,…, Москва, 2005).
При терапии экспериментальных опухолей циклофосфан инъецировали внутрибрюшинно двукратно в дозе 120 или 60 мг/кг на 3-и и 7-е сутки после трансплантации опухоли. Группе животных без введения цитостатиков по аналогичной схеме инъецировали эквиобъемные количества физиологического раствора. Гликозид аскорбиновой кислоты, в дозе 50 мг/кг или гликозид витамина Е в дозе 100 мг/кг вводили на протяжении роста опухоли со 2-го дня после перевивки.
Иммунодепрессию у мышей С57Bl/6 моделировали путем однократной внутрибрюшинной инъекции циклофосфана в максимально переносимой дозе 250 мг/кг. Введение гликозидов витамина С в дозе 50 мг/кг или витамина Е в дозе 100 мг/кг начинали со дня инъекции циклофосфана и продолжали в течении 4-7 дней. Для определения уровня показателей у животных без иммунодепрессии использовали группу здоровых мышей, которым вводили физиологический раствор по схеме, аналогичной введению антиоксидантов.
В качестве экспериментальной модели нейротоксичности использовали однократное внутрижелудочное введение саназола в токсической дозе 2,1 г/кг. Для оценки нейротоксического действия саназола служил тест “открытого поля” (Буреш Я. И и др., 1991). Эффективность применяемых воздействий оценивали по поведенческим реакциям (вертикальная, горизонтальная и локомоторная активность) до воздействия, на 1-е и 2-е сутки после введения препаратов. AAG вводили в дозе 50 мг/кг, перорально, TMG в дозе 100 мг/кг, внутрибрюшинно, контрольной группе вводили физиологический раствор за 30 минут до введения саназола.
Для изучения влияния модифицированных витаминов на побочные эффекты рентгеновского излучения у мышей использовали тотальное облучение в сублетальной дозе (доза облучения составила 5,6 Гр, при мощности дозы 0,5 Гр в минуту) на рентгеновском аппарате РУМ-17 (фильтр 0,5 мм. меди + 1,0 мм. алюминия, напряжение на трубке 200 кВ, анодный ток 5 мА).
Для изучения влияния модифицированных витаминов на систему кроветворения и пролиферацию лимфоцитов AAG или витамин С вводили перорально в дозе 100 мг/кг за 60 минут до облучения, TMG вводили внутрибрюшинно в дозе 600 мг/кг непосредственно сразу после облучения. Контрольной группе вводили эквиобъемные количества физиологического раствора по аналогичным схемам. Эффективность воздействия модифицированных антиоксидантов оценивали по динамике восстановления клеток крови и костного мозга, и иммунологическим показателям на 3, 7, 14 и 21-е сутки после облучения, в соответствии со стандартными гематологическими методами (Гольдберг Е.Д., Дыгай А.М., Шахов В.П., 1992)
Окислительный стресс в изолированных спленоцитах in vitro индуцировали гидроперекисью водорода.
Методы исследования
Для перевивки карциномы легких Льюис использовали стерильно выделенные опухолевые клетки по 1 млн. в 0,2 мл среды 199, которые вводили внутримышечно в бедро правой задней лапы.
Оценку эффективности терапевтических воздействий на животных-опухоленосителях проводили по торможению роста первичной опухоли и ингибированию метастазирования. Рассчитывали следующие показатели:
- торможение роста опухоли (ТРО, %):
ТРО = М0-Мк/Мк х 100%, где Мк и М0 – масса опухоли в контрольной (без лечения) и опытной группах;
- индекс ингибиции метастазирования (ИИМ, %) – интегральный показатель, рассчитываемый по формуле: ИИМ = (Ак Вк - АоВо) 100 / (Ак Вк, где Ак Ао) - Ак и Ао – доля мышей с метастазами в контрольной и опытной группах, Вк и Во – среднее количество метастазов в легких (в тех же группах);
- торможение роста метастазов (ТРМ, %): ТРМ = (Sk – So)/ Sk, где Sk и So – суммарная площадь метастазов в контрольной и опытной группах.
Определение уровня аскорбиновой кислоты в плазме крови и в головном мозге мышей проводили методом, предложенным Brubacher G. and Vuilleumier J.P. (1974). Интенсивность флюоресценции измеряли на спектрофлюориметре Hithachi – 750 (Япония).
Гидроперекиси липидов в селезенке мышей определяли FOX-2 методом (Hermes-Lima M., Willmore W.G., Storey K.B., 1995), основанным на способности гидропероксидов липидов окислять ионы Fe2+ при низком значении РН, в результате чего образуется комплекс Fe3+-ксиленолоранж[о-крезолсульфонфталеин-3`,3``-бис(метилиминоди-ацетата натриевая соль], имеющий максимум поглощения при 580 нм. Оптическую плотность регистрировали на СФ-2000 (Россия). В качестве стандарта использовали гидроперекись кумола («Merk», Германия).
Содержание уровня общего, восстановленного и окисленного глутатиона определяли высокоспецифичным и чувствительным циклическим методом, предложенным M. E. Anderson (1985). Кинетику реакции регистрировали на СФ-2000 (Россия). Уровень восстановленного и окисленного глутатиона выражали в мкмоль/мг белка и рассчитывали отношение GSH/GSSG.
Определение количества белка проводили по методу M.M. Bradford (I994) с использованием красителя Coomassie G-250.
Определение спонтанной пролиферации спленоцитов мышей проводили по включению меченного радионуклидами предшественника синтеза нуклеиновых кислот [3Н]-тимидина (Изотоп) в ДНК. Включение [3Н]-тимидина (радиоактивность) в ДНК исследуемых клеток измеряли с использованием планшетного микро--счетчика («Wallac», Голландия) и выражали в импульс/мин.
Статистическая обработка результатов
Все полученные данные подвергали математической обработке, используя методы вариационной статистики. Вычислялось: среднее значение, среднее квадратичное отклонение, ошибка среднего значения. Значимость различий показателей между группами оценивали с использованием непараметрического критерия Вилкоксона - Манна – Уитни. Различия считали статистически значимыми при р<0,05 (Реброва О.Ю., 2003).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Влияние гликозидов витамина С (AAG) и витамина Е (TMG) на эффективность циклофосфана у мышей с карциномой легких Льюис
Природа и механизм воздействия средств, включаемых в комбинированную терапию опухолей, могут быть различны и связаны с их радиомодифицирующим, иммунотропным, адаптогенным, антиоксидантным, антитоксическим действием (Якубовская Р.И., 2000, 2002; Rozenberg, 1999; Schrimacher P. et al., 2001; Zitvogel L., Kroemer G., 2008). Одним из современных подходов к повышению эффективности лечения злокачественных новообразований является использование биотерапевтических воздействий в сочетании с классическими методами (химио-, лучевая терапия, операционное вмешательство). Преимущество такого комплексного подхода заключается в одновременном повреждающем действии на опухолевые клетки и активизации защитных механизмов организма, оказывающих, в свою очередь, противоопухолевый эффект (Чердынцева Н.В., 2002; Гольдберг, Е. Д., Зуева Е.П., 2000; Zitvogel L., 2008). В число МБР входят природные и синтетические иммуномодуляторы и адаптогены, антиоксиданты, цитокины и их индукторы, а также физические факторы (Аничков Н.М., 2003; Кадагидзе З.Г., 2003; Константинова М.М., 2003; Schaid D. et al., 1999; Cerhard C., 2003).
Для изучения модулирующего влияния изучаемых антиоксидантов на рост и метастазирование экспериментальных опухолей использовали перевиваемую карциному легких Льюис (LLC).
Применение ЦФ в максимальной терапевтической дозе 120 мг/ кг приводило к умеренному торможению роста опухоли на 34,8 % и практически полному подавлению метастазирования (ТРМ составило 99,8 %; ИИМ – 99,9 %), однако сопровождалось выраженной токсичностью, о чем судили по снижению клеточности селезенки (таблица 1). Снижение дозы ЦФ хотя и приводило к снижению токсичности (таблица 1), однако не оказывало выраженного терапевтического эффекта (ТРО составило 8,7 %, ИИМ - 74,3 %,, ТРМ -71,6 %, (p<0,05)).
Таблица 1 – Влияние гликозидов витамина С и витамина Е на противоопухолевую и антиметастатическую активность циклофосфана в дозе 60 мг/кг у мышей С57Bl/6 с карциномой легких Льюис (X±m)
| Метастазы | ТРМ, % | ИИМ, % | Клеточность селезенки, 106/мл | ТРО, % | ||
| Количество шт | Площадь мм2 | |||||
| Контроль (LLC), n=5 | 16,7±1,9 | 28,8±4,7 | - | - | 325,0±13,3 | - |
| LLC + ЦФ, 120 мг/кг, n=5 | 1,5±0,5* | 0,045±0,01* | 99,8 | 99,9 | 231,0±9,3* | 34,8 |
| LLC + ЦФ, 60 мг/кг, n=5 | 6,5±1,2* | 8,2±3,4* | 71,6 | 74,3 | 294,0±10,1 | 8,7 |
| ЦФ(60)+TMG, 100 мг/кг, n=5 | 2±0,8** | 0,6±0,3** | 91,5 | 83 | 341,0±31,9** | 15,2 |
| ЦФ(60)+Вит.Е, 100 мг/кг, n=5 | 4,8±1,9 | 4,7±0,6 | 42,7 | 26,2 | 319,2±29,7 | 0 |
| ЦФ(60)+AAG, 50 мг/кг, n=5 | 6,5±1,5 | 2,9±1,7** | 89,9 | 61 | 421,0±38,9** | 0 |
| ЦФ(60)+Вит.С, 50 мг/кг, n=5 | 4,2±1,3 | 5,9±0,8 | 28,0 | 35,4 | 325±24,3 | 9,2 |
| Примечания 1 в таблице приведены результаты одного из 3-х серий экспериментов; 2 *- различия статистически значимы с контролем (p<0,05); 3 ** - различия статистически значимы с группой ЦФ, 60 мг/кг (p<0,05). | ||||||
Использование ЦФ в низкой дозе совместно с ААG или TMG приводило к выраженному торможению метастазирования, которое по величине было сравнимо с эффектом препарата в максимальной терапевтической дозе, но при этом не отмечалось токсического действия на селезенку (таблица 1). Влияния на первичный рост опухоли практически не отмечено. С одной стороны, это подтверждает целесообразность удаления первичного опухолевого узла для достижения максимальной эффективности сочетанного использования цитостатической терапии и модификаторов, с другой - свидетельствует о безопасности их применения при наличии опухолевого процесса в организме с точки зрения возможной стимуляции опухолевого роста. Введение аскорбиновой кислоты и -токоферола совместно с циклофосфаном не оказывало выраженного влияния на антиметастатическую эффективность цитостатической терапии.
Известно, что основной причиной смертности от злокачественных новообразований является диссеминация процесса, поэтому с самого начала развития направления по использованию модификаторов биологических реакций в онкологии главной целью было ингибирование метастазирования опухоли. В основе торможения метастатического процесса важную роль играет иммунная система. В последние годы убедительно показано, что иммунная система в синергичном режиме вовлекается в эрадикацию опухолевых клеткок при цитостатической терапии (Schrimacher P., 2001; Zitvogel L., 2008). Это происходит в связи с модификацией опухолевых клеток цитостатическими препаратами, способствующей активации специфического иммунного ответа. Однако иммуносупрессирующее действие цитостатической терапии может повреждать иммунную систему. Поэтому следующим этапом исследований была оценка способности модифицированных витаминов снижать токсическое действие цитостатиков на иммунную систему на модели циклофосфановой иммунодепрессии.
Влияние модифицированных антиоксидантов на уровень ядросодержащих клеток органов иммунитета при иммунодепрессии, вызванной введением высокой дозы циклофосфана
Циклофосфан – алкилирующий агент с высокой эффективностью и широким спектром противоопухолевого действия. Однако при проведении терапии больных злокачественными опухолями циклофосфаном, как и большинством противоопухолевых агентов, часто лимитирующими факторами являются миело – и иммунотоксичность цитостатических агентов, что вынуждает прекратить лечение или снизить дозы противоопухолевых агентов (Птушкин В.В., 2002; Yoon S. et al., 2003).
На общепринятой экспериментальной модели было показано, что ведение ЦФ в максимально переносимой дозе (250 мг/кг) угнетает кроветворение и иммунную систему мышей (таблица 2).
Таблица 2 – Влияние гликозидов витамина С (AAG) и витамина Е (TMG) на клеточность селезенки, тимуса, количество лейкоцитов в периферической крови и миелокариоцитов у мышей (С57Bl/6), получавших циклофосфан в дозе 250 мг/кг (X±m)
| Группы животных | Клеточность селезенки, млн/орган | Клеточность тимуса, млн/оган | Количество лейкоцитов в пер. крови, млн/мл | Количество миелокариоцитов, млн/бедро | |
| 4-е сутки | Интактные животные | 152,8±7,4 | 153,3±8,4 | 9,9±1,1 | 9,4±0,8 |
| ЦФ, 250 мг/кг | 55,6±3,6 | 19,2±1,4 | 2,2±0,3 | 3,8±0,4 | |
| ЦФ, 250 мг/кг + AAG, 50 мг/кг | 61,6±4,8 | 17,2±1,7 | 3,8±0,1* | 6,4±0,1* | |
| ЦФ, 250 мг/кг + TMG, 100 мг/кг | 57,6±3,1 | 15,4±1,6 | 3,2±0,2* | 4,9±0,9 | |
| 7-е сутки | ЦФ, 250 мг/кг | 118,8±6,9 | 68,0±2,02 | 6,5±0,6 | 15,1±1,6 |
| ЦФ, 250 мг/кг + AAG, 50 мг/кг | 151,2±9,9* | 82,8±10,7* | 9,96±1,4* | 16,6±0,7* | |
| ЦФ, 250 мг/кг + TMG, 100 мг/кг | 134,5±5,5* | 81,6±9,5 | 9,7±1,5* | 15,7±1,3* | |
| Примечание * - различия статистически значимы с группой ЦФ, 250 мг/кг (p<0,05). | |||||
Нарушение костномозгового кроветворения является критическим механизмом, ограничивающим использование цитостатических препаратов, с другой стороны, костный мозг – это морфофункциональная основа иммунной системы, напрямую определяющая ее полноценность. Оба модифицированных витамина оказывали протекторное действие, особенно выраженное в ранние сроки воздействия, на костный мозг мышей, получавших токсичную дозу цитостатика (таблица 2).
Одним из информативных критериев, позволяющих оценить степень повреждающего действия цитостатической химиотерапии на организм, является показатель общего количества лейкоцитов в периферической крови. Изучаемые антиоксиданты показали не только умеренную защиту этого показателя в «острый» период миелодепрессии, но и более раннее его восстановление до уровня нормы (таблица 2). Введение гликозидов аскорбиновой кислоты и витамина Е совместно с циклофосфаном в дозе 250 мг/кг сопровождалось повышением клеточности селезенки практически до уровня контроля. Клеточность тимуса увеличивалась до 54 и 52 % от исходного уровня, соответственно. Очевидно, что данные эффекты AAG и TMG могут вносить значительный вклад в улучшение переносимости цитостатической терапии (Туков А.Р. и др., 2002).
Влияние модифицированных антиоксидантов на показатели гемопоэза у мышей при действии гамма облучения
Ионизирующая радиация, используемая при лечении онкологических больных, оказывает повреждающее действие на нормальные ткани и вызывает комплексный ответ на клеточном и молекулярном уровнях. Одной из наиболее радиочувствительных является кроветворная система, поражение которой может оказаться критическим в плане невозможности продолжения лечения и, в случае фракционирования, для набора необходимой терапевтической суммарной дозы облучения.
Мы изучили влияние модифицированных антиоксидантов AAG и TMG на клетки крови при облучении мышей С57Bl/6 рентгеновскими лучами. Для этого была использована общепринятая экспериментальная модель, в которой мышей подвергали общему однократному рентгеновскому облучению в сублетальной дозе 5,6 Гр. AAG вводили за 60 минут до облучения в дозе 100 мг/кг, TMG сразу после облучения в дозе 600 мг/кг. В течение 24 дней после облучения наблюдали за изменением клеточного состава периферической крови и костного мозга.
Мы отметили, что в ранний период после воздействия степень лейкопении была менее выражена в группах облученных мышей, получавших AAG и TMG, чем в контрольной группе (рисунок 1, 2).
Известно, что лимфоциты составляют наибольшую долю клеток крови у мышей и являются менее устойчивыми к действию радиации по сравнению с другими клетками крови (Данилов И.П., Микша Я.С., 1999; Михайловская Э.В., 1999). Введение гликозида витамина Е приводило к значительной защите уровня лимфоцитов в периферической крови (рисунок 1). Абсолютное и процентное содержание лимфоцитов у мышей с ТМG на всем протяжении исследования было значимо выше, чем в группе облученных животных, получавших физиологический раствор, а, начиная с 8-х суток, не отличалось от показателей у необлученных животных. При введении AAG наблюдалась практически такая же закономерность (рисунок 2).
В острый период опустошения костного мозга (первую неделю после облучения) происходило существенное снижение клеточности костного мозга у животных всех исследуемых групп (рисунки 3, 4).
В группах животных, которым вводили ААG до облучения и TMG сразу после облучения, количество миелокариоцитов было умеренно выше, чем в контроле. К 14-му дню после облучения наблюдалась регенерация костного мозга и увеличение числа миелокариоцитов.

Рисунок 1 – Влияние гликозида витамина Е (ТМG) на содержание лейкоцитов (слева) и лимфоцитов (справа) в периферической крови мышей С57Bl/6 в разные сроки после облучения в сублетальной дозе 5,6 Гр (X±m)
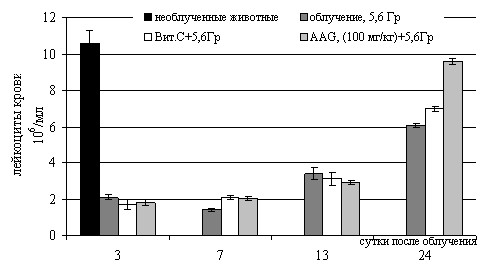

Рисунок 2 – Влияние гликозида витамина С (ААG) на содержание лейкоцитов (слева) и лимфоцитов (справа) в периферической крови мышей С57Bl/6 в разные сроки после облучения в сублетальной дозе 5,6 Гр (X±m)
При этом следует отметить, что содержание лимфоидных элементов в группе облученных животных, которым вводили AAG и TMG, значительно раньше достигало контрольного уровня, чем в группе только облученных животных (рисунки 3, 4).
Процесс регенерации был более выражен в группе с AAG, чем у получавших витамин С мышей, о чем судили по общему содержанию миелокариоцитов и лимфоидных элементов костного мозга (рисунки 3, 4).
По всей видимости, способность модифицированных витаминов уменьшать выраженность пострадиационной депрессии кроветворения обусловлена их защитным действием на лимфоидный росток кроветворения, и стимулирующим – на процессы кроветворения в восстановительный период.

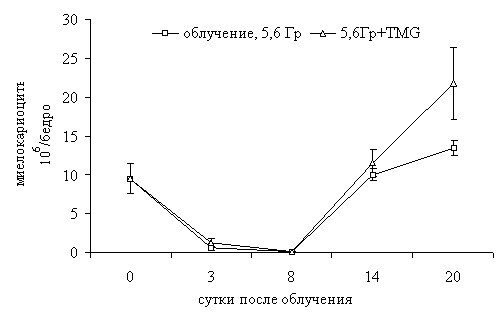 Рисунок 3 – Влияние гликозида витамина Е (ТМG) на содержание миелокариоцитов и лимфоидных клеток в костном мозге мышей С57Bl/6 в разные сроки после облучения в сублетальной дозе 5,6 Гр (X±m)
Рисунок 3 – Влияние гликозида витамина Е (ТМG) на содержание миелокариоцитов и лимфоидных клеток в костном мозге мышей С57Bl/6 в разные сроки после облучения в сублетальной дозе 5,6 Гр (X±m)


Рисунок 4 – Влияние гликозида витамина С (ААG) на содержание миелокариоцитов (слева) и лимфоидных клеток (справа) в костном мозге мышей С57Bl/6 в разные сроки после облучения в сублетальной дозе 5,6 Гр (X±m)
Способность модифицированных витаминов снижать нейротоксичность гипоксического радиосенсибилизатора саназола
Широкое использование лучевой терапии для воздействия на опухолевый процесс привело к созданию подхода по увеличению ее эффективности на основе использования радиосенсибилизаторов, позволяющих расширить радиотерапевтический потенциал, т. е. селективно усилить повреждение опухоли и снизить радиопоражаемость нормальных тканей (Бойко А.В. и др., 2004). В их число входят электроноакцепторные соединения нитроимидазольного ряда – мисонидазол, метронидазол, обладающие высокой нейротоксичностью (Sugie C. et al., 2005).
Головной мозг, в сравнении с другими органами, наиболее подвержен опасности воздействия свободных радикалов, и недостаточность антиоксидантной системы может быть причиной развития нейротоксичности (Heinrich E., Getoff N., 2000; Joshi G. et al., 2007). Синтезированный в 90-х годах саназол (Kimura R et al., 1986) выгодно отличался от мисонидазола низкой нейротоксичностью его терапевтических доз. В то же время положительные результаты по эрадикации солидных опухолей при интенсивном режиме введения высоких доз саназола, нередко приводят к появлению нейротоксичности (Kagiya V.T., 2006).Поскольку в развитии нейротоксического эффекта принимают участие АФК, достаточно очевидным является предположение о потенциальной роли антиоксидантов в качестве церебропротективных агентов, поэтому мы изучили возможность использования модифицированных витаминов для снижения нейротоксичности. Для этого в работе была создана модель нейротоксичности, индуцированной высокими (превышающими терапевтические) дозами саназола. Наличие нейротоксического действия и степень его выраженности, оценивали по поведенческим реакциям животных в классическом тесте “открытое поле” (Буреш Я. И и др., 1991).
Через 2 часа после введения саназола в дозе 2,1 г/кг наблюдалось статистически значимое снижение всех параметров поведения (вертикальной, горизонтальной двигательной активности и эмоциональной реакции) в “открытом поле” в сравнении с контрольной группой (p<0,05), которой вводили только физиологический раствор (рисунок 5).



Полученные данные указывают на то, что саназол в высокой дозе проявляет нейротоксический эффект, поскольку нарушение параметров поведения и ориентации животных является индикатором, свидетельствующим о развитии нейротоксического эффекта (Teunissen C.E. et al., 2001).
Введение гликозидов витамина С и витамина Е в концентрации 50 мг/кг и 100 мг/кг, соответственно, за 30 минут до введения высокой дозы саназола, приводило к статистически значимому повышению показателей эмоциональной и двигательной активности у мышей (p<0,05), по сравнению с группой животных, получавших только саназол, что указывает на их защитный эффект, то есть способность снижать нейротоксичность (рисунок 5).
На 2-й день после введения саназола происходило дальнейшее снижение эмоциональной, горизонтальной и двигательной активности в группе мышей, которой вводили только саназол (рисунок 5). Введение AAG или TMG способствовало восстановлению этих показателей (рисунок 5). Введение аскорбиновой кислоты не оказывало значимого влияния на данные показатели, по сравнению с группой животных, получавших гликозид аскорбиновой кислоты (р<0,05), а на 2-е сутки эксперимента даже привело к гибели животных, что может быть связано с прооксидантным действием аскорбиновой кислоты.
Для прояснения причин различий модулирующей и антитоксической эффективности AAG и витамина С мы оценили динамику уровня аскорбиновой кислоты в плазме крови у здоровых животных после введения гликозида витамина С в сравнении с введением экзогенной аскорбиновой кислотой. Было показано, что при введении AAG в дозе 50 мг/кг, наблюдается более быстрое и существенное увеличение уровня аскорбиновой кислоты в плазме крови, чем при введении просто аскорбиновой кислоты в той же дозе(p<0,05). В условиях нейротоксичности мы показали способность AAG предотвращать снижение уровня аскорбиновой кислоты в крови в условиях нейротоксического воздействия.
Это указывает на то, что введение гликозида витамина С может длительное время поддерживать высокие концентрации аскорбиновой кислоты в крови тем самым обеспечивая более выраженное защитное действие в организме.
Таким образом, в первой части работы представлены результаты, характеризующие эффекты новых модифицированных витаминов гликозидов витамина С и витамина Е, которые ранее не изучались. Принимая во внимание тот факт, что AAG является широко распространенным препаратом, достаточна легка технология его получения, что обеспечивает его низкую стоимость. Эффекты AAG проявляются при кратно более низких концентрациях, при пероральном пути введения. Все это свидетельствует, что при сопоставимых биологических эффектах с TMG гликозид витамина С является более перспективным в плане его внедрения в практическую медицину, как одного из препаратов поддерживающей терапии онкологических больных. Поэтому дальнейшее углубленное изучение механизма радиопротекторного и антинейротоксического действия было предпринято для гликозида витамина С.
Влияние гликозида витамина С на пролиферативную активность спленоцитов у мышей, облученных в сублетальной дозе
Способность клеток к пролиферации является одним из ключевых условий восстановления гемопоэза при действии повреждающих факторов, поэтому было изучено влияние гликозида витамина С и аскорбиновой кислоты на пролиферативную активность спленоцитов после облучения мышей в сублетальной дозе. Максимальное снижение пролиферативной активности клеток наблюдалось на 3-и сутки (рисунок 6) и было ассоциировано с минимальным уровнем ядросодержащих клеток в селезенке. Введение животным за один час до облучения аскорбиновой кислоты или ее гликозида препятствовало снижению пролиферативной активности клеток на протяжении всего эксперимента, при этом эффект гликозида был более значительным (рисунок 6).

Полученные результаты свидетельствуют о том, что радиозащитный эффект AAG на костный мозг и органы иммунной системы в существенной степени обусловлен его влиянием на пролиферативную активность клеток. Это влияние может носить как опосредованный характер, через воздействие на цитокиновую регуляцию процесса пролиферации, так и непосредственный, путем снижения уровня токсических интермедиатов кислорода и предотвращения их повреждающего действия на клетки.
Действительно, мы показали, что введение AAG за 1 час до тотального облучения мышей приводило к снижению уровня первичных продуктов ПОЛ – гидроперекисей липидов в селезенке через 12 и 24 часа после воздействия, более существенному по сравнению с аскорбиновой кислотой (рисунок 7).

Мы подтвердили эти результаты и на модели индукции окислительного стресса гидроперекисью водорода в изолированных спленоцитах in vitro. Гидроперекись водорода в высокой концентрации значимо ингибировала спонтанную пролиферацию спленоцитов. AAG в концентрации 5 мМ, в отличие от аскорбиновой кислоты в той же концентрации, полностью препятствовал ингибирующему действию Н2О2 на пролиферативные процессы в спленоцитах.
Исследование роли системы глутатиона в антитоксическом действии гликозида аскорбиновой кислоты
Основным механизмом повреждающего действия при химиотерапии и лучевом воздействии является избыточная генерация активных форм кислорода и радикалов в результате активации микросомального окисления и радиолиза воды. Посрадиационная ответная реакция клеток обусловлена состоянием антиоксидантной системы, что подтверждается многочисленными литературными данными (Biaglow J.E., et al., 2003; Guo G., et al., 2003; Ustinova A.A., Riabinin V.E., 2003; D'Andrea G.M., 2005). Ключевая роль в защите клеток от окислительного стресса отводится системе глутатиона. Недавние исследования показали, что аскорбиновая кислота играет важную роль в поддержании нормального уровня глутатиона в условиях окислительного стресса (Montecinos V. et al., 2007). Поэтому целесообразно было изучить влияние AAG на систему глутатиона в условиях окислительного стресса, индуцированного различными воздействиями, в частности, радиосенсибилизатором саназолом, при его использовании в нейротоксической дозе, и гамма-излучением в сублетальной дозе.
Введение саназола в нейротоксической дозе приводило к существенному снижению уровня восстановленного глутатиона в головном мозге экспериментальных животных (таблица 3). Содержание окисленного глутатиона при этом существенно повышалось и отношение GSH/GSSG снижалось, что свидетельствует об активации процессов окислительного стресса в ткани мозга.
Таблица 3 – Уровень восстановленного (GSH), окисленного (GSSG) и отношение GSH/GSSH в мозге мышей, получавших гликозид аскорбиновой кислоты в сочетании с нейротоксической дозой саназола (X±m)
| Группы животных | GSH (мкмоль/ г ткани) | GSSG (нмоль/ г ткани) | GSH/GSSG |
| Интактные | 1,34± 0,08 | 8,48± 0,53 | 163 |
| Саназол, 2,1 г/кг | 0,95± 0,08* | 10,64± 0,64* | 89* |
| Саназол, 2,1 г/кг + Вит.С, 50 мг/кг | 1,06± 0,08* | 10,08± 0,35 | 104* |
| Саназол, 2,1 г/кг + AAG, 50 мг/кг | 1,30± 0,05** | 8,76± 0,3** | 148** |
| Примечания 1 * - различия статистически значимы с интактной группой (p0,05); 2 ** - различия статистически значимы с саназолом (p0,05). | |||
Предварительное введение животным AAG приводило к повышению уровня GSH и снижению уровня окисленного глутатиона, по сравнению с группой животных, получавших только саназол. В результате этого происходило восстановление отношения GSH/GSSG, что свидетельствует о защите клеток от окислительного стресса. Очевидно, что способность AAG поддерживать высокий уровень GSH вносит вклад в его нейропротекторное действие. В то же время предварительное введение аскорбиновой кислоты не вызывало существенного повышения уровня GSH и не оказывало выраженного нейропротекторного эффекта.
Аналогичный эффект антиоксидантов на уровень глутатиона в спленоцитах мы наблюдали и на модели облучения животных в сублетальной дозе. Предварительное введение гликозида витамина С способствовало сохранению более высокого уровня восстановленного глутатиона в спленоцитах мышей в ранние сроки после облучения и более быстрому восстановлению его уровня до контрольных значений в отдаленные сроки (рисунок 8). AAG более эффективно, чем витамин С предотвращал повышение окисленной формы глутатиона и способствовал сохранению уровня его восстановленной формы и отношения GSH/GSSG в условиях окислительного стресса, индуцированного облучением.



Это объясняется тем, что в условиях in vivo, благодаря стабильности AAG, более длительное время создается высокая концентрация аскорбиновой кислоты в плазме крови. Под действием активных форм кислорода, образующихся в процессе радиолиза воды при действии радиации, происходит окисление аскорбиновой кислоты, в результате образуется дегидроаскорбиновая кислота, которая с помощью транспортеров глюкозы ГЛУТ-1 транспортируется в клетки и индуцирует активацию пентозофосфатного цикла (Puskas F. et al., 2000). Окисленный глутатион, образующийся в реакциях нейтрализации активных радикалов, генерируемых ионизирующим излучением, восстанавливается в глутатинредуктазной реакции за счет NADPH, который синтезируется в активированном пентозофосфатном цикле. Это позволяет клеткам поддерживать более высокий редокс-потенциал системы глутатиона и защищает их от радикалов, образующихся при действии ионизирующей радиации.
Таким образом, в результате проведенных исследований впервые показан целый ряд модулирующих эффектов новых соединений – гликозида витамина С (AAG) и гликозида витамина Е (TMG). Выявлена способность AAG и TMG повышать антиметастатическую эффективность циклофосфана путем снижения его токсического действия на показатели системы иммунитета и стимуляции функциональной активности лимфоцитов, при этом показано преимущество модифицированных витаминов по сравнению с природными. Показан широкий спектр антитоксической активности модифицированных витаминов на моделях циклофосфан-индуцированной гемо- и иммунотоксичности, нейротоксичности, рентгеновского облучения в сублетальной дозе, окислительного стресса in vitro. Одним из важных механизмов протекторного действия изучаемых агентов в условиях индукции окислительного стресса под влиянием цитостатической терапии является их способность проявлять умеренное защитное действие на клетки костного мозга и иммунной системы в ранний период после повреждающего действия и существенно стимулировать процессы восстановления кроветворения и функциональной (пролиферативной) активности лимфоцитов. Гликозид аскорбиновой кислоты более выражено, чем аскорбиновая кислота, ингибирует ПОЛ и способен сохранять высокий редокс-потенциал системы глутатиона. Полученные данные являются патогенетическим обоснованием для использования гликозида витамина С в комплексном лечении онкологических больных с целью снижения миело-, иммуно- и нейротоксических проявлений, индуцируемых химио- и лучевой терапией.
Выводы
- Гликозиды витамина С и витамина Е усиливают антиметастатическое действие низких доз циклофосфана (60 мг/кг) у мышей С57Bl/6 с карциномой легких Льюис (торможение роста метастазов составило 89,9% и 91,5% соответственно, индекс ингибиции метастазирования в группе с TMG составил 83%), что сопоставимо с уровнем эффективности максимальной дозы цитостатика (120 мг/кг) (ТРМ - 99,8%, ИИМ - 99,9%).
- Введение модифицированных витаминов одновременно с токсической дозой циклофосфана (250 мг/кг) существенно предотвращает степень снижения клеточности селезенки и содержания лейкоцитов в периферической крови и миелокариоцитов в костном мозге и способствует ускоренному их восстановлению у мышей С57Bl/6.
- Гликозиды витамина С и витамина Е способны нормализовать поведенческие реакции (горизонтальную, вертикальную двигательную активности и эмоциональную реакцию) животных в условиях индуцированной нейротоксичности, что свидетельствует о их нейропротекторном действии.
- Введение гликозидов витамина С и витамина Е мышам, облученным в сублетальной дозе, способствует защите уровня лейкоцитов и лимфоцитов в периферической крови и ядросодержащих клеток костного мозга на ранних этапах после гамма-облучения и ускоренному восстановлению кроветворения.
- Гликозид витамина С препятствует ингибированию спонтанной пролиферации спленоцитов при гамма облучении in vivo и в условиях окислительного стресса, индуцированного in vitro гидроперекисью водорода.
- Гликозид витамина С снижает уровень окислительного стресса, индуцированного радиацией и цитостатическими агентами, в нормальных клетках и тканях путем влияния на систему глутатиона, нормализуя соотношение восстановленной и окисленной форм глутатиона.
- Модифицированные витамины (гликозиды витамина С и витамина Е) в сравнении с аскорбиновой кислотой и альфа-токоферолом оказывают более выраженное действие на повышение эффективности и снижение токсичности противоопухолевой терапии.
Список работ, опубликованных по теме диссертации
- Inhibitory effect of water soluble bioantioxidants on the neurotoxicity induced by sanazole sensitizer in mice // 10th Annual Meeting on the Sensitization of Cancer Treatment, Japan. – 2004. – P. 19. (соавт. Cherdyntseva N.V., Kagiya T.).
- Исследование способности антиоксидантных агентов (аскорбиновой кислоты и водорастворимого витамина Е) понижать нейротоксичность высоких доз препарата саназола (АК-2123) у мышей (CBAxC57Bl/6)F1 // Науки о человеке: сборник статей по материалам пятого конгресса молодых ученых и специалистов, Томск. – 2004. – С. 332-334. (соавт. Малиновская Е.А.).
- Исследование способности водорастворимых антиоксидантов снижать нейротоксичность высоких доз саназола в эксперименте // Современное состояние и перспективы развития экспериментальной и клинической онкологии”, Томск. – 2004. – С. 312-313. (соавт. Чердынцева Н.В., Малиновская Е.А., Кагия Т.В.).
- Effect of tocopherol-monoglucoside (TMG) on hematopoietic recovery in irradiated mice // 47th Annual Meeting Japan Radiation Research Society, Nagasaki. – 2004. 11/25-27. – P.77. (соавт. Cherdyntseva N.V., Butorin I.Yu., Gervas P.A., Murase H.).
- Effect of tocopherol-monoglucoside (TMG), a water-soluble glycosylated derivative of vitamin E, on hematopoietic recovery in irradiated mice // J. Rad. Res. – 2005. – Vol. 46, №1. – P. 37-41. (соавт. Butorin I.Yu., Cherdyntseva N.V., Gervas P.A., Murase H., Kagiya V.T.).
- Влияние водорастворимого аналога витамина Е (TMG) на систему кроветворения у сублетально облученных мышей // Науки о человеке: сборник статей по материалам шестого конгресса молодых ученых и специалистов, Томск. – 2005. –С. 90-91. (соавт. Буторин И.Ю.).
- Effect of ascorbic acid and its glycoside on the glutathione level in brain of mice administered with high dose of sanazole (AK-2123) // 12 Annual Meeting on the sensitization of cancer treatment, Japan. – 2006. – P.18. (соавт. Cherdyntseva N.V., Ivanov V.V., Kagiya T.V.).
- Tocopherol mono-glucoside, and ascorbic acid glycoside modulate the efficacy of cyclophosphamide (CPA) // 12 Annual Meeting on the sensitization of cancer treatment, Japan. – 2006. – P.19. (соавт. Cherdyntseva N.V., Kagiya T.V.).
- Определение глутатиона в гомогенате мозга мышей после введения высокой дозы саназола // IV Всероссийская конференция молодых ученых “Проблемы фундаментальной и прикладной медицины”, Новосибирск. – 2006. – С. 24-25.
- Способность водорастворимого витамина Е (TMG) и гликозида витамина С (AA-2G) модулировать терапевтическую эффективность циклофосфана // Актуальные вопросы экспериментальной и клинической онкологии: сборник материалов региональной конференции молодых ученых, Томск. – 2006. – С.29-30.
- Влияние модифицированного антиоксиданта гликозида витамина С (AA-2G) на уровень глутатиона в гомогенате мозга мышей // VII Международная конференция “Биоантиоксидант”, Москва. – 2006. – С.142-144. (соавт. Чердынцева Н.В., Иванов В.В.).
- Способ снижения нейротоксичности радиосенсибилизатора саназола в эксперименте // Патент Российской Федерации на изобретение №2286777 от 10 ноября 2006 г. (соавт. Чердынцева Н.В., Малиновская Е.А., Кагия Т. В.).
- Biological mechanisms underlying the tocopherol mono-glucoside (TMG) ability to modify the efficacy of chemotherapy and decrease radio-and chemotoxicity // 13 Annual Meeting on the sensitization of cancer treatment, Japan. – 2007. – P.16. (соавт. Cherdyntseva N.V., Ivanov V.V., Butorin I.Yu., Murase H., Kagiya T.V.).
- Glucoside of ascorbic acid modifies efficacy and toxicity of chemotherapy and gamma irradiation // 13 Annual Meeting on the sensitization of cancer treatment, Japan. – 2007. – P.117. (соавт. Cherdyntseva N.V., Ivanov V.V., Malinovskaya E., Shepilova V., Kagiya T.V.).
- Biological mechanisms underlying the tocopherol mono-glucoside (TMG) ability to modify the efficacy of chemotherapy and decrease radio-and chemotoxicity // Конференция японского общества по радиопротекции, Kyoto, Japan. – 2007. – P.27. (соавт. Cherdyntseva N.V., Ivanov V.V., Butorin I.Yu., Murase H., Kagiya T.V.).
- Tocopherol mono-glucoside and Ascorbic acid glucoside inhibit radiation and chemotherapy induced side effects // Конференция японского общества по радиопротекции, Kyoto, Japan. – 2007. – P.28. (соавт. Cherdyntseva N.V., Ivanov V.V., Kagiya T.V.).
- Glucoside of ascorbic acid modifies efficacy and toxicity of chemotherapy and gamma irradiation // 1st Radioprotection (Human-Defense) Society, Kyoto, Japan. – 2007. - P.29. (соавт. Cherdyntseva N.V., Ivanov V.V., Malinovskaya E., Shepilova V., Kagiya T.V.).
- Mechanisms underlying the glucoside of ascorbic acid capacity to protect hemopoiesis in gamma-irradiated mice // 2nd Radioprotection (Human-Defense) Society, Kyoto, Japan. – 2008. – P.42-43. (соавт. Cherdyntseva N., Ivanov V., Shepilova V., Cherdyntsev E., Kagiya T.V.).
- Механизм действия гликозида витамина С (AAG) в защите системы кроветворения у мышей после облучения в сублетальной дозе // IV региональная конференция молодых ученых-онкологов им. Академика РАМН Н.В. Васильева “Актуальные вопросы экспериментальной и клинической онкологии”, Томск, 2009. – прил. № 1. – Р. 80 – 81. (соавт. Шепилова В.А.).
- Способность гликозида витамина С (AAG) защищать систему кроветворения у мышей после облучения в сублетальной дозе // Материалы Российской науно-практической конференции с международным участием “Проблемы современной онкологии”, Барнаул. – 2009. – С. 143 – 144. (соавт. Иванов В.В., Шепилова В.А.).
- Способность модифицированных витаминов Е и С модулировать терапевтическое действие циклофосфана // Сибирский онкологический журнал, № 2(32). – 2009. – С.55-59. (соавт. Иванов В.В., Чердынцева Н.В., Шепилова В.А., Кагия Т.В.).
Автор выражает глубокую признательность проф. В.Т. Кагии (Киото, Япония), к.б.н. С.Ю. Семенову, В.А. Шепиловой за помощь при проведении исследований и обсуждении результатов.
Список сокращений
АК-2123 – саназол
АО – антиоксидант
АФК – активные формы кислорода
ПОЛ – перекисное окисление липидов
ЦФ – циклофосфан
AAG – гликозид аскорбиновой кислоты (ascorbic acid glucoside)
GSH – восстановленный глутатион
GSSG – окисленный глутатион
LLC – карцинома легких Льюис
TMG – гликозид витамина (tocopherol monoglucoside)

