Клиническое значение диагностики геморрагических диатезов, генетических форм тромбофилии и полиморфизмов генов гемос таза у беременных с массивными акушерскими кровотечениями в анамнезе
- На правах рукописи
- СМУРЫГИНА ВАЛЕНТИНА ВИКТОРОВНА
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ДИАГНОСТИКИ ГЕМОРРАГИЧЕСКИХ
ДИАТЕЗОВ, ГЕНЕТИЧЕСКИХ ФОРМ ТРОМБОФИЛИИ И
ПОЛИМОРФИЗМОВ генов гемостаза
У БЕРЕМЕННЫХ с МАССИВНЫми АКУШЕРСКИми КРОВОТЕЧЕНИЯми в анамнезе
14.01.01. Акушерство и гинекология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
МОСКВА – 2010
Работа выполнена в ГОУ ВПО Первый Московский государственный медицинский университет имени И.М. Сеченова
Научный руководитель:
Доктор медицинских наук, профессор
Александр Давидович Макацария
Официальные оппоненты:
Академик РАМН, доктор медицинских наук, профессор
Владимир Николаевич Серов
Доктор медицинских наук, профессор
Лали Григорьевна Сичинава
Ведущее учреждение:
Московский Областной Научно-Исследовательский Институт Акушерства и Гинекологии МЗ РФ
Защита состоится «____» ___________________2010 г. в ___часов
на заседании диссертационного совета Д.208.040.03 в ГОУ ВПО Первый МГМУ имени И.М. Сеченова (119991,г. Москва, ул. Трубецкая, д.8, стр.2)
С диссертацией можно ознакомиться в ГЦНМБ Первого МГМУ имени
И.М. Сеченова (117998, г. Москва, Нахимовский пр-т, д.49)
Автореферат разослан «____» ___________________2010 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук,
профессор Александр Михайлович Шулутко
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы.
Проблема массивных акушерских кровотечений продолжает оставаться одной из наиболее актуальных в современном акушерстве. В структуре материнской смертности как в СССР так и в России массивные акушерские кровотечения продолжают занимать одно из ведущих мест, являясь в 20-25% случаев единственной причиной смертельных исходов (Репина М.А., 1986), а у погибших сопутствующей, но фатальной причиной. Во всем мире акушерские кровотечения остаются одной из важнейших причин материнской смертности. Согласно мировой статистике более 150000 женщин в год погибают от послеродовых кровотечений.
Послеродовое кровотечение (ПРК) – акушерское осложнение, которое может трансформировать нормальный физиологический процесс родов в жизнеугрожающее состояние. Кесарево сечение также может осложниться массивным кровотечением.
Предродовое кровотечение, возникающее в 2-5% беременностей часто предшествует послеродовому. Предродовым кровотечением называют кровотечение, возникающее после 20 недели беременности (Higgins L., 2003). В основе его этиологии могут лежать различные причины: от предлежания плаценты до генитальных инфекций. Наиболее частыми причинами предродового кровотечения являются: предлежание плаценты, преждевременная отслойка плаценты, варикозное расширение вен вульвы и влагалища, травма влагалища или шейки матки, доброкачественные или злокачественные новообразования генитального тракта, гематурия, инфекции вульвы и влагалища, цервициты, vasa previa (кровотечение из кровеносных сосудов плода, вызванное нарушенным прикреплением пуповины, при повреждении мембран).
ВОЗ определяет ПРК как послеродовую кровопотерю более 500 мл (ВОЗ,1990). Более точное определение – это объем кровопотери, достаточный для того, чтобы стать причиной геморрагического шока и вызвать летальный исход. ПРК после кесарева сечения определяется как кровопотеря более 1000 мл.
Наиболее ёмким является определение ПРК как любой кровопотери, вызывающей физиологические изменения, которые могут быть угрозой жизни женщины (McCormic M.E., 2002).
Согласно мировой классификации кровотечения подразделяются на тяжелые (объем кровопотери 1000-1500 мл) и массивные (объем кровопотери более 1500мл), сопровождающиеся тяжелыми гемодинамическими нарушениями и серьезно повышающие риск материнской смертности (McLintock C., 2009). При массивном акушерском кровотечении скорость кровопотери составляет 150 мл в минуту (или более 50% ОЦК, т.е. около 3 литров) в течение 3 часов. Подобные кровотечения по данным National Commitee into Confidential Enquiries into Maternal Deathes, 2006 г. возникают в 4 случаях на 1000 родов.
По мнению многих ведущих специалистов, массивные акушерские кровотечения всегда протекают на фоне изначальной коагулопатии, которая в большинстве случаев остается невыявленной (Серов В.Н., Макацария А.Д., 1987).
Выяснение структуры скрытых нарушений гемостаза как тромбофилической так и геморрагической направленности при массивных акушерских кровотечениях в анамнезе на современном этапе развития медицины представляется необыкновенно важным и своевременным, поскольку предоставит большие возможности для профилактики повторных кровотечений в родах, а также во время операции кесарево сечение.
Цель исследования.
Изучение взаимосвязи между скрытыми нарушениями гемостаза и массивными акушерскими кровотечениями в анамнезе, а также оптимизация подготовки к беременности и родам пациенток, имевших в анамнезе массивные акушерские кровотечения.
Задачи исследования.
- изучить структуру нарушений гемостаза как тромботической, так и геморрагической направленности у женщин с массивными акушерскими кровотечениями в анамнезе.
- научно обосновать противогеморрагическую профилактику у беременных, рожениц и родильниц с выявленными признаками геморрагических диатезов.
- научно обосновать противотромботическую профилактику у беременных, рожениц и родильниц с выявленными признаками генетических форм тромбофилии и АФС.
Научная новизна.
Впервые в нашей стране произведен анализ структуры нарушений системы гемостаза у женщин с массивными акушерскими кровотечениями. Впервые изучены как геморрагические, так и тромбофилические дефекты гемостаза в генезе массивных акушерских кровотечений. Впервые обоснованы и обобщены методы профилактики кровотечений у беременных, как с геморрагическими диатезами, так и генетическими и формами тромбофилии и АФС, а также при сочетании тромбофилических нарушений и дефектов функции тромбоцитов.
Практическая значимость.
Проведенное нами исследование позволило пересмотреть традиционные взгляды на патогенез акушерских кровотечений с точки зрения патогенетической роли скрытой коагулопатии.
Разработан алгоритм обследования женщин с массивными акушерскими кровотечениями в анамнезе, а также принципы дифференцированного подхода к ведению беременности и профилактики повторных кровотечений в родах у беременных с различными нарушениями системы гемостаза. Патогенетически обоснованная профилактика, индивидуализация подхода ведения пациентов с геморрагическими диатезами, тромбофилическими нарушениями, а также при их сочетаниях, с применением низкомолекулярного гепарина, витаминов и антиоксидантов в случае тромбофилических нарушений, отказа от препаратов, влияющих на функцию тромбоцитов и применение свежезамороженной плазмы в случае выявления тромбоцитопатии, позволила значительно улучшить принципы подготовки к беременности, ведения беременности у женщин с акушерскими кровотечениями в анамнезе, а также предотвратить повторные кровотечения в этой группе женщин высокого риска.
Положения, выносимые на защиту.
- У женщин, перенесших массивные акушерские кровотечения в родах или при операции кесарево сечение, в абсолютном большинстве случаев выявлялись скрытые нарушения гемостаза.
- Наиболее часто выявляемыми формами скрытых нарушений гемостаза у женщин с массивными акушерскими кровотечениями в анамнезе являлись:
а) нарушение адгезивно-агрегационных свойств тромбоцитов, в том числе скрытые формы болезни Виллебранда и недифференцированные формы тромбоцитопатий.
b) генетическая и комбинированная тромбофилия (в том числе мутация FVLeiden, протромбина G20210A, MTHFR, полиморфизмы в генах PAI-1, фибриногена, АПФ, tPA, рецептора 1 типа ангиотензина II, генах тромбоцитарных рецепторов GpIa, GpIIIa, циркуляция антифосфолипидных антител и антител к кофакторам (АКА, аннексину V, протромбину, 2 гликопротеину 1), гипергомоцистеинэмия);
с) сочетание дефектов гемостаза тромбофилической направленности с тромбоцитопатиями.
3. Генетическая и мультигенная тромбофилия являются наиболее вероятными пусковыми факторами возникновения ДВС синдрома, декомпенсация которого приводит к коагулопатии, тромбоцитопатии потребления и, впоследствии, массивного коагулопатического кровотечения.
4. Индивидуализация подхода к ведению последующих беременностей, родов и послеродового периода у женщин с массивными акушерскими кровотечениями в анамнезе, с учетом выявленных нарушений гемостаза, а также дифференцированный подход к профилактике тромбогеморрагических осложнений, позволяет во всех случаях избежать повторных кровотечений в родах и при операции кесарево сечение.
- Внедрение результатов работы в практику
Результаты исследования и основные рекомендации используются в практической работе Перинатального Центра при ГКБ N67, родильного дома N67 и N4 г. Москвы, Медицинского Женского Центра г. Москвы и внедрены в учебный процесс кафедры акушерства и гинекологии медико-профилактического факультета ММА им. И.М. Сеченова.
- Апробация работы
Основные положения работы доложены на расширенной конференции кафедры акушерства и гинекологии медико-профилактического факультета Московской медицинской академии им. И.М. Сеченова и врачей городской больницы №67, г. Москвы, на X всероссийском форуме «Мать и дитя» (Москва, сентябрь 2009г), а также на 3 Международном Симпозиуме «Вопросы здоровья женщины и тромбоз, гемостаз» (Прага, февраль 2009г), на XXII Международном конгрессе Международного Общества по Тромбозу и Гемостазу (Бостон, июль 2009г).
Публикации результатов работы
По теме диссертации опубликовано 3 научных работы в отечественной и зарубежной печати.
- Структура и объем работы
Диссертация изложена в традиционной форме. Состоит из введения, обзора литературы, глав собственных исследований, обсуждения полученных результатов, выводов, практических рекомендаций и списка литературы. Работа представлена на 152 страницах машинописного текста, иллюстрирована 15 рисунками и 16 таблицами. Библиографический указатель включает 115 работ на русском и 161 – на иностранных языках.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ.
Общая клиническая характеристика обследованных больных.
Для решения поставленных задач нами было обследовано 70 женщин с массивными акушерскими кровотечениями в анамнезе.
1 группа: ретроспективная группа, 45 женщин с массивными акушерскими кровотечениями в анамнезе.
2 группа: проспективная группа, 25 беременных женщин с массивными акушерскими кровотечениями в анамнезе, обследованные и получавшие терапию с I, II или III триместра беременности.
Контрольную группу составили 130 беременных с физиологическим течением гестационного процесса
Под массивным акушерским кровотечением понималось кровотечение во время беременности, родов и послеродового периода с кровопотерей более 1000 мл или более 5% массы тела.
Возраст обследованных колебался от 19 до 47 лет.
Среди обследованных 13(18,6%) пациенток оказались первобеременными и 57 (81,4%) повторнобеременными. В I группе 13(28,9%) женщин было первобеременных, 32 (71,1%) – повторнобеременных. Во II группе 25 (100%) повторнобеременных.
Среди обследованных женщин 21 (30%) пациенток были первородящими и 49 (70%) пациенток – повторнородящими. В I группе 21 (46,7%) женщин оказались первородящими, 24 (53,3%) – повторнородящими. Во II группе – все женщины были повторнородящими.
У 27 (38,6%) женщин акушерско-гинекологический анамнез был отягощен менометроррагиями или дисфункциональными маточными кровотечениями, в т.ч. ювенильными. У 36 (51,4%) пациенток имела место артериальная гипертензия. 16 (22,9%) женщин отмечали частые носовые, десневые кровотечения, легкое появление синяков, кровотечения после мелких оперативных вмешательств. Личный тромботический анамнез был отягощен у 2 пациенток – инсульт в анамнезе, а также у 10 (22,2%) пациенток I группы и у 7 (28%) пациенток II группы в предшествующую беременность имело место ПОНРП с досрочным родоразрешением путем операции кесарево сечение. Большое число женщин 41 (58,6%) имели отягощенный семейный анамнез по гипертонической болезни, у 38 (54,3%) был отягощен семейный тромботический анамнез (ранние инфаркты миокарда, инсульты, тромбозы, ТЭЛА). У 9 (12,9%) женщин выяснился семейный характер геморрагических осложнений.
Методы исследования.
Клинико-лабораторное обследование включало инструментальные методы – УЗИ, допплерометрия, кардиотокография в динамике, ЭКГ, ЭхоКГ; использовались такие лабораторные методы как клинический, биохимический анализы крови, общий анализ мочи, а также исследования системы гемостаза, в том числе генетические.
Исследование системы гемостаза.
Метод оценки внутрисосудистого тромбообразования - определение D-димера с помощью латекс-теста Dimertest (Agen, Australia), который основан на взаимодействии высокоспецифичных антител к D-димеру, фиксированных на латексных частицах. D-димер характеризует перекрестную полимеризацию фибрина в процессе внутрисосудистого свертывания крови; является одним из наиболее специфических тестов диагностики ДВС-синдрома, тромбофилии и тромбоза.
Исследование плазменного звена системы гемостаза.
а) Определение активированного частичного тромбопластинового времени (АЧТВ), характеризующего суммарную активность факторов внутреннего пути свертывания (кроме FVII и FVIII) в условиях стандартной активации факторов контакта (FXII и FXI) каолином и стандартного содержания фосфолипидов (частичный тромбопластин) с использованием коммерческих наборов Stago, Франция.
б) оценка показателей гемостаза на приборе тромбоэластограф «Hellige» (Germany): “r+k” (хронометрический показатель), “ma” (максимальная амплитуда) «ИТП» (индекс тромбодинамического потенциала) с целью оценки хронометрических и структурных параметров коагуляции.
Определение количества тромбоцитов.
Контроль количества тромбоцитов в периферической крови проводился на автоматическом счетчике «Тrombocounter», Франция.
Исследование функциональной активности тромбоцитов.
Исследование агрегации тромбоцитов проводили на агрегометре Рауtоn (США) по методу Вогn (106), с графической регистрацией интенсивности и динамики агрегации тромбоцитов при перемешивании их со стимуляторами агрегации в кювете агрегометра.
Определение функциональной активности тромбоцитов с помощью аппарата FPA100.
Метод основан на симуляции процесса агрегации и адгезии тромбоцитов вследствие повреждения сосудистой стенки in vitro (Kratzer, Born, 1985) и предназначен для быстрой оценки тромбоцитарной функции в небольших пробах цитратной крови. FPA-100 состоит из капилляров, резервуара для цитратной крови и биохимически активной мембраны с центральным отверстием. FPA-100 определяет время с начала теста и до закрытия отверстия мембраны, измеряется в секундах. Для диагностики тромбоцитарных дисфункций основным является картридж коллаген/эпинефрин(адреналин). Картридж коллаген/АДФ используется для подтверждения нарушений тромбоцитарной функции и исключения аспирин-индуцированной тромбоцитопатии.
Для диагностики болезни Виллебранда помимо количественного подсчета тромбоцитов и исследования их функциональной активности использовались также количественное определение антигена фактора Виллебранда в плазме крови. Это исследование производилось с помощью твердофазного иммуноферментного анализа (ELISA) на аппарате Anthos 2020 c помощью поликлональных антител.
Количественное определение активности фактора Виллебранда.
Метод определения активности vWF основан на его способности вызывать агглютинацию тромбоцитов в присутствии индуктора агрегации ристоцетина (ристомицина). Способность к такой агглютинации сохраняется у тромбоцитов после их фиксации формальдегидом, когда полностью утрачивается реакция на другие индукторы агрегации.
Определение антифосфолипидных антител. Основные принципы их выявления.
Выявление антифосфолипидных антител (АФА) основывалось на рекомендациях Международного Общества по тромбозу и гемостазу, опубликованных в материалах XVI Всемирного конгресса по тромбозу и гемостазу (Флоренция, Италия; июль 1997 г.) и XV Международного конгресса по тромбозу (Анталия, Турция; октябрь 1998 г.). Определение волчаночного антикоагулянта (ВА) включало 3 этапа: скрининг – тесты, коррекционная проба, подтверждающая проба с фосфолипидами.
Одновременно определение антикардиолипиновых антител (АКА) осуществлялось ELISA - методом и включало выявления изотипа и титра антител.
Глобальная оценка функционирования системы протеина С осуществлялась коагулометрическим методом с использованием коммерческих наборов «Парус»-тест фирмы «Технология-Стандарт», Барнаул, Россия на приборе «START 4» (Stago, Франция).
Выявление генетически обусловленных форм тромбофилии
Молекулярный анализ генетических дефектов гемостаза FV Leiden /1691G-A/, мутации гена MTHFR C677T, мутация в гене Pt G20210A, полиморфизмов в генах PAI-1 675 4G/4G, фибриногена 455 G/A, тромбоцитарного рецептора GpIa 807С/Т, тромбоцитарного рецептора GpIIIa 1565Т/С, АПФ I/D, тканевого активатора плазминогена, рецептора к ангиотензину II, интерлейкина 1В, интерлейкина-6, фактора некроза опухоли-, в гене CD-46 выполнялась методом полимеразной цепной реакции (ПЦР) с помощью наборов «TromboType», Германия.
Основные этапы выявления генетических дефектов гемостаза включали: выделение ДНК, амплификацию (методом ПЦР), рестрикцию.
Всем пациенткам с выявленной мутацией МТHFRС677Т проводилось определение концентрации гомоцистеина в плазме крови, иммуноферментным методом с использованием реактивов Axis® фирмы Axis-Shield AS, Норвегия на приборе ANТОS 2020, США.
Полученные данные были проанализированы и обработаны с применением параметрических (при нормальном распределении признака в выборках, а также в случаях, когда объем выборки >100) и непараметрических (при свободном распределении признака в выборках) методов оценки достоверности различий сравниваемых выборок. Различия между сравниваемыми выборками принимались достоверными при уровне значимости (р) менее 0,05. Расчет производили при помощи программы MS Excel 2002.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ОБСУЖДЕНИЕ.
У подавляющего большинства женщин из I и II групп - 67 (95,7%) был выявлен тот и/или иной скрытый дефект гемостаза по сравнению с 14 (10,7%) в контрольной группе здоровых женщин (р<0,005).
Рис.1. Структура нарушений гемостаза у женщин с массивными акушерскими кровотечениями в анамнезе.
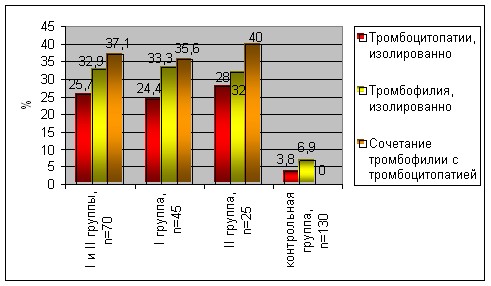
В соответствии с выявленными нарушениями гемостаза были сформированы три подгруппы:
а) с изолированным нарушением функции тромбоцитов: 18 (25%) обследованных женщин, включая болезнь Виллебранда у 7 (10%), из них I типа (снижение уровня антигена фактора Виллебранда, активность фактора Виллебранда в норме или незначительно снижена) у 4 (5,7%), IIа типа (снижение антигена фактора Виллебранда, значительное снижение активности фактора Виллебранда) у 2 (2,9%), IIb типа (различное снижение антигена фактора Виллебранда, активности фактора, повышение ристоцетин - индуцированной агрегации тромбоцитов; Gp1b – тромбоцитопения) у 1 (1,4%) и недифференцированные формы тромбоцитопатий у 11 (15,7%) женщин.
Критерием диагноза «недифференцированная тромбоцитопатия» являлись: снижение агрегации тромбоцитов на одном из индукторов менее 25, структурная гипокоагуляция (ИТП менее 20), удлинение времени закрытия мембраны на аппарате PFA-100 с картриджем коллаген/эпинефрин более 160сек., коллаген/АДФ более 121 сек.
Условием сдачи анализа на агрегацию тромбоцитов являлось исключение препаратов, влияющих на агрегацию тромбоцитов, особенно антиагрегантов (препараты аспирина, дипиридамола, НПВС и пр.) в течение минимум четырех недель перед сдачей анализа.
По сравнению с контрольной группой - недифференцированные формы тромбоцитопатии выявлены у 5 (3,8%) женщин (p<0,05). Ни одного случая болезни Виллебранда в контрольной группе выявлено не было.
b) с изолированной генетической или мультигенной тромбофилией: 23 (32,9%) обследованных женщин, из них генетическая тромбофилия выявлена у 18(25,7%), комбинированная тромбофилия (сочетание генетической тромбофилии с циркуляцией АФА) у 5 (7,4%), изолированной циркуляции АФА выявлено не было. При выявлении мутации MTHFR 17 (24,3%) женщинам проводилось определение гомоцистеина в плазме крови. Повышение гомоцистеина выявлено у 6 (8,6%) женщин, из них у 4 (5,7%) выявлена легкая степень гипергомоцистеинэмии (до 30 мкмоль/л), у 2 (2,9%) – гипергомоцистеинэмия средней тяжести (до 100 мкмоль/л) – у одной женщины 45 мкмоль/л из II группы и у одной – 78 мкмоль/л. В контрольной группе гипергомоцистеинэмия выявлена у 2(1,5%) женщин, в обоих случаях легкой степени (p<0,05).
В контрольной группе здоровых беременных женщин тромбофилия выявлена у 9 (6,9%) женщин, из них генетическая тромбофилия выявлена у 4 (3,8%), изолированная циркуляция антифосфолипидных антител у 3 (2,3%), комбинированная тромбофилия выявлена у 1 (0,8%) (p<0,05).
c) c сочетанием тромбофилических и геморрагических дефектов гемостаза: 26 (37,1%) женщин. Из них: сочетание болезни Виллебранда с генетической тромбофилией выявлено у 1 (1,4%) пациентки из I группы, сочетание мультигенной тромбофилии с недифференцированными формами тромбоцитопатий выявлено у 2 (2,9%), сочетание генетической тромбофилии с недифференцированными формами тромбоцитопатий выявлено у 23 (32,9%) пациенток.
Табл. 1. Данные по структуре выявленной тромбофилии у обследованных женщин с изолированной тромбофилией.
| Всего (n=70), nзаб (%) | Группа I (n=15) nзаб (%) | Группа II (n=25), nзаб (%) | Контр. группа (n=130), nзаб (%) | |
| Тромбофилия | 23 (32,9) | 15 (33,3) | 8 (32) | 9 (6,9) |
| АФА (всего) | 5 (7,1) | 4 (8,9) | 1(4) | 4 (3,08) |
| Генетическая тромбофилия | 18(25,7) | 11 (24,4) | 7(28) | 4 (3,08) |
| FV Leiden гомозиготная гетерозиготная | - 1 (1,6) | - 1 (2,2) | - - | - 1 (0,8) |
| Мутация протромбина G20210A гомозиготная гетерозиготная | - 2(2,9) | - 2(4,4) | - - | - - |
| MTHFR C677T гомозиготная гетерозиготная | 6 (8,6) 11 (15,7) | 3 (6,7) 7 (15,6) | 3 (12) 4 (16) | 2 (1,5) 4 (3,08) |
| Полиморфизм PAI-1 гомозиготный «675 4G/4G» гетерозиготный «675 4G/5G» | 15 (21,4) 5 (7,1) | 9 (20) 3 (6,7) | 6 (24) 2(8) | 1 (0,8) 3 (2,3) |
| Полиморфизм фибриногена «455 G/A» гомозиготный гетерозиготный | 11 (15,7) 9 (12,9) | 7 (15,6) 6 (13,3) | 4 (16) 3 (12) | - 5 (3,8) |
| Полиморфизм «807С/Т» тромбоцитарного рецептора GpIa гомозиготный гетерозиготный | 5 (7,1) 11 (15,7) | 4 (8,9) 6 (13,3) | 1 (4) 5 (20) | 2 (1,5) 4 (3,08) |
| Полиморфизм «1565Т/С» тромбоцитарного рецептора GpIIIa гомозиготный гетерозиготный | 1 (1,4) 6 (8,6) | 1 (2,2) 5 (11,1) | - 1 (4) | 2 (1,5) 4 (3,08) |
| Полиморфизм АПФ гомозиготный («D/D») гетерозиготный («I/D») | 5 (7,1) 7 (10) | 2 (4,4) 5 (11,1) | 3 (12) 2 (8) | 3 (2,3) 2 (1,5) |
| Полиморфизм тканевого активатора плазминогена гомозиготный гетерозиготный | 3 (4,3) 3 (4,3) | 3 (6,7) 2 (4,4) | - 1 (4) | 2 (1,5) 2 (1,5) |
| Полиморфизм «1166А/С» рецептора к ангиотензину II гомозиготный гетерозиготный | - 5 (7,1) | - 4 (8,9) | - 1 (4) | - 1 (0,8) |
| Комбинированная форма тромбофилии | 5 (7,1) | 4 (8,9) | 1 (4) | 1 (0,8) |
| АФА изолированно | - | - | - | 3(2,3) |
Ретроспективную (I) группу составили 45 женщин с массивными акушерскими кровотечениями в анамнезе, которые были обследованы нами спустя промежуток от 2 месяцев до 9 лет после родов.
Объем кровопотери составил в среднем 2370+820 мл.
Наиболее частой акушерской причиной массивных кровотечений были кровотечения в раннем послеродовом периоде у 15 (33,3%) обследуемых женщин. Чаще всего в этом случае выставлялся диагноз гипотонии матки. На втором месте по частоте у 10 (22,2%) обследованных женщин была отслойка нормально или низко расположенной плаценты. Кровотечения в течение операции кесарево сечения были у 8 (17,8%) обследованных I группы, а кровотечения в послеоперационном периоде у 6 (13,3%). Гораздо реже причинами кровотечений у женщин были: предлежание плаценты у 1(2,2%), кровотечения в позднем послеродовом периоде у 2(4,4%), кровотечение в результате плотного прикрепления и приращения плаценты у 2 (4,4%) и кровотечения на фоне шоковых состояний (эмболия околоплодными водами) у 1 (2,2%).
При обследовании 45 женщин из ретроспективной группы нарушения гемостаза распределились следующим образом. У 42 (93,3%) женщин из 45 выявлен тот или иной скрытый дефект гемостаза. У 3 (6,7%) пациенток I группы не выявлен тот или иной дефект гемостаза.
Согласно нашим данным всех женщин из ретроспективной группы можно распределить на 3 подгруппы:
Iа – подгруппа женщин с изолированным нарушением функции тромбоцитов – 11 (24,4%) женщин из 45; из них у 5 (11,1%) пациенток выявлена болезнь Виллебранда, причем у 3 (6,7%) I типа, у 1 (2,2%) пациентки 2А типа и у 1 (2,2%) 2В типа. У остальных 6 (13,3%) женщин выявлены недифференцированные формы тромбоцитопатии.
Ib – подгруппа женщин с изолированной тромбофилией; у 15 (21,4%) пациенток обнаружена тромбофилия, генетическая у 12 (26,7%) или комбинированная у 3 (6,7%).
Ic – подгруппа женщин с сочетанием тромбофилии и тромбоцитопатии – 16 (35,6%) обследованных женщин из ретроспективной группы. Из них у 1 (2,2%) пациентки выявлено сочетание комбинированной тромбофилии с недифференцированной тромбоцитопатией; у 1 (2,2%) выявлено сочетание болезни Виллебранда 1 типа с генетической тромбофилией; у 14 (31,1%) женщин имело место сочетание недифференцированной тромбоцитопатии с генетической тромбофилией.
Табл. 2. Данные исследования гемостаза у женщин ретроспективной группы.
| Подгруппа Ia n=11 | Подгруппа Ib n=15 | Подгруппа Ic n=16 | Контрольная группа, n=130 | |
| Агрегация с АДФ | 18,51+5,38 | 48,72+12,56 | 21,15+6,13 | 52,75+13,47 р<0,05 |
| Агрегация с ристомицином | 23,63+4,82 | 62,38+16,71 | 24,12+5,33 | 58,29+14,67 р<0,05 |
| Агрегация с адреналином | 15,64+3,12 | 53,36+8,18 | 17,74+4,36 | 61,17+17,72 р<0,05 |
| Агрегация с коллагеном | 14,82+6,37 | 57,26+11,69 | 18,02+4,59 | 66,92+15,03 р<0,05 |
| ИТП | 12,41+2,16 | 37,88+9,12 | 16,73+4,51 | 39,74+8,73 р<0,05 |
| Исследование на аппарате ФП100 АДФ Адреналин | 138,7+9,1 171,4+5,5 | 101+14,6 127+18,3 | 131+4,2 168+3,7 | 104+13,3 р<0,05 97+21,1 р<0,05 |
| Фибриноген (г/л) | 2,4+1,5 | 4,9±0,7 | 4,6+1,05 | 3,3±0,4 р<0,05 |
| НО («Парус»-тест), а абс.ед. | 1,3+0,12 | 1,0±0,1 | 1,2+0,14 | 1,4±0,1 р<0,05 |
| Количество тромбоцитов 109 /л | 223,5+24,6 | 241,8+26,8 | 251,3+33,9 | 231+37,53 р<0,05 |
| Д-димер (мкг/мл) | 0,5+0,07 | 2,0±0,4 | 1,8+0,3 | 0,5±0,1 р<0,05 |
| Антиген ФВ (U/ml) | 0,57+0,32 | 0,9+0,27 | 0,63+0,12 | 1,2+0,26 |
| Активность ФВ (%) | 47,4+19,8 | 110+35,7 | 69+32,8 | 116+29,4 |
Проспективную группу составили 25 беременных женщин с массивной акушерской кровопотерей в анамнезе, которые были обследованы, консультированы и получали терапию с I, II или III триместра беременности (II группа). Из 25 беременных большинство беременных 19 (76%) были обследованы и консультированы во II и III триместрах беременности, 6 (24%) беременных женщин наблюдались с I триместра беременности.
У 25 (100%) женщин во второй группе выявлен какой-либо дефект гемостаза.
Объем кровопотери составил в среднем 2230+780 мл.
Наиболее частой акушерской причиной массивных кровотечений были кровотечения в раннем послеродовом периоде у 9 (36%) обследуемых женщин. Чаще всего в этом случае выставлялся диагноз гипотонии матки. На втором месте по частоте у 7 (28%) обследованных женщин была отслойка нормально или низко расположенной плаценты. Кровотечения в течение операции кесарево сечения были у 1(4%) из обследованных II группы, а кровотечения в послеоперационном периоде у 3 (12%). Кроме того, причинами кровотечений у женщин были: предлежание плаценты у 1 (4%), кровотечения в позднем послеродовом периоде у 1 (4%), кровотечение в результате плотного прикрепления плаценты у 1 (4%) и кровотечения на фоне шоковых состояний (эмболия околоплодными водами) у 1 (4%).
Следует отметить, что в этой группе были 2 (8%) женщины, с повторными массивными послеродовыми кровотечениями в нескольких родах. У одной женщины кровотечения в трех предшествующих родах, и у одной – кровотечения в двух предшествующих родах.
Табл.3. Данные гемостазиологического обследования в проспективной группе.
| Показатели | IIа подгруппа n=7 | IIb Подгруппа (до терапии) n=8 | IIс подгруппа n=10 | Контрольная группа n=130 |
| АЧТВ (сек) | 30,1+2,03 | 26,7±1,3 | 28,4+4,02 | 27,4,±0,6 р<0,05 |
| ТЭГ r+k ma ИТП (у.е.) | 19,6+3,7 31,5+2,8 12,1+1,8 | 13,3±0,8 24,3+3,75 33,7±3,2 | 15,7+2,3 22,8+2,07 16,2+1,7 | 20,7±2,4 р<0,05 29,1±1,7 р<0,05 39,74+8,73 р<0,05 |
| Агрегация тромбоцитов: АДФ 110-3 М (%) Ристомицин 110-3 М %) Адреналин 110-3 М (%) Коллаген 110-3 М (%) | 16,8+3,01 24,1+4,6 12,7+1,7 19,4+2,1 | 76,1+5,03 68,5±3,7 70,1±4,2 57,9+4,8 | 18,3+2,9 26,2+4,7 14,7+2,3 22,6+3,8 | 52,75+13,47 р<0,05 58,29+14,67 р<0,05 61,17+17,72 р<0,05 66,92+15,03 р<0,05 |
| Исследование на аппарате ФП100 АДФ Адреналин | 131+4,75 118+2,12 | 108+11,6 102+7,3 | 127+3,4 115+3,1 | 104+13,3 р<0,05 97+21,8 р<0,05 |
| Фибриноген (г/л) | 3,9+1,7 | 4,5±0,2 | 4,3+1,05 | 3,3±0,4 р<0,05 |
| НО («Парус»-тест), абс.ед. | 1,2+0,08 | 1,1±0,1 | 1,0+0,03 | 1,4±0,1 р<0,05 |
| Количество тромбоцитов 109 /л | 218,5+25,8 | 195,7+13,4 | 227,3+31,6 | 231+37,53 р<0,05 |
| Д-димер (мкг/мл) | 0,6+0,09 | 2,3±0,6 | 2,1+0,5 | 1,2±0,1 р<0,05 |
| Антиген ФВ (U/ml) | 0,55+0,37 | 1,0+0,4 | 0,65+0,17 | 1,2+0,26 |
| Активность ФВ (%) | 49,4+3,8 | 115+30,7 | 59+12,8 | 116+29,4 |
Согласно группам по нарушениям гемостаза в проспективной группе пациенток выявленные нарушения распределились следующим образом: Подгруппа IIa - изолированное нарушение функции тромбоцитов выявлено у 7(28%) пациентов, из них у 2(8%) болезнь Виллебранда (у 1 (4%) пациентки 1 типа и у 1 (4%) 2А типа);
Наиболее вероятной причиной кровотечения в данной группе пациентов является отсутствие функциональной зрелости тромбоцитов и, как следствие, нарушение важнейших процессов тромбообразования в условиях повышенного потребления в родах. Это связано с недостаточностью адгезивно-агрегационной функции тромбоцитов – нарушением образования в поврежденных сосудах тромбоцитарной пробки.
При выявлении изолированного нарушения функции тромбоцитов и болезни Виллебранда у 7 (26,1%) пациенток IIa группы в I, II или III основное внимание уделялось отказу от применения препаратов, обладающих антиагрегантным действием, в течение всей беременности, в особенности в третьем триместре. Это препараты нестероидных противовоспалительных препаратов, в особенности аспиринового ряда, курантил, трентал, антикоагулянты (гепарин, НМГ), седативные препараты. В течение всей беременности, а также накануне родов проводился динамический контроль уровня тромбоцитов, агрегации тромбоцитов, показателей тромбоэластограммы. А также применение во II периоде родов или непосредственно перед операцией кесарево сечение свежезамороженной плазмы в дозе 500 мл (2 дозы) в качестве заместительной терапии.
Свежезамороженная плазма является источником всех факторов свертывания, в том числе тромбоцитарных, фактора Виллебранда, биологически активных веществ, т.е. является профилактической заместительной терапией. Согласно данным нашей кафедры профилактическое введение малых доз (2 дозы=500мл) СЗП позволяет избежать повторных кровотечений в родах.
Подгруппа IIb - изолированная тромбофилия выявлена у 8 (32%) пациентов, из них комбинированная форма тромбофилии у 1 (4%) пациентки. При выявлении изолированной наследственной мультигенной или комбинированной формы тромбофилии у женщин из подгруппы IIb назначалась дифференцированная противотромботическая профилактика в зависимости от причины и степени её выраженности, наличия гомо- или гетерозиготной формы мутаций, приводящей к состоянию тромбофилии, а также в зависимости от выявления циркуляции и уровня маркеров тромбофилии (Д-димер) и агрегационной активности тромбоцитов.
В данной группе женщин с выявленными тромбофилическими нарушениями, наиболее вероятной причиной кровотечения нам представляется декомпенсация ДВС синдрома, с переходом его из хронической, компенсированной формы, в острую с развитием коагулопатии потребления.
При наблюдении вне зависимости от триместра беременности пациентки получали витаминотерапию (а при наличии АФС или полиморфизма тромбоцитарных рецепторов – мини-дозы аспирина – 75 мг в сутки). Поддерживающая витаминотерапия включала фолиевую кислоту (минимум 1 мг в сутки), витамин Е 400МЕ, полиненасыщенные жирные кислоты (омега-3). Пациенты с мутацией MTHFR С677Т и гипергомоцистеинемией получали более высокие дозы фолиевой кислоты (4 мг в сутки), а также дополнительно витамины группы В в таблетированной форме. Также пациентки получали низкомолекулярный гепарин (НМГ) фраксипарин в профилактической дозе (от 0,3 до 0,6 мл 1 раз в сутки подкожно). В качестве противотромботической терапии мы применяли НМГ (в большинстве случаев фраксипарин). Доза препарата корректировалась в зависимости от уровней маркеров тромбофилии, агрегационной активности тромбоцитов, веса женщины.
Табл.4. Критерии эффективности и безопасности применения НМГ у пациенток с выявленной тромбофилией.
| Критерии эффективности и безопасности | |
| Клинические | Лабораторные |
| 1. Купирование угрозы прерывания беременности | 1. Снижение уровня маркеров тромбофилии: ТАТ, D-димер |
| 2. УЗИ-контроль | 2. Нормализация агрегации тромбоцитов |
| 3. Допплерометрия маточно-плацентарного кровотока | 3. Нормализация количества тромбоцитов или отсутствие снижения их количества (при исходно нормальных значениях) |
| 4. Отсутствие тромботических осложнений | |
| 5. Отсутствие осложнений беременности, таких как ПОНРП, СЗРП, АГП, мертворождение | |
| 6. Отсутствие массивного кровотечения в родах | |
Противопоказанием (временным) к применению НМГ (фраксипарин) были: наличие кровянистых выделений из половых путей; признаки отслойки участка плаценты или ворсин хориона по данным УЗИ; тромбоцитопения на 5-7 день применения фраксипарина.
На фоне проводимой антитромботической профилактики НМГ ни в одном из случаев не наблюдалось послеоперационных тромбоэмболических и геморрагических осложнений.
В послеродовом и послеоперационном периоде все пациентки получали антикоагулянтную профилактику фраксипарином (через 8 часов) в дозе 0,3 мл, а пациентки с инсультом в анамнезе в дозе 0,6 мл в течение месяца. Пациентки с комбинированными формами тромбофилии затем переводились на варфарин в течение 6 месяцев. Дозы варфарина подбирались индивидуально с целью достижения МНО в пределах 2,0-3,0.
Подгруппа IIc - сочетание тромбофилии и тромбоцитопатии – подгруппа IIc выявлено у 10 (40%) пациенток II группы, из них у 1 (4%) пациентки выявлено сочетание комбинированной тромбофилии с недифференцированной тромбоцитопатией, у остальных 9 (36%) обнаружено сочетание недифференцированных форм тромбоцитопатии с генетической тромбофилией.
В контрольной группе тромбоцитопатия выявлена у 4 (3,07%) женщин (р<0,05); тромбофилия выявлена у 9 (6,9%) женщин (р<0,05). Сочетания тромбофилических нарушений и нарушения функции тромбоцитов не выявлено (p<0,05).
В третьей группе женщин с сочетанными нарушениями гемостаза тромбофилической и геморрагической направленности наиболее вероятным вариантом развития коагулопатии является быстрая декомпенсация хронически протекающего ДВС-синдрома и развитие коагулопатии потребления на фоне исходной тромбоцитопатии.
При выявлении сочетания нарушений гемостаза тромбофилической и геморрагической направленности у 10 (40%) пациенток рекомендации зависели от конкретной ситуации у каждой пациентки на момент исследования, наличия осложнений беременности, уровня маркеров тромбофилии, уровня агрегации тромбоцитов, данных тромбоэластографии, данных УЗИ и допплерометрии и пр. Всем пациенткам с 33 недель рекомендации включали строгие противопоказания к применению антигрегантной и антикоагулянтной терапии. Во II периоде родов или непосредственно перед операцией кесарево сечение всем пациенткам этой группы проводилось переливание СЗП в дозе 500 мл.
Следует отметить, что в данной группе беременных антиагрегантная терапия не применялась, антикоагулянтная терапия применялась до 33 недель беременности при наличии высоких уровней маркеров тромбофилии у женщин в I и II триместрах, наличия у нее таких осложнений как ФПН, СЗРП, выявленные во II триместре беременности, признаков гестоза средней степени тяжести. Противотромботическую терапию получали 4(16%) беременных данной группы. В качестве антикоагулянтной терапии пациентки получали низкомолекулярный гепарин (НМГ) фраксипарин в профилактической дозе (от 0,3 до 0,6 мл 1 раз в сутки подкожно).
Табл.5. Осложнения данной беременности у пациенток IIa,IIb и IIс подгрупп.
| Осложнения беременности | II a подгруппа n=7 | IIb подгруппа n=8 | IIc подгруппа n=10 | Контрольная группа n=130 | |
| Отеки беременных Гестоз средней степени тяжести Тяжелый гестоз Преэклампсия, эклампсия | 2(8%) - - - | 6(24%) 4(16%) - - | 6(24%) 2(8%) - - | 4(3,08%) - - - | |
| ПОНРП | - | - | - | - | |
| ФПН (преждевременное созревание плаценты, нарушение маточно-плацентарного кровотока) | 1(4%) | 4(16%) | 5(20%) | 2(1,5%) | |
| СЗРП | - | - | 1(4%) | - | |
| АГП | - | - | - | - | |
| Угроза прерывания беременности | 1(4%) | 4(16%) | 3(12%) | 3(2,3%) | |
| Угроза преждевременных родов | - | 2(8%) | 2(8%) | 1(0,8%) | |
| Преждевременные роды | - | - | 1(4%) | 1(0,8%) | |
| Кесарево сечение | 1(4%) | 7(28%) | 5(20%) | 5(3,8%) | |
У всех пациенток II группы беременность завершилась рождением живого плода. Средняя масса новорожденных составила 3470±160 г, рост 51±1,5см, среднее значение оценки по шкале Апгар по группе составила 7,9±0,52 – 8,5±0,5 баллов.
Случаев массивного акушерского кровотечения в проспективной группе отмечено не было. Следует отметить, что средняя величина кровопотери в данной группе превышала таковую в контрольной группе: для естественных родов она составила 421,6+77,5 мл, по сравнению с 240+90 мл в контрольной группе (р<0,05); при операции кесарево сечение средняя кровопотеря 785+140 мл по сравнению с 680+120 мл в контрольной группе.
Полученные данные свидетельствуют о несомненной роли скрытых нарушений гемостаза как геморрагической, так и тромботической направленности в генезе массивной кровопотери в родах как непосредственной причине кровотечения или как сопутствующего нарушения, усугубляющего кровопотерю.
Это подтверждает высокая эффективность патогенетически обоснованной терапии во время беременности и в родах, которая позволяет предупредить развитие массивного акушерского кровотечения в 100% случаев по данным нашего исследования, даже при наличии повторных кровотечений в родах в анамнезе.
ВЫВОДЫ:
- У женщин, имевших в анамнезе массивные акушерские кровотечения в родах или при операции кесарево сечение, исследование системы гемостаза позволило выявить в 95,7% случаев исходные скрытые нарушения гемостаза, наличие которых может приводить к нарушениям гестационной адаптации системы гемостаза и коагулопатическому кровотечению в родах и при операции кесарево сечение.
2. Структура нарушений гемостаза у женщин с массивными акушерскими кровотечениями представляет собой:
а) нарушение функции тромбоцитов обнаружено в 25,7% случаев (включая болезнь Виллебранда (10%) и недифференцированные формы тромбоцитопатий (15,7%));
b) генетическая или мультигенная тромбофилия выявлена в 32,9 % случаев (соответственно, генетическая тромбофилия (25,7%), комбинированная (7,1%));
с) сочетание тромбофилических дефектов гемостаза с тромбоцитопатией выявлено в 37,1% случаев;
В 4,3% случаев не выявлено дефектов системы гемостаза.
3. У женщин с исходной тромбоцитопатией исключение во время последующей беременности и родов антикоагулянтов, антиагрегантов, анальгетиков, а также заместительная терапия свежезамороженной плазмой во II периоде родов или непосредственно перед операцией кесарево сечение позволило избежать во всех случаях повторных массивных кровотечений.
4. У женщин с массивными акушерскими кровотечениями в анамнезе и выявленной генетической или приобретенной тромбофилией, ведение гестационного процесса с применением с ранних сроков низкомолекулярных гепаринов, антиоксидантов, витаминов позволило избежать возникновения синдрома диссеминированного внутрисосудистого свертывания, коагулопатии и тромбоцитопатии потребления и обеспечить профилактику массивных акушерских кровотечений в родах или при операции кесарево сечение.
5. У повторно беременных женщин, с массивными акушерскими кровотечениями в анамнезе, с выявленными сочетанными нарушениями тромбофилической и геморрагической направленности, при возникновении лабораторных и клинических признаков хронического ДВС-синдрома в
сочетании с нарушением маточно-плацентарного кровотока и гестоза, применение низкомолекулярного гепарина (фраксипарина) в дозах до 0,6 мл до 33 недель гестации включительно, позволило добиться купирования нарушений гемостаза и маточно-плацентарного кровотока. При родоразрешении у данной группы женщин профилактическое применение свежезамороженной плазмы во II периоде родов или непосредственно перед операцией кесарево сечение позволило избежать повторных массивных кровотечений у всех женщин этой группы.
6. Ведение последующих беременностей, родов и послеродового периода у женщин с массивными акушерскими кровотечениями в анамнезе с учетом выявленных нарушений гемостаза, а также дифференцированный подход к профилактике тромбогеморрагических осложнений, позволило в нашем исследовании во всех случаях избежать повторных кровотечений в родах и при операции кесарево сечение.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ.
- Углубленное исследование гемостаза у женщин с массивными акушерскими кровотечениями в анамнезе является абсолютно необходимым для выявления скрытых факторов риска развития массивных геморрагий. При этом, диагностика скрытых нарушений гемостаза в условиях гестационного процесса не всегда возможна в силу влияния физиологических изменений гемостаза, свойственных беременности.
- Наиболее часто выявлялись следующие причины коагулопатических кровотечений:
-нарушение функции тромбоцитов (болезнь Виллебранда, недифференцированные формы тромбоцитопатий);
- генетическая или комбинированная тромбофилия;
- сочетание тромбофилических дефектов гемостаза с тромбоцитопатией;
3. При ведении последующих беременностей у женщин с исходными нарушениями функции тромбоцитов следует отказаться от применения антикоагулянтов, антиагрегантов, анальгетиков, а также показана заместительная терапия свежезамороженной плазмой во II периоде родов или непосредственно перед операцией кесарево сечение.
4. У женщин с мультигенной и генетической тромбофилией наиболее вероятной причиной массивных акушерских кровотечений при отсутствии травматических повреждений сосудов и мягких тканей является синдром диссеминированного внутрисосудистого свертывания с развитием коагулопатии потребления, вследствие этого этой группе женщин показано применение с ранних сроков низкомолекулярных гепаринов, антиоксидантов, витаминов.
5. У женщин с сочетанием тромбофилических дефектов гемостаза с тромбоцитопатией наиболее вероятной причиной массивных акушерских кровотечений является декомпенсация ДВС-синдрома в условиях исходной тромбоцитопатии и быстрое развитие коагулопатии потребления. Поэтому в этой группе женщин при наличии клинических и лабораторных признаков ДВС-синдрома, а также признаков гестоза, нарушения маточно-плацентарного кровотока показано применение НМГ (фраксипарина) в дозах до 0,6мл. Во II периода родов или непосредственно перед операцией кесарево сечение у этой группы женщин показано применение свежезамороженной плазмы 2 дозы в качестве заместительной терапии.
6. Индивидуализация ведения последующих беременностей, родов и послеродового периода у женщин с массивными акушерскими кровотечениями в анамнезе с учетом выявленных нарушений гемостаза позволяет во всех случаях избежать повторных кровотечений в родах и при операции кесарево сечение.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ.
1. Смурыгина В.В. Скрытые нарушения системы гемостаза и массивные акушерские кровотечения. // Врач. – 2009. - №8. – с.61-63.
2. Смурыгина В.В. Роль скрытых нарушений свертывания крови в генезе массивной акушерской кровопотери. // X Всероссийский Форум "Мать и дитя". – М.: 2009. – с. 192.
3. Smurygina V., Makatsariya A. The role of occult haemorrhagic and thrombophilic disorders of haemostasis in the genesis of massive obstetrical bleeding. // Thrombosis Reseach, 2009. - Vol.123 (Suppl.2). – Р.160-161.

