Клинико-бактериологические аспекты нарушений микробиоценоза кишечника у детей с острым лимфобластным лейкозом
На правах рукописи
ВАРАЧЕК Наталья Михайловна
КЛИНИКО-БАКТЕРИОЛОГИЧЕСКИЕ АСПЕКТЫ НАРУШЕНИЙ МИКРОБИОЦЕНОЗА КИШЕЧНИКА У ДЕТЕЙ
С ОСТРЫМ ЛИМФОБЛАСТНЫМ ЛЕЙКОЗОМ
14.01.08 – Педиатрия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Оренбург – 2010
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Оренбургская государственная медицинская академия Федерального агентства по здравоохранению и социальному развитию» и в Институте клеточного и внутриклеточного симбиоза Уральского отделения Российской академии наук
Научный руководитель:
Доктор медицинских наук, профессор Челпаченко Ольга Ефимовна
Научный консультант:
Кандидат медицинских наук, доцент Валышев Александр Владимирович
Официальные оппоненты:
Доктор медицинских наук, профессор Зыкова Лидия Сергеевна
Доктор медицинских наук, профессор Брудастов Юрий Авенирович
Ведущая организация: ГОУ ВПО «Уральская государственная меди- венная медицинская академия
Федерального агентства по
здравоохранению и социальному
развитию»
Защита диссертации состоится «3» марта 2010 г. в 10.00 часов на заседании диссертационного совета Д 208.066.01 при ГОУ ВПО «Оренбургская государственная медицинская академия Росздрава» по адресу: 460000, г.Оренбург, ул.Советская,6; тел.(3532)77-63-21; факс(3532)77-24-59.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Оренбургская государственная медицинская академия Росздрава» и на сайте: http://www.orgma.ru.
Автореферат разослан « » 2010г.
Ученый секретарь
диссертационного совета Соловых Г.Н.
Введение
Актуальность темы Острый лимфобластный лейкоз (ОЛЛ) – одна из центральных проблем детской гематологии, так как является наиболее частой патологией среди онкологических заболеваний. На его долю приходится примерно 80% всех лейкозов.
В Российской Федерации, как и в других, экономически развитых странах в последние годы отмечается тенденция к росту заболеваемости детей злокачественными новообразованиями (В.М.Чернов, С.Г.Лескова, Г.И.Сидорович и др., 2000). Общее число заболеваний лейкозами и лимфомами в Российской Федерации превысило рубеж 20 тысяч в год, из них около 1000 приходится на острый лейкоз детского возраста (И.В.Осечинский, А.Р.Мартиросов, 2005, В.В.Кочемасов, В.О.Саутина, А.И.Воробьев, 2007). По прогнозам ВОЗ за 1999-2020 годы заболеваемость и смертность от онкологических заболеваний во всем мире возрастет в 2 раза (В.М. Боев, Л.А.Перминова, 2004).
Современные протоколы лечения, сочетающие полихимиотерапию (ПХТ) и лучевую терапию, позволяют добиться длительной ремиссии более чем у 85% детей (Карачунский А.И., Кравченко Е.Г., Штакельберг А.Н., 1997). Однако при переходе к более интенсивным схемам лечения инфекционные осложнения стали преобладать в структуре летальности детей с острым лейкозом, при этом первое место занимают септические состояния без локализованных очагов инфекции, что является прямым следствием глубокого нарушения клеточных систем, осуществляющих фагоцитарный этап иммунного ответа в органах и тканях (Алейникова О.В., 1999).
Состояние тотальной иммуносупрессии, индуцированной ПХТ, создает угрозу развития полиэтиологических инфекционных осложнений, максимальная частота которых приходится на период индукции и консолидации ремиссии.
Подавляющее большинство инфекций (86%), встречающихся у онкологических больных, вызваны возбудителями эндогенной флоры: Escherichia coli, Klebsiella pneumonia, Candida albicans и др (A.G. Freifeld, P.A. Pizzo, 1993, Ch. A.Dinarello, 1994, О.В.Горонкова, 2005, A.Micozzi, 2001, М.А Волкова, 2001). Бактерии, обычно непатогенные у здоровых людей, часто становятся патогенными у иммунокомпрометированных лиц.
Основным резервуаром условно-патогенных микроорганизмов, активация которых способствует развитию системной эндотоксинемии и инфекционных осложнений, является микробиоценоз кишечника (Б.А.Шендеров,1998). Нарушения кишечного микробиоценоза являются важным фактором риска развития инфекционных осложнений.
На сегодняшний день основным средством профилактики и лечения инфекционных осложнений является антибактериальная терапия. Однако в ряде случаев она не позволяет достичь желаемого эффекта, что побуждает к поиску новых средств и изменению тактики ведения таких пациентов.
В настоящее время недостаточно данных о состоянии кишечного микробиоценоза у детей с ОЛЛ в разные периоды заболевания, а также о влиянии цитостатиков на межмикробные взаимодействия на фоне современной цитостатической терапии. Недостаточно изучен вопрос о клинической эффективности применения пребиотиков, в том числе лактулозы, у больных в период развернутой клинико-гематологической картины для коррекции кишечной микрофлоры и превентивного лечения инфекционных осложнений у детей с ОЛЛ. Имеются единичные работы, указывающие на целесообразность использования лактулозы у детей с ОЛЛ.
Цель работы: изучить клинико-бактериологические аспекты нарушений микробиоценоза кишечника и определить эффективность использования лактулозы в комплексной терапии у детей с острым лимфобластным лейкозом.
Задачи исследования:
1.Изучить состояние кишечного микробиоценоза у детей с острым лимфобластным лейкозом до лечения цитостатическими препаратами, на фоне лечения и через 3, 6, 12 месяцев после окончания полихимиотерапии.
2.Определить особенности клинического статуса, частоту встречаемости, нозологическую структуру и сроки развития инфекционных осложнений у детей с ОЛЛ.
3.Исследовать в эксперименте in vitro влияние цитостатиков на бактериоциногенную активность бактерий. Оценить диагностическую значимость использования бактериоциногенного и антилизоцимного тестов у детей с острым лимфобластным лейкозом.
4.Сопоставить эффективность превентивного лечения детей с острым лимфобластным лейкозом с использованием лактулозы с группой больных детей, получающих стандартное лечение, под контролем биологических свойств микроорганизмов. Определить сроки назначения лактулозы.
Научная новизна
Впервые в регионе проведен микробиологический мониторинг состояния кишечной микрофлоры до начала цитостатического лечения, во время полихимиотерапии и через 3, 6, 12 месяцев после окончания полихимиотерапии.
Установлено, что максимальные изменения кишечного микробиоценоза у детей с острым лимфобластным лейкозом отмечаются во время проведения комплексного лечения (в период индукции ремиссии), включающего полихимиотерапию и сопроводительную терапию. Определена связь инфекционных осложнений с нарушением кишечного микробиоценоза.
Впервые использован бактериоциногенный тест (БЦ-тест) у детей с ОЛЛ и выявлена его достоверная корреляция со степенью тяжести кишечного дисбиоза, что позволяет использовать этот тест как в качестве скринингового метода исследования, так и для расширения информативности классического бактериологического метода исследования микробиоценоза кишечника.
Доказана эффективность применения лактулозы для коррекции кишечного микробиоценоза у детей с ОЛЛ.
Теоретическая и практическая значимость работы
Обосновано использование бактериоциногенного теста в качестве скринингового метода исследования, для расширения информативности классического бактериологического метода исследования микробиоценоза кишечника, а также для оценки тяжести дисбиоза кишечника у детей с ОЛЛ и контроля проводимого превентивного лечения.
Доказана эффективность использования лактулозы для коррекции кишечного микробиоценоза, которое наиболее целесообразно во время проведения комплексного лечения, особенно в период индукции ремиссии.
Реализация результатов исследования
Практические рекомендации, изложенные в диссертации, внедрены в ММУЗ «Муниципальная городская клиническая больница №6» (акт внедрения от 07.12.09г.), ГУЗ «Областная детская клиническая больница» (акт внедрения от 10.09.07г.).
Результаты исследования используются при проведении семинаров, практических занятий, при чтении лекций врачам-педиатрам на кафедре педиатрии факультета последипломной подготовки и повышения квалификации специалистов ГОУ ВПО «ОрГМА Росздрава», а также вошли в учебное пособие для врачей, интернов.
Апробация диссертации
Основные положения диссертации доложены и обсуждены на: региональной научно-практической конференции молодых ученых и специалистов Оренбуржья (г. Оренбург, 2006, 2008), X съезде педиатров России (г.Москва, 2005), VI Российском конгрессе «Современные технологии в педиатрии и детской хирургии» (г.Москва, 2007), научно-практической конференции «Актуальные проблемы педиатрии» (г.Уфа, 2008, 2009), на врачебной конференции педиатров г.Оренбурга и Оренбургской области (г.Оренбург, 2008).
Результаты исследований по теме диссертации опубликованы в 8 печатных работах, из них 1 в журнале, рекомендованном ВАК.
Диссертационная работа выполнена в соответствии с открытым планом научно-исследовательской работы академии (№ 0102. 510194 государственной регистрации темы).
Структура и объем работы. Диссертация изложена на 150 страницах машинописного текста, состоит из введения, обзора литературы, 3 глав собственных исследований, заключения, выводов и практических рекомендаций. Указатель литературы включает 229 источников: 178 отечественных и 51 зарубежных. Текст иллюстрирован 10 таблицами, 19 рисунками, включает 5 клинических примеров.
Основные положения, выносимые на защиту
- Максимальные изменения кишечного микробиоценоза у детей с острым лимфобластным лейкозом отмечаются в период проведения комплексного лечения (ПХТ+сопроводительная терапия).
- Цитостатики (метотрексат и винкристин) влияют на межмикробные взаимодействия (бактериоциногенную активность E.coli) и усугубляют нарушения микробиоценоза кишечника.
- Дюфалак (лактулоза) является эффективным препаратом для коррекции микробиоценоза кишечника у детей с острым лимфобластным лейкозом.
Содержание работы
Материал и методы исследования
Работа осуществлялась в несколько этапов, которые включали: определение цели и задач исследования, освоение и внедрение в практику диагностических методов, проведение анкетирования, клинического и микробиологического обследования детей обоего пола от 1 до 15 лет с острым лимфобластным лейкозом (ОЛЛ), которые находились на лечении в онкогематологическом отделении областной детской клинической больницы г.Оренбурга и проживали в г.Оренбурге и Оренбургской области. Все дети поступали в стационар в период развернутой клинико-гематологической картины. Диагноз ставился на основании жалоб, клинического осмотра, лабораторного и инструментального обследования, которые включали анализы крови, мочи и кала, миелограмму, ликворограмму, иммунофенотипирование, молекулярно-генетическое исследование, а также рентгенографию грудной клетки, ультразвуковое исследование внутренних органов, ЭГДС с проведением биопсии тканей и посева микрофлоры, ЭКГ, ЭХО-КС и КТ грудной клетки. ЭКГ–исследование проводилось на аппарате ЭК1Т-ОЗМ2 и «Bioset 800», с регистрацией в 12-ти стандартных отведениях в положении лежа, стоя и после физической нагрузки. ультразвуковое исследование (печени, желчного пузыря, селезенки, почек, надпочечников, щитовидной железы, яичек, сердца) – на аппаратах «Aloka-500», «Leopard-2001», «Diasonick-Spektra», «Synerji», «Diagnostik Ultrasound», фиброгастродуоденоскопия – на аппарате «Olimpus XP-20» (Япония). По показаниям проводились консультации узких специалистов – окулиста, невролога, эндокринолога, гастроэнтеролога, нефролога, генетика, ЛОР-врача, стоматолога.
Определение иммунного статуса проводилось по методике G.Manchini et al., (1986), С.Г.Осипова с соавт., (1983), В.В.Меньшикова (1987). Контролем явились региональные нормы показателей иммунограммы для детей, проживающих в Оренбургской области. Степень иммунной дефицитности (А.М.Земсков,1986) рассчитывалась по формуле: СИД=(показатель обследуемого / нормальный уровень – 1)х100%.
Все больные получали лечение по протоколу ALL-BFM 90 (G.Schellong et al, 1988,1990,1992).
Для изучения состояния кишечного микробиоценоза детям с ОЛЛ проводилось бактериологическое исследование кала в соответствии с методическими рекомендациями «Применение бактерийных биологических препаратов в практике лечения больных кишечными инфекциями. Диагностика и лечение дисбактериоза кишечника» (М., 1986). Выделение и идентификацию микроорганизмов проводили общепринятыми методами. С диагностической целью, а также в качестве критерия эффективности используемого лекарственного средства для коррекции кишечной микрофлоры использовались методы определения антилизоцимной активности (Бухарин О.В. с соавт., 1984), и бактериоциногенной активности микроорганизмов (патент №2228529 от 10.05.2004).
Для изучения состояния микробиоценоза кишечника и инфекционных осложнений были обследованы 39 детей с ОЛЛ. В группу сравнения вошли 25 здоровых детей, которым проводилось исследование кишечного микробиоценоза с использованием вышеописанных методов.
Для установления влияния цитотатиков на бактериоциногенную активность E.coli использована модифицированная методика определения бактериоциногенной активности (Д.К.Кудлай, В.Г.Лиходед, 1966). На чашки Петри с плотной питательной средой, содержащий цитостатики в различных концентрациях (метотрексат от 2,5 до 10 мг/мл и винкристин от 0,125 до 0,5 мг/мл) уколом проводили посевы исследуемых культур. В качестве контроля использовали питательную среду с 10 мл питательного агара, куда проводили посев тех же штаммов Escherichia coli. Коэффициент изменения БЦ-активности определялся по формуле:
К= d зоны задержки роста / d зоны роста исследуемой культуры, где
d - диаметр в мм.
Оценка состояния микробиоценоза кишечника по степеням проводилась в соответствии с классификацией И.Б.Куваевой и К.С.Ладодо (1991).
Инфекционные осложнения диагностировались и классифицировались согласно рекомендациям ВОЗ (1993) и МКБ X пересмотра.
Клинические и лабораторные исследования проводились на базе Областной детской клинической больницы г.Оренбурга (гл. врач – Н.В. Смолягина), проблемной лаборатории по изучению механизмов естественного иммунитета Оренбургской государственной медицинской академии (зав. лабораторией – д.м.н., профессор А.И.Смолягин) и лаборатории дисбиозов института клеточного и внутриклеточного симбиоза УрО РАН г.Оренбурга (директор – академик РАН, д.м.н., профессор О.В. Бухарин).
С целью профилактики инфекционных осложнений дети с ОЛЛ были разделены на 2 группы, рандомизированные по основным показателям: 19 детей получали пребиотическое лечение для коррекции микробиоценоза кишечника, у 20 детей пребиотик не использовался. В качестве пребиотика нами использовался препарат Дюфалак (лактулоза), фирма SOLVAI PHARMA, Нидерланды, форма выпуска: сироп по 200 или 500 мл. Дозы и длительность применения препарата были следующие: лактулоза детям от 1 до 3 лет – 2,5 мл препарата 1 раз в день утром, детям от 3 до 6 лет – 3 мл препарата 1 раз в день утром, детям от 6 до 15 лет – 5 мл препарата 1 раз в день утром в течение 30 дней. Лактулоза назначалась детям одновременно с началом лечения цитостатиками по протоколу ALL BFM 90. I группа получала лактулозу в течение 4 недель, затем обе группы детей вновь были обследованы с использованием бактериологических методов, описанных выше. Эффективность используемого препарата оценивалась по динамике нарушений кишечного микробиоценоза, уровню БЦ-активности и персистентных свойств E. coli, клиническому течению инфекционных осложнений при наблюдении в катамнезе в течение 12 мес.
Обработка полученных результатов проводилась с использованием математических методов доказательной медицины: расчет показателей критериев достоверности Стьюдента – Фишера, Вилкоксона, Манна-Уитни, ранговой корреляции Спирмена, абсолютного риска. Для оценки влияния цитостатиков на БЦ-активность E. coli использован критерий знаков. Для объективизации результатов положительного влияния профилактического воздействия нами использован один из приемов доказательной медицины (Щеплягина Л.А. и соавт., 2003). Он предусматривает количественную характеристику эффективности профилактических/лечебных мер на основе сопоставления ключевых показателей (исходов) в основной и контрольной группах после объединения их в таблицу сопряженности с расчетом показателя - отношение шансов, которое показывает, во сколько раз вероятность неблагоприятного исхода в исследуемой группе выше или ниже, чем в контроле.
Результаты исследования и их обсуждение
Нами проведен анализ анамнестических данных, клинико-параклинических признаков и функциональных показателей, полученных при длительном (2-3 года) наблюдении за 39 детьми с ОЛЛ.
Выявлено, что у 69,3±7,9% детей с ОЛЛ манифестация заболевания отмечалась в возрасте от 1 до 7 лет. Установлена отягощенная наследственность по онкопатологии в семье у 24±2,7% детей. Патологическое течение беременности имело место у 66,7±7,6% матерей обследуемых детей: у 64±7,6% матерей беременность протекала на фоне анемии, у 59±6,7% - на фоне токсикозов I и II половины, у 25±2,8% матерей предыдущие беременности закончились самопроизвольным прерыванием. Установлено также, что у 23±2,8% обследуемых детей была повышенная масса тела при рождении (более 4000 гр). Из литературных данных известно, что в некоторых исследованиях демонстрируется связь повышенной заболеваемостью острыми лейкозами у детей, матери которых имели в анамнезе выкидыши, а также дети с высоким весом при рождении имеют в 2 раза больший риск заболеть этим заболеванием. (М.Б.Белогурова, 2002).
Анализ анамнестических данных выявил, что дисбиоз кишечника на первом году жизни (до заболевания острым лейкозом) отмечался у 26 детей (66,7±7,6%). Из них нарушение кишечного микробиоценоза I-II степени было выявлено у 23 человек (88,5±10,1%), III-IV степени – у 3 (11,5±1,2%). Дисбиоз кишечника чаще встречается у детей, матери которых во время беременности перенесли анемию, токсикоз I и II половины, осложненные роды (р<0,05). У этих детей чаще по сравнению с детьми, у которых не было проявлений дизбиоза кишечника на первом году жизни, отмечались частые простудные заболевания (15,3±1,7%, р<0,05), нарушения стула (80,7±9,2%, р<0,01), боли в животе (26,9±2,9%, р<0,05). Все это позволяет предположить, что дети, имеющие вышеописанные нарушения имеют больший риск к возникновению нарушений кишечного микробиоценоза.
Ведущими клиническими проявлениями ОЛЛ в периоде развернутой клинико-гематологической картины у детей служили синдром интоксикации (74,4±8,4%), анемический (100%), геморрагический (70±8,0%), лимфопролиферативный (90±10,3%) синдромы. Диспептический синдром в виде дисфункции кишечника (запоры, метеоризм, диарея) отмечался у 20±2,3% пациентов с ОЛЛ (рис.1).
 Рис.1 Ведущие клинические синдромы у детей с ОЛЛ
Рис.1 Ведущие клинические синдромы у детей с ОЛЛ
У 97,5% детей с ОЛЛ при осмотре выявлены симптомы недифференцированного синдрома соединительно-тканной дисплазии (НСТД), которые представлены на рис.2. В тоже время в общей популяции детей симптомы НСТД обнаружены у 34,1% человек (р<0,05). Наиболее часто у детей с ОЛЛ встречается восьмой вариант фенотипа НСТД – 56,4± 6,4%, а также четвертый – у 17,9±2,1% больных. Шестой вариант фенотипа НСТД обнаружен у 7,7±0,9% пациентов, и пятый вариант – у 5,1±0,6% (классификация С.Е.Лебедьковой, О.Е.Челпаченко, В.В.Суменко, 2003).
 Рис.2 Внешние фенотипические признаки НСТД у детей с ОЛЛ
Рис.2 Внешние фенотипические признаки НСТД у детей с ОЛЛ
Гематологические изменения в общем анализе крови в виде лейкопении (лейкоцитоза), тромбоцитопении, синдрома бластности, повышенной СОЭ имели место у всех больных детей. У 55±6,3% больных обнаружены изменения биохимических показателей крови.
Нами была проведена оценка не только клинических данных, но и показателей клеточного и гуморального иммунитета у детей с ОЛЛ в периоде развернутой клинико-гематологической картины.
Установлено достоверное снижение общего количества лейкоцитов до 3,3 т/л с преобладанием в лейкоцитарной формуле лимфоцитов – 87±9,9% (р<0,05), абсолютное количество составило 2,9 т/л (р>0,05). Повышение относительного количества лимфоцитов связано с выбросом из костного мозга в периферическую кровь незрелых клеток – лимфо-
бластов.
Исследование иммунофенотипа лимфоцитов выявило достоверное снижение абсолютного и относительного количества зрелых Т-лимфоцитов (СД3) – 1,0 т/л и 51,2% соответственно (р<0,05), а также тенденцию к снижению их субпопуляций: СД4 до 39,4±4,4%, СД8 до 20,7±2,4% (р>0,05). В тоже время отмечается достоверное повышение уровня В-лимфоцитов (СД19) – абсолютное количество составило 0,7т/л, относительное – 24,8±2,7% (р<0,05).
В лейкоцитарной формуле выявлено резкое снижение количества нейтрофилов: сегментоядерные нейтрофилы составили 10,4±1,1% (р<0,01), эозинофилы – 0,6±0,1% (р<0,01). У всех детей отмечено значительное снижение уровня моноцитов – средний показатель – 0,4±0,1% (р<0,001), что свидетельствует о выраженном угнетении клеток, выполняющих фагоцитарную функцию. Фагоцитарный показатель (ФП) снижен и составил 40,8±4,6% (р<0,05).
Гуморальный иммунный ответ у детей с ОЛЛ также изменен: установлено достоверное снижение уровня Jg А – 0,7 г/л (р<0,05) и Jg G – 7,8 г/л (р<0,05), в то время как содержание Jg М незначительно повышено – до 1,3 г/л (р>0,05).
Таким образом, у детей с ОЛЛ в первом остром периоде выявлены достоверные изменения показателей иммунограммы в виде снижения общего количества лейкоцитов, нейтрофилов и моноцитов, а также снижения ФП, содержания зрелых Т- и В-лимфоцитов и угнетения гуморального иммунного ответа, и соответствуют второй и третьей степени иммунной дефицитности. Эти изменения свидетельствуют о высоком риске развития инфекционных осложнений у детей с ОЛЛ в период развернутой клинико-гематологической картины.
С целью определения состояния микробиоценоза кишечника дети с ОЛЛ были обследованы на разных этапах заболевания и в период комплексного лечения (ПХТ+сопроводительная терапия).
Периоды обследования были следующие: I – до начала лечения химиопрепаратами; II – на фоне его проведения; III – через 3 месяца после окончания основного курса ПХТ; IV – через 6 месяцев после окончания основного курса ПХТ; V – через 12 месяцев после окончания основного курса химиотерапии.
При исследовании кишечного микробиоценоза дисбиоз кишечника выявлен у всех детей с ОЛЛ (100%), тогда как в контрольной группе здоровых детей – у 3 человек (12,2±6,5%), р<0,001 (рис.3).


Здоровые дети Дети с ОЛЛ
Рис. 3 Наличие дисбиоза кишечника у детей с ОЛЛ в сравнении со здоровыми детьми
Установлено, что основные изменения микробиоценоза кишечника выявлялись во время проведения комплексного лечения. У всех детей, обследованных до начала химиотерапии, на фоне ее проведения, через 3 и 6 месяцев после ее окончания диагностирован дисбиоз кишечника различных степеней. До лечения у большинства больных (84±12,4%) выявлен дисбиоз I и II степени. На фоне терапии преобладал дисбиоз III и IV степени (92±13,5%, р<0,05). Через 3 и 6 месяцев после окончания комплексного лечения количество детей с тяжелыми дисбиотическими нарушениями достоверно снижалось, в то же время в эти периоды регистрировались нарушения микробиоценоза кишечника I и II степени (р<0,05). Через 12 месяцев после окончания химиотерапии у большинства больных восстановления микрофлоры до нормы не происходило. Нормальный состав микрофлоры был обнаружен лишь у 16,7±2,5% больных (рис.4).
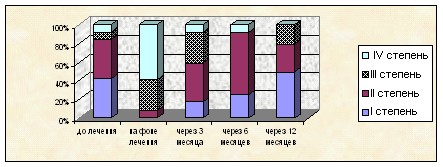
Рис. 4 Изменения кишечного микробиоценоза по степеням на разных этапах заболевания
Нормальное содержание бифидо- и лактобактерий выявлено у большинства детей до начала лечения. На фоне его проведения количество бифидо- и лактофлоры значительно снижалось и через 12 месяцев после окончания ПХТ только у половины больных содержание анаэробной нормофлоры восстанавливалось до нормы (р<0,01).
Количество детей с повышенным содержанием общего количества кишечной палочки, обусловленным гиперколонизацией E.coli с измененными свойствами, увеличивалось на фоне химиотерапии практически до 100% и через 12 месяцев после окончания лечения E.coli обнаруживалась у половины больных (р<0,01). На фоне лечения химиопрепаратами у 4-х детей (16,6±2,7%) были обнаружены представители условно-патогенной флоры - Proteus spp. и Klebsiella spp., во все остальные периоды обследования эти микроорганизмы не выявлены (р<0,05).
Повышенное количество дрожжеподобных грибов рода Candida было обнаружено у большинства больных (75%) на всех этапах обследования. Высокий уровень ПМО грибами рода Candida (104 КОЕ/г) на фоне проводимого лечения выявлен более чем у половины больных, через 12 месяцев после его окончания уровень грибов рода Candida уменьшается и выявляется в количестве <104 КОЕ/г у 30% детей (р<0,05).
В то же время по данным Хавкина А.И. дрожжеподобные грибы рода Candida редко обнаруживаются у здоровых детей и взрослых. Их уровень в норме не должен превышать 104 КОЕ/г испражнений. Однако, в каждом конкретном случае, обнаружение дрожжеподобных грибов даже в небольшом количестве, особенно у детей младшего возраста и у больных со сниженной иммунной резистентностью, должно сопровождаться клиническим обследованием с целью исключения кандидозов.
Для определения тяжести дисбиоза кишечника и качественных изменений кишечной микрофлоры у детей с ОЛЛ был использован БЦ-тест. При проведении БЦ-теста выявлено, что у 67±7,6% детей с дисбиозом III и IV степени определен положительный БЦ-тест (рис.5). Установлена корреляционная связь тяжелых нарушений микробиоценоза кишечника с положительным БЦ-тестом (r-0,56, р<0,01).

Рис.5. Связь бактериоциногенного теста со степенью дисбиотических изменений у детей с ОЛЛ
При проведении эксперимента in vitro выявлено, что под влиянием винкристина показатель БЦ-активности уменьшается у всех культур, взятых в исследование (рис.6).

Рис 6. Влияние цитостатиков на БЦ-активность E.coli in vitro
Коэффициент БЦ-активности E. сoli при добавлении в среду винкристина составил 1,07 по сравнению с контрольной группой бактерий – 2,29 (р<0,001). Этот коэффициент уменьшается за счет уменьшения зоны задержки роста E. сoli в среде с винкристином, (р<0,01). При оценке влияния метотрексата на бактериоциногенную активность кишечной палочки, напротив, показатель БЦ-активности увеличивается с 1,94 до 2,54 (р<0,01). Диаметр зоны задержки роста в среде с метотрексатом также увеличивается по сравнению с контролем, (р<0,01). Полученные данные свидетельствуют о качественных изменениях микрофлоры кишечника под влиянием цитостатиков.
Таким образом, установлено, что на фоне общего снижения иммунологической резистентности до лечения химиопрепаратами имеются изменения в микробиоценозе кишечника, которые значительно усугубляются на фоне химиотерапии и могут привести к серьезным инфекционным осложнениям, вплоть до септических состояний и летальному исходу.
При клиническом обследовании из 39 детей с ОЛЛ у 37-ти (94,8±10,7%) выявлены инфекционные осложнения. Всего нами было зафиксировано 119 инфекционных осложнений. Такое количество инфекционных осложнений объясняется тем, что во время лечения у одного ребенка даже на одном этапе терапии могло быть от 1 до 6 инфекционных эпизодов. Из всех инфекционных осложнений в 90,8±10,3% случаев встречалась локализованная инфекция (ЛИ). В структуре ЛИ наиболее частым было поражение органов дыхательной системы – 57,4±6,5%, на втором месте – заболевания органов пищеварительной системы – 37,9±4,3% и реже всего встречались болезни других органов и систем – 4,6±0,6 % (рис.7).
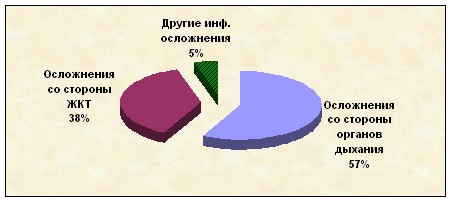 Рис. 7 Структура локализованной инфекции у детей с ОЛЛ
Рис. 7 Структура локализованной инфекции у детей с ОЛЛ
Среди инфекций дыхательной системы чаще всего регистрировался острый бронхит – 41,9±4,7%, обструктивный бронхит – 11,3±1,2%, фарингит – 16,1±1,8%, ринофарингит – 12,9±1,5%. Пневмония диагностирована у 2 детей (1,68±0,2%), обострение хронического риносинусита – у 3 человек (2,52±0,3%). Другие осложнения (ринит, ОРЗ) составили 12±1,3% (рис.8).
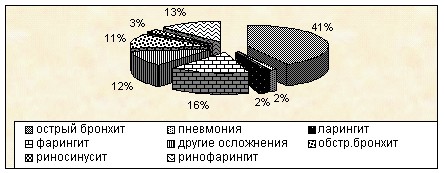
Рис. 8 Нозологическая структура инфекций дыхательной системы у детей с ОЛЛ
Среди инфекций ЖКТ наиболее часто встречался стоматит – 56±6,3% и токсичекая энтеропатия – 33±3,8%. У 3-х детей диагностирован кандидозный эзофагит (8±0,9%) и у одного ребенка – кандидоз 12-ти перстной кишки (3±0,3%) (рис.9). У 5 детей (12,1±1,3%) диагностированы различные формы гастрита (поверхностный, гранулярный, эрозивный), гастродуоденит, сопровождающийся ДГР. У 3 человек (8±0,9%) поставлен диагноз: ГЭРБ.
 Рис. 9 Нозологическая структура инфекций пищеварительной
Рис. 9 Нозологическая структура инфекций пищеварительной
системы у детей с ОЛЛ
Неидентифицированная инфекция (НИ) выявлена у 10 детей с ОЛЛ, что составило 8,4±0,9% от общего числа инфекционных осложнений. Данная патология проявлялась повышением температуры до фебрильных цифр без выявленного очага инфекции и в 90±10,3% случаев была зарегистрирована на I неделе с момента постановки диагноза острого лимфобластного лейкоза.
У одного ребенка (0,84±0,1%) диагностирован сепсис, который был бактериологически подтвержден – при посеве крови на стерильность был высеян Enterobacter cloacae. У 3-х детей с ОЛЛ (2,5±0,3%) был поставлен диагноз: Сепсис-синдром, так как наряду с выраженными клиническими проявлениями сепсиса бактериологического подтверждения не было получено.
Проведенные исследования выявили, что инфекционные осложнения были диагностированы на протяжении всего периода наблюдения на фоне полихимиотерапии. Наиболее часто (в 74,8±8,6% случаев) инфекционные осложнения возникали с I по 5 неделю постановки диагноза ОЛЛ и начала лечения по протоколу ALL-BFM 90. Затем количество осложнений снижается: с 10,9% до 1% случаев (р<0,001), (рис.10).
 Рис.10 Сроки развития инфекционных осложнений у детей с ОЛЛ
Рис.10 Сроки развития инфекционных осложнений у детей с ОЛЛ
Таким образом, из всего вышеизложенного следует, что у подавляющего большинства детей с ОЛЛ (94,8%) имеют место инфекционные осложнения. В нозологической структуре инфекционных осложнений преобладают поражение бронхо-легочной системы и желудочно-кишечного тракта.
Для коррекции кишечного микробиоценоза и профилактики инфекционных осложнений нами проведено лечение лактулозой. 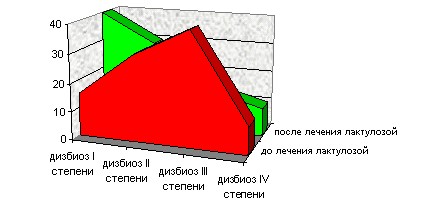
Рис. 11 Изменение кишечного дисбиоза по степеням у детей с ОЛЛ,
пролеченных лактулозой
Полученные результаты микробиологических исследований показали, что после лечения лактулозой достоверно улучшилось состояние микрофлоры дистального отдела кишечника у детей с ОЛЛ: уменьшилось количество детей с дисбиозом III степени в 2,5 раза (р<0,05), в тоже время увеличилось количество детей с нарушением микробиоценоза кишечника I степени с 3 до 8 человек (р<0,05). Количество детей с дисбиозом II степени не изменилось (рис.11). Также после проведенного лечения увеличилось количество детей с нормальным содержанием бифидо- и лактобактерий более чем на 50% (р<0,05) и достоверно (в 3 раза) уменьшилось число детей с пониженным содержанием бифидо- и лактофлоры (107 КОЕ/г) (р<0,05). Более чем у половины детей снизилась высеваемость кишечной палочки с измененными свойствами (р<0,001), в том числе гиперколонизация гемолитической кишечной палочкой в повышенном количестве – после лечения не высеяна ни у одного ребенка, (р<0,05).
На фоне лечения пребиотиком имеется тенденция к увеличению количества детей с нормальном содержанием молочнокислого стрептококка.
Количество больных с повышенным содержанием дрожжеподобных грибов рода Candida (104 КОЕ/г) после лечения пребиотиком уменьшилось на 35% (р<0,05). Число детей, у которых до нуля уменьшился ПМО грибами рода Candida значительно увеличилось (с 5-ти до 11-ти пациентов), р<0,05.
На 30% уменьшилось число больных, у которых выделена лактозонегативная кишечная палочка в количестве 106-108 КОЕ/г (р<0,05).
После лечения лактулозой проявляется тенденция к снижению уровня антилизоцимной активности (АЛА) лактозонегативной кишечной палочки с 3-4 мкг/мл до 1-2 мкг/мл и к повышению уровня АЛА лактозопозитивной E.coli с 0-1 мкг/мл до 1-2 мкг/мл.
Достоверные изменения обнаружены при определении бактериоциногенного теста (рис.12): на 35% увеличилось количество детей с отрицательным БЦ-тестом E.coli (р<0,01).
Количество детей с положительным БЦ-тестом на фоне лечения лактулозой напротив значительно уменьшается – с 12 до 5 больных (р<0,01), что свидетельствует о положительном влиянии лактулозы на микрофлору кишечника у детей с ОЛЛ.

Рис.12 Изменение показателей БЦ-теста на фоне лечения лактулозой по сравнению с контрольной группой у детей с ОЛЛ
В контрольной группе детей с ОЛЛ, не получавших лактулозу на фоне цитостатичекой терапии, отмечены значительные ухудшения количественных и качественных показателей микрофлоры кишечника.
Установлено, что на фоне лечения лактулозой у детей с ОЛЛ достоверно реже диагностировались инфекционные осложнения (табл.1).
Таблица 1.
Риск развития инфекционных осложнений у детей с ОЛЛ,
пролеченных лактулозой по сравнению с контрольной группой
| Инфекционное осложнение | I (%) | II (%) | АР(%) | ОШ | Доверительный интервал 95% | |
| Острый бронхит | 84,2 | 55 | 34,26 | 4,36 | 5,39 | 3,34 |
| Обструктивный бронхит | 26,3 | 10 | 27,68 | 3,21 | 4,10 | 2,33 |
| Ринофарингит | 36,9 | 15 | 28,62 | 3,31 | 4,20 | 2,41 |
| Фарингит | 36,9 | 15 | 28,62 | 3,31 | 4,20 | 2,41 |
| Хронический риносинусит | 21,1 | 5 | 35,88 | 5,07 | 6,17 | 3,96 |
| Стоматит | 73,7 | 35 | 37,98 | 4,85 | 5,89 | 3,81 |
| Токсическая энтеропатия | 21,1 | 5 | 35,88 | 5,07 | 6,17 | 3,96 |
| Кандидозный эзофагит | 10,5 | 2,5 | 33,42 | 4,59 | 5,64 | 3,54 |
| Хронический дуоденит | 21,1 | 10 | 21,21 | 2,40 | 3,17 | 1,63 |
| Герпетическая инфекция | 52,6 | 20 | 35,43 | 4,44 | 5,48 | 3,41 |
| Хламидийная инфекция | 26,3 | 10 | 27,68 | 3,21 | 4,10 | 2,33 |
| Микоплазменная инфекция | 36,8 | 10 | 37,78 | 5,25 | 6,37 | 4,13 |
Примечание: I- контрольная группа
II- группа детей, получавших лактулозу (процент детей, у которых диагностировано заболевание)
Острый бронхит диагностирован у 11 человек в группе детей, пролеченных пребиотиком (55%), и у 16 детей (84,2%), не получавших лактулозу, при этом абсолютный риск (АР) составил 34,3%, а отношение шансов (ОШ)– 4,36. Достоверно снизилось число детей с оструктивным бронхитом: до лечения лактулозой обострение данного заболевания выявлено у 5 детей (26,3%), а в контрольной группе – у двух больных, что составило 10%, (АР-24,7%, ОШ-3,21). Также уменьшилось и число детей, заболевших ринофарингитом: в группе детей, не получавших пребиотик – 7 человек, после лечения лактулозой – 3-е детей, (36,8% и 15% соответственно), АР-28,6, ОШ-3,31. Обострение хронического риносинусита после лечения пребиотиком выявлено у одного ребенка (5%), а в группе детей, которым лечение не проводилось, имело место у 4 человек (21,1%), АР-35,88, ОШ-5,07. Фарингит выявлен у 7 пациентов, не получавших лактулозу (36,8%) и у 3 больных, пролеченных пребиотиком (15%), АР-28,62%, ОШ-3,31.
После лечения в 2 раза снизилось количество детей со стоматитом: в группе детей, не пролеченных лактулозой данное заболевание диагностировано у 14-ти человек (73,7%), и у 7-ми детей, получивших пребиотическое лечение (35%), АР-33,42%, ОШ-4,59. Кандидозный эзофагит не диагностирован ни у одного пациента после пребиотического лечения, а в группе детей, не получавших пребиотик – у 5 человек (26,3%), АР-33,42 ОШ-4,59. Токсическая энтеропатия выявлена у 4 детей (21,1%), не получавших лечение лактулозой, а в группе пролеченных детей – у одного ребенка (5%), АР-35,88, ОШ-5,07.
Обострение герпетической инфекции наблюдались у 4 пациентов (20%), которым проводилось пребиотическое лечение и у 10 детей (52,6%), которым лечение лактулозой не проводилось, АР-35,43, ОШ-4,44. Хламидийная инфекция диагностирована у 2 детей (10%), получавших лактулозу и у 5 детей (26,3%) из группы, не пролеченных пребиотиком, АР-27,68, ОШ-3,21. Микоплазменная инфекция обнаружена у 2 детей (10%), пролеченных лактулозой, в группе детей, не получавших лактулозу – у 7 пациентов (36,8%), АР-37,78, ОШ-5,25.
Таким образом, на фоне лечения лактулозой отмечается достоверное улучшение состояния кишечного микробиоценоза у детей с ОЛЛ, о чем свидетельствует снижение количества детей с IV и III степенями дисбиоза кишечника в сравнении с группой детей, не получавших лечение пребиотиком. При этом определяется достоверное увеличение числа детей с нормальным содержанием бифидо- и лактобактерий и достоверное снижение показателей микробной обсемененности условно-патогенными микроорганизмами: кишечной палочки с измененными свойствами (лактозонегативной E.coli, E.coli с гемолитическими свойствами), грибов рода Candida.
Клиническая эффективность лечения лактулозой подверждается уменьшением частоты инфекционных осложнений, таких как острый бронхит, обструктивный бронхит, хламидийная, микоплазменная инфекция, обострение герпетической инфекции и хронического риносинусита, а также ринофарингит, стоматит, кандидозный эзофагит, токсическая энтеропатия у детей с ОЛЛ, получавших превентивное лечение пребиотиком.
ВЫВОДЫ
- Дисбиотические нарушения кишечной микрофлоры у детей с ОЛЛ определяются с высокой частотой (100%). Наиболее глубокие нарушения выявляются в период развернутой клинико-гематологической картины на фоне полихимиотерапии (на этапе индукции ремиссии): дисбиоз III и IV степени выявлен у 92% детей, значительное снижение бифидо- лактофлоры вплоть до полного ее отсутствия - у 75% детей, гиперколонизация E.coli с измененными свойствами и грибами рода Candida - у 92% и 67% детей соответственно.
- В процессе экспериментов in vitro доказано влияние цитостатиков (винкристина и метотрексата) на БЦ-активность E.coli. В среде с винкристином БЦ-активность E.coli снижается, а в среде с метотрексатом напротив, повышается. Выявлена достоверная корреляция БЦ-теста со степенью тяжести кишечного дисбиоза у детей с ОЛЛ.
- Частота инфекционных осложнений у детей с ОЛЛ составляет 94,8%. В нозологической структуре инфекционных осложнений преобладают поражение бронхо-легочной системы (57,4%) и желудочно-кишечного тракта (37,9%).
- Установлено положительное влияние пребиотика лактулозы на количественные и качественные нарушения кишечной микрофлоры у детей с ОЛЛ: в 2,5 раза уменьшилось количество детей с дисбиозом III степени, увеличилось содержание бифидо-и лактофлоры до нормы у 50% детей, снизились ПМО E.coli с измененными свойствами у 55% детей и у 35% - гиперколонизация грибами рода Candida. Количество детей с положительным БЦ-
тестом уменьшилось на 35%, АЛА E.coli достоверно не измени- лась.
- Включение пребиотика лактулозы в комплексное лечение детей с ОЛЛ в период полихимиотерапии с целью коррекции кишечного дисбиоза способствует снижению количества инфекционных осложнений таких как: острый бронхит, обструктивный бронхит, хламидийная, микоплазменная инфекции, обострение герпетической инфекции и хронического риносинусита, а также ринофарингит, стоматит, кандидозный эзофагит, токсическая энтеропатия.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Детям с острым лимфобластным лейкозом до начала полихимиотерапии, в период индукции и консолидации ремиссии рекомендуется систематически (1 раз в месяц) осуществлять бактериологическое исследование кишечного микробиоценоза с целью своевременного выявления нарушений микрофлоры кишечника, наличие которых служит основанием для проведения адекватных профилактических мероприятий.
2. При бактериологическом обследовании детей с острым лимфобластным лейкозом рекомендуется проведение бактериоциногенного теста для оценки тяжести кишечного дисбиоза, а также в качестве скринингового метода исследования и для расширения информативности классического бактериологического метода исследования микробиоценоза кишечника.
3. Учитывая клиническую эффективность применения пребиотика лактулозы предлагается назначать указанный препарат в комплексной терапии детей с острым лимфобластным лейкозом одновременно с началом полихимиотерапии. Длительность применения лактулозы должна составлять не менее одного месяца.
Список работ, опубликованных по теме диссертации.
1.Голубчикова Н.М. Обоснование применения пре- и пробиотиков в профилактике инфекционных осложнений у детей с гемобластозами // Вестник Оренбургского государственного университета. – 2006. - №13(63) – с.223-224.
2.Голубчикова Н.М. Коррекция дисбиоза кишечника у детей с острым лимфобластным лейкозом пребиотиком лактулозой //Материалы VI Российского конгресса «Современные технологии в педиатрии и детской хирургии». – Москва. – 2007. – с.197-198 (Н.М.Голубчикова, О.Е Челпаченко, А.В. Валышев, И.В. Валышева).
3.Голубчикова Н.М. Превентивное лечение лактулозой нарушений кишечного микробиоценоза у детей с острым лимфобластным лейкозом
//Вестник Оренбургского государственного университета. Материалы конференции молодых ученых и специалистов Оренбургской области. – Оренбург. – 2008.- №82 – с.129-130.
4.Голубчикова Н.М. Особенности микробиоценоза кишечника у детей с острым лимфобластным лейкозом // Сборник научных работ «Актуальные проблемы педиатрии». – Уфа. – 2008. – с.49-52 (Н.М. Голубчикова, О.Е. Челпаченко, В.В. Суменко).
5.Челпаченко О.Е. Клинические симптомы недифференцированной соединительно-тканной дисплазии у детей с острым лимфобластным лейкозом // Материалы VII Российского конгресса «Современные технологии в педиатрии и детской хирургии». – Москва. – 2008. – с.329-330 (О.Е. Челпаченко, Н.М. Голубчикова, В.В. Суменко).
6.Голубчикова Н.М.Характеристика бактериологического мониторинга микробиоценоза кишечника у детей с острым лимфобластным лейкозом // Вестник этнической медицины. – Кызыл – 2009. - №3. – с.11-14 (Н.М.Голубчикова, О.Е. Челпаченко).
7.Варачек Н.М. Эффективность лечения лактулозой детей с острым лимфобластным лейкозом // Материалы VIII Российского конгресса «Современные технологии в педиатрии и детской хирургии». – Москва. – 2009. – с.260-261 (Н.М. Варачек, О.Е. Челпаченко, В.В. Суменко).
8.Варачек Н.М. Эффективность лактулозы в профилактике инфекционных осложнений у детей с острым лимфобластным лейкозом // Сборник научных работ «Актуальные проблемы педиатрии». – Уфа. – 2009. – с.47-49 (Н.М. Варачек, О.Е. Челпаченко, В.В. Суменко).
Условные обозначения и сокращения
АЛА – антилизоцимная активность
АР – абсолютный риск
БАК – биохимический анализ крови
БЦ-активность – бактериоциногенная активность
БЦ-тест – бактериоциногенный тест
ВОЗ – Всемирная Организация Здравоохранения
ГМС – гипермобильность суставов
ГРК – гиперрастяжимость кожи
ГУЗ – государственное учреждение здравоохранения
ДГР – дуодено-гастральный рефлюкс
ДИ – доверительный интервал
ЖКТ – желудочно-кишечный тракт
КОЕ – колониообразующая единица
КП – кишечная палочка
КП (гем) – гемолитическая кишечная палочка
КП (Л-) – лактозонегативная кишечная палочка
КП (Л+) – лактозопозитивная кишечная палочка
КПИС – кишечная палочка с измененными свойствами
КТ – компьютерная томография
ЛПЗ – лимфопролиферативные заболевания
МЗ РФ – Министерство Здравоохранения Российской Федерации
МКБ – международная классификация болезней
МПА – мясо-пептонный агар
НИИ – научно-исследовательский институт
НИ – неидентифицированная инфекция
НСТД – недифференцированная соединительно-тканная дисплазия
ОАК – общий анализ крови
ОАМ – общий анализ мочи
ОДКБ – Областная детская клиническая больница
ОККП – общее количество кишечной палочки
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОРВИ – острая респираторно-вирусная инфекция
ОТ-ПЦР – обратная транскрипция полимеразной цепной реакции
ОШ – отношение шансов
ПК – повышенная кровоточивость
ПМК – пролапс митрального клапана
ПХТ – полихимиотерапия
РАМН – Российская академия медицинских наук
СИД – степень иммунной дефицитности
УЗИ – ультразвуковое исследование
УПФ – условно-патогенная флора
УрО РАН – Уральское отделение Российской академии наук
ФГДС – фиброгастродуоненоскопия
ФП – фагоцитарный показатель
ЦНС – центральная нервная система
ЭКГ – электрокардиограмма
ЭХО-КС - эхокардиоскопия
Варачек Наталья Михайловна
Клинико-бактериологические аспекты нарушений микробиоценоза
кишечника у детей с острым лимфобластным лейкозом
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
______________________________________________________________
Оригинал макет сверстан в программе Word
Подписано в печать 22.01.2010. формат А 4. гарнитура «Таймс».
Тираж 100 экз.

