Особенности экстрацеллюлярного матрикса и нарушений эпителио-стромальных отношений в механизме формирования атрофии слизистой оболочки желудка, ассоциированной с системной дисплазией соедин и тельной
На правах рукописи
САБЛИНА ОЛЬГА ФЕДОРОВНА
Особенности экстрацеллюлярного матрикса
и нарушений эпителио-стромальных отношений
в механизме формирования атрофии СлизисТой Оболочки Желудка, ассоциированной
с системной дисплазией соединительной ткани
14.03.03 – патологическая физиология
14.03.02 – патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Сургут – 2012
Работа выполнена в государственном образовательном учреждении высшего профессионального образования «Сургутский государственный университет Ханты-Мансийского автономного округа –Югры»
| Научный руководитель: доктор медицинских наук | Наумова Людмила Алексеевна |
| Официальные оппоненты: доктор медицинских наук, профессор | Рагозин Олег Николаевич ГОУ ВПО ХМАО – Югры «Ханты- Мансийская государственная медицинская академия» |
| доктор медицинских наук, профессор | Ларионов Петр Михайлович ФГБУ «Новосибирский научно- исследовательский институт травматологии и ортопедии Минздравсоцразвития России» |
| Ведущая организация: | Учреждение РАМН Научно-исследовательский институт общей патологии и патофизиологии РАМН (г. Москва) |
Защита диссертации состоится «___» _______2012 г. в _____ часов на заседании диссертационного совета Д 800.005.04 при ГОУ ВПО «Сургутский государственный университет ХМАО – Югры» (628400, Тюменская область, ХМАО – Югра, г. Сургут, пр. Ленина, 1).
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО «Сургутский государственный университет ХМАО – Югры» (628400, Тюменская область, ХМАО – Югра, г. Сургут, пр. Ленина, 1), а с авторефератом на сайте ВУЗа – www.surgu.ru.
Автореферат разослан «___»_________ 2012 г.
Ученый секретарь
диссертационного совета,
доктор медицинских наук, доцент А.Н. Поборский
Общая характеристика работы
Актуальность исследования. Актуальность проблемы хронической патологии желудка обусловлена не только ее высокой распространенностью, но и расширением возрастных границ в сторону «омоложения» контингента болеющих (Ю.А. Лысиков и соавт., 2006; И.С. Коржов, С.И. Мозговой, 2007; Е.Г. Мартемьянова, 2009). В этом аспекте особый интерес представляет хроническая патология желудка на фоне дисплазии соединительной ткани (Г.И. Нечаева, И.А. Викторова, 2007; Т.И. Кадурина, В.Н. Горбунова, 2009).
Соединительная ткань – не только важнейшая интегративная система организма, но и составляющая сосудисто-эпителио-стромальных отношений, определяющих сохранение тканевого гомеостаза и активно модулирующих течение патологического процесса (А.Б. Шехтер, В.В. Серов, 1991; В.П. Казначеев, М.Я. Субботин, 2006; Л.А. Наумова, С.В. Пушкарев, 2009; D. Сoradini et al., 2011). Среди многочисленных взаимосвязанных функций СТ особого внимания заслуживают морфогенетическая (структурообразующая), проявляющаяся в регулирующем влиянии компонентов СТ на пролиферацию и дифференцировку клеток различных тканей как в эмбрио-, так и постнатальном онтогенезе, и пластическая, выражающаяся в регенерации и восстановлении поврежденных тканей, адаптации к меняющимся условиям существования. Клеточные элементы СТ (фибробласты, макрофаги и др.) являются источниками ЦК и факторов роста разнонаправленного действия, ремоделируют активность матриксных металлопротеиназ, определяя структуру и функции СТ (И.Ю. Торшин, О.А. Громова, 2008).
Дисплазия СТ – нарушение развития СТ в эмбриональном и постнатальном периодах, характеризующееся дефектами волокнистых структур и основного вещества межклеточного, или ЭЦМ, приводящее к расстройству гомеостаза на тканевом, органном и организменном уровнях в виде различных морфофункциональных нарушений внутренних и локомоторных органов с прогредиентным течением (Г.И. Нечаева, И.А. Викторова, 2006; Т.И. Кадурина, В.Н. Горбунова, 2009). Распространенность проявлений ДСТ в популяции, по данным разных авторов, составляет от 26 до 80% и в значительной степени определяет характер течения разнообразных видов патологии (Г.И. Нечаева, И.А. Викторова, 2007).
Нарушения метаболизма ЭЦМ, обмена коллагенов, функциональной активности клеточных элементов СТ приводят к нарушениям ее гомеостаза, структурно проявляющимся в развитии сосудисто-стромальной дистрофии, различных морфогенетических вариантах склероза, инволюции СТ, ее ремоделировании и нарушении качественного состава компонентов СТ – врожденной или приобретенной дисплазии (В.В. Серов, 1990; А.Б. Шехтер, 1990). Все эти проявления могут быть связаны между собой патогенетически, определять патогенез широкого круга заболеваний от атеросклероза и язвенной болезни до развития неоплазий, ассоциироваться с проблемами старения организма, когда нарушения биохимического, или качественного состава СТ ведут к формированию приобретенных ДСТ, представляющих собой многочисленные фенокопии ее врожденных проявлений (И.В. Давыдовский, 1969; О.В. Лисиченко, 1986; В.В. Серов, 1990; А.Б. Шехтер, 1990; Р.Г. Оганов и соавт., 2003; Т.И. Кадурина, В.Н. Горбунова, 2009).
Актуальность атрофического поражения СОЖ хорошо известна в силу его ассоциированности с раком желудка. Отмеченная ранее высокая частота сочетания ХАГ с признаками недифференцированной ДСТ (Л.А. Наумова и соавт., 2009) инициировала продолжение исследований в аспекте связи дисрегенераторного процесса, каким является ХАГ (В.В. Чернин, 2006), с «аномальной подложкой», какой является диспластически измененная СТ для эпителиальной выстилки слизистых оболочек различной локализации, в том числе и СОЖ.
С этих позиций интересен морфогенез ассоциированного с ДСТ атрофического процесса в СОЖ, который, с одной стороны, отражает изменение регенераторного потенциала ткани, или развитие дисрегенерации, с другой – определяет ее потенции, или характер прогрессирования патологии.
Цель исследования – изучить особенности экстрацеллюлярного матрикса и нарушений эпителио-стромальных отношений в механизме формирования атрофии слизистой оболочки желудка при системной недифференцированной дисплазии соединительной ткани.
Основные задачи, поставленные в работе:
- Выявить особенности клинико-эндоскопических проявлений атрофического процесса в слизистой оболочке желудка, ассоциированного с системной недифференцированной дисплазией соединительной ткани.
- Изучить особенности структурной организации слизистой оболочки желудка при ее атрофии, ассоциированной с системной недифференцированной дисплазией соединительной ткани.
- Выявить особенности состояния экстрацеллюлярного матрикса по экспрессии его важнейших адгезивных молекул – фибронектина и ламинина как возможный патогенетический механизм развития атрофии слизистой оболочки желудка при системной недифференцированной дисплазии соединительной ткани.
- Изучить особенности состояния системы TGF-TGFR1 в механизме нарушения эпителио-стромальных отношений при атрофии слизистой оболочки желудка, ассоциированной с системной недифференцированной дисплазией соединительной ткани.
Научная новизна. Показано, что феномен атрофии СОЖ при ДСТ характеризуется особенностями клинико-эндоскопических проявлений и структурной организации СОЖ. К его клинико-эндоскопическим особенностям относятся высокая частота системности проявлений атрофического процесса, сопутствующих эндокринопатий, в частности, дисфункции половых желез, преобладание дистензионных болей и нарушений функционального состояния желудка (гипотония, недостаточность кардии, дуоденогастральный рефлюкс), высокая частота эрозивных поражений СОЖ и развития полипов.
Структурно феномен атрофии СОЖ при ДСТ ассоциируется с ее характерной тканевой организацией (уменьшение плотности и неравномерность залегания желез, тенденция к их мукоидизации и кистозной трансформации, увеличение плотности сосудов, формирующее зрительный феномен «перфорированности» собственной пластинки), в целом отражающей дисплазию СОЖ, формирующуюся, вероятно, как в эмбрио-, так и постнатальном онтогенезе при воздействии различных патогенных факторов и представляющую собой своеобразную гастропатию.
Установлено, что отмеченные особенности структурной организации СОЖ сопровождаются изменением экспрессии важнейших адгезивных молекул ЭЦМ – повышением уровня фибронектина и ламинина, ассоциирующимся с развитием дисбаланса в системе TGF-TGFR1 и изменениями пролиферативной активности эпителиоцитов СОЖ. Выявленные особенности ЭЦМ и нарушений эпителио-стромальных отношений могут бать важным патогенетическим механизмом формирования атрофии СОЖ при системной недифференцированной дисплазии СТ.
Показано, что при сопутствующей Н. pylori-инфекции наряду с характерными для нее и независящими от наличия ДСТ изменениями (преобладание дисрегенераторных изменений и признаков воспаления в антральном отделе желудка) происходит снижение уровня экспрессии фибронектина, ламинина и TGFR1, отражающее нарастание изменений в системе ЭЦМ и эпителио-стромальных отношениях, которые могут определять и поддерживать прогрессирование дисрегенерации.
Практическая значимость. Результаты исследования имеют принципиальное значение для понимания пато- и морфогенеза атрофического процесса в СОЖ при его ассоциированности с недифференцированной ДСТ, влияния ДСТ на течение патологических процессов в СОЖ и выбора патогенетической терапии.
Полученные в работе данные обусловливают особый диагностический алгоритм и лечебную тактику при патологии желудка у пациентов с ДСТ, в частности, выявление и анализ характера сопутствующей патологии, наличия системности проявлений патологического процесса. Особого внимания в лечебной тактике у этой категории больных требуют выявленные особенности структурной организации СОЖ, состояния ЭЦМ и дисбаланса в системе TGF-TGFR1, обусловливающего прогрессирование дисрегенераторных изменений.
Положения, выносимые на защиту:
1. Атрофический процесс в СОЖ, ассоциированный с системной недифференцированной дисплазией СТ, характеризуется наличием ряда клинико-эндоскопических особенностей в сравнении с атрофией СОЖ при отсутствии дисплазии СТ.
2. Структурно атрофический процесс в СОЖ, ассоциированный с системной ДСТ, характеризуется ее своеобразной организацией – тенденцией к мукоидизации, кистозной трансформации желез и уменьшению их плотности, увеличению плотности сосудов с изменением соответствующих морфометрических показателей.
3. Атрофический процесс в СОЖ, ассоциированный с системной недифференцированной дисплазией СТ, характеризуется увеличением экспрессии главных адгезивных молекул ЭЦМ – фибронектина и ламинина с развитием дисбаланса в системе TGF-TGFR1, которые могут быть одним из важных механизмов его патогенеза.
Апробация работы. Основные положения и результаты исследования были представлены в виде публикаций и докладов на ХI Региональной конференции молодых ученых, специалистов и студентов «Актуальные проблемы теоретической, экспериментальной и клинической медицины» (Ханты-Мансийск, 2009); III Международном молодежном медицинском конгрессе «Санкт-Петербургские научные чтения – 2009» (СПб., 2009); III Всероссийской научно-практической конференции «Актуальные вопросы внутренней патологии. Дисплазия соединительной ткани» (Омск, 2009); Международной научно-практической конференции, посвященной 15–летию медицинского образования в ГОУ ВПО «СурГУ ХМАО–Югры» «Фундаментальные и клинические аспекты охраны здоровья человека на Севере» (Сургут, 2010); V Международной Пироговской студенческой научной медицинской конференции (Москва, 2010); IV Всероссийской научно-практической конференции «Актуальные вопросы внутренней патологии. Дисплазия соединительной ткани» (Омск, 2011); XII Окружной конференции молодых ученых Ханты–Мансийского автономного округа–Югры «Наука и инновации XXI века» (Сургут, 2011).
Декларация личного участия автора. Автором самостоятельно проведен анализ литературы по профилю диссертационного исследования, анализ и обработка историй болезни пациентов при ретро- и проспективном исследовании; автор присутствовал при проведении ЭГДС и принимал активное участие в патоморфологическом и иммуногистохимическом исследованиях гастробиоптатов, анализе полученных результатов. Автором произведена статистическая обработка данных. Доля личного участия соискателя в совместных публикациях составляет 70-80%.
Публикации результатов исследования. По теме диссертации опубликовано 8 печатных работ, из них 4 в журналах, рекомендованных ВАК РФ для публикации материалов докторских и кандидатских диссертаций.
Объем и структура диссертации. Диссертация изложена на 101 странице машинописного текста, содержит 9 таблиц, 31 рисунок, в том числе 20 микрофото, состоит из введения, обзора литературы, описания материалов и методов исследования, двух глав результатов собственных исследований, обсуждения результатов, выводов, практических рекомендаций, списка литературы. Библиографический указатель содержит 156 источников, из которых 110 работ отечественных и 46 - иностранных авторов.
Организация, объект и методы исследования
В соответствии с целью и задачами настоящего исследования на базе патологоанатомического и эндоскопического отделений БУ ХМАО–Югры «Сургутская окружная клиническая больница» и лаборатории кафедры общей патологии медицинского института ГОУ ВПО «Сургутский государственный университет ХМАО–Югры» проведен сравнительный анализ историй заболевания 125 пациентов с эндоскопически диагностированными признаками атрофии СОЖ и диагнозом ХАГ и морфофункциональное исследование их гастробиоптатов.
Проанализированы жалобы больных, характер сопутствующей патологии с позиций возможных экзо- и эндогенных факторов риска хронического гастрита (Г.И. Дорофеев, В.М. Успенский, 1984; В.В. Чернин, 2006), результаты общеклинических методов исследования (рентгенологических, функциональных и инструментальных, в частности, ультразвукового исследования внутренних органов). Во всех случаях была проведена ЭГДС, в большинстве – ректоромано- и фиброколоноскопия. ЭГДС проводилась с использованием видеоэндоскопической системы «Olympus Exera II CV 180» (Япония) и сопровождалась биопсией слизистой оболочки из тела (малая кривизна, передняя стенка) и антрального отдела желудка.
Дизайн исследования представлен на рисунке 1.

Рис. 1. Дизайн исследования
В большинстве (100) случаев анализ был ретроспективным – при исследовании гастробиоптатов у пациентов с ХАГ в ряде случаев обратили на себя внимание характерные особенности организации СОЖ. Как показал анализ историй заболевания, все эти случаи объединяло наличие у пациентов множественных фенотипических и/или висцеральных признаков системной недифференцированной дисплазии СТ, далее исследование выполнялось в соответствии с дизайном. При проспективном исследовании (25 случаев) пациенты с признаками ДСТ и эндоскопическими признаками атрофии СОЖ включались в исследование при проведении ЭГДС, назначенной им в соответствии с планом обследования лечащим врачом. Во всех случаях пациенты дали добровольное информированное согласие на использование в работе результатов их обследования в клинике.
Из числа включенных в анализ случаев фенотипические и/или висцеральные признаки системной недифференцированной ДСТ имели место у 92 человек, из них 49 больных без сопутствующей H. pylori-инфекции в анамнезе и на момент исследования составили 1-ю группу наблюдений, 43 больных с H. pylori-позитивным процессом - 3-ю группу (основные группы).
Группы сравнения составили пациенты без признаков ДСТ соответственно с H. pylori-негативным (2-я группа) и –позитивным атрофическим процессом в СОЖ (4-я группа).
Оценка признаков ДСТ проводилась на основании результатов инструментальных методов исследования (эзофагогастродуоденоскопия, ректоромано- и фиброколоноскопия, УЗИ внутренних органов, эхо-кардиография) и данных осмотра узких специалистов – окулиста, эндокринолога, невропатолога и др. Характеристика основных групп по частоте признаков ДСТ представлена в таблице 1. Статистически значимых различий между группами не выявлено.
Так как известные подходы к балльной оценке степени тяжести дисплазии СТ базируются практически на оценке только фенотипических признаков, а в работе диагностика строилась на выявлении висцеральных признаков, о тяжести ДСТ мы судили по количеству вовлеченных в процесс систем, что в целом соответствует принятым представлениям о тяжести выраженности ДСТ (Г.И. Нечаева, И.А. Викторова, 2007; Т.И. Кадурина, В.Н. Горбунова, 2009). Статистически значимых различий между группами не выявлено – количество пациентов с поражением 3-х и более систем составило в 1-й группе 90%, во 2-й – 80% случаев (рис. 2), но, учитывая чрезвычайное разнообразие механизмов формирования системной недифференцированной ДСТ (Т.И. Кадурина, В.Н. Горбунова, 2009), теоретически, нельзя исключить различий между ними в качественном (биохимическом) состоянии СТ.
Таблица 1
Характеристика основных групп по частоте висцеральных
признаков дисплазии соединительной ткани
| Висцеральные признаки дисплазии соединительной ткани | 1-я группа, n=49 | 3-я группа, n=43 |
| % (абс.) | % (абс.) | |
| Сердечно-сосудистая система: | 67,3 (33) | 62,8 (27) |
| - дополнительная хорда левого желудочка | 28,6 (14) | 32,6 (14) |
| - пролапс митрального капана | 40,8 (20) | 37,2 (16) |
| - варикозное расширение вен | 28,6 (14) | 23,3 (10) |
| Органы зрения: | 59,2 (29) | 53,5 (23) |
| - миопия | 40,8 (20) | 34,9 (15) |
| - астигматизм/гиперметропия | 18,4 (9) | 18,6 (8) |
| Желудочно-кишечный тракт: | 79,6 (39) | 76,7 (33) |
| - перегиб шейки желчного пузыря | 75,5 (37) | 74,4 (32) |
| - гастроптоз | 2,0 (1) | – |
| - мегаколон, долихосигма | 4,1 (2) | 2,3 (1) |
| - дивертикулы пищевода | 2,0 (1) | – |
| - грыжи пищеводного отверстия диафрагмы | 6,1 (3) | 9,3 (4) |
| - недостаточность кардии | 40,8 (20) | 32,6 (14) |
| - дуоденогастральный рефлюкс | 12,2 (6) | 20,9 (9) |
| Костно-суставная система: | 28,6 (14) | 32,6 (14) |
| - ювенильный остеохондроз | 28,6 (14) | 32,6 (14) |
| Мочеполовая система: | 55,1 (27) | 53,5 (23) |
| - нефроптоз | 40,8 (20) | 46,5 (20) |
| - удвоение чашечно-лоханочной системы почек | 6,1 (3) | 7,0 (3) |
| - паховая грыжа | 2,0 (1) | – |
| - варикоцеле | 4,1 (2) | – |
| - гипоплазия матки | 2,0 (1) | – |
Методы морфологического исследования. Для светооптического изучения биоптаты СОЖ фиксировали в 10% растворе нейтрального формалина, обезвоживали в спиртах, возрастающей концентрации, заливали в парафин. Серийные парафиновые срезы окрашивали гематоксилином и эозином, по ван Гизону, Романовскому-Гимзе, ставили ШИК-реакцию.


Рис. 2. Структура основных групп по стигматизации систем
Примечание: серый сектор – проявления признаков ДСТ со стороны 2-х систем, темный сектор – проявления со стороны 3-х систем, светлый сектор – 4-х систем и более.
Морфометрическое исследование. Сравнительное изучение морфометрических параметров желез и микрососудов СО проводилось по биоптатам из зоны малой кривизны и антрального отдела желудка в 20 случаях 1-й группы и 15-ти второй (без признаков ДСТ). Морфометрию проводили с использованием морфометрического программного обеспечения «Micromed images». В каждом случае определяли численную плотность желез и капилляров на стандартной площади среза, равной средней площади поля в исследовании – 23083 мкм2; вычисляли железистый и сосудистый индексы, равные отношению суммарной площади исследуемых полей к суммарной площади соответственно желез или капилляров; относительную поверхностную площадь желез и капилляров - как долю суммарной площади желез (сосудов) от суммарной площади исследуемых полей.
Иммуногистохимическое исследование выполнялось стрептавидин-биотиновым иммунопероксидазным методом на серийных парафиновых срезах СОЖ с использованием моноклональных антител: к TGF и TGFR1 – в обоих случаях в рабочем разведении 1:40; к фибронектину – в разведении 1:200; ламинину – 1:100; к протеину Ki67 – в готовом к использованию разведении («Novocastra», Великобритания). Во всех случаях предварительно выполнялась высокотемпературная демаскировка антигенов, при работе с антителами к фибронектину и ламинину – ферментативная демаскировка с использованием трипсина. Для выявления первичных антител использовали биотинилированные вторичные антитела и стрептавидин, меченый пероксидазой, для визуализации реакции – раствор диаминобензидина (DAB), ядра клеток докрашивали гематоксилином Майера («Novocastra», Великобритания»). Для отрицательного контроля первичные антитела заменяли неиммунной сывороткой.
Оценка результатов иммуногистохимического исследования (фибронектин, ламинин, TGF, TGFR1) рассчитывалась как средний результат оценки интенсивности (от 1 до 3-х баллов) и площади окрашивания по условной 6-балльной шкале: 1 балл - реакция отсутствует или позитивных клеток не более 2%; 2 балла – слабо позитивная (окрашивание единичных клеток или их мелких фокусов общей площадью не более 15% площади исследуемого компартмента), 3 балла – умеренно позитивная реакция (окрашивание до 30% клеток или площади), 4 балла – умеренно выраженная (окрашивание до 50% клеток или площади), 5 баллов – выраженная позитивная реакция (окрашивание до 75%), 6 баллов – сверхэкспрессия, или сильная позитивная реакция (окрашивание более 75% площади). Экспрессия Ki67, являющегося ядерным маркером, рассчитывалась как отношение ядер, содержащих продукт реакции, к 500 ядрам клеток в произвольных полях зрения зоны пролиферации шеечно-ямочного эпителия.
Исследование проводилось в соответствии с принципами доказательной медицины (С. Гланц, 1999; О.Ю. Реброва, 2002). Статистическая обработка материала осуществлялась параметрическими и непараметрическими методами медико-биологической статистики после проверки типа распределения данных с помощью критерия Шапиро-Уилка с использованием пакета компьютерных программ Excel 2007 (Microsoft, США) и «Biostat». Для определения статистической значимости различий данных при их распределении, не соответствующем нормальному, использовали критерий 2 с поправкой Йетса, точный критерий Фишера, при нормальном распределении данных - t-критерий Стъюдента с поправкой Бонферрони для множественных сравнений. Критический уровень значимости при проверке статистических гипотез был принят равным 0,05.
Результаты собственных исследований
Особенности клинико-эндоскопических проявлений атрофического процесса в слизистой оболочке желудка, ассоциированного с системной дисплазией соединительной ткани. При однотипности патологического процесса (атрофия СОЖ) и большинства его клинических проявлений (высокая частота сопутствующих эндокринопатий, хронических урогенитальных инфекций, патологии гепато-панкреато-дуоденальной зоны, симптомов желудочной и кишечной диспепсии) во всех 4-х группах (табл. 2), в 1-й группе по сравнению со второй и 3-й среди сопутствующих эндокринопатий преобладали патология щитовидной железы (38,8 %, в числе которых аутоиммунный тиреоидит составил 26,3%) и дисфункции половых желез (93,8% женщин) с клиническими маркерами дис- и гиперэстрогенемии, в частности только в основных группах как проявление гипоталамо-гипофизарно-яичниковой дисфункции отмечен синдром поликистозных яичников - соответственно в 22 и 13,3% случаев. Влияние ДСТ на состояние половой системы и эндокринную регуляцию остается далеко не изученным (Т.И. Кадурина, В.Н. Горбунова, 2009), вместе с тем влияние дисбаланса стероидных гормонов на дисрегенераторные процессы в СОЖ известно (Ю.М. Степанов, Н.Е. Кушлинский, 2001; Л.М. Берштейн, 2009). В обеих группах сравнения среди проявлений гипоталамо-гипофизарной дисфункции у больных преобладало ожирение – соответственно 76,9% и 71,4% случаев (p1-2<0,001, p3-4<0,01). Среди симптомов желудочной диспепсии в 1-й группе по сравнению со второй преобладали дистензионные боли, в обеих группах сравнения – симптомы кишечной диспепсии. Погрешности в питании как экзогенный фактор риска хронического гастрита чаще отмечали больные в группах сравнения, а также пациенты 3-й группы в сравнении с первой.
При сравнении основных групп между собой 1-ю группу отличал старший возраст больных, большая длительность заболевания, высокая частота системности атрофического процесса (обнаружение признаков атрофии в СО желудка, двенадцатиперстной и толстой кишки при эндоскопических методах исследования), значительная частота сопутствующих урогенитальных инфекций, также ассоциирующихся с системностью поражения пограничных эпителиев. Астено-вегетативный синдром, в том числе с эпизодами снижения массы тела, чаще наблюдался в основных группах в сопоставлении с группами сравнения При высокой во всех группах частоте сопутствующей патологии гепато-панкреато-дуоденальной зоны в 1-й она отмечена чаще, чем в третьей (табл. 2).
Таблица 2
Сравнительная характеристика групп
| Показатель | 1 группа | 2 группа | 3 группа | 4 группа |
| Наблюдения, n | 49 | 16 | 43 | 17 |
| Возраст, лет | 37,6±2,6 3* | 38,2±5,5 | 30,1±2,1 | 28,1±2,9 |
| Пол муж/жен | 17/32 | 3/13 | 13/30 | 3/14 |
| Продолжительность заболевания, лет | 12,0±2,0 3* | 7,8±2,2 | 5,1±1,3 | 4,3±1,6 |
| Сопутствующие эндокринопатии, в том числе дисфункции: | 32 (65,3) | 13 (81,3) | 21 (48,8) | 15 (88,2) 3* |
| - половых желез | 30 (93,8) 2*; 3* | 7 (53,8) | 21 (70,0) | 7 (41,2) |
| - щитовидной железы | 19 (38,8) 3* | 3 (18,8) | 4 (9,2) | 4 (23,5) |
| Хронические урогенитальные инфекции | 24 (49,0) 3* | 6 (37,5) | 10 (23,3) | 6 (35,3) |
| Астено-вегетативный синдром | 32 (65,3) 2* | 6 (37,5) | 25 (58,1) | 6 (35,3) |
| Эпизоды снижения массы тела | 10 (20,4) 3* | 3 (18,8) | 2 (4,7) | 1 (5,9) |
| Системность АП | 36 (73,5) 3* | 9 (56,3) | 14 (32,6) | 6 (35,3) |
| Сопутствующая патология ГПДЗ | 41 (83,7) 3* | 16 (100,0) 1* | 28 (65,1) | 17 (100,0) 3* |
| Симптомы желудочной диспепсии, в том числе: | 36 (73,5) 2* | 7 (43,8) | 25 (58,1) | 7 (41,2) |
| - дистензионные боли | 28 (57,1) 2*; 3* | 4 (25,0) | 8 (18,6) | 5 (29,4) |
| Симптомы кишечной диспепсии | 25 (51,0) | 15 (93,8) 1* | 21 (48,8) | 15 (88,2) 3* |
| Продолжительные погрешности в питании | 8 (16,3) | 12 (75,0) 1* | 21 (48,8) | 13 (76,5) 3* |
Примечание: в скобках указан процент; * – различия между группами статистически значимы при р<0,05. 1 – различия в сравнении с 1-й группой, 2 – различия в сравнении со 2-й группой, 3 – различия в сравнении с 3-й группой.
Так как по частоте большинства висцеральных признаков ДСТ основные группы не различались между собой (табл. 1), выраженная полисиндромность патологии в 1-й группе может объясняться большей долей в ней пациентов (рис. 2) со стигматизацией 3-х и более систем, что отражает тяжесть дисплазии (Т.И. Кадурина, В.Н. Горбунова, 2009) и, вероятно, обусловливает более высокую частоту системности атрофического процесса; значение также может иметь старший возраст пациентов 1-й группы – как известно, у больных с ДСТ с возрастом увеличивается количество ее проявлений, отражающее нарастающее повреждение компонентов СТ (Г.И. Нечаева, И.А. Викторова, 2007).
Эндоскопически в основных группах при сопоставлении с соответствующими группами сравнения чаще диагностирована недостаточность кардии (соответственно 40,8% и 6,3%, p1-2<0,01; 32,6% и 5,9%, p3-4<0,025), только в основных группах – дуоденогастральный рефлюкс (18,4% и 23,3%) и полипы СОЖ (10,2% и 25%). Эрозии СО тела желудка (10,2%) и гипотония (атония) желудка (6,1%) выявлены только в 1-й группе. Для групп с наличием H. pylori-инфекции (3-й и 4-й) характерна высокая частота признаков сопутствующего воспаления. Так, в 3-й группе признаки воспаления СО антрального отдела желудка диагностированы у 51,2% больных, в 1-й – у 20,4% (p1-3<0,001), в 4-й - в 17,6% случаев (p3-4<0,01), что в сравнении с 1-й группой могло объясняться наличием H. pylori-инфекции, в сравнении с 4-й – еще и наличием дуоденогастрального рефлюкса (в обеих группах сравнения он отсутствовал). Грыжи пищеводного отверстия диафрагмы были диагностированы только в основных группах соответственно в 6,3% и 14,0% случаев.
Особенности структурной организации слизистой оболочки желудка при ее атрофии, ассоциированной с системной дисплазией соединительной ткани. К стереотипным проявлениям патологического процесса в СОЖ в исследуемых группах относились: мелкие, неравномерно или редко расположенные желудочные ямки, уменьшение толщины СОЖ в большинстве наблюдений и выраженная мозаичность структурно-функционального состояния желудочных желез, характеризующаяся формированием нескольких тенденций – к мукоидизации и кистозной трансформации, а также к кишечной метаплазии и дисплазии железистого эпителия, ассоциирующейся с нарастающей перигландулярной лимфоидной инфильтрацией и формированием лимфоидных фолликулов на фоне разной степени выраженности склеротических изменений в собственной пластинке.
К особенностям атрофического процесса, ассоциированного с ДСТ (1-я и 3-я группы) относились высокая частота мукоидизации желез по малой кривизне и тенденция к их кистозной трансформации, ассоциирующиеся с уменьшением количества париетальных клеток как отражением формирования функциональной атрофии железистого компартмента, а также значительная плотность сосудов, формирующая в сочетании с кистозными изменениями в собственной пластинке зрительный феномен ее «перфорированности». Кистообразование различной локализации – нередко встречающийся при ДСТ феномен, вероятно, обусловленный нарушениями мезодермы в период органогенеза и изменениями свойств экстрацеллюлярного матрикса (Т.И. Кадурина, В.Н. Горбунова, 2009; D. M. Hockenbery, 2003; M.G. Chiu et al., 2006). При сравнении основных групп (их отличало присутствие Н. pylori в 3-й группе) отмечены статистически значимое преобладание частоты гиперплазии железистого эпителия в обоих отделах желудка в 3-й группе, частоты дисплазии желез в 1-й группе в теле желудка, в 3-й – в антральном отделе (табл. 3).
Признаки структурной атрофии желез преобладали в основных и 4-й группах, реже встречались во второй, что может быть связано с выраженной мозаичностью процесса и ограниченным количеством биоптатов. При сравнении основных групп атрофия желез преобладала в 3-й группе, в ней же чаще отмечены лимфоидные фолликулы (в обоих отделах желудка) и уменьшение толщины СОЖ в антральном отделе, что может объясняться хроническим воспалением, возможно обусловленным как высокой частотой дуоденогастрального рефлюкса в этой группе, так и присутствием Н. pylori-инфекции. Отмеченная тенденция прослеживается и при сравнении между собой 2-й (нет Н. pylori) и 4-й групп (присутствие Н. pylori).
Таблица 3
Частота основных структурных проявлений атрофического процесса в слизистой оболочке желудка (%)

Примечание: числитель – тело желудка, знаменатель – антральный отдел; * – различия между группами статистически значимы при р<0,05. 1 – различия в сравнении с 1-й группой, 2 – различия в сравнении со 2-й группой, 3 – различия в сравнении с 3-й группой, 4 – раз-личия в сравнении с 4-й группой.
Данные морфометрического анализа подтверждают особенности структурной организации СОЖ у пациентов с ДСТ (табл. 4). Это отражающий уменьшение плотности желез более высокий железистый индекс в обоих отделах СОЖ 1-й группы, снижение относительной поверхностной площади желез и их численной плотности на стандартной площади среза, а также более низкие значения сосудистого индекса в слизистой оболочке обоих отделов желудка.
Таблица 4
Морфометрическая характеристика слизистой оболочки желудка
| Показатель | 1-я группа | 2-я группа | ||
| тело | антрум | тело | антрум | |
| Железистый индекс | 3,83±0,4# | 4,33±0,25# | 1,4±0,1 | 2,0±0,12 |
| Численная плотность желез на стандартной площади среза | 4,4±0,9* | 5,4±1,0 | 15,5±5,3 | 9,0±1,7 |
| Относительная поверхностная площадь желез (%) | 28,9±3,8# | 20,9±3,4# | 73,1±4,8 | 50,3±3,4 |
| Сосудистый индекс | 17,9±0,53* | 16,1±7,3 | 43,9±12,2 | 33,7±7,8 |
| Численная плотность сосудов на стандартной площади среза | 3,9±0,9 | 5,1±0,8** | 2,0±0,7 | 2,6±0,4 |
| Относительная поверхностная площадь сосудов (%) | 7,1±1,6* | 12,2±2,9@ | 2,95±1,2 | 3,2±0,66 |
Примечание: * – различия между 1-й и 2-й группами статистически значимы при р<0,05. ** – при p<0,01; @ – при p<0,005; # – при p<0,001.
Особенности экстрацеллюлярного матрикса и нарушений эпителио-стромальных отношений в механизме формирования атрофии СОЖ, ассоциированной с системной дисплазией соединительной ткани. Иммуногистохимический анализ важнейших адгезивных молекул ЭЦМ выявил статистически значимо выраженную экспрессию фибронектина в СО тела желудка в обеих основных группах (то есть в группах с ДСТ), относительно соответствующих им группам сравнения (2-й и 4-й группам). Экспрессия фибронектина в СО антрального отдела желудка также статистически значимо была выше в 1-й группе (ХАГ+ДСТ) как при сопоставлении с соответствующей группой сравнения (2-я группа), так и 3-й группой (ХАГ+ДСТ+ Н.pylori), в которой ее снижение, вероятно, было обусловлено как наличием Н.pylori-инфекции, так и дуодено-гастрального рефлюкса, и было более выраженным, чем в соответствующей группе сравнения (4-я группа - ХАГ+Н.pylori) (рис.3).
В экспрессии ламинина отмечены сходные тенденции – в СО тела желудка статистически значимо высокий уровень экспрессии ламинина в основных группах; в антральном отделе в 1-й группе он также выше, чем в соответствующей группе сравнения (2-я группа) и в третьей группе, то есть при ХАГ, ассоциированном с ДСТ и H. pylori-инфекцией прослеживается характерная для инфицирования этим микробом тенденция к снижению экспрессии ламинина, отражающая повреждение ЭЦМ, и она более выраженная, чем в соответствующей группе сравнения без признаков ДСТ (рис. 4).
Таким образом, отмеченные нами статистически значимо высокие уровни экспрессии фибронектина и ламинина при атрофическом процессе в СОЖ, ассоциированном с ДСТ, первоначально показались неожиданными в силу господства представлений преимущественно о недостаточном синтезе тех или иных компонентов СТ при ДСТ. Вместе с тем, нарушения метаболизма СТ при ее дисплазии многолики. Так, у детей с ДСТ и синдромом раздраженной кишки было отмечено как снижение, так и повышение уровня экспрессии фибронектина, в частности при его гипосекреторном варианте (Г.И. Москович, 2009), структурно этому варианту синдрома раздраженной кишки соответствовал выраженный атрофический процесс в СО сигмовидной кишки.

Рис. 3. Экспрессия фибронектина в теле и антральном отделе желудка
Примечание: светлый столбец – тело желудка, темный столбец – антральный отдел; * – раз-личия между группами статистически значимы при р<0,05, 2 – различия в сравнении со 2-й группой, 3 – различия в сравнении с 3-й группой, 4 – различия в сравнении с 4-й группой, ^ – различия между телом и антральным отделом желудка внутри группы.

Рис. 4. Экспрессия ламинина в теле и антральном отделе желудка
Примечание: светлый столбец – тело желудка, темный столбец – антральный отдел; * – раз-личия между группами статистически значимы при р<0,05, 2 – различия в сравнении со 2-й группой, 3 – различия в сравнении с 3-й группой, 4 – различия в сравнении с 4-й группой.
Возможные эффекты установленного нами повышения уровня экспрессии важнейших адгезивных молекул – фибронектина и ламинина при атрофии СОЖ, ассоциированной с ДСТ, могут быть следующими. Прежде всего, это влияние на процессы формирования, физиологической и репаративной регенерации железистого компартмента СОЖ и, как свидетельствуют результаты структурного анализа, это уменьшение плотности желез, залегание их небольшими группами, выраженная тенденция к мукоидизации и кистообразованию одному из важнейших феноменов ДСТ (D.M. Hockenbery, 2003; M.G. Chiu et al., 2006).
Так как фибронектин является своеобразной сшивкой при построении различных коллагенов, повышение или снижение его уровня, теоретически, должно ассоциироваться с диспропорцией содержания коллагенов различного типа, а это определяет процессы дифференцировки клеточных популяций СОЖ. Так, культивирование эпителиоцитов на фибронектине ассоциируется с активацией TGF, который ответственен за многие тканевые процессы, в частности, развитие фиброза. Теоретически, усиление экспрессии фибронектина ведет к повышению активности TGF через увеличение связи малого скрытого TGF комплекса с фибриллином, встраивание его в ЭЦМ, вследствие чего он становится менее устойчивым к действию активаторов, избыточно освобождается и обусловливает характерные для TGF многочисленные эффекты (К. Kim et al., 2006; R.S. Sterman et al., 2008). Возможно также взаимодействие между фибронектином и интегриновыми рецепторами к нему на лимфоцитах, определяющее регуляцию активности матриксных металлопротеиназ, процессы деградации ЭЦМ и базальных мембран (С. Moore еt al., 2007), а также состояние местного иммунитета, в частности состояние системы «хелперы-супрессоры» с появлением активированных лимфоцитов с цитотоксическим действием на покровно-ямочный и железистый эпителий (Г.И. Не-чаева и соавт., 2002).
Дисбаланс в системе TGF-TGFR1 имел место во всех рассматриваемых группах (рис. 5, 6): в стромальном компартменте СОЖ это тенденция к снижению TGFR1 в обоих отделах желудка (и высокая экспрессия TGF), но более выраженная в антруме, в 4-й группе статистически значимая в сравнении с телом в своей же группе, в этой же группе она ассоциируется с самыми низкими показателями экспрессии фибронектина и ламинина (рис. 3, 4); в железистом компартменте отмечено снижение экспрессии TGF и TGFR1, регистрируемое нами и ранее (Л.А. Наумова и соавт., 2009), при этом статистически значимое в группах с инфицированием H. pylori (3-я и 4-я группы). TGF в железистом компарменте 1-й группы статистически значимо выше, чем в соответствующей группе сравнения (2-я группа), что ассоциируется с более высоким уровнем фибронектина и ламинина в этой группе. В железистом компартменте во 2-й группе, по сравнению с четвертой, статистически значимо ниже экспрессия и TGF, и TGFR1, что не исключает особенностей морфогенеза атрофического процесса в каждой из групп. Для пролиферативной активности в СОЖ, оцениваемой по экспрессии Ki67 была характерна выраженная мозаичность – продукт реакции определялся не во всех железах, в отдельных железах – в ядрах единичных клеток, напротив, активная экспрессия (продукт реакции в ядрах практически каждой клетки герминативной зоны шеечно-ямочного эпителия) структурно часто не соответствовала фокусам гиперплазии эпителия. К выявленным тенденциям в экспрессии протеина Ki67 относились: статистически значимо высокий ИМ в СО тела желудка в 1-й группе, как при сопоставлении с соответствующей группой сравнения, так и 3-й группой - ИМ по группам соответственно был равен – 45,2±7,7; 24,3±5,2; 19,3±5,7; 15,2±4,8 (р1-2<0,05, р1-3<0,01); снижение экспрессии протеина Ki67 в антральном отделе желудка в 1-й и 2-й группах, при сохраняющемся ее более высоком уровне в 1-й группе (ИМ соответственно равен 28,5±5,3; 15,2±3,7; р1-2<0,05); статистически незначимое повышение уровня экспрессии Ki67 в антральном отделе в 3-й и 4-й группах – ИМ соответственно был равен 21,4±6,3 и 19,8±4,1%.
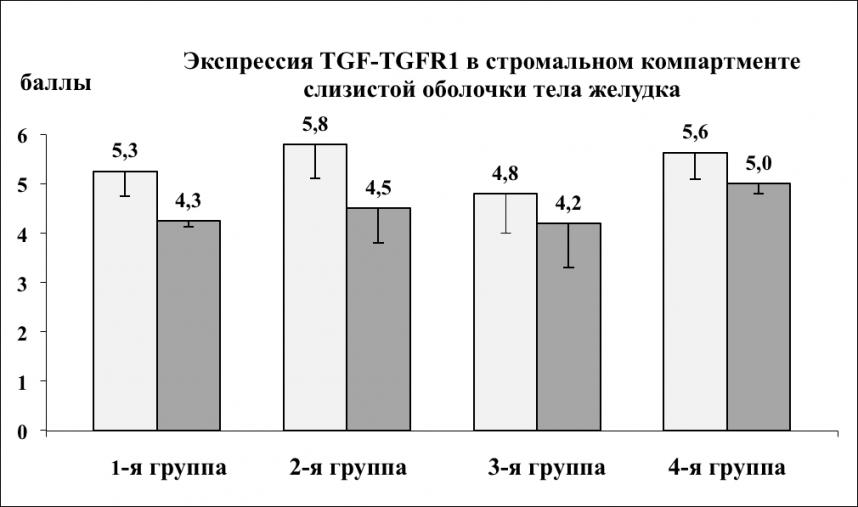
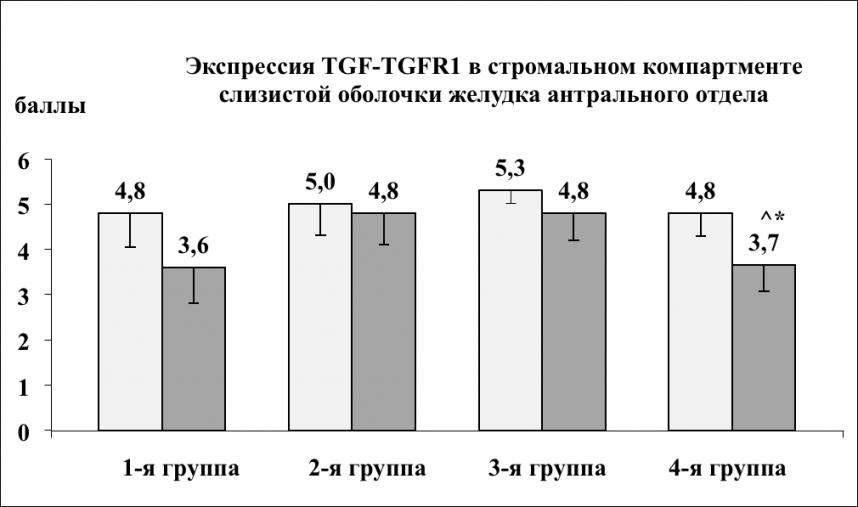
Рис. 5. Экспрессия TGF-TGFR1
в стромальном компартменте слизистой оболочки желудка
Примечание: светлый столбец TGF, темный столбец – TGFR1; * – различия статистически значимы при р<0,05; ^ – различия между телом и антральным отделом желудка.
При известной полиэтиологичности атрофии в целом, отмеченные особенности экспрессии фибронектина, ламинина и дисбаланса в системе TGF-TGFR1 у пациентов с системной недифференцированной ДСТ могут быть одним из возможных механизмов нарушения эпителио-стромальных отношений в сложной цепи патогенеза атрофического процесса в СОЖ и схематично могут быть представлены следующим образом (рис. 7).
Таким образом, по результатам исследования феномен атрофии СОЖ при ДСТ характеризуется рядом клинических и морфологических особенностей. К клиническим особенностям относятся высокая частота системности процесса, сопутствующих эндокринопатий, в частности, дисфункции половых желез, преобладание дистензионных болей и нарушений функционального состояния желудка (недостаточность кардии, дуоденогастральный рефлюкс, гипотония).


Рис. 6. Экспрессия TGF-TGFR1
в железистом компартменте слизистой оболочки желудка
Примечание: светлый столбец TGF, темный столбец – TGFR1; * – различия статистически значимы при р <0,05; 2 – различия в сравнении со 2-й группой, 4 – различия в сравнении с 4-й группой, ^ – различия между телом и антральным отделом желудка.
Наличие Н. pylori-инфекции сопровождается увеличением частоты признаков воспаления в антральном отделе желудка и там же – преобладанием дисрегенераторных изменений в покровно-ямочном и железистом эпителии с нарастанием частоты формирования лимфоидных фолликулов и признаков структурной атрофии желез. Структурно феномен атрофии СОЖ при ДСТ ассоциируется с характерной тканевой организацией (уменьшение плотности и неравномерность залегания желез, тенденция к их мукоидизации и кистозной трансформации, увеличение плотности сосудов как возможный маркер сосудистых мальформаций), важнейшим механизмом формирования которой могут быть изменение ЭЦМ и эпителио-стромальных отношений – выявленные изменения экспрессии главных адгезивных молекул ЭЦМ и дисбаланс в системе TGF-TGFR1. Установленные особенности организации СОЖ при ее атрофии, ассоциированной с системной дисплазией СТ, свидетельствуют о дисплазии СОЖ, формирующейся, вероятно, как в эмбрио-, так и постнатальном онтогенезе (учитывая морфогенетические эффекты исследованных протеинов), и представляют собой своеобразную гастропатию.
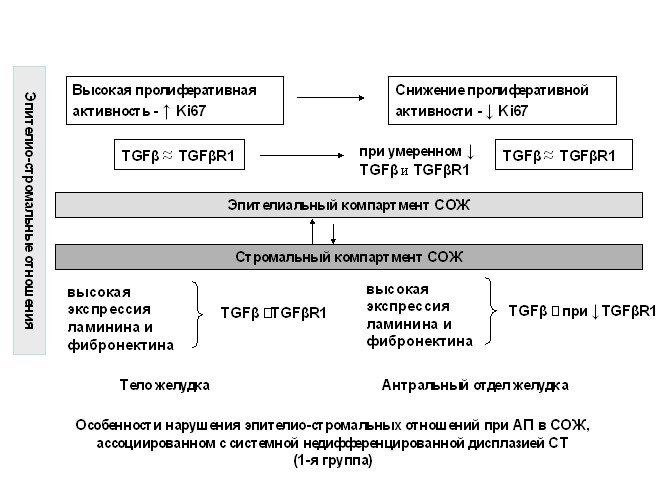
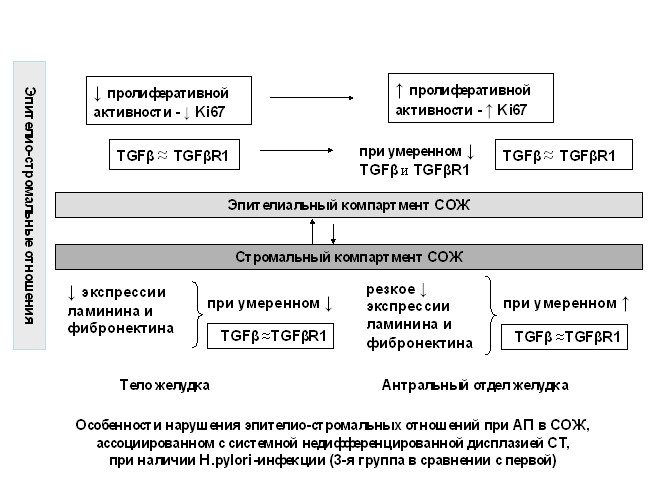
Рис. 7. Возможные механизмы нарушения эпителио-стромальных отношений при атрофическом процессе в слизистой оболочке желудка, ассоциированном с системной недифференцированной дисплазией соединительной ткани при отсутствии и наличии H. pylori-инфекции
ВЫВОДЫ
- Феномен атрофии СОЖ при системной недифференцированной дисплазии соединительной ткани характеризуется высокой частотой системности проявлений атрофического процесса, ассоциирующейся с выраженностью ДСТ (р1-3<0,001); сопутствующих эндокринопатий с преобладанием патологии щитовидной железы (р1-3<0,05) и дисфункции половых желез (р1-2<0,05, р3-4<0,05). К особенностям его клинических проявлений относятся – высокая частота астено-вегетативного синдрома (р1-2<0,05) с эпизодами снижения массы тела (р1-3<0,05), преобладание дистензионных болей (р1-2<0,05, р1-3<0,001) и нарушений функционального состояния желудка (недостаточность кардии - р1-2<0,01, р3-4<0,05); дуоденогастральный рефлюкс, гипотония, грыжи пищеводного отверстия диафрагмы – выявлены только в основных группах.
- Структурно феномен атрофии СОЖ при системной недифференцированной дисплазии соединительной ткани ассоциируется с характерной тканевой организацией слизистой оболочки (уменьшение плотности и неравномерность залегания желез, тенденция к их мукоидизации и кистозной трансформации, увеличение плотности сосудов), которая подтверждается данными морфометрии - увеличение железистого и снижение сосудистого индексов (в обоих случаях р1-2<0,05); уменьшение численной плотности и относительной поверхностной площади желез, с противоположно направленными изменениями соответствующих показателей для сосудов (во всех случаях р1-2<0,05) и может свидетельствовать о дисплазии СОЖ, формирующейся, вероятно, как в эмбрио-, так и постнатальном онтогенезе.
- Феномен атрофии СОЖ при системной недифференцированной дисплазии соединительной ткани ассоциируется с иным, в отличие от групп сравнения, состоянием ЭЦМ, выражающимся в высокой экспрессии основных молекул адгезивного комплекса – фибронектина и ламинина в слизистой оболочке обоих отделов желудка (р1-2<0,05, р3-4<0,05) со снижением экспрессии в антральном отделе при инфицировании Н. pylori (в 3-й группе).
- Атрофический процесс во всех рассматриваемых группах сопровождается выраженным дисбалансом в системе TGF-TGFR1: в стромальном компартменте СОЖ это тенденция к снижению TGFR1 в обоих отделах желудка (при высокой экспрессии TGF), более выраженная в антруме. Экспрессия TGF в железистом компартменте СОЖ при дисплазии соединительной ткани без сопутствующей Н. pylori-инфекции выше, чем в соответствующей группе сравнения (р1-2<0,05), и ассоциируется с более высоким уровнем фибронектина и ламинина. Установленным особенностям экспрессии адгезивных молекул и дисбаланса в системе TGF-TGFR1 при атрофии СОЖ, ассоциированной с системной дисплазией соединительной ткани, соответствует статистически значимо высокий уровень пролиферативной активности эпителиоцитов СОЖ в сопоставлении с соответствующей группой сравнения.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Обнаружение феномена атрофии СОЖ особенно у пациентов молодого возраста требует обратить внимание на наличие фенотипических и/или висцеральных признаков системной ДСТ, обусловливающей особенности проявлений гастрита, его пато- и морфогенеза, особенности сопутствующих заболеваний, в частности, наличие аутоиммунного тиреоидита, дисфункции половых желез и др., что в значительной степени определит характер патогенетической терапии.
2. При диагностике атрофии СОЖ у пациентов с ДСТ необходимо учитывать особенности этого феномена (выраженная тенденция к мукоидазации и кистозной трансформации главных желез желудка) и его возможные патогенетические механизмы, обусловленные состоянием ЭЦМ и нарушениями эпителио-стромальных отношений. Так, учитывая морфогенетический эффект париетальных клеток и, вероятно, их недостаток в связи с отмеченной перестройкой желез, нельзя исключить риск прогрессирования тканевой дисплазии при назначении ингибиторов протонной помпы, которые входят в схемы эрадикации H. pylori в случаях инфицирования. В то же время, особенно при наличии H. pylori-инфекции, лечение должно предусматривать стабилизацию экстрацеллюлярного матрикса, в частности, назначение препаратов магния, стабилизирующих матриксные металлопротеиназы и деградацию ЭЦМ через активацию TGFR.
Список работ, опубликованных по теме диссертации
Статьи в ведущих рецензируемых журналах, определенных ВАК
- Шевчишина О.Ф. Отдельные аспекты структурных проявлений ассоциированного с дисплазией соединительной ткани атрофического процесса в слизистой оболочке желудка / Л.А. Наумова, О.Ф. Шевчишина, А.Ю. Дятлова // Кубанский научный медицинский вестник. – 2009. – № 6(111). – С. 60–62.
- Шевчишина О.Ф. Атрофия слизистой оболочки желудка у пациентов с недифференцированной соединительнотканной дисплазией / О.Ф. Шевчишина // Вестник РГМУ. – 2010. – Специальный выпуск, № 2. – С. 101–102.
- Саблина О.Ф. Особенности клинических и структурных проявлений атрофического процесса в слизистой оболочке желудка при дисплазии соединительной ткани / Л.А. Наумова, О.Ф. Саблина, Е.Е. Чичагова // Вестник Новгородского Государственного Университета имени Ярослава Мудрого. Серия «Медицинские науки». – 2011. – № 66. – С. 83–87.
- Саблина О.Ф. Клинико-морфогенетические варианты атрофического поражения слизистой оболочки желудка / Л.А. Наумова, С.В. Пушкарев, Е.Е. Чичагова // Сибирский медицинский журнал. – 2011. – Т. 26. - №4. – С. 84–89.
Статьи в сборниках и научных журналах, не входящих в список ВАК
- Шевчишина О.Ф. Клинико-морфологические особенности атрофического гастрита у пациентов с дисплазией соединительной ткани / О.Ф. Шевчишина, Л.А. Наумова // ХI Региональная конференция молодых ученых, специалистов и студентов «Актуальные проблемы теоретической, экспериментальной и клинической медицины»: Сб. Докладов. – Ханты-Мансийск, 2009. – С. 47–49.
- Шевчишина О.Ф. Особенности структурных проявлений ассоциированного с дисплазией соединительной ткани атрофического процесса в слизистой оболочке желудка / О.Ф. Шевчишина // III Международный молодежный медицинский конгресс «Санкт-Петербургские научные чтения – 2009»: Сб. Тезисов докладов. – Санкт-Петербург, 2009. – С. 198.
- Шевчишина О.Ф. Клинико-морфологические особенности атрофического поражения слизистой оболочки желудка при дисплазии соединительной ткани / О.Ф. Шевчишина, А.Л Кострубин, Л.А. Наумова // Материалы международной научно-практической конференции, посвященной 15-летию медицинского образования в ГОУ ВПО «Сургутский государственный университет ХМАО-Югры» «Фундаментальные и клинические аспекты охраны здоровья человека на Севере». – Сургут, 2010. – С. 506–508.
- Саблина О.Ф. Клинико-морфологические особенности «атрофического поражения» слизистой оболочки желудка при дисплазии соединительной ткани / Л.А. Наумова, О.Ф. Саблина // IV Всероссийская научно-практическая конференция «Актуальные вопросы внутренней патологии. Дисплазия соединительной ткани»: Сб. тезисов. – Омск, 2011. – С. 38–39.
СПИСОК СОКРАЩЕНИЙ
| АП | – атрофический процесс |
| ГПДЗ | – гепато-панкреато-дуоденальная зона |
| ДСТ | – дисплазия соединительной ткани |
| ЖЭ | – железистый эпителий |
| ИГХ | – иммуногистохимия |
| ИМ | – индекс метки |
| ПОД | – пищеводное отверстие диафрагмы |
| ПЯЭ | – покровно-ямочный эпителий |
| СО | – слизистая оболочка |
| СОЖ | – слизистая оболочка желудка |
| СТ | – соединительная ткань |
| ХАГ | – хронический атрофический гастрит |
| ЦК | – цитокины |
| ЭГДС | – эзофагогастродуоденоскопия |
| ЭКГ | – электрокардиография |
| ЭЦМ | – экстрацелллюлярный матрикс |
| H. pylori, Нр (в таблицах) – Helicobacter pylori | |
| Ki-67 | – ядерный протеин, экспрессируемый в различные фазы клеточного цикла |
| TGF | – Transforming Growth Factor beta (трансформирующий фактор роста бета) |
| TGFR1 | – Receptor 1 to Transforming Growth Factor beta (рецептор первого типа к трансформирующему фактору роста бета) |

