Клинико-функциональные, патоморфологические и молекулярные особенности тяжелой терапевтически резистентной бронхиальной астмы
На правах рукописи
СЕЛИВАНОВА
Полина Александровна
КЛИНИКО-ФУНКЦИОНАЛЬНЫЕ, ПАТОМОРФОЛОГИЧЕСКИЕ И МОЛЕКУЛЯРНЫЕ ОСОБЕННОСТИ ТЯЖЕЛОЙ ТЕРАПЕВТИЧЕСКИ РЕЗИСТЕНТНОЙ БРОНХИАЛЬНОЙ АСТМЫ
14.00.43 - пульмонология
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Томск - 2009
Работа выполнена в ГОУ ВПО Сибирский государственный медицинский университет Росздрава
| Научный руководитель: доктор медицинских наук, профессор, заслуженный деятель науки РФ, член-корреспондент РАМН | Огородова Людмила Михайловна |
| Научный консультант: Кандидат биологических наук | Фрейдин Максим Борисович |
| Официальные оппоненты: Доктор медицинских наук, профессор Кандидат медицинских наук, доцент | Бодрова Тамара Николаевна Агеева Татьяна Сергеевна |
| Ведущая организация: ГОУ ВПО Новосибирский государственный медицинский университет Росздрава | |
Защита состоится «____»__________ 2009 г. в ____00 часов на заседании диссертационного совета Д 208.096.02 при Сибирском государственном медицинском университете по адресу: 634050, г. Томск, Московский тракт, 2.
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета
Автореферат разослан «____»___________ 2009 г.
Ученый секретарь диссертационного совета Тюкалова Л.И.
Введение
Актуальность работы
Согласно данным Всемирной Организации Здравоохранения количество больных, страдающих бронхиальной астмой (БА), оценивается в 300 миллионов человек, распространенность астмы среди взрослого населения составляет от 1 до 18% в различных регионах (Burney P., 2008; Masoli M., 2004). В России этот показатель колеблется от 4 до 6% (Балаганская М.А., 2008; Федосеев Г.Б., 2003; Чучалин А.Г., 1999). Несмотря на значительные достижения в диагностике и лечении астмы, внедрение в практику согласительных документов по БА (GINA, 2006 и др.), заболеваемость и смертность продолжают сохраняться на высоком уровне, особенно в случае тяжелой астмы.
Тяжелая БА является значимой медико-социальной проблемой, составляя в общей структуре заболевания 15-20% (Holgate S.T., 2003; Чучалин А.Г., Огородова Л.М. 2004). Тяжелая БА ассоциирована с высоким риском смерти, частыми жизнеугрожающими обострениями болезни, высоким уровнем инвалидизации, резким снижением качества жизни таких пациентов. Именно на долю тяжелой астмы приходится 80% всех затрат, связанных с БА, сюда входят как прямые затраты на медикаментозное обеспечение, оказание дорогостоящей экстренной помощи, так и непрямые затраты в связи с длительными периодами нетрудоспособности пациентов (Чучалин А.Г., 1997; Ленская Л.Г., 2000; Медников Б.Л., 1998).
По результатам проведенных в последние годы эпидемиологических исследований (AIRE, AIRCEE, AIA, НАБАТ) контроль над заболеванием регистрируется лишь у 5-20% больных, что связано в первую очередь с неадекватным степени тяжести лечением. Однако у части больных формируется терапевтически резистентная астма, характеризующаяся сохранением симптомов болезни, несмотря на применение высоких доз базисных препаратов (Holgate S.T., 2006; Chung K.F., 1999; Barnes P.J., 1998). В литературе активно обсуждаются возможные причины, приводящие к терапевтической резистентности (персистенция эозинофильного воспаления, ремоделирование бронхов, формирование вторичной кортикостероидной резистентности, наследственная предрасположенность) (Wenzel S.E., 2006; Vignola A.M., 1999; Chetta A., 1997), но часто не принимается во внимание клиническая и патогенетическая гетерогенность терапевтически резистентной астмы. Так, на сегодняшний день выделяют три клинических фенотипа тяжелой неконтролируемой астмы (фатальная астма, фенотип «brittle» и «астма с фиксированной обструкцией») (Holgate S., 1999), продемонстрированы и патогенетические различия этих клинических фенотипов (Кобякова О.С., 2005). Однако отсутствуют данные о морфологических и молекулярных особенностях, лежащих в основе клинической гетерогенности тяжелой астмы.
Таким образом, изучение патоморфологических и молекулярных характеристик тяжелой неконтролируемой астмы представляет значительный научный и практический интерес с точки зрения их вклада в формирование терапевтической резистентности и разработки оптимальных патогенетически обоснованных терапевтических стратегий.
Цель: установить клинико-функциональные, патоморфологические и молекулярные особенности тяжелой терапевтически резистентной бронхиальной астмы (фенотипов «brittle» и «астма с фиксированной обструкцией») для разработки мероприятий патогенетически обоснованной терапии.
Задачи:
- Оценить особенности формирования, поло-возрастные, клинические и функциональные характеристики у больных тяжелой терапевтически резистентной астмой фенотипов «brittle» и «астма с фиксированной обструкцией» в различные периоды болезни. Дать сравнительный анализ параметров функции внешнего дыхания и бронхиальной гиперреактивности у пациентов с изучаемыми фенотипами тяжелой БА.
- Представить характеристику цитологического состава бронхиальных смывов, морфометрических и цитологических параметров бронхиальных биоптатов у больных тяжелой терапевтически резистентной БА фенотипов «brittle» и «астма с фиксированной обструкцией» в сравнении со среднетяжелой БА. Оценить вклад эффекторных клеток воспаления и явлений ремоделирования в формирование клинических фенотипов тяжелой терапевтически резистентной астмы.
- Оценить экспрессию генов воспаления и бронхоконстрикции (CHRM3, H1R, ADRB2) в бронхиальных биоптатах пациентов с изучаемыми фенотипами тяжелой БА в сравнении со среднетяжелой астмой и проанализировать их вклад в клинико-функциональные и патоморфологические особенности фенотипов «brittle» и «астма с фиксированной обструкцией» тяжелой терапевтически резистентной БА.
- Исследовать динамику клинико-функциональных, патоморфологических и молекулярных показателей на фоне использования базисной ингаляционной терапии в дозах, соответствующих степени тяжести заболевания (у пациентов с тяжелой БА фенотипа «астма с фиксированной обструкцией» и среднетяжелой БА).
Научная новизна. Впервые проведена комплексная оценка патоморфологических (цитологический состав бронхиальных смывов, морфометрия и плотность клеточного инфильтрата в слизистой оболочке бронхов) и молекулярных (уровень экспрессии генов рецепторов воспаления и бронхоконстрикции - М3-холинорецептора, 2-адренорецептора, Н1-рецептора гистамина в бронхиальных биоптатах, полученных при фибробронхоскопии) показателей у пациентов с фенотипами «brittle» и «астма с фиксированной обструкцией» тяжелой терапевтически резистентной астмы. Доказано, что в основе клинико-функциональных различий изучаемых фенотипов лежат выявленные патоморфологические и молекулярные особенности.
Приоритетными являются результаты, полученные методом дискриминантного анализа, показавшие, что наибольший вклад в формирование различий между обследованными группами вносят плотность нейтрофилов и высота эпителиального пласта в бронхиальных биоптатах, а также уровень экспрессии генов М3-холинорецептора и 2-адренорецептора.
Установлены взаимосвязи между основными показателями ремоделирования тканей (толщина базальной мембраны, высота эпителиального пласта и относительный объем соединительной ткани) и такими клинико-функциональными характеристиками, как тяжесть, стаж БА, ОФВ1. Приоритетными являются данные о наличии положительных корреляций между плотностью в слизистой оболочке бронхов таких эффекторных клеток, как макрофаги и эозинофилы и показателем суточной лабильности бронхов.
Впервые выявлено, что плотность гистио-макрофагальных элементов в слизистой оболочке бронхов ассоциирована с уровнем экспрессии гена М3-холинорецептора, а плотность эозинофилов – с экспрессией Н1-рецептора гистамина. Это служит подтверждением тесной взаимосвязи между морфологическими и молекулярными особенностями фенотипов БА и основными клинико-функциональными характеристиками заболевания.
Получены приоритетные данные с использованием цитологических, морфометрических и молекулярных методов об отсутствии динамики патоморфологических и молекулярных показателей у больных с тяжелой терапевтически резистентной БА фенотипа «астма с фиксированной обструкцией» на фоне применения адекватных степени тяжести доз базисной ингаляционной терапии. Это реализуется в невозможность достижения критериев полного контроля и подтверждает базисный вклад выявленных патоморфологических и молекулярных изменений в формирование болезни и феномена терапевтической резистентности. Установлено, что на фоне использования базисной противовоспалительной терапии в группе среднетяжелых больных отмечается положительная динамика патоморфологических и молекулярных параметров, что приводит к достижению контроля над заболеванием.
Практическая значимость. Проведенное комплексное изучение клинико-функциональных, патоморфологических и молекулярных особенностей тяжелой терапевтически резистентной астмы позволяет обосновать наличие разных клинико-патогенетических фенотипов тяжелой терапевтически резистентной БА. Установлено, что «brittle» фенотип тяжелой астмы характеризуется преобладанием гистио-макрофагальных элементов и эозинофилов в составе инфильтрата слизистой оболочки бронхов, тогда как фенотип «астма с фиксированной обструкцией» отличается нейтрофильным паттерном воспаления и выраженными явлениями ремоделирования бронхов, что позволяет рассматривать изученные патоморфологические характеристики в качестве дополнительных критериев диагностики фенотипов заболевания.
Патогенетически важные для фенотипов тяжелой терапевтически резистентной БА патоморфологические и молекулярные особенности, выявленные в исследовании, представляют большой практический интерес в качестве потенциальных молекулярных мишеней для разработки индивидуальных режимов противовоспалительной терапии бронхиальной астмы.
Положения, выносимые на защиту:
- Клинические фенотипы «brittle» и «астма с фиксированной обструкцией» тяжелой терапевтически резистентной бронхиальной астмы характеризуются значительными различиями по клинико-функциональным параметрам болезни, в основе которых лежат патоморфологические особенности каждого фенотипа. Фенотип «brittle» тяжелой астмы ассоциирован с гистио-макрофагальной инфильтрацией и эозинофильным типом воспаления. Фенотип «астма с фиксированной обструкцией» характеризуется преобладанием нейтрофилов и выраженными явлениями ремоделирования.
- Тяжелая терапевтически резистентная астма ассоциирована с увеличением экспрессии в бронхиальных биоптатах генов М3-холинорецептора и 2-адренорецептора, в сравнении со среднетяжелыми больными. Отличительной особенностью «brittle» фенотипа тяжелой БА на молекулярном уровне является существенное увеличение уровня экспрессии генов М3-холинорецептора и Н1-рецептора гистамина, в сравнении как со среднетяжелой астмой, так и с фенотипом «астма с фиксированной обструкцией» и меньшая экспрессия гена 2-адренорецептора в сравнении с фенотипом «астма с фиксированной обструкцией». Фенотип тяжелой терапевтически резистентной БА «астма с фиксированной обструкцией» характеризуется максимальным уровнем экспрессии гена 2-адренорецептора и статистически значимо меньшим уровнем экспрессии М3-холинорецептора в сравнении с «brittle» фенотипом.
- У больных тяжелой терапевтически резистентной астмой фенотипа «астма с фиксированной обструкцией» на фоне проводимой терапии отсутствует динамика патоморфологических параметров и уровня экспрессии изучаемых генов, не удается достичь критериев контроля астмы. При среднетяжелой астме положительная динамика патоморфологических и молекулярных параметров на фоне использования базисной ингаляционной противовоспалительной терапии приводит к достижению контроля над заболеванием.
Апробация работы. Материалы диссертации доложены и обсуждены на VII международном конгрессе молодых учёных и специалистов «Науки о человеке» (Томск, 2006), VIII международном конгрессе молодых учёных и специалистов «Науки о человеке» (Томск, 2007), XII Национальном конгрессе «Человек и лекарство» (Москва, 2007), VIII международном конгрессе «Здоровье и образование в XXI веке; концепции болезней цивилизации» (Москва, 2007), XVIII национальном конгрессе по болезням органов дыхания (Екатеринбург, 2008), заседании областного научно-практического общества аллергологов-иммунологов (Томск, 2005), совещании кафедры госпитальной терапии с курсом физической реабилитации и спортивной медицины СибГМУ (Томск, 2008).
Внедрение результатов исследований. Полученные результаты используются в работе отделения пульмонологии ОГУЗ «Томская областная клиническая больница». Материалы проведенных исследований используются в учебном процессе на кафедре госпитальной терапии с курсом физической реабилитации и спортивной медицины ГОУ ВПО СибГМУ Росздрава для студентов лечебного факультета, учебном процессе кафедры госпитальной терапии БУ ВПО «Ханты-Мансийского государственного медицинского института», учебном процессе кафедры аллергологии и пульмонологии ГОУ ДПО «Иркутский государственный институт усовершенствования врачей» Росздрава.
Публикации. По теме диссертации опубликованы 12 работ, в том числе 2 полнотекстовые журнальные статьи в изданиях, рекомендованных ВАК РФ.
Объем и структура диссертации. Работа изложена на 169 страницах машинописного текста, состоит из введения, обзора литературы, материалов и методов исследования, глав собственных наблюдений (главы 3-5), обсуждения и выводов, списка литературы. Работа иллюстрирована 31 рисунком и 19 таблицами. Список источников цитируемой литературы включает в себя 229 работ, из которых 25 отечественных и 204 зарубежных авторов.
Материалы и методы исследования
Клинические группы
Согласно поставленным целям было обследовано 56 пациентов в возрасте от 18 до 65 лет, 29 из которых имели диагноз тяжелой персистирующей БА (10 пациентов с «brittle» фенотипом тяжелой БА, 19 – с фенотипом «астма с фиксированной обструкцией»), 27 - персистирующей астмы средней степени тяжести (группа сравнения). Работа выполнена на базе кафедры госпитальной терапии с курсом физической реабилитации и спортивной медицины ГОУ ВПО СибГМУ Росздрава (зав. каф.- д-р мед. наук, профессор Г.Э. Черногорюк), отделения пульмонологии ОГУЗ «Томская областная клиническая больница» (гл. врач – Б.Т. Серых), отделения пульмонологии МЛПУ «Городская больница №3» (гл. врач – М.А. Лукашов), кафедры внутренних болезней педиатрического факультета ГОУ ВПО СибГМУ Росздрава (зав. каф.- д-р мед. наук, профессор Л.И. Волкова). Молекулярные методы исследования проводились на базе ГУ НИИ медицинской генетики ТНЦ СО РАМН (директор – д-р мед. наук, профессор, академик РАМН В.П. Пузырев). Функциональные методы исследования выполнены в лаборатории функциональной диагностики кафедры факультетской педиатрии с курсом детских болезней лечебного факультета ГОУ ВПО СибГМУ Росздрава (зав. каф. - д-р мед. наук, профессор, член-корр. РАМН Л.М. Огородова). Исследование выполнено на базе протокола, одобренного локальным комитетом по этике ГОУ ВПО СибГМУ Росздрава г. Томска (заключение №383 от 31.01.2006).
Критерии включения пациентов с бронхиальной астмой
- Ранее подтверждённый диагноз БА (не менее 1 года).
- Возраст от 18 до 65 лет.
- Для тяжелой БА:
- Наличие у больного «brittle» фенотипа БА, подтвержденного медицинскими документами (диагноз лабильной астмы должен быть подтвержден не ранее чем за 1 год до включения больного в исследование): наличие суточной вариабельности уровня ПСВ с амплитудой >40% в течение более 50% времени за 5-ти месячный период, на фоне максимально интенсивного лечения с применением высоких доз ингаляционных стероидов (прием беклометазона в суточной дозе >1,5 мг/сут или будесонида >1,0 мг/сут или флютиказона пропионата (ФП) >0,75 мг/сут), частых ингаляций бронхолитиков;
- Наличие у больного фенотипа «астма с фиксированной обструкцией»: постоянная персистенция симптомов БА, низкие показатели функции внешнего дыхания (ФВД) (ОФВ1<60% от должного, ПСВ<60% от должного), с или без эпизодов внезапного ухудшения, требующие системной терапии ГКС (в дозах 5-20 мг/сут по преднизолону, в течение не менее 1 года), которая приводит к неполному ответу;
- Для среднетяжелой неконтролируемой астмы: на фоне базисной терапии в дозах 500-750 мкг/сут по бекламетазону (ступень 3 по GINA 2006) симптомы соответствуют легкой персистирующей БА.
- Отсутствие острых респираторных заболеваний в течение последних 4-х недель перед исследованием.
- Умение правильно пользоваться ингалятором, пикфлоуметром, способность адекватно оценивать своё состояние.
Методы исследования
Клинико-анамнестические методы. Диагностика БА, оценка степени тяжести, уровень контроля над БА, а также оценка клинической эффективности противовоспалительной терапии определялись согласно критериям документа GINA, 2006 г. (табл. 1) путем объективного осмотра, ежедневного мониторирования симптомов, потребности в бронхолитиках.
Исследование вентиляционной функции легких. Оценка функциональных тестов, уровня бронхиальной гиперреакивности к гистамину проведена у всех пациентов, включённых в исследование на оборудовании MasterScope фирмы Erich Jaeger GMBH (условия проведения теста ATS Standardization of Spirometry, 1995). Пиковая скорость выдоха измерялась пикфлоуметрами Mini-Wright в утренние и вечерние часы до приёма любых лекарственных препаратов.
Цитоморфологические методы. С целью получения бронхиальных смывов (БС) и биоптатов всем пациентам проводилась БФС по стандартной методике (Robinson D.S., 1998) гибким фиброскопом (BF1T20, Olympus Corporation) в условиях эндоскопического кабинета. Процедура БС осуществлялась через тубус бронхоскопа путем введения 30-40 мл стерильного изотонического раствора NaCl, подогретого до 37°С, с немедленной аспирацией в специальный силиконизированный контейнер (Полосухин В.В., 1995). Биоптаты получали со слизистой оболочки среднедолевого бронха методом щипковой биопсии, в количестве двух фрагментов.
Таблица 1
Уровни контроля астмы (GINA, 2006)
| Характеристики | Контролируемая БА (все критерии из нижеприведенных) | Частично контролируемая БА (какая-либо из характеристик, присутствующая в любую неделю) | Неконтролируемая БА |
| Дневные симптомы | Нет (дважды или менее в неделю) | Более 2-х в неделю | Три и более признака частично контролируемой астмы, присутствующие в любую неделю |
| Ограничение активности | Нет | Любые | |
| Ночные симптомы/про-буждения | Нет | Любые | |
| Потребность в использовании 2-агонистов короткого действия в качестве средства скорой помощи | Нет (дважды или менее в неделю) | Более 2-х в неделю | |
| Функция легких (ПСВ или ОФВ1) | Норма | <80% от должного или персонального лучшего значения | |
| Обострения | Нет | Одно и более в год | Одно в какую-либо из недель |
Обработка БС включала центрифугирование и приготовление мазков из полученного осадка. Цитологическое исследование окрашенных препаратов проводилось при увеличении 1500 на светооптическом микроскопе, подсчитывалось не менее 300 клеток и определялось процентное содержание каждого типа клеток с последующим пересчетом на абсолютное значение.
Материал бронхобиоптатов фиксировался в 10% забуференном формалине. После стандартной проводки и заливки готовились срезы толщиной 5-7 мкм с последующей окраской гематоксилином и эозином (Лили Р., 1969). Под малым увеличением (х 200) проводилась обзорная микроскопия слизистой оболочки бронхов. При морфометрическом исследовании методом точечного счета сеткой Автандилова оценивалась объемная плотность покровного эпителия и отдельных клеток (мм3/мм3), относительный объем соединительной ткани и желез (%). С помощью окуляр-микрометра измерялась высота покровного эпителия, толщина базальной мембраны (мкм). Подсчет плотности различных клеточных популяций в 1 мм2 собственной пластинки слизистой оболочки проводился в графическом редакторе Adobe PhotoShop 7.0.
Молекулярные методы (выполнены на базе ГУ НИИ медицинской генетики ТНЦ СО РАМН). Образцы ткани бронха для молекулярного исследования сразу после забора помещались в эппендорфы и замораживались в жидком азоте при температуре -196 оС, где они хранились вплоть до момента выделения РНК. Выделение РНК производилось методом кисло-фенольной экстракции с помощью реактива Три-реагент (Molecular Research Center Inc., США). Далее выполнялась постановка реакции обратной транскрипции с целью накопления кДНК (комплект для обратной транскрипции РНК «Реверта», ООО «Амплисенс» ФГУН ЦНИИЭ Роспотребнадзора). Синтезированную кДНК в дальнейшем использовали для постановки полимеразной цепной реакции. Генотипирование генов ADRB2, H1R, CHRM3, GAPDH осуществляли с помощью ПЦР в реальном времени, используя коммерческие наборы, разработанные и произведенные в ООО «Биосан», г. Новосибирск. Определение уровня экспрессии проводили путем сравнения пороговых уровней флюоресценции маркерного гена и гена глицеральдегид-3-фосфат дегидрогеназы (GAPDH), уровень экспрессии которого принимался за 100%.
Статистическая обработка результатов. Статистическую обработку полученных результатов проводили при помощи пакета программ “Statistica for Windows 6.0”. Данные представлены в виде X±х, где Х – среднее арифметическое, х – ошибка среднего. Для оценки различия средних в попарно не связанных выборках применяли U-критерий Манна-Уитни, в связанных – критерий Вилкоксона. Для сравнения показателей в трех несвязанных группах проводили дисперсионный анализ ANOVA Крускала-Уоллиса. Степень взаимосвязи между признаками оценивали, вычисляя коэффициент ранговой корреляции Спирмена. Проводился многофакторный дисперсионный анализ изучаемых параметров. Разницу значений считали значимой при р<0,05. Данные группировались в соответствии с задачами исследования (Гланц С., 1999; Реброва О.Ю., 2002).
Результаты и их обсуждение
1. Клинко-функциональная характеристика больных, включенных в исследование.
Средний возраст обследованных пациентов составил 46,77±1,76 лет, статистически значимые различия по возрасту обнаружены только между группами пациентов со среднетяжелой и тяжелой БА фенотипа “астма с фиксированной обструкцией» (p<0,05). Стаж заболевания также различался у этих двух групп пациентов. Средний возраст манифестации болезни составил 34,86±1,99 лет, статистически значимых различий между группами не обнаружено, однако, среди пациентов с «brittle» астмой чаще встречались лица с так называемой early-onset БА (возникшей в возрасте до 12 лет), фенотип «brittle» сформировался к 18-20 годам. Исходная клинико-функциональная характеристика пациентов представлена в таблице 2.
Пациенты с тяжелой терапевтически резистентной астмой имели исходно статистически значимо более частые и выраженные дневные и ночные симптомы астмы. Основные показатели ФВД (ОФВ1, ПСВ, СЛБ) также статистически значимо отличались в группах среднетяжелых и тяжелых больных. Пациенты с тяжелой терапевтически резистентной БА фенотипа «brittle» характеризовались исключительно атопической формой заболевания, высокой среднесуточной лабильностью бронхов. Больные тяжелой БА фенотипа «астма с фиксированной обструкцией» отличались низким индексом атопии, монотонностью показателей функции легких.
Таблица 2
Сравнительная клинико-функциональная характеристика обследованных групп пациентов с диагнозом БА (X±x)
| Показатели | Больные БА | ||
| Среднетяжелые (n=27) | Тяжелые, фенотип «brittle» (n=10) | Тяжелые, фенотип «астма с фиксированной обструкцией» (n=19) | |
| Средний возраст, лет | 42,67±2,47 | 43,40±5,22 | 54,37±1,88* |
| Стаж заболевания, лет | 8,15±1,34 | 15,50±3,57 | 13,89±2,35* |
| Средний возраст манифестации болезни, лет | 34,51±2,85 | 27,10±5,99 | 39,42±2,57 |
| Дневные симптомы, баллы# | 1,53±0,15 | 3,72±0,40* | 3,69±0,11* |
| Ночные симптомы, баллы# | 0,12±0,01 | 2,06±0,25* | 2,61±0,20* |
| Потребность в бронхолитиках, доз/сут | 0,96±0,12 | 5,88±1,12* | 8,28±0,94*,** |
| Обострения, число случаев в год | 2,28±0,35 | 3,60±0,46* | 6,50±1,33*,** |
| Утренние значения ПСВ, % | 77,75±1,76 | 64,83±6,41* | 54,61±2,07* |
| ОФВ1, % | 74,54±1,82 | 55,06±4,33* | 60,34±2,79* |
| СЛБ, % | 20,12±1,12 | 45,82±1,22* | 8,28±0,94*,** |
| ПК 20 мг/мл## | 3,34±0,73 | 0,24±0,19* | -## |
| IgE МЕ/мл | 272,68±53,00 | 309,60±34,90 | 107,34±24,68*,** |
Примечание: # – оценка по шкале симптомов;
##– тест выполнялся только пациентам с исходным уровнем ОФВ170% от должного;
* – p<0,05 по сравнению с показателями группы среднетяжелых пациентов;
** – p<0,05 по сравнению с показателями группы тяжелой БА фенотипа «brittle».
Таким образом, установлено, что клинические фенотипы тяжелой терапевтически резистентной БА различаются по клинико-функциональным параметрам, при этом максимальный вклад в различия между группами вносят показатели бронхиальной реактивности.
2. Патоморфологическая характеристика фенотипов тяжелой терапевтически резистентной БА.
Обзор исследований БА с использованием бронхоскопических методик (бронхоальвеолярный лаваж, биопсия) продемонстрировал ряд различий в морфологической картине воспаления бронхов в случае разнородности клинических фенотипов заболевания. S.E. Wenzel и соавт. (1997) обнаружили, что в случае тяжелого персистирующего течения астмы преобладает нейтрофильная инфильтрация воздухоносных путей. У пациентов с преобладанием ночных симптомов было установлено значительное увеличение количества эозинофилов в тканях, полученных при трансбронхиальной биопсии в 4 часа утра (Martin R. J., 1996; Kraft M., 1998). Вероятно, в основе фенотипов БА лежат различные воспалительные реакции с преобладанием тех или иных эффекторных клеток, однако комплексные исследования патоморфологических характеристик терапевтически резистентной астмы с учетом ее клинической гетерогенности отсутствуют.
С целью определения морфологических особенностей клинических фенотипов тяжелой БА в данной работе проведена оценка клеточного состава БС, морфометрических и цитологических параметров биоптатов слизистой оболочки бронха больных тяжелой терапевтически резистентной БА фенотипов «brittle» и «астма с фиксированной обструкцией» в сравнении со среднетяжелой астмой.
При анализе полученных морфометрических данных установлено, что структурные изменения слизистой оболочки бронхов у больных тяжелой БА, независимо от фенотипа, носят преимущественно атрофический характер и выражаются в уменьшении толщины эпителиального пласта, снижении объемной плотности покровного эпителия, уменьшении относительного объема желез. Одновременно выявлен фиброз собственной пластинки, что проявлялось в увеличении относительного объема соединительной ткани, а также в утолщении базальной мембраны (табл. 3). Для больных «brittle» БА характерна гиперплазия гладкомышечных клеток в собственной пластинке слизистой оболочки.
Статистически значимые различия между фенотипами тяжелой БА выявлены по высоте эпителиального пласта и толщине базальной мембраны.
Таблица 3
Показатели морфометрии у больных среднетяжелой и тяжелой БА (X±x)
| Исследуемые параметры | Тяжесть БА | ||
| Среднетяжелая (n=22) | Тяжелая, фенотип «brittle» (n=9) | Тяжелая, фенотип «астма с фиксированной обструкцией» (n=14) | |
| Объемная плотность всего покровного эпителия, мм3/ мм3 | 0,26±0,01 | 0,12±0,01* | 0,16±0,02* |
| Объемная плотность реснитчатых эпителиоцитов, мм3/ мм3 | 0,12±0,01 | 0,05±0,002* | 0,07±0,01* |
| Объемная плотность бокаловидных эпителиоцитов, мм3/ мм3 | 0,08±0,004 | 0,02±0,002* | 0,04±0,01* |
| Объемная плотность базальных эпителиоцитов, мм3/ мм3 | 0,06±0,005 | 0,05±0,01 | 0,05±0,01 |
| Относительный объем желез, % | 66,30±2,48 | 32,16±2,63* | 26,76±5,56* |
| Относительный объем соед. ткани, % | 34,58±2,25 | 68,12±2,67* | 60,18±5,03* |
| Высота эпителиального пласта, мкм | 63,30±2,80 | 56,31±4,23 | 24,31±3,46*, ** |
| Толщина базальной мембраны, мкм | 8,47±0,64 | 18,77±2,74* | 25,69±5,37*, ** |
Примечание:*–р0,01 по сравнению с показателями группы среднетяжелой БА;
** – р<0,05 по сравнению с группой тяжелой БА, фенотип «brittle».
Известно, что уменьшение толщины покровного эпителия в бронхиальных путях существенно снижает его защитные свойства, облегчая проникновение аллергенов (Абросимов В.Н., 1994; Vrugt B., 1993). Морфологическим подтверждением такой антигенной стимуляции является высокий уровень лимфоцитов и гистио-макрофагальных элементов в слизистой оболочке бронхов, имеющий место у больных с «brittle» БА. Значимость снижения толщины эпителиального пласта слизистой оболочки бронхов в патогенезе персистенции симптомов у тяжелых больных подтверждают выявленные в ходе работы корреляционные связи. Отрицательная корреляция обнаружена между тяжестью заболевания, частотой дневных и ночных симптомов и высотой эпителиального пласта (r=-0,57; p=0,001), и положительная – между объемной плотностью покровного (r=0,67; p=0,0002), реснитчатого (r=0,67; p=0,0002) и бокаловидного эпителия (r=0,57; p=0,002) и уровнем ПК20 в тесте с гистамином.
При сравнении клеточного состава инфильтрата слизистой оболочки бронхов обнаружено преобладание эозинофилов и нейтрофилов при БА средней степени тяжести, тогда как в случае «brittle» БА превалировали гистио-макрофагальные элементы, а при тяжелой БА фенотипа «астма с фиксированной обструкцией» выявлено значительное число нейтрофилов (рис. 1).

Рис. 1. Характеристика клеточного состава инфильтрата в слизистой оболочке бронхов у больных среднетяжелой и тяжелой (фенотипы «brittle» и «астма с фиксированной обструкцией») БА.
Примечание: * - р<0,05 по сравнению с группой среднетяжелой БА;
# - р<0,05 по сравнению с группой тяжелой БА, фенотип «brittle»;
Г-М - гистио-макрофагальные элементы;
Л – лимфоциты;
НФ – нейтрофилы;
Э – эозинофилы.
На сегодняшний день нет единого мнения о преобладании какого-либо типа эффекторных клеток в воспалительном инфильтрате, особенно в случае тяжелой БА. В проведенном исследовании наибольшее количество нейтрофилов (79,42±9,26 в 1 мм2), инфильтрирующих слизистую оболочку бронха, выявлено у пациентов с тяжелой БА фенотипа «астма с фиксированной обструкцией», именно в этом случае можно говорить о нейтрофильном паттерне воспаления. Необходимо отметить, что все эти пациенты получали в качестве базисной терапии БА системные кортикостероиды, для которых показан эффект подавления апоптотической гибели нейтрофилов у больных с БА (Cox G., 1995; Nguyen L.T., 2005).
В случае «brittle» БА отмечена относительно высокая плотность эозинофилов в слизистой бронхов (15,35±2,13 в 1 мм2) в сравнении с БА фенотипа «астма с фиксированной обструкцией» (p=0,003), что позволяет характеризовать данное воспаление как эозинофильное. Полученные данные соответствуют результатам S.E. Wenzel с соавт. (1999 г.), которые в группе больных с тяжелой БА, не разделяя их на клинические фенотипы, выделили два морфологических подтипа, характеризующихся различным паттерном воспаления в слизистой бронха: при эозинофильном фенотипе количество эозинофилов, инфильтрирующих стенку бронха, составляет от 16 до 31 клетки в 1 мм2 (медиана = 20), при нейтрофильном – количество нейтрофилов – 39-273 клетки в 1 мм2 (медиана = 65), число эозинофилов – 0-2 клетки в 1 мм2.
Результаты дискриминантного анализа свидетельствуют о достоверном различии патоморфологических характеристик для отдельных фенотипов тяжелой БА и среднетяжелых больных, что подтверждает их значимый вклад в формирование фенотипической гетерогенности пациентов (табл. 4, рис. 2).
Таблица 4
Результаты дискриминантного анализа патоморфологических характеристик при сравнении групп больных среднетяжелой и тяжелой терапевтически резистентной астмой
| Показатели | Среднетяжелая БА | Тяжелая БА, фенотип «brittle» | Тяжелая БА, фенотип «астма с фиксированной обструкцией» |
| Число больных | 22 | 9 | 14 |
| Правильная классификация, % | 100 | 100 | 93 |
| Включенные в уравнение ЛДФ характеристики ФВД, Уилкса и уровень значимости | Плотность нейтрофилов, кл. в 1мм2; =0,04; p<0,001 | ||
| Высота эпителиального пласта, мкм; =0,05; p<0,0001 | |||
| Характеристики уравнения ЛДФ | =0,29; F=12,63; р<0,0001 | ||
Примечание: ЛДФ – линейная дискриминантная функция.
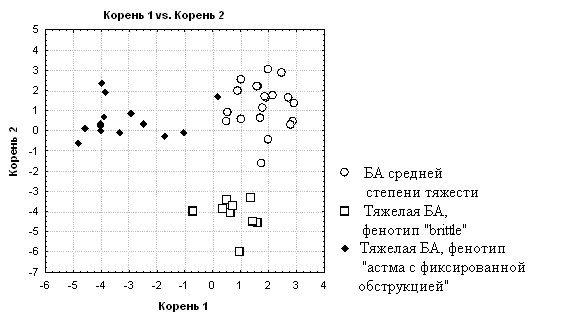
Рис. 2. Рассеяние значений дискриминантной функции при сравнении групп больных с тяжелой БА фенотипы «brittle» и «астма с фиксированной обструкцией» и среднетяжелой астмой по изучаемым патоморфологическим характеристикам.
Изменение клеточного состава БС у обследованных групп больных в целом отражает клеточный паттерн воспаления в слизистой оболочке бронхов. Так, у пациентов с тяжелой БА фенотипа «астма с фиксированной обструкцией» преобладающими клетками БС являются нейтрофилы (0,73±0,05106 в 1 мл), в группе среднетяжелых больных – наряду с клетками бронхиального эпителия, одинаково часто встречались эозинофилы (0,47±0,06106 в 1мл) и нейтрофилы (0,46±0,11106 в 1мл). Для пациентов с «brittle» фенотипом тяжелой астмы характерно меньшее абсолютное количество клеток (1,73±0,10106 в 1 мл) в связи с более низким содержанием лимфоцитов, эозинофилов и эпителиальных клеток.
Таким образом, основной патоморфологической характеристикой «brittle» фенотипа БА является персистирующее воспаление в ответ на постоянную стимуляцию аллергенами, проявляющееся в высокой плотности гистио-макрофагальных элементов, лимфоцитов и эозинофилов, что подтверждает важный вклад активно персистирующего воспаления в манифестное течение заболевания у этой группы больных.
У пациентов с тяжелой БА фенотипа «астма с фиксированной обструкцией» воспаление носит качественно иной характер, что отражается в клинико-функциональных параметрах болезни. Так, преобладание нейтрофилов ассоциировано с выделением ферментов, обладающих деструктивным и ремоделирущим действием на ткани (Cundall M., 2003; Simpson J.L., 2005; Pepe C., 2005), что приводит к необратимым структурным изменениям ткани бронхов, имеющим крайнюю степень выраженности у этой группы больных, и может быть реализовано в наблюдаемый у них феномен фиксированной обструкции.
3. Особенности экспрессии генов воспаления и бронхоконстрикции у больных тяжелой терапевтически резистентной БА.
Изучаемые клинические фенотипы тяжелой астмы значительно различаются по показателям гиперреактивности бронхов. Одним из факторов, принимающих участие в формировании феномена БГР, является нарушение нейрогенного контроля тонуса гладких мышц бронхов больных БА (Barnes P.J., 1999; Smith H., 2002). В рамках настоящей работы проведен анализ экспрессии генов, задействованных в воспалении и механизмах бронхоконстрикции (ген М3-холинорецептора, ген 2-адренорецептора, ген H1-рецептора гистамина), в образцах ткани бронхов больных со среднетяжелой БА и тяжелой терапевтически резистентной БА фенотипов «brittle» и «астма с фиксированной обструкцией».
Исходная характеристика уровня мРНК исследуемых генов представлена в табл. 5.
Таблица 5
Исходные показатели экспрессии генов в бронхиальных биоптатах у больных среднетяжелой и тяжелой БА
| Исследуемые параметры | Тяжесть БА | ||
| Среднетяжелая (n=16) | Тяжелая, фенотип «brittle» (n=10) | Тяжелая, фенотип «астма с фиксированной обструкцией» (n=14) | |
| мРНК CHRM3, % | 45,76±1,76 | 57,17±0,94* | 50,54±1,61*,** |
| мРНК ADRB2, % | 28,92±1,31 | 51,70±0,56* | 71,41±2,43*,** |
| мРНК H1R, % | 34,36±0,59 | 38,82±1,26* | 34,65±0,98** |
Примечание: *–р0,05 по сравнению с показателями группы среднетяжелой БА;
** – р0,05 по сравнению с группой тяжелой БА, фенотип «brittle».
Максимальное повышение уровня экспрессии гена M3-холинорецептора наблюдалось в группе пациентов тяжелой БА с «brittle» фенотипом как в сравнении со среднетяжелыми больными (p=0,0002), так и с группой тяжелой БА фенотипа «астма с фиксированной обструкцией» (p=0,008). Уровень мРНК H1-рецептора гистамина статистически значимо повышен в группе больных БА с «brittle» фенотипом, как в сравнении со среднетяжелыми пациентами (p=0,005), так с пациентами с фенотипом «астма с фиксированной обструкцией» (p=0,03). Установлена положительная корреляционная связь между уровнем экспрессии H1R и CHRM3 и СЛБ (r=0,67; p=0,002 и r=0,86; p=0,0006, соответственно).
Известно, что рецепторы гистамина активно экспрессируют клетки воспаления (лимфоциты, эозинофилы), поэтому повышение уровня экспрессии H1R у больных с «brittle» БА может быть следствием активно протекающего аллергического воспаления в слизистой оболочке бронхов. Это отражается в положительной корреляционной взаимосвязи между уровнем мРНК H1R и плотностью эозинофилов в слизистой оболочке бронхов в группе пациентов с «brittle» БА (r=0,92; p=0,002).
В ряде работ установлено, что М3-холинорецептор активно экспрессируется макрофагами, опосредуя их хемотаксис (Mita Y., 1996; Sato E., 1998). По результатам проведенного исследования, количество макрофагов, инфильтрирующих слизистую оболочку бронхов, максимально у больных «brittle» БА; у пациентов с фенотипом «астма с фиксированной обструкцией» инфильтрация гистио-макрофагальными элементами слизистой оболочки выше по сравнению со среднетяжелой астмой, но ниже этого показателя у больных «brittle» БА. Это согласуется с установленным уровнем экспрессии М3-холинорецептора и подтверждено корреляцией между количеством макрофагов и уровнем экспрессии CHRM3 (r=0,41; p=0,043).
Активность гена ADRB2 достоверно различалась во всех трех группах, наибольший уровень отмечен в группе больных тяжелой БА фенотипа «астма с фиксированной обструкцией» (p<0,0001, в сравнении со среднетяжелой БА), у пациентов с «brittle» БА показатель уровня мРНК гена 2-адренорецептора был достоверно выше, чем в группе среднетяжелой БА (p=0,00002), однако ниже уровня пациентов с фенотипом «астма с фиксированной обструкцией» (p=0,00003). Это может быть объяснено с позиции влияния проводимой терапии. Так, по данным литературы, ГКС способны повышать экспрессию гена ADRB2 через инактивацию транскрипционного NF-kB (Szefler S. J., 1997; Nelson H. S., 2003), возможно, именно это оказывает влияние на полученные результаты, так как пациенты группы БА фенотипа «астма с фиксированной обструкцией» исходно получали в качестве базисной терапии системные стероиды.
При оценке значимости вклада уровня экспрессии изучаемых генов в формирование различий между группами больных со среднетяжелой и фенотипами тяжелой БА установлено, что наибольший вклад вносят активность гена 2-адренорецептора и M3-холинорецептора (рис. 3, табл. 6).
Таблица 6
Результаты дискриминантного анализа уровня мРНК генов воспаления и бронхоконстрикции при сравнении групп больных среднетяжелой и тяжелой терапевтически резистентной астмой
| Показатели | Среднетяжелая БА | Тяжелая БА, фенотип «brittle» | Тяжелая БА, фенотип «астма с фиксированной обструкцией» |
| Число больных | 16 | 10 | 14 |
| Правильная классификация, % | 100 | 100 | 85 |
| Включенные в уравнение ЛДФ показатели экспрессии генов бронхоконстрикции, Уилкса и уровень значимости | мРНК ADRB2, %; 0,43; р<0,0001 | ||
| мРНК CHRM3, %; =0,06; р=0,03 | |||
| Характеристики уравнения ЛДФ | =0,039; F=22,82; р<0,0001 | ||
Примечание: ЛДФ – линейная дискриминантная функция.
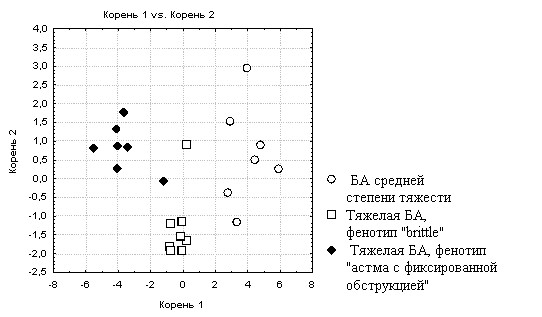
Рис. 3. Рассеяние значений дискриминантной функции при сравнении групп больных с тяжелой БА фенотипов «brittle» и «астма с фиксированной обструкцией» и среднетяжелой астмой по показателям уровня экспрессии генов рецепторов воспаления и бронхоконстрикции.
Таким образом, у пациентов с тяжелой терапевтически резистентной астмой с фенотипами «brittle» и «астма с фиксированной обструкцией» выявлены различия в уровне экспрессии генов, вовлеченных в воспалительный и бронхоконстрикторный ответ (CHRM3, H1R, ADRB2).
4. Динамика клинико-функциональных, патоморфологических и молекулярных показателей на фоне использования базисной противовоспалительной терапии у пациентов с различной степенью тяжести БА.
В ходе проведенной работы всем пациентам назначена базисная ингаляционная терапия в дозах, соответствующих степени тяжести заболевания (рис. 4).
Эффективность назначаемой базисной терапии оценивали на основании клинико-функциональных и патоморфологических критериев. Клиническую оценку эффективности выполняли с учетом соответствия пациента критериям контроля GINA, 2006 (табл. 1).

Рис. 4. Дизайн исследования пациентов с БА различной степени тяжести.
На фоне проводимой противовоспалительной терапии отмечена положительная динамика клинико-функциональных показателей во всех группах обследуемых пациентов (табл. 7).
Таблица 7
Клинико-функциональная характеристика больных с различной степенью тяжести БА при использовании адекватной базисной терапии
| Показатель | Больные БА (n=56) | |||||
| Средней степени тяжести (n=27) | Тяжелой БА, фенотип «brittle» (n=10) | Тяжелой БА, фенотип «астма с фиксированной обструкцией» (n=19) | ||||
| Исходно | После лечения | Исходно | После лечения | Исходно | После лечения | |
| Дневные симптомы, баллы | 1,53±0,15 | 0,72±0,12* | 3,72±0,40 | 1,11±0,44* | 3,69±0,11 | 1,78±0,25* |
| Ночные симптомы, баллы | 0,12±0,01 | 0,04±0,00* | 2,06±0,25 | 0,25±0,14* | 2,61±0,20 | 0,57±0,14* |
| Потребность в 2-агонистах (количество ингаляций/сутки) | 0,96±0,12 | 0,02±0,01* | 5,88±1,12 | 2,43±0,90* | 8,28±0,94 | 2,34±0,78* |
| ОФВ1, % от должного | 74,54±1,82 | 80,12±1,66* | 55,06±4,33 | 74,50±3,18* | 60,39±2,79 | 73,55±2,28* |
| ПСВ, % от должного | 77,75±1,76 | 84,36±1,95* | 64,83±6,41 | 77,49±4,00* | 54,61±2,07 | 73,22±2,28* |
| СЛБ, % | 20,12±1,12 | 10,48±0,72* | 45,82±1,22 | 41,16±1,06* | 8,28±0,94 | 8,34±0,59 |
| ПК20 в тесте с гистамином (мг/мл)# | 3,34±0,73 | 6,66±1,33* | 0,24±0,19 | 1,18±0,46* | # | 2,66±0,42 |
Примечание: * - p<0,05 по сравнению с исходными показателями;
# - тест выполнялся только пациентам с исходным уровнем ОФВ170% от должного.
В группе больных БА средней степени тяжести по окончании лечебного периода критериев полного и частичного контроля по GINA 2006 достигли все обследованные пациенты. Параллельно с восстановлением клинико-функциональных показателей наблюдали достоверные изменения морфологической картины воспаления в слизистой оболочке бронхов (табл. 8, рис. 5).
Таблица 8
Динамика морфометрических показателей больных среднетяжелой БА на фоне базисной терапии, соответствующей степени тяжести
| Исследуемые параметры | Больные БА средней степени тяжести (n=12) | |
| Исходно | На фоне адекватной базисной терапии | |
| Объемная плотность всего покровного эпителия, мм3/ мм3 | 0,26±0,01 | 0,34±0,03* |
| Объемная плотность реснитчатых эпителиоцитов, мм3/ мм3 | 0,12±0,01 | 0,17±0,01* |
| Объемная плотность бокаловидных эпителиоцитов, мм3/ мм3 | 0,08±0,004 | 0,07±0,01 |
| Объемная плотность базальных эпителиоцитов, мм3/ мм3 | 0,06±0,005 | 0,09±0,01* |
| Относительный объем желез, % | 66,30±2,48 | 64,17±3,35 |
| Относительный объем соед. ткани, % | 34,58±2,25 | 33,79±2,79 |
| Высота эпителиального пласта, мкм | 63,30±2,80 | 53,00±3,65* |
| Толщина базальной мембраны, мкм | 8,47±0,64 | 10,25±0,58 |
Примечание: * - p<0,05 по сравнению с исходными показателями.

Рис. 5. Динамика клеточного состава инфильтрата в слизистой оболочке бронхов у больных БА средней степени тяжести на фоне адекватной базисной терапии.
Примечание: * - p<0,05 по сравнению с исходными значениями.
Восстановление клинико-функциональных и патоморфологических параметров сочеталось со снижением уровня экспрессии генов М3-холинорецептора и Н1-рецептора гистамина и повышением уровня экспрессии гена 2-адренорецептора (табл. 9), что может быть отражением эффективного подавления воспаления в тканях бронхов у этих пациентов.
Таблица 9
Динамика экспрессии генов в бронхиальных биоптатах у больных среднетяжелой и тяжелой БА на фоне адекватной степени тяжести ингаляционной терапии (X±x)
| Исследуемые параметры | Больные БА | |||
| Среднетяжелые (n=10) | Тяжелые, фенотип «астма с фиксированной обструкцией» (n=14) | |||
| До лечения | После лечения | До лечения | После лечения | |
| мРНК CHRM3, % | 46,58±3,19 | 41,77±2,62* | 50,54±1,61 | 49,72±1,20 |
| мРНК ADRB2, % | 24,91±0,90 | 30,29±1,47* | 71,41±2,43 | 59,21±6,41 |
| мРНК H1R, % | 33,06±0,97 | 29,75±1,75* | 34,65±0,98 | 34,37±0,96 |
Примечание: * - p<0,05 по сравнению с исходными показателями.
Указанные на рисунке 6 и изученные в данной работе рецепторы задействованы в воспалительном и бронхоконстрикторном ответе, что отражает тесную взаимосвязь между клинико-функциональными, морфологическими и молекулярными особенностями фенотипов тяжелой терапевтически резистентной астмы.






Рис. 6. Локализация и биологические эффекты изучаемых рецепторов.
Известно, что Н1-рецепторы гистамина локализованы, помимо гладких миоцитов бронхов, на лимфоцитах, участвуя в их дифференцировке по Th2 пути, и эозинофилах, опосредуя их хемотаксис в очаг воспаления. М3-холинорецептор экспрессируется тучными клетками, макрофагами, стимулирует секрецию ими медиаторов воспаления, провоспалительных цитокинов, хемоаттрактантов. М3-холинорецептор представлен также на эффекторных клетках – эозинофилах и нейтрофилах, обеспечивая хемотаксис и накопление их в очаге воспаления. Локализованный на эпителиальных клетках подслизистых желез бронха, М3-холинорецептор способствует усилению продукции слизи.
2-адренорецептор, не только участвует в расслаблении гладких мышц бронхов, но и экспрессируется провоспалительными клетками – лимфоцитами, тучными, макрофагами, эозинофилами, нейтрофилами, оказывая при стимуляции противовоспалительное действие – блокирует выброс медиаторов, выработку провоспалительных цитокинов и приводит к синтезу противовоспалительных цитокинов.
Концепция работы
В процессе выполнения исследования показан дифференцированный вклад экспрессии генов в развитие фенотипов терапевтически резистентной БА, как доказательство биологически закрепленных механизмов клинического полиморфизма тяжелой неконтролируемой БА.
Персистенция аллергического воспаления - базисный механизм «brittle» фенотипа тяжелой терапевтически резистентной астмы, что обосновано высокой активностью экспрессии генов М3-холинорецептора, Н1-рецептора гистамина, 2-адренорецептора в слизистой бронхиальной стенки больных «brittle» БА. Уровень мРНК М3-холинорецептора, Н1-рецептора гистамина был значительно выше у пациентов с «brittle» астмой, в сравнении с фенотипом «астма с фиксированной обструкцией», что характеризовалось высокой суточной лабильностью бронхов и патоморфологическими особенностями – высокой плотностью лимфоцитов, макрофагов и эозинофилов, выявленных у данной группы больных.
Тяжелая БА фенотипа «астма с фиксированной обструкцией» отличается нейтрофильным паттерном воспаления, значительными явлениями ремоделирования бронхов, что приводит к необратимым структурным изменениям у этой группы больных и реализуется в феномен фиксированной бронхообструкции. Установленная статистически значимо более высокая экспрессия гена 2-адренорецептора в этой группе больных, вероятно, обусловлена влиянием терапии системными стероидами.
Предположительно, высокий уровень экспрессии 2-адренорецептора, выявленный в группе пациентов с тяжелой терапевтически резистентной БА и не приводящий к ожидаемым противовоспалительным и бронходилатационным эффектам, может быть следствием синтеза функционально неполноценной формы рецептора (Audet M., 2008; McGraw D.W., 2005), однако это требует дальнейшего изучения.
Терапевтическая резистентность пациентов доказана отсутствием контроля над заболеванием в ответ на назначение высоких доз базисной противовоспалительной ингаляционной терапии, а также отсутствием динамики патоморфологических и молекулярных параметров у пациентов с тяжелой астмой фенотипа «астма с фиксированной обструкцией», что подтверждает базисный вклад этих изменений в формирование терапевтической резистентности.
Таким образом, клинический полиморфизм тяжелой терапевтически резистентной астмы подтвержден новыми фундаментальными данными, раскрывающими дифференцированный вклад морфологических и молекулярных механизмов воспаления и бронхоконстрикции.
ВЫВОДЫ
- Тяжелая терапевтически резистентная бронхиальная астма фенотипов «brittle» и «астма с фиксированной обструкцией» характеризуется значительными различиями по клинико-функциональным, патогенетическим, морфологическим и молекулярным параметрам болезни: «brittle» фенотип характеризуется обязательным наличием атопии, ранним началом заболевания (у 30% пациентов астма развивалась в возрасте до 12 лет), высокой среднесуточной лабильностью бронхов; фенотип «астма с фиксированной обструкцией» отличается низким индексом атопии (больший удельный вес эндогенной астмы, существенно более низкие значения сывороточного IgE), монотонностью показателей функции легких (пониженные показатели среднесуточной лабильности бронхов).
- В бронхиальных смывах пациентов с «brittle» фенотипом БА снижен общий цитоз за счет более низкого содержания лимфоцитов, эозинофилов и эпителиальных клеток по сравнению со среднетяжелой астмой. В бронхиальных смывах больных с фенотипом «астма с фиксированной обструкцией» преобладают нейтрофилы.
- У больных «brittle» фенотипом тяжелой БА в составе клеточного инфильтрата слизистой оболочки бронхов преобладают гистио-макрофагальные элементы, лимфоциты и эозинофилы, в случае фенотипа «астма с фиксированной обструкцией» – нейтрофилы.
- В слизистой оболочке бронхов пациентов с тяжелой терапевтически резистентной БА в сравнении со среднетяжелыми больными выражены явления ремоделирования (уменьшение объемной плотности и высоты покровного эпителия, реснитчатых и бокаловидных эпителиоцитов, снижение относительного объема желез, значительное увеличение толщины базальной мембраны и относительного объема соединительной ткани). Фенотип «астма с фиксированной обструкцией» отличается от «brittle» БА более выраженным утолщением базальной мембраны и снижением высоты эпителиального пласта.
- Повышена экспрессия ряда генов воспаления и бронхоконстрикции (CHRM3 и ADRB2) у пациентов с тяжелой БА по сравнению с группой среднетяжелых больных; «brittle» фенотип тяжелой БА характеризуется увеличением активности генов CHRM3 и H1R в сравнении со среднетяжелой БА и фенотипом тяжелой БА «астма с фиксированной обструкцией», и меньшей активностью гена ADRB2 по сравнению с фенотипом «астма с фиксированной обструкцией».
- Плотность гистио-макрофагальных элементов статистически значимо взаимосвязана с экспрессией CHRM3, плотность эозинофилов в слизистой бронхиальной стенки – с экспрессией гена H1R.
- Пациенты среднетяжелой БА на фоне применения базисной терапии, в дозах соответствующих степени тяжести, достигли критериев контроля, что ассоциировано с достоверными изменениями морфологической картины воспаления в слизистой оболочке бронхов, а также снижением экспрессии генов CHRM3 и H1R, и увеличением уровня экспрессии ADRB2 в бронхиальных биоптатах.
- Установлено улучшение клинико-функциональных показателей у больных с тяжелой БА на фоне применения адекватных степени тяжести доз базисной терапии, но критерии полного контроля достигнуты не были: у пациентов с «brittle» фенотипом частичный контроль достигнут у 30% пациентов, при этом сохранялся высокий уровень гиперреактивности бронхов по показателям ПК20 в тесте с гистамином и СЛБ; назначение адекватной степени тяжести базисной терапии у пациентов с фенотипом «астма с фиксированной обструкцией» не сопровождалось динамикой патоморфологических показателей и статистически значимыми изменениями экспрессии изучаемых генов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Для индивидуализации режимов базисной противовоспалительной терапии у пациентов с терапевтически резистентной бронхиальной астмой принципиально важным является тщательная диагностика фенотипов терапевтически резистентной бронхиальной астмы.
- Пациентам с терапевтически резистентной бронхиальной астмой фенотипов «brittle» и «астма с фиксированной обструкцией» с целью контроля воспаления в дыхательных путях и снижения его вклада в терапевтическую резистентность, рекомендовано использовать долговременную базисную терапию в стабильно высоких дозах в течение как минимум 6 месяцев. Конечной целью лечения должно быть достижение максимально возможного контроля тяжелой астмы.
Перечень работ, опубликованных по теме диссертации
- Особенности течения тяжелой неконтролируемой бронхиальной астмы в сочетании с гастроэзофагеальной рефлюксной болезнью / О.С. Кобякова, У.В. Рудык, Г.Э. Черногорюк, П.А. Селиванова // Сибирский журнал гастроэнтерологии и гепатологии. – 2005. – №19. – С. 40-43.
- Костная прочность у больных бронхиальной астмой по данным ультразвуковой остеометрии / О.П. Зоркальцева, В.Д. Завадовская, О.С. Кобякова, О.Ю. Килина, П.А. Селиванова и др. // Материалы IV региональной конференции, посвященной 50-летию кафедры лучевой диагностики и Лучевой терапии ГОУ ВПО СибГМУ Росздрава. – Томск.– 2006. – С. 301-306.
- Изменение биологических маркеров атопического воспаления на фоне базисной терапии бронхиальной астмы у детей / Д.В. Козырицкая, Е.В. Деева, Е.А. Старовойтова, П.А. Селиванова // Материалы Российского национального конгресса «Человек и лекарство». – Москва. – 2007. – С. 703.
- Геренг, Е.А. Морфологическая характеристика бронхобиоптатов у больных различными фенотипами тяжелой бронхиальной астмы / Е.А. Геренг, П.А. Селиванова // Научные труды VIII международного конгресса «Здоровье и образование в XXI веке; концепции болезней цивилизации». – Москва. – 2007. – С. 195-196.
- Геренг, Е.А. Морфофункциональная характеристика слизистой оболочки бронхов у больных различными формами тяжелой бронхиальной астмой / Е.А. Геренг, П.А. Селиванова // Сибирский консилиум. – 2007. – №7(62). – С. 30-31.
- Селиванова, П.А. Особенности морфологической картины различных фенотипов тяжелой бронхиальной астмы / П.А. Селиванова, Е.А. Геренг, Е.С. Куликов // Материалы VIII конгресса молодых ученых и специалистов «Науки о Человеке». – Томск. – 2007. – С. 22-24.
- Оценка влияния вентиляционных нарушений на костную прочность при бронхиальной астме по данным ультразвуковой остеометрии / О.П. Зоркальцева, В.Д. Завадовская, О.С. Кобякова, В.М. Шевелев, О.Ю. Килина, П.А. Селиванова и др. // Материалы Невского радиологического форума «Новые горизонты». - Санкт-Петербург. – 2007. – С.139-140.
- Показатели костной прочности у больных бронхиальной астмой с наличием и различным стажем базисной терапии / О.П. Зоркальцева, О.С. Кобякова, В.Д. Завадовская, Д.В. Капитанова, П.А. Селиванова // Сборник трудов Томской областной клинической больницы. – Томск. – 2007. – выпуск 14. – С. 60-64.
- Огородова, Л.М. GINA 2006: контроль астмы как основная цель лечения и критерий эффективности терапии / Л.М. Огородова, И.А. Деев, П.А. Селиванова // Пульмонология. – 2007. – №6. – С. 98-103.
- Клеточный состав бронхиальных смывов у больных тяжелой бронхиальной астмой / Е.А. Геренг, И.В. Суходоло, Р.И. Плешко, П.А. Селиванова // Морфология (Материалы докладов IX конгресса МАМ). – 2008. – №2. – С. 31.
- Патоморфологическая характеристика нестабильной бронхиальной астмы (фенотип brittle) / Л.М. Огородова, П.А. Селиванова, Е.А. Геренг и др. // Терапевтический архив. – 2008. – №3. – С. 39-43.
- Геренг, Е.А. Тканевые изменения слизистой оболочки бронхов при лечении больных тяжелой бронхиальной астмой / Е.А. Геренг, Е.В. Константинова, П.А. Селиванова //Материалы XI межрегиональной научно-практической конференции «Актуальные проблемы медицины». – Абакан. – 2008. – С. 41-43.
Условные сокращения
БА – бронхиальная астма
БГР – бронхиальная гиперреактивность
БС – бронхиальный смыв
БФС – бронхофиброскопия
ГКС – глюкокортикостероиды
ДНК – дезоксирибонуклеиновая кислота
мРНК – матричная рибонуклеиновая кислота
ОФВ1 - объем форсированного выдоха за 1 секунду
ПК20 - предельная концентрация гистамина, вызывающая падение ОФВ1 на 20%
ПСВ – пиковая скорость выдоха
ПЦР – полимеразная цепная реакция
СЛБ – среднесуточная лабильность бронхов
ФВД – функция внешнего дыхания
ФП – флутиказона пропионат
ФЖЕЛ – форсированная жизненная емкость легких
ADRB2 – ген 2-адренорецептора
CHRM3 – ген М3-холинорецептора
GINA – Global Initiative for Asthma
H1R – ген H1-рецептора гистамина
IgE – иммуноглобулин класса Е

