Роль сопутствующих заболеваний при тяжелой неконтролируемой бронхиальной астме
На правах рукописи
Рудык Ульяна Валерьевна
Роль сопутствующих заболеваний при тяжелой неконтролируемой бронхиальной астме
14.00.43. – пульмонология
автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Томск – 2006
Работа выполнена в ГОУ ВПО Сибирский государственный медицинский университет Росздрава
Научный руководитель:
доктор медицинских наук Кобякова
Ольга Сергеевна
Официальные оппоненты:
доктор медицинских наук, профессор Волкова
Людмила Ивановна
кандидат медицинских наук Плеханова
Елена Владимировна
Ведущая организация:
ГОУ ВПО Алтайский государственный медицинский университет Росздрава
Защита состоится “___” _________ 2006г. в “____” часов на заседании диссертационного совета Д 208.096.02 при Сибирском государственном медицинском университете по адресу: 634050, г. Томск, Московсий тракт 2.
С диссертацией можно ознакомиться в научно - медицинской библиотеке Сибирского государственного медицинского университета (634050, г. Томск, пр. Ленина 107).
Автореферат разослан “___”_________ 2006 года.
Ученый секретарь
диссертационного совета Тюкалова Л.И.
ВВЕДЕНИЕ
Актуальность работы
В последние годы в России под эгидой общества пульмонологов проведены современные эпидемиологические исследования, методология которых была построена на рекомендациях Европейского респираторного общества. Основываясь на этих доверительных данных, установлено, что бронхиальная астма (БА) так же актуальна в России, как и других странах Европы. Общее число больных астмой в стране приближается к 7 миллионам человек, из числа которых около 1 миллиона имеют тяжелые неконтролируемые формы болезни [Чучалин А.Г., 2004; Черняк Б.А., 1999; Биличенко Т.Н., 2001].
В настоящее время исследователей во всем мире в большей степени занимает проблема контроля над БА [Bateman E. D., 2001; Nelson H.S., 1998]. В этом плане определенным прорывом были опубликованные в 2004 году результаты международного рандомизированного клинического исследования GOAL, в котором принимали участие 3 421 больных [Bateman E. D., 2002; Clark T. J. H., 2002]. В ходе исследования GOAL у большинства больных был достигнут хороший контроль над БА и у меньшего числа больных – полный контроль. Доказано, что при более длительной терапии стабильными дозами ингаляционных кортикостероидов возможно достижение полного контроля у пациентов и достигнутый уровень контроля можно эффективно поддерживать в течение длительного времени.
В современной литературе собственно обсуждаются причины отсутствия контроля астмы при верифицированном диагнозе в достаточной степени условно разделены на экзогенные и эндогенные. Экзогенные (внешние) причины отсутствия контроля над симптомами болезни доминируют в структуре неконтролируемой БА.
В настоящее время внимание исследователей привлекает изучение роли сопутствующей патологии, в частности, заболеваний верхних дыхательных путей, желудочно-кишечного тракта (ЖКТ), патологии щитовидной железы, в качестве причины неконтролируемого течения заболевания [Чучалин А.Г., 2000;. Crit J., 1999; Barnes P. J., 1998.].
Выявлено, что аллергический ринит нередко представляет сопряженную с астмой проблему [Ревякина В.А., 2002; Емельянов А.В., 2001]. Аллергический ринит часто предшествует БА или развивается одновременно с ней у 59 – 89 % пациентов всех возрастных групп. При этом степень влияния данной нозологии на уровень контроля над астмой в настоящее время не определена.
Сочетание БА и гастроэзофагеальной рефлюксной болезни (ГЭРБ) встречается весьма часто. По данным различных авторов, распространенность рефлюкс-эзофагита среди пациентов с БА варьирует от 30 до 90% [Goodall R.J.R., 2001; Gustafsson P. M., 1998]. Гастроэзофагеальный рефлюкс является потенциальным триггером БА [Harper P.С., 1997; Field S. K., 1999].
В отношении хронического описторхоза, анализируя недавние публикации [Озерецковская Н.Н., 2000], можно отметить что, несмотря на изучение тонких механизмов иммунной регуляции при развитии аллергических реакций и гельминтозов, до настоящего времени вопрос об их взаимоотношении остается дискутабельным.
Данные литературы в отношении взаимосвязи аутоиммунного тиреоидита и БА достаточно противоречивы. Ведется исследовательский поиск взаимосвязи между дисфункцией щитовидной железы и отсутствием контроля над БА [Ландышев Ю. С., 1997; Ласкин Г. М., 1996; Joe Anderson C., 1996; Luong K. V., 2000; Jerez F.R., Plaza V., 1999].
Таким образом, с достаточной долей вероятности установлено, что определенные заболевания оказывают существенное влияние на течение БА. Вместе с тем, в настоящее время в доступной литературе отсутствуют сведения, позволяющие оценить степень влияния отдельных сопутствующих заболеваний на контроль астмы, а также не проанализирована возможность достижения контроля над астмой на фоне адекватной терапии указанных заболеваний в проекции критериев, разработанных в рамках программы GOAL.
Все вышеперечисленное определяет необходимость изучения роли сопутствующей патологии, как фактора, ухудшающего контроль над БА.
Цель исследования
Установить роль сопутствующих заболеваний (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит) в качестве причины отсутствия контроля у пациентов с тяжелой неконтролируемой бронхиальной астмой для разработки мероприятий третичной профилактики заболевания.
Задачи исследования
1. Проанализировать степень влияния сопутствующих заболеваний (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит) на уровень контроля над бронхиальной астмой.
2. Оценить возможность достижения контроля над тяжелой бронхиальной астмой путем коррекции сопутствующей патологии (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит).
3. Разработать клинические рекомендации по ведению больных с тяжелой неконтролируемой бронхиальной астмой, страдающих сопутствующей патологией (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит).
4. Дать характеристику маркеров аллергического воспаления у пациентов с тяжелой неконтролируемой бронхиальной астмой, в сочетании с сопутствующей патологией (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит).
Научная новизна
В результате выполнения настоящей диссертационной работы получены новые сведения, касающиеся значимости сопутствующей патологии (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит) в качестве одной из причин формирования неконтролируемого течения БА.
Впервые проведен анализ влияния отдельных сопутствующих заболеваний (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит) на уровень контроля тяжелой неконтролируемой БА согласно критериям программы GOAL.
Доказано, что у пациентов с тяжелой неконтролируемой БА, страдающих сопутствующей патологией, возможно достижение контроля над заболеванием согласно критериям программы GOAL путем медикаментозной коррекции сопутствующих заболеваний. Однако возможность достижения контроля в значительной степени зависит от нозологической принадлежности сопутствующих заболеваний.
Результаты исследования показали, что аллергический ринит и гастроэзофагеальная рефлюксная болезнь играют важную роль в отсутствии контроля над бронхиальной астмой.
Доказано, что у подавляющего большинства пациентов с тяжелой неконтролируемой БА, страдающих аллергическим ринитом и гастроэзофагеальной рефлюксной болезнью, возможно достижение критериев полного контроля регламентируемых программой GOAL, благодаря адекватной коррекции сопутствующей патологии (в 80% и 90% случаях соответственно).
Впервые отмечена достоверная редукция маркеров воспаления (эозинофилы индуцированной мокроты, назальные эозинофилы, интерлейкин - 4 (ИЛ – 4) индуцированной мокроты, ИЛ – 4 сыворотки крови, ИЛ – 5 индуцированной мокроты, ИЛ – 5 сыворотки крови) на фоне терапии, как аллергического ринита, так и гастроэзофагеальной рефлюксной болезни, что сопоставимо с результатами клинико-функциональных параметров у пациентов указанных групп.
Неудовлетворительные результаты в плане достижения контроля над БА получены в группах больных тяжелой неконтролируемой астмой, в сочетании с хроническим описторхозом и аутоиммунным тиреоидитом. Несмотря на проведение дегельминтизации у пациентов, страдающих хроническим описторхозом, не удалось достичь критериев “полного контроля” согласно программе GOAL у 85% участников исследования. У большинства пациентов (80%) с тяжелой неконтролируемой БА, страдающих аутоиммунным тиреоидитом, не удалось достичь критериев “полного контроля” по окончанию 12 недель исследования.
Практическая значимость
Результаты проведенного исследования показали, что тактически важным является обследование больных, страдающих тяжелой неконтролируемой БА, на предмет наличия сопутствующих заболеваний, с целью выяснения причин отсутствия контроля заболевания.
В рамках проведенного исследования доказана возможность достижения “полного контроля” у пациентов с тяжелой неконтролируемой БА в сочетании с аллергическим ринитом и ГЭРБ.
Полученные сведения легли в основу разработки клинических рекомендаций по ведению пациентов с тяжелой неконтролируемой формой заболевания, страдающих аллергическим ринитом и ГЭРБ.
Внедрение настоящих клинических рекомендаций позволит существенным образом снизить влияние неконтролируемой бронхиальной астмы на общество в целом и значительно повысить качество жизни отдельного пациента.
Положения, выносимые на защиту:
- Сопутствующие заболевания вносят значительный вклад в неконтролируемое течение тяжелой БА. У большинства пациентов, страдающих тяжелой неконтролируемой БА в сочетании с аллергическим ринитом (80%) и гастроэзофагеальной рефлюксной болезнью (90%), возможно достижение контроля над БА, согласно критериям программы GOAL путем медикаментозной коррекции сопутствующих заболеваний.
- Уровень маркеров воспаления (эозинофилы индуцированной мокроты, назальные эозинофилы, ИЛ – 4 индуцированной мокроты, ИЛ – 4 сыворотки крови, ИЛ – 5 индуцированной мокроты, ИЛ – 5 сыворотки крови) у больных с тяжелой неконтролируемой бронхиальной астмой, страдающих аллергическим ринитом и гастроэзофагеальной рефлюксной болезнью, является дополнительным критерием контроля над заболеванием.
- Терапия аллергического ринита и гастроэзофагеальной рефлюксной болезни у пациентов с тяжелой неконтролируемой БА является эффективным методом третичной профилактики БА.
Внедрение
Комплекс мероприятий по ведению пациентов с тяжелой неконтролируемой БА используется в практике специалистов-пульмонологов ОГУЗ “Томская областная клиническая больница” и Томского областного Астма-центра.
Результаты работы применяются в учебном процессе кафедры госпитальной терапии с курсом физической реабилитации и спортивной медицины Сибирского государственного медицинского университета.
Апробация работы
Материалы диссертации были обсуждены на I Съезде терапевтов Сибири и Дальнего Востока (Новосибирск, 2005), 15 Национальном конгрессе по болезням органов дыхания (Москва, 2005), клинических семинарах кафедры госпитальной терапии с курсом физической реабилитации и спортивной медицины СибГМУ.
Публикации
По теме диссертации опубликовано 16 печатных работ, из них 6 статей в центральной печати.
Структура и объем диссертации
Диссертация изложена на 189 страницах машинописного текста, содержит 48 таблиц, иллюстрирована 20 рисунками и состоит из введения, обзора литературы (первая глава), объекта и методов исследования (вторая глава), клинической характеристики пациентов, принимавших в исследовании (третья глава), характеристики маркеров воспаления (четвертая глава), результатов исследования (пятая глава), обсуждения, выводов, практический рекомендаций, списка литературы.
Библиографический указатель содержит 253 источников, из которых 66 на русском и 187 на иностранном языках.
ОБЪЕКТ И МЕТОДЫ ИССЛЕДОВАНИЯ
Клинические группы
Настоящее исследование проведено на базе аллергологического отделения ОГУЗ “Томская областная клиническая больница” за период с 2002-2005г.
В исследование были включены больные (n=80, возраст – 42,5±1,0 года) с тяжелой неконтролируемой БА (GINA, 2002)
Все пациенты получали адекватную базисную терапию БА, в объеме IV ступени (ингаляционными глюкокортикостероидами (флутиказона пропионат 1000 мкг/сут) в сочетании с 2- агонистами длительного действия). Пациенты были разделены на подгруппы в зависимости от вида того или иного сопутствующего заболевания:
I. Аллергический ринит (n=20)
II. Гастроэзофагеальная рефлюксная болезнь (n=20)
III. Хронический описторхоз (n=20)
IV. Хронический аутоиммунный тиреоидит (n=20)
Группа контроля - 30 человек в возрасте от 17 до 54 лет (средний возраст 35,5 ± 1,5 лет). Это - добровольцы, не страдавшие БА, другими атопическими заболеваниями, гельминтозами, у которых отсутствовала изучаемая сопутствующая патология (аллергический ринит, гастроэзофагеальный рефлюкс, хронический описторхоз, хронический аутоиммунный тиреоидит), по 10 человек в каждой возрастной группе. Критериями включения в группу контроля также служили отсутствие острых и обострение хронических заболеваний в течение трех месяцев, предшествующих процедуре обследования.
Методы исследования
Клинико-анамнестические: степень тяжести заболевания БА устанавливалась, согласно критериям GINA 2002. В исследуемой группе пациентов течение астмы характеризовалось как неконтролируемое, согласно критериям GOAL (табл. 1). Период болезни – вне обострения.
Таблица 1
GOAL: критерии контроля астмы
| “Полный контроль” | “Хороший контроль” |
Все перечисленные критерии:
| Два или более из следующих критериев:
|
Больным проводилась анамнестическая оценка чувствительности к стероидам (прирост ОФВ1 > 20% на фоне терапии преднизолоном в дозе 40 мг/сутки в течение 14 дней).
Диагностика сопутствующих заболеваний осуществлялась согласно национальным и международным рекомендательным документам. Хронический описторхоз диагностировался в соответсвии с классификацией В.Н. Дроздова, Н.А. Зубова (1982). ГЭРБ диагностировалась в соответсвии с Лос-Анжелесской классификацией (1994). Верификация диагноза аутоиммунного тиреоидита проводилась на основании клинических рекомендаций Российской ассоциации эндокринологов по диагностике и лечению аутоиммунного тиреоидита у взрослых. Диагноз аллерический ринит устанавливался на основании критериев, предложенных группой экспертов ВОЗ в 2001г. (документ ARIA, Allergic Rhinitis and its Impact on Asthma).
Больным БА для ежедневного мониторирования тяжести астмы, оценки эффективности лечения, определения обратимости бронхиальной обструкции проводилась пикфлоуметрия в течение всего срока наблюдения.
Функциональные: исследование ФВД выполняли по стандартной методике (анализ кривой поток-объем и показателей спирометрии) на аппарате Master Lab Pro («Эрих Йегер», Германия).
Степень реактивности дыхательных путей оценивали при помощи провокационного теста с метахолином.
Для визуализации патологических изменений в верхних отделах ЖКТ, и соответственно верификации диагноза ГЭРБ проводилась эзофагогастродуоденоскопия (ЭГДС) по стандартной методике.
Описторхозная инвазия устанавливалась при исследовании дуоденального содержимого по классической методике Мельтцера-Лайона.
Иммунологические: исследование уровня общего сывороточного IgE (“Veda-Lab”, Франция) и ИЛ-4 в сыворотке крови (ProCon, Санкт – Петербург, Россия), ИЛ-5 (“Cytelisa”, США) было проведено с помощью твердофазного иммуноферментного анализа (ИФА) с использованием стандартных наборов в соответствии с рекомендациями производителя. Измерение уровня ИЛ-4 (ProCon, Санкт – Петербург, Россия), ИЛ-5 (“Cytelisa”, США) в индуцированной мокроте проводилось методом ИФА.
Функциональное состояние щитовидной железы оценивалось путем измерения концентрации в периферической крови тиреотропного гормона (ТТГ) и свободного тироксина (Т4) («Рош», Франция) методом ИФА.
Определение антител (иммуноглобулин G) к антигенам описторхисов проводилось методом ИФА (тест-системы «Тиатоп»).
Цитологические: определение уровня эозинофилов в индуцированной мокроте по методу Голофеевского В.Ю. (1987).
Помимо этого, в группе I (аллергический ринит) проводилось определение содержания эозинофилов в мазках-отпечатках со слизистой носа по методу профессора Матвеевой Л.М., 1993г.
Аллергологические: аллергологическое обследование проводилось в соответствии с методическими рекомендациями и включало сбор аллергоанамнеза, а также проведение КАП. Для проведения кожных аллергопроб с ингаляционными и эпидермальными аллергенами использовали наборы «Биомед» (г. Москва), с растительными и грибковыми аллергенами фирмы «Immuno Tek» (Испания).
Методы математической обработки полученных результатов
Статистический анализ данных осуществлялся при помощи пакета программ Statistica 6,0 (StatSoft, USA). В работе проводился анализ вариационных рядов методами описательной статистики с вычислением среднего значения (М) и его стандартной ошибки (m). Описание качественных признаков осуществлялось путем вычисления их абсолютных и относительных частот.
Оценка различий между независимыми и зависимыми группами по непрерывным количественным признакам выполнялась с использованием U-критерия Манна-Уитни и парного теста Вилкоксона. Сравнение групп по качественным признакам осуществлялась при помощи критерия 2. Для изучения связей между признаками применялся ранговый корреляционный анализ Спирмена. Для многофакторного сравнения исследуемых групп в работе использован дискриминантный анализ.
Для доказательства влияния сопутствующей патологии на контроль БА выполнено исследование, дизайн которого представлен на рис. 1.
Лечение эрозивной ГЭРБ (стадия 1-4) проводилось в соответствии с рекомендациями по диагностике и лечению ГЭРБ (Конференция экспертов в Генвале (1997). Всем пациентам назначался омепразол 40 мг 1 раз в сут утром (натощак) за 30-60 мин до приема пищи. Продолжительность приема -12 недель.
Антигельминтная терапия проводилась по стандартной схеме препаратом празиквантель из расчета 60 мг/кг.
Лечение АИТ в стадии гипотиреоза проводилось по принципу адекватной заместительной терапии препаратами тиреоидных гормонов. Терапия проводилась препаратом L- тироксин, доза титровалась в зависимости от уровня ТТГ (средняя итоговая доза L- тироксина составляла, как правило, 1,6 мкг на 1 кг массы тела).
Лечение аллергического ринита осуществлялось согласно документу ВОЗ 2001, (документ ARIA, Allergic Rhinitis and its Impact on Asthma). Пациенты получали топический глюкокортикостероид для интраназального применения - флутиказона пропионат (ФП) 50 мкг по 2 дозы в каждый носовой ход 1 раз в день.
Помимо этого, в каждой группе пациенты получали адекватную базисную терапию БА согласно проекту GINA, 2002, ступень IV: сальметерол/ФП в дозе 1000 мкг в сутки по ФП. Симптоматическая терапия 2 -агонистами короткого действия применялась в режиме по требованию. Все пациенты были обучены правильной технике пользования ингаляторами. Общая продолжительность исследования составила 20 недель. Этап лечения 12 недель.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
1. Клиническая характеристика пациентов, принимавших участие в исследовании
Анализ клинико-функциональных показателей у пациентов с тяжелой неконтролируемой астмой, страдающих сочетанной патологией (аллергический ринит, гастроэзофагеальный рефлюкс, хронический описторхоз, хронический аутоиммунный тиреоидит) на старте исследования показал несоответствие критериям «полного контроля», регламентируемых программой GOAL, во всех изучаемых группах (табл. 2). Таким образом, на начальном этапе исследования клинико-функциональные показатели изучаемых групп были в целом однородны.
Также, проводилась оценка клинической картины сопутствующих заболеваний, согласно изучаемым группам. Так у 80% больных аллергическим ринитом клиническая симптоматика ринита была значительно выражена. Характеристика клинической картины АР представлена на рис.2.
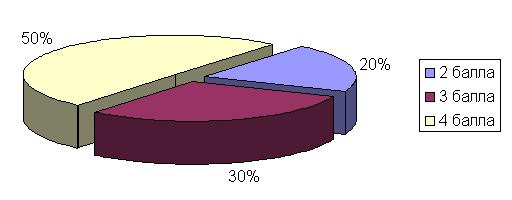
Рис. 2. Распределение пациентов, в зависимости от тяжести течения АР
Анализ клинической картины в группе пациентов, с сочетанной ГЭРБ показал, что больные не акцентируют внимание на гастроэнтерологических проблемах, как следствие этого у большинства пациентов патология гастроэзофагеальной зоны диагностирована впервые - 10 случаев (50%). В клинической картине превалировали изжога, боль за грудиной и/или в эпигастральной области, отрыжка – 11(55%) случаев. Эндоскопические признаки эзофагита были выявлены в 100% случаев. Оценка состояния пищевода у обследованных пациентов, согласно классификации, представлена на рисунке 3.

Рис. 3. Распределение пациентов по степени тяжести рефлюкс – эзофагита.
Таким образом, среди обследованных больных преобладала вторая степень (35%), - множественные эрозии и "экссудативные" поражения, расположенные нециркулярно, занимающие более чем один продольно расположенный участок слизистой оболочки пищевода, имеющие округлую форму, без слияния между собой.
Анализ клинической картины в группе пациентов, с сочетанным хроническим описторхозом показал, что симптоматика со стороны ЖКТ и гепатобилиарной системы скудна. У всех пациентов клинический диагноз соответствовал хроническому некалькулезному холециститу.
При проведении дуоденального зондирования у всех больных установлены моторно-тонические нарушения желчевыделительной системы. Причем у 18 пациентов (90%) выявлено нарушение моторной функции желчевыводящих путей по гипотоническому типу и соответственно у двух (10%) - по гипертоническому типу.
При микроскопии дуоденального содержимого определяется во всех порциях, но особенно в порции “С”, увеличение количества лейкоцитов, эпителиальных клеток, а также детрита, кристаллов билирубина и холестерина. При микроскопии порций дуоденального содержимого выявлены яйца описторхисов в 100% случаях.
Клиническая симптоматика АИТ у пациентов группы IV была разнообразна и неспецифична, что затрудняло проведение систематизированного анализа. У большинства пациентов (70%, n=14) прослеживались типичные признаки гипотиреоза (сонливость, сухость кожи, запоры).
2. Характеристика маркеров воспаления у больных тяжелой неконтролируемой БА в сочетании с сопутствующей патологией
Исследование показателей воспаления (уровни ИЛ – 4 и ИЛ- 5 в индуцированной мокроте, уровни ИЛ – 4 и ИЛ- 5 сыворотки крови, абсолютное и относительное содержание эозинофилов в индуцированной мокроте, концентрация общего IgЕ в сыворотке крови) проводилось у пациентов соответствующих групп дважды: исходно и по окончанию терапии сопутствующих заболеваний.
Ранее были доказаны достоверные отличия на уровне маркеров воспаления (уровни ИЛ – 4 и ИЛ- 5 в индуцированной мокроте, уровни ИЛ – 4 и ИЛ- 5 сыворотки крови, абсолютное и относительное содержание эозинофилов в индуцированной мокроте) у больных тяжелой БА, в зависимости от наличия или отсутствия контроля над заболеванием [Кобякова О.С., 2005]. В рамках настоящего исследования показано, что исходно уровни маркеров воспаления у больных с тяжелой неконтролируемой БА, страдающие указанными сопутствующими заболеваниями, достоверно отличались от аналогичных показателей группы контроля.
Таким образом, пациенты с тяжелой неконтролируемой астмой, страдающие изучаемыми сопутствующими заболеваниями на начальном этапе наблюдения были однородны по уровню исследуемых показателей воспаления (табл. 3).
3. Оценка эффективности терапии сопутствующих заболеваний (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит) у пациентов с тяжелой неконтролируемой бронхиальной астмой
Цель данного этапа исследования заключалась в оценке возможности достижения «полного контроля», согласно критериям GOAL у данной категории больных, а также в анализе динамики маркеров аллергического воспаления на фоне терапии сопутствующих заболеваний (аллергический ринит, гастроэзофагеальная рефлюксная болезнь, хронический описторхоз, хронический аутоиммунный тиреоидит) у больных изучаемых групп.
Динамика клинико-функциональных показателей и маркеров воспаления у больных с тяжелой неконтролируемой бронхиальной астмой на фоне терапии аллергического ринита (группа I)
Динамика клинико – функциональных показателей пациентов группы I представлена в табл. 4. Так, по окончанию 12 недельного курса терапии у пациентов, страдающих аллергическим ринитом, 80% больных достигли критериев “полного контроля”. В результате после проведения терапии аллергического ринита обнаружено достоверное снижение количества дневных симптомов по сравнению с количеством дневных симптомов на начальном этапе исследования. Положительная динамика данного показателя была отмечена уже через 6 недель терапии аллергического ринита. Среди пациентов изучаемой группы, также по окончании 12 недель исследования выявлено достоверное снижение частоты ночных симптомов. Кратность использования 2- агонистов короткого действия у больных достоверно снизилась по сравнению с потребностью в бронхолитиках до проведения терапии аллергического ринита. Исследуемые показатели среднесуточной лабильности бронхов, среднесуточной проходимости бронхов в группе больных с АР не продемонстрировали статистически значимых отличий в процессе терапии.
Таблица 4
Динамика клинико-функциональных показателей у больных группы I на фоне терапии аллергического ринита
| Критерии GOAL | До лечения (n=20) | После лечения (n=20) | Критерии GOAL «полный контроль» |
| Дневные симптомы, баллы* | 1,48 ± 0,19** | 0,60±0,13 | 0 |
| Ночные симптомы, баллы* | 0,88 ± 0,16** | 0,32±0,11 | 0 |
| Потребность в бронхолитиках, доз/сут. | 2,06 ± 0,27** | 0,59±0,12 | 0 |
| Среднесуточная лабильность бронхов, % | 17,35 ± 3,08 | 21,36±2,52 | <20 |
| Среднесуточная проходимость бронхов, % | 77,27 ± 4,38 | 84,22±1,67 | 80 |
Примечание: * - средняя оценка по шкале симптомов/сутки; **- p<0,05 у представителей группы I до лечения по сравнению с клинико-функциональными показателями после лечения.
Динамика маркеров воспаления у пациентов группы I на фоне терапии аллергического ринита (табл.5).
Таблица 5
Динамика маркеров воспаления у пациентов группы I на фоне терапии аллергического ринита, M ± m
| Маркеры воспаления | БА +АР | |
| До лечения (n=20) | После лечения (n=20) | |
| ЭИМ, % | 4,64±0,92 | 3,56±0,85 |
| ЭИМ 106/л | 0,12±0,04* | 0,08±0,04 |
| Ig Е, МЕ/мл | 341,78±35,43 | - |
| ИЛ - 4 ИМ, пг/мл | 132,41±24,96* | 65,40±18,08 |
| ИЛ – 4 сыворотки крови, пг/мл | 342,85±110,82* | 83,90±27,48 |
| ИЛ – 5 ИМ, пг/мл | 331,41±18,35* | 282,50±16,76 |
| ИЛ – 5 сыворотки крови, пг/мл | 101,90±4,75* | 54,80±6,70 |
| Э наз. % | 9,86±0,72* | 7,61±0,49 |
Примечание: * - p<0,01 до лечения по сравнению с после лечения; n = количество пациентов в абсолютных цифрах.
Динамика клинико-функциональных показателей у больных с тяжелой неконтролируемой БА с сочетанным аллергическим ринитом были сопоставимы с динамикой уровня маркеров аллергического воспаления (ЭИМ, назальные эозинофилы, ИЛ - 4 ИМ, ИЛ – 4 сыворотки крови, ИЛ – 5 ИМ, ИЛ – 5 сыворотки крови) на фоне терапии аллергического ринита.
Среди пациентов группы, с сочетанным аллергическим ринитом по окончании 12 недель исследования была зарегистрирована достоверная редукция изучаемых маркеров аллергического воспаления (ЭИМ, назальные эозинофилы, ИЛ - 4 ИМ, ИЛ – 4 сыворотки крови, ИЛ – 5 ИМ, ИЛ – 5 сыворотки крови).
При анализе клинической картины аллергического ринита отмечена положительная динамика, так у 55% пациентов по окончанию лечения отсутствовали симптомы ринита (нарушение сна, заложенность носа).
Динамика клинико-функциональных показателей и маркеров воспаления у больных с тяжелой неконтролируемой бронхиальной астмой на фоне терапии гастроэзофагеальной рефлюксной болезни (группа II)
Динамика клинико – функциональных показателей пациентов группы II (табл. 6).
Таблица 6
| Критерии GOAL | До лечения (n=20) | После лечения (n=20) | Критерии GOAL «полный контроль» |
| Дневные симптомы, баллы* | 1,80 ± 0,12** | 0,48±0,03 | 0 |
| Ночные симптомы, баллы* | 1,74 ± 0,13** | 0,22±0,04 | 0 |
| Потребность в бронхолитиках, доз/сут. | 3,38 ± 0,27** | 0,62±0,03 | 0 |
| Среднесуточная лабильность бронхов, % | 30,30 ± 2,92 | 30,72±1,75 | <20 |
| Среднесуточная проходимость бронхов, % | 76,96 ± 1,63** | 80,58±1,38 | 80 |
Динамика клинико-функциональных показателей у больных группы II на фоне терапии ГЭРБ
Примечание: * - средняя оценка по шкале симптомов/сутки; **- p<0,05 у представителей группы II до лечения по сравнению с клинико-функциональными показателями после лечения.
В результате терапии ГЭРБ у пациентов, с тяжелой неконтролируемой БА, 90% больных достигли критериев “полного контроля” программы GOAL. Так, в ходе проведения лечения ГЭРБ зарегистрировано достоверное снижение количества дневных симптомов, ночных симптомов. Потребность в 2 - агонистах короткого действия у пациентов, страдающих ГЭРБ, достоверно уменьшилась по сравнению с потребностью в бронхолитиках до проведения терапии гастроэзофагеального рефлюкса. Показатель среднесуточной проходимости бронхов до терапии ГЭРБ статистически значимо отличался от аналогичного показателя через 12 недель исследования. При этом выявлена более ранняя положительная (через 6 недель исследования) динамика со стороны частоты ночных симптомов, по сравнению с другими изучаемыми клинико-функциональными показателями. Динамика маркеров воспаления у пациентов группы II на фоне терапии ГЭРБ (табл. 7).
Таблица 7
Динамика маркеров воспаления у пациентов группы II на фоне терапии ГЭРБ, M ± m
| Маркеры воспаления | БА +ГЭРБ | |
| До лечения (n=20) | После лечения(n=20) | |
| ЭИМ, % | 10,02±1,29* | 6,20±1,37 |
| ЭИМ 106/л | 0,19±0,03* | 0,10±0,02 |
| Ig Е, МЕ/мл | 225,78±19,50 | - |
| ИЛ - 4 ИМ, пг/мл | 51,64±14,53* | 18,30±5,97 |
| ИЛ – 4 сыворотки крови, пг/мл | 122,95±61,65* | 25,10±10,29 |
| ИЛ – 5 ИМ, пг/мл | 314,95±17,74* | 280,95±17,35 |
| ИЛ – 5 сыворотки крови, пг/мл | 98,20±4,97* | 59,60±4,78 |
Примечание: * - p<0,01 до лечения по сравнению с после лечения; n = количество пациентов в абсолютных цифрах.
В результате анализа динамики маркеров аллергического воспаления на фоне терапии гастроэзофагеальной рефлюксной болезни отмечалась достоверная редукция маркеров воспаления (ЭИМ, ИЛ - 4 ИМ, ИЛ – 4 сыворотки крови, ИЛ – 5 ИМ, ИЛ – 5 сыворотки крови), что сопоставимо с изменениями клинико-функциональных параметров среди пациентов изучаемой группы.
Анализ клинической картины среди пациентов, страдающих ГЭРБ, в стадии рефлюкс-эзофагита показал положительную динамику, - у 90% пациентов симптомы отсутствовали. Изжога, боль за грудиной или в эпигастральной области, отрыжка не отмечались. Кроме того, при проведении контрольного исследования ЭГДС (через 12 недель) эндоскопические признаки эзофагита исчезли у 15 пациентов (75%).
Динамика клинико-функциональных показателей и маркеров воспаления у больных с тяжелой неконтролируемой бронхиальной астмой на фоне терапии хронического описторхоза (группа III)
Динамика клинико – функциональных показателей пациентов группы III (табл. 8).
Таблица 8
Динамика клинико-функциональных показателей у больных III группы на фоне дегельминтизации
| Критерии GOAL | До лечения (n=20) | После лечения (n=20) | Критерии GOAL «полный контроль» |
| Дневные симптомы, баллы* | 1,82 ± 0,14** | 1,21±0,11 | 0 |
| Ночные симптомы, баллы* | 1,53 ± 0,14** | 1,12±0,10 | 0 |
| Потребность в бронхолитиках, доз/сут. | 3,18 ± 0,25** | 1,99±0,23 | 0 |
| Среднесуточная лабильность бронхов, % | 26,52 ± 3,28 | 27,51±2,25 | <20 |
| Среднесуточная проходимость бронхов, % | 82,08 ± 1,85 | 83,54±1,39 | 80 |
Примечание: * - средняя оценка по шкале симптомов/сутки; **- p<0,05 у представителей группы III до лечения по сравнению с клинико-функциональными показателями после лечения.
Несмотря на проведение дегельминтизации у пациентов, страдающих хроническим описторхозом, не удалось достичь критериев “полного контроля” согласно программе GOAL у 85% (n= 17) участников исследования.
На основании анализа дневников самоконтроля у пациентов, страдающих хроническим описторхозом, отмечено, что критериев “полного контроля” удалось достичь только у 15% (n=3) больных. Результаты анализа дневников самоконтроля продемонстрировали снижение утренней ПСВ < 80% от должной - у 5 пациентов; у 16 пациентов сохранялись дневные симптомы (>1 балла) в течение последних 2 недель; шесть человек отметили ночные пробуждения из-за астмы в дневнике самоконтроля. У одного больного среднесуточная лабильность бронхов составила 40,1 %.
Следует отметить, в группе больных БА, страдающих хроническим описторхозом, отмечена положительная динамика со стороны отдельных клинико-функциональных параметров. Так, после проведения терапии хронического описторхоза зарегистрировано достоверное снижение количества дневных симптомов. Количество ночных симптомов, зарегистрированных до начала дегельминтизации, статистически значимо отличалось от аналогического показателя через 12 недель исследования. Кратность использования 2 - агонистов короткого действия среди пациентов данной группы достоверно снизилась по сравнению с потребностью в бронхолитиках до проведения терапии хронического описторхоза.
Динамика маркеров воспаления у пациентов группы III на фоне терапии хронического описторхоза (табл.9).
Таблица 9
Динамика маркеров воспаления у пациентов группы III на фоне терапии хронического описторхоза, M ± m
| Маркеры | БА +хр. описторхоз | |
| До лечения (n=20) | После лечения (n=20) | |
| ЭИМ, % | 3,80±0,61 | 3,67±1,46 |
| ЭИМ 106/л | 0,07±0,07 | 0,06±0,01 |
| Ig Е, МЕ/мл | 249,18±24,77 | - |
| ИЛ - 4 ИМ, пг/мл | 160,28±28,64* | 91,80±21,29 |
| ИЛ – 4 сыворотки крови, пг/мл | 76,45±9,05* | 41,65±7,95 |
| ИЛ – 5 ИМ, пг/мл | 265,01±29,19 | 230,42±23,96 |
| ИЛ – 5 сыворотки крови, пг/мл | 97,7±11,01 | 75,00±15,21 |
Примечание: * - p<0,01 до лечения по сравнению с после лечения; n = количество пациентов в абсолютных цифрах.
Анализ динамики маркеров воспаления на фоне дегельминтизации у пациентов, страдающих хроническим описторхозом, продемонстрировал, что достоверная редукция зафиксирована лишь в отношении ИЛ - 4 индуцированной мокроты и ИЛ – 4 сыворотки крови, что объяснимо с точки зрения неполной динамики клинико-функциональных характеристик. В отношение ИЛ – 5 индуцированной мокроты, ИЛ – 5 сыворотки крови, а также уровня эозинофилов индуцированной мокроты отмечена лишь тенденция к снижению, однако результаты не достигли статистически значимой отметки.
По окончанию этапа исследования всем обследуемым пациентам было проведено исследование дуоденального содержимого, в результате которого при микроскопии яйца описторхисов выявлены не были. Однако у ряда пациентов (30%, n=6), было отмечено сохранение следующих симптомов: тошнота, боли в правом подреберье.
Динамика клинико-функциональных показателей и маркеров воспаления у больных с тяжелой неконтролируемой бронхиальной астмой на фоне терапии аутоиммунного тиреоидита (группа IV)
Динамика клинико – функциональных показателей пациентов группы IV (табл. 10).
Таблица 10
Динамика клинико-функциональных показателей у больных IV группы на фоне терапии АИТ
| Критерии GOAL | До лечения (n=20) | После лечения (n=20) | Критерии GOAL «полный контроль» |
| Дневные симптомы, баллы* | 1,14 ± 0,21 | 1,38±0,07 | 0 |
| Ночные симптомы, баллы* | 1,08 ± 0,23** | 0,92±0,60 | 0 |
| Потребность в бронхолитиках, доз/сут. | 2,12 ± 0,41 | 1,83±0,17 | 0 |
| Среднесуточная лабильность бронхов, % | 15,45 ± 2,65** | 23,75±1,87 | <20 |
| Среднесуточная проходимость бронхов, % | 80,18 ± 4,52 | 90,73±3,80 | 80 |
Примечание: * - средняя оценка по шкале симптомов/сутки; **- p<0,05 у представителей группы IV до лечения по сравнению с клинико-функциональными показателями после лечения.
У большинства пациентов (80%, n=16) с тяжелой неконтролируемой БА, страдающих аутоиммунным тиреоидитом, не удалось достичь критериев “полного контроля” по окончанию 12 недель исследования.
Анализируя дневники самоконтроля у пациентов, страдающих аутоиммунным тиреоидитом выявлено, что у 14 (70%) пациентов сохранялись дневные симптомы (>1 балла) в течение последних 2 недель; у трех пациентов зарегистрировано снижение утренней ПСВ < 80% от должной; 4 человека отметили ночные пробуждения из-за астмы в дневнике самоконтроля.
При количественной оценке клинико-функциональных показателей после лечения аутоиммунного тиреоидита выявлена тенденция к снижению количества ночных симптомов, зарегистрированных до начала коррекции функции щитовидной железы. Дневные симптомы, использование 2 - агонистов короткого действия, среднесуточная проходимость бронхов отличались статистически недостоверно в сравнении с аналогичными показателями после проведения гормонозамещающей терапии.
Динамика маркеров воспаления у пациентов группы на фоне терапии аутоиммунного тиреоидита (табл. 11).
Таблица 11
Динамика маркеров воспаления у пациентов группы IV на фоне терапии АИТ, M ± m
| Маркеры | БА +АИТ | |
| До лечения (n=20) | После лечения (n=20) | |
| ЭИМ, % | 6,25±0,96 | 4,35±0,62 |
| ЭИМ 106/л | 0,13±0,03 | 0,17±0,03 |
| Ig Е, МЕ/мл | 246,4±23,81 | - |
| ИЛ - 4 ИМ, пг/мл | 97,20±11,18 | 72,05±11,30 |
| ИЛ – 4 сыворотки крови, пг/мл | 328,65±17,0 | 296,73±14,11 |
| ИЛ – 5 ИМ, пг/мл | 356,45±14,15 | 332,50±15,67 |
| ИЛ – 5 сыворотки крови, пг/мл | 128,7±21,78 | 92,00±14,12 |
Примечание: * - p<0,01 до лечения по сравнению с после лечения; n = количество пациентов в абсолютных цифрах.
Данные, полученные при исследовании маркеров аллергического воспаления на фоне терапии аутоиммунного тиреоидита сопоставимы с результатами исследования маркеров после дегельминтизации, при хроническом описторхозе. Зарегистрирована неполная редукция уровней изучаемых показателей.
Анализ клинического течения тиреоидита проводился на основании динамического наблюдения и клинического обследования пациентов данной группы. Всем пациентам проводилась оценка функционального состояния щитовидной железы: концентрации тиреотропного гормона и свободного тироксина. Результаты продемонстрировали, что концентрация ТТГ статистически значимо (p<0,01) снизилась на фоне проводимой гормонозамещающей терапии (1,85±0,18 мкМе/мл) в сравнении с исходными данными аналогичного показателя (5,36±0,39 мкМе/мл), а уровень свободного тироксина достоверно возрос (17,96±0,88 нМоль/л, p<0,01) в сравнении с данным показателем до лечения (10,73±0,65 нМоль/л) (рис.4).


Рис. 4. Динамика концентрации ТТГ и Т4 на фоне проводимой гормонозамещающей терапии у пациентов группы IV.
Примечение: * - p<0,01 у представителей группы IV до лечения по сравнению с уровнем ТТГ после лечения и уровнем Т4 после лечения.
Таким образом, у пациентов с тяжелой неконтролируемой БА с сочетанной сопутствующей патологией, возможно достижение контроля над БА путем медикаментозной коррекции сопутствующих заболеваний.
Так, у пациентов, страдающих аллергическим ринитом и гастроэзофагеальной рефлюксной болезнью возможно достижение критериев “полного контроля” у 80%, и 90% больных соответственно.
Тогда как, в группах больных тяжелой неконтролируемой БА, страдающих хроническим описторхозом и аутоиммунным тиреоидитом не удалось достичь критериев “полного контроля” согласно программе GOAL у 85% и 80% больных соответственно, несмотря на проведение терапии изучаемых сопутствующих заболеваний.
На основании результатов исследования были сформулированы клинические рекомендации по ведению пациентов с тяжелой неконтролируемой БА, страдающих аллергическим ринитом, гастроэзофагеальной рефлюксной болезнью, схематично представленные на рисунке 5.
В рамках указанных клинических рекомендаций выделяется три периода ведения больных с тяжелой неконтролируемой БА.
Так, I этап терапии (достижение контроля) проводится путем назначения комбинированной терапии (сальметерол/ФП) в суточной дозе 1000 мкг по ФП сроком 12 недель, с одновременной коррекцией сопутствующих заболеваний (аллергический ринит, гастроэзофагеальная рефлюксная болезнь). Продолжительность II этапа терапии (стабилизация ремиссии) составляет 12 – 24 недели, на протяжении которых доза ИКС в составе комбинированной терапии или остается прежней, или снижается на 250 мкг по ФП ежемесячно до минимально эффективной (500 мкг/сутки по ФП), обеспечивающей контроль над симптомами болезни. Заключительный (III) этап терапии БА подразумевает постоянное использование комбинированной терапии (сальметерол/ФП) в дозе не менее 500 мкг в сутки по ФП.
ВЫВОДЫ:
- Сопутствующие заболевания (аллергический ринит, гастроэзофагеальная рефлюксная болезнь) являются одной из причин отсутствия контроля бронхиальной астмы.
- Назначение терапии аллергического ринита (ФП 50 мкг по 2 дозы в каждый носовой ход), а также стандартной антирефлюксной терапии (омепразол 40 мг 1 раз в сутки) больным тяжелой неконтролируемой бронхиальной астмой является эффективным способом третичной профилактики астмы.
- У пациентов тяжелой неконтролируемой бронхиальной астмы в сочетании с аллергическим ринитом и гастроэзофагеальной рефлюксной болезнью возможно достижение критериев “полного контроля”, регламентируемых программой GOAL, в 80% случаев и 90% случаев соответственно на фоне 12 недельного курса медикаментозной коррекции указанных заболеваний.
- У больных тяжелой неконтролируемой бронхиальной астмой, страдающих хроническим описторхозом, а также аутоиммунным тиреоидитом не удалось достичь критериев “полного контроля”, регламентируемых программой GOAL в 85 % и 80% случаев соответственно, несмотря на проведение 12 недельного курса медикаментозной коррекции указанных заболеваний.
- У пациентов с тяжелой неконтролируемой бронхиальной астмой, в сочетании с аллергическим ринитом, а также гастроэзофагеальной рефлюксной болезнью зарегистрирована достоверная редукция маркеров воспаления (эозинофилы индуцированной мокроты, назальные эозинофилы, ИЛ - 4 ИМ, ИЛ – 4 сыворотки крови, ИЛ – 5 ИМ, ИЛ – 5 сыворотки крови) по окончании 12 недельного этапа терапии сопутствующих заболеваний.
- У больных тяжелой неконтролируемой бронхиальной астмой динамика маркеров аллергического воспаления в группах пациентов, страдающих хроническим описторхозом и аутоиммунным тиреоидитом, продемонстрировала отсутствие достоверного снижения большинства изучаемых маркеров воспаления.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ:
- Тактически важным является обследование больных, страдающих тяжелой неконтролируемой бронхиальной астмой, на предмет сопутствующих заболеваний с целью выявления причин отсутствия контроля заболевания.
- У пациентов с тяжелой неконтролируемой бронхиальной астмой в сочетании с аллергическим ринитом и гастроэзофагеальной рефлюксной болезнью необходимо стремиться к достижению полного контроля над астмой, согласно критериям программы GOAL, путем медикаментозной коррекции сопутствующих заболеваний.
- Третичная профилактика заболевания у больных тяжелой неконтролируемой бронхиальной астмой в сочетании с аллергическим ринитом заключается в назначении топических стероидов в дозе 200 мкг/сут по ФП продолжительностью 12 недель.
- Третичная профилактика заболевания у больных тяжелой неконтролируемой бронхиальной астмой в сочетании с гастроэзофагеальной рефлюксной болезнью заключается в назначении омепразола 40 мг/сут в течение 12 недель.
- Для оценки эффективности противовоспалительной терапии, помимо клинико-функциональных характеристик астмы, целесообразно оценивать динамику показателей воспаления (эозинофилы индуцированной мокроты, назальные эозинофилы, ИЛ – 5 ИМ, ИЛ – 5 сыворотки крови).
- Отсутствие снижения или нарастание уровней маркеров воспаления (эозинофилы индуцированной мокроты, назальные эозинофилы, ИЛ – 5 ИМ, ИЛ – 5 сыворотки крови) на фоне 12 недельного курса коррекции сопутствующих заболеваний свидетельствует о недостаточном контроле бронхиальной астмы.
Список работ, опубликованных по теме диссертации
1. Новые подходы к ведению пациентов с тяжелой неконтролируемой бронхиальной астмой (результаты открытого многоцентрового рандомизированного исследования “BRILLIANT”) – часть I // Аллергология. –2002. – №1.- С.3-11. (Соавт. Огородова Л.М., Кобякова О. С., Петровский Ф.И., Смоленов И.В., Ребров А.П., Пунин А.А., Скалозуб Е.А., Кароли Н.А., Сосонная Н.А., Молотков А.О.).
2. Комбинированная терапия при тяжелой неконтролируемой бронхиальной астме // Врач. – 2002. – №3.- С.31-35. (Соавт. Огородова Л.М., Кобякова О. С., Петровский Ф.И., Смоленов И.В., Ребров А.П., Пунин А.А., Скалозуб Е.А., Кароли Н.А. и др.).
3. Безопасность использования различных режимов комбинированной терапии у пациентов с тяжелой неконтролируемой бронхиальной астмой // Сборник статей “Актуальные проблемы медицинской биологии” – Томск, 2002.- С.119. (Соавт. Огородова Л.М., Кобякова О. С., Петровский Ф.И., Петровская Ю.А., Ханова Ф.М.).
4. Астмоподобные синдромы // Сборник статей по итогам II Межрегиональной научно-практической конференции “Здоровье детей – наше будущее”. – Томск. – 2002. -С. 58-59. (Соавт. Кобякова О. С., Сметаненко Т.В.).
5. Многоцентровое исследование эффективности препарата комбинированной терапии Серетид Мультидиск у пациентов со среднетяжелой бронхиальной астмой // Качественная клиническая практика. – 2002, №3. – С.24-30. (Соавт. Огородова Л.М., Кобякова О.С., Смоленов И.В. и др.).
6. Влияние социальных факторов на эффективность контроля над симптомами бронхиальной астмы в Томской области // Вестник Межрегиональной Ассоциации «Здравоохранение Сибири».- Новосибирск, 2002.- № 2-3.-С. 21-29. (Соавт. Ленская Л. Г., Ковалева Е.В., Стреж Ю. А., Сметаненко Т. В).
7. Генетический анализ вариабельности уровня сывороточного интерлейкина-5 у больных бронхиальной астмой // Генетика человека и патология: Сб. научных трудов. / Под ред. В.П.Пузырева. – Вып.7. – Томск: Печатная мануфактура, 2002. - С.220-225. (Соавт. Кобякова О.С.).
8. Оказание амбулаторной помощи больным бронхиальной астмой в Томской области как фактор риска несоблюдения режима лечения // Сибирский медицинский журнал.-2002.-№1-2.-С.15-24. (Соавт. Ленская Л.Г.).
9. Значение сопутствующих заболеваний при неконтролируемой бронхиальной астме // Сборник научных статей, посвященных 110 – летию каф госпитальной хирургии и терапии. - Томск: Печатная мануфактура, 2002.- С.28. (Соавт. Краюшкина Н.П., Кобякова О.С.).
10. Эффективность и безопасность использования различных режимов комбинированной терапии у пациентов с тяжелой неконтролируемой бронхиальной астмой // Пульмонология. –2003. – №1.- С.75-79. (Соавт. Огородова Л.М., Кобякова О.С., Ханова Ф.М.).
11. Значение адекватной терапии гастроэзофагеальной рефлюксной болезни для достижения контроля над симптомами тяжелой бронхиальной астмы // Клинико-эпидемиологические и этно-экологические проблемы заболеваний органов пищеварения: материалы пятой восточно-сибирской гастроэнтерологической конференции с международным участием.- Красноярск. – 2005.- С.12-17. (Соавт. Огородова Л.М., Кобякова О.С., Черногорюк Г.Э.).
12. Достижение контроля над симптомами тяжелой бронхиальной астмы при адекватном лечении сопутствующей гастроэзофагеальной рефлюксной болезни // Материалы шестой международной научно-практической конференции “Здоровье и Образование в ХХI веке”, РУДН. – Москва. - 2005.- С. 97. (Соавт. Огородова Л.М., Кобякова О.С., Черногорюк Г.Э.).
13. Значение адекватной терапии гастроэзофагеальной рефлюксной болезни для достижения контроля над симптомами тяжелой бронхиальной астмы // Материалы 15 Национального конгресса по болезням органов дыхания. – Москва. – 2005.-С. 76. (Соавт. Огородова Л.М., Кобякова О.С., Черногорюк Г.Э.).
14. Особенности течения тяжелой неконтролируемой бронхиальной астмы в сочетании с гастроэзофагеальной рефлюксной болезнью // Материалы I съезда терапевтов Сибири и Дальнего Востока. – Новосибирск. – 2005. – С. 65 (Соавт. Кобякова О.С., Черногорюк Г.Э.).
15. Особенности течения тяжелой неконтролируемой бронхиальной астмы в сочетании с гастроэзофагеальной рефлюксной болезнью // Сибирский журнал гастроэнтерологии и гепатологии. – 2005. – № 19. – С. 59 – 62 (Соавт. Кобякова О.С., Черногорюк Г.Э.).
16. Induced sputum free interleukin – 5 level and its mRNA expression in atopic asthma //European Respiratory Society Annual Congress. – 2003. (Соавт. Ogorodova L. M., Kobyakova O.S.).
Список сокращений
АР – аллергический ринит
АИТ – аутоиммунный тиреоидит
БА – бронхиальная астма
FVC - форсированная жизненная емкость легких
FEV1 (ОФВ1) - объем форсированного выдоха за секунду
FEV1/FVC% - индекс Тиффно
FEV25- мгновенная объемная скорость воздушного потока после выдоха 25% FVC
FEV50- мгновенная объемная скорость воздушного потока после выдоха 50% FVC
FEV75- мгновенная объемная скорость воздушного потока после выдоха 75% FVC
ПСВ (PEF) – пиковая скорость выдоха
СЛБ - среднесуточная лабильность бронхов
СПБ - среднесуточная проходимость бронхов
ГКС – глюкокортикостероиды
БО - обратимость бронхиальной обструкции
ИКС – ингаляционные кортикостероиды
КАП - кожные аллергопробы
IgЕ – иммуноглобулин Е
IgG – иммуноглобулин G
БГР – бронхиальная гиперреактивность
ФП – флутиказона пропионат
БДП – бекламетазона пропионат
ФВД – функция внешнего дыхания
GINA – Global Initiative for asthma
ИФА – иммуноферментный анализ
Г/л – гига/ л (х 109/л)
ПК 20 – концентрация метахолина, вызывающая 20% снижение ОФВ1
ИМ – индуцированная мокрота
ЭИМ - эозинофилы индуцированной мокроты
Э наз – назальные эозинофилы
ХОБЛ – хроническая обструктивная болезнь легких
ИЛ - интерлейкины
GOAL - Gaining Optimal Asthma Control
ГЭРБ - гастроэзофагеальная рефлюксная болезнь
ГЭР – гастроэзофагеалный рефлюкс
НПС - нижний пищеводный сфинктер
Таблица 2
| Критерии GOAL* | Группа I (БА+АР) n=20 | Группа II (БА+ГЭРБ) n=20 | Группа III (БА+ Описторхоз) n=20 | Группа IV (БА+АИТ) n=20 | p | p1 | p2 | p3 | p4 | p5 | “полный контроль” |
| Дневные симптомы, баллы | 1,48 ± 0,19 | 1,80 ± 0,12 | 1,82 ± 0,14 | 1,14 ± 0,21 | 0,01 | 0,01 | 0,26 | 0,68 | 0,01 | 0,01 | 0 |
| Ночные симптомы, баллы | 0,88 ± 0,16 | 1,74 ± 0,13 | 1,53 ± 0,14 | 1,08 ± 0,23 | 0,01 | 0,01 | 0,79 | 0,24 | 0,01 | 0,01 | 0 |
| Потребность в бронхолитиках, доз/сут. | 2,06 ± 0,27 | 3,38 ± 0,27 | 3,18 ± 0,25 | 2,12 ± 0,41 | 0,01 | 0,01 | 0,72 | 0,46 | 0,01 | 0,01 | 0 |
| Среднесуточная лабильность бронхов, % | 17,35 ± 3,08 | 30,30 ± 2,92 | 26,52 ± 3,28 | 15,45 ± 2,65 | 0,01 | 0,01 | 0,71 | 0,34 | 0,01 | 0,01 | <20 |
| Среднесуточная проходимость бронхов, % | 77,27 ± 4,38 | 76,96 ± 1,63 | 82,08 ± 1,85 | 80,18 ± 4,52 | 0,01 | 0,66 | 0,08 | 0,01 | 0,01 | 0,23 | 80 |
Сравнительная характеристика клинико-функциональных параметров в соответствующих группах, M±m
p – значимость различий при сравнении между группами I и II;
p1 – значимость различий при сравнении между группами I и III;
p 2 – значимость различий при сравнении между группами I и IV;
p 3 – значимость различий при сравнении между группами II и III;
p 4 – значимость различий при сравнении между группами II и IV;
p 5 – значимость различий при сравнении между группами III и IV;n= количество пациентов в абсолютных цифрах.
Таблица 3
| Маркеры воспаления Маркеры | Группа I БА +АР (n=20) | Группа II БА+ ГЭРБ (n=20) | Группа III БА + хр.описторхоз (n=20) | Группа IV БА + АИТ (n=20) | P (для I по сравнению со II) | P1 (для I по сравнению с III) | P2 (для I по сравнению с IV) | P3 (для II по сравнению с III) | P4 (для II по сравнению с IV) | P5 (для III по сравнению с IV) |
| ЭИМ, % | 4,64±0,92 | 10,02±1,29 | 3,80±0,61 | 6,25±0,96 | 0,01 | 0,57 | 0,15 | 0,01 | 0,01 | 0,06 |
| ЭИМ 106/л | 0,12±0,04 | 0,19±0,03 | 0,07±0,07 | 0,13±0,03 | 0,01 | 0,31 | 0,19 | 0,01 | 0,09 | 0,05 |
| Ig Е, МЕ/мл | 341,78±35,43 | 225,78±19,5 | 249,18±24,77 | 246,4±23,81 | 0,01 | 0,08 | 0,01 | 0,60 | 0,58 | 0,80 |
| ИЛ - 4 ИМ, пг/мл | 132,41±24,96 | 51,64±14,53 | 160,28±28,64 | 97,20±11,18 | 0,01 | 0,67 | 0,43 | 0,01 | 0,01 | 0,32 |
| ИЛ – 4 сыворотки крови, пг/мл | 342,85±11,08 | 122,95±61,65 | 76,45±9,05 | 328,65±17,0 | 0,01 | 0,04 | 0,37 | 0,01 | 0,01 | 0,07 |
| ИЛ – 5 ИМ, пг/мл | 331,41±18,35 | 314,95±17,74 | 265,01±29,19 | 356,45±14,15 | 0,23 | 0,09 | 0,35 | 0,29 | 0,08 | 0,01 |
| ИЛ – 5 сыворотки крови, пг/мл | 101,90±4,75 | 98,20±4,97 | 97,7±11,01 | 128,7±21,78 | 0,69 | 0,09 | 0,84 | 0,21 | 0,60 | 0,14 |
| Э наз. % | 9,86±0,72 | - | - | - | - | - | - | - | - | - |
Сравнительная характеристика маркеров воспаления у пациентов с тяжелой неконтролируемой БА, в сочетании с изучаемой сопутствующей патологией, M ± m

