Клинико-патогенетическое обоснование методов лечения острого флеботромбоза и его осложнений
На правах рукописи
ИВЧЕНКО
Андрей Олегович
КЛИНИКО-ПАТОГЕНЕТИЧЕСКОЕ ОБОСНОВАНИЕ МЕТОДОВ ЛЕЧЕНИЯ ОСТРОГО ФЛЕБОТРОМБОЗА И ЕГО ОСЛОЖНЕНИЙ
14.00.27. - хирургия
Автореферат
диссертации на соискание ученой степени
доктора медицинских наук
Томск -2006
Работа выполнена в ГОУ ВПО «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Научный консультант:
доктор медицинских наук, профессор,
член-корреспондент РАМН Дамбаев Георгий Цыренович
Официальные оппоненты:
доктор медицинских наук, профессор,
Заслуженный деятель науки РФ Жерлов Георгий Кириллович
доктор медицинских наук, профессор Баширов Рафаэль Серажутдинович
доктор медицинских наук, профессор Чернявский Александр Михайлович
Ведущая организация: ГОУ ВПО «Российский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
Защита состоится « » 2006 г. в___ часов на заседании диссертационного совета Д. 208.096.01 при Сибирском государственном медицинском университете (634050, г. Томск, Московский тракт, 2)
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета (634050, г. Томск, пр. Ленина, 107)
Автореферат разослан « » 2006 г.
Ученый секретарь диссертационного совета Суханова Г.А.
ОБЩАЯ ХАРАКТЕРИСТИКА ДИССЕРТАЦИИ
Актуальность темы. Тромбоз глубоких вен нижних конечностей представляет серьезную проблему современной медицины. В последние годы отмечается неуклонный рост частоты тромботического поражения магистральных вен и его непосредственного осложнения – тромбоэмболии легочной артерии, что обусловлено общим постарением населения, увеличением распространенности онкологических заболеваний, неконтролируемым приемом гормональных средств, ростом травматизма и все более частым возникновением наследственных и приобретенных нарушений системы гемостаза (Савельев В.С., 1998, 2005; Покровский А.В. и соавт., 1999, 2004; Константинова Г.Д., 2000; Баешко А.А., 2000; Кириенко А.И. и соавт., 2001; Гордеев Н.А., 2004; Швальб П.Г., 2004; Фокин Ал.Ан., 2005 ).
Эпидемиологические данные показывают, что частота тромбоза глубоких вен нижних конечностей в общей популяции составляет 160 случаев на 100 тыс населения (Nordstrom M., 1999). Количество случаев острого флеботромбоза в России составляет 240 тыс ежегодно. Самое грозное осложнение острого флеботромбоза – тромбоэмболия легочной артерии встречается в 42% случаев. Из всех случаев тромбоэмболии легочной артерии смертельная развивается в 37,5% (Баешко А.А., 2000; Бондаренко А.В., 2003; Гордеев Н.А., 2003; Савельев В.С., 2005; Фокин Ал.Ан., 2005). Легочная тромбоэмболия стала одной из основных причин послеоперационной летальности, особенно в травматологии и ортопедии, и вышла на первое место среди причин материнской смертности.
У 20-45% больных после перенесенной тромбоэмболии легочной артерии развивается хроническая постэмболическая легочная гипертензия, которая в течение 5 лет уносит жизни 50-70% больных (Кириенко А.И. и соавт., 2004; Швальб П.Г., 2005). У 70% пациентов развивается посттромбофлебитический синдром (Баешко А.А., 2000), который в 1,5-2% случаев приводит к образованию трофических язв (Nicolaides A.N., 2001), а в 40-80% случаев – к потере трудоспособности (Яблоков Е.Г. и соавт., 1999). Отмечаются также огромные экономические затраты на лечение больных данной категории (Савельев В.С., 2005). Острые венозные тромбозы занимают одно из первых мест среди наиболее грозных заболеваний. Для сравнения, так называемые социально значимые инфекции обнаруживаются гораздо реже (вирусный гепатит – 196 тыс, туберкулез – 127 тыс, носители ВИЧ – 71 тыс).
Нередко осложняет ситуацию латентное течение флеботромбоза, когда правильный диагноз устанавливается уже при осложнениях основного заболевания в виде тромбоэмболии легочной артерии.
Несовершенство диагностики острого флеботромбоза и отсутствие стандартизации тактики его лечения приводит к значительному числу рецидивов тромбоза, тромбоэмболии легочной артериии и увеличению числа больных с тяжелыми формами хронической венозной недостаточности.
Это диктует необходимость разработки эффективных методов диагностики тромботического процесса и воздействия на все звенья его патогенеза, включая оперативную профилактику ТЭЛА.
Цель исследования. Изучить основные закономерности нарушений функционального состояния системы гемостаза и системной гемодинамики, разработать и дать патогенетическое обоснование применению комплексного лечебно-профилактического воздействия и новых методов хирургической коррекции при венозных тромбозах в системе нижней полой вены для улучшения непосредственных и отдаленных результатов лечения.
Задачи исследования:
1. Выявить специфические ультрасонографические критерии преобразования тромба при остром флеботромбозе в системе нижней полой вены с использованием функции гистограмм.
2. Дать патогенетическое обоснование достоверности ультрасонографических критериев динамики тромботического процесса с использованием экспериментальной модели венозного тромбоза.
3. Разработать алгоритм тактики ведения больных с острым флеботромбозом в системе нижней полой вены в зависимости от ультрасонографических критериев.
4. Изучить характер изменений функционального состояния сосудисто-тромбоцитарного, коагуляционного компонентов системы гемостаза и фибринолиза у больных с острым флеботромбозом в системе нижней полой вены по общепринятой методике и с использованием анализатора реологических свойств крови АРП-01 «Меднорд».
5. Выявить изменения компонентов системы гемостаза и фибринолиза с использованием анализатора реологических свойств крови АРП-01 «Меднорд» у больных с острым флеботромбозом в системе нижней полой вены после проведения курса комплексного лечения.
6. Провести сравнительную оценку эффективности медикаментозной терапии и медикаментозной терапии в сочетании с дискретным плазмаферезом и гипербарической оксигенацией при лечении больных с венозными тромбозами.
7. Провести корреляционный анализ между ультрасонографическими критериями с использованием функции гистограмм и результатами гемостазиограмм с использованием анализатора реологических свойств крови АРП-01 «Меднорд» в динамике тромботического процесса у больных с острым флеботромбозом до и после лечения.
8. Разработать новую конструкцию из никелида титана для профилактики тромбоэмболии легочной артерии у больных с эмбологенными формами флеботромбоза и изучить эффективность ее применения.
9. Провести сравнительную оценку эффективности пликации нижней полой вены конструкцией из никелида титана и ручной кавапликации при профилактике тромбоэмболии легочной артерии.
Научная новизна. Теоретически обоснован, экспериментально доказан и клинически подтвержден новый метод ультрасонографической оценки степени активности процесса тромбообразования при острых флеботромбозах с использованием функции гистограмм, позволяющий определять динамику развития тромба на этапе его эхонегативной картины. На основании ультрасонографических критериев определены новые подходы и разработан алгоритм тактики ведения больных. Новизна исследования подтверждена Патентом РФ на изобретение № 2252706.
Предложен принципиально новый подход к определению степени активности процесса тромбообразования при остром флеботромбозе, основанный на оценке характера изменений функционального состояния компонентов системы гемостаза и фибринолиза. Разработан новый способ диагностики изменений системы регуляции агрегатного состояния крови при данном патологическом процессе, позволяющий выявлять степень ее повреждения, определять объем проводимого лечения и прогнозировать дальнейшее течение болезни. Путем проведения корреляционного анализа доказана закономерность изменений степени активности тромбообразования на основании ультрасонографических критериев и стадии патологического процесса системы регуляции агрегатного состояния крови на основании результатов гемостазиограмм.
Разработан и клинически подтвержден высокоэффективный комплексный подход к лечению больных с острым флеботромбозом в системе нижней полой вены, заключающийся в сочетании стандартной медикаментозной терапии с дискретным плазмаферезом и гипербарической оксигенацией.
Теоретически обоснована, экспериментально доказана и подтверждена клиническими испытаниями высокая эффективность нового способа профилактики тромбоэмболии легочной артерии при эмбологенных формах флеботромбозов в системе нижней полой вены с использованием конструкции из никелида титана. Новизна исследования подтверждена Патентом РФ на изобретение № 2211675.
Практическая значимость. Разработанный и внедренный в клиническую практику метод определения тактики ведения больных с острыми флеботромбозами в зависимости от степени активности процесса тромбообразования позволил снизить развитие тромбоэмболии легочной артерии в 4 раза.
Деление больных с острыми флеботромбозами по стадиям патологического состояния системы регуляции агрегатного состояния крови позволило прогнозировать течение тромботического процесса. Зависящая от этого тактика ведения пациентов в сочетании с комплексным лечением позволила в 5 раз снизить летальность, в 8,5 раза – случаи тромбоэмболии легочной артерии, в 6,1 раза – случаи ретромбоза.
Внедрение в клиническую практику способа профилактики ТЭЛА клипсой из никелида титана позволило предотвратить тромбоэмболические осложнения, в 5 раз снизить количество ретромбозов, в 3,9 раза - развитие хронической венозной недостаточности в отдаленном послеоперационном периоде.
Положения, выносимые на защиту:
1. Ультрасонографическое исследование с использованием функции гистограмм является объективным способом диагностики острого флеботромбоза и определения степени активности тромбообразования в зависимости от качественной характеристики тромба; позволяет определять тактику лечения и оценивать эффективность проводимой терапии у больных с острыми флеботромбозами в системе нижней полой вены.
2. Отсутствие значимых патологических изменений в показателях системы гемокоагуляции у больных с венозными тромбозами свидетельствуют о стадии компенсации; достоверно повышенная активность сосудисто-тромбоцитарного и коагуляционного компонентов системы гемостаза при неизмененном фибринолизе характерна для стадии субкомпенсации; наличие угнетения активности сосудисто-тромбоцитарного и коагуляционного компонентов системы гемостаза на фоне активизированного фибринолиза является признаком декомпенсации; выраженная активация фибринолиза с преобладанием его над свертыванием крови говорит об условно-необратимой стадии декомпенсации системы РАСК.
3. Комплексный метод лечения острого флеботромбоза в системе НПВ, включающий медикаментозную терапию, дискретный плазмаферез и ГБО, является эффективным и патогенетически обоснованным видом консервативной терапии; может применяться в качестве лечения, проводимого в до и послеоперационном периоде.
4. Динамика морфологического преобразования тромба по данным ультрасонографических исследований с применением функции гистограмм коррелирует с изменением показателей гемостазиограмм при остром флеботромбозе.
5. Экстравазальная кава-, илиопликация оригинальной клипсой из никелида титана надежно предотвращает ТЭЛА при эмболоопасных формах флеботромбоза, не вызывая гемодинамического сопротивления, и снижает частоту развития выраженной хронической венозной недостаточности в отдаленном послеоперационном периоде.
Реализация результатов исследования. Разработанная тактика ведения больных с острым флеботромбозом в системе нижней полой вены внедрена в работу отделения сосудистой хирургии Томской областной клинической больницы, клиники госпитальной хирургии им. А.Г.Савиных Сибирского государственного медицинского университета. Результаты работы используются в научной и практической деятельности сотрудников кафедр факультетской и госпитальной хирургии Сибирского государственного медицинского университета. Результаты научных изысканий включены в учебный процесс указанных кафедр. По материалам исследования получено 2 патента Российской Федерации.
Апробация диссертации. Основные положения работы были доложены и обсуждались на IХ Всероссийском съезде хирургов, Волгоград, 2000 г.; международной конференции «Биосовместимые материалы и имплантаты с памятью формы», Томск, 2001 г.; 12-ой международной конференции Российского общества ангиологов и сосудистых хирургов, Казань, 2001 г.; научно-практической конференции областной клинической больницы, Томск, 2001, 2002, 2003 гг.; 13-ой международной конференции Российского общества ангиологов и сосудистых хирургов, Ярославль, 2002 г.; 14-ой международной конференции Российского общества ангиологов и сосудистых хирургов, Ростов-на-Дону, 2003 г.; заседании Томского областного общества хирургов, 2003 г.; 15-ой международной конференции Российского общества ангиологов и сосудистых хирургов, Петрозаводск, 2004 г.; международной конференции «Биосовместимые материалы и новые технологии в медицине», Томск, 2004 г.; заседаниях кафедр факультетской и госпитальной хирургии, СибГМУ, 2004 г.; 16-ой международной конференции Российского общества ангиологов и сосудистых хирургов, Москва, 2005 г.; областной научно-практической конференции «Актуальные проблемы клинических исследований агрегатного состояния крови», Томск, 2005 г.; Съезде хирургов Сибири и Дальнего Востока, Улан-Удэ, 2005 г.
Публикации. По материалам диссертации опубликовано 24 печатных работы, из них 7 в центральных рецензируемых изданиях, 2 патента РФ на изобретения, 1 учебно-методическое пособие, 14 работ в местной печати.
Структура и объем диссертации. Диссертация изложена на 298 страницах машинописного текста, иллюстрирована 67 рисунками и 60 таблицами. Работа состоит из введения, 6 глав, заключения, выводов, практических рекомендаций и списка использованной литературы. Библиографический указатель содержит 246 отечественных и 144 иностранных источника литературы.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Материал и методы исследования
- Экспериментальные объекты и методы исследования
Экспериментальный раздел работы был выполнен на животных в Центральной научно-исследовательской лаборатории Сибирского государственного медицинского университета в отделе экспериментальной хирургии и патофизиологии животных. Гистологические исследования выполнены на базе кафедры патологической анатомии Сибирского государственного медицинского университета.
Эксперименты проводились на 45 беспородных собаках обоего пола в возрасте от 2 до 3 лет весом 12-25 кг (возраст определялся по таблице состояния зубов, разработанной И.П.Западнюком) и 25 кроликах весом до 3 кг, находившихся до и после операции в обычных условиях вивария. Для всех животных подготовка к операции, анестезиологическое пособие и ведение послеоперационного периода были однотипными соответственно. Все оперативные вмешательства на собаках, согласно приказам МЗ СССР №742 от 13.11.1984г. «Об утверждении правил проведения работ с использованием экспериментальных животных» и №48 от 23.01.85г. «О контроле за проведением работ с использованием экспериментальных животных» выполнялись под общей анестезией. За день до операции животных не кормили. С целью премедикации в/м вводили лекарственный коктейль следующего состава: дроперидол 0,5 мг/кг, димедрол 1,5 мг/кг, анальгин 50-60 мг/кг, атропин 0,1 мг/кг. Через 25-30 минут животных брали на операционный стол. Наркоз достигался путем внутриплеврального введения 2% раствора гексенала с последующей интубацией и переводом на искусственную вентиляцию легких (ИВЛ). Для поддержания необходимой глубины наркоза повторяли введение гексенала из расчета 20 мг/кг в/в. Операционное поле выбривали и обрабатывали по Гроссиху-Филончикову. После проведения срединной лапаротомии вскрывали задний листок брюшины над инфраренальным отделом каудальной вены. В зоне выделенного сегмента экстравазально накладывали клипсу. Сразу после установки клипсы на каудальную вену и спустя 3 месяца аппаратом Вальдмана измеряли венозное давление проксимальнее и дистальнее стенозированного участка, оценивая пропускную способность тока крови через зону кава-клипсы. Задерживающая способность стеноза для эмболов проверялась моделированием последних в виде поролоновых конкрементов диаметром 3 мм и более, импрегнированных тразографом и помещенных в дистальные участки магистральных вен. За время операции животному в/в вводили 500-700 мл изотонического раствора, 5% раствора глюкозы. После окончания опыта в/м вводили 4-6 мл 50% раствора анальгина, 2-3 мл 1% раствора димедрола. Во время операции, после нее, при выведении животных из эксперимента осуществляли электрокардиографию, выполнялась флебография.
Животных выводили из эксперимента через 7 суток, 1; 1,5; 3; 6 месяцев после установки клипсы. При выведении животных из эксперимента выполнялся наркоз по выше описанной методике. Производилась лапаротомия, мобилизация каудальной вены с имплантатом. Оценивались положение клипсы на вене, изменение самой вены (наличие деформации, стеноза, кинкинга). Эвтаназия проводилась болюсным в/в введением 10% раствора тиопентала натрия в количестве 1,0г сухого вещества. Для изучения морфологических изменений в зоне операции иссекали участок каудальной вены вместе с экстравазальным устройством. Препараты окрашивали гематоксилином, эозином и по Ван-Гизону.
Экспериментальный раздел работы по моделированию острого флеботромбоза выполнен на кафедре морфологии и общей патологии медико-биологического факультета СибГМУ. Исследования проведены на 25 кроликах весом от 2,5 до 3 кг. Острый флеботромбоз вызывали введением с помощью инсулинового шприца раствора этоксисклерола 1%-0,5 мл в краевую вену уха и вены бедра. После возникновения флеботромбоза осуществляли ультрасонографический контроль с применением стандартной методики обследования и добавлением функции гистограмм. Первое исследование проводили через 30 минут после формирования тромба, последующие – через 24 часа, 2, 4, 7 суток. В эти же сроки под местной инфильтрационной анестезией 0,5% раствором новокаина в количестве до 10,0 мл после соответствующей обработки операционного поля производили забор исследуемого материала – резецировали сегмент тромбированной вены с последующим его морфологическим исследованием. Выведенные из эксперимента животные помещались обратно в виварий. Материал фиксировали в 10% растворе нейтрального формалина в герметично закрытых флаконах, в последующем заливали в парафин. Далее на ротационном микротоме готовили срезы толщиной 3-5 мкм. Срезы окрашивали гематоксилином и эозином, по Шуенинову на фибрин и по Ван-Гизону на соединительную ткань. Все препараты изучали на микроскопах «NEOVAR» (Австрия) и «KARL CEYTS» (Германия). Для микрофотографий использовали цифровую фотокамеру «MINOLTA» с проецированием изображения на компьютер «Pentium 4» и принтер «Canon LBP-80».
Количество ядросодержащих клеток на единицу площади и индекс кровяного сгустка рассчитывали с помощью компьютерных программ. Изображение получали со светового микроскопа фирмы Reichert (Австрия) при помощи цифровой фотокамеры Casio QV-100. Полученные изображения переносили в компьютер, используя программу QV-Link. Подготовку изображения и его анализ проводили с использованием программы ImageJ (USA). Подготовленное изображение анализировали и получали численные данные о нем. Определяли следующие параметры: площадь, среднюю яркость, стандартное отклонение значений яркости, минимальный и максимальный уровни яркости и периметр. (Шилов Борис Владимирович, «Компьютерный морфометрический анализ структуры ядер лимфоцитов периферической крови человека в норме и при Эпштейн-Барр вирусной инфекции в условиях IN VIVO и IN VITRO»).
- Клинические объекты и методы исследований
В работе анализируются результаты обследования и лечения 576 больных с острыми венозными тромбозами в системе нижней полой вены, находившихся на лечении в клиниках СибГМУ, отделениях сосудистой хирургии и травматологии ГОУЗ ТОКБ за период с 1994 по 2005 годы.
Исследования носили рандомизированный характер. Среди больных было 359(62,3%) женщин и 217(37,7%) мужчин. Средний возраст 53,3±3,6 г. 488(84,7%) пациентов - лица трудоспособного возраста. По срокам госпитализации больные распределялись следующим образом: до суток – 95(16,5%); 2-5-ые сут – 313(54,3%); 6-10-ые сут – 134(23,3) и более 10 сут- 34(5,9%).
Всем больным при поступлении и в ходе динамического наблюдения проводилось ультрасонографическое исследование вен нижних конечностей с использованием функции гистограмм. Все пациенты на основании определения коэффициента плотности тромба разделены нами на три группы в зависимости от степени активности тромбообразования. В группу пациентов с I степенью активности тромбообразования вошли 229 (39,8%) человек. Группу пациентов со II степенью активности тромбообразования составили 243 (42,2%) человека. Группа больных с III степенью активности тромбообразования представлена 104 (18%) пациентами.
Все пациенты с острым флеботромбозом в системе НПВ в зависимости от варианта нарушения функционального состояния компонентов системы гемостаза и фибринолиза, определенных с помощью коагулографии, исследования обратимой агрегации эритроцитов, агрегации тромбоцитов и гемостазиографии, разделены на 4 группы: компенсированную, субкомпенсированную, декомпенсированную и декомпенсированную условно необратимую стадии патологического процесса системы РАСК (таб.1).
Таблица 1
Распределение больных с острым флеботромбозом по стадиям патологического процесса системы регуляции агрегатного состояния крови
| Стадия | Количество больных |
| Компенсация | 157(27,3%) |
| Субкомпенсация | 232(40,3%) |
| Декомпенсация | 179(31,0%) |
| Декомпенсация условно обратимая | 8(1,4%) |
| Итого | 576(100%) |
Все больные с острым флеботромбозом, которым проводились только консервативные методы лечения, разделены нами на две группы (таб.2).
Таблица 2
Распределение больных с острым флеботромбозом в системе нижней полой
вены по методам проведения консервативной терапии
| Группы | Метод лечения | Кол-во больных | % |
| Основная (n=212) | Медикаментозная терапия + ГБО | 44 | 21% |
| Медикаментозная терапия + ПФ | 60 | 28% | |
| Медикаментозная терапия + ГБО + ПФ (комплексное лечение) | 108 | 51% | |
| Итого | 212 | 100% | |
| Контрольная (n=277) | Медикаментозная терапия | 277 | 100% |
В контрольную группу вошли 277 пациентов, получавших традиционную медикаментозную терапию. Всем больным с целью прекращения прогрессирования тромбоза проводилась антикоагулянтная терапия, включающая нефракционированный гепарин (НФГ) или низкомолекулярный гепарин (НМГ) – фраксипарин в терапевтической дозе 20000-30000 ЕД/сут и 1,2 мл/сут соответственно с дальнейшим переводом на непрямые антикоагулянты. Для улучшения микроциркуляции крови, снижения ее вязкости, уменьшения агрегации форменных элементов крови, повышения эластичности эритроцитов назначали гемореологически активные средства: реополиглюкин 400-800 мл/сут, пентоксифиллин (трентал) 0,1 г/сут, аспирин до 0,15 г/сут. Назначали препараты, улучшающие венозный и лимфатический отток, уменьшающие проницаемость капилляров, повышающие тонус стенок вен – детралекс 1т 2р/сут. Неспецифические противовоспалительные препараты (диклофенак) применяли с целью снижения воспалительной реакции в сосудистой стенке и уменьшения болевого синдрома. Также проводилось местное лечение, назначался постельный режим в течение 5-7 сут и эластическая компрессия.
Основную группу составили 212 пациентов, получавших кроме стандартной медикаментозной терапии, подобной контрольной группе, дополнительные методы лечебного воздействия в виде дискретного плазмафереза и гипербарической оксигенации (таб.2).
Все больные в зависимости от оперативного метода профилактики ТЭЛА разделены на две группы (таб.3).
Таблица 3
Распределение больных по группам и методам оперативного вмешательства
| Группы | Вид операции | Кол-во больных |
| Основная (n=52) | Кавапликация + тромбэктомия | 19(10)* |
| Илиопликация + тромбэктомия | 23(7)* | |
| Перевязка НПВ | 4 | |
| Перевязка подвздошной вены | 6 | |
| Итого | 52 | |
| Контрольная (n=35) | Тромбэктомия | 11 |
| Ручная кавапликация + тромбэктомия | 7(5)* | |
| Перевязка НПВ | 6 | |
| Перевязка подвздошной вены | 11 | |
| Итого | 35 |
Примечание: * - в скобках указано количество тромбэктомий при пликациях вен
1-ая группа – контрольная (35 человек), включала в себя больных, которым выполнялись оперативные вмешательства в объеме тромбэктомии, тромбэктомии с последующей ручной кавапликацией (метод Spencer), а также перевязка НПВ и подвздошных вен. В качестве шовного материала при лигировании магистральных вен использовалась полифиламентная лавсановая нить, а при парциальной окклюзии НПВ не рассасывающуюся монофиламентную нить PROLENE 5/0.
Ведение раннего послеоперационного периода у всех больных заключалось в ранней активизации пациента, эластической компрессии нижних конечностей, назначении антикоагулянтной терапии, включающей НФГ в дозе 20000-30000 ЕД/сут или НМГ (фраксипарин) 0,3-0,6 мл/сут с последующим переводом на непрямые антикоагулянты (варфарин, фенилин), флеботропных препаратов, препаратов, улучшающих микроциркуляцию, а также симптоматической терапии.
2-ая группа – основная (52 человека), состояла из больных, которым проводился следующий объем оперативных вмешательств: кавапликация с тромбэктомией или без нее; илиопликация с тромбэктомией или без нее; в исключительных случаях перевязка нижней полой вены в инфраренальном ее отделе или подвздошной вены, дополняющиеся методами комплексной консервативной терапии.
- Лабораторные исследования
Система гемостаза исследовалась в динамике с использованием следующих тестов: подсчет тромбоцитов крови при помощи фазово-контрастной микроскопии; время свертывания крови классическим методом по R.I.Lee, P.D.White (1913); активированное частичное тромбопластиновое время по I.Caer с соавт. (1968); протромбиновое время по Quik; протромбиновый индекс по Туголукову. Из общих коагуляционных тестов применяли определение времени рекальцификации цитратной плазмы по Howell с использованием 0,1 мл хлорида кальция и определение толерантности плазмы к гепарину по Sigg с использованием раствора гепарина (5000 ед/мл) фирмы «J.Richter». Конечный этап свертывания крови исследовали, определяя тромбиновое время по Macfarlane с использованием свежеприготовленного раствора тромбина в буфере Михаэлиса (pH=7,3) активностью 15-17 с. Определяли концентрацию общего фибриногена гравиметрическим методом по Р.А.Рутберг. Определение фибриногена «В» проводили по методу Cummine et Lyons в количественной модификации Х.Д.Ломазовой.
- Инструментальные исследования
Ультразвуковое исследование венозной системы с использованием функции гистограмм проводилось на аппаратах «Combison-530» (Австрия) и «ALOKA SSD-1700» (Япония). Для повышения качества визуализации исследование проводили через толстый слой геля (гелиевую подушку). Использовали линейный трансдьюссер с рабочей частотой 7,5 МГц и 5-11 МГц. При описании венозных тромбозов обращали внимание на стадию тромботического процесса: острую, подострую, хроническую (подразумевая стадию уже сформированного посттромботического синдрома), оценивали его локализацию, протяженность, степень нарушения проходимости просвета сосуда, эхо-структуру тромботических масс в В-режиме, состояние гемодинамики в области тромбоза и проксимальнее ее. Использование функции гистограмм осуществляло вывод эхосигнала на произвольном участке и показывало распределение интенсивности на ограниченном трассировкой месте локализации тромба.
По расчетной формуле определялся средний уровень интенсивности на участке дефекта кровенаполнения (формула расчета заложена в программу сканирования). Средний уровень интенсивности (MN) отражал коэффициент плотности различных тканей на заданном участке. Изменение этого показателя при сканировании на одном участке в различные временные промежутки позволяло оценивать динамику плотности эхонегативного тромба и судить о происходящих в нем изменениях.
Флебографические исследования проводились в ангиоблоке областной клинической больницы на рентгеновском аппарате CHIRALUX фирмы CHIRANA c сериографической приставкой. С целью выявления уровня локализации и протяженности тромботического процесса, а также степени обтурации использовали антеградный путь контрастирования магистральных вен. Антеградная бедренная флебография осуществлялась чресподколенным доступом. Пункцию подколенной вены осуществляли в стандартной точке, при невозможности обнаружения последней проекцию вены маркировали при проведении ультразвукового исследования. Инъецировали 10-20 мл контрастного вещества со скоростью 5-10 мл/с. В качестве контраста использовался 76% раствор урографина. Выполнялась серия флебограмм в течение 5-6 секунд. Для оценки проходимости магистральной вены (общей бедренной, подвздошной) при ее тромботическом поражении, выявления коллатерального кровотока, а также для оценки проходимости общей подвздошной и нижней полой вен после проведения оперативного вмешательства в объеме кава-, илиопликации выполнялась антеградная пункционная чрезбедренная флебография, либо антеградная чрезбедренная флебография по методике Сельдингера. В вену со скоростью 10-12 мл/с вводили 30-40 мл 76% урографина. Выполняли серию рентгенограмм продолжительностью 3-5 с по 1 снимку в секунду. Скорость и объем введения контраста регулировался автоматическим дозатором TUR-DZ-12.
Агрегационные свойства тромбоцитов исследовали фотометрическим методом с графической регистрацией по Born (1963) с помощью анализатора агрегации тромбоцитов АТ-02, сопряженного с самописцем Н-3092. Сущность метода основывалась на регистрации изменения оптической плотности плазмы крови под действием агрегирующего агента. Тест выполняли следующим образом. После забора 8 мл крови из кубитальной вены стабилизировали ее добавлением цитрата натрия 3,8% - 2,0 мл. Затем для получения плазмы, богатой тромбоцитами, центрифугировали стабилизированную цельную кровь при 1500 об/мин в течение 7 мин при комнатной температуре. Плазму, бедную тромбоцитами (бестромбоцитную) получали после центрифугирования стабилизированной цельной крови при 1500 об/мин в течение 30 минут. В качестве агрегирующего агента использовали раствор аденозиндифосфата (АДФ) фирмы «Технология-Стандарт» в различных концентрациях. Всего готовилось 4 рабочих раствора АДФ в конечных концентрациях: 10 мкг/мл; 5 мкг/мл; 2,5 мкг/мл и 1,25 мкг/мл. Оценивали показатели: спонтанную агрегацию, латентный период, скорость агрегации, максимальную амплитуду агрегации и амплитуду дезагрегации.
Определение обратимой агрегации эритроцитов (ОАЭ) проводили фотометрическим методом в микрокювете. В основе определения прочности эритроцитарных агрегатов лежал принцип прочности агрегатов, который характеризовался величиной напряжения сдвига, необходимой для полной дезагрегации эритроцитов. Степень дезагрегации контролировалась микроскопированием и фотометрированием. Определяли амплитуду фотометрического сигнала, полупериод агрегации, минимальную и максимальную прочность агрегатов, а также индекс агрегации.
Комплексный анализ реологических характеристик цельной крови с возможностью оценки сосудисто-тромбоцитарного компонента гемостаза, основных этапов гемокоагуляции и активности фибринолитической системы осуществляли методом низкочастотной вибрационной гемостазиографии с применением портативного анализатора реологических свойств крови АРП-01 «Меднорд», регистрирующего даже незначительные изменения агрегатного состояния крови, отражающие внутренние процессы при свертывании, ретракции и лизисе сгустка. При исследовании строилась графическая кривая, рассчитывались амплитудные и хронометрические константы An, Ar, r, k, KK, AM, T, F, характеризующие агрегацию тромбоцитов, основные этапы гемокоагуляции и фибринолиза. Построение графика изменений агрегатного состояния крови осуществлялись в системе координат, где по оси абсцисс отражалось время исследования в минутах, а по оси ординат – амплитуда в относительных единицах (рис.1).

Рис.1. Интегральная гемостазиограмма здоровых добровольцев
Принцип работы прибора заключается в непрерывной регистрации изменений агрегатного состояния крови при ее свертывании за счет регистрации изменения сопротивления исследуемой среды резонансным колебаниям иглы, закрепленной на камертоне и опущенной в стакан с пробой крови пациента.
Оценивались показатели, характеризующие реологические свойства цельной нестабилизированной крови: An – «начальный показатель» агрегатного состояния крови; показатели, характеризующие агрегационную активность тромбоцитов: Ar - «интенсивность агрегации»; показатели, характеризующие процесс образования протромбиназы, активации протромбина и образования тромбина: R - «время реакции»; показатели, характеризующие интенсивность тромбинообразования и процесс полимеризации фибрина: k - «константа тромбина»; показатели, характеризующие физико-химические свойства сгустка: АМ – показатель «фибринтромбоцитарной константы» крови, Т – показатель «начала лизиса»; показатели, характеризующие процесс ретракции сгустка и функциональное состояние фибринолитической системы: показатель ретракции и спонтанного лизиса сгустка – F.
- Методика проведения плазмафереза
Курс лечения методом плазмафереза включал 3 сеанса, проводимые с интервалом 48 часов. Объем эксфузируемой плазмы составлял 430±50 мл за сеанс, за курс лечения - составлял в среднем 1200±100 мл. Сеансы плазмафереза проводили в специально оборудованном кабинете с наличием функциональной кровати. Материалы и инструменты проходили стерилизацию методом автоклавирования. Перед процедурой измеряли артериальное давление, пульс, частоту дыхательных движений. Забор крови производился из кубитальных вен через иглу системы «Гемакон» в количестве 800±50 мл (по 400 мл крови в один пакет с гемаконом). Пакеты взвешивали и центрифугировали со скоростью 1500 об/мин в течение 15 минут. Во время центрифугирования крови через эту же иглу больному внутривенно вводили физиологический раствор в количестве до 400 мл или реополиглюкин. Пациентам с декомпенсированной стадией нарушения функционального состояния системы гемостаза и фибринолиза вводили свежезамороженную плазму в том же количестве. После центрифугирования плазму удаляли, взвешивали оставшуюся эритромассу. После чего в пакет с эритромассой добавляли 50 мл физиологического раствора и реинфузировали больному.
- Методика проведения гипербарической оксигенации
Сеансы оксигенобаротерапии проводились в барокамере «Ока-МТ». Лечение гипербарическим кислородом начинали с пробного сеанса при давлении 1,3-1,4 АТА и экспозиции 20-30 минут. Курс лечения проводился при рабочем давлении индивидуально подобранным для каждого больного путем «титрования» (постепенного от сеанса к сеансу повышения избыточного давления) под контролем клинических данных, артериального давления, пульса, дыхания. Сеансы ГБО проводились ежедневно в режиме 1,5-1,9 АТА (0,5-0,9 ати) продолжительностью 70 минут (15 мин – компрессия, 40 мин – изопрессия, 15 мин – декомпрессия). Все пациенты получали от 8 до 10 сеансов.
- Методы статистической обработки
Полученные данные подвергались статистической обработке при помощи программы STATISTICA 6.0. Количественные показатели представлены в виде X±m, где Х – среднее значение, а m – стандартная ошибка среднего. Для показателей, характеризующих качественные признаки, указывалось абсолютное число и относительная величина в процентах (%). При проверке совпадения законов распределения исследуемых количественных показателей с нормальным в группах пользовались критерием согласия Колмогорова-Смирнова. В случае нормального закона распределения достоверность различий показателей определяли при помощи t-критерия Стьюдента. Если закон распределения исследуемых числовых показателей отличался от нормального, достоверность различий проверяли при помощи U-критерия Манна – Уитни (попарные сравнения независимых совокупностей показателей), W-критерия Уилкоксона (попарные сравнения зависимых совокупностей показателей), Н-критерия Краскалла - Уоллиса (множественные сравнения независимых совокупностей данных) и критерия 2 (для сравнения качественных признаков). Различия считали достоверными при p<0,05. Для определения существования корреляций между параметрами вычисляли коэффициент корреляции r Пирсона, который считали достоверным при p<0,05.
Результаты исследования и их обсуждение
Эмпирическим путем на основании ретроспективного анализа данных ультрасонографической картины, показателей функции гистограмм, вариантов течения тромботического процесса и исходов заболевания все больные в зависимости от значений коэффициента плотности тромба были разделены на три группы. Коэффициент плотности (MN) в пределах 1,5 – 10,0 усл.ед. определен нами как I степень активности тромбообразования. Коэффициент плотности 10,1 – 15,0 усл.ед. - II степень активности, 15,0 усл.ед. и более – III степень активности соответственно.
В контрольную группу вошли 30 здоровых добровольцев, коэффициент плотности (MN) исследуемой крови которых на заданном участке составил 1,20±0,15 усл.ед., что соответствовало данным исследований крови в обычном состоянии.
При статистической обработке данных ультрасонографических исследований с функцией гистограмм выявлено распределение коэффициентов плотности тромба по трем группам с достоверными различиями между средними величинами каждой из степеней (рис.2).

Рис.2. Величина численного эквивалента коэффициента плотности тромба у пациентов с разной степенью активности тромбообразования
Далее нами был проведен экспериментальный раздел работы, позволяющий установить и объяснить меняющуюся в динамике плотность тромба. Для этого на лабораторных животных (25 кроликах) была создана экспериментальная модель острого флеботромбоза путем введения в краевую вену уха или бедренную вену флебосклерозирующего препарата. Динамика тромботического процесса оценивалась через 30 минут после формирования тромба и на 1, 2, 4 и 7-ые сутки. Проводилось ультрасонографическое исследование тромбированных вен с последующим морфологическим изучением иссеченных венозных сегментов.
Проведенный анализ коэффициента плотности тромба экспериментальных животных подтвердил данные ультрасонографических исследований пациентов с острым флеботромбозом. При анализе результатов морфологического исследования I степень активности тромбообразования соответствовала начальной стадии формирования тромба (стадии «красного тромба»), II степень – стадии клеточной инфильтрации, III степень – стадии образования соединительной ткани.
При проведении морфологического исследования с помощью компьютерных программ рассчитали количество ядросодержащих клеток на единицу площади тромбированного сосуда и индекс кровяного сгустка при разных степенях активности тромбообразования. В результате исследования установлено, что при I степени активности количество ядросодержащих клеток на единицу площади сосуда минимальное (41,2±4,5). При II степени активности тромбообразования клеточный состав тромба достоверно увеличивается (524,3±32,7). Отличается количественный клеточный состав и при III степени активности тромбообразования (1078,2±32,3).
Исходя из результатов распределения коэффициента плотности тромба MN и количества ядросодержащих клеток в просвете тромбированного сосуда по степеням активности тромбообразования, нами проведен корреляционный анализ между данными величинами, который продемонстрировал наличие значимой положительной связи между этими показателями и трех групп объектов исследования по регрессионной прямой, соответствующих трем степеням активности (рис.3).
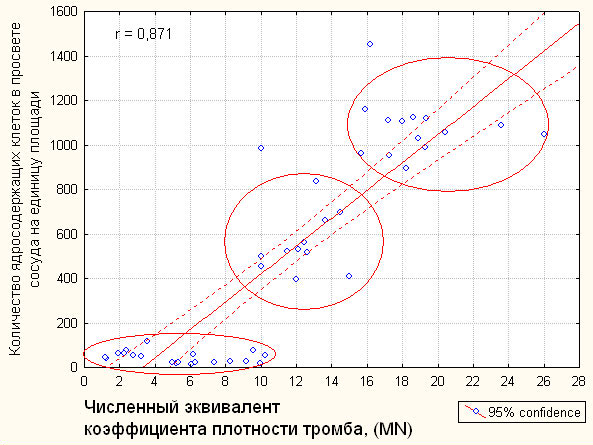
Рис.3. Корреляция количества ядросодержащих клеток на единицу площади сосуда и численного эквивалента коэффициента плотности тромба
Таким образом, коэффициент плотности МN при ультрасонографическом исследовании с использованием метода гистограмм отражал морфологическое состояние тромба.
На основании вышеизложенных данных нами предложен следующий алгоритм в решении диагностических задач и выборе лечебной тактики у больных с острым флеботромбозом в системе нижней полой вены. При подозрении на острый флеботромбоз выполняются стандартные методики, подтверждающие наличие тромба. После чего осуществляется определение коэффициента плотности тромба. В зависимости от этого показателя определяется лечебная тактика (рис.4).
При I степени активности тромбообразования в случае отсутствия роста показателя MN или его уменьшения тактика хирурга склоняется в сторону оперативного вмешательства. При увеличении показателя MN продолжается консервативное лечение. При II степени активности тромбообразования увеличение MN говорит о стабилизации процесса - уплотнении тромба, Отсутствие динамики MN позволяет продолжать консервативное лечение, принимая во внимание клинические проявления заболевания. При уменьшении MN вопрос должен решаться в пользу оперативного лечения. При III степени активности тромбообразования тактика ведения должна склоняться в сторону проведения консервативной терапии.

Рис.4. Алгоритм тактики ведения больного с острым флеботромбозом в зависимости от ультрасонографических критериев
При анализе результатов диагностики и лечения пациентов на основании предложенного алгоритма тромбоэмболия легочной артерии в контрольной группе выявлена у 21(7,6%) пациента, а в основной группе - у 4(1,9%). Что позволило снизить развитие ТЭЛА в 4 раза.
Учитывая проблему эффективности лечения тромботического процесса, важным моментом является выяснение факторов, способствующих венозному тромбозу. Как показывает практика, в большинстве случаев удается установить причину тромботического состояния. Но встречаются и так называемые идиопатические флеботромбозы. Благодаря развитию усовершенствованных лабораторных методов диагностики, в последние годы категория таких больных уменьшилась почти в три раза.
В связи с неоднозначной оценкой состояния системы РАСК по одному из лабораторных критериев, мы дали системную интерпретацию нарушений разных звеньев гемостаза при остром флеботромбозе на основании комплекса исследований, включающих гемокоагулографию, исследование обратимой агрегации эритроцитов, агрегации тромбоцитов и гемостазиографию с использованием анализатора реологических свойств крови АРП-01 «Меднорд», и, таким образом, попытались раскрыть закономерность внутренних изменений свертывающей системы крови.
Исследование динамики показателей, характеризующих функциональное состояние компонентов системы гемостаза и фибринолиза, было выполнено у 576 больных с острым флеботромбозом разной локализации в системе нижней полой вены. Изменения показателей в каждой из групп сравнивались с показателями 30 здоровых добровольцев, что позволило установить степень отклонения исследуемых параметров от варианта нормы.
По результатам данных исследований все пациенты были разделены нами на 4 группы в зависимости от стадии патологического состояния системы РАСК:
- отсутствие значимых патологических изменений в сосудисто-тромбоцитарном, коагуляционном компонентах системы гемостаза при неизмененном фибринолизе у больных с острым флеботромбозом указывало на стадию компенсации;
- достоверно повышенная функциональная активность сосудисто-тромбоцитарного и коагуляционного компонентов системы гемостаза при угнетенном фибринолизе свойственна стадии субкомпенсации;
- наличие угнетения активности сосудисто-тромбоцитарного и коагуляционного компонентов системы гемостаза на фоне активизированного фибринолиза являлось признаком декомпенсации расстройств системы РАСК;
- выраженная активация фибринолиза с преобладанием его над свертыванием крови, клиническая манифестация тромбогеморрагического синдрома являлись условно-необратимой стадией декомпенсации патологического состояния системы гемостаза.
Т.о., деление патологического состояния системы РАСК на стадии возможно вследствие последовательного истощения компенсаторных механизмов, что приводит к развитию ДВС-синдрома. На основании этого мы заключили, что наиболее перспективный подход к профилактике тромботических осложнений лежит в оценке функционального состояния компонентов системы гемостаза и фибринолиза. А своевременность проведения подобных диагностических мероприятий дает возможность адекватного лечения больных с острым флеботромбозом, что является действенной мерой профилактики ДВС-синдрома и тромбоэмболии легочной артерии.
Исходя из деления больных с венозными тромбозами на стадии патологического процесса системы РАСК, мы разработали патогенетически обоснованный комплексный подход к лечению больных данной категории.
Все больные с острым флеботромбозом, которым проводились только консервативные методы лечения, разделены нами на две группы. В контрольную группу вошли 277 пациентов, получавших традиционную медикаментозную терапию. Основную группу составили 212 пациентов, получавших кроме стандартной медикаментозной терапии, дополнительные методы лечебного воздействия. В виду чего данная группа была разделена нами на 3 подгруппы: 44(21%) пациента прошли курс ГБО; 60(28%) человек – курс плазмафереза; 108(51%) – комплексное лечение, включающее перечисленные выше методы.
Назначение дискретного плазмафереза было обусловлено его специфическими эффектами: удалением экзогенных и эндогенных токсических веществ, выведением продуктов свободнорадикального окисления из организма, снижением вязкости крови, повышением деформируемости эритроцитов, снижением агрегационных характеристик эритроцитов и тромбоцитов, элиминация антигенов, антител, циркулирующих иммунных комплексов, уменьшением гиперкоагуляции и активацией фибринолиза (корригирующее влияние на компоненты ДВС-синдрома).
Гипербарическая оксигенация выбрана нами из соображений уникальных ее способностей ликвидировать кислородную недостаточность тканей без дополнительной мобилизации систем адаптации организма к кислородному голоданию и без стимуляции самой сердечно-сосудистой системы, нормализовывать энергетический баланс клетки, активировать биосинтетические и репаративные процессы, предупреждать образование токсических метаболитов и активировать их разрушения.
Т.о., мы сделали заключение, что плазмаферез и гипербарическая оксигенация, обладая выше перечисленными эффектами могут быть использованы в патогенетической терапии комплексного лечения острых венозных тромбозов.
Были получены следующие результаты. ГБО наиболее эффективно воздействует на сосудисто-тромбоцитарный гемостаз и фибринолиз, нормализуя показатели свертывающей системы в стадию компенсации, приближая к норме в стадию субкомпенсации. Максимально влияя на систему фибринолиза в стадию декомпенсации, изменяет в сторону нормализации показатели всех звеньев гемостаза.
Дискретный плазмаферез наиболее эффективно воздействует на фибринолитическую активность, мало изменяя показатели фибринолиза в стадию компенсации, нормализуя их в стадию субкомпенсации и максимально стремясь приблизить к норме в стадию декомпенсации. В меньшей степени по сравнению с ГБО плазмаферез улучшает показатели сосудисто-тромбоцитарного гемостаза. И наконец, достаточно эффективно воздействует на коагуляционный компонент системы гемостаза, превосходя действие гипербарической оксигенации на 2,5-8,5%.
Комплексное лечение больных с острым флеботромбозом оказывает выраженное положительное влияние на все звенья системы гемостаза и фибринолиза, нормализуя коагуляционный компонент при всех стадиях расстройств системы РАСК. Комплексное лечение обусловливает гипокоагуляционный сдвиг на 20-35% от исходного состояния. Снижает агрегационную активность тромбоцитов от 20 до 40% в зависимости от стадии патологического состояния системы РАСК. Комплексное лечение позволяет добиться регресса расстройств системы РАСК, путем повышения фибринолитической активности в стадии компенсации и субкомпенсации. Снижает высокий компенсированный фибринолиз в стадию декомпенсации при замене эксфузируемой плазмы плазмой донора. После проведения комплексного метода лечения уменьшается количество продуктов деградации фибрина, нормализуются структурно-реологические свойства крови, формируется фибрин-тромбоцитарная структура сгустка.
При сравнении эффективности воздействия различных методов консервативного лечения на свертывающую систему больных с острым флеботромбозом выявлено, что в стадию компенсации патологического состояния системы РАСК все применяемые методы по данным проводимых исследований одинаково эффективно нормализовали показатели системы гемостаза. В стадию субкомпенсации нормализация показателей происходила в основном под действием комплексного лечения. И наконец, в стадию декомпенсации всегда более других методов воздействия комплексное лечение приближало показатели к уровню здоровых добровольцев.
Т.о., комплексное лечение оказалось предпочтительным для всех 3-х групп обследуемых больных, не смотря на стадию патологического процесса системы РАСК.
Нами была проведена сравнительная оценка эффективности лечебных мероприятий в основной и контрольной группах.
Данные статистической обработки полученных результатов наглядно демонстрируют преимущества комплексного лечения над традиционной медикаментозной терапией. Так общее количество осложнений в основной группе составило 7,5% против 20,6% осложнений в контрольной группе, что в 2,7 раза превосходит результаты контрольной группы.
На фоне комплексного лечения тромбоэмболия легочной артерии зафиксирована всего у 1(0,9%) больного, а при проведении медикаментозной терапии – у 21(7,6%) пациента, что в 8,5 раз превышает показатель основной группы.
Особый эффект проявился в отношении рецидивов тромботического процесса. Количество рецидивов тромбоза при проведении комплексного лечения произошло в 2(1,9%) случаях, а при проведении медикаментозной терапии – в 32(11,6%) с разницей в 6,1 раза.
Количество зафиксированных больных с ДВС-синдромом относится к случаям условно необратимой стадии патологического состояния системы РАСК и поэтому одинаково неэффективно поддается коррекции различными методами лечения.
В основной группе отмечен 1(0,5%) летальный случай в отличие от контрольной группы, летальность в которой составила 7(2,5%).
Полученные результаты говорят о том, что патогенетически обоснованный комплексный подход в лечении больных с острым флеботромбозом в системе НПВ позволил ликвидировать случаи смертельного исхода, связанные с осложнениями заболевания, путем снижения количества самих осложнений: ТЭЛА – в 8,5 раза, ретромбоза – в 6,1 раза.
Нами осуществлялось наблюдение за пациентами, перенесшими острый флеботромбоз и проходившими различные курсы консервативной терапии. Ввиду того, что данная категория больных 2-3 раза в год проходит профилактическое лечение, контроль за ними не представлял трудностей. Катамнез заболевания в течение 5 лет после перенесенного флеботромбоза позволил выявить отдаленные результаты проводимого лечения, которые наиболее демонстративно выражаются в развитии различной степени тяжести хронической венозной недостаточности.
В основной группе больных, получавших комплексное лечение, развитие посттромботической болезни наблюдалось в 2,3 раза реже пациентов контрольной группы, которым проводилась медикаментозная терапия.
По стадиям ХВН наиболее благоприятно протекают последствия перенесенного флеботромбоза после комплексного лечения. Так в основной группе стадия компенсации наиболее многочисленная и превышает по количеству пациентов контрольную группу в 1,7 раза. Стадия субкомпенсации в основной группе за время наблюдения зафиксирована у 15(24,2%) человек против 71(37,8%) контрольной группы, что превышает показатель последней в 1,6 раза. Самая малочисленная в основной группе подгруппа больных относится к стадии декомпенсации. Количественный состав ее 5(8,1%) пациентов против 42(22,3%) больных подобной стадии контрольной группы, что превышает основную группу в 2,8 раза. Т.о., отличительной особенностью больных основной группы является характерное преимущественное перераспределение их за 5 лет в стадию компенсации ХВН.
На основании выявления ближайших и отдаленных результатов можно сделать вывод о патогенетической обоснованности комплексного метода лечения острого флеботромбоза в системе НПВ и его наибольшей эффективности по сравнению с другими методами терапевтической коррекции. Целенаправленно действуя на различные компоненты системы гемостаза, комплексное лечение препятствует прогрессированию тромботического процесса. Оно может применяться как основной вид консервативного воздействия, так и в качестве терапии, проводимой в до и послеоперационном периоде.
Изучив характерные особенности различных стадий патологического процесса системы РАСК и получив определенные результаты лечебных мероприятий в отдельных группах пациентов, нами были проведены исследования взаимоотношений показателей коэффициента плотности тромба и результатов гемостазиограмм, полученных с помощью анализатора реологических свойств крови АРП-01 «Меднорд», в динамике тромботического процесса до и после лечения.
Основные показатели гемостазиограмм оказались связаны с изменением плотности тромба (MN). Так, показатели сосудисто-тромбоцитарного и коагуляционного компонентов системы гемостаза имели выраженную положительную связь с коэффициентом плотности тромба, а показатели фибринолитической системы были связаны с MN тесной отрицательной связью (рис.5).

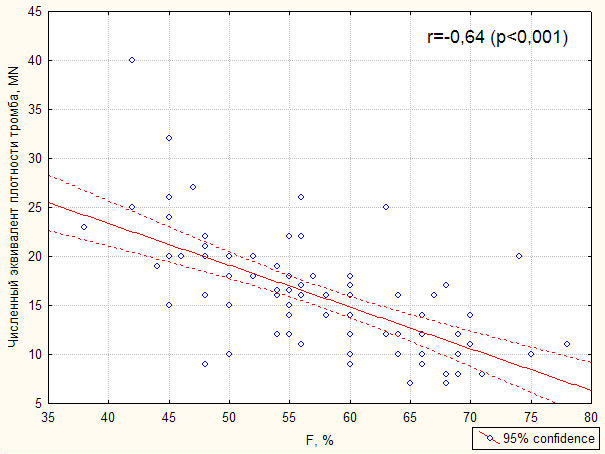

Рис.5. Корреляция численного эквивалента коэффициента плотности тромба и показателей гемостазиограммы Ar, AM и F, характеризующих функциональное состояние системы РАСК
Оказалось, что степень плотности тромба не соответствует стадиям патологического состояния системы РАСК. Показателям I степени активности тромбообразования соответствовали результаты исследований гемостазиограмм больных в стадию декомпенсации, показателям II степени активности соответствовали результаты компенсированных больных, а показателям III степени – результаты, характерные для стадии субкомпенсации расстройств системы РАСК (рис.6).

Рис.6. Величина численного эквивалента коэффициента плотности тромба у больных с острым флеботромбозом с разной стадией патологического состояния системы РАСК
После проводимого комплексного лечения также выявлялась корреляция между основными показателями гемостазиограмм и численным эквивалентом плотности тромба. Оказалось, что в стадию компенсации выявлено снижение связи между показателем сосудисто-тромбоцитарного гемостаза и коэффициентом плотности тромба MN. В стадию субкомпенсации наиболее выражено снижение тесной положительной связи между сосудисто-тромбоцитарным, коагуляционным гемостазом и MN и отсутствие изменений между MN и фибринолизом. При лечении больных со стадией декомпенсации РАСК повышается взаимосвязь между сосудисто-тромбоцитарным гемостазом и MN и уменьшается между MN и фибринолизом (таб.4).
Таблица 4
Взаимосвязь численного эквивалента плотности тромба с некоторыми интегральными показателями, характеризующими состояние системы РАСК у пациентов в разной стадии патологического процесса (после лечения)
| Основные показатели гемостазиограммы | Численный эквивалент плотности тромба (MN) | ||
| Компенсация | Субкомпенсация | Декомпенсация | |
| Аr, отн. ед. | r=0,21 p=0,024 | r=0,26 p=0,015 | r=0,33 p=0,014 |
| АM, отн. ед. | r=0,58 p=0,025 | r=0,64 p=0,001 | r=0,46 p<0,001 |
| F, % | r=-0,49 p=0,039 | r=-0,45 p=0,011 | r=-0,51 p<0,001 |
Т.о., эффективность лечения на основании сопоставления плотности тромба и показателей гемостазиограмм прослеживается в стадии компенсации и субкомпенсации. Т.е. под действием комплексного лечения в эти стадии уменьшается риск развития тромбоэмболии легочной артерии. В стадию декомпенсации в плане риска развития эмболических осложнений эффективность консервативного лечения не всегда возможна, что подтверждается оперативными вмешательствами по поводу рецидивирующего флеботромбоза и тромбоэмболии легочной артерии у больных преимущественно этой группы.
Поскольку тромбоэмболия легочной артерии неразрывно связана с венозным тромбозом системы НПВ, изучив положительные и отрицательные стороны методов профилактики ТЭЛА, мы предложили оригинальную клипсу из никелида титана для профилактики эмболических осложнений. С целью устранения нежелательных осложнений методов оперативной профилактики ТЭЛА и повышения ближайших и отдаленных результатов нами совместно с НИИ медицинских материалов и имплантатов с памятью формы г.Томск проведено моделирование оригинальной конструкции для кава-, илиоклипирования.
Технический результат предлагаемого изобретения – снижение гемодинамического сопротивления и повышение задерживающей способности мелких эмболов - достигнут оригинальной формой клипсы с волнообразно изогнутыми браншами. Выбраны оптимальные материал и параметры изделия (рис.7).
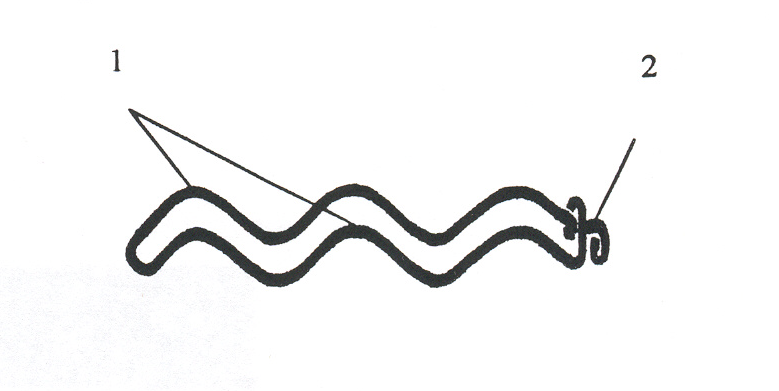

Рис.7. Клипса для профилактики ТЭЛА: а - внешний вид (1-бранши, 2-разъемный фиксатор); б – схема фиксации на магистральную вену (поперечный срез, 1-бранши, 2-разъемный фиксатор, 3-стенки магистральной вены, 4-просвет сосуда)
Доказательством достижимости технического результата послужило экспериментальное исследование, проведенное на 45 лабораторных животных (собаках). Результат подтверждался флеботонометрическими исследованиями с помощью аппарата Вальдмана – выявлено отсутствие градиента давления дистальнее и проксимальнее клипсы. Так же установлена 100% задерживающая способность искусственных эмболов.
Данные экспериментальных исследований свидетельствовали о хорошей пропускной способности клипсы току крови благодаря ее оригинальной форме, что подтверждалось отсутствием градиента венозного давления дистальнее и проксимальнее ее местонахождения, а также отсутствием развития тромбоза дистальнее места ее фиксации. Минимальная реакция окружающих клипсу тканей не вызывала массивного рубцового процесса и деформации магистральной вены, что благоприятно сказывалось на гемодинамических показателях в отдаленные сроки после оперативного вмешательства. Пропускная способность клипсы очень удачно сочеталась с важным ее свойством – 100% задержкой эмболов. Этот факт подтверждал правильность подбора геометрических параметров конструкции.
Результаты экспериментальных исследований позволили применить данную клипсу в клинической практике при эмбологенных формах флеботромбоза с целью профилактики ТЭЛА путем кава-, илиопликации.
С целью клинической проверки эффективности предложенного способа профилактики ТЭЛА нами проведен анализ результатов лечения 87 больных, наблюдавшихся преимущественно в отделении с/х ОКБ г.Томска, а также в клинике госпитальной хирургии имени А.Г.Савиных СибГМУ за период с 1994 по 2005 год.
Все больные были разделены на две группы. В контрольной группе, состоящей из 35 человек, выполнялись оперативные вмешательства в объеме тромбэктомии, тромбэктомии с последующей ручной кавапликацией (метод Spencer), а также перевязка НПВ и подвздошных вен. В основной группе, состоящей из 52 человек - кавапликация с тромбэктомией или без нее; илиопликация с тромбэктомией или без нее; в исключительных случаях перевязка нижней полой вены в инфраренальном ее отделе или подвздошной вены.
Основными критериями сравнительной оценки этих методов являлись частота послеоперационных тромбоэмболий легочной артерии, количество ретромбозов дистальнее уровня парциальной окклюзии и частота развития хронической венозной недостаточности.
Были получены следующие результаты. После пликации магистральных вен не было отмечено ни одного случая ТЭЛА и кровотечения; ретромбоз зафиксирован в 5(9,6%) случаях против 17(48,6%) – в контрольной группе, что в 5 раз превышает показатели основной группы.
При динамическом наблюдении в течение пяти лет за оперированными по поводу эмбологенных форм флеботромбоза пациентами нами констатировано появление такого осложнения, как ТЭЛА в основной группе у 2(4%) больных, в контрольной – у 8(23%). Ретромбоз зафиксирован в основной группе у 5(10%) человек, в контрольной – у 19(54%).
Таким образом, пациенты без отдаленных осложнений в основной группе составили 87%, а в контрольной - 23%, что в 3,4 раза хуже результатов основной группы.
Хроническая венозная недостаточность в отдаленном периоде в основной группе развилась в 23% случаев, в контрольной - в 89%, что в 3,7 раза превышает показатель основной группы.
После оперативного лечения больных предложенным нами способом значительно меньшее количество пациентов страдает выраженной стадией ХВН.
Таким образом, применение с целью профилактики ТЭЛА клипсы из никелида титана имеет определенные преимущества перед другими способами экстравазальной парциальной окклюзии, заключающиеся в минимальной реакции тканей на применяемый сплав; отсутствии гемодинамического сопротивления и повышении задерживающей способности мелких эмболов за счет оригинальной формы конструкции; простоте технического исполнения и сокращении времени операции; эффективном предупреждении ТЭЛА и рецидивов самого заболевания; а также, снижении частоты развития выраженной хронической венозной недостаточности в отдаленном периоде после операции.
Исходя из полученных результатов, пликация магистральной вены клипсой из никелида титана является методом выбора при профилактике тромбоэмболии легочной артерии.
Подводя итог проведенной работе, можно сделать вывод о том, что предложенные патогенетически обоснованные методы диагностики динамического преобразования тромба, стадии расстройств системы РАСК и связанный с ними выбор тактики, а также методы комплексного лечения острого флеботромбоза в системе нижней полой вены и оперативной профилактики тромбоэмболии легочной артерии позволили повысить эффективность диагностики и лечения тромботического процесса, ликвидировать тромбоэмболию легочной артерии и максимально снизить процент отдаленных осложнений.
ВЫВОДЫ
1. Ультрасонографическое исследование с использованием функции гистограмм на этапе эхонегативного тромба при остром флеботромбозе позволяет получить достоверную информацию о динамике процесса тромбообразования, которая характеризуется изменением коэффициента плотности тромба: I степень активности тромбообразования соответствует коэффициенту плотности тромба от 1,5 до 10,0 усл.ед, II степень – от 10,1 до 15,0 усл.ед., III степень – более 15,0 усл.ед.
2. Коэффициент плотности тромба прямо пропорционален количеству ядросодержащих клеток и отражает морфологическое состояние тромба: I степень активности тромбообразования соответствует начальной стадии формирования тромба, II степень – стадии клеточной инфильтрации, III степень – стадии образования соединительной ткани.
3. Разработанный алгоритм тактики ведения больных с острым флеботромбозом в зависимости от ультрасонографических критериев плотности тромба позволяет определять показания к оперативной профилактике тромбоэмболии легочной артерии и прогнозировать дальнейшее течение тромботического процесса. Оптимизация тактики лечения позволила снизить развитие тромбоэмболии легочной артерии в 4 раза.
4. Исследование показателей, характеризующих функциональное состояние компонентов системы гемостаза и фибринолиза у пациентов с острым флеботромбозом, позволило выявить стадии патологического процесса системы РАСК, прогнозировать течение венозного тромбоза и определять тактику ведения больного.
5. Комплексное лечение больных с острым флеботромбозом в системе нижней полой вены, включающее стандартную медикаментозную терапию, плазмаферез и ГБО, снижает агрегационную активность тромбоцитов на 20-40% в зависимости от стадии патологического состояния системы РАСК; нормализует коагуляционный компонент при всех стадиях расстройств гемостаза; повышает фибринолитическую активность в стадии компенсации и субкомпенсации и снижает высокий компенсированный фибринолиз в стадию декомпенсации.
6. Патогенетически обоснованное комплексное лечение острого флеботромбоза, проводимое в основной группе позволило снизить летальность по сравнению с традиционной медикаментозной терапией контрольной группы в 5 раз за счет уменьшения тромбоэмболии легочной артерии – в 8,5 раза, ретромбоза – в 6,1 раза.
7. Корреляционный анализ между ультрасонографическими критериями динамики тромбообразования и результатами гемостазиограмм выявил наличие значимой положительной связи коэффициента плотности тромба с показателями, характеризующими агрегационную активность тромбоцитов (Ar) и максимальную плотность сгустка (АМ), а также наличие значимой отрицательной связи с показателем фибринолитической активности крови (F). После комплексного лечения в стадию компенсации отмечается снижение связи между Ar и MN, в стадию субкомпенсации – между Ar, АМ и MN, в стадию декомпенсации – между F и MN.
8. Предлагаемая оригинальная клипса из никелида титана для профилактики тромбоэмболии легочной артерии обеспечивает хорошую пропускную способность для тока крови с отсутствием гемодинамического сопротивления и высокой задерживающей способностью для мелких эмболов. Биоинертность конструкции не вызывает массивного рубцового процесса и деформации вены.
9. Разработанный метод пликации нижней полой и подвздошной вен клипсой из никелида титана по сравнению с другими методами экстравазальной профилактики тромбоэмболии легочной артерии не вызывает рецидивов последней, снижает количество ретромбозов в 5 раз, развитие хронической венозной недостаточности в отдаленном периоде после операции – в 3,9 раза.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. С целью установления степени активности тромбообразования и определения дальнейшей тактики ведения больного следует пользоваться предложенным алгоритмом ультрасонографического исследования (рис.4). После проведения первого этапа диагностического поиска, включающего визуализацию венозной стенки, определение спонтанного и стимулированного кровотока, определения эхопозитивных включений в просвете вены, при условии обнаружения эхонегативного дефекта наполнения в просвете вены, следует продолжать диагностику с использованием функции гистограмм для установления степени активности тромбообразования. Для этого надо провести трассировку эхонегативного участка тромба в просвете вены и вывести функцию гистограмм с получением коэффициента плотности выделенного участка. Дальнейшая тактика ведения больного должна определяться после начатого лечения с обязательным ультрасонографическим исследованием в динамике.
2. В составе комплексного лечения острого флеботромбоза обоснованным является применение дискретного плазмафереза, курс лечения которым должен включать не менее 3-х сеансов, проводимых через 1 сут. Объем эксфузируемой плазмы должен быть не менее 450 мл за сеанс. Также параллельно с базисной терапией острого флеботромбоза целесообразно назначение ежедневных сеансов гипербарической оксигенации, которую следует начинать с пробного сеанса при давлении 1,3-1,4 АТА и экспозиции 20-30 минут, а затем, постепенно увеличивая давление, переходить к режиму 1,5-1,9 АТА (0,5-0,9 ати) продолжительностью 70 минут (15 мин – компрессия, 40 мин – изопрессия, 15 мин – декомпрессия). Количество сеансов 8-10.
3. При проведении комплексного лечения острого флеботромбоза в стадию компенсации патологического состояния системы РАСК положительный результат достигается стандартной медикаментозной терапией, поэтому плазмаферез и гипербарическая оксигенация рекомендуются для профилактики прогрессирования тромботического процесса, развития осложнений, а также для улучшения исхода заболевания. В стадию субкомпенсации назначение выше указанных мероприятий в комплексном лечении считаем обязательным. В стадию декомпенсации при гипокоагуляционных сдвигах в системе РАСК для профилактики развития условно необратимой стадии и ДВС-синдрома следует осуществлять 100% восполнение эксфузируемой плазмы больного, здоровой донорской.
4. При выполнении оперативного вмешательства при венозном тромбозе в системе нижней полой вены с целью профилактики тромбоэмболических осложнений из методов кавапликации рекомендуем применение клипсы из никелида титана, наиболее отвечающей требованиям снижения гемодинамического сопротивления и повышения задерживающей способности мелких эмболов. Кава-, илиоклипирование проводится из правостороннего забрюшинного доступа. Для изготовления клипсы наиболее приемлема проволока из никелида титана марки ТН-10 диаметром 1,0-1,1 мм. Клипсу следует накладывать на инфраренальный отдел нижней полой вены или на общую подвздошную вену под острым углом, желательно 45, к ее оси. При этом габаритная длина клипсы должна превышать поперечный диаметр вены на 1/3.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Анализатор реологических свойств крови с U-образной кюветой // В сборнике: Наукоёмкие технологии двойного назначения и механизмы их реализации на предприятиях ВПК. Томск, 1999. – С.50-53 (в соавт. с Ивченко О.А., Галкиным В.И., Кураковым С.А., Ушаковым В.Г., Новиковым Ю.Л., Трофимовым Ю.С.)
- Ультразвуковая диагностика заболеваний магистральных вен // Сборник трудов областной клинической больницы. -Томск, 1999. - Выпуск VI. - С.100-102 (в соавт. с Соловцовой И.А., Соловцовым М.А., Савельевым И.О., Демиховым С.В.)
- Тактика хирурга при остром тромбозе в системе нижней полой вены // IХ Всероссийский съезд хирургов. - Волгоград, 20-22 сентября 2000 г. – С. 252-253 (в соавт. с Ивченко О.А., Савельевым И.О., Демиховым С.В.)
- Применение конструкций из никелида титана в реконструктивной хирургии посттромбофлебитической болезни // Сборник трудов областной клинической больницы. - Томск, 2000. - Выпуск VII - С. 90-91 (в соавт. с Савельевым И.О.)
- Профилактика тромбоэмболии легочной артерии методом илиокавапликации оригинальной конструкцией из никелида титана // Сборник трудов областной клинической больницы. – Томск, 2001. – Выпуск VIII. - С. 3-6 (в соавт. с Гюнтером В.Э., Дамбаевым Г.Ц., Авалиани М.В., Ивченко О.А., Савельевым И.О.)
- Новый метод бесшовной пластики магистральных вен пористой пластиной из никелида титана // Сборник трудов областной клинической больницы. – Томск, 2001. – Выпуск VIII. - С. 18-21 (в соавт. с Гюнтером В.Э., Ивченко О.А., Черновым А.И.)
- Метод профилактики тромбоэмболии легочной артерии с помощью имплантата из никелида титана // Shape Memory Biomaterial and Implants. – Томск, 2001. – С.229-232 (в соавт. с Гюнтером В.Э., Дамбаевым Г.Ц., Авалиани М.В., Ивченко О.А., Богачевым А.В.)
- Метод бесшовной пластики магистральных вен пористым проницаемым имплантатом из сплава на основе никелида титана // Shape Memory Biomaterial and Implants. – Томск, 2001. – С. 265-267 (в соавт. с Ходоренко В.Н., Черновым А.И., Быстровым С.В., Подгорновым В.Ф.)
- Профилактика тромбоэмболии легочной артерии оригинальной конструкцией из никелида титана // Сборник трудов областной клинической больницы. – Томск, 2002. – Выпуск IX. - С. 22-25 (в соавт. с Савельевым И.О., Демиховым С.В., Дворяниновым А.Н., Латыповым В.Р.)
- Ультразвуковая оценка процесса тромбообразования на этапе эхонегативного тромба // Сборник трудов областной клинической больницы. – Томск, 2002. – Выпуск IX. - С. 13-14 (в соавт. с Соловцовой И.А., Саадехом Р.Д.)
- Профилактика и лечение тромбоэмболии легочной артерии методом кавапликации оригинальной конструкцией из никелида титана // Ангиология и сосудистая хирургия. –2002. №3. – С. 75-76 (в соавт. с Гюнтером В.Э., Дамбаевым Г.Ц., Савельевым И.О., Ивченко О.А)
- Метод ультразвукового дуплексного сканирования в диагностике и лечении патологии периферических вен // Ангиология и сосудистая хирургия. –2003. - №3. – С. 286-287 (в соавт. с Соловцовой И.А., Савельевым И.О., Ивченко О.А., Дмитриенко И.В., Саадехом Р.Д.)
- Профилактика рецидива тромбоэмболии легочной артерии при остром флеботромбозе методом кавапликации оригинальной конструкцией из никелида титана // Сборник научных трудов, посвященный 25-летию факультета повышения квалификации и профессиональной подготовки специалистов. – Томск, изд-во СибГМУ, 2004. – С. 283-288 (в соавт. с Ивченко О.А., Безлепкиной О.М., Назаренко А.Г., Соловцовой И.А.)
- Профилактика и лечение тромбоэмболии легочной артерии при остром флеботромбозе методом кавапликации оригинальной конструкцией из никелида титана // Биосовместимые материалы с памятью формы и новые технологии в медицине. – Томск, ИПФ: изд-во НТЛ, -2004. – С. 63-66 (в соавт. с Гюнтером В.Э., Ивченко О.А., Савельевым И.О., Демиховым С.В.)
- Применение сверхэластичных никелид-титановых имплантатов в реконструктивной хирургии посттромботической болезни // Биосовместимые материалы с памятью формы и новые технологии в медицине. – Томск, ИПФ: изд-во НТЛ, -2004. – С. 314-315 (в соавт. с Савельевым И.О., Дамбаевым Г.Ц., Базиевой Л.О., Ивченко О.А.)
- Профилактика тромбоэмболии легочной артерии при остром флеботромбозе методом кавапликации оригинальной конструкцией из никелида титана // X Всероссийский съезд сердечно-сосудистых хирургов: Бюллетень НЦ ССХ им. А.Н.Бакулева РАМН. Сердечно-сосудистые заболевания. – 2004. –Т.5, № 11. – С.143 (в соавт. с Ивченко О.А., Дамбаевым Г.Ц., Савельевым И.О.)
- Диагностика и комплексное лечение тромбоэмболических осложнений у больных со скелетной травмой // Ангиология и сосудистая хирургия. –2004. - №2. – С. 115-117 (в соавт. с Саадехом Р.Д., Ивченко О.А.)
- Состояние свертывающей системы крови у больных с острым илиофеморальным тромбозом // материалы областной научно-практической конференции «Актуальные проблемы клинических исследований агрегатного состояния крови», - Томск, 2005. – С. 22-23 (в соавт. с Савельевым И.О., Силиной М.С., Ивченко О.А.)
- Роль оценки степени активности тромбообразования при острых флеботромбозах в лечении и профилактике тромбоэмболии легочной артерии // Ангиология и сосудистая хирургия. –2005. - №2. – С. 138-140 (в соавт. с Соловцовой И.А., Рязанцевой Н.В., Савельевым И.О., Силиной М.С.)
- Профилактика тромбоэмболии легочной артерии при остром флеботромбозе методом кавапликации оригинальной конструкцией из никелида титана // Ангиология и сосудистая хирургия. –2005. - №2. – С. 141-142 (в соавт. с Ивченко О.А., Рязанцевой Н.В., Соловцовой И.А., Непомнящей О.В., Силиной М.С.)
- Профилактика тромбоэмболии легочной артерии при остром флеботромбозе по данным ультрасонографии с применением метода кавапликации оригинальной конструкцией из никелида титана // Бюллетень ВСНЦ СО РАМН. Материалы 1-го съезда хирургов Сибири и Дальнего Востока, Улан-Удэ, 22-24 июня: – 2005. - №3. – С. 35-36 (в соавт. с Дамбаевым Г.Ц., Ивченко О.А., Гюнтером В.Э., Соловцовой И.А., Савельевым И.О., Щедловским Т.В.)
Патенты
- Патент РФ № 2211675 от 10 сентября 2003 г. «Клипса для профилактики тромбоэмболии легочной артерии» (в соавт. с Гюнтером В.Э., Дамбаевым Г.Ц., Ивченко О.А., Авалиани М.В., Проскуриным А.В., Савельевым И.О., Латыповым В.Р.)
- Патент РФ № 2252706 от 27 мая 2005 г. «Способ дифференциальной оценки степени тромбообразования при флеботромбозах» (в соавт. с Соловцовой И.А., Ивченко О.А., Савельевым И.О., Назаренко А.Г.)
Учебно-методическое пособие
- Острые тромбозы магистральных вен: Методические рекомендации, утвержденные цикловой методической комиссией лечебного факультета. - №3, 22.11.02., Томск, СибГМУ, - 2002г. - 29 с. Тираж 500 экз. Заказ 342
Список используемых сокращений
АДФ - аденозиндифосфат
ГБО – гипербарическая оксигенация
ДВС – диссеминированное внутрисосудистое свертывание
КСП – коэффициент светопропускания
КЛ – комплексное лечение
МТ – медикаментозная терапия
НПВ – нижняя полая вена
ОАЭ – обратимая агрегация эритроцитов
ОФТ – острый флеботромбоз
ПДФ – продукты деградации фибрина
ПТФС – посттромбофлебитический синдром
ПФ - плазмаферез
РАСК – регуляция агрегатного состояния крови
ТЭЛА – тромбоэмболия легочной артерии
ХВН – хроническая венозная недостаточность
Автор выражает глубокую признательность научному консультанту заведующему кафедрой госпитальной хирургии с курсом онкологии СибГМУ доктору медицинских наук, профессору, член-корреспонденту РАМН Г.Ц.Дамбаеву; директору НИИ медицинских материалов и имплантатов с памятью формы при СФТИ и ТГУ доктору технических наук, профессору В.Э.Гюнтеру; коллективам кафедр факультетской хирургии СибГМУ и госпитальной хирургии с курсом онкологии СибГМУ; сотрудникам отделения хирургии сосудов ОГУЗ Томской областной клинической больницы и клиники госпитальной хирургии им. А.Г.Савиных за ценные теоретические и методические рекомендации, а также большую практическую помощь.

