карпович александр викторович к методике сохранения добавочной печеночной артерии у пациентов с органическими заболеваниями пищевода и желудка 14.00.27 – хирургия автореферат диссертации на ...
На правах рукописи
Карпович Александр Викторович
К МЕТОДИКЕ СОХРАНЕНИЯ ДОБАВОЧНОЙ ПЕЧЕНОЧНОЙ АРТЕРИИ У ПАЦИЕНТОВ С ОРГАНИЧЕСКИМИ ЗАБОЛЕВАНИЯМИ ПИЩЕВОДА И ЖЕЛУДКА
14.00.27 – хирургия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Томск - 2006
Работа выполнена в государственном образовательном учреждении высшего профессионального образования «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
НАУЧНЫЙ РУКОВОДИТЕЛЬ:
Заслуженный деятель науки РФ,
доктор медицинских наук, профессор Жерлов Георгий Кириллович
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ:
Заслуженный деятель науки РФ,
доктор медицинских наук, профессор, Альперович Борис Ильич
доктор медицинских наук Баранов Андрей Игоревич
Ведущая организация:
ГОУ ВПО Иркутский государственный медицинский университет Росздрава
Защита диссертации состоится “_____ ”________________2006 г. в ______час. на заседании диссертационного совета Д 208.096.01 при Сибирском государственном медицинском университете по адресу: 634050, г. Томск, Московский тракт, 2.
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета (634050, г. Томск, пр. Ленина, 107).
Автореферат разослан “______”____________________2006 г.
Ученый секретарь диссертационного совета Суханова Г.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность работы
Анатомической особенностью малого сальника является наличие в 30% случаев вариантной добавочной печеночной артерии, которая участвует в кровоснабжении левых отделов печени. Добавочная печеночная артерия может отходить от чревной, левой желудочной, верхней брыжеечной и желудочно-двенадцатиперстной артерий. Диаметр этой артерии непостоянен и колеблется в пределах 0,1—0,5 см. При оперативном лечении пациентов с органическими заболеваниями пищевода и желудка, в частности, при выполнении расширенной лимфодиссекции в этой области (7, 8, 9 и 12 группы лимфоузлов по классификации Японской Ассоциации Рака Желудка), в случае пересечения этой артерии в раннем послеоперационном периоде может развиться некроз левой доли печени [А.С. Лурье, 1973].
Значимость данной проблемы связана еще и с тем, что основной тенденцией в хирургическом лечении злокачественных опухолей этой локализации в настоящее время является стремление к выполнению, по возможности, органощадящих операций с одновременным расширением объема лимфодиссекции. Однако необоснованное применение суперрасширенной лимфодиссекции на практике часто приводит к увеличению числа ранних послеоперационных осложнений и послеоперационной летальности у таких пациентов [И.С. Базин, А.М. Гарин, 2002].
Необходимость адекватной лимфодиссекции обусловлена высокой степенью лимфогенного метастазирования рака верхних отделов ЖКТ, первые метастазы в региональных лимфоузлах выявляются уже при инвазии опухоли до подслизистого слоя, а при вовлечении в процесс мышечного слоя процент наблюдаемых лимфогенных метастазов в коллекторах первого порядка достигает 62,6%, в лимфоузлах N2 – 32,7% [А.Ф. Черноусов, С.А. Поликарпов, 2004].
И если на современном этапе можно говорить о стандартном подходе к определению необходимого объема резекции пищевода и желудка в зависимости от локализации и распространенности опухоли, то вопросы лимфодиссекции остаются спорными и дискутируемыми в литературе [Н.А. Кузнецов, 2000; М.И. Давыдов, М.Д. Тер-Ованесов, 2000; I.K. Schumacher, A. Hunsicker, 2002].
На сегодняшний день в мире рассматривают 4 варианта лимфодиссекции при раке желудка по количеству удаляемых лимфатических коллекторов: стандартная (D1), стандартная радикальная (D2), расширенная радикальная (D3) и суперрасширенная радикальная (D4). На IV Международном Конгрессе по раку желудка в Нью–Йорке (США, 2001 год) лимфодиссекция D2 определена, как стандартный объем радикального хирургического вмешательства, так как улучшает отдаленные результаты и снижает частоту местных рецидивов [В.Ю. Сельчук, М.П. Никулин, 2003].
Лимфодиссекция при раке пищевода подразделяется по количеству областей, в которых выполняется лимфодиссекция: брюшная полость, средостение, область шеи. Большинство хирургов в мире придерживаются стратегии удаления лимфатических коллекторов брюшной полости и заднего средостения [S.M. Griffin, J. Wayman, 2002].
Таким образом, как при выполнении расширенной лимфодиссекции по поводу опухолей желудка и пищевода, так и при обширных вмешательствах на пищеводе и желудке при других заболевания (ахалазия кардии IV степени, послеожоговые стриктуры) у пациентов с добавочной печеночной артерией сохраняется риск повреждения этого вариантного сосуда с последующим развитием сегментарного некроза.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Разработать и внедрить в клинику алгоритм выбора и способ сохранения добавочной печеночной артерии при операциях у больных с органическими заболеваниями желудка и пищевода, позволяющий снизить частоту ранних послеоперационных осложнений и повысить выживаемость пациентов.
ЗАДАЧИ ИССЛЕДОВАНИЯ
Для достижения поставленной цели решались следующие задачи:
- Разработать способ сохранения добавочной печеночной артерии при выполнении радикальных операций у пациентов с органическими заболеваниями желудка и пищевода (рак, ахалазия, стриктура).
- Разработать объективные методы оценки кровоснабжения левой доли печени при наличии добавочной печеночной артерии.
- Разработать критерии сохранения или перевязки добавочной печеночной артерии при выполнении радикальных операций у пациентов с органическими заболеваниями желудка и пищевода (рак, ахалазия, стриктура).
- Изучить непосредственные и отдалённые результаты клинического применения способа сохранения добавочной печеночной артерии при выполнении радикальных операций у пациентов с органическими заболеваниями желудка и пищевода.
НАУЧНАЯ НОВИЗНА
Разработан новый подход к решению проблемы оптимизации результатов хирургического лечения органических заболеваний желудка и пищевода.
Впервые применен объективный метод оценки влияния добавочной печеночной артерии на кровоснабжение левой доли печени с определением показаний к ее сохранению или пересечению, что позволило избежать тяжелого раннего послеоперационного осложнения – сегментарного некроза печени. В связи с этим, разработан способ расширенной лимфодиссекции, направленный на удаление основных лимфатических коллекторов малого сальника (7, 8, 9 и 12 группы лимфоузлов) и сохранение добавочной печеночной артерии при операциях по поводу рака желудка и пищевода.
На основании изучения гистологической структуры удаленных лимфоузлов, послеоперационного обследования больных показано, что разработанный способ не снижает радикальность оперативного лечения данной группы больных без увеличения частоты ранних послеоперационных осложнений и с сохранением хороших функциональных результатов в отдаленном периоде.
На методику получен патент РФ №2188594 от 10.09.2002 г. «Способ профилактики некроза левой доли печени при гастрэктомии по поводу рака пищевода и желудка при наличии добавочной печеночной артерии».
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ РАБОТЫ
- Применение нового способа сохранения добавочной печеночной артерии при выполнении радикальных операций у пациентов с органическими заболеваниями желудка и пищевода позволяет уменьшить число послеоперационных осложнений, связанных с сегментарным некрозом печени, без ухудшения здоровья пациентов в раннем послеоперационном периоде и без снижения показателей выживаемости у онкологических больных.
- Интраоперационная лазерная допплеровская флоуметрия позволяет определить показания к сохранению и пересечению добавочной печеночной артерии.
- Выполнение лимфодиссекции в области малого сальника при сохранении добавочной печеночной артерии путем скелетизации ее стенки не приводит к ухудшению кровотока по сосуду в раннем и отдаленном послеоперационном периоде.
- Трансабдоминальное ультразвуковое исследование в режиме цветного дуплексного сканирования в послеоперационном периоде позволяет визуализировать сохраненную добавочную печеночную артерию в ткани левой доли печени и при исследовании чревного ствола, что делает возможным оценить кровоток и состоятельность сосуда.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ В ПРАКТИКУ
Изложенные в диссертации теоретические положения и методики используются в практике НИИ гастроэнтерологии СибГМУ, лечебных отделений ЦМСЧ–81 г. Северска.
Выводы и рекомендации, вытекающие из проведенного исследования, используются в учебном процессе на курсе хирургических болезней ФПК и ППС Сибирского государственного медицинского университета.
ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ
- Разработанный способ сохранения добавочной печеночной артерии при выполнении радикальных операций у пациентов с органическими заболеваниями желудка и пищевода надежен в отношении развития послеоперационных осложнений, связанных с сегментарным некрозом печени.
- Сохраненная добавочная печеночная артерия после выполнения расширенной лимфодиссекции остается состоятельной и сохраняет адекватный кровоток в раннем и отдаленном периодах.
- Способ сохранения добавочной печеночной артерии при выполнении радикальных операций у пациентов с органическими заболеваниями желудка и пищевода не ухудшает здоровья пациентов в раннем послеоперационном периоде и не снижает показателей выживаемости у онкологических пациентов.
АПРОБАЦИЯ МАТЕРИАЛОВ ДИССЕРТАЦИИ
Материалы и основные положения диссертационной работы доложены на:
- Томском областном обществе хирургов (Томск, 2006).
- 2-й научно-практической конференции, посвященной памяти А.Ф. Родина (Северск, 2006).
ПУБЛИКАЦИИ
По материалам диссертации опубликовано 8 печатных работ, в том числе 2 статьи в журналах, рекомендованных ВАК РФ, и 1 патент РФ на изобретение.
ОБЪЕМ И СТРУКТУРА ДИССЕРТАЦИИ
Диссертация изложена на 149 страницах машинописного текста, состоит из введения, 4 глав, заключения, выводов и практических рекомендаций. Список литературы включает 110 отечественных и 75 иностранных источников, иллюстрирован 28 рисунками, 5 диаграммами и документирован 14 таблицами.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В основу исследования положены материалы наблюдений за 66 больными раком желудка и пищевода, двумя пациентами с ахалазией кардии IV степени и тремя пациентами с послеожоговой обширной стриктурой нижней и средней третей пищевода, перенесшими радикальное оперативное лечение. Пациенты находились на лечении в Научно-исследовательском институте гастроэнтерологии СибГМУ и ЦМСЧ №81 г. Северска.
Возраст пациентов варьировал от 36 до 75 лет (в среднем 58 лет). Мужчин было 43 (60,6%), женщин 28 (39,4%). Среди исследуемых больных основную долю составили пациенты с онкологическими заболеваниями – 66 (93,0%): при этом у 56 из них (84,8%) был выявлен рак желудка, у 10 (15,2%) – рак пищевода. Пациенты с доброкачественными заболеваниями составили 7,0% (5 пациентов): из них с ахалазией кардии – 2 (40%) пациента, со стриктурой пищевода – 3 (60%) пациента. Из общего числа оперированных больных интраоперационно добавочная печеночная артерия была выявлена у 15 (21,2%) больных раком желудка, 3 (4,2%) больных раком пищевода и 5 (7,0%) больных с доброкачественной патологией пищевода.
Таблица 1
Распределение больных по возрасту и полу
| Возраст, лет | Мужчины | Женщины | Всего | Пациенты с ДПА |
| 30-39 | 4 | 1 | 5 (7,0%) | 2 |
| 40-49 | 8 | 7 | 15 (21,2%) | 7 |
| 50-59 | 12 | 9 | 21 (29,6%) | 5 |
| 60-69 | 15 | 10 | 25 (35,2%) | 8 |
| 70 и > | 4 | 1 | 5 (7,0%) | 1 |
| Итого | 43 (60,6%) | 28 (39,4%) | 71 (100,0%) | 23 (32,4%) |
В плановом порядке радикальное оперативное лечение проведено 71 пациенту с органическим заболеванием желудка и пищевода, при этом у 66 (93,0%) пациентов со злокачественным поражением дополнительно выполнялась расширенная лимфодиссекция с последующим патолого-анатомическим исследованием удаленных тканей и окончательным стадированием заболевания.
Из 56 больных раком желудка операция в объеме гастрэктомии выполнена у 37 (66,1%), субтотальной дистальной резекции – у 12 (21,4%) и субтотальная проксимальная резекция – у 7 (12,5%). При этом комбинированная резекция выполнена 21 (37,5%) пациенту.
Объем выполненной лимфодиссекции определялся общим числом удаленных и исследованных лимфатических узлов:
D1 – менее 26 лимфатических узлов (в среднем 19,2±4,3) удалено у 8 (14,3%) пациентов;
D2 – от 26 до 40 лимфатических узлов (в среднем 34,7±5,2) удалено у 27 (48,2%) пациентов;
D3 – 40 и более лимфатических узлов (в среднем 44,1±2,9) удалено у 21 (37,5%) пациента.
Десяти больным раком пищевода была выполнена субтотальная резекция пищевода с удалением кардиального отдела и малой кривизны желудка, одномоментно выполнена первичная эзофагогастропластика желудочным стеблем из большой кривизны, проведенным в заднем средостении в ложе удаленного пищевода, с формированием пищеводно-желудочного анастомоза в области шейного доступа. Всем 10 пациентам выполнена расширенная двухзональная лимфодиссекция с удалением от 28 до 46 лимфатических узлов (в среднем 35,2±4,7).
Из пяти пациентов с доброкачественной патологией пищевода двум (40%) больным с ахалазией кардии IV степени выполнена демукозация пищевода с пластикой желудочным стеблем, проведенным в собственной мышечной оболочке пищевода. Трем (60%) пациентам с послеожоговыми обширными стриктурами пищевода выполнена субтотальная резекция пищевода с пластикой желудочным стеблем, проведенным за грудиной.
Для последующей оценки эффективности предложенного метода лимфодиссекции у пациентов с добавочной печеночной артерией все 66 больных раком желудка и пищевода были разделены на 2 группы:
– основная группа исследования – 18 (27,3%) пациентов с добавочной печеночной артерией;
– контрольная группа – 48 (72,7%) пациентов без вариантного сосуда, оперированных по традиционной методике.
При анализе объема лимфодиссекции и хирургического вмешательства, выполненного у пациентов, а также при стадировании опухолевого процесса после окончательного гистологического исследования группы сравнения признаны сопоставимыми по данным критериям.
Пациенты с доброкачественными заболеваниями пищевода составили отдельную группу, в которой оценивалась частота послеоперационных осложнений и функции печени, без поправок на показатели онкологической выживаемости.
Для определения характера органического поражения пищевода и желудка и выполнения адекватного хирургического лечения всем больным проводилось комплексное обследование. При этом эндоскопическое исследование явилось основным как для скрининговой диагностики рака верхних отделов ЖКТ, так и для уточнения локализации опухоли, макроскопического ее типа, а также получения биопсийного материала для морфологической верификации диагноза.
Экзофитный рост опухоли имел место у 31 (55,4%) из 56 больных, эндофитный – 20 (35,7%) случаев, смешанный – 5 (8,9%). Локализация опухоли в проксимальном (кардиальном) отделе желудка диагностирована у 12 (21,4%) пациентов, среднего отдела (тела) желудка – 13 (23,2%) пациентов, дистальных (антрального и препилорического) отделов желудка – 29 (51,8%) пациентов. У 2 (3,6%) пациентов отмечено тотальное поражение желудка (более одного отдела). Наличие язвенного дефекта слизистой оболочки желудка диаметром от 0,5 до 5,0 см выявлено у 34 (60,7%) пациентов, у 13 (23,2%) пациентов при осмотре установлен стеноз выходного отдела желудка.
У 10 пациентов с раком пищевода отмечался эндофитный характер роста опухоли, которая поражала окружности поперечного сечения у 2 (20%) пациентов, окружности – у 3 (30%) пациентов, имела циркулярное распространение – у 5 (50%) пациентов. По локализации опухоль нижней трети пищевода выявлена в 7 (70%) наблюдениях, средней трети – в остальных 3 (30,0%). Стеноз пищевода выявлен у 4 (40%) пациентов.
У всех из 5 пациентов с доброкачественными заболеваниями пищевода обнаружили значительную дилатацию пищевода, в котором натощак содержалась слизь и остатки пищи. Слизистая пищевода имела участки атрофии, в нижней трети была отечна, гиперемирована, местами контактно кровоточила. Кардия была сомкнута, при инсуффляции не раскрывалась. Основным эндоскопическим различием у 2 пациентов с ахалазией кардии явилось свободное прохождение тубуса эндоскопа диаметром 11 мм через кардию в желудок. У трех пациентов с послеожоговой стриктурой нижней трети пищевода тубус аппарата диаметром 9 мм проходил с большим с трудом в связи с выраженным рубцеванием стенки органа.
Эндоскопическая ультрасонография в комплексе с рутинным эндоскопическим исследованием позволила уточнить степень местного распространения рака желудка и пищевода, заинтересованность региональных лимфатических узлов, что напрямую влияло на выбор и характер оперативного лечения обследованных пациентов.
Из 56 пациентов с раком желудка распространение опухоли в пределах мышечного слоя органа отмечено в 14 (25%) наблюдениях; поражение всех слоев стенки органа - в 35 (62,5%) случаях и еще у 7 (12,5%) пациентов опухоль распространялась за пределы наружной оболочки органа. Переход опухолевой инфильтрации на стенку нижней трети пищевода выявлен у 4 (7,1%) пациентов с раком кардиального отдела желудка, переход на стенку ДПК – у 5 (8,9%) пациентов. При исследовании перигастрального пространства в 37 (66,1%) случаях выявлены лимфатические узлы размерами от 5 до 40 мм.
Из 10 больных раком пищевода рост опухоли по данным ЭУС ограничивался мышечным слоем лишь у 2 (20%) пациентов, поражал все слои стенки – у 6 (60%) и распространялся на окружающие ткани средостения – у остальных 2 (20%). В отличие от эндоскопического исследования, циркулярный рост опухоли отмечен в 7 (70%) наблюдениях, у остальных 3 (30%) пациентов опухоль занимала окружности поперечного сечения. При ультразвуковом сканировании периэзофагеального и перигастрального пространства у 8 (80%) пациентов выявлены увеличенные лимфатические узлы в заднем средостении и у 2 (20%) – по ходу малой кривизны желудка.
У пяти пациентов с доброкачественным поражением дистального отдела пищевода при ультрасонографии отсутствовало типичное для опухолевого роста нарушение дифференцировки по слоям. Двум пациентам с ахалазией кардии ЭУС позволила выявить утолщение циркулярного мышечного слоя пищевода в нижней его трети, диффузную гиперэхогенность мышечного слоя в месте сужения, как признак развития соединительной ткани и рубцового изменения мышечного слоя. Для 3 пациентов с послеожоговыми стриктурами не характерно утолщение мышечного слоя, напротив отмечалось его замещение на большом протяжении разными по форме участками гиперэхогенной соединительной ткани.
При трансабдоминальном ультразвуковом исследовании 56 пациентов с раком желудка симптом ППО в проекции органа был выявлен в 51 (91,1%) случае. Среди этих пациентов инвазия опухоли в мышечный слой отмечена у 9 (17,6%) больных, в субсерозный слой – у 35 (68,6%) больных, за пределы серозной оболочки – у 7 (13,8%) больных. При этом в последней категории больных у 6 отмечалась инфильтрация хвоста и тела поджелудочной железы, а у одного – симптом ППО в проекции поперечно-ободочной кишки. Из 56 больных раком желудка увеличенные лимфатические узлы выявлены в 39 (69,6%) случаях. Примерно у половины (46,4%) больных раком желудка диагностированы увеличенные регионарные лимфатические узлы различных групп.
Диагностика заболеваний пищевода, расположенного за грудиной, практически неосуществима: из 7 больных раком нижней трети пищевода признаки ППО абдоминального отдела выявлены лишь у 4 (57,1%). При обзорном ультразвуковом исследовании брюшной полости из 10 больных раком пищевода у 3 (30%) определены увеличенные лимфатические узлы в области чревного ствола, по ходу общей печеночной артерии, в области малой кривизны желудка, размерами от 8 до 25 мм.
К сожалению, ни в режиме реального времени, ни в режиме цветного дуплексного сканирования с помощью трансабдоминального УЗИ достоверно выявить добавочную печеночную артерию не удалось в силу анатомических особенностей исследуемой зоны.
Основным показанием к рентгеноскопии пищевода и желудка с барием явилось наличие стеноза пищевода или желудка, выявленные на ранних этапах диагностики. Всего рентгенологическое исследование было проведено 21 (31,8%) пациенту из 66 больных раком желудка и пищевода и 5 пациентам с доброкачественной патологией пищевода. Из них в 17 (65,4%) случаях показанием к исследованию явился опухолевый стеноз выходного отдела желудка, еще в 4 (15,4%) – опухолевый стеноз пищевода, в остальных 5 (19,2%) – доброкачественная стриктура нижней трети пищевода. У 4 (23,5%) пациентов с признаками стеноза выходного отдела желудка по данным трансабдоминального УЗИ контрастная взвесь из желудка эвакуировалась своевременно. Говоря о степени стеноза желудка, необходимо отметить увеличение доли субкомпенсированного и декомпенсированного стеноза по сравнению с результатами предыдущих исследований: из 13 (76,5%) пациентов компенсированный стеноз выявлен у 3 (17,6%); субкомпенсированный – у 7 (41,3%); декомпенсированный – у 3 (17,6%) пациентов. Субкомпенсированный стеноз пищевода установлен у 3 (75%) исследованных больных раком пищевода; декомпенсированный – у 1 (25%). У всех пяти пациентов с доброкачественным поражением пищевода диагностирован субкомпенсированный стеноз пищевода.
В плановом порядке радикальное оперативное лечение проведено 71 пациенту с органическим заболеванием желудка и пищевода, при этом у 66 (93,0%) пациентов со злокачественным поражением дополнительно выполнена расширенная лимфодиссекция с последующим патолого-анатомическим исследованием удаленных тканей и окончательным стадированием заболевания.
При оперативном лечении 71 пациента с органическими заболеваниями желудка и пищевода в 23 (32,4%) случаях интраоперационно была выявлена добавочная печеночная артерия (рис. 1 а). Для профилактики сегментарного некроза печени в послеоперационном периоде этим пациентам проведено интраоперационное исследование микроциркуляции левой доли печени по оригинальной методике (приоритетная справка РФ №2006102802 от 31.01.2006 г. «Способ выполнения операций на желудке и пищеводе при наличии добавочной печеночной артерии»).


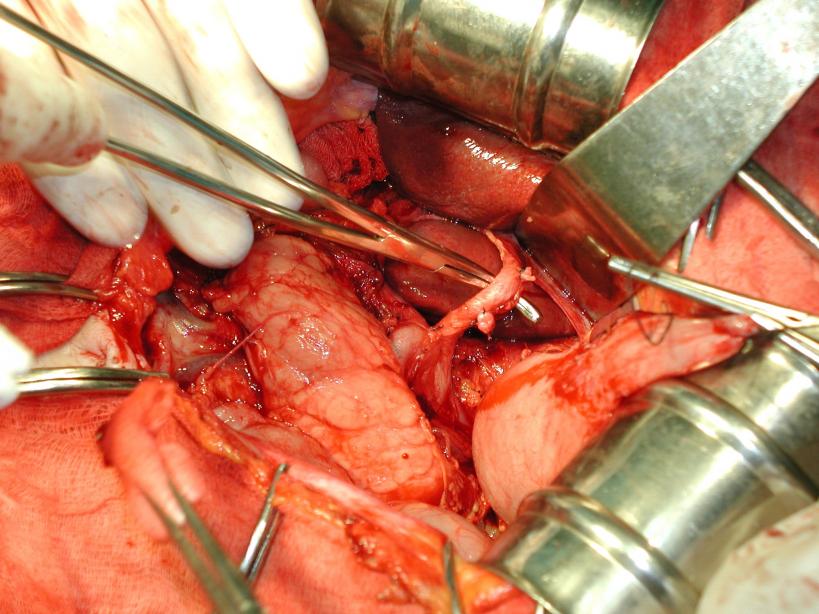

а. б.
Рис. 1. Интраоперационные фотографии этапов операции: а. – добавочная печеночная артерия в составе печеночно-желудочной связки; б. – окончательный вид скелетированной артерии.
Подойдя к нижнему краю печеночно-желудочной связки – месту прохождения добавочной печеночной артерии, выполняли ее выделение и подготовку к исследованию с помощью ножниц или электроножа. В качестве точки исследования использовали центр висцеральной или диафрагмальной поверхности левой доли печени. Датчик аппарата ЛАКК-01 красного спектра излучения (в связи с его большей проникающей способностью) устанавливали на капсулу печени в месте исследования. Запись показателей проводили в течение 2-3 мин без дополнительного медикаментозного и механического воздействия на печень – при этом регистрировали базовые показатели микроциркуляции. После этого накладывали сосудистую клипсу на добавочную печеночную артерию и продолжали запись показателей микроциркуляции в течение 5 минут. При снижении среднего арифметического значения показателя микроциркуляции на 25% и более, которое отмечено у 9 больных раком желудка, 2 больных раком пищевода, 2 пациентов со стриктурой пищевода и у одного больного ахалазией кардии IV степени, сохраняли добавочную печеночную артерию в связи с ее гемодинамической значимостью в кровоснабжении левой доли печени и риском развития сегментарного некроза печени в послеоперационном периоде.
При этом лимфодиссекцию выполняли следующим образом (патент РФ №2188594 от 10.09.2002 г. «Способ профилактики некроза левой доли печени при гастрэктомии по поводу рака пищевода и желудка при наличии добавочной печеночной артерии»): для удобства манипуляции с сосудами добавочную и общую печеночные артерии брали на держалки. Клетчатку и лимфатические узлы (7 и 8 групп) удаляли исключительно острым путем, придерживаясь адвентиции обнажаемых сосудов, начиная со стороны печени и печеночно-двенадцатиперстной связки, сдвигая удаляемую жировую ткань с лимфоузлами в сторону препарата.
Дойдя до истока добавочной печеночной артерии, перевязывали восходящую левую желудочную артерию, проводили ее препаровку со сдвиганием клетчатки в сторону малой кривизны желудка. Ветви второго порядка, идущие от добавочной печеночной артерии к желудку, под контролем глаза перевязывали и пересекали. Проксимальный отрезок левой желудочной артерии выше отхождения ДПА обрабатывали аналогичным образом вплоть до чревного ствола, смещая лимфатические узлы 7 и 9 групп в сторону препарата (рис. 1 б).
При сохранении адекватной микроциркуляции (у остальных 6 больных раком желудка, одного больного раком пищевода, одного пациента с ахалазией кардии IV степени и одного пациента со стриктурой пищевода) в тканях левой доли печени после пережатия добавочного сосуда (снижение среднего арифметического показателя микроциркуляции менее чем на 25% в первые 5 минут после пережатия сосуда), артерию перевязывали и пересекали непосредственно у места ее вхождения в ткань печени. Левую желудочную артерию и вену перевязывали раздельно сразу же над поджелудочной железой выше отхождения добавочного сосуда вблизи от чревного ствола и вместе с окружающей их клетчаткой и лимфатическими сосудами сдвигали в сторону препарата. Во всех случаях выполнено тщательное удаление лимфатических узлов 7, 8, 9 и 12 групп.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
В послеоперационном периоде проводился анализ, как хирургических осложнений, так и показателей онкологической выживаемости. Осложнений, связанных с технической стороной выполняемой операции, ни у одного из 23 пациентов с ДПА не отмечено. В целом, в группе онкологических больных добавочной печеночной артерией осложнения наблюдались у 7 (38,9%) пациентов, в контрольной группе – у 19 (39,6%) пациентов. Частота повторных вмешательств в группе исследования и контрольной группе составила 11,1% и 10,4%, соответственно. Основными причинами повторных вмешательств у пациентов обеих групп явились спаечная непроходимость, панкреонекроз культи поджелудочной железы, гематома селезенки. В исследуемой группе после операции не умер ни один пациент, в контрольной группе послеоперационная летальность составила 2,1%. Среди прочих осложнений раннего послеоперационного периода в группе пациентов с ДПА и контроля отмечены следующие: анемия различной степени тяжести (33,3% и 35,4%, соответственно), пневмония (11,1% и 10,4%), тромбофлебит вен нижних конечностей (16,7% и 14,6%), нагноение раны (0% и 4,1%), острый панкреатит (0% и 4,1%). Все осложнения были успешно купированы консервативными мероприятиями к моменту выписки пациентов из стационара. Средний послеоперационный койко-день у онкологических пациентов с ДПА составил 12,3±4,1; у пациентов контрольной группы – 13,2±5,6; и у пациентов с доброкачественной патологией пищевода – 8±1,2.
Для контроля функции печени у 9 пациентов с пересеченной во время операции ДПА проводили мониторинг показателей сывороточных трансаминаз и системы гемостаза, проводили их сравнение с группами пациентов с сохраненным добавочным сосудом и контрольной группой, не получавшими антикоагулянтной терапии (12 и 39 больных, соответственно). Достоверных различий в сравниваемых группах по показателям системы гемостаза не выявлено. Некоторое повышение среднего значения ПТО и фибриногена во всех группах в первые сутки после операции обусловлено операционной травмой и кровопотерей.
Напротив, при анализе уровня сывороточных трансаминаз у всех пациентов в группе с пересеченной ДПА с первых суток отмечалось повышение уровня АлАТ и АсАТ в 1,5-2 раза от исходных значений с максимумом на 3-4 сутки. При этом у всех пациентов отсутствовали признаки печеночной патологии в дооперационном периоде, а показатели системы гемостаза и уровень билирубина не отличались от таковых у пациентов с сохраненной ДПА и контрольной группы. Выявленные отклонения пришли в норму у всех пациентов на 8-9 сутки после операции на фоне инфузионной и гепатопротективной терапии. Функциональные печеночные показатели в группе с сохраненной ДПА не отличались от таковых в контрольной группе.
Все прооперированные больные находились на диспансерном учете, что позволило оценить уровни 1-, 2- и 3-летней выживаемости у онкологических больных. В группе пациентов с ДПА они составили 72,2%; 66,7% и 55,6%; соответственно. В контрольной группе – 72,9%; 64,6% и 54,2%.
Средняя продолжительность диспансерного наблюдения за выжившими пациентами обеих групп составила 46,5±8,2 месяцев (диапазон, 36-58 месяцев).
В послеоперационном периоде проводился мониторинг состояния больного с выполнением эндоскопии и ультрасонографии через 3 месяца, а затем 1 раз в полгода, что позволяло своевременно определить возможное рецидивирование основного заболевания и назначить специфическое лечение. Кроме того, с помощью трансабдоминальной ультрасонографии в послеоперационном периоде удалось исследовать и оценить состоятельность добавочной печеночной артерии у тех пациентов, у кого она была сохранена во время операции.
В ближайшие сроки (6-14 суток) после операции эндоскопическое исследование проводилось для контроля и изучения характера заживления пищеводно-кишечного анастомоза, а также визуальной оценки его проходимости. Среди 65 онкологических больных обеих групп у трех (4,6%) пациентов (в том числе одного с ДПА), перенесших гастрэктомию, и двух (3,1%) пациентов (по одному из каждой группы), перенесших субтотальную дистальную резекцию желудка, отмечался анастомозит 2 степени пищеводно-кишечного и желудочно-кишечного анастомозов, соответственно, с участками наложения фибрина по окружности анастомоза. У остальных 60 (92,3%) пациентов заживление проходило первичным натяжением. У пяти пациентов с доброкачественным поражением пищевода отмечена удовлетворительная клапанная функция созданного анастомоза, с признаками воспаления 0-1 степени.
Трансабдоминальное ультразвуковое исследование в послеоперационном периоде проводилось с целью оценки органов брюшной полости и области хирургического вмешательства в раннем послеоперационном периоде и своевременной диагностики возможных осложнений. В ранние сроки после оперативного вмешательства (от 3 до 12 суток) обследованы все пациенты (71 человек). На основании проведенного исследования среди 66 онкологических больных у трех (4,5%) пациентов контрольной группы был выявлен острый панкреатит; у четырех (6,1%) пациентов (включая одного с ДПА) – гипотония и перерастяжение отводящей петли анастомоза, расцененное как кишечная непроходимость; у двух (3,0%) пациентов (по одному из каждой группы) в первые 2-3 суток отмечено формирование подкапсульной гематомы нижнего полюса селезенки.
При оценке, собственно, структуры печени и ее левой доли в частности, ни у одного из данных 23 пациентов с ДПА не было выявлено очаговых или диффузных изменений. При оценке ткани печени в режиме цветного дуплексного сканирования у 8 (57,1%) из 14 пациентов с сохраненной ДПА визуализировался внутрипаренхимальный ствол диаметром 4-6 мм с хорошим спонтанным кровотоком (рис. 2). Кроме того, из 14 пациентов данной подгруппы у 11 (78,8%) при исследовании области чревного ствола помимо общей печеночной и селезеночной артерий визуализировался сохраненный добавочный ствол, диаметром 3-6 мм.

Рис. 2. Определение объемной и линейной скорости кровотока по вариантному сосуду.
Для исследования моторно-эвакуаторной функции выполняли полипозиционное рентгенологическое исследование пищевода и желудка с контрастной взвесью.
При рентгенологическом обследовании в сроки от 2 до 6 месяцев после операции у всех пациентов отмечена удовлетворительная удерживающая функция клапанных анастомозов, порционное поступление контрастной взвеси в нижележащие отделы ЖКТ, при этом отмечено раскрытие клапана на 12-17 мм. Гипотония культи желудка после проксимальных и дистальных резекций являлась следствием операционной травмы и наблюдалась в этом периоде одинаково часто у онкологических пациентов обеих групп. В положении Тренделенбурга заброс бариевой взвеси выше клапана отмечен лишь у одного (1,5%) пациента контрольной группы.
Таким образом, при анализе частоты и характера послеоперационных осложнений в обеих группах онкологических пациентов достоверных различий не выявлено, что указывает на отсутствие негативных эффектов, связанных с выполняемой интраоперационной манипуляцией, на течение раннего послеоперационного периода. Выявленные при анализе уровня сывороточных трансаминаз изменения, без сомнений, обусловлены пересечением добавочного печеночного сосуда, что привело к субклиническому цитолизу, не имевшему значимых последствий для здоровья пациентов и прочих проявлений при инструментальных методах исследования.
В отдаленные сроки (от 6 месяцев до 5 лет) эндоскопическое исследование выполнено 12 онкологическим пациентам с ДПА и 31 пациенту контрольной группы после различных по объему вмешательств. Местный рецидив по линии анастомоза выявлен у одного пациента из группы с ДПА, перенесшего гастрэктомию; рак культи желудка выявлен еще у двух пациентов контрольной группы перенесших субтотальную проксимальную и субтотальную дистальную резекции желудка. Среди остальных пациентов отмечены следующие изменения со стороны слизистой верхних отделов ЖКТ: у одного пациента контрольной группы, перенесшего гастрэктомию, отмечался рефлюкс-эзофагит на фоне недостаточности клапанного пищеводно-кишечного анастомоза, у двух пациентов контрольной группы (после проксимальной резекции желудка и после субтотальной резекции пищевода) регистрировался дуодено-гастральный рефлюкс и дистальный атрофический гастрит культи желудка; еще у двух пациентов (по одному из каждой группы) отмечался атрофический гастрит культи желудка после субтотальной дистальной резекции. У остальных онкологических пациентов, а также пациентов, оперированных по поводу доброкачественной патологии, нарушений со стороны слизистой оболочки проксимальных отделов пищеварительной трубки не выявлено.
В отдаленном послеоперационном периоде (от 6 месяцев до 5 лет) трансабдоминальное ультразвуковое исследование выполнено 70 пациентам (исключая одного пациента, погибшего в послеоперационном периоде), при этом у 24 (36,9%) из 65 онкологических больных (в том числе у шести пациентов с ДПА) выявлено метастатическое поражение печени в сроки от 6 месяцев до 2,5 лет после операции. У 10 (55,6%) из группы пациентов с ДПА не отмечено прогрессирования основного заболевания при комплексном обследовании в отдаленные сроки, среди них у 6 (33,3%) пациентов во время операции добавочный сосуд был сохранен, у 4 (22,3%) – пересечен. У данных пациентов структура ткани левой доли печени не имела достоверных различий с пациентами контрольной группы. У всех 6 онкологических больных с сохраненной во время операции ДПА сосуд отчетливо визуализировался при исследовании чревного ствола в режиме цветного дуплексного картирования. При этом определялся спонтанный магистральный кровоток со скоростью 13-17 см/сек, диаметр сосуда варьировал от 4 до 6 мм.
Рентгенологическое исследование в отдаленные сроки (от 1 до 5 лет) проведено 35 онкологическим пациентам (включая 10 с ДПА) после различных по объему оперативных вмешательств, при этом у большинства пациентов отмечался удовлетворительный последовательный пассаж контрастной массы по проксимальным участкам ЖКТ с адекватной функцией клапанного анастомоза; лишь у одного пациента контрольной группы после СДР желудка регистрировался желудочно-пищеводный рефлюкс и у одного пациента после резекции пищевода отмечался дуодено-гастральный рефлюкс.
Таким образом, предлагаемый способ оценки гемодинамического эффекта добавочной печеночной артерии при операциях на пищеводе и желудке позволяет объективно определить показания к пересечению или сохранению добавочного сосуда, что уменьшает число послеоперационных осложнений, связанных с сегментарным некрозом печени, без ухудшения здоровья пациентов в раннем послеоперационном периоде и без снижения показателей онкологической выживаемости.
ВЫВОДЫ
- Разработан и внедрен в клинику способ сохранения добавочной печеночной артерии у пациентов с органическими заболеваниями желудка и пищевода.
- Рутинные методы дооперационной диагностики не позволяют достоверно оценить тип артериального кровоснабжения печени, в связи, с чем интраоперационная ревизия остается основным методом диагностики добавочного печеночного сосуда, а интраоперационная лазерная допплеровская флоуметрия – единственным объективным методом оценки его влияния на кровоснабжение левой доли печени.
- Показанием к сохранению добавочной печеночной артерии при выполнении расширенной лимфодиссекции являются диаметр сосуда более 3 мм, снижение среднего арифметического значения показателя микроциркуляции, измеряемого с помощью лазерной допплеровской флоуметрии с поверхности левой доли печени, более чем на 25% в первые 5 минут после пережатия добавочного сосуда. Показанием к пересечению добавочной печеночной артерии являются диаметр сосуда менее 3 мм и снижение среднего арифметического значения показателя микроциркуляции менее чем на 25% в первые 5 минут после пережатия сосуда.
- Выполнение лимфодиссекции в области добавочной печеночной артерии при ее сохранении путем скелетизации стенки сосуда не приводит к ухудшению кровотока по нему в раннем и отдаленном послеоперационном периоде.
- Применение предлагаемого способа лимфодиссекции у пациентов с добавочной печеночной артерией позволяет уменьшить число послеоперационных осложнений, связанных с сегментарным некрозом печени, без ухудшения здоровья пациентов в раннем послеоперационном периоде и с сохранением показателей 1-, 2- и 3-летней выживаемости на уровне 72,2%, 66,7% и 55,6%, соответственно.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Оценка гемодинамической значимости добавочной печеночной артерии в кровоснабжении левой доли печени возможна при выполнении интраоперационно лазерной допплеровской флоуметрии у пациентов с раком желудка и пищевода и является обязательной для данной категории больных.
- У больных со снижением среднего арифметического значения показателя микроциркуляции, измеряемого с помощью лазерной допплеровской флоуметрии с поверхности левой доли печени, более чем на 25% в первые 5 минут после пережатия добавочного сосуда необходимо его сохранение для профилактики некроза печени. При снижение среднего арифметического значения показателя микроциркуляции менее чем на 25% в первые 5 минут после пережатия сосуда, возможно его пересечение без развития клинически значимых последствий.
- Трансабдоминальное ультразвуковое исследование в режиме цветного дуплексного сканирования в послеоперационном периоде позволяет визуализировать сохраненную добавочную печеночную артерию в ткани левой доли печени у 54,5% больных и при исследовании чревного ствола у 72,7%, что делает возможным оценить кровоток и состоятельность сосуда.
- Способ лимфодиссекции у пациентов с добавочным печеночным сосудом при операциях на пищеводе и желудке позволяет уменьшить число послеоперационных осложнений, связанных с сегментарным некрозом печени, без ухудшения здоровья пациентов в раннем послеоперационном периоде и без снижения показателей онкологической выживаемости.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Жерлов, Г.К. Лимфодиссекция при раке желудка при наличии добавочной печеночной артерии / Г.К. Жерлов, А.В. Карпович, О.Н. Блохина // Актуальные проблемы хирургической службы республики Тыва. – Кызыл, 2004. – с. 168.
- Жерлов, Г.К. К улучшению функциональных результатов в хирургии рака желудка // Г.К. Жерлов, Д.В. Зыков, А.В. Карпович // Новые технологии в онкологической практике. – Барнаул, 2005. – с. 67.
- Карпович, А.В. Профилактика некроза левой доли печени при радикальных операциях на желудке при наличии добавочной печеночной артерии / А.В. Карпович, О.Н. Блохина // Актуальные вопросы клинической медицины (Северск). – Томск, 2005. – с. 225-7.
- Коррекция моторно-эвакуаторной функции оперированного желудка в ранние сроки после операции / Г.К. Жерлов, А.П. Кошель, В.М. Воробьев и др. // Экспериментальная и клиническая гастроэнтерология. – 2005. – №4. – с. 44-48.
- Жерлов, Г.К. Профилактика некроза левой доли печени при операциях на пищеводе и желудке при наличии добавочной печеночной артерии / Г.К. Жерлов, Д.В. Зыков, А.В. Карпович // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – 2006. – №1 – с. 87.
- Карпович, А.В. К методике выполнения операций на пищеводе и желудке при наличии добавочной печеночной артерии / А.В. Карпович, Г.К. Жерлов, Н.П. Резанцева // XI всероссийская научно-практическая конференция «Молодые ученые в медицине». – Казань, 2006. – с. 234-5.
- Карпович, А.В. Обоснование сохранения добавочной печеночной артерии при операциях на желудке и пищеводе / А.В. Карпович, Г.К. Жерлов, Д.В. Зыков // Актуальные вопросы клинической медицины (Северск). – Томск, 2006. – с. 205-7.
- Карпович, А.В. Показания к сохранению добавочной печеночной артерии при оперативном лечении рака желудка и пищевода / А.В. Карпович, Г.К. Жерлов, Д.В. Зыков // Современные методы лечения онкологических больных : достижения и неудачи. – Барнаул, 2006. – с. 19-20.
ПАТЕНТЫ И ИЗОБРЕТЕНИЯ
Жерлов Г.К., Зыков Д.В., Кошель А.П. и др. Способ оперативного лечения дистального рака желудка. Положительное решение РФ №2005114848/14 (017027) от 17.04.06.
Список сокращений
АлАТ — аланинаминотрансфераза
АсАТ — аспартатаминотрансфераза
ЖКТ – желудочно-кишечный тракт
ДПК — двенадцатиперстная кишка
ЛДФ – лазерная допплеровская флоуметрия
ПТО — протромбиновое отношение
УЗИ – ультразвуковое исследование
ЦДС – цветное дуплексное сканирование
ЭГДС — эзофагогастродуоденоскопия
ЭУС — эндоскопическая ультрасонография

