Бесшовной метод пластики магистральных вен пористым имплантатом из сплава на основе никелида титана в эксперименте
На правах рукописи
БЫСТРОВ СЕРГЕЙ ВИКТОРОВИЧ
БЕСШОВНОЙ МЕТОД ПЛАСТИКИ МАГИСТРАЛЬНЫХ ВЕН ПОРИСТЫМ ИМПЛАНТАТОМ ИЗ СПЛАВА НА ОСНОВЕ
НИКЕЛИДА ТИТАНА В ЭКСПЕРИМЕНТЕ
14.00.27 – хирургия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
ТОМСК – 2007
Работа выполнена в Государственном образовательном учреждении высшего профессионального образования «Сибирский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию»
НАУЧНЫЙ РУКОВОДИТЕЛЬ:
доктор медицинских наук,
профессор Ивченко Олег Алексеевич
ОФИЦИАЛЬНЫЕ ОППОНЕНТЫ:
доктор медицинских наук,
профессор, Задорожный Александр Антонович
доктор медицинских наук,
профессор Баширов Рафаэль Серажудинович
ВЕДУЩАЯ ОРГАНИЗАЦИЯ: ГОУ ВПО Новосибирский государственный медицинский университет Росздрава.
Защита состоится «_____»__________________2007 г. в ___часов на заседании диссертационного совета Д 208.096.01 при Сибирском государственном медицинском университете (634050, г. Томск, ул. Московский тракт, 2).
С диссертацией можно ознакомиться в научно-медицинской библиотеке Сибирского государственного медицинского университета (634050,
г. Томск, пр. Ленина, 107).
Автореферат разослан «___»________________2007г.
Ученый секретарь
диссертационного совета Суханова Г.А.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Проблема эффективности лечения повреждений магистральных сосудов была и остается одной из самых актуальных задач экстренной хирургии. Особенностью таких состояний является острый дефицит времени, отпущенного на оказание экстренной хирургической помощи. Особые трудности представляет кровотечения из нижней полой вены, многие из которых заканчиваются геморрагическим шоком и смертью.
В этом вопросе существуют определенные трудности. Так у значительного числа пострадавших (16-49%) наблюдаются закрытые повреждения вен, что затрудняет их распознавание, к тому же в результате диагностических, организационных и тактических ошибок больные поздно поступают в специализированные сосудистые отделения. По мнению ряда авторов, лишь 18,5% больных с повреждением сосудов поступают в первые 6 часов с момента травмы. В военно - полевых условиях изолированное ранение вен явилось причиной гибели 39,6% больных с повреждением кровеносных сосудов на поле боя [Т.Е. Гнилорыбов, В.Л. Хенкин, 1944]. Значительные технические трудности, развитие тромбоза у 25% больных при восстановительных операциях на магистральных венах при их повреждении служат основной причиной сдержанного отношения к реконструктивным операциям на магистральных венах.
Повреждения магистральных вен составляют от 12,8% до 30,5% изолированных ранений вен и от 22,1% до 84,7% с одновременным поражением артерий и вен в мирное время и 3,7% и 41,7% соответственно - в военный период. Необходимо отметить, что повреждение артериальных сосудов при сочетанных травмах длинных трубчатых костей встречается более чем в 63 % случаев, а венозных – у 100 % пострадавших [В.В.Руцкой и соавт., 1989 г.]
Особую группу составляют ятрогенные повреждения сосудов при оперативных вмешательствах как полостных, так и эндоскопических, выполняемых в зоне расположения крупных вен, а также погрешности при выполнении диагностических и лечебных манипуляций, связанных с введением в просвет сосуда проводников, зондов, катетеров.
Хирургические вмешательства при повреждении магистральных сосудов проводятся в экстренных условиях и направлены на скорейшую остановку кровотечения и восстановление проходимости сосуда с целью сохранения жизни пациента и жизнеспособности конечности (органа). Хирургия вен имеет ряд специфических особенностей, обусловленных низким давлением крови в них, замедленным кровотоком, “нежностью” венозной стенки и повышенной возможностью тромбообразования. Восстановительные операции на магистральных венах, особенно малого и среднего калибра, отличаются значительными техническими трудностями, связанными с тонкостью стенок, наличием клапанов, легкой спадаемостью вен. До последнего времени восстановительным операциям на магистральных венах уделялось мало внимания. Слабо изучены возможности и роль реконструкции вен при отрывах, обширных анатомических разрушениях сегмента конечностей и сочетанной травме, не решены вопросы пластического замещения вен в ургентной хирургии.
В настоящее время разработаны тактика и методы лечения ранений магистральных вен. Существует много способов закрытия дефекта сосуда, начиная от различных модификаций сосудистого шва, пластики ауто - и ксенотрансплантатами и заканчивая всевозможными аллопротезами. Каждый из способов имеет свои преимущества и недостатки. В целом результаты хирургического лечения больных с флеботравмой до сих пор остаются неудовлетворительными, летальность составляет от 4,3% до 50,3%.
Иногда даже выполняется ампутация конечности вследствие развития гангрены. Вышеизложенное диктует необходимость проведения дальнейших исследований, направленных на улучшение результатов хирургического лечения повреждений венозных сосудов.
В последние годы в медицине нашли достойное применение качественно новые имплантируемые материалы – высокоэластичные сплавы с эффектом памяти формы. В связи с этим открылись широкие возможности использования последних в различных областях медицины. Применение сплавов из никелида титана позволило создавать принципиально новые конструкции имплантатов и в сосудистой хирургии.
Цель исследования
Разработать в эксперименте способ пластики дефекта магистральных вен при механических повреждениях пористой конструкцией из сплава на основе никелида титана.
Задачи исследования
- Разработать в эксперименте на животных методику закрытия дефекта магистральных вен пористой пластиной из сплава на основе никелида титана.
- Подобрать оптимальную форму и пористость пластины из сплава на основе никелида титана для быстрого и надежного гемостаза.
- Изучить изменения функциональных свойств магистральных вен при механических повреждениях после их пластики путем проведения рентгенографии, флебографии и ультразвуковой сонографии.
- Провести морфологическое исследование «новой» сосудистой стенки в области дефекта и в местах ее контакта с металлической пластиной по общепринятой методике, а также методом шлифования ткани в различные сроки от момента оперативного вмешательства.
- Дать обоснование и разработать показания для применения пористой пластины из сплава на основе никелида титана в клинической практике.
Научная новизна
Впервые проведено изучение применения пористой конструкции из сплава на основе никелида титана при механических повреждениях магистральных вен в эксперименте. Доказана биологическая и биомеханическая совместимость предлагаемой конструкции и венозного сосуда. Доказано отсутствие морфофункциональных нарушений сосудистой стенки в разные сроки с момента операции. Разработанная оригинальная конструкция из сплава на основе никелида титана и технология ее применения при механических повреждениях магистральных вен в эксперименте позволяет быстро и качественно надежно остановить венозное кровотечение. По заявке на патент № 2006103450 от 06.02.2006 г. на предлагаемый метод «Способ пластики магистральных вен» получено положительное решение от 12.02.2007 г.
Практическая значимость полученных результатов
Новый способ пластики дефекта магистральных вен пористой пластиной из сплава на основе никелида титана позволяет остановить кровотечение в максимально короткое время, технически просто и надежно.
Основные положения, выносимые на защиту
- Эксплантат из пористого никелида титана обладает биологической и биомеханической совместимостью с венозным сосудом.
- Эксплантат из пористого никелида титана прорастает соединительно- тканными, нервными клетками, капиллярами и создает механический каркас для формирования стенки сосуда в области дефекта.
- Разработанный способ пластики дефекта стенки венозного сосуда позволяет быстро и надежно осуществлять остановку кровотечения с восстановлением магистрального кровотока.
Внедрение результатов исследования в практику
Результаты исследования внедрены в практику хирургического отделения Томской областной клинической больницы. Основные положения исследования используются в учебном процессе на кафедре факультетской хирургии ГОУ ВПО СибГМУ Росздрава.
Апробация работы
Основные положения диссертации и полученные результаты работы были доложены на Конгрессах молодых ученых «Науки о человеке», г. Томск, 2004 г., 2005 г, 2006 г., на Всероссийской научно – практической конференции «Стандартизация медицинских технологий, реабилитация в ангиологии и сосудистой хирургии», г. Новокузнецк, 2006 г.
Публикации
Основные положения диссертации изложены в 7 печатных работах, в том числе 1 статья опубликована в журнале, входящем в «Перечень…» ВАК РФ. По результатам исследования получено положительное решение от 12.02.2007 г. по заявке на патент № 2006103450 от 06.02.2006 г. на предлагаемый метод «Способ пластики магистральных вен».
Объем и структура диссертации
Работа изложена на 102 страницах машинописного текста, состоит из введения, 3 глав, заключения, выводов, практических рекомендаций и указателя литературы. Работа иллюстрирована 2 таблицами, 31 рисунком. Указатель литературы содержит 255 наименований работ (176 отечественных и 79 иностранных авторов).
Материал и методы исследования
Изготовление проницаемой пористой пластины из сплава на основе никелида титана проводилось на базе медико-инженерного центра имплантатов с памятью формы Сибирского физико-технического института. В качестве материала для изготовления пористой пластины использовался сплав на основе никелида титана, приготовленный методом самораспространяющегося высокотемпературного синтеза (СВС). В основе данного метода лежит использование тепла, которое выделяется при взаимодействии (экзотермической реакции) различных элементов, в том числе разнородных материалов. Различают два процесса: СВС в режиме послойного горения и СВС в режиме теплового взрыва. В первом из них при возбуждении экзотермической реакции в некотором локальном объеме вещества выделяется тепло. Оно путем теплопроводности нагревает соседние слои вещества, вызывая в них реакцию, и обеспечивает перемещение зоны реакции в пространстве. При послойном горении химическая реакция происходит не во всем объеме вещества одновременно, а только в тонком слое – волне горения. При СВС в режиме теплового взрыва повышение температуры во всем объеме реакционной системы приводит к развивающемуся во времени саморазогреву, который подобен тепловому взрыву.
Для определения нужного диаметра пористых пластин проводилось две серии измерений.
Первая серия измерений выполнялась на преренальном отделе нижней полой вены собаки. Полученные данные были статистически обработаны и положены в основу определения необходимого диаметра пластины, которые применялись в экспериментальных исследованиях.
Вторая серия измерений выполнялась в клинике с помощью ультразвукового аппарата "Aloka SSD 1700", c использованием конвексного датчика с переменной частотой 3,5 – 5 МГц в режиме серошкального сканирования (В-режим), цветового допплеровского картирования (ЦДК). Методом сонографии определялся диаметр нижней полой вены человека в разных возрастных группах. Полученные данные служили основой для определения параметров конструкции, которая может быть предложена в клиническую практику, и для подтверждения объективности измерений нижней полой вены животного.
Расчет пористости применяемой пластины выполняется по формуле:
![]() ,
,
плотность пластины:
![]() .
.
Размер пор определялся методом секущих под микроскопом марки «Эпитип-2».
Конечной целью стендовых испытаний было определение показателей давления пористой пластины на единицу площади стенки сосуда, что является определяющим при дальнейшем применении пористых пластин разных размеров на сосуды различного диаметра. Давление вычислялось по формуле:
![]() (Н/мм2)
(Н/мм2)
Экспериментальный раздел работы выполнен в отделе патофизиологии Центральной научно-исследовательской лаборатории Сибирского государственного медицинского университета (директор - доктор медицинских наук, профессор А.Н.Байков).
Эксперименты проводились на 26 беспородных собаках обоего пола, находившихся до и после операции в обычных условиях вивария. Выбраковывались животные с кожными и другими заболеваниями и чрезмерно агрессивные. Использовались преимущественно гладко-шерстные собаки в возрасте от 4 до 6 лет. Возраст определялся по таблице состояния зубов, разработанной И. Л. Западником. Вес собак составлял от 12 до 20 кг. Все оперативные вмешательства на собаках согласно Приказа министра здравоохранения СССР № 755 от 12.08.77 г. "О мерах по дальнейшему совершенствованию организационных форм работы с использованием экспериментальных животных" выполнялись под общей анестезией. За день до операции животных не кормили, пить давали последний раз в 18 часов накануне дня операции. Эксперименты проводились в дневное время суток. Для премедикации применяли внутримышечно лекарственный коктейль следующего состава: дроперидол 0,5 мг/кг, димедрол 1,5 мг/кг, анальгин 50- 70 мг/кг, атропин 0,1 мг/кг. Затем через 20-25 минут животное фиксировали к операционному столу. Дальнейший наркоз осуществлялся путем внутриплеврального введения 5% раствора гексенала 15-18 мг/ 1кг веса с последующей интубацией и переводом на искусственную вентиляцию легких. Операционное поле выбривали и обрабатывали по Гроссиху-Филончикову.
Эксперимент проводили на преренальном отделе нижней полой вены через средне-срединный лапаротомный разрез. Во время операции животному внутривенно переливалось 500-700 мл изотонического раствора 5% раствора глюкозы. По окончании опыта внутримышечно вводили 4-5 мл 50% раствора анальгина, 2-3 мл 1% раствора димедрола. Применяемую пористую пластину из сплава на основе никелида титана стерилизовали методом тиндализации с последующей стерилизацией в сухожаровой камере, затем помещали для хранения в раствор 96° спирта. Накануне операции пористую пластину вынимали, и поджигали для выпаривания спирта, затем помещали в раствор антибиотиков широкого спектра действия.
Для сравнения результатов операций по разработанной методике в качестве контроля изучались также методика и исходы пластики дефектов нижней полой вены лоскутом аутовены, взятым из малой подкожной вены задней конечности из отдельного разреза. Этот вид пластики использовался для сравнения как общепринятый и наиболее часто применяемый для закрытия краевого дефекта сосуда. Контрольная группа состояла из 6 собак. Животных выводили из эксперимента через 7 суток, 1; 1,5; 3; 6; 12 месяцев после пластики нижней полой вены. Повторную операцию проводили по выше описанной методике.
С целью забора материала для дальнейшего исследования результатов опытов проводилась эвтаназия животных по следующей методике: после премедикации внутривенно вводили 3-5 мг 2% раствора гексенала, затем внутривенно максимально быстро вводили концентрированный раствор гексенала количеством 1мг сухого вещества.
Инструментальные методы исследования проводились с целью оценки результатов пластики. Сразу после проведения эксперимента выполнялось рентгенологическое исследование для контроля местонахождения пористой пластины из никелида титана в двух проекциях.
Для оценки диаметра нижней полой вены в месте пластики, а также для контроля адекватности гемостаза проводилась контрастная каваграфия. Каваграфия выполнялась следующим образом: через отдельный разрез в проекции бедренной вены животного выходили на последнюю, в которую путем катетеризации вводился контраст. Манипуляция осуществлялась в конце операции и при выведении животного из эксперимента. Исследование проводилось под общим наркозом. Через обнаженную бедренную вену пункционно по направлению к нижней полой вене проводился катетер. С этой целью использовался подключичный катетер разового применения с внутренним диаметром 1,4 мм. Свободный конец последнего соединялся с 20-граммовым шприцем "Рекорд", наполненным контрастным веществом. В качестве контраста применялся 76% раствор урографина. Для получения четких каваграмм в зависимости от веса животного, требовалось 15-20 мл контраста. Рентгеновский аппарат включали в момент введения последних 2-3 мл. Снимки выполнялись на рентгеновском аппарате марки "Дюна-2". Режим работы: напряжение 75 кВ, сила тока 20 мА, экспозиция 0,6 с, фокусное расстояние 25 см, чувствительность пленки 1000-1200 Р-1 обратных рентген. После выполнения контрастного исследования через катетер вводили 5000 ЕД гепарина для профилактики тромбоза. Целостность бедренной вены восстанавливали наложением сосудистого шва атравматичной нитью PROLENE 5/0. После чего ушивали ткани над веной.
В ходе всей операции, а также до и после нее производился электрокардиографический контроль за работой сердца. Запись электрокардиограмм выполнялась на шестиканальном электрокардиографе RFT BIOSET 6000. Скорость движения бумаги 25 и 50 мм/с. Для отведения электрических потенциалов сердца применялись игольчатые электроды, устанавливающиеся по стандартной методике. Запись ЭКГ выполнялась во II стандартном отведении.
Процессы образования и прорастания ткани в поры имплантата исследовали через 1,5 и 3 месяца после оперативного вмешательства методом шлифования. Исследования проводились на базе научно-исследовательского института медицинских материалов. По истечении указанных сроков пористые пластины из никелида титана извлекали из организма животного и проводили детальное микроскопическое исследование взаимодействия пористого имплантата с окружающими тканями. Для этих целей были приготовлены микрошлифы поверхностей извлеченных объектов. При этом использовали известный метод изготовления шлифов металлических материалов, специально усовершенствованный для исследуемых оригинальных объектов "никелид титана - ткань". Образцы шлифовали на шлифовальном станке, используя последовательно шкурки различной зернистости. После шлифования образцы тщательно полировали тонкой алмазной пастой на мокром сукне, затем последовательно промывали в мыльном растворе проточной водой, спиртом и просушивали фильтровальной бумагой на воздухе. Для того, чтобы уменьшить механическое повреждение тканей при шлифовании, скорость оборотов станка и усилия необходимые для шлифования были минимальными. Подготовленные таким образом поверхности шлифов исследовали на металлографическом микроскопе "Эпитип-2", устанавливая образцы на столик микроскопа и фотографировали их, используя фотокамеру "Зенит Е". Увеличение х 90 и х 180.
Морфологические исследования были выполнены на базе кафедры судебной медицины СГМУ. Материал забирали на 7 сутки, через I; 1,5; 3; 6; 12 месяцев от начала эксперимента. Такие сроки выведения животных из опыта обусловлены, по данным А.Д. Смирнова, формированием различных видов тканей в стенке нижней полой вены. Через срединный лапаротомный разрез выполняли резекцию оперированного сегмента нижней полой вены, отступив от пористой пластины из никелида титана проксимальнее и дистальнее на 15 мм. После макроскопического изучения резецированный сегмент нижней полой вены подвергался фиксации в 12% растворе нейтрального формалина в герметично закупоренных флаконах по 50 мл в течении 10 дней. Соотношение ткани и жидкости 1:10. После фиксации из него вырезались участки стенки нижней полой вены из места бывшего повреждения, прилежащие к пористой пластине из сплава на основе никелида титана. Последняя заливалась в парафин. В последующем из нее на ротационном микротоме готовились срезы толщиной 5-7 мкм, взятых снаружи и кнутри от пористой пластины. Это выполнялось с целью субъективного подтверждения прорастания тканью пористой пластины, так как по техническим возможностям микротомом нельзя сделать срез содержащий метал, а для объективного подтверждения прорастания имплантата тканью, мы использовали метод шлифования. Для морфологического изучения процессов регенерации сосудистой стенки применяли окраску препаратов гематоксилин-эозином, пикрофуксином по Ван-Гизону, резорцин-фуксином Вейгерта, серебрение. Все препараты изучали под микроскопом МИКМЕД-4.
Статистическая обработка экспериментального материала проводилась по методике Ю.И.Иванова и О.Н.Погорелюка (1990).
Вычисление средней арифметической производилось по формуле:
где: ![]() - средняя арифметическая величина;
- средняя арифметическая величина;
![]() - сумма всех показателей;
- сумма всех показателей;
n - количество показателей.
Квадратическое отклонение средней арифметической:
![]()
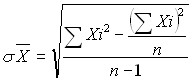
где: ![]() - среднее квадратическое отклонение квадратов индивидуальных показателей;
- среднее квадратическое отклонение квадратов индивидуальных показателей;
![]() - сумма квадратов индивидуальных показателей;
- сумма квадратов индивидуальных показателей;
![]() - квадрат суммы всех показателей;
- квадрат суммы всех показателей;
n - количество вариант в ряду.
Стандартная ошибка средней арифметической:
Оценку значимости различий двух средних арифметических проводили по критерию t Стьюдента:
где: ![]() - средняя арифметическая первого ряда,
- средняя арифметическая первого ряда,
![]() - средняя арифметическая второго ряда.
- средняя арифметическая второго ряда.
Различия считались статистически достоверными при Р < 0,05.
Результаты экспериментальных исследований
Цель эксперимента заключалась: в разработке методики закрытия дефекта нижней полой вены пористой пластиной из сплава на основе никелида титана; в подтверждении надежности гемостаза и проверке адекватности выбранной пластины с заданными физико-геометрическими параметрами относительно сосудистой стенки. Операции выполнялись под общим наркозом по вышеописанной методике. Эксперимент проводили на преренальном отделе нижней полой вены (рис.1).
а) б)
Рис.1. а) Схематичное изображение нижней полой вены и аорты: А. Нижняя полая вена (преренальный отдел), В. Аорта; б) Вшивание аутовенозной заплаты
Выполнялась средне-срединная лапаротомия. Доступ к нижней полой вене осуществлялся через брюшную полость. Общепринятый забрюшинный доступ по Пирогову не использовали, так как последний неприемлем для экстренных операций при ранениях магистральных сосудов, а также ввиду достаточно легкой травматичности брюшины собак.
Для сравнительной оценки результатов предлагаемого способа пластики с известным ранее, экспериментальные исследования были выполнены в двух группах опытов.
Первая группа опытов проведена на 5-и собаках. Выполнена пластика нижней полой вены общепринятым и наиболее часто используемым методом: закрытием дефекта лоскутом аутовены, взятым из малой подкожной вены через отдельный разрез в области латеральной лодыжки. Размер бокового дефекта составлял 10-15 х 2 мм.
После выкраивания из стенки нижней полой вены лоскута указанного размера в образованный дефект вшивали аутовенозную заплату с помощью обвивного сосудистого шва (рис. 1 б).
В момент восстановления кровотока во всех случаях из мест проколов иглой наблюдалось небольшое кровотечение, которое прекращалось после прижатия марлевыми тампонами в течение 1 минуты. После данного метода пластики животным выполнялись теже инструментальные методы исследований, что и основной группе собак после предлагаемого метода. Сроки их выведения из эксперимента совпадали со сроками выведения собак основной группы.
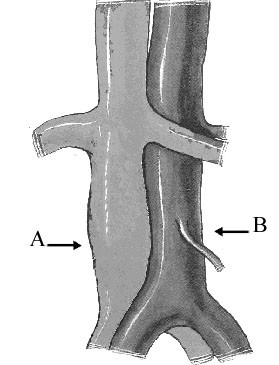
Вторая группа опытов проводилась на 19 собаках. Пластика дефекта нижней полой вены осуществлялась пластиной из сплава на основе никелида титана.

Рис.2. Пористая пластина из никелида титана применяемая для пластики дефекта нижней полой вены.
Выше и ниже места предполагаемого ранения под нижнюю полую вену подводили резиновые турникеты для предупреждения кровопотери.
Во всех последующих операциях описываемая техника выделения сосуда идентична. Дефект нижней полой вены производили остроконечным скальпелем, выкраивая лоскут размером 10-15 х 2 мм на передней и боковых сторонах сосуда в продольном и косом направлениях. Для пластики применяли пористую пластину, изогнутую по окружности сосуда. При кровотечении на нижнюю полую вену накладывали заранее приготовленную пористую пластину, пропитанную кровью животного в течение 30 секунд. Размер пластины превышал площадь дефекта по длине в 1,5 раза, по ширине соответствовал I/3-I/2 окружности сосуда. Применяли пластину желобообразной формы, толщиной 0,4 мм, пористостью 60±2% с размером пор 50-500 мкм. Пористая поверхность пластины придает ей шероховатость, что способствует "прилипанию" последней к адвентиции сосуда (рис.2).

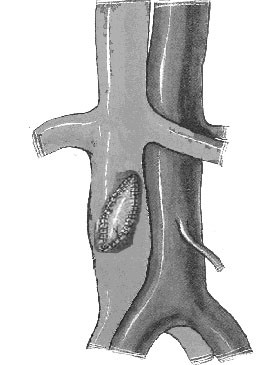
Рис. 3. Схема пластики дефекта нижней полой вены пористой пластиной из никелида титана: а). Дефект преренального отдела нижней полой вены; б). Дефект нижней полой вены закрыт пористой из никелида титана.
В течение 40-60 секунд во избежание массивной кровопотери пластину прижимали к сосуду марлевым шариком. Поры тромбировались, кровотечение останавливалось. Величина кровопотери определялась взвешиванием марлевых салфеток и шариков до и после операции и составляла 30-50 мл (рис.3). На этом основной этап операции считался завершенным. Видимой деформации стенки сосуда не отмечалось.
Место оперативного вмешательства орошали раствором антибиотиков (I млн ЕД пенициллина или 1 г канамицина). Выполняли перитонизацию нижней полой вены. Брюшную полость ушивали наглухо послойно. Операционные швы обрабатывали клеем "Лифузоль". По окончании операции с целью профилактики тромбоза внутривенно вводили 5 тыс.ед. раствора гепарина. После операции животные в течение 1 - 1,5 часов наблюдались в операционной, затем помещались в виварий. В послеоперационном периоде инфузионная терапия не проводилась. Течение послеоперационного периода оценивалось по поведению животного, желанию принимать пищу, изменениям частоты сердечных сокращений, массе тела. Как правило, в первые сутки после операции состояние животных было тяжелым, что обусловлено посленаркозной депрессией. Собаки были вялыми, отказывались принимать пищу, употребляли только воду. На 2-3 сутки активность возрастала, животные вставали, передвигались по виварию, охотно принимали пищу. На 6-7 сутки поведение их ничем не отличалось от поведения здоровых животных. Назначался обычный рацион.
В ходе проведения экспериментов погибли 2 собаки. Одна через 6 часов после операции от внутрибрюшного кровотечения, ввиду неправильно подобранного размера и пористости используемой пластины из никелида титана. Вторая - на 7-е сутки после пластики нижней полой вены аутовеной. При секционном исследовании было установлено, что смерть наступила от разлитого перитонита в результате спаечной тонкокишечной непроходимости. В данном случае и во всех других экспериментах осложнений, связанных с пластикой дефекта нижней полой вены пористой пластиной из никелида титана, не наблюдалось.
Для оценки результатов пластики проводились инструментальные методы исследований. Обзорные рентгенограммы брюшной полости выполнялись сразу после операции для контроля местонахождения пластины из никелида титана на нижней полой вене. Обзорные рентгенограммы выполнены у 10 собак (рис.4 а). Ни в одном случае не выявлено смещения пористой пластины относительно нижней полой вены.
В послеоперационном периоде для контроля адекватности гемостаза по окончании операции выполнялась катетеризационная каваграфия (рис. 4 б).
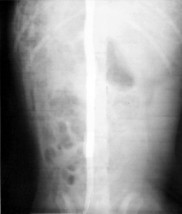
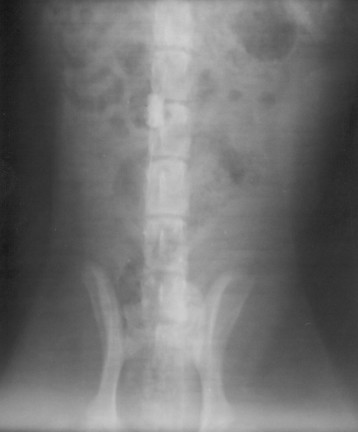
Повторные каваграммы выполняли при выведении животного из эксперимента с целью визуализации места пластики, диаметра сосуда, возможной окклюзии в месте стояния пластины.
а б)
Рис.4. а) Положение пористой пластины относительно нижней полой вены при обзорной рентгенографии., б) Положение пористой пластины относительно нижней полой вены при катетеризационной каваграфии.
Также для визуализации места пластики, диаметра сосуда, возможной окклюзии в месте стояния пластины выполнялось сонографическое исследование нижней полой вены.
У собак, оперированных по общепринятой методике с пластикой дефекта заплатой из аутовены в сроки до 1,5 месяцев, изменений диаметра нижней полой вены на каваграммах не обнаружено. Но у собаки, выведенной из опыта через 6 месяцев, наблюдалось аневризматическое выбухание контура нижней полой вены, проходимость последней не нарушена. Учитывая, что в раннем послеоперационном периоде расширения нижней полой вены не отмечалось, последующая дилятация не связана с неправильным выбором размеров заплаты. Скорее всего, данные изменения наступили вследствие структурной перестройки венозной стенки под влиянием новых гемодинамических условий, а именно значительного повышения давления по сравнению с давлением в венозной системе нижней конечности.
В ходе операций, а также до и после нее осуществлялся контроль за работой сердца электрокардиографическим методом. На представленных электрокардиограммах как до, так и после операции ритм сердечных сокращений правильный, расстояние между зубцами R - R одинаковое. Аритмии, экстрасистолии не отмечено. Высота желудочковых комплексов в одинаковых отведениях идентичны. Таким образом, кровопотеря, связанная с самой операцией и с кровотечением во время пластики, существенно не влияет на изменения гемодинамики.
Для анализа процессов регенерации и прорастания тканей через поры пластины из сплава на основе никелида титана через 1,5 и 3 месяца после оперативного вмешательства выполнялось исследование методом шлифования. На поверхности шлифов наблюдали узкую полоску пористой пластины из никелида титана. Количество пор по ширине пластины ограничено. Через 1,5 месяца после операции ткань прорастает в поры имплантата. Связь пористой пластины с образующейся тканью слабая, так как последняя имеет "рыхлую" структуру, находится в стадии формирования в зрелую ткань. Окружающая имплантат ткань и вновь образованная в порах имплантата отличаются по контрасту и структурному рисунку. Через 3 месяца ткань в порах имплантата хорошо сформирована и по структурному рисунку соответствует зрелой ткани. Ткань хорошо взаимодействует со стенками пор, повторяя их рельеф, и имеет прочную связь с ними. Ткань в основном полностью заполняет поры, однако, наблюдаются пустоты, как в центре пор, так и у их стенок. Структурный рисунок ткани идентичен практически во всех порах. Отмечается прочная связь на границе раздела имплантат - живая ткань (рис.5).

Рис. 5. Срез микрошлифа
Кроме исследования препаратов полученных методом шлифования была изучена гистологическая картина тканей нижней полой вены после пластики пористой пластиной из сплава на основе никелида титана и аутовеной, окрашена гематоксилин-эозином, по Ван-Гизону и Вейгерту, а также серебрением.
Целью макро- и микроскопических исследований явилось определение сроков формирования новой сосудистой стенки в области дефекта и реакции собственной ткани на конструкцию.
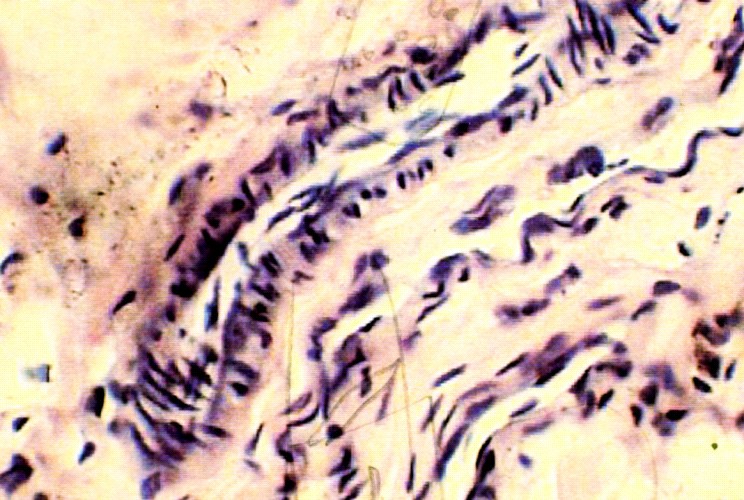
Через 7 дней после пластики дефекта нижней полой вены пористой пластиной из сплава на основе никелида титана на макропрепарате пластина снаружи окружена тканями рыхло спаянными с конструкцией и стенкой сосуда. Изнутри поры пластины заполнены фибрином. Граница перехода со стенки НПВ на пористую пластину сглажена и по всему периметру прослеживалась эндотелизация с краев стенки НПВ. При микроскопическом исследовании кнутри от пластины определяется молодая рыхлая соединительная ткань, представленная массой новообразованных сосудов, резко полнокровных с густой перифокальной инфильтрацией, представленной лимфоцитами, моноцитами с примесью большого количества фибробластов (рис.6 а).
а) б)
Рис. 6. а) Стенка нижней полой вены в области дефекта через 7 суток кнутри от пористой пластины из никелида титана. Окраска гемоатоксилин-эозин х 600; б) Стенка нижней полой вены в области дефекта через 7 суток кнаружи от пористой пластины из никелида титана. Окраска гемоатоксилин-эозин х 600.
Снаружи от пластины обнаруживается грануляционная ткань, пред-ставленная лимфоцитами, моноцитами с большим количеством фибробластов и массой новообразованных сосудов. Регенерация эндотелия идет с краев сосуда и путем трансформации соединительнотканных клеток рубца или субэндотелиальных клеток. Эластические волокна не прослеживаются (рис.6 б).
В первой серии опытов контрольной группы через 7 дней после пластики дефекта НПВ аутовенозной заплатой на макропрепарате наружная капсула не определялась, окружающая ткань была не спаяна со стенкой сосуда. Сужений или расширений в области заплаты не обнаруживалось. Внутренняя поверхность покрыта слоем фибрина до 1-1,5 мм толщиной. Отложение фибрина идет на поверхности отторгающегося венозного эндотелия. По линии шва отмечается блестящая полоска эндотелизации шириной до 1,5-2мм. Начинается организация фибриновой выстилки со стороны НПВ и формирование внутренней капсулы. Граница области соединения аутовенозной заплаты со стенкой НПВ четко определяется. Шовные нити отделены от просвета лишь узкой полоской ткани, состоящей из одного слоя.
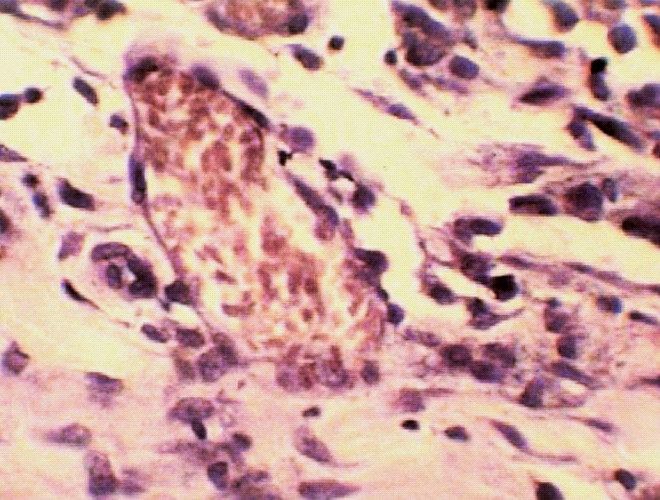
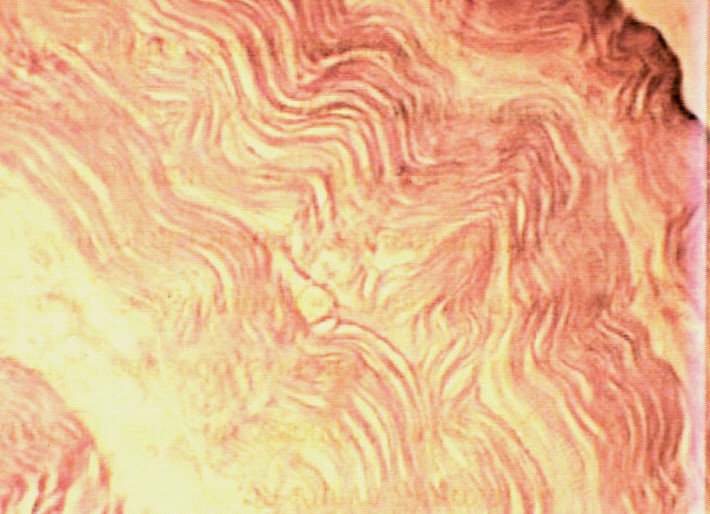
Во второй серии опытов через месяц после пластики дефекта пористой пластиной на макропрепаратах наружная поверхность ее покрыта тканями и плотно сращена с ними. Внутренняя поверхность пластины сформирована более четко, хотя соединительная ткань имеет неодинаковую толщину в различных отделах, поверхность почти полностью эпителизирована. При микроскопическом исследовании кнутри от никелид-титановой пластины отмечается скопление многочисленных фибробластов с единичными лимфоцитами, обнаруживается новообразование сосудов, резко полнокровных, по периферии лимфомоноцитарная инфильтрация (рис.7 а).

а) б)
Рис.7. а) Стенка нижней полой вены в области дефекта через 1 месяц кнутри от пористой пластины из никелида титана. Видны новообразованные сосуды, резко полнокровные. Окраска гемоатоксилин-эозин х 600; б) Стенка нижней полой вены в области дефекта через 1 месяц кнутри от пористой пластины из никелида титана. Видны богатая сеть коллагеновых и эластических волокон. Окраска по Вейгерту х 600.
Соединительная ткань богата коллагеновыми и эластическими волокнами (рис. 7 б). Снаружи от пластины определяется густая диффузно-очаговая инфильтрация, представленная лимфоцитами, моноцитами с большим количеством фибробластов, местами формируется подобие грануляционной ткани с массой новообразованных кровеносных сосудов, в том числе артериол, венул. При серебрении определяется нежная сеть аргирофильных волокон. Сохраняется явление межуточного отека. Инфильтрация отсутствует, скопления макрофагов нет (рис.8 а).
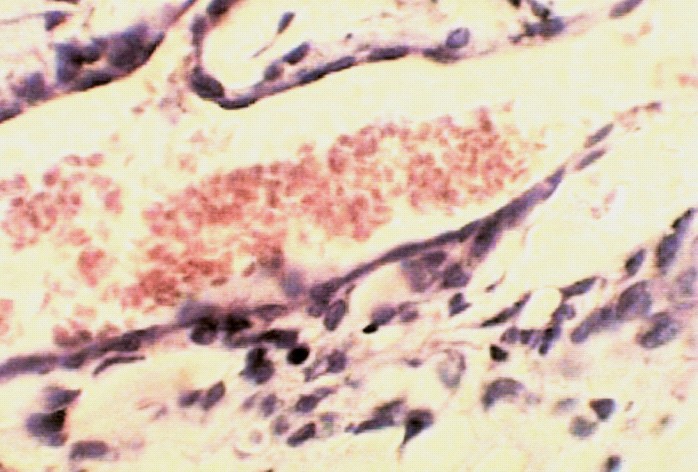
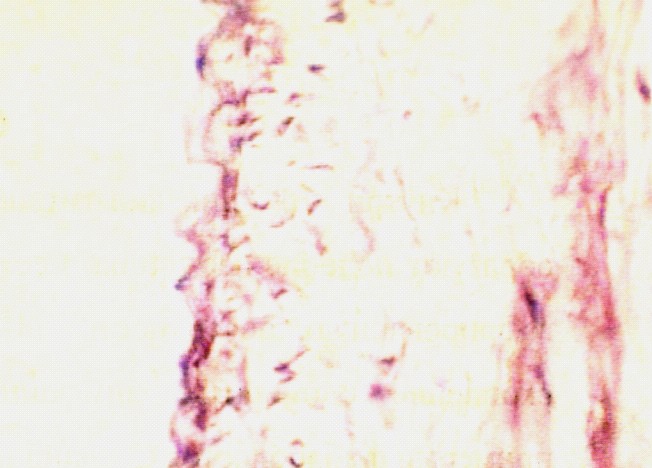
а) б)
Рис.8. а) Стенка нижней полой вены в области дефекта через 1 месяц кнаружи от пористой пластины из никелида титана. В месте стояния пластины отмечается разрастание коллагеновых волокон без клеточной реакции с явлениями межуточного отека. Окраска гемоатоксилин-эозин х 400; б) Стенка нижней полой вены в области дефекта через 1,5 месяца после пластики кнутри от пластины из пористого никелида титана. Видна неоинтима образующая гофрированную поверхность. Окраска гемоатоксилин-эозин х 600.
Во второй серии опытов через месяц после аутовенозной пластики дефекта НПВ на макропрепаратах наружная поверхность аутовенозной заплаты сращена с окружающими тканями. Внутренняя поверхность почти полностью покрыта эндотелиальными клетками. При микроскопическом исследовании аутовенозной заплаты во внутреннем слое определяются коллагеновые волокна. Видны фибробласты и гладкомышечная ткань. Эластика выражена слабо. Средний фиброзно-эластический слой состоит из коллагеновых пучков и частично фрагментированных эластических волокон. Адвентиция представлена соединительной тканью с многочисленными сосудами. Вокруг шовного материала адвентиции хорошо прослеживается микрофагальная и гигантоклеточная реакция.
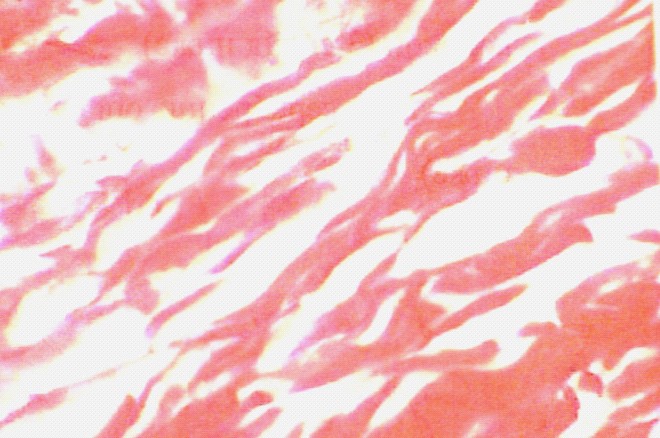

В третьей серии опытов после пластики пористой пластиной; через 1,5 месяца на макропрепарате пластина снаружи покрыта соединительнотканной капсулой, интимно связана с окружающими тканями, Внутренняя поверхность сосуда в области неоинтимы почти не отличается по цвету. При микроскопическом исследовании внутренняя капсула в основном представлена эндотелиальными клетками, которые образуют подобие неоинтимы, местами с явлениями пролиферации эндотелиальных клеток, формируя гофрированную поверхность (рис.8 б). Субэндотелиально отмечается скопление немногочисленных лимфоцитарных и моноцитарных элементов с примесью фибробластов, а также обширное разрастание коллагеновых волокон (рис.9 а).
а) б)
Рис.9. а) Стенка нижней полой вены в области дефекта через 1,5 месяца после пластики кнутри от пластины из пористого никелида титана. Видна обширная сеть коллагеновых волокон. Окраска по Ван-Гизону х 600; б) Стенка нижней полой вены в области дефекта через 1,5 месяца после пластики кнутри от пластины из пористого никелида титана. Видна обширная аргирофильная сеть с единичными осевыми цилиндрами. Окраска серебрение х 600.
В аргирофильной сети определяются единичные осевые цилиндры (рис.9 б). Кнаружи от внутреннего слоя пористая пластина заполнена соединительной тканью с хорошо выраженными коллагеновыми пучками. На границе интактной ткани в месте соприкосновения с имплантатом из сплава на основе никелида титана не отмечается выраженной воспалительной реакции в виде отека и инфильтрации форменными элементами крови лейкоцитарного ряда и макрофагами. Основные морфологические изменения выражены в более интенсивном развитии нежных коллагеновых волоконец рыхлой не оформленной соединительной ткани. Пористая пластина заполненная тканью ограничена двумя слоями: новообразованной внутренней капсулой и наружным слоем представленным зрелой соединительной тканью с выраженными кровеносными сосудами.
Что касается третьей серии опытов, через 1,5 месяца после пластики НПВ аутовенозной заплатой на макропрепарате наружная поверхность ее спаяна с окружающей клетчаткой. Внутренняя поверхность заплаты имеет матовый цвет и почти полностью покрыта эндотелием. При микроскопическом исследовании под эпителием располагался тонкий слой вытянутых веретенообразных клеток, которые по форме относятся к гладкомышечным клеткам, здесь же проходят тонкие эластические волоконца. Средний слой представлен коллагеновыми волокнами, среди клеток встречаются зрелые фибробласты. Наружный слой (адвентиция) состоит из зрелой соединительной ткани, среди которой выражены кровеносные капилляры.
Анализ результатов третьей серии опытов показывает более быстрое формирование неоинтимы при пластике дефекта НПВ пористой пластиной, здесь же прослеживается почти полное отсутствие реакции на имплантат. Тогда как при аутовенозной пластике выражена тканевая реакция на шовный материал, а также идет запаздывание формирования неоинтимы на венозной стенке. Известно, что скорость и качество формирования внутренней и наружной капсул, а также структурно-метаболическая перестройка в них зависят от вида используемого материала.

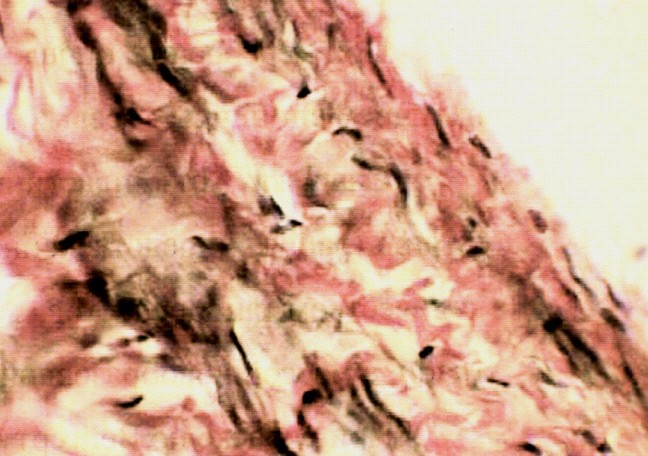
В четвертой серии опытов через 3 месяца после пластики НПВ пористой пластиной на макропрепаратах наружная поверхность ее покрыта соединительнотканной капсулой. Внутренняя поверхность гладкая, обычного цвета. Пря микроскопическом исследовании внутренняя капсула имеет зрелую соединительную ткань. Коллагеновые волокна располагаются продольно. Видны гладкомышечные клетки и эластические волокна. В глубине слоя определяются кровеносные сосуды, просвет их не изменен, иногда расширен.
а) б)
Рис. 10. а) Стенка нижней полой вены в области дефекта через 3 месяца после пластики кнутри от пластины из пористого никелида титана. Виден мышечно-эластический функциональный слой, множество новообразованных сосудов. Окраска гемоатоксилин-эозин х 600; б) Стенка нижней полой вены в области дефекта через 3 месяца после пластики кнаружи от пластины из пористого никелида титана. Видна зрелая соединительная ткань, пласты эластической ткани, сосуды, единичные нервные клетки. Окраска гемоатоксилин-эозин х 600.
Ядра эндотелиоцитов проявляют сродство и возвращаются ближе к исход-ному, реактивные явления убывают, формируется обычная стенка. Неоинтима НПВ приобретает характерное строение, ядра эндотелиоцитов умеренно окрашены. Процесс приспособления уже закончен или идет к концу. Этот пласт новой ткани является "функциональным" мышечно-эластическим слоем (рис.10 а).
Наружная капсула представлена лимфоцитами, моноцитами с большим количеством фибробластов, определяется густая диффузно-очаговая инфильтрация, местами формируется подобие грануляционной ткани с массой новообразованных сосудов, а также отмечается разрастание коллагеновых волокон, замещающих эластические на некотором протяжении. В месте контакта ткани с пористой пластиной из сплава на основе никелида титана отмечено интенсивное развитие соединительной ткани, выражающееся в виде нежных узких пучков интенсивно окрашенных коллагеновых волокон. За границей указанной зоны отмечается обычная соединительная ткань в виде пучков эластических волокон, их много, преимущественно широкими пластами, между ними разрастание кровеносных капилляров, встречаются нервные клетки (рис.10 б).
Необходимо отметить, что формирование соединительной ткани кнутри от пластины идет заметно быстрее, так как здесь отмечается снижение фиброзного компонента (видны единичные фибробласты), тогда как снаружи все еще идет формирование грануляционной ткани.
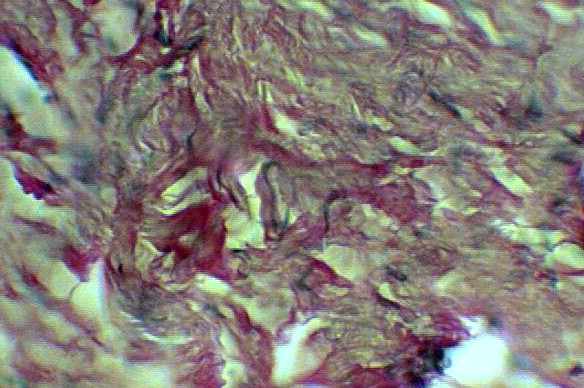
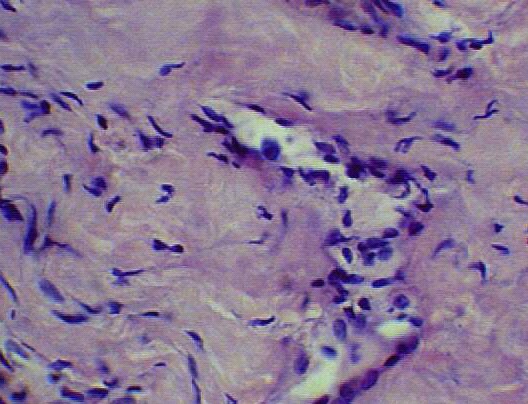
В пятой серии опытов через 6 месяцев после пластики дефекта преренального отдела нижней полой вены пористой пластиной на макропрепарате наружная капсула выражена, спаяна с окружающей клетчаткой. При микроскопическом исследовании кнутри от пластины обнаруживается сформированная неоинтима, субинтимально определяется преимущественно очаговая инфильтрация немногочисленными фибробластами (рис.11 а).
а) б)
Рис.11. а) Стенка нижней полой вены в области дефекта через 6 месяцев после пластики кнутри от пластины из пористого никелида титана. Видна сформированная неоинтима, со множеством кровеносных сосудов. Окраска гемоатоксилин-эозин х 600; б) Стенка нижней полой вены в области дефекта через 6 месяцев после пластики кнутри от пластины из пористого никелида титана. Виден эндотелий выстилающий кровеносный сосуд. Окраска гемоатоксилин-эозин х 600.
Обнаруживаются кровеносные сосуды, выстланные эндотелием (рис.11 б).
Определяется сформировавшийся эластический каркас (рис.12 а). Кнаружи от пластины видно завершение формирования соединительно-тканной капсулы. Определяются крайне немногочисленные фибробласты.
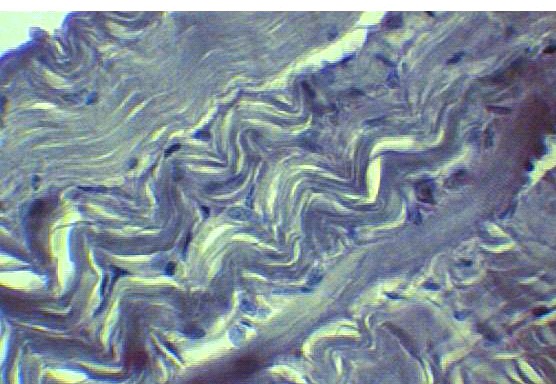
а) б)
Рис.12. а) Стенка нижней полой вены в области дефекта через 6 месяцев после пластики кнаружи от пластины из пористого никелида титана. Виден сформированный эластический каркас. Окраска по Вейгерту х 600; б) Стенка нижней полой вены в области дефекта через 6 месяцев после пластики кнаружи от пластины из пористого никелида титана. Видна сформированная соединительно-тканная капсула с множеством нервных волокон в ней. Окраска серебрение х 600.
Вблизи места стояния пластины определяются кровеносные сосуды как артериальные, так и венозные, имеются нервные клетки. У места перехода дефекта НПВ в пористую пластину соединительнотканный слой толще, а по направлению к середине пластина постепенно истончается. Выявляемая часть периферического нервного волокна характеризуется реактивными изменениями в виде наплывов нейроплазмы (рис.12 б).
Спустя 6 месяцев после аутовенозной пластики на макропрепарате видно аневризматическое выпячивание в области венозной заплаты. Наружная капсула интимно сращена с окружающей клетчаткой. Внутренняя поверхность капсулы матового цвета. При микроскопическом исследовании стенка аутовенозной заплаты также имеет три слоя. Во внутреннем слое, состоящем преимущественно из соединительной ткани наряду с фибробластами, встречаются гладкомышечные клетки. В глубине внутреннего слоя выявляются немногочисленные сосуды, осуществляющие васкуляризацию новообразованного слоя заплаты. Во внутренней зоне этого слоя сформирован мышечно-эластический пласт, где проходят эластические волокна и гладкие мышцы. Поверхность имеет почти везде эндотелиальное покрытие. Средний слой состоит из грубых фрагментированных коллагеновых пучков, гладкие мышцы почти не определяются. Адвентиция тонкая, выражены сосуды сосудов и появились нервные клетки.
В шестой серии опытов через 12 месяцев после пластики дефекта НПВ пористой пластиной из сплава на основе никелида титана на макропрепаратах в пророщенных пластинах деление на наружную и внутреннюю капсулы условно, так как они плотно связаны между собой через широкие поры пластины в единое целое. Наружная капсула связана с окружающей клетчаткой, внутренняя капсула неоинтимы по цвету не отличается от эндотелия вены. При микроскопическом исследовании ткань адвентиции над пористой пластиной напоминает зрелую соединительную ткань. Здесь расположены сосуды, пласты эластической ткани и
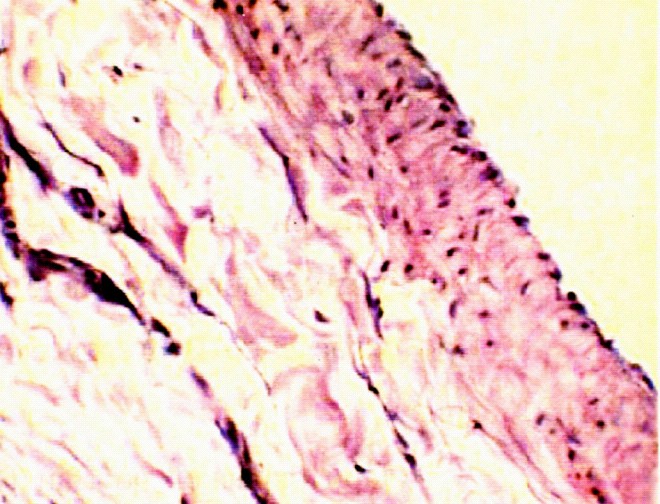
единичные нервные клетки (рис.13 а)
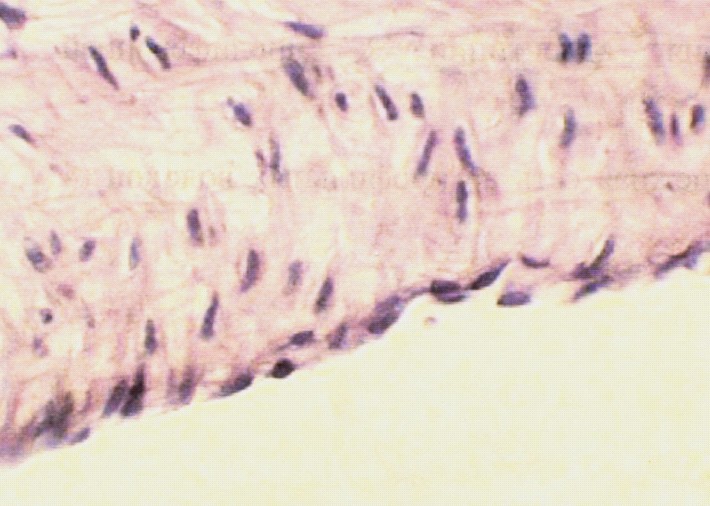
а) б)
Рис.13. а) Стенка нижней полой вены в области дефекта через 12 месяцев после пластики кнаружи от пластины из пористого никелида титана. Видна зрелая соединительная ткань с наличием единичных фибробластов. Окраска гемоатоксилин-эозин х 600; б) Стенка нижней полой вены в области дефекта через 12 месяцев после пластики кнутри от пластины из пористого никелида титана. Видна неоинтима богатая кровеносными сосудами и эластическими волокнами. Окраска гемоатоксилин-эозин х 600.
Внутренняя капсула полностью организована, мышечно-эластический слой хорошо выражен, на границе с краями НПВ толще. Эластические волокна отчетливо выражены, хотя они тоньше, чем в НПВ. Внутренняя поверхность эпителизирована на всем протяжении, выражены сосуды, эластика, определяется крайне немногочисленные фибробласты (рис.13 б).
На основании анализа полученных результатов пришли к следующим выводам. В первой серии опытов через 7 дней после операции макропрепарат уже имел внутреннюю и наружную капсулы. К этому времени на стыке края НПВ и пористой пластины кроме фибрина были и эпителиальные клетки, отмечено наличие эластической ткани, сосудистых капилляров. Прослеживая динамику развития неоинтимы, отмечается четкая дифференциация клеток и тканей пропорционально времени от момента операции. К 1,5 месяцам большую часть поверхности внутренней капсулы закрывают эпителиальные клетки, под которыми располагался, так называемый, функциональный слой, состоящий из мышечно-эластических волокон. К этому времени соединительная ткань плотно заполняет поры пластин, выражены кровеносные сосуды, появились нервные окончания. Отмечено также отсутствие воспалительной реакции вокруг пористой пластины. Полное развитие неоинтима получает к 6 месяцам от момента операции. В отличие от других пластических материалов пористая пластина, будучи эластичной, биохимически и биофизически совместимой, создает прочный каркас новой сосудистой стенки, а также необходимо отметить, что ни в одном из исследованных срезов, взятых в различные сроки, не отмечалось пристеночного тромбоза.
Изучены также морфологические данные другого трансплантата - аутовены. Выявлено, что ткань аутовены, функционируя в качестве заплаты, претерпевает изменения всех слоев венозной стенки. Эти изменения отмечены уже к 7 дню после операции, когда появляется отек стенки вены, клеточная инфильтрация, десквамация внутреннего слоя. Перестройка венозной стенки продолжается в течение 6 месяцев функционирования на новом месте. К этому времени на месте десквамационного внутреннего слоя вены организуется эпителизация неоинтимы, венозная стенка рубцуется, создавая условия для образования аневризмы, что отмечено в эксперименте. Описанные изменения постоянны в новых условиях функционирования вены, так как непривычные гемодинамические условия ведут к перестройке тканей трансплантата.
На основании вышеизложенного можно заключить, что эксплантат из сплава на основе никелида титана обладает всеми необходимыми свойствами материалов пригодных для пластики магистральных венозных сосудов.
ВЫВОДЫ
- Разработана в эксперименте методика закрытия дефекта магистральной вены пористой конструкцией из сплава на основе никелида титана. Новый способ пластики позволяет остановить кровотечение в максимально короткое время, технически прост и надежен.
- Установлено, что размер пластины должен превышать площадь дефекта по длине в 1,5 раза, по ширине соответствовать I/3-I/2 окружности сосуда. Наиболее отвечающей предъявляемым требованиям является пластина желобообразной формы, толщиной 0,4 мм, пористостью 60±2% с размером пор 50-500 мкм. Пористая поверхность пластины придает ей шероховатость, что способствует "прилипанию" последней к адвентиции сосуда.
- Инструментальные методы исследования показали, что пористая конструкция из никелида титана не вызывает сужения просвета сосуда и тем самым не изменяет гемодинамику венозного русла.
- Макро- и микроскопические методы исследования, выполненные в контрольные сроки после операции, показали, что процесс прорастания и заполнения пор пластины происходит в сроки до 3 месяцев. Образование неоинтимы начинается с 7-х суток и заканчивается полной эндотелизацией внутреннего слоя к 6 месяцу.
- На основании экспериментальных, инструментальных и морфологических методов исследования можно рекомендовать применение предлагаемого способа пластики в клинической практике в экстренных условиях, особенно в военно-полевой хирургии, требующих в максимально короткое время технически просто и надежно остановить кровотечение.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Пластику дефекта магистральных вен рекомендуется осуществлять по следующей методике. Выделение сосуда в месте ранения производится на протяжении 5-6 см. Затем на рану вены накладывается пористая пластина из сплава на основе никелида титана, превосходящая ее по длине в 1,5 раза, по ширине соответствующая I/3-I/2 окружности сосуда, с радиусом кривизны, конгруэнтной наружной стенке сосуда. Для осуществления максимально быстрого гемостаза пластина плотно прижимается к вене на 40-60 секунд.
- Для пластики дефекта магистральных вен необходимо иметь набор пористых пластин, изогнутых по окружности.
- Для пластики дефекта магистральных вен оптимальной является пористая пластина желобообразной формы, толщиной 0,4 мм, пористостью 60±2% с размером пор 50-500 мкм.
- Стерилизация конструкции из никелида титана может быть произведена в асептических растворах: спирт, первомур, хлоргексидин и др.
Список работ, опубликованных по теме диссертации
- Ивченко, О.А. Возможности ультразвуковой допплерографии в диагностике сосудов / Ивченко О.А, С.В. Быстров // Сборник трудов Областной клинической больницы. – Вып. V. – 1998. С.39 - 42.
- Ивченко, О.А. Новый метод бесшовной пластики магистральных вен пористой пластиной из никелида титана / О.А.Ивченко, В.Э. Гюнтер, А.О. Ивченко, А.И. Чернов, С.В. Быстров // Сборник трудов Областной клинической больницы. – Вып. VII. – 2001. С.18 - 21.
- Methods of sutureless plastics of the major veins with porous permeable implant on TiNi base / O.A. Ivchenko, S.V. Bystrov // Shape memory biomaterials and implants. – Tomsk.- 2001.- P. 62 – 64
- Ивченко, О.А. Оригинальный бесшовный метод пластики магистральных вен пористой пластиной из никелида титана / Ивченко О.А., Быстров С.В., Гюнтер В.Э. // Сборник трудов Областной клинической больницы. – Вып. IX. – 2002. С. 9 - 13.
- Быстров, С.В. К вопросу о выборе метода пластики дефекта магистральных вен при их ранениях / Быстров С.В., Ивченко О.А., Саадех Р.Д. / Сборник трудов Областной клинической больницы. – Вып. X. – 2003. С. 14 - 17.
- Быстров, С.В. оригинальный метод бесшовной пластики магистральных вен пористой пластиной из никелида титана / Быстров С.В., Ивченко О.А., Савельев И.О. // Мат.всеросс. науч – практ. конф. «стандартизация медицинских технологий, реабилитация в ангиологии и сосудистой хирургии», г. Новокузнецк.- 2006. – С.216.
- Быcтров, С.В. Новый бесшовный метод пластики магистральных вен пористым нитиноловым имплантатом в эксперименте / Быстров С.В. // Сибирский медицинский журнал. 2007. №2. С.78-82.

