Дифференцированный подход к диагностике и лечению гиперплазии эндометрия у женщин позднего репродуктивного и перименопаузального возраста
На правах рукописи
Станоевич Ирина Васильевна
Дифференцированный подход к диагностике и лечению гиперплазии эндометрия у женщин позднего репродуктивного и перименопаузального возраста
14.00.01 – Акушерство и гинекология
14.00.15 – Патологическая анатомия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва-2007
Работа выполнена в
Московской Медицинской Академии им. И.М.Сеченова.
Научные руководители:
доктор медицинских наук, профессор Ищенко Анатолий Иванович
доктор медицинских наук, профессор Коган Евгения Алтаровна
Официальные оппоненты:
член-корреспондент РАМН,
доктор медицинских наук, профессор Сидорова Ираида Степановна
член-корреспондент РАМН,
доктор медицинских наук, профессор Кактурский Лев Владимирович
Ведущее учреждение: Московский областной научно-исследовательский институт акушерства и гинекологии
Защита диссертации состоится « » 2007 года в часов на заседании диссертационного совета Д.280.040.03 при Московской Медицинской Академии им. И.М.Сеченова (119992, г.Москва, ул. М.Трубецкая, д.8, стр.2)
С диссертацией можно ознакомиться в Центральной медицинской научной библиотеке (117998, г. Москва, Нахимовский проспект, д.49)
Автореферат разослан « » 2006 года
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Шулутко Александр Михайлович
Общая характеристика работы.
Актуальность. Гиперплазия эндометрия (ГЭ) в позднем репродуктивном и перименопаузальном возрасте представляет собой актуальную медико-социальную проблему. (Макацария А.Д. и соавт, 1998; Савельева Г.М. и соавт., 1998) Это обусловлено изменением демографической ситуации в нашей стране, ограниченными возможностями консервативного лечения в связи с сопутствующими заболеваниями, высокой частотой рецидивирования и возможностью малигнизации. Частота рецидивирования ГЭ составляет от 30% после лечения до 50% без лечения. (Вихляева Е.М., 1990; Уменушкина Л.Н., 1982) Частота малигнизации зависит от предшествующей формы ГЭ и составляет от 0,25% до 50%. (Адамян Л.В, 1991; Бохман Я.В. и соавт, 1995; Gruber D.M. et al., 1999)
К изучению этиологии, клинико-патогенетических вариантов течения, морфологии, значения иммунных нарушений в организме, изменению биомолекулярных маркеров в эндометрии обращались многие исследователи. (Бреусенко В.Г. и соавт., 1996; Белоцерковцева Л.Д., 1999; Лысенко О.Н., 2003; Савельева Г.М. и соавт., 1998; Valenazo M., 1999)
Несмотря на значительные успехи в изучении ГЭ вплоть до молекулярного уровня, усовершенствование тактики ведения и методов лечения данной патологии с применением новых технологий, данное заболевание остается важной проблемой гинекологии и онкологии. При этом рак эндометрия занял 4 место в структуре онкологических заболеваний у женщин. (Новикова Е.Г., 1999; Чиссов В.И., 1999; P.J. Di Saia et al., 1998)
В зависимости от морфологической картины ГЭ может быть предраковым процессом эндометрия. При этом отсутствует четкий комплекс клинических, патоморфологических и иммуногистохимических критериев максимального и минимального риска малигнизации. Это ведет к проведению неадекватного лечения, как в сторону недостаточной, так и сторону избыточной радикальности, основанной на субъективных клинических и морфологических признаках.
В связи с выше изложенным, следует необходимость усовершенствования обследования и тактики ведения женщин с ГЭ в позднем репродуктивном и перименопаузальном возрасте.
Целью настоящего исследования служило усовершенствование диагностики и лечения гиперплазии эндометрия у женщин позднего репродуктивного и перименопаузального возраста.
Для реализации поставленной цели были определены следующие задачи:
1. Изучить клинико-морфологические особенности ГЭ у женщин позднего репродуктивного и перименопаузального возраста.
2. Выяснить патогенетическую роль биомолекулярных маркеров (Ki-67, EGF, EGFR, TGF-, VEGF, белка Р53, белка апоптоза, рецепторов эстрогенов и прогестерона) в развитии ГЭ.
3. Оценить зависимость между содержанием указанных биомолекулярных маркеров и морфологической формой ГЭ.
4. Определить ценность иммуногистохимического исследования маркеров пролиферации, апоптоза, ангиогенеза и рецепторного статуса эндометрия для диагностики ГЭ.
5. Определить дифференцированный подход к лечению [консервативному (использование прогестагенов, аналогов гонадотропин-релизинг гормона) или хирургическому (экстирпация матки, надвлагалищная ампутация матки, аблация эндометрия)] ГЭ в зависимости от морфологического заключения, верифицированного иммуногистохимическим методом.
6. Обосновать необходимость выделения больных позднего репродуктивного и перименопаузального возраста и пациенток с сочетанной патологией матки (ГЭ, миома матки, аденомиоз) в группу риска по возникновению рецидива и прогрессированию ГЭ.
Научная новизна.
- На основании выявленных особенностей экспрессии маркеров пролиферации, апоптоза, ангиогенеза и рецепторов эстрогенов и прогестерона впервые предложена патогенетически обоснованная дифференцированная тактика лечения больных с ГЭ в зависимости от морфологического заключения, подкрепленного иммуногистохимическими критериями.
- Впервые предложено использование оценки экспрессии сосудистого эндотелиального фактора роста (VEGF) и белка Р53 для выявления ГЭ с высоким злокачественным потенциалом и определения показаний к гистерэктомии (№ заявки на изобретение 2006108570);
- Впервые сформулировано понятие об отсроченной гистерэктомии у женщин с комплексной гиперплазией эндометрия с атипией (КГСА) после реализации генеративной функции.
Практическая значимость.
Данные иммуногистохимического исследования позволяют выдвинуть концепции развития каждого морфологического варианта ГЭ и, в соответствии с этим, применять дифференцированную тактику лечения пациенток с ГЭ.
На основании полученных данных, доказана целесообразность включения иммуногистохимического определения патогномоничных маркеров различных вариантов ГЭ в алгоритм диагностики гиперплазии эндометрия.
Обнаруженные особенности рецепторного статуса эндометрия при простой гиперплазии (ПГ) и комплексной гиперплазии эндометрия без атипии (КГБА) объясняют эффективность гормональной терапии при ПГ и ее более низкую эффективность при КГБА.
Появление иммуногистохимически определяемого белка Р53 при КГСА свидетельствует о необратимости изменений, произошедших в эндометрии, и диктует необходимость осуществления радикального хирургического вмешательства.
Внедрение результатов в практику. Результаты исследования внедрены в клиническую практику клиники акушерства и гинекологии и диагностическую работу биопсийной лаборатории ММА им. И.М.Сеченова. Материалы диссертации используются при чтении лекций и проведении практических занятий со студентами и клиническими ординаторами на кафедре акушерства и гинекологии №1 ММА им. И.М.Сеченова и кафедре патологической анатомии ММА им. И.М.Сеченова.
Апробация работы состоялась 18 октября 2006 года на заседании кафедры акушерства и гинекологии №1 лечебного факультета ММА им. И.М.Сеченова. Диссертация рекомендована к защите.
Публикации. По материалам диссертации опубликовано 7 работ: из них статей в центральных журналах - 1, тезисов в материалах научных конференций - 4, заявок на изобретение – 1, публикаций в зарубежных изданиях – 1.
Положения диссертации, выносимые на защиту:
- Гиперплазия эндометрия представляют собой заболевание с различными механизмами возникновения, морфологическими и молекулярно-генетическими изменениями слизистой оболочки матки. Изменение показателей маркеров пролиферации, апоптоза, неоангиогенеза и рецепторного статуса эндометрия различных морфологических вариантов гиперплазии эндометрия являются ранним этапом развития заболевания..
- Клинические проявления гиперплазии эндометрия (метроррагия, менометроррагия, отсутствие жалоб) с одинаковой частотой встречаются при ее различных гистологических варианта, а также миоме матки и аденомиозе, и указывают на необходимость проведения диагностического поиска пролиферативных процессов матки.
- Используемый в настоящее время «золотой стандарт» обследования пациенток на предмет гиперплазии эндометрия недостаточен для точной диагностики заболевания. Современный уровень знаний диктует необходимость определения онкомаркеров (VEGF и Р53) для диагностики и дифференцированного подхода к лечению гиперплазии эндометрия.
Структура и объем диссертации.
Диссертация состоит из введения, 4 глав (обзор литературы, материал и методы исследования, результаты собственных исследований, обсуждение полученных результатов), выводов, практических рекомендаций и списка использованной литературы. Текст диссертации изложен на 136 страницах машинописного текста, иллюстрирован 20 микрофотографиями, 11 таблицами, 16 диаграммами и 2 схемами. Библиографический указатель включает 188 источников: из них - 99 отечественных, 89 - зарубежных авторов.
Содержание работы.
Клиническая характеристика больных и
методы исследования и лечения.
В исследование включено 98 больных позднего репродуктивного и перименопаузального возраста (с 35 лет до 2 лет постменопаузы включительно), обратившихся в клинику акушерства и гинекологии им В.Ф.Снегирева ММА им. И.М.Сеченова в период с 1997 по 2005 год. Из них 76 пациенток с морфологически верифицированной ГЭ, составили основную группу, и 22 женщины с морфологически верифицированным отсутствием патологии эндометрия) – контрольную группу.
Возраст пациенток варьировал от 35 до 56 лет. Средний возраст в основной группе составили 45,6±6,1 лет, в контрольной группе 43,4±6,7года. Возрастной состав женщин представлен в таблице 1.
Таблица 1. Возрастной состав больных
| Возраст, годы | Основная группа N=76 | Контрольная группа N=22 |
| 35-39 | 15 | 4 |
| 40-44 | 16 | 10 |
| 45-49 | 30 | 6 |
| 50 и старше | 15 | 2 |
Основные жалобы пациенток основной и контрольной групп представлены в таблице 2.
Таблица 2. Основные жалобы пациенток
| Жалобы | Основная группа (N=76) | Контрольная группа (N=22) |
| Меноррагия | 39 (51,3%) | 11 (50%) |
| Метроррагия | 43 (56,6%) | 11 (50%) |
| Альгоменоррея | 24 (31,6%) | 2 (9,1%) |
| Бесплодие | 6 (7,9%) | 8 (36,4%) |
| Боли в гипогастрии | 16 (21,1%) | 3 (13,6%) |
| Астенический синдром (слабость, вялость, быстрая утомляемость) | 32 (42,1%) | 9 (40,9%) |
| Отсутствие жалоб | 8 (10,5%) | 0 |
Большинство обследованных больных были правильного телосложения. 34 (34,7%) женщины страдали избыточной массой тела либо ожирением 1 степени. Мы наблюдали увеличение ИМТ с возрастом: если в возрастной группе 35-39 лет он составил 23,1±1,3кг/м2, то в возрастных группах 40-44, 45-49, 50 лет и старше он составил 25,9±0,9; 27,4±3,1; 28,1±2,5 кг/м2 соответственно.
Изучение наследственности и аллергоанамнеза, перенесенных инфекционных и неинфекционных заболеваний не выявило достоверных различий в основной и контрольной группах. 45 (45,9%) женщин страдали двумя и более хроническими соматическими заболеваниями.
При изучении характера менструальной функции установлено, что средний возраст менархе составил 13,7±1,2 лет. Появление первой менструации до 12 лет отмечено у 2 (2,3%) пациенток, в 15 лет и старше – у 5 (6,0%) пациенток. Продолжительность менструального цикла у большинства пациенток 77 (78,5%) находилась в пределах 28-30 дней. Длительность менструаций у 67 (68,4%) больных составила 5 и более дней. Средний возраст наступления менопаузы у 16 (21,1%) обследованных женщин основной группы составил 51±1,4год. Статистически достоверных различий в особенностях менструальной функции между основной и контрольной группами не выявлено.
Удельная частота искусственных абортов, родов, самопроизвольных абортов и трубных беременностей к общему числу беременностей соответственно составила 61,2%, 27,1%, 10,2%, 1,5%.
При анализе перенесенных и имеющихся гинекологических заболеваний установлено, что наиболее часто встречались воспалительные заболевания внутренних половых органов 49 (58,3%), из них: эндометриты, возникшие после родов и абортов у 12 (14,3%), а также миома матки (ММ) – 50 (65,9%), аденомиоз (А) – 21 (27,6%). Данные о частоте ММ и А в основной группе представлены в таблице 3.
Таблица 3. Частота миомы матки и аденомиоза у женщин основной группы
| Абсолютное количество (N=76) | % | |
| Миома матки | 37 | 48,7 |
| Аденомиоз | 8 | 10,5 |
| Сочетание миомы матки и аденомиоза | 13 | 17,1 |
Таким образом, ММ и А отсутствовали у 18 (23,7%) больных основной группы.
Дисфункциональные маточные кровотечения в анамнезе отмечены у 47 (48,0%) женщин основной группы и у 4 (18,2%) контрольной группы.
ГЭ был впервые выявлен у 41 (53,9%) пациентки, у 35 (46,1%) процесс носил рецидивирующий характер. Число рецидивов варьировало от 1 до 6 и, в среднем, составило 1,8±0,7. Анамнез заболевания ряда пациенток достигал 18 лет, с периодами «ремиссии» 1-5-10 лет. Число больных с рецидивирующим течением ГЭ в зависимости от возраста отражено на диаграмме 1.

Из полученных данных следует, что наиболее часто рецидивирующий характер течения ГЭ наблюдался в возрасте 40-49 лет; а с 40 лет риск рецидива возрос в 1,5 раза.
В целях воздействия на ГЭ все женщины с рецидивирующим течением процесса ранее получали консервативную терапию прогестагенами и/или антигонадотропинами по стандартным схемам. У 14 (40%) больных отмечали побочные эффекты различного характера.
Осмотр шейки матки в зеркалах в 9 (9,2%)случаях позволил выявить рубцовую деформацию шейки матки, в 10 (10,2%) случаях – цервикальную эктопию. Указанные находки были подтверждены и дополнены данными, полученными при расширенной кольпоскопии.
Данные бимануального гинекологического исследования у женщин с ГЭ отличались от нормативных в случае наличия сопутствующей патологии внутренних гениталий и не позволяли с достоверностью предположить или опровергнуть диагноз ГЭ.
Всем пациенткам проводили расширенную кольпоскопию при помощи бинокулярного кольпоскопа фирмы «Leistgang» (Германия). Доброкачественная патология шейки матки была обнаружена у 30 (30,6%) больных. Наиболее часто встречались посткоагуляционный синдром -20(20,4%) и ретенционные кисты шейки матки - 13 (13,2%), эктопия шейки матки – 10 (8,9%).
Наиболее ценным методом исследования для установления предварительного клинического диагноза и показаний к проведению гистероскопии, выскабливанию эндоцервикса и эндометрия явилась трансвагинальная эхография, которую осуществляли при обращении в клинику, а затем 4-5 раз в процессе лечения. Ультразвуковое исследование проводили на аппаратах «Acuson 128XP/10» (США), относящегося к системам контактного сканирования и работающем в реальном масштабе времени, с трансвагинальным конвексным датчиком ЕС7 частотой 7МГц и трансабдоминальным датчиком С3 с частотой 3,5МГц, и «Toshiba-SSH-140A» с трансвагинальным конвексным датчиком с частотой 6,5МГц.
У пациенток с отсутствием жалоб величина М-эхо была решающей в установлении предварительного клинического диагноза и определения показаний для проведения гистероскопии и раздельного диагностического выскабливания (РДВ). В 67,1% (51 пациентка) толщина М-эхо варьировала от 12,1 до 22мм, у 10 (13,2%) пациенток, находящихся в постменопаузе, толщина эндометрия превышала 4мм, а у 5 (6,6%) была менее 4мм. Поводом проведения гистероскопии и РДВ у последней группы женщин послужили жалобы на метроррагию. У 10 (13,2%) больных, с и без сопутствующей патологии миометрия, предъявлявших жалобы на менометроррагию, при ультразвуковом исследовании эндометрий имел неоднородную структуру, величина М-эхо находилась в пределах 8-12мм.
Значительная часть клинико-лабораторных показателей доминирующего большинства изученных женщин не отличалось от возрастной нормы.
Основными этапами диагностики гиперплазии эндометрия служили гистероскопия с РДВ и морфологическое исследование тотальных соскобов, дополненное иммуногистохимическим определением биомолекулярных маркеров.
Гистероскопию выполняли под внутривенной анестезией с помощью жесткого 7мм гистероскопа фирмы «Karl Storz» (Германия) после предварительного расширения цервикального канала до 7,5мм. В качестве дестенционной среды использовали 0,9% раствор хлорида натрия. Постоянство давления в полости матки создавалось и поддерживалось на уровне 100мм рт.ст. с помощью Homou Hysteromat фирмы «Karl Storz». Обязательный гистероскопический контроль обеспечивал тотальность произведенного РДВ. Гистероскопический диагноз гиперплазии эндометрия во всех случаях был подтвержден морфологически, однако, заключения о распространенности процесса (диффузный/очаговый) не совпадали в 27,6% случаев.
Морфологическое и иммуногистохимическое исследование материала, полученного в результате оперативных вмешательств, осуществляли на кафедре патологической анатомии ММА им И.М.Сеченова (зав.каф. – академик РАН и РАМН, проф. М.А.Пальцев) под руководством проф. Е.А.Коган. Морфологический тип ГЭ определяли, используя классификацию, ВОЗ (1994): I. гиперплазия эндометрия без атипии: простая и комплексная (сложная); II. гиперплазия эндометрия с атипией: простая и комплексная (сложная).
Для гистологического исследования ткани или орган фиксировали в 10% забуференном (фосфатном) нейтральном формалине, подвергали обработке с помощью аппарата гистологической проводки тканей фирмы «Pool Scientific Instruments» (Швейцария) и заливали в парафин. Суммарное время фиксации, проводки и заливки материала не превышало 24 часов. Затем с каждого блока делали не менее 10 ступенчатых срезов толщиной 4 мкм с последующей окраской гематоксилином и эозином. Распределение больных в зависимости от морфологического варианта ГЭ и количество пациенток, включенных в иммуногистохимическое исследование представлено в таблице 4.
Таблица 4. Распределение больных в зависимости от морфологического варианта ГЭ и количество пациенток, включенных в иммуногистохимическое исследование.
| Основная группа | Морфологическое исследование | Иммуногистохимическое исследование |
| ПГ | 49 | 19 |
| КГБА | 16 | 6 |
| КГСА | 8 | 5 |
| АКЭ | 3 | 3 |
| Всего | 76 | 33 |
| Контрольная группа | ||
| Фаза пролиферации или ранняя фаза секреции | 8 | 8 |
| Средняя и поздняя фаза секреции | 14 | 0 |
| Всего | 22 | 8 |
Иммуногистохимическое исследование проведено на материале от 41 пациентки. Критерием отбора пациенток для проведения данного исследования служила формально установленная фаза пролиферации (с учетом первого дня последней менструации).
На серийных парафиновых срезах толщиной 4 мкм иммунопероксидазным методом двойных антител с предварительной демаскировкой антигенов с СВЧ-печи в течение 20 минут выявляли следующие биомолекулярные маркеры: Ki-67, белок апоптоза (аро), VEGF, P53, EGF, EGFR, TGF-beta, ER и PR. В качестве первичных специфических антител применяли моноклональные антитела к Ki-67 1:50 (Dako Cytomation, США), EGF 1:300 (Santa Cruz Biotechnology, США), EGFR 1:300 (Santa Cruz Biotechnology), TGF-beta 1:100 (R&D systems, Великобритания), P53 «ready to use» (Novocastra, Великобритания), VEGF 1:100 (Dako Cytomation), ER 1:100 (Novocastra) и PR 1:100 (Novocastra), аро 1:100 (Novocastra). В качестве вторичных антител использовали биотинилированные антитела к мышиным иммуноглобулинам. Для визуализации места связывания антитела с антигеном использовали метку – фермент – пероксидазу хрена в присутствии субстрата – пероксида водорода – и колориметрического реактива с 3,3-диаминобензидином (LSAB, Dako Cytomation). В результате образовывался нерастворимый в органических растворителях конечный продукт реакции, который визуализировался в виде светло-коричневого окрашивания структур клеток. Для определения локализации антигена в клетках применяли фоновой краситель – гематоксилин. Ставились негативные контроли с использованием иммуноглобулинов свиньи вместо первичных антител и позитивные контроли на мелкоклеточном, плоскоклеточном раке легкого c изученным содержанием маркеров.
Наличие или отсутствие положительной иммуногистохимической реакции оценивалось в ядрах и цитоплазме эпителиальных и стромальных клеток. Результаты реакций по EGF, EGFR, VEGF и TGF-beta выражались в баллах по 6-бальной системе: 1 балл – 5-10% окрашенных клеток, 2 балла – 10-20%, 4 балла – 20-40%, 6 баллов - более 40%. Оценка экспрессии Кi-67, P53, ER, PR осуществлялась путем подсчета процента окрашенных ядер на 300 клеток. Результаты по экспрессии аро-белка представлены в виде промилей окрашенных клеток на 3000 клеток.
Пациентки с ГЭ подвергались как консервативному, так и оперативному лечению. Консервативные методы включали гормонотерапию, направленную на нормализацию морфологической картины эндометрия, и рекомендации по коррекции имеющегося метаболического синдрома (снижение массы тела до оптимальных значений, поддержание уровня физической активности).
Гормональные препараты назначали после морфологической верификации диагноза в течение 4-6 циклов и относились к следующим группам: 1. прогестагены (дюфастон 20мг/сут, норколут 10мг/сут) с 16 по 25 день менструального цикла; 2. антигонадотропные препараты - аналоги гонадотропин-релизинг гормона (золадекс 3,6мг, диферелин 3,75мг) в виде депо-инъкций 1 раз в 28 дней.
Контроль за эффективностью консервативной терапии проводили непосредственно после окончания курса гормональной терапии и через 6-12мес на основании клинико-анамнестических данных, результатов ультразвукового исследования, цитологического исследования аспирата из полости матки, по необходимости – гистероскопии, РДВ с последующим гистологическим исследованием. Гистероскопию, РДВ и морфологическое исследование выполняли во всех случаях завершения курса гормональной терапии комплексной гиперплазии эндометрия. При неполном морфологическом эффекте гормональное лечение продолжали еще на 4 менструальных цикла с последующей гистероскопией, РДВ и гистологическим исследованием. В случаях неэффективности проведенного консервативного лечения ставился вопрос о целесообразности перехода к хирургическим методам лечения. В случаях рецидивирующего характера течения процесса, отсутствия эффекта от гормональной терапии, особенно у женщин с сочетанной патологией матки, проводили гистерэктомию. Вариант радикальной операции (экстирпация матки с/без придатков и надвлагалищная ампутация матки (НАМ) с/без придатков с иссечением слизисто-мышечного слоя культи шейки матки или коагуляцией эндоцервикса) определяли в зависимости от типа ГЭ и наличия патологии шейки матки. Хирургический доступ (чревосечение или лапароскопия) при выполнении НАМ был обусловлен размерами матки, выраженностью спаечного процесса в брюшной полости, противопоказаниями к использованию положения Тренделенбурга. Гистерэктомии выполняли под эндотрахеальной анестезией.
Экстирпация матки или НАМ лапаротомным доступом выполняли по общепринятой методике, лапароскопическую НАМ с коагуляцией эндоцервикса - по способу А.И.Ищенко и соавт. (1997), разработанному на кафедре акушерства и гинекологии №1. Для проведения лапароскопических операций использовалась аппаратура фирмы «Karl Storz» и «Strayker». Изображение выводилось на профессиональный видеомонитор фирмы «Sony» с разверткой 700строк.
Показаниями к аблации эндометрия служил рецидивирующий характер течения ГЭ, неэффективность проводимого консервативного лечения, наличие противопоказаний к радикальной операции или настойчивое желание женщины сохранить орган, при потере его основной функции. Операцию осуществляли под интубационным наркозом. Аблация эндометрия включала 2 этапа: 1. расширение цервикального канала расширителями Гегара до № 11,5; 2. гистероскопия с помощью гистерорезектоскопа с рабочим каналом. Последний этап мог быть осуществлен с помощью лазерного излучения, электрического воздействия или их комбинации. Лазерную аблацию выполняли Nd-YAG лазером с длиной волны 1,064 мкм и проникающей способностью 4-6мм. Источником лазера служила установка «Medilas 4060 Fibertom» фирмы «Dornier» (Германия). Доставка лазерной энергии осуществлялась по гибким лазерным световодам по свободным наконечником диаметром 400мкм. Аблацию эндометрия проводили по бесконтактной методике мощностью энергии 20-30Вт в области трубных углов матки и 40-60Вт в области дна и стенок матки. Область внутреннего зева оставляли интактной. Электродеструкцию эндометрия проводили в той же последовательности шариковым электродом фирмы «Karl Storz» электрическим током мощностью 80-100Вт, плотно прижимая электрод к поверхности эндометрия. В качестве дестенционной среды при использовании электрической энергии применяли 5% раствор глюкозы.
Комбинированную аблацию эндометрия осуществляли по методике, разработанной на кафедре акушерства и гинекологии №1 А.И.Ищенко и соавт. (1997). Сущность метода заключается в последовательном воздействии Ho-YAG лазера длиной волны 2,09мкм и проникающей способностью 0,4-0,5мм в области устьев маточных труб, затем Nd-YAG лазера мощностью 60 и 40Вт в области дна и боковых стенок матки по бесконтактной методике. После этого, 90 петлевым электродом резектоскопа осуществляли последовательную резекцию эндометрия задней и передней стенки матки до области внутреннего зева на глубину 3 мм с помощью режущего тока мощностью 80-100Вт. По необходимости дополнительный гемостаз выполняли шариковым электродом резектоскопа. Во время всех операций обязательно контролировался объем введенных дестенционных растворов.
Послеоперационное ведение больных не отличалось от стандартных схем. Оценку эффективности аблации эндометрия проводили не ранее, чем через 9 месяцев после операции на основании клинических и ультразвуковых данных. При подозрении на наличие остаточных участков эндометрия выполняли гистероскопию с прицельной биопсией. Аблацию эндометрия расценивали как неэффективную при обнаружении ГЭ в остаточных островках эндометрия.
Статистическую обработку данных осуществляли с помощью программ SPSS 7.0 и Microsoft Excel XP на персональном компьютере методами вариационной статистики. Для выявления различий между группами использовали однофакторный дисперсионный анализ (для количественных признаков), определение Хи-квадрата и точного метода Фишера для таблиц сопряженности 2*2 (для качественных признаков). Достоверность различий определяли для уровня значимости Р<0,05 (95%-й уровень значимости). Связь между изучаемыми показателями оценивали по результатам корреляционного анализа с вычислением коэффициента корреляции Пирсона (r) или Спирмена (R) и последующим установлением его значимости по критерию t.
Результаты исследования и их обсуждение.
Морфологический диагноз ПГ, КГБА, КГСА аденокарциномы эндометрия (АКЭ) был установлен на основании обнаружения характерных признаков того или иного варианта ГЭ или АКЭ.
ПГ характеризовалась как сбалансированной гиперплазией клеток паренхимы и стромы, так и явлениями гипертрофии - укрупнением размеров клеток эпителия желез. КГБА отличало прогрессирующее нарастание тканевой атипии – увеличение железисто-стромального соотношения, как за счет пролиферации эпителиального компонента, так и за счет уменьшения стромообразования. Клетки при КГБА сохраняли полярность, ядерная атипия отсутствовала. Диагноз КГСА был установлен на основании обнаружения признаков клеточной атипии на фоне изменений, характерных для КГБА. Во всех наблюдениях комплексная гиперплазия носила очаговый характер и располагалась на фоне явлений ПГ. Морфологическая картина АКЭ наиболее ярко отражает изменения тканевой и клеточной архитектоники, происходящие в ряду КГБА-КГСА-АКЭ. Микроскопическая картина нормального эндометрия в контрольной группе четко зависела от дня менструального цикла. Микроскопически пролиферативная активность нормального эндометрия нарастала в течение фазы пролиферации и сохранялась в раннюю секреторную стадию.
Выявленные микроскопические особенности эндометрия в норме, при ГЭ и АКЭ подтверждаются и объективизируются иммуногистохимическими маркерами. Количественные данные по биомолекулярным маркером представлены в таблице 5.
Таблица 5. Содержание биомолекулярных маркеров в эпителиальных (э) и
стромальных (с) клетках эндометрия (р<0,05).
| Контроль n=8 | ПГ n=19 | КГБА n=6 | КГСА n=5 | РЭ n=3 | ||||||
| маркер | э | с | э | с | э | с | э | с | э | с |
| Ki-67 (%) | 7,1 ± 0,02* | 1,15± 0,05 | 5,47 ± 0,01 | 1,16 ± 0,04 | 8,1 ± 0,02 | 1,36 ± 0,01 | 13,6± 1,2 | 6,9 ± 0,1 | 34,8 ± 1,7 | 8,1 ± 0,7 |
| EGF (баллы) | 3 ± 0,02 | 0,38± 0,01 | 2,46 ± 0,03 | 1,33 ± 0,05 | 4,4 ± 0,03 | 2,8 ± 0,03 | 6 ± 0,06 | 3,2 ± 0,05 | 6 ± 0,06 | 3,8 ± 0,03 |
| EGFR (баллы) | 1,5± 0,03 | 0,5± 0,02 | 2,23± 0,02 | 0,33± 0,01 | 4,4± 0,03 | 3,34± 0,03 | 6± 0,06 | 3,6± 0,07 | 6± 0,06 | 3,8±0,02 |
| Apo (‰) | 3,65 ± 0,01 | 3,15± 0,02 | 1,04 ± 0,01 | 0,1 ± 0,02 | 6,67 ± 0,08 | 0,96 ± 0,01 | 12,9 ± 0,2 | 4,06 ± 0,5 | 18,9 ± 1,5 | 7,9 ±0,8 |
| TGF- (баллы) | 1,25 ± 0,01 | 1,13± 0,03 | 1,31 ± 0,06 | 0,69 ± 0,03 | 1,67 ± 0,05 | 0,96 ± 0,01 | 1,97 ± 0,02 | 1,2 ± 0,03 | 2,4 ± 0,01 | 1,8 ± 0,01 |
| P53 (%) | 0 | 0 | 0 | 0 | 0 | 0 | 12,6± 0,03 | 8,94± 0,02 | 70,1±2 | 67,2±3 |
| VEGF (баллы) | 0 | 0 | 0 | 0 | 0,1± 0,02 | 0,3± 0,01 | 1,13± 0,02 | 1,38± 0,01 | 2,7± 0,03 | 3,4± 0,01 |
| ER (%) | 8,63 ± 0,05 | 10,5± 0,07 | 16,11± 0,04 | 4,56 ± 0,03 | 19,84± 0,06 | 7,65 ± 0,04 | 19,31± 0,03 | 7,75 ± 0,02 | 22,85± 0,07 | 7,29± 0,01 |
| PR (%) | 4,44 ± 0,03 | 8,65± 0,04 | 17,58± 0,08 | 19,59± 0,08 | 16,94± 0,06 | 13,85± 0,03 | 4,52 ± 0,01 | 16,75 ± 0,07 | 3,91 ± 0,02 | 19,7± 0,07 |
*- здесь и далее в таблице: первая цифра – средняя, вторая – ошибка средней
Пролиферацию оценивали по уровню экспрессии Ki-67, EGF и его рецептора (EGFR). Положительная иммуногистохимическая реакция на Ki-67 проявлялась в виде коричневого окрашивания ядер эпителиальных и стромальных клеток (преимущественно в поверхностных слоях). По сравнению с контрольной группой при ПГ обнаружена относительно низкая пролиферативная активность как клеток эпителия, так и стромы. В КГБА, КГСА и АКЭ мы наблюдали нарастание пролиферативной активности по мере ухудшения морфологической картины. (Диаграмма 2) Экспрессия Ki-67 в гиперплазированном эндометрии характеризовалась выраженной очаговостью.
Экспрессия маркеров EGF и EGFR определялась в виде коричневого окрашивания цитоплазмы (EGF) или цитоплазматической мембраны и ядер (EGFR) эпителиальных, стромальных и эндотелиальных клеток. Содержание EGF и EGFR нарастало в ряду контрольная группа – ПГ-КГБА-КГСА-АКЭ. (Диаграмма 3 и 4) Необходимо отметить, что EGF служит сильными ангиогенными фактором, поэтому усиление его продукции не может не приводить к стимуляции неоангиогенеза при ГЭ и АКЭ.
Обращала на себя внимание очаговость высокой экспрессии EGF и EGFR во всех группах ГЭ и АКЭ. Благодаря проведению иммуногистохимических реакций на серийных срезах обнаружено соответствие локусов высокой экспрессии EGF и его рецептора, что говорит о задействовании ауто- и паракринного способа регуляции и, следовательно, появлении некоторой степени пролиферативной автономии указанных очагов. Кроме того, в случае очаговости морфологической картины, зоны повышенной экспрессии EGF и EGFR совпадали с локусами морфологических изменений.
Изменения пролиферативной активности эндометрия в различных морфологических вариантах ГЭ и РЭ происходят одновременно с изменением уровня апоптоза. Экспрессия белка апоптоза – аро – иммуногистохимически проявлялась коричневым окрашиванием ядер эпителиальных и стромальных клеток. Причем, если экспрессию белка апоптоза в контрольной группе принять как среднюю, то ПГ отличается самыми низкими значениями аро, а от КГБА к КГСА и АКЭ апоптоз резко усиливается. (Диаграмма 5)
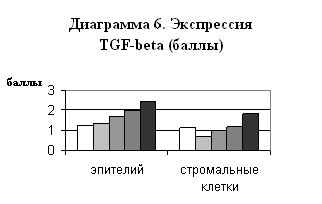
Экспрессия TGF- проявлялась коричневым окрашиванием цитоплазмы эпителиальных и стромальных клеток. Повышение содержания данного фактора при ГЭ свидетельствует об интенсификации процессов апоптоза в ряду контроль-ПГ-КГБА-КГСА-АКЭ. (Диаграмма 6) Однако TGF- может оказывать и непрямое пролиферативное действие через повышение экспрессии EGFR, что, вероятно, имеет место при ПГ, в случаях которой прямой маркер апоптоза – аро достоверно ниже контроля, а TGF- достоверно выше контроля.
Ангиогенез при ГЭ усилен. В пользу данного утверждения помимо усиления экспрессии EGF говорит тот факт, что морфологические признаки КГБА сопровождаются появлением экспрессии одного из самых мощных стимуляторов ангиогенеза – VEGF. Экспрессия VEGF проявлялась светло-коричневой окраской цитоплазмы эпителиальных, стромальных и эндотелиальных клеток. В случаях КГСА уровень VEGF резко нарастал, достигая максимальных значений в АКЭ, причем экспрессия в стромальных клетках преобладала над эпителиальными. Контрольные случаи и ПГ демонстрировали отрицательную иммуногистохимическую реакцию на VEGF. (Диаграмма 7)
Анализ уровня различных факторов с ангиогенным действием позволяет говорить об усилении неоангиогенеза от нормального эндометрия к раку эндометрия (РЭ) с вовлечением в процесс качественно новых механизмов стимуляции образования сосудов по мере нарастания тканевого и клеточного атипизма.
Кроме того, мы наблюдали появление (в виде светло-коричневого окрашивания ядер) и нарастание экспрессии белка Р53 в эпителиальных и стромальных клетках эндометрия при комплексной гиперплазии, демонстрирующей черты клеточной атипии. В РЭ уровень Р53 возрос в 6-7 раз. В контроле, ПГ, КГБА белок Р53 не выявлен. Важным для интерпретации экспрессии Р53 является тот факт, что продукт немутированного («дикого») гена р53 живет не более 20 минут, следовательно, примененным иммуногистохимическим методом не выявляется. Мутации гена р53 приводят к появлению долгоживущего, но функционально неактивного продукта – белка Р53. Появление экспрессии Р53 говорит о приобретении способности клетки к уклонению от апоптоза – то есть способности к иммортализации.
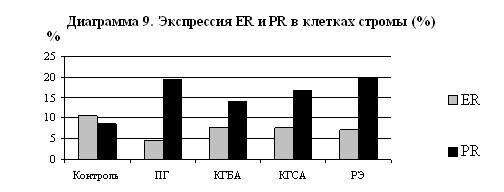
Анализ рецепторного статуса нормального, гиперплазированного и неоплазированного эндометрия говорит об изменении количества ER и PR как в эпителиальных, так и в стромальных клетках в условиях патологии. (Диаграмма 8 и 9) Положительная иммуногистохимическая реакция на ER и PR проявлялась в виде светло-коричневого окрашивания ядер эпителиальных и стромальных клеток.
Согласно мнению многих исследователей (Н.М.Побединский, 2000; И.Д.Хохлова, 1996), уровни ER и PR необходимо рассматривать не по отдельности, а в соотношении, благодаря чему можно оценить сбалансированность гормональных влияний. Так, в эндометрии фазы пролиферации отношение ER к PR в паренхиме примерно равняется 2, в случаях ПГ – 0,9, КГБА – 1,2, КГСА – 4,3, РЭ – 5,9. Таким образом, эстрогены в условиях преобладания собственных рецепторов над рецепторами прогестерона могут и оказывают пролиферативное действие в норме (фаза пролиферации), при комплексных гиперплазиях и РЭ. ПГ характеризовалась преобладанием PR над ER, что может объяснить доминирование явлений гипертрофии клеток при данной патологии. Строма эндометрия отличается иной экспрессией рецепторов стероидных гормонов как в норме, так и при ГЭ и РЭ, однако, четко прослеживается выше описанная тенденция в изменении соотношении ER/PR. Указанное соотношение в стромальных клетках составило: в контрольной группе – 1,21, при ПГ – 0,23, КГБА – 0,55, КГСА – 0,46, РЭ – 0,37. Для ER и PR, наряду с факторами пролиферации (Ki-67, EGF, EGFR) и апоптоза (аро), характерна очаговая экспрессия с ее преобладанием в поверхностных слоях слизистой оболочки матки. Таким образом, интерпретацию гормонального статуса эндометрия целесообразно осуществлять, ориентируясь не на абсолютно высокие или низкие цифры ER и PR, а на показатель соотношения ER/PR в эпителиальных и стромальных клетках.
Оценку пролиферативного потенциала ткани необходимо проводить, учитывая как уровень факторов пролиферации, так и апоптоза.
Особенности экспрессии биомолекулярных маркеров, выявленные в процессе иммуногистохимического исследования 33 случаев ГЭ, были
 | ||
 |  | |
 | ||
 |  | |
 | ||
экстраполированы на всю основную группу больных, что на том или ином этапе внесло коррективы в проводимую терапию.
Консервативные методы лечения включали гормонотерапию и рекомендации по коррекции имеющегося метаболического синдрома. Таким образом, у 34 (69,4%) женщин с впервые выявленной ПГ лечение начинали с традиционных схем прогестагенов (дюфастон 20мг, норколют 10мг с 16 по 25 день менструального цикла в течении 4-6 циклов), с впервые выявленной КГБА 4 (25,0%) – депо формами аналогов гонадотропинрелизинг-гормона – (золадекс 3,6мг; диферелин-депо 3,75мг – 4-6 инъекции), с последующей гистероскопией, РДВ и морфологическим исследованием соскобов эндоцервикса и эндометрия. Обязательным условием назначения гормональной терапии являлось отсутствие противопоказаний к использованию выше указанных препаратов.
Тактика лечения у впервые обратившихся пациенток с ПГ представлена на диаграмме 10.
Диаграмма 10. Тактика лечения впервые обратившихся пациенток с диагностированной ПГ
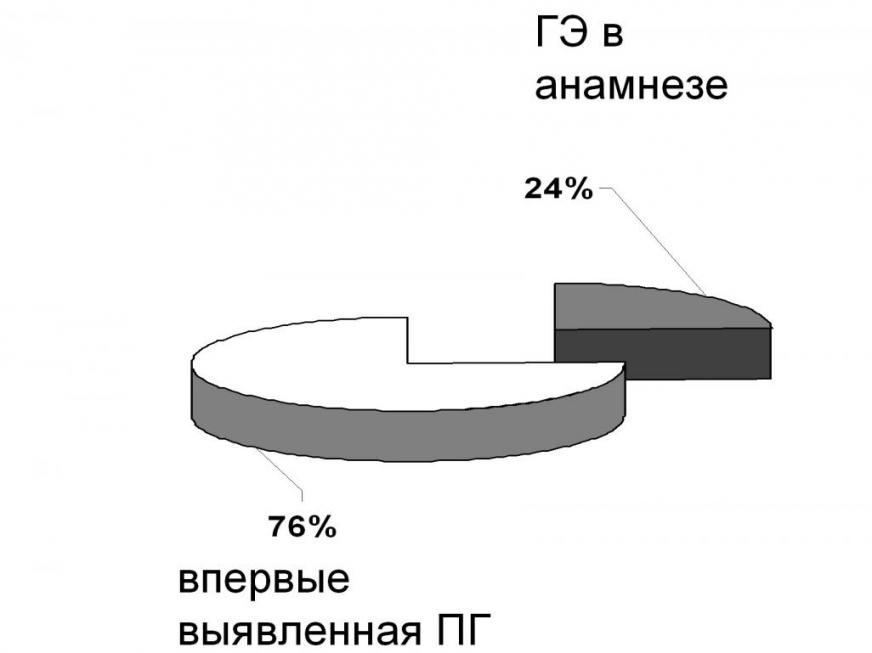
Эффективность лечения ПГ прогестагенными препаратами и аналогами гонадотропин-релизинг гормона представлена на диаграмме 11.

Нормализация микроскопического строения эндометрия отмечена в 28 (73,7 %) случаях: из них 22 (78,6%) - у пациенток без сопутствующей патологии миометрия (миома матки, внутреннего эндометриоза) и у 6 (21,4%) с сопутствующей ММ и/или А. (Диаграмма 12)

Ни в одном случае супрессивного гормонального лечения КГБА в сочетании с миомой матки и/или аденомиозом полный морфологический эффект не был достигнут
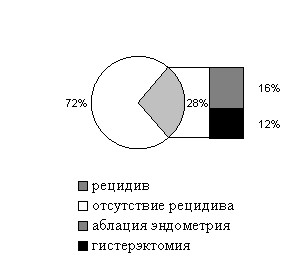
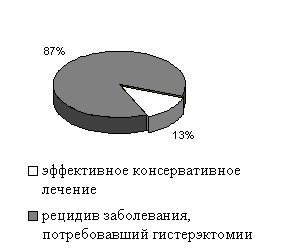
Несмотря на достигнутый полный морфологический эффект лечения ПГ и КГБА у 14 (41,2%) женщин при динамическом наблюдении спустя 6-12-36 месяцев диагностирован рецидив заболевания, что послужило показанием для выполнения гистерэктомии.
Отдаленные результаты и тактика лечения пациенток с ПГ представлены на диаграмме 13. Отдаленные результаты консервативной терапии пациенток с КГБА представлены на диаграмме 14.
| Диаграмма 13. Отдаленные результаты и тактика лечения пациенток с ПГ | Диаграмма 14. Отдаленные результаты консервативной терапии пациенток с КГБА |
 |  |
У 12 (15,9%) больных с КГБА в сочетании с миомой матки или/и аденомиозом и незаинтересованности женщины в сохранении репродуктивной функции была выполнена гистерэктомия (экстирпация матки, надвлагалищная ампутация матки с иссечением слизисто-мышечного слоя культи шейки матки или коагуляцией эндоцервикса) без предшествующей гормональной терапии.
Диагноз КГСА служил показанием для выполнения гистерэктомии (экстирпации матки).
Без сомнений, важным является тот факт, что супрессивная гормональная терапия у 20 (26,3%) женщин существенно снижала качество жизни пациенток вследствие неизбежных побочных эффектов, а также у 3 (3,9%) больных имела место совокупность относительных или абсолютные противопоказания для ее назначения. Таким образом, у трех пациенток с впервые выявленной ПГ эндометрия и противопоказаниями для супрессивной терапии (3,9%), а так же у трех пациенток (3,9%), для которых побочные эффекты терапии аналогами гонадотропин-релизинг гормона оказались неприемлемыми, выполнена аблация эндометрия. Помимо выше указанных случаев, аблацию эндометрия осуществили 7 (9,2%) больным с рецидивирующей ПГ без патологии миометрия или в сочетании с ММ и А при размерах матки не превышающих 7 недель беременности.
9 (11,8%) пациенткам с рецидивирующим течением ПГ в сочетании с ММ и А и/или неэффективности двухэтапной супрессивной гормональной терапии была выполнена гистерэктомия: из них 6 (7,9%) НАМ (чревосечение, НАМ с иссечение слизисто-мышечного слоя культи шейки матки – 2 (2,6%) и лапароскопия, НАМ с коагуляцией эндоцервикса – 4 (5,2%)); 3 (3,9%) – экстирпация матки.
Рецидивирующее течение КГБА, вне зависимости от морфологической формы рецидива и скомпромитированности миометрия, а так же КГБА в сочетании с гиперпластическими процессами миометрия мы рассматривали как показание для гистерэктомии (14 случаев – 18,4%).
Отсутствие патологии шейки матки служило показанием для НАМ (10 случаев – 13,2%) с иссечением слизисто-мышечного слоя культи шейки матки (в случаях лапаротомного доступа) – 4 (5,2%) или с коагуляцией эндоцервикса (в случаях лапароскопического доступа) – 6 (7,9%). Сопутствующая КГБА патология шейки матки явилась показанием для выполнения экстирпации матки - 4 (5,3%).
Вопрос о необходимости сохранения придатков матки (при отсутствии клинически и инструментально выявленной патологии яичников) решался индивидуально в виду неоднозначного мнения различных медицинских школ по данной проблеме. В связи с этим, диагноз КГСА служил абсолютным показанием для выполнения экстирпации матки – 8 (9,5%). Тактика в отношении придатков матки была определена индивидуально, в связи с тем, что овариоэктомия грозит развитием тяжелого постовариоэктомического синдрома, усугубляющего течение эндокринно-обменных заболеваний и сердечно-сосудистой патологии у женщин пременопаузального возраста.
Таким образом, дифференцированный подход позволил сохранить яичники в 19 случаях (61,3%) гистерэктомий.
Три пациентки с диагнозом АКЭ (3,9%), поставленным на основании гистологического исследования соскобов эндоцервикса и эндометрия были направлены для дальнейшего обследования и лечения в специализированные учреждения.
Как указывалось выше, результаты иммуногистохимических исследований, полученные нами, повлияли на ведение пациенток с ГЭ благодаря переосмыслению механизмов рецидивирования и прогрессирования, причин неэффективности лечения гиперплазии эндометрия.
В первую очередь, коррекция тактики коснулась больных с КГБА, при которой происходит очаговая стимуляция пролиферации желез, угнетение апоптоза, активация нехарактерных для нормального эндометрия механизмов неоангиогенеза и снижение чувствительности к прогестерону. Эти черты позволили нам рассматривать не только рецидивирующую, но и впервые выявленную КГБА как процесс с 1. несбалансированной избыточной пролиферацией клеток желез, поддерживаемой самодостаточностью в отношении факторов роста; 2. уклонением от апоптоза; 3. сниженной чувствительностью к рост-ингибирующим сигналам (прогестерону); 4. усиленным неоангиогенезом.
Эти характеристики позволили нам рассматривать органосберегающую тактику лечения в отношении больных, страдающих КГБА, нецелесообразной. Гормонотерапия аналогами гонадотропин-релизинг гормона может быть оправдана лишь у пациенток позднего репродуктивного возраста, заинтересованных в рождении ребенка. В случае успешной реализации генеративной функции, данный контингент больных должен находиться под строгим контролем и нуждается в отсроченном оперативном лечении. Применение аблации эндометрия у больных с КГБА, по нашему мнению, рискованно, так как доказана возможность асимптомного существования остаточных участков эндометрия и вероятность малигнизации.
«Агрессивная» тактика в отношении комплексных гиперплазий эндометрия усугубляется при диагностировании КГСА, что подкреплено выявлением Р53 во всех случаях КГСА. Иммуногистохимическое определение Р53 необходимо проводить во всех случаях комплексных изменений эндометрия для безошибочной дифференциальной диагностики между КГБА и КГСА, так как положительную реакцию на указанный онкомаркер мы считаем абсолютным показанием для экстирпации матки даже при минимальных и/или трудно различимых морфологических признаках клеточной атипии.
Во всех случаях КГБА и КГСА морфологические изменения носили очаговый характер на фоне ПГ, что согласуется с данными Н.И.Кондрикова (1991)) В ряде случаев локусы комплексной гиперплазии были редки, что требовало тщательного изучения всех полей зрения. Для очагов комплексных гиперплазий было характерно появление положительной иммуногистохимической реакции на VEGF, что существенно облегчало дифференциальную диагностику между простой и комплексной гиперплазиями.
Выше описанные особенности КГБА и КГСА дают нам основания утверждать, что на современном этапе развития науки в алгоритм диагностики ГПЭ должны быть включены иммуногистохимические маркеры P53 и VEGF.
Уровень онкомаркеров (Ki-67, EGF, EGFR, TGF-, VEGF, P53, apo) и рецепторный статус эндометрия свидетельствуют о меньших отклонениях ПГ от нормальной клеточной физиологии. Более того, высокий уровень PR в ПГ можно рассматривать как защитный (адаптационный) механизм эндометрия в условиях абсолютной или относительной гиперэстрогении, характерной для позднего репродуктивного и перименопаузального возраста. Поэтому, основным методом лечения ПГ без патологии миометрия мы считаем консервативную терапию. Причем лечение впервые выявленной ПГ следует начинать с гестагенов. Выбор натурального или синтетического препарата должен осуществляться с учетом наличия у пациентки метаболических нарушений, так как синтетические прогестагены оказывают большее негативное влияние на липидный спектр сыворотки крови. В случае рецидивирующего характера течения ПГ мы не можем исключить роль перименопаузальных изменений в системе регуляции гипоталяму-гипофиз-яичники-матка. В связи с этим, на наш взгляд, в случае рецидивирующей ПГ без пролиферативных процессов в миометрия необходимо использовать препараты «выключающие» угасающую систему циклической регуляции менструальной функции (аналоги гонадотропин-релизинг гормона).
Однако существуют клинические и временные ограничения для их использования. В этих случаях альтернативой длительной антигонадотропной терапии может служить аблация эндометрия, являющаяся, по сути, симптоматической терапией заболеваний матки.
Проанализированные клинические случаи сочетанной патологии матки (ГЭ + ММ, ГЭ + А, ГЭ + ММ, А) свидетельствуют о высоком риске рецидивирования ГЭ в условиях гормончувствительной патологии миометрия, значительном риске прогрессирования как ГЭ, так и миомы матки, аденомиоза при сочетанной патологии, низкой эффективности консервативного лечения ГЭ в условиях гиперпластических процессов миометрия.
Выше перечисленные особенности сочетанной патологии матки привели нас к заключению о необходимости первоначально радикальной тактики у данного контингента больных, позволяющей избежать неоднократных РДВ и курсов гормонотерапии, лишь «затягивающих» время до выполнения гистерэктомии. Консервативная терапия дает временный эффект – «окно» фертильности – в некоторых клинических и жизненных ситуациях необходимое для реализации невыполненной репродуктивной функции.
Оптимизированная нами диагностическая и лечебная тактика ГЭ отражена в практических рекомендациях.
Выводы:
- Гиперплазия эндометрия представляет собой заболевание, возникающее вследствие преобладания процессов пролиферации над апоптозом на фоне усиленного неоангиогенеза и измененного рецепторного статуса эндометрия.
- ПГ развивается как результат увеличения продолжительности жизни клеток эндометрия за счет резкого угнетения апоптоза на фоне низкой пролиферации, а также гипертрофии эпителия и стромообразования.
- КГБА и КГСА возникают в результате гиперплазии эпителиальных клеток эндометрия и снижения стромообразования с подключением механизмов стимуляции неоангиогенеза, нехарактерных для нормального эндометрия фазы пролиферации и ПГ. Экспрессию VEGF и Р53 при КГСА следует рассматривать ранним маркером готовности эндометрия к злокачественной трансформации.
- Клинические проявления ГЭ (метроррагия – 56,6%, меноррагия – 51,3%, бесплодие – 7,9%, отсутствие жалоб – 10,5%) не коррелируют с морфологическим вариантом заболевания. ГЭ в позднем репродуктивном и перименопаузальном возрасте носит изолированный характер в 23,7%, а в 76,3% сочетается с миомой матки и/или внутренним эндометриозом (48,7%, 17,1%, 10,5%).
- Иммуногистохимическое определение сосудистого эндотелиального фактора роста (VEGF) и белка Р53 в эндометрии повышает точность морфологической диагностики заболевания.
- Сочетание ГЭ с миомой матки и/или аденомиозом снижает эффективность консервативной терапии больных с ГЭ. Эффективность прогестагенов в лечении пациенток с ПГ составляет 44%, аналогов гонадотропин-релизинг гормона – 47%; при КГБА эффективность аналогов гонадотропин-релизинг гормона - 13%. Альтернативой длительной гормональной терапии больных с ПГ является аблация эндометрия.
- Гистерэктомия служит патогенетически обоснованным методом лечения при КГСА, рецидивирующей КГБА, КГБА в сочетании с миомой матки и/или аденомиозом и рецидивирующей ПГ в сочетании с миомой матки и/или аденомиозом.
Практические рекомендации:
- Для повышения точности диагностики «золотой стандарт» обследования пациенток на предмет ГЭ (трансвагинальная эхография, гистероскопия, выскабливание эндоцервикса и эндометрия, морфологическое исследование тотальных соскобов) необходимо дополнять иммуногистохимическим определением маркеров – сосудистого эндотелиального фактора роста и белка Р53.
- Показанием для назначения прогестагенных препаратов при ГЭ служит впервые выявленная ПГ. Лечение рецидивирующей ПГ следует проводить аналогами гонадотропин-релизинг гормона. Методом выбора в лечение ПГ при противопоказаниях к гормонотерапии или нежелании женщины испытывать побочные эффекты от ее назначения является аблация эндометрия.
- КГБА является показанием для назначения аналогов гонадотропин-релизинг гормона.
- Пациентки позднего репродуктивного возраста, незаинтересованные в беременности и пациентки 45 лет и старше с диагностированной КГСА нуждаются в выполнении экстирпации матки.
- Рецидивирующая ПГ в сочетании с миомой матки и/или аденомиозом, КГБА в сочетании с миомой матки и/или аденомиозом и рецидивирующая КГБА при условии отсутствия патологии шейки матки служат показанием для выполнения надвлагалищной ампутации матки с иссечением слизисто-мышечного слоя культи шейки матки или коагуляцией эндоцервикса.
- Пациенткам репродуктивного возраста, заинтересованным в беременности, с впервые выявленной КГСА вне зависимости от состояния миометрия допустимо проведение супрессивной гормональной терапии аналогами гонадотропин-релизинг гормона с отсроченным оперативным лечением после рождения ребенка.
- Женщин позднего репродуктивного и перименопаузального возраста с сочетанной патологией матки (ММ, А, ГЭ) необходимо включать в группу риска по возникновению рецидива и прогрессированию ГЭ.
Список опубликованных работ.
- Станоевич И.В., Ищенко А.И., Кудрина Е.А. Тактика ведения пациенток с гиперплазией эндометрия позднего репродуктивного и перименопаузального возраста. // Современные технологии в диагностике и лечении гинекологических заболеваний. «ПАНТОРИ». Москва, 2005. – С.349-350.
- А.И.Ищенко, И.В.Станоевич. Молекулярно-биологические аспекты гиперпластических процессов и рака эндометрия. //Вопросы гинекологии, акушерства и перинатологии. – 2006. - Т.5. - №3. - С. 47-50.
- Е.А.Коган, И.В.Станоевич, А.И.Ищенко, Е.А.Кудрина. Маркеры ангиогенеза, пролиферации, апоптоза и рецепторы стероидных гормонов при гиперплазии и раке эндометрия. // Труды II съезда российских патологоанатомов. Москва, 2006. – Т.2. – С. 67-69.
- Станоевич И.В. Причины выбора хирургической тактики лечения гиперплазии эндометрия у пациенток позднего репродуктивного и перименопаузального возраста. //Вестник Российского Государственного Университета. – 2006. – Спец. вып. - С.458.
- Станоевич И.В., Ищенко А.И., Коган Е.А., Кудрина Е.А. Целесообразность определения маркера апоптоза (Р53) и ангиогенеза (VEGF) при гиперпластических процессах эндометрия. // Материалы Международного конгресса: «Практическая гинекология: от новых возможностей к новой стратегии». Москва, 2006. - С.288.
- A.Ischenko, I.Stanoevich, E.Kudrina, I.Gadaeva. Place of laparoscopic hysterectomy in treatment for benign uterine deseases in perimenopausal women.// 14th Annual Congress of the European Society for Gynaecological Endoscopy. Athens, Grece, Oct. 6-8, 2005, P024.
- Способ определения показаний к гистерэктомии при гиперплазии эндометрия. //Заявка на изобретение №2006108570, 2006/ А.И.Ищенко, Е.А.Кудрина, И.В.Станоевич, Е.А.Коган/.

