Интерлейкин-6 и его рецептор в сыворотке крови больных опухолями и опухолеподобными поражениями костей
На правах рукописи
- Тарасова Татьяна Анатольевна
Интерлейкин-6 и его рецептор в сыворотке крови больных опухолями и опухолеподобными поражениями костей
14.01.12 - онкология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2010
Работа выполнена в Учреждении Российской академии медицинских наук Российском онкологическом научном центре им. Н.Н.Блохина РАМН (директор – академик РАН и РАМН, профессор М.И.Давыдов)
Научные руководители:
член-корреспондент РАМН, профессор Н.Е.Кушлинский
академик РАМН, профессор Ю.Н.Соловьев
Официальные оппоненты:
доктор биологических наук, профессор Н.С.Сергеева
доктор медицинских наук, профессор С.Б.Петерсон
Ведущее учреждение:
ФГУ Российский научный центр рентгенорадиологии МЗ СР РФ
Защита состоится «___»___________2010 года в ____ часов на заседании Диссертационного совета (Д.001.017.02) Российского онкологического научного центра им. Н.Н.Блохина РАМН (115478, Москва, Каширское шоссе, 24)
С диссертацией можно ознакомиться в библиотеке Российского онкологического научного центра им. Н.Н.Блохина РАМН
Автореферат разослан «___»______________2010 года
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Ю.А.Барсуков
Введение
Актуальность проблемы. Саркомы костей – один из важных и трудных в диагностическом и лечебном плане разделов клинической онкологии (Н.Н.Трапезников и соавт., 1986, 2001; Н.Е.Кушлинский, 2000; М.Д.Алиев, 2008; Folpe A.L. et al., 2010). Эти заболевания объединяют группу различных морфологических вариантов опухолей, которые встречаются в основном в молодом возрасте, отличаются тяжестью клинического течения, низкой эффективностью лечебных мероприятий и ранним метастазированием (Ю.Н.Соловьев, 1998; Н.М.Иванова и соавт., 2003; М.Д.Алиев и соавт., 2006; П.А.Ревелл, 1993; Dahlin D. et al., 1986).
Известно, что в механизмах роста, апоптоза, пролиферативной активности и ангиогенеза при саркомах костей участвует ряд цитокинов – низкомолекулярных пептидов, секретируемых клетками воспаления, иммунного ответа и самой опухоли (М.Н.Стахеева и соавт., 2003; А.А.Новик и соавт., 2004). Большинство цитокинов действует локально на клетку, секретирующую пептиды (аутокринный эффект) или на соседние клетки (паракринный эффект). При этом некоторые цитокины обладают системным, эндокринным эффектом (В.Д.Маршал, 1999; Я.Я.Ветра и соавт., 2000).
В настоящее время выделено четыре класса цитокинов (провоспалительные, ростовые и дифференцировочные факторы лимфоцитов, отдельные регуляторные цитокины) (А.С.Симбирцев, 2004), однако нас заинтересовали интерлейкины (от inter - между, leukins - белые клетки крови) и, в частности, интерлейкин-6 (IL-6) – гликопротеид с молекулярной массой 19-24 кДа. Известно, что клетки злокачественных опухолей и их микроокружение могут сами секретировать некоторые цитокины, в том числе IL-6, и экспрессировать соответствующие рецепторы. При этом, чрезмерная продукция IL-6 может благоприятствовать росту опухоли и усилению ее васкуляризации, что способствует распространению регионарных и отдаленных метастазов (А.М.Гранов и соавт., 2008; Blanchard F. et al., 2009).
В литературе имеются сведения о том, что в сыворотке крови больных остеосаркомой и хондросаркомой наблюдается повышение уровня IL-6, причем секреция последнего возрастает при диссеминации опухолевого процесса (Н.Е.Кушлинский, 2001; Rutkowski P. et al., 2003). Представлены единичные экспериментальные наблюдения по изучению экспрессии IL-6 в клетках остеосаркомы: SaOS-2, HOS, MG-63 (Kondo A. et al., 2001). Биологическая активность IL-6 осуществляется после связывания цитокина с высокоаффинным рецепторным комплексом, состоящим из двух мембранных гликопротеинов 80 kDa, непосредственно связывающего IL-6, и 130 kDa, обеспечивающего высокую аффинность связанного комплекса (Н.Н.Тупицин, 2000, 2005; Reth M. et al., 1991; Yamasaki K. et al., 1998). Растворимый рецептор IL-6 (sIL-6R) - продукт протеолиза мембраносвязанного рецептора IL-6, представляет собой гликопротеин 50 kDa. Роль этих рецепторов до конца не ясна, высказываются предположения об их способности повышать активность IL-6 в условиях патологического процесса (Yasukawa K. et al., 1987; Narazaki M. et al., 1993).
Важной характеристикой костной ткани является присутствие в ней щелочной фосфатазы (ЩФ) – фермента, который секретируется остеобластами. Функцией этих клеток является формирование и постоянное обновление костной ткани. Формирование кости связано с синтезом остеоида и наличием достаточных количеств кальция и фосфата для закладки гидроксиапатита (В.Д.Маршал, 1999). В литературе представлены работы по изучению активности ЩФ в сыворотке крови при опухолях костей, но большинство из них посвящено одной нозологической форме - остеосаркоме (Bacci G. et al., 1993; Matchak G. et al., 1998). В настоящем исследовании активность ЩФ изучали у пациентов с различными новообразованиями скелета в сочетании с экспрессией IL-6 и sIL-6R.
Все выше указанное свидетельствует об актуальности этого направления исследований.
Цель исследования - сравнительный анализ содержания IL-6, sIL-6R, общей активности ЩФ в сыворотке крови больных саркомами, гигантоклеточной опухолью (ГКО) и доброкачественными новообразованиями костей, оценка их взаимосвязи с клинико-морфологическими характеристиками и прогнозом заболевания.
Для достижения указанной цели необходимо решить следующие задачи:
1. Провести сравнительное определение частоты выявления и содержания IL-6 в сыворотке крови больных саркомами, ГКО и доброкачественными новообразованиями костей, а также у практически здоровых людей соответствующего возраста.
2. Изучить взаимосвязь между содержанием IL-6 в сыворотке крови больных новообразованиями костей и основными клиническими и морфологическими характеристиками болезни.
3. Провести сравнительный анализ уровней IL-6 и общей активности щелочной фосфатазы (ЩФ) в сыворотке крови больных опухолями костей с учетом клинико-морфологических характеристик новообразования.
4. Определить содержание sIL-6R в сыворотке крови больных первичными опухолями костей.
5. Оценить роль IL-6, sIL-6R и общей активности ЩФ сыворотки крови в прогнозе злокачественных опухолей костей.
Научная новизна
Впервые проведен сравнительный анализ содержания IL-6, sIL-6R, активности ЩФ в сыворотке крови больных саркомами, ГКО и доброкачественными новообразованиями костей с учетом клинико-морфологических характеристик заболеваний и их прогнозом. Доказано, что исходные уровни IL-6 связаны с гистологическим строением опухолей костей и степенью выраженности их лечебного патоморфоза. Не выявлено различий в показателях sIL-6R и больными саркомами, доброкачественными новообразованиями и ГКО кости. Однако выраженность лечебного патоморфоза и степень злокачественности сарком были обратно пропорциональны исходному уровню sIL-6R, а у больных хондросаркомой обнаружена положительная корреляционная связь показателей sIL-6R и размера опухоли (критерий Т в системе TNM). Многофакторный анализ у больных саркомами костей выявил, что определяющими факторами прогноза безрецидивной выживаемости являются:
1. уровень IL-6 в сыворотке крови;
2. степень активности ЩФ в сыворотке крови;
3. сочетание биохимических показателей IL-6 и общей активности ЩФ в сыворотке крови до лечения (р=0,005);
4. критерий Т (размер опухоли в системе TNM) (р=0,03);
5. критерий М (наличие отдаленных метастазов в системе TNM) (р=0,0001).
Практическая значимость исследования
Многофакторный анализ безрецидивной выживаемости больных саркомами костей показал, что стадия заболевания, биохимические показатели IL-6 и общей активности ЩФ в сыворотке крови являются значимыми и независимыми факторами прогноза.
Больные злокачественными опухолями костей с исходной (до лечения) концентрацией свободного IL-6 в сыворотке крови 5 пг/мл составляют группу риска, у которых высока вероятность развития раннего рецидива опухолевого процесса. Поэтому эти пациенты нуждаются в пристальном наблюдении и, вероятно, в дополнительном лечении.
Разработан алгоритм клинико-лабораторного обследования больных злокачественными опухолями костей, который позволяет с высокой степенью вероятности прогнозировать развитие раннего рецидива заболевания, а также прогнозировать эффективность адъювантной химиотерапии. Основными критериями этого алгоритма следует считать сочетанные исходные «благоприятные» и «неблагоприятные» уровни IL-6 и общей активности ЩФ в сыворотке крови, а также показатели распространенности опухолевого процесса Т и М.
Апробация диссертации
Материалы диссертации доложены на совместной научной конференции лаборатории клинико-диагностической, лаборатории клинической биохимии и лаборатории клинической иммунологии опухолей централизованного клинико-лабораторного отдела, отделения опухолей опорно-двигательного аппарата, отделения вертебральной хирургии, патологоанатомического отдела опухолей человека НИИ клинической онкологии РОНЦ им. Н.Н.Блохина РАМН 24 марта 2009г.
Материалы диссертации доложены на: XI Российском Национальном Конгрессе «Человек и лекарство» (Москва, 19-23 апреля 2004г.); Конгрессе «Национальные дни лабораторной медицины России-2004» (Москва, 20-22 октября 2004г.); Российской научно-практической конференции «Современное состояние и перспективы развития экспериментальной и клинической онкологии», посвященной 25-летию НИИ онкологии ТНЦ СО РАМН (Томск, 24-25 июня 2004г.); XII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 18-22 апреля 2005г.); I Всероссийской научно-практической конференции патологоанатомов «Актуальные вопросы патологической анатомии» (Орел, 31 мая - 2 июня 2005г.); Х Российском онкологическом конгрессе (Москва, 21-23 ноября 2006г.); XIII Российском Национальном Конгрессе «Человек и лекарство» (Москва, 3-7 апреля 2006г.); XIV Российском Национальном Конгрессе «Человек и лекарство» (Москва, 8-12 апреля 2007г.); Конгрессе «Национальные дни лабораторной медицины России-2007» (Москва, 10-12 октября 2007г.).
Публикации по теме диссертации
По теме диссертации опубликовано 14 научных работ.
Объем и структура диссертации
Диссертация изложена на 194 страницах машинописного текста, включает введение, обзор данных литературы, главы «Материалы и методы исследования» и «Результаты собственных наблюдений», обсуждение полученных данных, выводы, список цитируемой литературы, который состоит из 116 работ отечественных и 151 работы зарубежных авторов. Работа иллюстрирована 51 таблицей, 33 рисунками.
Содержание работы
Материал и методы исследования
Общая характеристика больных. Материалом для настоящего исследования послужили наблюдения за 159 больными с новообразованиями костей в возрасте от 5 до 66 лет (средний возраст 26,5±1,1 лет), которые получали лечение в хирургическом отделе общей онкологии (руководитель – академик РАМН, профессор М.Д.Алиев) РОНЦ им. Н.Н.Блохина РАМН с января 2001 по декабрь 2006 гг. Опухоль кости у всех больных выявлена впервые, до проведения клинических, инструментальных, морфологических и лабораторных биохимических методов исследования пациенты лечение не получали. Клинико-рентгенологический диагноз новообразования кости у всех пациентов подтвержден данными морфологического исследования опухоли согласно «Международной классификации опухолей человека» (ВОЗ, 2003г.) (табл. 1).
Таблица 1.
Характеристика материала
| Опухоли | Число больных (абс.) | ||
| IL-6 | sIL-6R | ЩФ | |
| Злокачественные: остеосаркома | 135 61 | 45 18 | 135 61 |
| хондросаркома первичная | 34 | 14 | 34 |
| хондросаркома вторичная | 3 | 0 | 3 |
| саркома Юинга | 28 | 8 | 28 |
| ЗФГ | 9 | 5 | 9 |
| ГКО | 15 | 12 | 15 |
| Доброкачественные: костно-хрящевой экзостоз | 9 3 | 5 1 | 9 3 |
| аневризмальная костная киста | 3 | 1 | 3 |
| остеобластома | 1 | 1 | 1 |
| хондробластома | 1 | 1 | 1 |
| хондрома | 1 | 1 | 1 |
| Всего | 159 | 62 | 159 |
Контрольную группу составили 38 практически здоровых людей в возрасте от 5 до 60 лет, средний возраст 21,3±2,3 года.
Первую группу составили 135 больных саркомами костей (87 мужчин, 48 женщин) в возрасте от 5 до 66 лет (средний возраст 26,2±1,2 года, медиана 19 лет): остеосаркома (61), первичная хондросаркома (34), вторичная хондросаркома (3), саркома Юинга (28), злокачественная фиброзная гистиоцитома (ЗФГ) (9). У 18 из 135 (13,3%) больных саркомами костей наряду с опухолью выявлены отдаленные метастазы: в легких (14), в костях таза и легких (1), в спинномозговом канале (2), в костном мозге и грудных позвонках (1). Отдаленные метастазы выявлены у 9 из 28 (32,1%) больных саркомой Юинга, у 6 из 61 (9,8%) остеосаркомой, у 2 из 34 (5,9%) хондросаркомой и у 1 из 9 (11,1%) ЗФГ.
У преобладающего числа больных саркомами костей опухоль поражала бедренную (49), большеберцовую (16), малоберцовую (14), плечевую (13), подвздошную (15) кости, ребро (5), грудину (4) и лопатку (9). Локализация опухоли в других костях скелета была представлена единичными наблюдениями: крестец (3), челюсть (2), седалищная (2), лонная (1), лучевая (1) и пяточная (1) кости.
Больные остеосаркомой, неблагоприятными морфологическими вариантами хондросаркомы и ЗФГ получали 4 ежемесячных курса неоадъювантной химиотерапии (доксорубицин и цисплатин), после чего им выполняли радикальную операцию по удалению опухоли. В послеоперационном периоде всем проводили 6 ежемесячных курсов адъювантной химиотерапии: при выраженном лечебном патоморфозе те же схемы, что и в неоадъювантном режиме, но в редуцированных дозах; при низкой степени выраженности лечебного патоморфоза добавляли к ранее проводимой схеме этопозид и ифосфамид.
При саркоме Юинга в предоперационном периоде проводили 4-6 курсов неоадъювантной химиотерапии по схеме VIDE – винкристин, этопозид, доксорубицин и ифосфамид. Затем либо проводили радикальное удаление первичной опухоли кости, либо лучевую терапию на пораженную саркомой кость. После чего все больные получали поддерживающую химиотерапию по схеме VAIА: винкристин, ифосфамид, актиномицин Д, доксорубицин.
Степень выраженности лечебного патоморфоза опухоли после неоадъювантной полихимиотерапии определяли по A.G.Huvos (1993) у 65 больных: остеосаркомой (46), саркомой Юинга (14), ЗФГ (4), хондросаркомой (1).
Отдаленные результаты лечения были прослежены у 103 из 135 (прослеженность 76,3%) больных саркомами костей.
Во второй группе обследовали 15 больных ГКО (9 женщин, 6 мужчин) в возрасте от 17 до 46 лет (средний возраст 28,8±2,4 года, медиана 27 лет). Опухоль была локализована: в бедренной (3), большеберцовой (3), малоберцовой (3), лучевой (2) и плечевой (1) костях. У 3 больных ГКО установлено поражение плоских костей: подвздошной, лопатки, надколенника.
В третьей группе обследовали 9 больных доброкачественными новообразованиями костей (7 женщин, 2 мужчин) в возрасте от 10 до 50 лет (средний возраст 25,6±5,0 лет, медиана 17 лет): костно-хрящевой экзостоз - 3, аневризмальная костная киста - 3, остеобластома - 1, хондрома - 1, хондробластома – 1.
Уровни IL-6 и sIL-6R в сыворотке крови определяли иммуноферментным методом «сэндвичевого» типа с использованием реактивов компании «R&D» (США), а общую активность ЩФ оптимизированным спектрофотометрическим методом на автоматическом анализаторе «Hitachi 911» (Швейцария).
Известно, что активность ЩФ меняется в зависимости от возраста. У людей молодого возраста в период интенсивного роста костной ткани уровень фермента значительно выше, чем у взрослых. Кроме того, активность фермента у подростков и взрослых мужчин выше, чем у женщин. Поэтому для каждой возрастной группы использовали отдельные референсные пределы активности ЩФ с учетом пола. Для определения активности ЩФ применяли наборы реактивов фирмы «Roche» (Швейцария) и их показатели нормы, относительно которых рассматривали изменения активности фермента у пациентов. Активность ЩФ, измеряемая при 37оС у здоровых детей в возрасте 4-6 лет не превышала 644 Ед/л, 7-12 лет - <720 Ед/л, подростков женского пола 13-17 лет – <448 Ед/л, подростков мужского пола 13-17 лет – <936 Ед/л, практически здоровых женщин - <240 Ед/л и мужчин – 270 <Ед/л. По собственным наблюдениям, показатели нормы активности ЩФ, которые были изучены у практически здоровых людей, совпадали с литературными данными (В.Хейль и соавт., 2001). Рассчитали также частоту превышения уровня активности ЩФ относительно нормы с учетом пола, возраста пациентов и относительную величину превышения нормы.
Статистический анализ результатов исследования проводили с помощью однофакторного и многофакторного дисперсионного анализа. Для малых выборок и для типа распределения, отличного от нормального, достоверность различия средних оценивали с помощью непараметрических критериев – медианного, Колмогорова-Смирнова, Mann-Whitney U-test. Достоверность различий частот в изучаемых признаках оценивали с помощью критерия 2, для малых выборок рассчитывали непараметрический точный критерий Фишера. Меру линейной связи оценивали с помощью коэффициента корреляции Пирсона, коэффициента корреляции рангов Spearman. При множественных сравнениях расчет уровня значимости проводили с учетом поправки Бонферрони. Анализ кривых выживаемости проводили методом Kaplan-Mayer, сравнения кривых выживаемости проводили методом Log-Rank. Многофакторный анализ влияния признаков на безрецидивную выживаемость проводили с использованием модели Cox hazard proportional regression. Все вычисления выполняли на персональном компьютере с помощью пакета статистических программ «Statistica для Windows» и SPSS.
Результаты собственных исследований
1. IL-6 у больных новообразованиями костей и в контроле. IL-6 выявлен у всех 159 больных новообразованиями костей и не выявлен у 11 из 38 практически здоровых людей (29%) в сыворотке крови. Распределение IL-6 в обследованных группах достоверно отличалось от распределения Гаусса, поэтому для его анализа применяли непараметрические методы, а в качестве центральной характеристики использовали медиану. Медианы IL-6 у больных опухолями костей и в контроле составили 4,8 и 1,2 пг/мл соответственно, различия высокодостоверны (р=0,0001). Максимальное значение IL-6 в группе контроля равнялось 2,24 пг/мл, что и составило верхнюю границу 95% референсного интервала цитокина (пороговое значение).
Данные настоящего исследования свидетельствуют о том, что значения IL-6 в сыворотке крови 95,6% больных новообразованиями костей превышали таковые в контроле. Медиана IL-6 у больных злокачественными опухолями костей в 4,4 раза, ГКО – в 3,3 раза, доброкачественными новообразованиями – в 2,7 раза была выше, чем в контроле.
Таблица 2.
Статистические характеристики IL-6 у больных новообразованиями костей с учетом гистологического строения опухоли
| Новообразования костей | Число больных (абс.) | Уровень IL-6, пг/мл | * | ||
| M±m | Пределы колебания | Медиана | |||
| Злокачественные1 | 135 | 13,9±1,9 | 1,5-134,7 | 5,3 | 134 |
| ГКО2 | 15 | 18,6±13,8 | 1,5-210,5 | 3,9 | 11 |
| Доброкачественные3 | 9 | 3,1±0,3 | 1,9-4,6 | 3,2 | 7 |
Примечание: p1-2=0,046; p1-3=0,003; p3-2=0,56; *- частота выявления IL-6 выше порогового уровня (2,24 пг/мл).
При этом у 99,3% больных злокачественными, у 73,3% больных ГКО и у 77,8% доброкачественными новообразованиями костей значения IL-6 в сыворотке крови были выше его порогового значения (табл. 2).
В группе контроля у мужчин и женщин не выявили достоверных различий IL-6, однако у больных новообразованиями костей различия между мужчинами и женщинами в показателе IL-6 были достоверными (5,7 и 3,8 пг/мл соответственно, р=0,047). При этом, медианы IL-6 в группе больных новообразованиями костей у мужчин были в 4,4 раза, а у женщин - в 3,2 раза выше, чем в контроле.
Таблица 3.
Статистические характеристики IL-6 в сыворотке крови больных новообразованиями костей с учетом гистологического строения опухоли
| Гистологическое строение опухоли | Число больных (абс.) | Средний уровень IL-6 (пг/мл) | Медиана IL-6 (пг/мл) |
| 1) Остесаркома | 61 | 8,8±1,8 | 4,6 |
| 2) Хондросаркома первичная | 34 | 14,5±4,6 | 4,3 |
| 3) Хондросаркома вторичная | 3 | 5,2±2,3 | 3,2 |
| 4) ЗФГ | 9 | 20,4±8,2 | 15,4 |
| 5) Саркома Юинга | 28 | 23,4±5,2 | 10,4 |
| 6) ГКО | 15 | 18,6±13,8 | 3,9 |
| 7) Остеобластома | 1 | 1,9 | - |
| 8) Костно-хрящевой экзостоз | 3 | 4,0±0,4 | 4,2 |
| 9) Аневризмальная костная киста | 3 | 3,3±0,4 | 3,3 |
| 10) Хондрома | 1 | 2,3 | - |
| 11) Хондробластома | 1 | 1,96 | - |
| Всего | 159 | - | - |
Примечание: p1-4=0,015; p1-6=0,0005; p2-4=0,037; p2-6=0,004; p5-6=0,002; p10-4=0,03; p10-6=0,019; p9-5=0,045.
У практически здоровых людей также не выявлено связи содержания IL-6 с полом.
У больных саркомами костей пределы колебания IL-6 составили 1,5-131 пг/мл, а наиболее высокие медианы цитокина обнаружены при ЗФГ (15,4 пг/мл) и саркоме Юинга (10,4 пг/мл). При остеосаркоме (4,6 пг/мл) и первичной хондросаркоме (4,3 пг/мл) медианы IL-6 не различались (табл. 3).
Значение IL-6 5 пг/мл составило 51,9% в группе злокачественных опухолей костей, 33,3% - в группе ГКО, тогда как в группе доброкачественных опухолей – 0% (р=0,005). При этом, частота превышения содержания IL-6 5 пг/мл составила соответственно 42,6 и 41,2% у больных остеосаркомой и хондросаркомой, 77,8 и 78,6% в группе больных ЗФГ и саркомой Юинга (р=0,006).
Медиана IL-6 в группе больных саркомами костей была достоверно выше при показателе Т2, чем при Т1 (соответственно 7,6 и 4,9 пг/мл; р=0,04). Медиана IL-6 в сыворотке крови больных саркомой Юинга увеличивалась достоверно при выявлении отдаленных метастазов (Мо - 7,7 и М1 - 32,2 пг/ мл) (р=0,005). Во всех группах больных саркомами костей с увеличением степени злокачественности опухоли выявляли достоверно более высокие медианы IL-6 в сыворотке крови.
Содержание IL-6 в сыворотке крови 15 больных ГКО отличалось большим разбросом значений показателя – от 1,5 до 211 пг/мл, при этом у 13 (86,7%) пациентов значения не превышали 10 пг/мл. У 9 больных с доброкачественными новообразованиями костей разброс уровней IL-6 был не значительным и составил 1,9-4,6 пг/мл, что отличало эту группу от пациентов с ГКО и злокачественными опухолями костей. В то же время уровни IL-6 в сыворотке крови больных ГКО и доброкачественными новообразованиями костей не были связаны с полом и возрастом пациентов.
У больных ГКО и доброкачественными новообразованиями костей медианы IL-6 не различались и составили соответственно 3,9 и 3,2 пг/мл и были достоверно ниже, чем при саркомах костей (5,3 пг/мл). В то же время у больных ГКО отмечены более низкие уровни IL-6 при увеличении размера опухоли. Так, медиана IL-6 при опухолях размером <5 см составила 6,7 пг/мл, тогда как при опухолях 5 см - 2,7 пг/мл. При рецидиве заболевания медиана содержания IL-6 в сыворотке крови больных ГКО была достоверно выше (6,0 пг/мл), чем без такового (2,4 пг/мл) (p<0,05).
Анализируя связь между содержанием IL-6 в сыворотке крови больных злокачественными новообразованиями костей до лечения и степенью выраженности лечебного патоморфоза опухоли, была выявлена следующая особенность. Более высокая медиана IL-6 в сыворотке крови отмечена среди больных с IV степенью выраженности лечебного патоморфоза (8,1 пг/мл) по сравнению с I, II и III степенями (медианы 5,1, 4,8 и 5,0 пг/мл соответственно).
2. sIL-6R в сыворотке крови при новообразованиях костей определен у 62 больных (29 женщин, 33 мужчины) в 3 группах: 1) саркомы (45); 2) ГКО (12); 3) доброкачественные новообразования (5).
Распределение уровней sIL-6R не отличалось от распределения Гаусса, и при сравнениях применяли параметрические методы статистического анализа, а в качестве центральной характеристики показателя использовали его среднее значение. Анализ уровней sIL-6R в трех группах больных злокачественными опухолями (29,8±1,3 нг/мл), ГКО (28,3±1,7 нг/мл) и доброкачественными новообразованиями (30,4±5,1 нг/мл) костей не выявил различий.
В группе мужчин, больных саркомами костей, выявлена обратная корреляционная связь между IL-6 и sIL-6R (r=-0,44, p=0,024) независимо от гистологического строения опухоли. В то же время при саркомах костей у женщин эта зависимость не подтвердилась.
Уровни sIL-6R при опухолях трубчатых костей (28,3±1,1 нг/мл) были достоверно ниже, чем при опухолях плоских костей (34,1±2,6 нг/мл) (р=0,03). Наиболее высокие показатели sIL-6R выявлены при опухолях подвздошной кости (36,2±4,4 нг/мл), наиболее низкие при поражении большеберцовой кости (25,4±2,6 нг/мл) и ребер (23,2±1,0 нг/мл).
При исследовании sIL-6R в группах больных новообразованиями костей с учетом их гистологического строения показано, что при саркоме Юинга и остеосаркоме обнаружены наиболее низкие значения рецептора (27,1±2,9 и 27,6±2,0 нг/мл соответственно). Достоверно более высокие значения sIL-6R обнаружены при анализе множественных сравнений по критерию Шеффе у больных хондросаркомой, по сравнению с остеосаркомой и саркомой Юинга (табл. 4).
Таблица 4.
Статистические характеристики sIL-6R у больных новообразованиями костей с учетом гистологического строения опухоли
| Гистологическое строение опухоли | Число наблюдений | sIL-6R, нг/мл | |
| M±m | Пределы колебания | ||
| Остеосаркома1 | 18 | 27,6±2,0 | 11,9-46,5 |
| Хондросаркома первичная2 | 14 | 33,7±2,6 | 18,9-53,4 |
| ЗФГ3 | 5 | 30,6±3,8 | 18,9-41,1 |
| ГКО4 | 12 | 28,3±1,7 | 19,9-40,1 |
| Саркома Юинга5 | 8 | 27,1±2,9 | 16,4-39,2 |
| Остеобластома | 1 | 45,1* | - |
| Костно-хрящевой экзостоз | 1 | 26,2* | - |
| Аневризмальная костная киста | 1 | 13,9* | - |
| Хондрома | 1 | 34,8* | - |
| Хондробластома | 1 | 32,1* | - |
| Всего | 62 | - | - |
Примечание: р1-2=0,046; р2-5=0,044; *- абсолютное значение.
В группах с однородным гистологическим строением опухоли кости не выявлено статистически значимых различий в среднем значении sIL-6R при учете пола, возраста пациентов, локализации опухоли в костях скелета.
В общей группе больных новообразованиями костей обнаружили корреляционную зависимость между значениями sIL-6R и показателем Т (r=0,33; p=0,009). В группе больных остеосаркомой коэффициент корреляции повышался до уровня r=0,42 (p=0,08), у больных хондросаркомой кости эта зависимость была выраженно линейной и усиливалась до показателя r=0,73 (p=0,003), а у больных саркомой Юинга - до значения r=0,83 (p=0,04). Данная закономерность не зависела от пола пациентов и локализации опухоли. При ГКО данная зависимость отсутствовала.
У больных злокачественными опухолями костей при показателе Т2 содержание sIL-6R было достоверно выше (33,0±9,9 нг/мл; n=20), чем при Т1 (25,7±5,7 нг/мл; n=25; р=0,003). Не установлено связи содержания sIL-6R в сыворотке крови больных саркомами костей со степенью злокачественности, наличием отдаленных метастазов и выраженностью лечебного патоморфоза опухоли. Однако, при IV степени лечебного патоморфоза опухоли средние показатели sIL-6R имели тенденцию к снижению по сравнению с больными, в опухоли которых обнаружена I-III степени выраженности лечебного патоморфоза.
3. Общая активность ЩФ в сыворотке крови больных новообразованиями костей. Активность ЩФ определили в сыворотке крови 159 больных новообразованиями костей. Распределение показателя было логнормальным и после соответствующего математического преобразования для его анализа применяли непараметрические статистические методы, а в качестве центральной характеристики использовали медиану.
Анализ результатов определения активности ЩФ в сыворотке крови с учетом возраста и пола больных показал, что в группе пациентов с саркомами костей активность фермента была достоверно выше у подростков 13-17 лет, чем у взрослых мужчин (р=0,005). В то же время только у 19,4% подростков мужского пола активность ЩФ была выше нормы, у подростков женского пола – в 64,3%, а у пациентов в возрасте старше 17 лет как мужчин, так и женщин – в 73% наблюдений. При злокачественных новообразованиях костей наибольшая медиана превышения нормы уровня активности ЩФ выявлена у подростков мужского и женского пола (соответственно 73,5 и 94,6%) по сравнению с детьми 7-12 лет и пациентами старше 18 лет.
У больных ГКО кости в возрасте старше 18 лет медиана активности ЩФ была повышена относительно нормы (у 77,2% мужчин и у 42,3% женщин).
В связи с тем, что различия в показателях активности ЩФ в сыворотке крови больных новообразованиями костей основных групп по полу и возрасту не были значимы, сравнительный анализ уровня фермента в основных группах провели без учета этих факторов.
В общей группе больных злокачественными новообразованиями костей (n=135) среднее значение ЩФ в сыворотке крови составило 680±84,4 Ед/л, медиана 453 Ед/л, пределы колебания равнялись 144-9678 Ед/л. В группе больных ГКО (n=15) среднее содержание равнялось 296,0±29,4 Ед/л, медиана 290 Ед/л, пределы колебания фермента 137-490 Ед/л. В группе больных доброкачественными новообразованиями костей (n=9) активность ЩФ была наименьшей, среднее значение составило 231,0±19,1 Ед/л, медиана 199 Ед/л, пределы колебания 157-329 Ед/л. Медиана активности ЩФ в сыворотке крови больных саркомами костей (453 Ед/л) была достоверно выше, чем при доброкачественных опухолях (199 Ед/л; р=0,002) и ГКО (290 Ед/л; р=0,004). Показатели активности ЩФ у больных доброкачественными новообразованиями и ГКО статистически не различались (р=0,48).
Наиболее высокие значения активности ЩФ выявлены у больных остеосаркомой (медиана 502 Ед/л), значительно более низкие – при первичной (299 Ед/л) и вторичной (260 Ед/л) хондросаркомах, ГКО (290 Ед/л) (табл. 5).
Таблица 5.
Статистические характеристики активности ЩФ в основных группах больных новообразованиями костей
| Гистологическое строение опухоли | Число больных (абс.) | Активность ЩФ, Ед/л | ||
| M±m | Пределы колебания | Медиана | ||
| Остеосаркома1 | 61 | 927±177 | 158-9678 | 502 |
| Хондросаркома первичная2 | 34 | 421±44,8 | 144-1100 | 299 |
| Хондросаркома вторичная3 | 3 | 248±40,0 | 173-310 | 260 |
| ЗФГ4 | 9 | 508±124 | 211-1367 | 356 |
| Саркома Юинга5 | 28 | 557±66,7 | 171-1455 | 376 |
| ГКО6 | 15 | 296±±29,4 | 137-490 | 290 |
| Доброкачественные новообразования7 | 9 | 231±19,1 | 157-329 | 199 |
Примечание: р1vs2=0,0003; p1vs5=0,07; p1vs6<0,0001; p1vs7<0,0001; p2vs7=0,06; p4vs7=0,04; p5vs6=0,016; p5vs7=0,005.
Обнаружена прямая корреляция между значениями активности ЩФ в сыворотке крови и показателями Т1, Т2. При этом у больных доброкачественными новообразованиями костей коэффициент корреляции равнялся r=0,73 (p=0,06), а при ГКО r=0,42 (p=0,1). У больных злокачественными опухолями костей независимо от гистологического строения опухоли эта зависимость снижалась до значения r=0,1 (p=0,27).
Не выявлено связи между значениями активности ЩФ у больных саркомами костей до лечения и показателями степени выраженности лечебного патоморфоза опухоли. Проведенный многофакторный анализ выявил, что степень выраженности лечебного патоморфоза опухоли связана с возрастом больных (р=0,0044), но не с активностью ЩФ (р=0,8).
Больные остеосаркомой. Уровень активности ЩФ был выше нормы в 54,7% наблюдений при остеосаркоме. При этом, если у подростков мужского пола частота превышения уровня фермента в норме составляла всего 20%, то у взрослых мужчин достигала 94% (р=0,0001). У больных остеосаркомой не установлено статистических различий в показателях ЩФ при учете пола и возраста, поэтому дальнейший анализ активности фермента проводили без учета этих факторов.
Таблица 6.
Активность ЩФ в сыворотке крови больных остеосаркомой
с учетом показателей Т и М
| Показатели | N | АктивностьЩФ, Ед/л M±m (медиана) | Частота превышения активности ЩФ относительно нормы Абс.(%) | Медиана превышения активности ЩФ относительно нормы (%) |
| Т1 | 10 | 406±66,4 (364) | 5 (50,0) | 48,3 |
| Т2 | 51 | 1029±209 (578) | 30 (58,8) | 97,3 |
| Мо | 55 | 900±187 (497) | 33 (60,0) | 81,0 |
| М1 | 6 | 1172±604 (560) | 2 (33,3) | 86,5 |
Примечание: рТ1vsТ2=0,02.
Обнаружили достоверное повышение активности ЩФ в сыворотке крови больных остеосаркомой при увеличении максимального размера первичной опухоли (Т2), при этом частота выявления превышения фермента увеличивалась незначительно (на 9%), но величина превышения увеличивалась в 2 раза с 48,3 до 97,3%. При изучении взаимосвязи активности ЩФ и критерия М аналогичная закономерность была выражена в меньшей степени (табл. 6).
Отмечена тенденция к повышению активности ЩФ в сыворотке крови больных остеосаркомой с увеличением степени злокачественности опухоли (рис. 1).
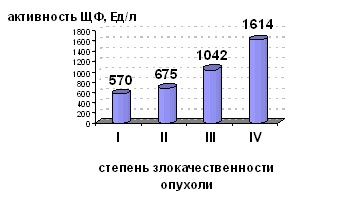

Рис. 1. Среднее значение активности ЩФ в сыворотке крови больных остеосаркомой и частота превышения ферментом нормы в группах с учетом степени злокачественности опухоли.
Не обнаружено связи активности ЩФ с уровнями IL-6 и sIL-6R в сыворотке крови, а также со степенью лечебного патоморфоза опухоли.
Больные хондросаркомой. Частота превышения активности ЩФ верхнего предела нормы составила 70% в группе из 34 больных первичной хондросаркомой и у 1 из 3 больных вторичной хондросаркомой.
Таблица 7.
Активность ЩФ в сыворотке крови больных хондросаркомой
с учетом критериев Т и М
| Показатели | N | Активность ЩФ, Ед/л M±m (медиана) | Частота превышения активности ЩФ относительно нормы Абс., (%) | Медиана превышения активности ЩФ относительно нормы (%) |
| Первичная хондросаркома | ||||
| Т1 | 8 | 418±98,5 (339) | 5 (50,0) | 97,1 |
| Т2 | 26 | 422±51,3 (296) | 19 (73,1) | 60,8 |
| Мо | 32 | 413±45,9 (295) | 22 (68,8) | 64,5 |
| М1 | 2 | 290 и 800* (545) | 2 (100) | 120 |
| Вторичная хондросаркома | ||||
| Т2 | 3 | 248±40 (291) | 1 (33,3) | |
| Мо | 3 | 248±40 (291) | 1 (33,3) | |
Примечание: *- абсолютные значения; все различия недостоверны.
Активность ЩФ в сыворотке крови мужчин и женщин не различалась достоверно, поэтому в дальнейшем анализ показателей ЩФ в сыворотке крови больных первичной хондросаркомой проводили без учета пола и возраста.
Не обнаружено связи уровней активности ЩФ в сыворотке крови больных первичной хондросаркомой с показателем Т и М (табл. 7). Установлена тенденция к повышению активности ЩФ в сыворотке крови больных первичной хондросаркомой при увеличении степени злокачественности опухоли. Не выявлено достоверных различий в показателях активности ЩФ в сыворотке крови у больных хондросаркомой с поражением трубчатых (456 Ед/л) и плоских (282 Ед/л; р=0,2) костей.
Больные ЗФГ. В группе 9 больных ЗФГ у 66,7% пациентов выявлено превышение активности ЩФ относительно верхнего предела нормы. Такие признаки как тип пораженной кости, локализация опухоли не были связаны с уровнем активности ЩФ. Однако было выявлено почти двукратное превышение активности ЩФ при размере опухоли менее 8 см, а также значения ЩФ заметно увеличивались при увеличении степени злокачественности опухоли.
Больные саркомой Юинга. В группе 28 больных саркомой Юинга частота превышения активности ЩФ верхнего предела нормы составила 50%. Не установлено статистических различий в содержании фермента в сыворотке крови с учетом пола и возраста пациентов. Активность ЩФ в сыворотке крови больных саркомой Юинга не была связана с показателем Т, наличием отдаленных метастазов, степенью злокачественности и лечебного патоморфоза опухоли, типом пораженной кости.
4. Безрецидивная выживаемость больных саркомами костей. Оценка показателей безрецидивной выживаемости проведена у 103 пациентов с саркомами костей. Достоверно выше была безрецидивная выживаемость у больных хондросаркомой по сравнению с ЗФГ и саркомой Юинга (p=0,04), безрецидивная выживаемость в двух последних группах различалась незначимо (табл. 8)
Таблица 8.
Показатели безрецидивной выживаемости у больных саркомами костей различного гистологического строения
| Группы больных | Число больных (абс.) | Медиана прогресс. (мес.) | Безрецидивная выживаемость(%) | ||
| 1-летняя | 3-летняя | 5-летняя | |||
| Остеосаркома | 49 | 18,6 | 74,8±6,3 | 31,7±7,4 | 23,4±6,8 |
| Хондросаркома | 20 | 32,0 | 75,0±9,7 | 43,1±11,4 | 38,7±11,8 |
| ЗФГ | 8 | 11,5 | 53,5±20,0 | 17,9±16,0 | 17,9±16,0 |
| Саркома Юинга | 26 | 15,7 | 62,6±10,7 | 14,1±9,1 | 14,1±9,1 |
Количество прослеженных пациентов с исследуемыми уровнями всех показателей (IL-6, sIL-6R, ЩФ) было невелико (n=4), однако у трех их этих больных прогрессирование заболевания наступило в короткие сроки (4,6; 9,1; 10,0 мес.). Количество прослеженных пациентов с изученными уровнями только двух показателей - IL-6 и общей активности ЩФ в сыворотке крови в настоящем исследовании составило 99. Поскольку ранее было показано отсутствие значимых различий активности ЩФ по полу и возрасту, определили связь активности ЩФ с отдаленными результатами лечения пациентов независимо от превышения уровня фермента относительно нормы. Таким пороговым значением оказалась активность ЩФ равная 400 Ед/л. При многофакторном анализе с учетом значений IL-6 и активности ЩФ больные были разделены на 4 группы:
1) группа - с неблагоприятными уровнями обоих показателей: ЩФ(-) 400 Ед/л и IL-6(-) 5 пг/мл;
2) группа - с благоприятными уровнями обоих показателей: ЩФ(+) - <400 Ед/л и IL-6(+) <5 пг/мл;
3) группа - только с благоприятными уровнями общей активности ЩФ: ЩФ(+) - <400 Ед/л и IL-6(-) 5 пг/мл;
4) группа - только с благоприятными уровнями показателя IL-6: ЩФ(-)
400 Ед/л и IL-6(+) - <5 пг/мл.
Наибольшие различия в показателях 5-летней безрецидивной выживаемости отмечены между пациентами 1 и 2 групп: с одновременно благоприятными и неблагоприятными уровнями активности ЩФ и IL-6, а показатели 3-летней безрецидивной выживаемости различались в этих группах в 7 раз (р=0,0017) (рис. 2).

Рис. 2. Показатели безрецидивной выживаемости больных саркомами костей с учетом благоприятных и неблагоприятных уровней IL-6 и ЩФ в сыворотке крови до лечения.
Следует отметить низкий риск возврата болезни в сроки до 72 месяцев наблюдения от начала терапии у больных с благоприятными значениями IL-6 и ЩФ. Эти данные указывают на высокую прогностическую информативность показателей IL-6 и ЩФ у больных саркомами костей.
Безрецидивная выживаемость больных остеосаркомой. При разделении 49 больных остеосаркомой с учетом уровня IL-6 в сыворотке крови (<5 и 5 пг/мл) выявлена тенденция к различию (р=0,1) в показателях безрецидивной выживаемости. При этом различия становились заметными после 1-го года наблюдения. Отдаленные результаты лечения при учете уровня общей активности ЩФ < и 400 Ед/л различались высокодостоверно (р=0,0004) (табл. 9).
Пол и возраст не были значимо связаны с отдаленными результатами лечения (р>0,05). Однако, показатели Т1 и Т2 связаны с показателями безрецидивной выживаемости, при Т1 она достоверно выше (р=0,005).
Таблица 9.
Показатели безрецидивной выживаемости больных остеосаркомой
с учетом уровня IL-6 и общей активности ЩФ в сыворотке крови
| Уровни IL-6, ЩФ в сыворотке крови | Число больных (абс.) | Медиана прогрес. (мес.) | Безрецидивная выживаемость(%) | ||
| 1-летняя | 3-летняя | 5-летняя | |||
| IL-6 <5 пг/мл | 26 | 21,8 | 71,8±9,1 | 43,1±10,6 | 32,8±10,3 |
| IL-6 5 пг/мл | 23 | 17,1 | 73,4±9,3 | 18,4±9,3 | 12,2±8,0 |
| ЩФ <400 Ед/л | 14 | - | 91,7±7,9 | 81,5±11,9 | 61,1±15,4 |
| ЩФ 400 Ед/л | 35 | 13,0 | 64,5±8,3 | 13,8±6,4 | 10,4±5,6 |
Стадия остеосаркомы значимо связана с отдаленными результатами лечения. При IV стадии у всех пациентов прогрессирование выявлено в первый год наблюдения, а при I и IIa стадиях 5-летняя безрецидивная выживаемость равнялась 80%. Связь отдаленных результатов лечения со степенью злокачественности остеосаркомы не достоверна (р=0,29).
Безрецидивная выживаемость больных первичной хондросаркомой кости. У мужчин с первичной хондросаркомой кости 5-летняя безрецидивная выживаемость была достоверно ниже, чем у женщин (р=0,02) (табл. 10).
Таблица 10.
Показатели безрецидивной выживаемости больных первичной хондросаркомой кости с учетом пола пациентов
| Пол | Число больных (абс.) | Медиана прогрес. (мес.) | Безрецидивная выживаемость(%) | ||
| 1-летняя | 3-летняя | 5-летняя | |||
| Мужской | 10 | 5,0 | 40,0±15,5 | 20,0±12,6 | 20,0±12,6 |
| Женский | 10 | Не достигн. | 90,0±9,5 | 67,5±15,5 | 54,0±17,3 |
Возраст больных хондросаркомой и тип пораженной кости не были связаны с отдаленными результатами лечения. При уровнях IL-6 <5 пг/мл у больных хондросаркомой, также, как в общей группе саркомами костей 5-летняя безрецидивная выживаемость была более, чем в 2 раза выше, чем при значениях цитокина 5 пг/мл (р=0,03) (табл. 11).
Таблица 11.
Показатели безрецидивной выживаемости больных первичной хондросаркомой кости с учетом уровней IL-6 в сыворотке крови
| Уровень IL-6 в сыворотке крови | Число больных (абс.) | Медиана прогрес.(мес.) | Безрецидивная выживаемость(%) | ||
| 1-летняя | 3-летняя | 5-летняя | |||
| IL-6 <5 пг/мл | 13 | 57,6 | 76,2±12,1 | 59,2±14,1 | 49,4±14,8 |
| IL-6 5 пг/мл | 7 | 4,8 | 42,9±18,7 | 14,3±13,2 | 14,3±13,2 |
Выявлено достоверное различие в показателях безрецидивной выживаемости пациентов при хондросаркоме кости с активностью ЩФ в сыворотке крови <400 Ед/л, по сравнению с больными, у которых активность фермента была 400 Ед/л (р=0,018). Так, в группе из 13 больных хондросаркомой с активностью ЩФ <400 Ед/л медиана безрецидивной выживаемости составила 57,6 месяцев, а 5-летняя безрецидивная выживаемость 59,2±14,1%. В группе из 7 больных с активностью ЩФ 400 Ед/л медиана составила всего 4,8 месяца, 5-летняя безрецидивная выживаемость равнялась 0.
Безрецидивная выживаемость больных хондросаркомой не зависела достоверно от распространения первичной опухоли (критерия Т) (р=0,06) и степени ее злокачественности (р=0,12).
Безрецидивная выживаемость больных саркомой Юинга. При прогностически благоприятных значениях IL-6 (<5 пг/мл) и ЩФ (<400 Ед/л) 1-летняя безрецидивная выживаемость была выше на 20%. У больных с «низкими» значениями IL-6 (<5 пг/мл) в сыворотке крови 1-летняя безрецидивная выживаемость составила 66,7±27,1%, а с «высокими» уровнями IL-6 (5 пг/мл) - 46,9±11,8% (р=0,11). В то же время 1-летняя безрецидивная выживаемость при «низкой» (<400 Ед/л) и «высокой» (400 Ед/л) активностях ЩФ в сыворотке крови составили соответственно 79,7±9,1 и 0% (р=0,03). Отдаленные результаты лечения больных саркомой Юинга не были связаны со степенью выраженности лечебного патоморфоза опухоли, но достоверно связаны с наличием отдаленных метастазов М (р=0,001) и величиной превышения верхнего предела нормы активности ЩФ в сыворотке крови (р=0,015).
5. Безрецидивная выживаемость больных злокачественными новообразованиями костей с учетом уровня sIL-6R в сыворотке крови. Количество прослеженных больных злокачественными опухолями костей с измеренным уровнем рецептора было невелико и поэтому представили данные по безрецидивной выживаемости в общей группе больных. Больные были разбиты на 3 группы с учетом значений sIL-6R: 1) группа - <25 нг/мл; 2) группа - 25-34 нг/мл; 3) группа - >34 нг/мл. Не обнаружено достоверных различий в показателях безрецидивной выживаемости в общей группе больных злокачественными новообразованиями костей с учетом уровня sIL-6R, однако несколько лучшая безрецидивная выживаемость установлена в группе больных с низкими значениями рецептора (табл. 12).
Таблица 12.
Показатели безрецидивной выживаемости больных злокачественными новообразованиями костей в общей группе
| Уровни sIL-6R в сыворотке крови | Число больных (абс.) | Меди-ана (мес.) | Безрецидивная выживаемость(%) | |||
| 1-летняя | 3-летняя | 5-летняя | ||||
| <25 нг/мл | 12 | 34,1 | 83,3±10,8 | 50,0±14,4 | 50,0±14,4 | |
| 25-34 нг/мл | 17 | 26,4 | 88,2±7,8 | 47,1±12,1 | 41,1±11,9 | |
| >34 нг/мл | 12 | 24,0 | 75,0±12,5 | 41,7±14,2 | 41,2±14,2 | |
Таким образом, подводя итоги исследования IL-6 и общей активности ЩФ в сыворотке крови больных новообразованиями костей, следует отметить, что высокие уровни цитокина и изучаемого фермента свидетельствовали о высоком злокачественном потенциале опухоли, а их показатели можно считать дополнительными маркерами, характеризующими биологическое поведение опухоли.
Не установлено связи между показателями безрецидивной выживаемости и sIL-6R в сыворотке крови у больных злокачественными новообразованиями костей.
Многофакторный анализ безрецидивной выживаемости (Сox regression model) в общей группе больных саркомами костей с учетом изученных клинических признаков и биохимических показателей выявил, что определяющими факторами прогноза были сочетание биохимических показателей IL-6 и общей активности ЩФ в сыворотке крови до лечения (р=0,005), критерии Т (р=0,03) и М (р=0,0001).
Выводы
1. Медиана показателя IL-6 в сыворотке крови практически здоровых людей высокозначимо ниже (1,2 пг/мл), чем у больных саркомами (5,3 пг/мл), ГКО (3,9 пг/мл) и доброкачественными новообразованиями (3,2 пг/мл) костей, а наиболее высокие уровни IL-6 обнаружены у больных ЗФГ и саркомой Юинга.
2. Достоверно высокие исходные значения IL-6 выявлены в сыворотке крови больных саркомами костей при выраженной степени лечебного патоморфоза опухоли.
3. Не обнаружено различий в показателях sIL-6R между больными саркомами, ГКО и доброкачественными новообразованиями костей.
4. Выявлена положительная корреляционная связь значений sIL-6R с размером первичной опухоли, а исходные уровни sIL-6R в сыворотке крови были обратно пропорциональны выраженности лечебного патоморфоза и степени злокачественности опухоли.
5. Значения общей активности ЩФ в сыворотке крови достоверно различались между больными доброкачественными и злокачественными новообразованиями костей. Наиболее высокие медианы активности ЩФ обнаружены в сыворотке крови больных остеосаркомой и саркомой Юинга (502 и 376 Ед/л соответственно).
6. Выявлена достоверная зависимость (р=0,02) активности ЩФ в сыворотке крови больных саркомами костей с размером опухоли, наличием отдаленных метастазов и степенью злокачественности новообразования.
7. Многофакторный анализ выявил, что определяющими факторами прогноза безрецидивной выживаемости больных саркомами костей следует считать показатели IL-6 и общей активности ЩФ в сыворотке крови до лечения (р=0,005), критерии Т (р=0,03) и М (р=0,0001).
Список работ, опубликованных по теме диссертации
- Интерлейкин 6 в сыворотке крови больных новообразованиями костей // Кремлевская медицина (клинический вестник).-2001.-№4.-с.62-64 / Н.Е.Кушлинский, И.В.Бабкина, Ю.Н.Соловьев, М.Д.Алиев, Т.А.Тарасова, Н.Н.Трапезников.
- Интерлейкин-6 в крови больных первичными опухолями костей // Материалы V ежегодной Российской онкологической конференции.-М.-2001.-с.166 / Н.Е.Кушлинский, И.В.Бабкина, Ю.Н.Соловьев, Т.А.Тарасова, Н.Н.Трапезников.
- Интерлейкин-6 и его растворимый рецептор при опухолях костей // Вопросы онкологии.-2002.-том 4, №4-5.-с.588-592 / Н.Е.Кушлинский, Т.А.Тарасова, Ю.Н.Соловьев.
- Интерлейкин-6 (ИЛ-6) и растворимая форма молекулы адгезии эндотелия сосудов I типа (SVCAM-1) у больных косте- и хрящеобразующими опухолями костей // Материалы I Всероссийской научно-практической конференции патологоанатомов «Актуальные вопросы патологической анатомии».-Орел.-2005.-с.227-229 / Н.Е.Кушлинский, И.В.Бабкина, Ю.Н.Соловьев, Т.А.Тарасова, И.Н.Кузнецов, Е.Ю.Руссо, Д.А.Борисов.
- Интерлейкин-6 и растворимая форма молекулы адгезии эндотелия сосудов 1 типа в сыворотке крови при косте- и хрящеобразующих саркомах // Материалы VI Всероссийского съезда онкологов «Современные технологии в онкологии».-Ростов-на-Дону.-2005.-том 2.-с.353-354 / Н.Е.Кушлинский, И.В.Бабкина, Ю.Н.Соловьев, Т.А.Тарасова, И.Н.Кузнецов, Д.А.Борисов.
- Растворимая форма молекулы адгезии эндотелия сосудов типа 1 (sVCAM-1) и интерлейкин-6 при остеогенной саркоме и хондросаркоме кости // Материалы конференции «Национальные дни лабораторной медицины России». Клиническая лабораторная диагностика.-2005.-№9.-с.23 / Е.Ю.Руссо, Д.А.Борисов, Ю.Н.Соловьев, Т.А.Тарасова, И.В.Булычева, Л.Т.Лякина.
- Особенности продукции интерлейкина-6 у больных злокачественными и доброкачественными опухолями костей // Материалы II Международной конференции «Молекулярная медицина и биобезопасность».-М.-2005.-с.172 / Н.Е.Кушлинский, Т.А.Тарасова, Ю.Н.Соловьев, Д.А.Борисов, И.Н.Кузнецов, И.В.Булычева.
- Особенности продукции интерлейкина-6 у больных злокачественными и доброкачественными новообразованиями костей // Материалы IX Российского онкологического конгресса.-М.-2005.-с.154 / Н.Е.Кушлинский, Т.А.Тарасова, Ю.Н.Соловьев, Д.А.Борисов, И.В.Булычева.
- Интерлейкин-6 и его растворимый рецептор у больных опухолями костей // Клиническая лабораторная диагностика.-2005.-№9.-с.22 / Н.Е.Кушлинский, Ю.Н.Соловьев, Т.А.Тарасова, И.В.Бабкина, Д.А.Борисов, И.В.Булычева.
- Peculiarities of interleukin-6 production in patients with bone neoplasms // In abstract book 17th ICACT (17th International congress on anti-cancer treatment, Paris, 30th January – 2nd February, 2006).-Paris.-2006.-p.320 / Kushlinsky N.E., Borisov D.A., Tarasova T.A., Solovyev Yu.N., Bulytcheva I.V.
- Интерлейкин-6 в крови больных первичной и вторичной хондросаркомой // Материалы ХIV Российского национального конгресса «Человек и лекарство».-М.-2007.-с.224 / Т.А.Тарасова, Н.Е.Кушлинский.
- Саркомы костей и интерлейкин-6 // Материалы ХIV Российского национального конгресса «Человек и лекарство».-М.-2007.-с.134 / Н.Е.Кушлинский, Ю.Н.Соловьев, Т.А.Тарасова, И.В.Булычева, Д.А.Борисов, И.Н.Кузнецов, Е.Ю.Руссо, Л.Т.Лякина.
- Интерлейкин-6 в сыворотке крови больных первичной остеогенной и хондросаркомой // Материалы конференции «Национальные дни лабораторной медицины России». Клиническая лабораторная диагностика.-2007.-№9.-с.68 / Т.А.Тарасова, Ю.Н.Соловьев, Л.Т.Лякина, М.Д.Алиев.
- IL-6, sIL-6R, активность ЩФ при опухолях костей и их роль в прогнозе заболевания // Вопросы биологической, медицинской и фармацевтической химии.-2010.-№2.-с.13-25 / Н.Е.Кушлинский, Т.А.Тарасова, Ю.Н.Соловьев, И.В.Бабкина, И.В.Булычева, Г.Н.Мачак, Е.К.Дворова, М.Д.Алиев.

