Антиангиогенная активность экстрактов растений и их фракций
На правах рукописи
СОЛОМКО ЭЛИСО ШАЛИКОВНА
АНТИАНГИОГЕННАЯ АКТИВНОСТЬ
ЭКСТРАКТОВ РАСТЕНИЙ И ИХ ФРАКЦИЙ
14.01.12 – онкология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2011
Работа выполнена в Учреждении Российской академии медицинских наук Российском онкологическом научном центре им. Н.Н. Блохина РАМН (директор – академик РАН и РАМН, профессор М.И.Давыдов)
| Научные руководители - | доктор медицинских наук, Е.В.Степанова доктор медицинских наук, А.В.Киселев |
| Официальные оппоненты - | доктор биологических наук, профессор О.А. Бочарова доктор медицинских наук, Р.К.Чайлахян |
Ведущее научное учреждение:
ФГУ Московский научно-исследовательский онкологический институт им. П.А. Герцена Министерства здравоохранения и социального развития РФ
Защита диссертации состоится «__» ____________ 2012 г. в ____ часов на заседании диссертационного Совета. Д.001.017.02.РОНЦ им.Н.Н.Блохина РАМН по адресу:115478, Москва, Каширское шоссе, д. 23.
С диссертацией можно ознакомиться в библиотеке РОНЦ им. Н.Н.Блохина РАМН.
Автореферат разослан «___» ______________ 2012 г.
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Ю.А.Барсуков
ВВЕДЕНИЕ
Актуальность темы
Одним из важных направлений исследований в области развития и прогрессии злокачественных заболеваний является изучение механизмов опухолевого ангиогенеза. Ангиогенез, или формирование новых микрососудов на основе уже существующей в ткани сети сосудов, является необходимым началом для роста опухоли и формирования отдаленных метастазов.
В настоящее время активно разрабатываются новые подходы к лекарственному лечению злокачественных опухолей. Среди них – ингибирование роста новых микрососудов опухоли – антиангиогенная терапия, и уничтожение уже сформированных опухолевых микрососудов – васкулярная терапия. Новые направления в лечении опухолей требуют совершенно иной методологии скрининга активных соединений.
На сегодняшний день разработаны основные методики тестирования веществ на антиангиогенную активность in vitro. К ним относятся: пролиферативный, миграционный тест, тест на блокирование образования сосудисто-подобных структур (СПС). Однако до сих пор не разработаны стандарты критериев оценки антиангиогенных свойств вещества.
В предклинических исследованиях in vitro и in vivo изучено более 2000 различных ингибиторов ангиогенеза. Только несколько препаратов ингибиторов VEGF рецептор-лигандной системы (Авастин, Сунитиниб и другие) показали эффективность в III фазе клинических испытаний и одобрены для клинического применения.
Основной мишенью одобренных антиангиогенных препаратов является блокирование активности VEGF рецептор-лигандной системы. В последнее время возрос интерес к скринингу противоопухолевых и антиангиогенных веществ природного происхождения, блокирующих несколько механизмов активации ангиогенеза в опухоли. Преимуществом данного подхода является то, что вещества-кандидаты уже обладают некоторыми свойствами, необходимыми для лекарств, а также высоким химическим разнообразием, необходимым для изучения корреляций активность-структура. Выделенные из природных источников лидерные вещества могут быть оптимизированы с помощью методов комбинаторной химии. В настоящее время во многих странах (США, Южная Америка, Китай и других) имеются программы, направленные на разработку противоопухолевых препаратов на основе веществ, полученных из природных источников.
Комплексный подход к изучению антиангиогенных свойств, основанный на механизмах действия ингибиторов, может иметь фундаментальное значение и определять создание новых терапевтических подходов на рациональной основе.
Цель работы
Разработать комплексную систему исследования антиангиогенной активности веществ и оценить способность различных экстрактов растений и их фракций блокировать ангиогенез in vitro и in vivo.
Задачи исследования
- разработать систему анализа и критерии оценки антиангиогенных свойств веществ in vitro с использованием линии ЭК мыши SVEC-4-10;
- исследовать in vitro антиангиогенную активность различных экстрактов и фракций, выделенных из растений;
- исследовать in vivo антиангиогенную активность экстрактов и фракций, выделенных из растений;
- проанализировать взаимосвязь антиангиогенной активности веществ in vitro и in vivo.
Научная новизна
Разработан комплексный подход к определению антиангиогенных свойств веществ in vitro с использованием культуры ЭК мыши SVEC-4-10. На основании изучения антиангиогенных свойств известных ингибиторов ангиогенеза было показано, что данный подход может быть использован для характеристики антиангиогенных свойств различных экстрактов и их фракций, синтетических соединений и противоопухолевых препаратов.
В работе впервые изучены антиангиогенные свойства экстрактов растений и их фракций, перспективных для дальнейшего исследования с целью создания отечественного антиангиогенного противоопухолевого препарата. Были отобраны 4 экстракта (Лопуха обыкновенного, Валерианы лекарственной, Эвкоммии вязолистной и Пассифлоры инкартной), которые являются наиболее перспективными для дальнейшего исследования. Эти экстракты обладали цитотоксическим эффектом in vitro как в отношении опухолевых культур, так и ЭК. Впервые показано, что этилацетатная и н-бутанольная фракции сока листьев и корней лопуха обладают антиангиогенными свойствами in vitro и in vivo. Обнаружено, что фракции 2 (Хаменерин I) и 3 (Хаменерин II) Кипрея узколистого (Chamaenerion angustifolium) блокируют формирование СПС in vitro, а также ангиогенез в имплантате Матригеля in vivo.
Научно-практическое значение
Разработанные и стандартизированные методы оценки ангиогенеза in vitro и in vivo широко используются в Российском онкологическом научном центре им. Н.Н. Блохина РАМН для оценки антиангиогенных свойств экстрактов различных растений и их фракций, а также синтетических соединений. При исследовании известных ингибиторов ангиогенеза опухоли было показано, что разработанная система скрининга может быть использована для практического скрининга антиангиогенных веществ.
Отобраны н-бутанольные и этилацетатные фракции сока корней и листьев Лопуха обыкновенного, обладающих антиангиогенным действием для дальнейшего углубленного изучения в предклинических моделях опухолей. Нами показано, что эти фракции блокируют ангиогенез in vitro и in vivo, а также проявляют значительный цитотоксический эффект на различных опухолевых клетках. Данные фракции могут быть использованы в дальнейшем для создания нового оригинального отечественного антиангиогенного препарата.
Нами были отобраны две фракции гидрализируемых таннинов Кипрея узколистого (Хаменерин I и II), которые обладают антиангиогенными свойствами in vitro и in vivo и могут быть использованы для дальнейшей разработки противоопухолевых веществ, блокирующих ангиогенез.
Апробация работы
Апробация диссертационной работы состоялось 28 июля 2011г. на совместной конференции лаборатории медицинской биотехнологии, лаборатории фармакоцитокинетики, клеточного иммунитета, лаборатории фармакологии и токсикологии и отделения комбинированного лечения злокачественных образований НИИ экспериментальной диагностики и терапии опухолей РОНЦ им. Н.Н.Блохина РАМН.
Публикации
По материалам диссертации опубликовано 9 работ, в том числе 4 статьи и 5 тезисов.
Объем и структура диссертации
Диссертация состоит из введения, обзора литературы, описания материалов и методов, результатов собственных исследований и их обсуждения, заключения, выводов и списка литературы, включающего 141 источник, в том числе 5 отечественных. Диссертация изложена на 136 страницах машинописного текста, включает 22 таблицы и 40 рисунков.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Материалы
В рамках работы было протестировано 40 соединений. Из них 2 противоопухолевых препарата, 2 известных ингибитора ангиогенеза, 18 экстрактов растений и 18 отдельно выделенных фракций растений.
Противоопухолевые препараты и известные ингибиторы ангиогенеза
В качестве контрольных веществ в работе были использованы противоопухолевые препараты: Паклитаксел (Bristol-Myers Squibb), разведенный в кремафоре согласно инструкции, Проспидин (ФГУП "Микроген") и вещества, блокирующие ангиогенез: эндостатин (BioVision), и ресвератрол (Alexis Biochemicals).
Экстракты растений
В работе были использованы водно-спиртовые экстракты, предоставленные Всероссийским научно-исследовательским институтом лекарственных и ароматических растений (ВИЛАР). Экстракты были приготовлены из листьев и стеблей высушенных растений: Боярышника кровянокрасного (Crataegus sanquinea L.), Валерианы лекарственной (Valeriana officinalis L.), Лопуха обыкновенного (Arctium L.), Пиона узколистного (Paeonia teruifolia L.), Репешка опушенного (Agrimoniae heiba L.), Сабельника болотного (Comarum palustre L.), Ноготков лекарственных (Calendula officinalis L.), Эхинацеи пурпуровой (Echinacea purpurea L.), Подофилла щитовидного (Podophylum peltatum L.), Ректантеры душистой (Rectanthera fragrans L.), Заманихи высокой (Oplopanax Elatus L.), Эвкоммии вязолистной (Eucommia ulmoides L.), Пассифлоры инкарнатной (Passiflora incarnata L.), Женьшеня обыкновенного (Panax girseng L.), Будры плющевидной (Glechoma hederacea L.), Ореха грецкого (Juglans regia L.), Чистотела большого (Chelidonium majus L.) и Элеутерококка (Eleutherococcus L.).
Фракции, выделенные из растений
В работе были использованы соки и фракции (полисахаридная, водная, водная без полисахаридов, н-бутанольная, этилацеататная), выделенные из корней или листьев Лопуха обыкновенного (Arctium L.), предоставленные ВИЛАР.
В работе были использованы 4 фракции гидрализированных таннинов, выделенные из Кипрея узколистого (Chamaenerion angustifolium) и их смесь, полученные в НИИ ЭДиТО РОНЦ им. Н.Н.Блохина РАМН.
Клеточные линии
В работе была использована клеточная линия ЭК: SVEC4-10, полученная из регионарных лимфатических узлов мышей С3H/HeJ (H-2k), трансформированных большим антигеном вируса SV40 [O’Connel K., 1990]. Клеточная линия имеет функциональные характеристики нормальных микроваскулярных эндотелиальных клеток. SVEC.
Так же были использованы культуры опухолевых клеток человека: SK-BR-3 (рак молочной железы), SKOV-3 (рак яичников), А-431 (эпидермальный рак кожи), Mel Kor (метастатическая меланома), MelP (метастатическая меланома), Melur (меланома), Mel Il (метастатическая меланома) и Mel Cher (метастатическая меланома).
Методы исследований
Культивирование клеточных линий
Клетки культивировали в DMEM или RPMI-1640 содержащей 10% телячьей эмбриональной сыворотки, 2mM/мл глутамина, 0,1 мг/мл гентамицина, при t+37оС, в атмосфере 5% CO2. Клетки поддерживали в логарифмической фазе роста.
Метод оценки цитотоксического действия веществ
Клетки (6х104 клеток/мл) вносили в 96-луночный планшет в полной среде. Инкубацию с веществами проводили 24 часа, затем добавляли в каждую лунку по 10 мкл раствора МТТ в конечной концентрации 0,5 мг/мл. Клетки инкубировали еще 4 часа, затем среду отбирали и добавляли к клеткам 200 мкл ДМСО. Оптическую плотность раствора формазана определяли на анализаторе иммуноферментных реакций «Униплан» при 540 нм, используя ДМСО как нулевой контроль.
Для каждого препарата строили график зависимости «доза-эффект» и определяли ИК50.
Все остальные тесты (пролиферационный, миграционный и формирование СПС) проводили на нецитотоксических дозах препарата (90% живых клеток через 24 часа). Использование этого принципа позволяет избежать ложноположительного результата, когда, например, эффект блокирования миграции на 60% от контроля связан с гибелью ЭК в течение 24 часов.
Метод оценки эффективности блокирования пролиферации
Клетки (15х103 клеток/мл) вносили в 96-луночный планшет в полной среде, содержащей дополнительно 20 нг/мл bFGF. Клетки инкубировали с вещствами в течение 72 часов, затем добавляли в каждую лунку по 10 мкл раствора МТТ в конечной концентрации 0,5 мг/мл.
Индекс пролиферации определяли по аналогичной для цитотоксического действия формуле.
Метод оценки блокирования миграционной способности клеток по методу «заживления раны»
Клетки SVEC-4-10 (3х105 клеток/мл) вносили в лунки 24-луночного планшета в полной среде ДMEM и инкубировали до образования монослоя. Затем монослой нарушали путем соскабливания части клеток. В течение 24 часов клетки инкубировали в полной среде с добавлением различных нецитотоксических доз веществ. В качестве положительного контроля использовали клетки в бессывороточной среде ДМЕМ. Результаты оценивали как процент мигрирующих клеток в опыте по отношению к контролю (клетки в полной среде ДМЕМ).
Метод оценки блокирования формирования СПС
24-луночную плашку покрывали Матригелем (100 мкл/лунка, плотность 8.4 мг/мл, BD Bioscience) и инкубировали 20-30 минут до его полной полимеризации. Клетки SVEC-4-10 (5х105 клеток/мл) инкубировали в среде ДМЕМ с добавлением нецитотоксических доз препарата в течение 30 минут при t+37оС.Затем клетки переносили в лунки, покрытые Матригелем, и инкубировали от 4-6 до 20 часов. В качестве положительного контроля использовали клетки, инкубировавшиеся в среде ДМЕМ без добавления препарата. Оценивали длину трубочек и количество контактов между трубочками.
Имплантат Матригеля
Метод имплантата Матригеля был выполнен согласно процедурам описанным ранее [Passaniti A., 1992]. Аликвоты (700 мл) Матригеля (BD Biosciences), содержащие гепарин 60 У.Е./мл, VEGF (100 или 50 нг/мл, BD Biosciences) или VEGF165 (100 или 50 нг/мл) были приготовлены на льду. В качестве отрицательного контроля использовали введение Матригеля, содержащего гепарин 60 У.Е./мл. Инъекцию Матригеля вводили подкожно, мышам-самкам F1(57Bl/6*DBA/2). После инъекции Матригель быстро образовывал одиночный, твердый гелеобразный имплантат.
Через 7 дней после введения Матригеля мыши были усыплены медицинским эфиром для удаления имплантата. Имплантаты были фиксированы в 10% нейтральном формалине и заключены в парафин для дальнейшего гистологического исследования.
Гистологическое исследование проводилось при окрашивании срезов имплантата гематоксилином и эозином.
Статистический анализ
Статистический анализ проводили с использованием программ “BIOSTAT” (Version 3.2). Достоверность различий оценивали по критерию Стьюдента. Различия считали статистически достоверными при p<0,05 (Гланц С.А., 1998).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Фенотипическая и функциональная характеристика культуры эндотелиальных клеток мыши SVEC-4-10 in vitro
Проведено иммуноцитохимическое фенотипирование клеточной линии ЭК мыши SVEC-4-10. Оценивали экспрессию маркеров, характерных для ЭК (CD31, CD34, VEGFR и другие).
Экспрессия CD31 определялась как в цитоплазме, так и на мембране ЭК. Очень слабая экспрессия CD34 наблюдалась только на отдельных клетках (менее 1%). Для культуры клеток характерна средняя цитоплазматическая экспрессия VEGF. Экспрессия VEGFR-1 (Flt-1) определялась с низкой интенсивностью на мембранах 5% клеток, тогда как цитоплазматическая и мембранная экспрессия VEGFR-2 (Flk-1) была характерна для 100% клеток. Отсутствовало окрашивание антителами к рецептору лимфатических клеток (VEGFR-3).
Полученные нами данные указывают на то, что клеточная линия SVEC-4-10 экспрессирует маркеры, характерные для микроваскулярных ЭК.
Показано, что VEGF и bFGF дозозависимо стимулируют пролиферацию ЭК SVEC-4-10 (Таблица 1). Добавление 10 нг/мл bFGF к клеткам увеличивало через 3 суток количество клеток по сравнению с контролем на 241%. Стимуляция пролиферации SVEC-4-10 VEGF менее значительна и составляла 130% при концентрации 10 нг/мл и 160% - при 50 нг/мл.
Таблица 1.
Стимуляция пролиферации ЭК SVEC-4-10
| Стимулятор | Количество клеток, % от контроля |
| bFGF 10 нг/мл | 241+36 |
| VEGF 10 нг/мл | 130+12 |
| VEGF 50 нг/мл | 160+27 |
Миграцию ЭК SVEC-4-10 оценивали методом «заживления раны» (Рисунок 1). Наблюдалась активация миграции ЭК в ответ на стимуляторы (сыворотка, bFGF или VEGF) по сравнению с контролем. 10% сыворотки увеличивало миграцию клеток SVEC-4-10 на 145%, добавление bFGF 50 нг/мл – на 139%, а VEGF165 100 нг/мл – на 122% по сравнению с отрицательным контролем. Различия в стимуляции миграции между сывороткой крупного рогатого скота, bFGF и VEGF не достоверны.

Рисунок 1. Миграция ЭК в модифицированном тесте на «заживление раны» по действием стимуляторов ангиогенеза.
Клетки были способны формировать СПС при инкубации на Матригеле. Добавление ростовых факторов (VEGF 50 нг/мл или bFGF 50 нг/мл) не влияло на длину сформированных трубочек и количество контактов между ними.
Таким образом, ростовые факторы человека стимулируют пролиферацию и миграцию клеток линии SVEC-4-10. Клетки способны формировать СПС без добавления ростовых факторов.
Изучены эффекты известных ингибиторов ангиогенеза на клетки линии SVEC-4-10 в функциональных тестах in vitro. Антиангиогенный эффект Эндостатина был изучен в диапазоне концентраций от 0.1 до 20 нМ. В указанном диапазоне концентраций пептид не обладал цитотоксическим эффектом. Пептид в концентрации 10 нМ ингибировал образование СПС в течение 24 часов.
Ресвератрол не показал цитотоксической активности на культуре клеток SVEC-4-10 в диапазоне концентраций, однако при 10-5 М блокировал миграцию клеток и формирование СПС (Рисунки 2 и 3).
Таким образом, полученные нами результаты подтвердили, что культура ЭК мыши SVEC-4-10 имеет фенотип, характерный для микроваскулярных клеток и может быть использована для изучения антиангиогенной активности соединений. Исследования известных ингибиторов ангиогенеза различных механизмов действия (эндостатин, ресвератрол) выявили активность, описанную при изучении на культурах ЭК человека.
A Б
Б 
Рисунок 2. Ингибирование миграции клеток SVEC4-10 в тесте на «заживление раны». А. Ресвератрол 10-5 М; Б. Положительный контроль.
А  Б
Б 
Рисунок 3. Ингибирование формирования СПС клетками SVEC4-10 А. Ресвератрол 10-5 М; Б. Положительный контроль.
Для разработки комплексной системы исследования антиангиогенной активности веществ была изучена активность двух противоопухолевых препаратов.
Мы показали, что Паклитаксел снижает выживаемость SVEC-4-10 in vitro. Кроме того, он в нецитотоксических концентрациях (10 и 5 мг/мл) блокировал формирование СПС.
Исследовано влияние препарата Проспидин на гибель, пролиферацию, миграцию ЭК SVEC-4-10 и формирование СПС в концентрациях 1-0,0001 мг/мл. Проспидин не оказывал цитотоксического действия на культуру ЭК SVEC-4-10 при концентрациях (1-0,0001 мг/мл). Выживаемость клеток после инкубирования с препаратом составляла 90-100% от клеток по сравнению с контролем, когда клетки инкубировались в чистой среде ДМЕМ. Проспидин блокировал пролиферацию bFGF-активированных ЭК в концентрациях 1-0,05 мг/мл (ИК50=0,5+0,12 мг/мл). При тестировании клеток с помощью метода «раневой поверхности» показано, что Проспидин блокирует миграцию ЭК в концентрации 1 мг/мл на 70%. При концентрации 0,1 мг/мл и меньше ширина миграционной поверхности была сравнима с контрольным образцом. Данные о влиянии препарата на миграцию представлены в таблице 2.
Таблица 2.
Влияние препарата Проспидин на миграцию ЭК SVEC-4-10
| Доза препарата | Ширина миграционной поверхности, % от контроля |
| 1 мг/мл | 32+10 |
| 0,5 мг/мл | 76+15 |
| 0,1 мг/ил | 95+12 |
| 0,05 мг/мл | 110+21 |
Проспидин частично блокирует образование сосудисто-подобных структур в концентрациях 0,5 и 0,1 мг/мл. Наблюдаемая сосудисто-подобная сеть является короткой и прерывистой («незакрытой»). При концентрациях препарата 0,05 мг/мл и 0,01 мг/мл не обнаружено существенных отличий от контрольных опытов. Образовавшиеся СПС высоко структурированы, ярко выражены и все клетки вовлечены в СПС.
Таким образом, фенотип культуры соответствует микроваскулярным ЭК. Клетки SVEC-4-10 отвечают на стимуляцию ангиогенными ростовыми факторами bFGF и VEGF. Известные ингибиторы ангиогенеза блокируют активность клеток по механизмам, описанным для ЭК человека HUVEC. Полученные нами результаты позволяют использовать культуру ЭК мыши SVEC-4-10 для изучения in vitro антиангиогенных свойств различных соединений.
Изучение антиангиогенной активности фракций растений in vitro и in vivo
Представлены данные исследований экстрактов и отдельных фракций различных растений на их способность ингибировать ангиогенез in vitro и in vivo.
Изучение антиангиогенных свойств экстрактов 18 растений
На первом этапе нами было проведено изучение влияния экстрактов на выживаемость культур опухолевых клеток (меланомы и рака молочной железы) и ЭК (SVEC-4-10) с использованием МТТ теста. Интерес представляли экстракты, показавшие высокую цитотоксическую активность на культуре ЭК по сравнению к опухолевым культурам клеток, что может свидетельствовать об их антиангиогенных и аваскулярных свойствах. Экстракты протестированы в не менее 3 разведениях (от 0,3% спирта до 0,03%). В качестве контроля служили клетки, инкубированные в среде, содержащей 0,3% спирта. Ни один из изученных экстрактов не показал цитотоксического эффекта при разведении экстрактов до содержания спирта 0,03%.
Мы показали, что спиртовые экстракты Боярышника кровянокрасного, Лопуха обыкновенного, Ноготка лекарственного, Эвкомии вязолистной обладали цитотоксическим действием (выживаемость клеток менее 50%) в отношении культуры клеток меланомы кожи человека Mel Kor при разведении экстракта до концентрации 0,3% спирта. Только Элеутерококк показал цитотоксичность (42+4% выживших клеток) при разведении экстракта до содержания спирта 0,15%.
Аналогичные результаты были получены для культуры опухолевых клеток меланомы Mel P. Цитотоксическое действие в концентрации 0,3% спирта показано для экстрактов Боярышника кровянокрасного (20%+2 выживших клеток), Валерьяны лекарственной (21+2%), Лопуха обыкновенного (37+4%), Пиона узколистного (39+3%), Подофилла щитовидного (38+3%), Эвкомии вязолистной (39+3%), Женьшеня обыкновенного (50+5%), Чистотела (50+5%) и Элеутерококка (28+2%). Только элеутерококк обладает цитотоксическим действием (47+4%) при разведении экстракта до 0,15% спирта. Ни один из изученных экстрактов не показал цитотоксического эффекта при разведении экстрактов до концентрации спирта 0,03%.
Клеточные линии метастатической меланомы Melur, Mel Il и Mel Cher показали более низкую чувствительность к изученным экстрактам.
На культуре клеток рака молочной железы MCF-7 изученные экстракты показали низкую цитотоксичность. Снижение выживаемости опухолевых клеток наблюдалось для 0,3% спиртовых экстрактов Лопуха обыкновенного (до 46+4%), Репешка опущенного (34+3%), и Элеутерококка (25+2%). Данные препараты обладали цитотоксическим действием (выживаемость клеток менее 50%). При концентрации спирта 0,15% только экстракт Элеутерококка показал выживаемость клеток менее 50% по сравнению с контролем.
Определенный интерес представляло изучение цитотоксического действия экстрактов на культуре ЭК мыши SVEC-4-10. Цитотоксическую активность показали спиртовые экстракты в концентрации спирта 0,3% Валерианы лекарственной (22+2%), Лопуха обыкновенного (наблюдалось снижение выживаемости до 43+4%), Пиона узколистного (49+4%), Эвкомии вязолистной (18+1%), Пассифлоры инкартной(49+4%) и Элеутерококка (36+3%). И только экстракты Валерьяны лекарственной и Лопуха обыкновенного обладали цитотоксическим действием при концентрации спирта 0,15%.
Для определения специфичности цитотоксического действия проведено сравнение выживаемости культур опухолевых и ЭК (Табл. 3). Статистически значимых различий в выживаемости опухолевых и ЭК (р>0,05) для всех изученных экстрактов не обнаружено. Из 18 изученных экстрактов только 4 (22,2%) обладали цитотоксическим действием на ЭК в концентрациях, сравнимых с концентрациями, вызывающими гибель некоторых культур опухолевых клеток, что может свидетельствовать о том, что экстракты этих растений потенциально могут обладать антиангиогенными свойствами.
При сравнении выживаемости клеток в зависимости от концентрации экстрактов отмечено, что 2 клеточные линии метастатической меланомы кожи имеют сравнимую со SVEC-4-10 цитотоксичность:
- Mel P – при инкубации с экстрактами Лопуха обыкновенного, Пиона узколистого, Валерианы лекарственной,
- Mel Kor – при инкубации с экстрактами Пассифлоры инкарнатной и Элеутерококка.
Наиболее низкую цитотоксичность по сравнению с культурой ЭК показали клеточные линии меланомы Melur и рака молочной железы MCF-7 для экстрактов Лопуха обыкновенного и Валерианы лекарственной и Пиона узколистого.
Таблица 3.
Цитотоксическое действие изученных экстрактов на культуры опухолевых и эндотелиальных клеток
| цитотоксическое действие экстрактов | Количество экстрактов, n (%) | Экстракты |
| Оказывают цитотоксическое действие на ЭК в концентрациях, сравнимых с ОК | 4 (22,2) | Лопух обыкновенный Валериана лекарственная Эвкоммия вязолистная Пассифлора инкартная |
| Оказывают цитотоксическое действие на ЭК в концентрациях, больших, чем для ОК | 2 (11,1) | Элеутерококк Пион узколистый |
| Имеют цитотоксическое действие на ОК, но не ЭК | 7 (38,9) | Боярышник кровянокрасный Ноготки лекарственные Подофилл щитовидный Чистотел большой Женшень обыкновенный Репешок опущенный Эхинацея пурпуровая |
| Не обладают цитотоксическим действием на ЭК и ОК | 5 (27,8) | Сабельник болотный Ректантера душистая Будра плющевидная Орех грецкий Заманиха высокая |
Для экстрактов изучена также способность ингибировать формирование СПС в нецитотоксических концентрациях (0,15-0,03% спирта). Блокирование формирования СПС наблюдалось только у 3 (16,7%) экстрактов растений: Репешка опущенного, Сабельника болотного и Эхинацеи пурпуровой, что может свидетельствовать о возможных антиангиогенных свойствах этих растений.
Контрольные клетки (при добавлении 0,15% спирта) образуют четко очерченную структурированную сеть, сохраняющуюся в течение 24 часов. Аналогичные СПС наблюдаются для остальных 15 экстрактов, которые не блокируют формирование трубочек. Для экстрактов Репешка опущенного, Сабельника болотного и Эхинацеи пурпуровой наблюдается формирование неполных, укороченных СПС с разрывами.
Таким образом, можно выделить 2 основные группы экстрактов растений: с цитотоксическим действием и со способностью блокировать СПС in vitro. Цитотоксическое действие на культуру ЭК оказали экстракты Лопуха обыкновенного, Валерианы лекарственной, Эвкоммии вязолистной, Пассифлоры инкартной, однако данные экстракты не ингибировали формирование СПС в экспериментах in vitro. Экстракты Репешка опущенного, Сабельника болотного и Эхинацеи пурпуровой не оказывали цитотоксического действия на ЭК, однако значительно блокировали формирование СПС.
Антиангиогенные свойства веществ, выделенных из Лопуха обыкновенного (Arctium L.).
Мы провели исследование антиангиогенного действия фракций, выделенных из сока Лопуха обыкновенного in vitro и in vivo, который обладает цитотоксическим действим на ЭК в концентрациях, сравнимых с ОК. Обобщенные результаты исследования in vitro антиангиогенных свойств веществ, выделенных из Лопуха обыкновенного, представлены в таблице 4.
Таблица 4.
Результаты тестов на культуре ЭК мыши SVEC-4-10
| № | Фракция | ИК50 24 часа | ИК50 72 часа | Блок миграции | Блок СПС |
| 1 | Водная | НД | НД | НД | 1 мг/мл |
| 2 2 | Водная без полисахаридов | НД | НД | НД | 1 мг/мл |
| 3 | Полисахаридная | НД | НД | НД | 1 мг/мл |
| 4 | Сок из корней лопуха (СКЛ) | 1% | 0,24% | НД | НД |
| 5 | Сок из листьев лопуха (СЛЛ) | 1,8% | 1,8% | НД | НД |
| 6 | СКЛ н- бутанольная | 0,4 мг/мл | 0,7 мг/мл | 0,1 мг/мл | 0,05 мг/мл |
| 7 | СЛЛ н- бутанольная | 0,05 мг/мл | 0,02 мг/мл | 0,001 мг/мл | 0,005 мг/мл |
| 8 | СКЛ этилацетатная | 0,52 мг/мл | 0,05 мг/мл | 0,005 мг/мл | 0,05-0,001 мг/мл |
| 9 9 | СЛЛ этилацетатная | 0,05 мг/мл | 0,01 мг/мл | 0,005 мг/мл | 0,005-0,001 мг/мл |
| 10 | Арктиин | 0,8 мг/мл | НД | НД | НД |
Сок корней Лопуха обыкновенного (СКЛ) индуцировал гибель клеток в диапазоне концентраций от 3% до 0,3% раствора спирта. Сравнительный анализ показал, что СКЛ вызывает гибель культуры ЭК SVEC4-10 при инкубировании в течение 24 и 72 часов при меньших концентрациях, чем исследованные опухолевые культуры клеток человека (Рисунок 4). Ингибирующая константа ИК50 составила 0,92% при инкубации с СКЛ в течение 24 часов, что примерно в 2,5-3 раза меньше чем для культур опухолевых клеток (ИК50 для линии А-431 составила 2,5%; для SKOV-3 – 3% и SK-BR-3 – 3,1% спирта) (р<0,05). При инкубации с СКЛ в течение 72 часов различия в константах ингибирования жизнеспособности ЭК относительно опухолевых составляли уже 4-10 раз. ИК50 для культуры SVEC4-10 составила 0,22%, для A-431 – 0,98%, для SKOV-3 – 1,18% и SK-BR-3 – 2,24% спирта (р<0,05).
Нами не обнаружено блокирование миграции ЭК SVEC-4-10 «в рану» и формирование СПС.
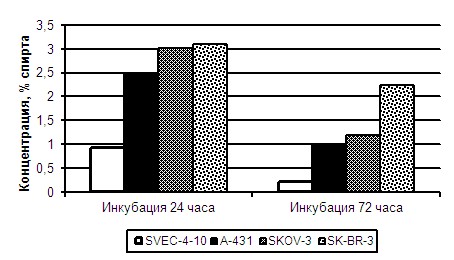
Рисунок 4. Специфическое действие СКЛ на культуры опухолевых (А431, SKOV-3, SK-BR-3) и эндотелиальных (SVEC4-10) клеток при инкубировании с препаратом в течение 24 и 72 часов.
При изучении сока листьев Лопуха обыкновенного (СЛЛ) не выявило статистически значимых отличий снижения выживаемости эндотелиальных от опухолевых клеток человека (Рисунок 5). ИК50 составила 1,8% спирта для SVEC4-10, 1,35% для А-431, 2,8 % для SKOV-3, 2,9% для линии SK-BR-3 при инкубировании с веществом 24 часа (р>0,1). Через 72 часа инкубировании ИК50 равнялась для SVEC4-10 1,84% спирта, A-431 0,79%, SKOV-3 1,9%, SK-BR-3 -1,39% (р>0,1).
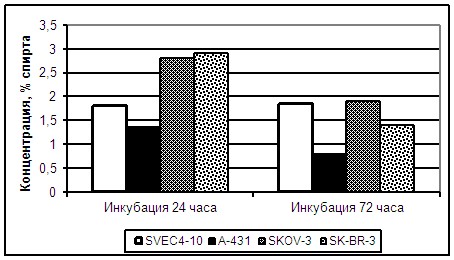
Рисунок 5. Специфическое действие СЛЛ на культуру клеток SVEC4-10 и опухолевые клетки при инкубировании с препаратом в течение 24 и 72 часов.
СЛЛ не ингибировал миграцию SVEC-4-10 и формирование СПС при инкубировании ЭК с СЛЛ в течение 24 часов.
Н-бутанольная фракция СКЛ блокировала жизнеспособность ЭК (SVEC4-10) при инкубировании в течение 24 или 72 часов в диапазоне концентраций 1-0,1мг/мл. ИК50 составила при концентрации 0,7 мг/мл для теста в течение 24 часов и 0,9 мг/мл в течение 72 часов. Сравнение результатов показало, что ИК50 SVEC4-10, А-431 и SKOV-3 в несколько раз выше ИК50 для культуры клеток SK-BR-3 (Рисунок 6). При инкубировании клеток в течение 24 часов или 72 часов достоверных различий в константах ингибирования жизнеспособности ЭК в сравнении с опухолевыми культурами клеток (A-431, SKOV-3 и SK-BR-3) не получено.

Рисунок 6. Специфическое действие н-бутанольной фракции СКЛ на культуру клеток SVEC4-10 и опухолевые клетки при инкубировании с препаратом в течение 24 и 72 часов.
Нами показано ингибирование миграции при концентрации н-бутанольной фракции СКЛ 0,1 мг/мл. Ингибирование миграции клеток «в рану» составило 62+12% при концентрации 0,1 мг/мл – 5+6% - при 0,05 мг/мл- 2±3% (р<0,05).
Кроме того, наблюдалось блокирование формирования СПС фракцией н-бутанольной фракцией СКЛ в концентрациях 0,1-0,05 мг/мл.
Сравнительный анализ показал, что н-бутанольная фракция СЛЛ вызывает гибель культуры ЭК SVEC4-10 и исследованных опухолевых культур клеток человека при инкубировании в течение 24 часов (Рисунок 7). Ингибирующая константа ИК50 составила 0,5мг/мл для SVEC-4-10 при инкубировании с н-бутанольной фракцией СЛЛ в течение 24 часов. Для опухолевых клеток ИК50 для линии А-431 составила 0,25мг/мл; для SKOV-3 и SK-BR-3 – 0,35мг/мл (р>0,05). При инкубировании с н-бутанольной фракцией СЛЛ в течение 72 часов константы ингибирования жизнеспособности ЭК по сравнению с культурой опухолевых клеток не отличались. ИК50 для культуры SVEC4-10 составила 0,49мг/мл, для A-431 – 0,47 мг/мл, для SKOV-3 – 0,8 мг/мл и SK-BR-3 – 0,5 мг/мл (р>0,05).
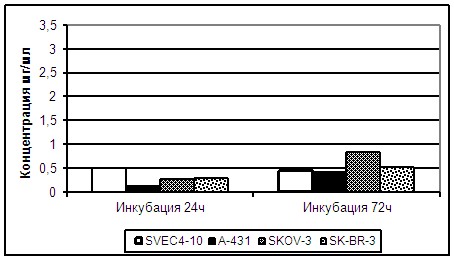
Рисунок 7. Специфическое действие н-бутанольной фракции СЛЛ на культуру клеток SVEC4-10 и опухолевые клетки при инкубировании с препаратом в течение 24 и 72 часов.
Н-бутанольная фракция СЛЛ также блокировала миграцию ЭК «в рану» в диапазоне концентраций 0,1-0,005 мг/мл. Наблюдалось ингибирование миграции на 96+14% при концентрации н-бутанольной фракции СЛЛ 0,05 мг/мл, на 78+6% - при 0,05 мг/мл и на 36+12% - при 0,01 мг/мл. Кроме того, наблюдалось блокирование формирования СПС н-бутанольной фракции СЛЛ в диапазоне концентраций 0,1-0,005.
Этилацетатная фракция СКЛ вызывает гибель культуры ЭК SVEC4-10 при инкубировании в течение 24 часов (ИК50 равна -0,5 мг/мл) и при 72 часов (0,25мг/мл) (р>0,05). При сравнении результатов не обнаружено достоверных различий в константах ингибирования жизнеспособности ЭК в сравнении с опухолевыми культурами клеток (A-431, SKOV-3 и SK-BR-3) при инкубировании в течение 24 часов и 72 часов (Рисунок 8).

Рисунок 8. Специфическое действие этилацетатной фракции СКЛ на культуру клеток SVEC4-10 и опухолевые клетки при инкубировании с препаратом в течение 24 и 72 часов.
Этилацетатная фракция СКЛ ингибировала миграционную активность при концентрациях 0,1-0,05 мг/мл до 82+11%, однако не оказывало влияния на способность ЭК формировать СПС.
Мы не обнаружили статистически значимых различий в кривых выживаемости клеток SVEC4-10 при инкубировании в течение 24 часов и 72 часов с этилацетатной фракцией СЛЛ (р>0,1).
Сравнительный анализ показал, что ИК50 SVEC4-10, А-431 и SKOV-3 и SK-BR-3 при инкубировании клеток в течение 24 часов и 72 часов с этилацетатной фракцией СЛЛ достоверных различий в константах ингибирования жизнеспособности ЭК в сравнении с опухолевыми культурами клеток (A-431, SKOV-3 и SK-BR-3) не выявлено (Рисунок 9).

Рисунок 9. Специфическое действие этилацетатной фракции СЛЛ на культуру клеток SVEC4-10 и опухолевые клетки при инкубировании с препаратом в течение 24 и 72 часов.
Следует отметить, что этилацетатная фракция СЛЛ, ингибировала миграционную активность ЭК SVEC-4-10 и их способность формировать СПС в диапазоне концентраций 0,1-0,01 мг/мл (Таблица 6).
Таблица 6.
Блокирование миграции клеток линии SVEC-4-10 «в рану»
| Концентрация этилацетатной фракции СКЛ, мг/мл | Блокирование миграции, % от контроля |
| 0,1 | 87+9 |
| 0,05 | 64+7 |
| 0,001 | 35+11 |
Арктиин является основным компонентом семян Лопуха обыкновенного. Сравнительный анализ показал, что Арктиин из семян Лопуха обыкновенного вызывает гибель культуры ЭК SVEC4-10 при инкубировании в течение 24 часов в концентрации (0,8мг/мл) и 72 часов при 1мг/мл. ИК50 для культуры SVEC 4-10 составила 0,22%, для A-431 – 0,98%, для SKOV-3 – 1,18% и SK-BR-3 – 2,24% спирта (р<0,05). Достоверных различий в константах ингибирования жизнеспособности ЭК в сравнении с опухолевыми культурами клеток (A-431, SKOV-3 и SK-BR-3) не обнаружено (Рисунок 10).
Кроме того, обнаружено отсутствие ингибирования миграции SVEC-4-10 и формирования СПС Арктиином в течение 24 часов.

Рисунок 10. Специфическое действие Арктиина из семян Лопуха обыкновенного на культуру клеток SVEC4-10 и опухолевые клетки при инкубировании их с препаратом в течение 24 и 72 часов.
Полисахарадная фракция, водная фракция без полисахаридов и водная фракция СКЛ не влияли на выживаемость ЭК и опухолевых клеток при инкубировании их с веществом в течение 24 часов. Все изученные три фракции СКЛ не блокировали миграцию и способность формировать СПС.
Таким образом, полученные нами результаты in vitro свидетельствуют о том что наибольшую антиангиогенную активность проявляли н-бутанольные и этилацетатные фракции СКЛ и СЛЛ. Эти фракции проявляли цитотоксическое действие на культуру ЭК, блокирование пролиферацию, а также снижали миграционную способность и блокировали формирование СПС.
Нами были проведены эксперименты на модели формирования кровеносных сосудов в имплантате Матригеля на мышах F1(C57Bl/6*DBA /2) для выявления антиангиогенного эффекта СКЛ, СЛЛ и их фракций на ангиогенез in vivo. Соки Лопуха обыкновенного и его фракции вводили внутрибрюшинно в различных дозах в объеме 100-150 мкл в 1, 3 и 5 дни после имплантации Матригеля
При введении Матригеля без стимуляторов ангиогенеза на гистологических срезах имплантата мы обнаружили только небольшое количество веретеновидных клеток и несколько сформированных кровеносных сосудов. Введение bFGF в Матригель значимо увеличивало миграцию клеток и формирование кровеносных сосудов в имплантате Матригеля. В Матригеле обнаруживались кровенаполненные сосуды, содержащие эритроциты. При концентрациях СКЛ (7,5 мл/кг) и СЛЛ (7,5 мл/кг) ангиогенез в импланте блокировался незначительно (60%). Однако при более низких концентрациях формирование кровенаполненных сосудов практически не наблюдалось.
Н-бутанольная фракция при концентрациях СКЛ (100 мг/мл) и СЛЛ (50 мг/мл) проявляла более выраженный антиангиогенный эффект и блокировала ангиогенез in vivo. При исследовании гистологических срезов, окрашенных гематоксилином и эозином, в Матригеле отсутствовали кровенаполненные сосуды и имелись только небольшое количество веретеновидных клеток. При снижении дозы фракций наблюдалось появление сосудов и отдельных клеток в имплантате.
Аналогичные результаты получены при изучении этилацетатной фракции СКЛ и СЛЛ.
Срезы имплантатов были также окрашены моноклональными антителами к маркеру эндотелиальных клеток CD31 и подсчитано количество положительных структур. Показано, что количество микрососудов в имплантате Матригеля снижалось с 18+3 (положительный контроль, 20 нг/мл bFGF) до 5+3 (н-бутанольная фракция СКЛ 100 мг/кг) и 4+2 (н-бутанольная фракция СЛЛ 50 мг/кг), р<0,05.
Суммируя результаты, полученные in vivo, можно отметить статистически значимое ингибирование образования CD31-положительных структур под действием н-бутанольной и этилациетатной фракции СКЛ (100 мг/мл) и СЛЛ (50 мг/мл) по сравнению с положительным контролем (р<0,05). При этом эффективная доза фракций, выделенных из СЛЛ, в два раза меньше по сравнению с аналогичными дозами СКЛ. Достоверных различий в ингибировании ангиогенеза для фракций СКЛ и СЛЛ (100 мг/мл, 50 мг/мл и 25 мг/мл, 5 мг/мл) не получено.
Таким образом, проведенные исследования подтвердили полученные in vitro результаты, что н-бутанольная и этилацетатная фракций СКЛ и СЛЛ ингибируют образование новых сосудов в имплантате Матригеля. Для СКЛ и СЛЛ эта способность выражена меньше.
Антиангиогенные свойства фракций гидрализуемых таннинов, выделенных из Кипрея узколистого (Chamaenerion angustifolium)
Показано, что фракции 2 (Хаменерин I) и 3 (Хаменерин II) не оказывают цитотоксического и антипролиферативного действия на клеточные линии SVEC-4-10, SK-BR-3 и SKOV-3 в концентрации 10-5-10-8 мг/мл.
Тест на ингибирование формирования СПС показал, что фракции 2 и 3 блокируют образование СПС в концентрации 10-5-10-6 мг/мл (Рисунок 11).

Рисунок 11. Ингибирование формирования СПС клетками SVEC4-10 А. контрольные клетки (положительный контроль); Б. Фракция 2 (Хаменерин I), 10 µг/мл; В. Фракция 3 (Хаменерин II), 10 µг/мл.
Фракции блокировали также миграционную активность клеток SVEC-4-10 примерно на 50% (Рисунок 12).
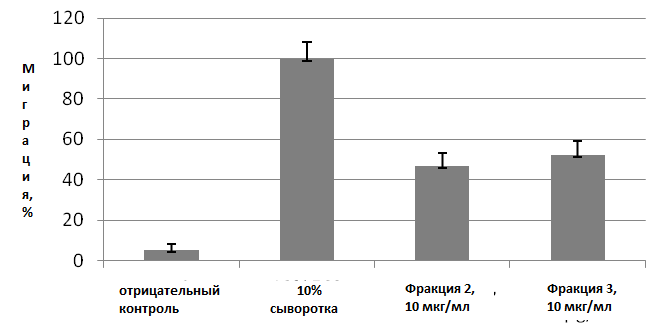
Рисунок 12. Миграция ЭК SVEC-4-10 в модифицированном тесте на «заживление раны» под действием фракций гидрализуемых таннинов, выделенных из Кипрея узколистого (Chamaenerion angustifolium).
Исследование in vivo также показало, что фракции 2 и 3 блокируют ангиогенез. Наблюдалось снижение количества микрососудов (до 6+2) в имплантате Матригеля при внутрибрюшинном введении фракций в дозе 15 мг/кг на 1 и 3 день после имплантации (р<0,05).
Для фракций 1 и 4 антиангиогенной активности in vitro выявлено не было.
Анализ взаимосвязи антиангиогенной активности веществ in vitro и in vivo
Проведен анализ корреляции антиангиогенной активности веществ in vitro и in vivo. Показано, что способность образцов ингибировать миграцию ЭК и способность формировать СПС более чем на 50% in vitro ассоциировано с блокированием ангиогенеза в имплантате Матригеля in vivo.
Разработан комплексный подход к определению антиангиогенных свойств веществ in vitro и in vivo с использованием культуры ЭК мыши SVEC-4-10:
1. проводится анализ цитотоксической активности веществ на культуре ЭК SVEC-4-10 в сравнении с активностью на культурах опухолевых клеток;
2. проводится анализ антипролиферативной, антимиграционной активности веществ и их способности блокировать формирование СПС на культуре ЭК SVEC-4-10;
3. антиангиогенная активность веществ, которые in vitro блокируют миграцию ЭК и/или способность формировать СПС более чем на 50%, должна быть подтверждена в экспериментах in vivo на имплантате Матригеля.
На основании изучения антиангиогенных свойств известных ингибиторов ангиогенеза, экстрактов растений и их фракций было показано, что данный подход может быть использован для характеристики антиангиогенных свойств различных образцов.
ВЫВОДЫ
1. Проведена фенотипическая и функциональная характеристика культуры ЭК мыши SVEC-4-10. Выявлено, что она имеет фенотип, характерный для микроваскулярных клеток, и может быть использована для изучения антиангиогенной активности соединений.
2. Выявлены 4 экстракта растений (Лопуха обыкновенного, Валерианы лекарственной, Эвкоммии вязолистной, Пассифлоры инкартной), обладающих цитотоксическим действием на ЭК в концентрациях, сравнимых с концентрациями, вызывающими гибель культур опухолевых клеток.
3. Впервые выявлены 3 экстракта растений (Репешка опущенного, Сабельника болотного и Эхинацеи пурпуровой), блокирующих миграцию клеток и формирование СПС культурой SVEC-4-10.
4. Показано, что н-бутанольная и этилацетатная фракции СКЛ и СЛЛ блокируют ангиогенную активность ЭК in vitro и in vivo.
5. Показано, что фракции гидрализуемых танинов, выделенные из Кипрея узколистого, Хаменерин I и Хаменерин II блокируют ангиогенную активность ЭК in vitro и in vivo.
6. Выявлено, что способность образцов ингибировать миграцию ЭК и способность формировать СПС более чем на 50% in vitro ассоциирована с блокированием ангиогенеза в имплантате Матригеля in vivo. Разработан комплексный подход определению антиангиогенных свойств веществ in vitro и in vivo с использованием культуры ЭК мыши SVEC-4-10.
СПИСОК РАБОТ ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Е.В. Степанова, Э.Ш. Соломко, А.Ю. Барышников. Оценка антиангиогенной активности противоопухолевых препаратов //Российский Биотерапевтический Журнал -2007. –Т.6. №1.- С.7.
2. Э.Ш. Соломко, Е.В. Степанова, М.Р. Личиницер, А.Ю. Барышников. Оценка антиангиогенной активности in vitro: опыт российского онкологического научного центра им. Н.Н.Блохина РАМН.//Российский Биотерапевтический журнал- 2007.-Т.6.№3 - С.3-7.
3. Е.В. Степанова, Э.Ш. Соломко, И.Н. Григорьева, А.Ю. Барышников Механизмы опухолевой васкуляризации in vitro. //Российский Биотерапевтический Журнал-2008.-Т.7. №1 -С.32.
4. Э.Ш. Соломко, Е.В. Степанова, И.Н. Григорьева, А.Ю. Барышников. Оценка антиангиогенной активности экстрактов растений и их фракций, произрастающих на территории России.// Российский Биотерапевтический журнал -2009.- Т. 8.№2 -С.56.
5. А.А. Кладиев, Е.В. Степанова, Э.Ш. Соломко, В.А. Кальцев, Б.Ф. Немцов, А.Ю. Барышников. Антиангиогенные свойства проспидина in vitro.//Российский Биотерапевтический Журнал -2009.-Т.8.№3-С.45-50.
6. И.Н. Григорьева, Э.Ш. Соломко, Е.В. Степанова, Т.К. Харатишвили. Ингибирование васкулогенной мимикрии – новый подход к противоопухолевой антиангиогенной терапии с использованием нанопрепаратов. //Российский Биотерапевтический журнал- 2010.-Т.9. №3-С.9.
7. Э.Ш. Соломко, Е.В. Степанова, М.Е. Абрамов, А.Ю. Барышников М.Р. Личиницер. Ингибиторы ангиогенеза растительного происхождения: перспективы использования в клинической онкологий. //Российский Биотерапевтический Журнал- 2010. - Т.9. №4-С.3-10.
8. Э.Ш. Соломко, М.Е. Абрамов, А.В. Киселев, А.Ю. Барышников, Е.В. Степанова. Цитотоксическая активность экстрактов растений на культурах клеток меланомы кожи. // Российский Биотерапевтический Журнал- 2012. - Т.10. №2 (в печати).
9. Э.Ш. Соломко, М.Е. Абрамов, А.Ю. Барышников, Е.В. Степанова. Цитотоксическая активность экстрактов растений на культурах клеток меланом. // Саркомы костей, мягких тканей и опухоли кожи - 2012. - №2 (в печати).

