Современные возможности и перспективы комбинированного лечения остеосаркомы (
На правах рукописи
Мачак Геннадий Николаевич
СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ И ПЕРСПЕКТИВЫ
КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ОСТЕОСАРКОМЫ
(14.00.14 - онкология)
А в т о р е ф е р а т
диссертации на соискание ученой степени
доктора медицинских наук
Москва 2007 год
Работа выполнена в отделе общей онкологии (руководитель – член-корр. РАМН, профессор М.Д. Алиев) ГУ РОНЦ им. Н.Н. Блохина РАМН (директор – академик РАН и РАМН, профессор М.И. Давыдов)
Научный консультант:
Член-корр. РАМН, профессор М.Д. Алиев
Официальные оппоненты:
член-корреспондент РАН, доктор медицинских наук, профессор М.Р. Личиницер
доктор медицинских наук, профессор А.Н. Махсон
доктор медицинских наук, профессор А.К. Морозов
Ведущее учреждение – Московский научно-исследовательский онкологический институт им. П.А. Герцена
Защита диссертации состоится «_____» «________________________» 2007 г. в _______ часов на заседании специализированного ученого совета Д.001.017.01 при ГУ РОНЦ им. Н.Н. Блохина РАМН (115478, Москва, Каширское шоссе, 24)
С диссертацией можно ознакомиться в библиотеке ГУ РОНЦ им. Н.Н. Блохина РАМН
Автореферат диссертации разослан «_____» «_____________________» 2007 г.
Ученый секретарь
специализированного совета
доктор медицинских наук Ю.В. Шишкин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Остеосаркома – одна из наиболее агрессивных злокачественных опухолей человека. Стандартом лечения этой опухоли является неоадъювантный подход, включающий индукционную химиотерапию, хирургическое удаление опухоли и адъювантную химиотерапию. Под руководством академика Н.Н. Трапезникова в середине 80-х годов прошлого столетия в отделении общей онкологии РОНЦ им. Н.Н.Блохина РАМН был утвержден первый в России неоадъювантный протокол, который включал предоперационную регионарную монохимиотерапию (доксорубицин или цисплатин) или химиотерапию метотрексатом в высоких дозах, удаление опухоли и адъювантную химиотерапию, адаптированную к степени лечебного патоморфоза (Трапезников и соавт. 1993). Результатом внедрения этой программы стало достоверное увеличение выживаемости по сравнению с историческим контролем. Однако наиболее ярко ее преимущества удалось продемонстрировать лишь в ограниченной группе пациентов, у которых отмечен выраженный гистологический ответ, и безрецидивная выживаемость прогнозировалась на уровне 87%. При слабо выраженном эффекте, что наблюдалось чаще, этот показатель составил лишь 37% (Синюков, 1993). Тем не менее, важным для того периода достижением стало расширение показаний к органосохраняющим вмешательствам, которые выполнялись примерно в 40% случаев.
В последующие годы возможности лекарственного лечения остеосаркомы расширились. Современная индукционная химиотерапия антрациклинами, производными платины, метотрексатом в высоких дозах и ифосфамидом, позволяет достичь выраженного гистологического ответа в 60-70% случаев и выполнения органосохраняющей операции у 80-90% больных (Алиев и соавт., 2005, Трапезников, 2001, Bacci, 2000, Bielak, 1999). При отсутствии ответа на первую линию химиотерапии прогноз хуже, чем при патоморфозе III-IV степени, однако за счет альтернативных схем удается повысить пятилетнюю выживаемость этих больных до 50-60%. В настоящее время показатель выживаемости при остеосаркоме в развитых странах западной Европы, США и Японии составляет 60-70% (Bacci et al., 2001, Bielack et al., 2002, Kudawara et al., 2004, Meyers, 2002). Достижение этих цифр в рамках первого неоадъювантного протокола не представлялось возможным. В связи с этим одной из актуальных задач была разработка и оценка эффективности режима комбинированного лечения, который приблизил бы результаты к современным мировым стандартам.
В последние годы прогресс в лечении остеосаркомы замедлился. Существующие комбинации и дозовые режимы достигли предела эффективности. Наряду с очевидными преимуществами, в первую очередь расширением показаний к органосохраняющим вмешательствам, обозначились ряд недостатков неоадъювантного подхода. В условиях, когда у 30-40% пациентов опухоль может оказаться химиорезистентной, предоперационная химиотерапия не улучшает условий для операции, может подвергнуть больных риску системного прогрессирования. В этой ситуации гистологическую оценку ответа нельзя считать своевременной. С другой стороны, больные, которые отвечают на химиотерапию, могут быть потенциальными кандидатами на ее продление с целью достижения более выраженного локального эффекта, позволяющего выполнить органосохраняющую операцию в минимальном объеме, а в случае метастатической остеосаркомы максимальной регрессии отдаленных метастазов. Очевидно, что назрела необходимость ранней оценки эффекта и риска за счет использования дотерапевтических факторов прогноза и/или характеристик, отражающих эволюцию заболевания на фоне индукционной химиотерапии. Отсутствие общепринятых критериев предсказывания локального ответа и выживаемости вынуждает специалистов использовать эмпирические подходы, основанные на популяционных данных, и как следствие назначать всем больным агрессивное, многокомпонентное и дорогостоящее лечение. Вместе с тем удовлетворительных результатов можно добиться, используя менее токсичные и более доступные режимы.
Таким образом, дальнейший прогресс в лечении остеосаркомы наряду с по-
иском новых патогенетически обоснованных подходов связан с усовершенствованием неоадъювантной стратегии, в частности разработкой и внедрением в практику индивидуализированных программ на дооперационном этапе.
Возможность предсказания непосредственных и отдаленных результатов изучалась с разных позиций. Серия работ, посвященная исследованию лекарственной устойчивости опухолевых клеток, не показала явной и однозначной корреляции между экспрессией П-гликопротеина, гистологическим ответом или исходом. Тесты in vitro, отражающие не связанные с этим белком механизмы устойчивости, оказались слабо специфичными, а корреляция с ответом в лучшем случае была удовлетворительной. Также изучалась прогностическая роль клинико-рентгенологических, морфологических и лабораторных критериев. Факторами высокого риска в момент установления диагноза считаются явные метастазы, аксиальная локализация, большие размеры опухоли и высокий уровень ЩФ в крови. В то же время стратификация остеосарком костей конечностей IIB стадии, а это основная часть популяции, остается трудной и нерешенной задачей. Редкость заболевания, использование разных терапевтических подходов, сложность формирования репрезентативных групп обследованных и леченных по стандартизованным программам, внутриопухолевая гетерогенность остеосарком – все эти факторы обусловили противоречивость полученных данных и как следствие отсутствие общепринятых критериев стратификации.
Малоизученным аспектом является оценка эффекта и риска прогрессирования на предоперационном этапе, особенно если предусмотрена длительная индукция. Это направление связано с исследованием качественных и количественных критериев ранней оценки ответа in vivo. Наряду с клиническими показателями для мониторинга эффективности лечения используются рентгенологические, ангиографические, сцинтиграфические критерии, ПЭТ, а также уровень ЩФ. Адаптация индукционной химиотерапии к ответу не нашла широкого применения, что связано с отсутствием стандартных подходов к оценке риска и недоста-
точной разработкой альтернативных тактических решений.
Эффективность местного контроля зависит от радикальности удаления опухоли и гистологического ответа. В этих условиях особую роль при планировании операции приобретает прогнозирование эффекта химиотерапии. С этой целью использовались ангиография, МРТ с контрастным усилением, сцинтиграфия с таллием-201 и ПЭТ, однако эти исследования проведены на небольших сериях больных. Их специфичность, за исключением МРТ, относительно невысока. Из-за того, что многие из указанных выше диагностических технологий внедрены лишь в последние годы проблема прогнозирования степени некроза опухоли in vivo и установки показаний к органосохраняющим вмешательствам изучена мало.
Наблюдения показывают, что у больных с выраженным патоморфозом, традиционно относящихся к группе благоприятного прогноза, нередко наступает прогрессирование. Повышение точности прогнозирования после удаления опухоли возможно, если учитывать стадию, объем опухоли, ЩФ, радикальность операции, а также клинический, рентгенологический, ангиографический, сцинтиграфический и биохимический ответы, однако эта область изучена недостаточно.
Цель и задачи исследования. Наряду с необходимостью разработки новых режимов, важной задачей является совершенствование неоадъювантной стратегии, в частности внедрение дифференцированных подходов на ранних этапах комбинированного лечения. Целью данного исследования было улучшение результатов лечения остеосаркомы благодаря внедрению современного протокола, а также усовершенствование методологии индивидуализированной терапии. Для ее достижения сформулированы следующие задачи.
- Разработка, оценка эффективности и токсичности современного протокола неоадъювантного лечения остеосаркомы.
- Создание моделей прогнозирования результатов лечения и разработка рекомендаций по дифференцированной терапии при установлении диагноза.
- Поиск критериев эффективности индукционной химиотерапии.
- Разработка моделей прогнозирования и обоснование индивидуализированных подходов на этапах неоадъювантной терапии остеосаркомы.
Научная новизна работы. Показаны возможности улучшения непосредственных и отдаленных результатов лечения остеосаркомы благодаря интенсификации индукционной химиотерапии, использования новых подходов в адъювантном лечении и более активной хирургической тактики при генерализованных формах опухоли. Установлены преимущества регионарного пути введения цисплатина в двухкомпонентных схемах индукционной химиотерапии.
Проведен анализ одного из наиболее крупных в мире клинических материалов одного учреждения, с использованием современных методов статистической обработки данных. На высоком уровне доказательности разработаны критерии оценки риска на всех этапах неоадъювантного лечения. Изучена прогностическая роль ряда характеристик опухоли, оцененных с помощью таких современных диагностических технологий как КТ, МРТ, цифровая ангиография, планарная и динамическая сцинтиграфия, ДНК – проточная цитофлюорометрия. На основании многофакторного анализа разработаны модели прогнозирования непосредственных и отдаленных результатов до начала терапии. Определены клинико-инструментальные и лабораторные критерии эффективности индукционной химиотерапии. Разработана методика формирования групп на дооперационном этапе. Разработана модель прогнозирования гистологического ответа после окончания индукционной химиотерапии. Для более точного прогнозирования риска после локального лечения предложено включение в прогностические модели кроме основного критерия – гистологического ответа, признаков, отражающих течение заболевания на этапе индукционной химиотерапии.
Практическое значение полученных результатов. Новый неоадъювантный протокол улучшил непосредственные и отдаленные результаты лечения остеосаркомы и приблизил их к современным стандартам. Его строгое соблюдение позволяет достичь общей пятилетней выживаемости на уровне 80%, а безрецидивной – 50%. Органосохраняющие операции выполнимы более чем у 90% больных. Данный протокол может рассматриваться в качестве стандарта лечения остеосаркомы в России.
Прогнозирование на дотерапевтическом этапе позволит выделить больных со стандартным риском, которые могут успешно лечиться согласно протоколам средней степени интенсивности, а также пациентов с высоким и крайне высоким риском, нуждающихся изначально в более интенсивной химиотерапии. Оценка эффекта на промежуточном этапе индукции позволит выделить опухоли устойчивые к первой линии химиотерапии, при которых целесообразны переход на более интенсивные режимы или раннее удаление опухоли с последующей химиотерапией второй линии. Прогнозирование эффекта после окончания стандартной индукции позволит выделить пациентов с высокочувствительными опухолями, которым показано ее продление с целью достижения максимального местного эффекта и улучшения условий для органосохраняющего лечения. Предсказание гистологического ответа до операции позволит более четко оценить риск местного рецидивирования после органосохраняющих вмешательств. Повышение точности оценки риска за счет добавления к морфологическим критериям параметров, отражающих объективный ответ опухоли на фоне предоперационного лечения, позволит принимать более обоснованные терапевтические решения при планировании адъювантной химиотерапии.
Полученные результаты открывают перспективы углубленного анализа индивидуализированных подходов к лечению остеосаркомы, их внедрения в практическую медицину, выявления преимуществ или недостатков по сравнению с эмпирической химиотерапией.
Материалы и методы исследования. В компьютерную базу данных включены сведения о 593 больных с гистологически доказанной остеосаркомой, которые находились на лечении в РОНЦ им. Н.Н.Блохина РАМН с 1979 по 2006 гг. Демографические данные соответствовали популяционным. Преобладали пациенты мужского пола, которых было 366, а лиц женского пола – 227. Средний возраст составил 19,5 лет. У большинства пациентов опухоль располагалась в костях, формирующих коленный сустав (77%).
Степень местной распространенности определяли с помощью стандартной рентгенографии, КТ, МРТ и сцинтиграфии. Для уточнения стадии использовали рентгенографию или КТ органов грудной клетки и сцинтиграфию скелета.
Объем опухоли выражали в кубических сантиметрах и рассчитывали по стандартной методике как произведение трех максимальных размеров, определяемых на рентгенограммах, КТ, МРТ или ангиограммах, умноженных на коэффициент 0,52 для образований сферической и неправильной формы и 0,78 – для цилиндрических опухолей.
Качественная оценка васкуляризации проводилась по данным стандартной или цифровой субтракционной артериографии на установке SIEMENS Multistar T.O.P. Учитывались архитектоника сосудов в артериальной фазе, состояние артерий, питающих опухоль, и характер контрастирования в капиллярной фазе.
Активность ЩФ в сыворотке периферической крови определяли с помощью оптимизированного спектрофотометрического метода на автоматическом анализаторе HITACHI-911 (Япония). Ее выражали в виде процента по отношению к норме, рассчитанной для соответствующего пола и возраста (Wallach, 1986).
В исследовании использованы два радиоизотопных метода: планарная и динамическая сцинтиграфия (Рыжков, 1997, Gandsman и McCullough, 1990). Радиофармпрепаратом служил комплекс 99mTc – метилендифосфонат. Исследования проводились на двухдетекторных гамма-камерах SIEMENS ZLC-75 и E.CAM.
Для оценка показателей пролиферативной активности клеток использовали лазерную ДНК-проточную цитофлюорометрию. Распределение клеток в фазах клеточного цикла оценивали с помощью компьютерных программ Cell Fitt (Becton Dickinson, США), WinList и Multicycle (Phoenix Flow Systems, США).
С 1979 г. в РОНЦ им. Блохина РАМН последовательно утверждены три протокола. С 1979 по 1983 гг. предоперационное лечение включало 72-часовую внутриартериальную инфузию доксорубицина 90 мг/м2. Далее проводилась локальная лучевая терапия СОД 36-40 Гр. Следующим этапом было хирургическое удаление опухоли. После операции были предусмотрены 6 курсов адъювантной химиотерапии по схеме САР (циклофосфан 400-600 мг/м2, доксорубицин 50-60 мг/м2 и цисплатин 100-120 мг/м2 внутривенно в течение одного дня) или доксорубицином 30 мг/м2 в 1-3 дни. В работе протокол условно назван химиолучевым.
С 1985 по 1998 гг. больные получали лечение согласно первому отечественному неоадъювантному протоколу (НЕО-1). В предоперационном периоде проводились курсы регионарной (внутриартериальной) монохимиотерапии доксорубицином 90 мг/м2 в течение 72 часов или цисплатином 120 мг/м2 в течение 4-х часов на фоне гипергидратации и форсированного маннитолового диуреза. Количество курсов варьировало и зависело от ответа на лечение. Интервал между циклами химиотерапии составлял один месяц. Небольшая группа из 6 пациентов получила 4 введения метотрексата в дозе 8 г/м2. После индукции следовало локальное лечение, чаще хирургическое. В ряде случаев, когда пациенты отказывались от операции, проводилось облучение по радикальной программе в дозах 45-60 Гр (Machak et al., 2003). Адъювантная химиотерапия адаптировалась к гистологическому ответу. При патоморфозе III-IV степени химиотерапия содержала препараты первой линии. В случае слабо выраженного гистологического ответа использовались схемы, включающие ранее не вводимые цитостатики.
С 1999 г. по настоящее время утвержден неоадъювантный протокол (НЕО-2), согласно которому до операции проводятся 4 ежемесячных курса химиотерапии по схеме: доксорубицин 90 мг/м2 в виде 96-часовой инфузии в одну из центральных вен, цисплатин 120 мг/м2 на 5-й день курса в виде 4-часовой внутриартериальной или 2-часовой внутривенной инфузии на фоне гипергидратации и форсированного диуреза. После индукционной химиотерапии опухоль удалялась хирургически или, в случае отказа от операции, применялась лучевая терапия в дозе 60 Гр. После операции проводились 6 ежемесячных курсов адъювантной химиотерапии. У больных со слабо выраженным ответом использованы два подхода. Первый заключался в переходе на альтернативную комбинацию этопозид 100 мг/м2 + ифосфамид 1.5 г/м2 в 1-5 дни, а второй – в чередовании комбинации доксорубицин – цисплатин с режимом этопозид – ифосфамид. При достижении выраженного гистологического часть больных продолжала получать препараты первой линии, а другой части назначались чередующиеся курсы доксорубицин – цисплатин и этопозид – ифосфамид. В предоперационном периоде кумулятивная доза доксорубицина составляла 360 мг/м2, а после локального лечения – 190 мг/м2, которые делились на 5-6 введений в группе продолжающей лечение препаратами первой линии или на 3 введения – в группе, получающей альтернирующие курсы. Цисплатин в послеоперационном периоде вводился из расчета 100 мг/м2. Его кумулятивная доза на этапе индукции составила 480 мг/м2, а после локального лечения она доходила до 1080 мг/м2 (6 курсов доксорубицин - цисплатин) или 780 мг/м2 (3 курса доксорубицин – цисплатин).
Методы мониторинга химиотерапии представлены в таблице 1.
Таблица 1.
Алгоритм обследования в процессе индукционной химиотерапии.
| Метод | До лечения | После двух курсов | Перед операцией |
| Клиническое обследование | + | + | + |
| КТ органов грудной клетки | + | +* | |
| Рентгенография органов грудной клетки | + | + | |
| Стандартная рентгенография опухоли | + | + | + |
| КТ и МРТ опухоли | + | + | |
| Ангиография | + | + | + |
| Сцинтиграфия | + | + | + |
| Уровень ЩФ | + | + | + |
| * - при метастазах в легких | |||
Гистологический ответ в опухоли классифицировали по Huvos 1993 г.
Оценка радикальности хирургического лечения. Радикальность удаления опухоли устанавливалась согласно классификации Enneking 1980. Адекватными с онкологических позиций считались те операции, при которых достигался радикальный или широкий край резекции. Нерадикальными считались краевые и чрезопухолевые резекции. Сведения о степени радикальности операции получали из протоколов операции, описания макропрепарата (целостность псевдокапсулы, толщина слоя, покрывающего опухоль), по результатам морфологического изучения содержимого костно-мозгового канала по линии резекции, сопоставления пред и послеоперационных рентгенограмм.
Критериями оценки отдаленных результатов были: общая выживаемость – интервал от даты начала лечения до даты смерти от остеосаркомы или даты последнего обследования больного и безрецидивная выживаемость – интервал от даты локального лечения до даты выявления отдаленных метастазов и/или местного рецидива или даты последнего обследования больного.
Комплексное обследование в РОНЦ им. Н.Н. Блохина РАМН проводилось ежемесячно в течение первых 6 мес. после локального лечения, каждые 3 мес. в течение 7-24 мес., и каждые 6 мес. в дальнейшем. Оно включало стандартную рентгенографию зоны поражения и органов грудной клетки, определение ЩФ в крови, динамическую и планарную сцинтиграфию (при консервативном лечении).
Методы статистического анализа. Для решения статистических задач использованы программы STATISTICA (версия 5.0, Statsoft Inc. США) и SPSS (версия 10.0, SPSS Inc.). Поиск стратификационных границ осуществляли с помощью оптимизирующего алгоритма BASSEL (Kuznetsov et al., 1996). При сравнении частот в группах, сформированных с учетом дискретных признаков (категории) использовали критерий 2. Выживаемость рассчитывали по методу Kaplan-Meier, а достоверность различий кривых оценивали посредством log rank теста.
Многофакторный анализ. Задачи индивидуального прогнозирования с бинарным откликом решались с помощью логистического регрессионного анализа. Для оценки влияния различных факторов на выживаемость использован регрессионный анализ по Коксу
Группы риска прогрессирования и смерти от основного заболевания форми-
ровали согласно следующей классификации: стандартный – прогнозируемая общая пятилетняя выживаемость >70%, безрецидивная – >60%; высокий – общая выживаемость 50–70%, безрецидивная 40–60%; крайне высокий – общая выживаемость <50%, безрецидивная – <40%. При оценке риска возникновения местного рецидива после операции использована следующая классификация: стандартный – прогнозируемая пятилетняя выживаемость без местного рецидива 90-100%; высокий – 70-89%; крайне высокий – менее 70%.
Апробация диссертации. Основные положения и выводы диссертационной работы были доложены на совместной конференции с участием отдела общей онкологии, отделения химиотерапии и комбинированного лечения злокачественных опухолей, отделения химиотерапии, отделения клинической фармакологии и химиотерапии, отдела лучевой диагностики и рентгенохирургических методов лечения, отдела патологической анатомии опухолей человека, лаборатории клинической биохимии НИИ КО РОНЦ им. Н.Н. Блохина РАМН.
Внедрение результатов работы.
Результаты внедрены в отделении опухолей опорно-двигательного аппарата НИИ ДОиГ РОНЦ им. Н.Н. Блохина РАМН.
Объем и структура диссертации. Диссертация изложена на 271 странице машинописного текста и состоит из введения, 6 глав, заключения и выводов. Библиографический указатель содержит 18 отечественных и 309 иностранных источников. Работа иллюстрирована 64 таблицами и 71 рисунком.
Основные положения, выносимые на защиту.
За счет внедрения нового режима индукционной химиотерапии, новым под-
ходам к адъювантной химиотерапии, повышения хирургической активности при лечении генерализованных форма улучшены непосредственные и отдаленные результаты лечения больных остеосаркомой. Однофакторный и многофакторный анализ позволил разработать модели предсказания эффекта химиотерапии, локального контроля и риска на всех этапах лечения, что повышает существующие возможности прогнозирования, основанные на оценке риска с учетом гистологического ответа. Разработанная система оценки риска создает реальные предпосылки для внедрения дифференцированных подходов в ставшую стандартной неоадъювантную стратегию и сравнения риск - адаптированной химиотерапии с эмпирической.
Содержание диссертации
С целью улучшения результатов лечения остеосаркомы в клинике общей онкологии РОНЦ им. Н.Н. Блохина РАМН разработан и внедрен новый протокол, НЕО-2, который, с одной стороны предполагал более интенсивное предоперационное лечение, а с другой – использование новых схем и подходов к адъювантной химиотерапии. Лечение согласно этому протоколу было начато 101 пациенту, у 82% из них была IIB стадия. У 5 пациентов была аксиальная локализация, а у остальных – остеосаркомы конечностей.
Большинство пациентов (95%) получили 4 курса индукционной химиотерапии. Локальное лечение проведено 95 больным. Двое больных умерли от осложнений на этапе индукции, а 4 – отказались от операции и дальнейшего лечения. Адъювантную химиотерапию в полном объеме (4-6 курсов) получил 81% больных (77/95), а остальные – неполную (0-3 курсов).
Токсичность режима индукции была следующей. Частота лейкопений и гра-
нулоцитопений III-IV степени составила 24%, лихорадки > 380 – 20%, фебрильных нейтропений – 13%, тромбоцитопений III степени – 7%, IV степени – 3%. Кровотечений, требующих переливания крови, не наблюдалось. Выраженная анемия с уровнем гемоглобина менее 10 г/л развилась в 5% случаев. Гепатотоксичность режима была низкой. Билирубинемия и повышение уровня трансаминаз отмечено менее чем в 2% случаев. Наиболее частым видом токсичности была гастроэнтерологическая. Тошнота и преходящая рвота отмечены в 93% случаев. Явления умеренно выраженного стоматита с зудом, жжением или эритемой выявлены в 17% случаев, изъязвление без затруднения приема пищи – в 7%, изъязвление, требующее приема только жидкой пищи – в 3%, и невозможность приема любой пищи – в 1% случаев. В 9% случаев наблюдалась диарея продолжительностью до 2 дней и переносимая сроком более 2 дней.
Явления кардиотоксичности в виде диффузных метаболических изменений на ЭКГ, не проявляющихся клинически, наблюдались у 8% больных. Нарушение функции почек (протеинурия/гематурия) отмечено у 5% пациентов. Другие виды токсичности распределились следующим образом: полная, но обратимая аллопеция – 98%, периферические нейропатии – 4%, ототоксичность – 14%.
Наиболее грозным осложнением была фебрильная нейтропения. В первые годы использования протокола от таких осложнений умерли 3 больных. В последнее время за счет усовершенствования сопроводительной терапии удалось исключить летальность, связанную с химиотерапией. Лечение фебрильной нейтропении заключалось в использовании антибиотиков широкого спектра действия, противогрибковой терапии, переливании компонентов крови (тромбоконцентрат, эритроцитарная масса), колониестимулирующих факторов.
Переносимость адъювантной химиотерапии была хорошей. Нами не отмечено случаев выраженной гематологической и органной токсичности.
Непосредственный эффект оценен у 82 больных. Выраженный патоморфоз отмечен у 66%, а полный некроз опухоли – у 16% больных. При сравнении с протоколом НЕО-1 различия были достоверными: р<0,00001 и р=0,028 соответственно. Таким образом, локальный эффект комбинации доксорубицин - цисплатин по более выражен сравнению с регионарной монохимиотерапией НЕО-1.
Одной из задач было сравнение результатов с учетом пути введения цисплатина. Демографические и клинические параметры в сравниваемых группах были сбалансированными. При артериальном введении цисплатина патоморфоз III-IV
степени встречался более чем в 1,5, а полный некроз в 3 раза чаще (табл. 2).
Таблица 2.
Результаты лечения больных остеосаркомой конечностей, получавших предоперационную химиотерапию согласно протоколу НЕО-2.
| Показатель | Путь введения цисплатина | р | |
| Артериальный n=43 | Внутривенный n=39 | ||
| Патоморфоз III-IV степени * | 35 (81%) | 19 (49%) | 0,002 |
| Патоморфоз IV степени | 10 (23%) | 3 (8%) | 0,05 |
| Органосохраняющие операции | 37/39 (95%) | 33/38 (87%) | 0,2 |
| Частота местных рецидивов** | 2/22 (9%) | 4/15 (27%) | 0,15 |
| Рецидивы после сохранных операций* | 1/16 (6%) | 3/9 (33%) | 0,076 |
| * включены данные секции или отсроченных операций; ** медиана наблюдения не менее года | |||
Хотя в обеих группах органосохраняющие вмешательства выполнялись с одинаковой частотой (>85%), локальный контроль зависел от вида химиотерапии. При системном лечении риск рецидивирования был в 3, а после органосохраняющих операций в 5,5 раз выше, чем при регионарной химиотерапии. Общая и безрецидивная пятилетняя выживаемость при IIB стадии составила 70±11% и 48±12% соответственно, а при регионарной химиотерапии эти показатели были 56±11% и 44±11% соответственно, р>0,05. Таким образом, в комбинации с доксорубицином внутриартериальное введение цисплатина приводит к более выраженному локальному эффекту, снижает риск рецидивирования и вероятность повторных, в том числе калечащих операций.
Хирургический метод был основным в локальном лечении. При опухолях конечностей в 80% случаев (77/96) выполнены операции, 13 больным (15%) проведено консервативное химиолучевое лечение, 2 больных умерли на этапе индукции. При аксиальных остеосаркомах (5 больных) применялась лучевая терапия. В 4 случаях локального лечения не проводилось. Органосохраняющие операции выполнены в 91% случаев, что более чем в 2 раза чаще, чем в предыдущем протоколе. При местно-распространенных опухолях (объем >300 см3) частота сохранных операций возросла с 35% (42/121) до 76% (25/33) – р<0,00001. При пороговом значении 500 см3, тенденция сохранилась (р=0,002). Эти данные демонстрируют расширение показаний к органосохраняющим вмешательствам, во многом обусловленное возросшей эффективностью индукционной химиотерапии.
Общая пятилетняя выживаемость составила 48±9%, а безрецидивная – 45±8%. При локализованной форме общая выживаемость составила 59±9%, а при IIIB стадии, больных, переживших пятилетний срок к моменту проведения анализа, не было (рис.1).
Рис. 1. Общая выживаемость при лечении согласно протоколу НЕО-2 с учетом стадии: непрерывная линия – IIB стадия (n=79); прерывистая линия – IIIB стадия (n=17), р=0,007.
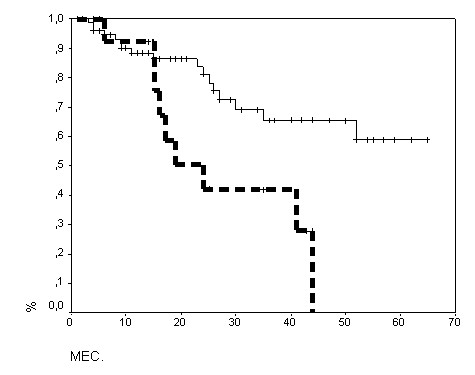
Общая выживаемость при IIB стадии была достоверно выше, чем в предыдущем протоколе (рис. 2). При генерализованной остеосаркоме прогноз существенно не изменился. Несмотря на возросшую медиану выживаемости (с 19 до 24 мес.), различия были недостоверными.
Гистологический ответ продолжал оставаться фактором прогноза (рис. 3). В то же время медиана общей и безрецидивной выживаемости при слабо выраженном эффекте возросла с 23 до 30 мес. и с 9 до 14 мес. соответственно.
Количество курсов адъювантной химиотерапии влияло на прогноз (рис. 4). При проведении всех предусмотренных курсов даже при отсутствии выраженного патоморфоза общая пятилетняя выживаемость может прогнозироваться на уровне 68±14%, а безрецидивная – 29±12%. Пятилетняя выживаемость данного контингента увеличилась на 27%, а безрецидивная – на 10%. Отмечена тенденция к
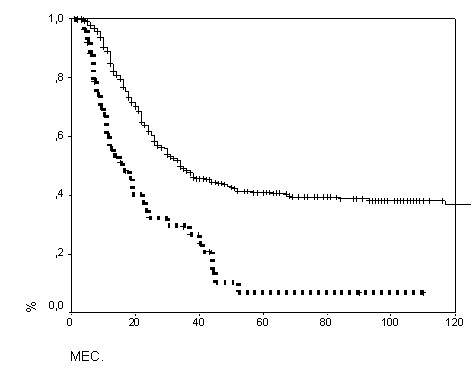
Рис. 2. Общая выживаемость с учетом протокола при IIB стадии.
непрерывная линия – НЕО-1 (n=155),
прерывистая – НЕО-2 (n=82), р=0,02.



Рис. 3. Общая (слева) и безрецидивная (справа) выживаемость с учетом патоморфоза (протокол НЕО-2): непрерывная линия – слабо выраженный ответ (n=36); прерывистая – выраженный ответ (n=65), р=0,02, р=0,006 соответственно.
Рис. 4. Общая выживаемость с учетом количества курсов адъювантной химиотерапии: непрерывная линия – 0-3-х курсов (n=18); прерывистая – 4-6 курсов (n=61), р=0,0009

улучшению прогноза больных, не ответивших на химиотерапию доксорубицином и цисплатином, которым адъювантно вводились ифосфамид и этопозид. При выраженном патоморфозе отказ от химиотерапии или сокращение ее длительности ухудшали прогноз (рис. 5).
Рис. 5. Безрецидивная выживаемость с учетом количества курсов адъювантной химиотерапии при выраженном патоморфозе: непрерывная линия – от 0 до 3 курсов (n=9); прерывистая – 4-6 курсов (n=32), p=0,002

При патоморфозе 0-II степени вид адъювантной химиотерапии (элиминационный или альтернирующий) не влиял на прогноз. Большую роль это играло при выраженном патоморфозе – традиционно благоприятном факторе прогноза. Продолжение химиотерапии препаратами первой линии ассоциировалось с худшей выживаемостью, нежели чередование комбинаций доксорубицин – цисплатин и этопозид – ифосфамид (рис. 6).
Рис. 6 Общая выживаемость с учетом вида адъювантной химиотерапии при выраженном патоморфозе:
непрерывная линия – адаптированная к ответу (n=29);
прерывистая – не адаптированная к ответу (n=21), р=0,05

С другой стороны, все больные, получившие химиотерапию не адаптированную к патоморфозу, к моменту проведения анализа были живы, двое из них с метастазами и один – с местным рецидивом.
Обобщая эти данные, мы пришли к выводу, что выраженный гистологический ответ не исключает риска прогрессирования и не должен быть поводом для
снижения интенсивности или длительности адъювантной химиотерапии.
Частота объективных ответов со стороны измеряемых очагов при IIIB стадии составила 61%. У 7 больных отмечен частичный эффект в виде значительного уменьшения размеров и количества метастазов в легких или снижения накопления РФП в костных метастазах. У 4 больных по данным КТ отмечено исчезновение легочных метастазов. В остальных 7 случаях положительной динамики не отмечено или имело место прогрессирование заболевания.
В случае отсутствия ответа на химиотерапию избиралась консервативная тактика. Хирургическим вмешательствам на отдаленных метастазах также не подвергнуты 4 больных с полной регрессией легочных очагов. У 3 из них они перестали определяться по окончании индукции, а у 1 – после завершения адъювантной химиотерапии. Трое из этих больных были прооперированы после индукции в объеме сегментарной резекции и эндопротезирования. У 2 из них был выявлен патоморфоз III степени, а у 1 – полный некроз опухоли. Другую группу составили 7 больных с выраженным, но неполным эффектом. Трое из них прооперированы по окончании адъювантной химиотерапии. При гистологическом исследовании у 2 обнаружены метастазы, содержащие жизнеспособные клетки, а у 1 пациента в 4 удаленных узлах опухоль не обнаружена. Оставшиеся 4 пациентов от дальнейшего лечения отказались.
Отдаленные результаты при отсутствии положительной динамики были неудовлетворительными. Пять из 7 больных умерли, а двое наблюдались лишь 2 месяца. В группе частичных эффектов (7 больных), 3 умерли через 17, 41 и 44 мес. с момента начала лечения. Полной ремиссии заболевания не достигнуто ни у одного больного. Среди пациентов с полным эффектом в легких 1 умер, а 3 живы в ремиссии в течение 3, 25 и 43 мес. Таким образом, за счет более интенсивной химиотерапии и активной хирургической тактики в отношении метастазов медиана выживаемости по сравнению предыдущим протоколом увеличена с 19 до 24 мес. В 2 раза возросло количество больных, которым первичная опухоль удалена, причем в 80% случаев в объеме органосохраняющей операции, что крайне редко было в предыдущем протоколе.
ПРОГНОЗИРОВАНИЕ НА ДОТЕРАПЕВТИЧЕСКОМ ЭТАПЕ
Пол, возраст, локализация, длительность анамнеза, количество симптомов, протяженность по кости, клеточный состав, дифференцировка, уровень остеогенеза, качественные и количественные параметры васкуляризации, рентгенологические характеристики, уровень включения в опухоль фосфатных соединений не предсказывали эффекта предоперационного лечения и не влияли на прогноз. Наиболее информативными при однофакторном анализе оказались:
Стадия. По сравнению со IIB стадией частота выраженных ответов при генерализованной остеосаркоме оказалась в 2 раза ниже, а полный некроз не наблюдался (табл.3). В протоколе НЕО-1 результаты у этих пациентов оказались достоверно хуже, а в НЕО-2 выраженный эффект наблюдался с одинаковой частотой. Стадия влияла на прогноз. В объединенной группе пятилетняя выживаемость при IIIB стадии составила 7±5%, а при IIB – 41±3% (рис. 7).
Рис. 7. Общая выживаемость с учетом стадии:
непрерывная линия – IIB стадия (n=453);
пунктир – IIIB стадия (n=60)
Log rank = 29,2, p<0,00001
Фактор был информативен и в протоколах НЕО, особенно в НЕО-1 (p<0,00001).
Степень местной распространенности. Выявлена тенденция к лучшей выживаемости при IIA стадии. Безрецидивная пятилетняя выживаемость составила 66±11%, по сравнению с 27±2% при IIB стадии (p=0,005). В общей выборке выявлены пороговые значения объема опухоли: 300 и 1000 см3. Наиболее высокая частота
выраженных ответов отмечена при объеме <300 см3 (табл.3). При объеме >1000 см3
вероятность достижения эффекта составила лишь 22%. В химиолучевом протоколе и в протоколе НЕО-2, такие опухоли отвечали так же, как остеосаркомы объемом 300-1000 см3. В протоколе НЕО-1, в котором запущенные случаи были самыми многочисленными, только 11% таких больных (6/53) ответили на химиотерапию. При анализе прогностической роли выявлены пороговые значения 150 и 1000 см3. У основной части больных (объем 150-1000 см3) безрецидивная выживаемость к 5 годам составила 31±3%, а при объеме до 150 см3 – 55±7% (рис.8).
Рис. 8. Безрецидивная выживаемость с учетом объема опухоли:
непрерывная линия – объем опухоли до 150 см3 (n=57);
прерывистая линия – от 150 до 1000 см3 (n=331);
пунктир – более 1000 см3 (n=67), p<0,00001.

Крайне высок риск при объеме опухоли >1000 см3, когда показатель составил 10±4%. Достоверные различия кривых получены в химиолучевом протоколе (р=0,0002) и НЕО-1 (р=0,008). Из-за короткого срока наблюдения в протоколе НЕО-2 тенденции требуют дальнейшего подтверждения.
Темп роста опухоли варьировал от 4 до 1500 см3/мес. (средняя 164±189, медиана – 107). Граница признака 80 см3/мес. была близка к медиане. Среди опухолей с низким темпом роста частота ответов была достоверно выше, особенно в протоколах НЕО (табл.3). Чувствительность критерия не превысила 55%, а специфичность – 70%. Более явной была связь признака с прогнозом (рис.9). В группе медленно прогрессирующих опухолей показатель безрецидивной пяти летней выживаемости составил 42±4% и только 20% - в альтернативной. Различия достоверны в химиолучевом протоколе (p=0,001) и НЕО-1 (p=0,0001).
Рис. 9. Безрецидивная выживаемость с учетом темпа роста опухоли:
непрерывная линия –до 80 см3/мес. (n=203);
пунктир – более 80 см3/мес. (n=306), p<0,00001.

Показатели плоидности и пролиферативной активности. При диплоидных опухолях выраженных эффектов не наблюдалось (табл. 4).
Таблица 4.
Ответ на химиотерапию с учетом плоидности опухолевых клеток
| Плоидность | n | Ответ# | р | Точность |
| Диплоидные | 11 | 0 (0) | 0,1 | Ч – 100% |
| Анеуплоидные | 68 | 13 (19) | С – 17% | |
| # - патоморфоз III-IV степени; в скобках – % | ||||
Высокий процент ложноположительных прогнозов обусловил низкую специфичность критерия. При содержании в опухоли >90% анеуплоидных клеток частота ответов составила 25% (5/20) по сравнению с 14% (8/58) при меньшем количестве.
ИДНК не был взаимосвязан с эффектом и прогнозом.
Выявлена достоверно более высокая чувствительность к химиотерапии анеуплоидных остеосарком с умеренным содержанием клеток в синтетической, премитотической фазе и в митозе (табл. 5). При высокой чувствительности параметров пролиферативной активности они недостаточно специфичны.
Наибольшие шансы пережить 5-летний срок без прогрессирования были при фракции клеток в S-фазе <7% (p=0,03), G2+M <20% (p=0,01), и ИП <17% (рис.10).
ЩФ. Повышение ЩФ отмечено у 86% больных (355/412). Уровень маркера предсказывал патоморфоз (табл. 3). Чувствительность критерия была менее 40%, в то время как специфичность превысила 85%, а в протоколе НЕО-2 составила 97%.
Таблица 5.
Ответ на химиотерапию с учетом уровня пролиферативной активности.
| Фаза клеточного цикла | n | Ответы# | р | Точность |
| S-фаза, % <12 12 | 37 28 | 11 (30) 2 (7) | 0,02 | Ч – 85% С – 50% |
| G2+M, % <12 12 | 31 34 | 12 (39) 1 (3) | 0,0003 | Ч – 92% С – 63% |
| ИП, % <25 25 | 30 35 | 12 (40) 1 (3) | 0,0002 | Ч – 92% С – 65% |
| # - патоморфоз III-IV степени; в скобках – % | ||||
Рис. 10. Безрецидивная выживаемость с учетом ИП: непрерывная линия – до 17% (n=16); прерывистая – более 17% (n=49), p=0,03

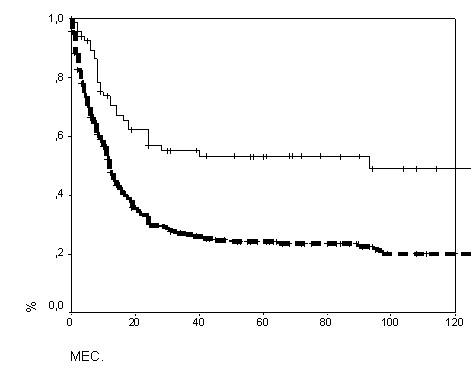
При нормальном уровне ЩФ вероятность прожить пятилетний срок без прогрессирования составила 53±6%, а при высоком – лишь 24±3% (рис. 11).
Рис. 11 Безрецидивная выживаемость с учетом ЩФ: непрерывная линия – нормальный уровень (n=76); прерывистая – больше нормы (n=303), p<0,00001
МОНИТОРИНГ ИНДУКЦИОННОЙ ХИМИОТЕРАПИИ. КРИТЕРИИ ЭФФЕКТИВНОСТИ ЛЕЧЕНИЯ. Оценка изменений клинического статуса
Использована следующая система оценки клинического ответа: частичный ответ – уменьшение болевого синдрома и размеров опухоли, а также улучшение функции конечности; выраженный частичный эффект – стойкое исчезновение болей, полное или практически полное восстановление функции и наличие пальпируемой опухоли костной плотности; полный клинический ответ – исчезновение болей, пальпируемой опухоли и восстановление функции.
Ранний клинический ответ предсказывал эффект химиотерапии. Среди больных с выраженной или полной регрессией симптоматики частота выраженных ответов была достоверно выше (табл.6). Чувствительность критерия была невысокой, а специфичность превысила 90%. Выживаемость также была достоверно выше среди больных, ответивших на лечение (табл.7). Только исчезновение в конце индукции характерной триады симптомов (боли, опухоли и нарушенной функции) ассоциировалось с большей вероятностью выраженного эффекта и системного контроля. Отметим, что даже при полном клиническом ответе резидуальная опухоль выявлена более чем у половины больных. Чувствительность критерия на данном этапе составила около 50%, а специфичность – 83%.
Данные, представленные в таблицах 6 и 7 свидетельствуют о взаимосвязи между значениями абсолютного объема на фоне химиотерапии, эффектом и прогнозом. Более высокая вероятность выраженного ответа и благоприятного исхода прогнозировалась среди больных, у которых объем опухоли на фоне индукции не превышал 300 см3. Следует подчеркнуть, что выраженный некроз выявлялся примерно у 20% больных с опухолями более 300 см3 и в то же время патоморфоз 0-II степени отмечен у 60% больных с опухолями меньшего размера. Это обусловило относительно низкую чувствительность и специфичность критерия.
Любая степень регрессии после 2 курсов химиотерапии прогнозировала лучший эффект и более высокую выживаемость (табл. 6,7). В конце индукции пороговое значение признака повысилось до 20%. Вновь следует обратить внимание на диагностическую точность критерия. Среди больных, у которых размеры опухоли после 2 курсов оставались неизменными или незначительно уменьшались к концу лечения, в 16-17% случаев отмечен выраженный гистологиче-
ский ответ. С другой стороны регрессия опухоли далеко не всегда предсказывала
эффекта. У половины таких пациентов определялся патоморфоз 0-II степени. Иногда выраженный гистологический ответ документировался на фоне увеличения опухоли. Вскоре после операции у них появились метастазы. Чувствительность и специфичность критерия после 2 курсов не превысили 70%, а в конце лечения составили 60% и 78% соответственно.
Мы посчитали целесообразным изучить показатель, отражающий регрессию опухоли и ее абсолютный объем – комбинированный клинический ответ. На промежуточном этапе предполагались любая степень регрессии, а в конце индукции более чем на 20% и достижение объема <300 см3. Остеосаркомы объемом >1500 см3 редко регрессировали до этого уровня, поэтому комбинированный клинический ответ, косвенно указывал на небольшие исходные размеры. Критерий был взаимосвязан с эффектом и прогнозом уже на ранних этапах лечения (табл. 6, 7). Он обладает большей специфичностью, нежели абсолютный объем и относительное уменьшение опухоли. При комбинированном клиническом ответе по окончании химиотерапии общая и безрецидивная выживаемость были 71% и 48% соответственно, что существенно выше, чем среди оставшихся больных.
Другим, более строгим показателем оценки местного статуса, схожим с предыдущим, была полная регрессия внекостного компонента или формирование минерализованной, незначительно смещенной по отношению к кости надкостницы, а под ней – ассимилированной периостальной реакции, слоя губчатой или ячеисто-трабекулярной кости. Такую картину на промежуточном этапе мы наблюдали у 6%, а по окончании индукции – у 10% больных. Эта подгруппа отличалась сравнительно более высокой частотой выраженных гистологических ответов (табл. 6). При изучении диагностической точности мы обнаружили, что в остающейся за пределами кости опухоли выраженный некроз наблюдался у 1/4 больных. Таким образом, для достижения патоморфоза III-IV степени полная регрессия не обязательна, что обусловило низкую чувствительность критерия. С другой стороны, даже при исчезновении внекостного компонента более чем у 1/3 пациентов во внутрикостной части выявлялись жизнеспособные опухолевые клетки. Тем не менее, специфичность критерия на этапах лечения была самой высокой среди всех признаков, характеризующих клинический статус.
Полная регрессия внекостного компонента ассоциировалась с более высокой выживаемостью (табл. 7), причем тенденция отмечена уже после 2 курсов. В данной группе прогнозировалась максимальная по сравнению с другими критериями выживаемость – 62%.
Рентгенологическая динамика. Изменения внутрикостной части.
Уплотнение внутрикостной части опухоли относительно слабо коррелировало с эффектом (табл. 8). Патоморфоз III-IV степени чаще выявлялся при нарастании пластического компонента, однако примерно у 1/4 больных он отмечен и без уплотнения очага остеоклазии. Чувствительность критерия составила около 40%, а специфичность - 80%. Влияние признака на прогноз было слабым.
Выделены следующие виды изменений структуры кости.
1) частичное или полное восстановление губчатости. На фоне опухолевого костеобразования пластический компонент частично резорбировался, восстанавливалась структура кости, появлялась губчатость или трабекулярность.
2) отграничение очагов остеоклазии без значительного увеличения их площади, формирование трабекул, разнокалиберных одиночных или множественных кист с четкими контурами, овальной, округлой или неправильной формы. Изменения могут наблюдаться уже после 2 курсов химиотерапии.
3) формирование зон остеосклероза вокруг очагов лизиса.
Репарация ассоциировалась с более выраженным эффектом (табл. 8). Достоверность различий высока уже на промежуточном этапе индукции. Чувствительность критерия возросла к ее окончанию, хотя и не превысила 60%, а специфичность снизилась с 79 до 76%. При перестройке внутрикостной части выживаемость была достоверно выше уже после 2 курсов (табл. 9).
Таблица 8.
Динамика рентгенологических признаков и патоморфоз
| Признак и градации | После двух курсов | Конец химиотерапии | |||||
| n | Ответ # | n | Ответ | ||||
| Внутрикостный компонент | |||||||
| Пластический компонент | |||||||
| без динамики | 195 | 49 (25) | 0,02* | 194 | 45 (23) | 0,002 | |
| уплотнение | 77 | 30 (39) | 75 | 32 (43) | |||
| всего | 272 | Ч-38%, С-76% | 269 | Ч-42%, С-78% | |||
| Структура кости | |||||||
| без динамики | 201 | 49 (24) | 22,1 0,0000 | 189 | 32 (17) | 29,6 0,0000 | |
| частичная/полная репарация | 82 | 30 (37) | 95 | 45 (47) | |||
| всего | 283 | Ч-49%, С-79% | 284 | Ч-58%, С-76% | |||
| Корковый слой | |||||||
| без динамики | 235 | 49 (21) | 22,1 0,0000 | 204 | 32 (16) | 39,3 0,0000 | |
| частичное/полное восстановление | 66 | 33 (50) | 96 | 48 (50) | |||
| всего | 301 | Ч-40%, С-85% | 300 | Ч-60%, С-78% | |||
| Внекостный компонент | |||||||
| Пластический компонент** | |||||||
| без динамики | 92 | 14 (15) | 0,004 | 175 | 33 (19) | 16,8 0.0000 | |
| уплотнение | 163 | 52 (32) | 70 | 31 (44) | |||
| всего | 255 | Ч-79%, С-41% | 245 | Ч-48%, С-78% | |||
| Структура | |||||||
| без динамики | 224 | 44 (20) | 17 0,0000 | 202 | 31 (15) | 35,4 0,0000 | |
| частичная/выраженная перестройка | 48 | 23 (48) | 66 | 34 (52) | |||
| всего | 272 | Ч-34%, С-88% | 268 | Ч-52%, С-84% | |||
| Периостальная реакция | |||||||
| без динамики/частич. ассимил.яция | 260 | 59 (23) | 22,1 0,0000 | 228 | 39 (17) | 44,8 0,0000 | |
| выраженная/полная ассимиляция | 26 | 17 (65) | 57 | 35 (61) | |||
| всего | 286 | Ч-22%, С-96% | 285 | Ч-47%, С-90% | |||
| Отграничение | |||||||
| без динамики/частичное | 259 | 60 (23) | 17,2 0,0000 | 239 | 53 (22) | 0,0007 | |
| полное отграничение | 31 | 18 (58) | 51 | 23 (45) | |||
| всего | 290 | Ч-23%, С-94% | 290 | Ч-30%, С-87% | |||
| # - патоморфоз III-IV степени; в скобках – %; * 2 и значение р; ** - изменение способа стратификации в конце химиотерапии - выраженное уплотнение (ближе к плотности губчатой кости) против остальных | |||||||
Репарация коркового слоя характеризовались его уплотнением, частичным или полным восстановлением целостности, четким отграничением. Частичное или полное восстановление в конце индукции наступало чаще (22% против 32%) и было связано с эффектом (табл. 8). Чувствительность симптома возросла до 60%, а специфичность снизилась. При репарации после 2 курсов видна
Таблица 9.
Безрецидивная пятилетняя выживаемость с учетом рентген - динамики
| Признак | После двух курсов | После химиотерапии | ||||
| n | БРВ, % | n | БРВ, % | |||
| Внутрикостная часть | ||||||
| Пластический компонент | ||||||
| без динамики уплотнение | 144 58 | 24±4 28±8 | 0,2* | 143 57 | 24±4 33±8 | 0,1 |
| Структура | ||||||
| без динамики частичная/полная репарация | 142 64 | 19±4 39±7 | 0,002 | 135 75 | 17±3 40±7 | 0,0002 |
| Корковый слой | ||||||
| без динамики частичное/полное восстановление | 165 51 | 22±4 40±8 | 0,01 | 143 77 | 20±4 38±6 | 0,0009 |
| Внекостный компонент | ||||||
| Пластический компонент** | ||||||
| без динамики уплотнение | 69 118 | 20±5 25±4 | 0,4 | 133 51 | 19±4 28±7 | 0,05 |
| Структура | ||||||
| без динамики частичная/выраженная перестройка | 156 39 | 20±4 33±8 | 0,17 | 145 52 | 14±3 41±7 | 0,0007 |
| Периостальная реакция | ||||||
| без динамики/частичная ассимиляция выраженная/полная ассимиляция | 183 19 | 22±3 83±11 | 0,0001 | 161 45 | 18±3 61±8 | 21,3 0,0000 |
| Отграничение | ||||||
| без динамики/частичное отграничение полное отграничение | 182 27 | 19±3 58±10 | 0,0002 | 173 41 | 18±3 50±8 | 17,5 0,0000 |
| * - log-rank тест и значение р; ** - изменение способа стратификации в конце индукции - выраженное уплотнение (ближе к плотности губчатой кости) против остальных | ||||||
тенденция к лучшей выживаемости, усиливающаяся в конце лечения (табл. 9).
Изменения внекостного компонента опухоли
Между уплотнением внекостного компонента и ответом обнаружена достоверная взаимосвязь (табл. 8). Чувствительность критерия на промежуточном этапе индукции составила около 80%, а специфичность – около 40%. В конце химиотерапии чувствительность снизилась, а специфичность приблизилась к
80%. Влияние критерия на прогноз было менее значимым (табл. 9).
Мы смогли выделить несколько вариантов изменений структуры внекостного компонента. Во-первых, это формирование костной ткани с губчатой структурой. Далее – образование грубых трабекул, разнокалиберных одиночных или множественных кист и полостей с относительно правильными очертаниями, овальной, округлой или неправильной формы, иногда с широким выходом к капсуле опухоли. Признаки перестройки можно увидеть уже на промежуточном этапе, а к концу лечения они становятся отчетливее и выявляются чаще.
Анализ выявил четкую взаимосвязь между перестройкой внекостного компонента и гистологическим ответом (табл. 8). При относительно низкой чувствительности, специфичность критерия была достаточно высокой. Также удалось выявить влияние критерия на прогноз. Тенденция к лучшей выживаемости проявилась уже при обнаружении ранних структурных изменений и стала отчетливее в конце лечения (табл. 9). При репарации внекостного компонента безрецидивная выживаемость была почти в 3 раза выше.
Уже после 2 курсов химиотерапии отмечена достоверная связь ассимиляции периостальной реакции с ответом (табл. 8). При выраженной или полной ассимиляции локальные эффекты получены в 60% случаев. Специфичность критерия превысила 95%, с тенденцией к снижению в конце химиотерапии. Ассимиляция после 2 курсов достоверно ассоциируется и с более высокой выживаемостью (табл. 9). В небольшой группе из 22 больных безрецидивная выживаемость была 83±8%. В конце химиотерапии, когда группа увеличилась более чем в 2 раза, выживаемость несколько снизились, однако осталась одной из самых высоких, прогнозируемых с помощью рентгенологических критериев, что свидетельствует о достаточно высокой специфичности изменений периостальной реакции.
Отграничение от внескелетных тканей взаимосвязано с гистологическим ответом, что подтверждается значимыми различиями (табл. 8). Чувствительность критерия не превысила 30%, а специфичность была в пределах 87-94%. Полное и четкое отграничение опухоли достоверно ассоциировалось с более высокой безрецидивной выживаемостью, причем уже после 2 курсов лечения (табл. 9).
Многофакторный анализ. Независимыми факторами, предсказывающими вероятность прогрессирования, оказались структура внутрикостной части, степень ассимиляции периостоза и отграничения внекостного компонента. После 2 курсов их информативность составила: р=0,02, р=0,01 и р=0,05 соответственно, а по окончании лечения – р=0,05, р=0,01 и р=0,003. Наиболее благоприятное течение прогнозировалось при выраженной или полной ассимиляции периостоза, репарации внутрикостной части или отграничении опухоли. Эти условия соответствовали рентгенологическому ответу, а остальные сочетания признаков расценивались как его отсутствие. При анализе отдаленных результатов получены достоверные различия кривых выживаемости (рис. 12).

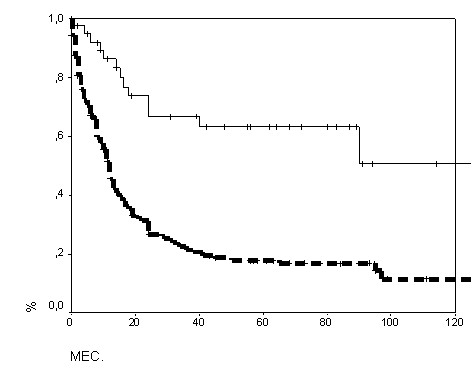
Рис. 12. Безрецидивная выживаемость с учетом рентген - динамики после 2 курсов (слева): непрерывная линия – ответ есть (n=30), прерывистая – ответа нет (n=212); p<0,00001 и после индукции (справа): непрерывная линия – ответ есть (n=47), прерывистая – ответа нет (n=200); p<0,00001
Частота выраженных эффектов при рентгенологическом ответе после 2 курсов составила 65% (22/34), по сравнению с 22% (59/263) в альтернативной группе (р<0,00001). Специфичность была 94%, а чувствительность – 27%. Явная связь признаков сохранилась и после индукции. Эффективность химиотерапии при ответе и без него составила 63% (32/51) и 20% (49/248) соответственно (р<0,00001).
Оценка изменений васкуляризации опухоли. Качественные критерии.
Ранним ангиографическим ответом считалось выраженное снижение или исчезновение патологической васкуляризации, снижение или отсутствие контрастирования в капиллярной фазе и частичная или полная нормализация диаметра питающих артерий. В конце химиотерапии ответом было отсутствие зон неоваскуляризации и контрастирования, а также нормализацию диаметра питающих артерий. Взаимосвязь между регрессией ангиографической симптоматики и эффектом химиотерапии отмечена уже после 2 курсов (табл. 10).
Таблица 10.
Динамика ангиографических признаков и локальный ответ.
| Ангиографический ответ | После двух курсов | Конец химиотерапии | ||||
| n | Ответ# | n | Ответ | |||
| Нет | 101 | 16 (16) | 32.4* <0,00001 | 122 | 24 (20) | 39.4 <0,00001 |
| Есть | 59 | 35 (59) | 34 | 26 (76) | ||
| всего | 160 | Ч-69%; С-78% | 156 | Ч-52%; С-92% | ||
| # - патоморфоз III-IV степени; в скобках – %; * 2 и значение р; | ||||||
Среди ответивших больных патоморфоз III-IV степени наблюдался в 59% случаев по сравнению с 16% в альтернативной группе. По окончании индукции связь ангиографического эффекта с патоморфозом и специфичность возросли. Ангиографический ответ ассоциировался и с лучшим прогнозом (рис. 13).

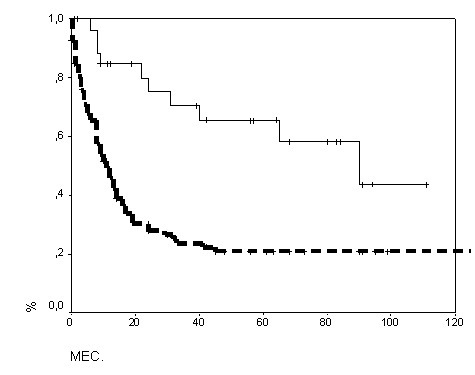
Рис. 13. Безрецидивная выживаемость с учетом ангиографического ответа после 2 курсов химиотерапии (слева): непрерывная линия – ответ есть (n=54), прерывистая – ответа нет (n=84); p=0,0007 и по окончании индукции (справа): не
прерывная линия – ответ есть (n=30), прерывистая – ответа нет (n=104); p=0,0002
Количественные критерии. Пороговое значение уровня перфузии опухоли
составило 200%. При низкой перфузии частота эффектов была достоверно выше (табл. 11).
Таблица 11.
Ответ на лечение с учетом динамики показателей перфузии опухоли.
| Признак | После двух курсов | После химиотерапии | ||||
| Перфузия опухоли | n | Ответы# | n | Ответы | ||
| 200 % <200 % | 52 27 | 18 (35) 21 (78) | 0,0003* | 50 45 | 18 (36) 31 (69) | 0,001 |
| Всего | 79 | Ч-54%, С-85% | 95 | Ч-63%, С-70% | ||
| Динамика | ||||||
| <50% 50% | 51 23 | 19 (37) 18 (78) | 0,001 | 41 36 | 12 (29) 27 (75) | <0,00001 |
| Всего | 74 | Ч-49%, С-86% | 77 | Ч-69%, С-76% | ||
| Комбинированный ответ** | ||||||
| нет есть | 64 12 | 26 (41) 11 (92) | 0,001 | 60 23 | 25 (42) 17 (74) | 0,009 |
| Всего | 76 | Ч-30%, С-97% | 83 | Ч-40%, С-85% | ||
| # - патоморфоз III-IV степени; в скобках – %; * 2 и значение р; ** - комбинированный ответ: снижение перфузии более чем в 2 раза до уровня менее 200%. | ||||||
Более специфичным критерий оказался на промежуточном этапе. Большой процент ложноотрицательных случаев обусловил относительно низкую чувствительность. Степень снижения перфузии (граница 50%) также оказалась информативной в отношении эффекта. Ее диагностическая точность была выше, чем у предыдущего критерия, особенно в конце лечения.
Показатель, отражающий степень снижения и конечный уровень перфузии, обладал высокой информативностью и наибольшей специфичностью, а его чувствительность была 40%. Уровень перфузии взаимосвязан и с прогнозом (табл. 12). При низком уровне перфузии выживаемость превысила 60%. Влияние на прогноз степени снижения перфузии было менее значимым. Комбинированный ответ на промежуточном этапе и в конце лечения ассоциировался с лучшей выживаемостью.
Таблица 12.
Безрецидивная пятилетняя выживаемость с учетом динамики перфузии.
| Признак | После двух курсов | После химиотерапии | ||||
| Перфузия опухоли * | n | БРВ, % | р | n | БРВ, % | р |
| 200% <200% | 46 20 | 13±7 64±12 | 0,0019 | 62 19 | 24±6 69±12 | 0,027 |
| Динамика | ||||||
| <50% 50% | 47 16 | 20±7 56±14 | 0,065 | 41 25 | 22±8 44±11 | 0,2 |
| Комбинированный ответ | ||||||
| нет есть | 56 8 | 17±7 67±27 | 0,002 | 51 20 | 22±7 52±14 | 0,056 |
| *-изменение порогового значения в конце лечения: 150% vs >150% | ||||||
Таким образом, выявлены достаточно явные тенденции, свидетельствующие о том, что изменения уровня перфузии на фоне индукции, предсказывают эффект и прогноз. Более благоприятное течение ожидаемо при сохранении низкого уровня перфузии, его значительном уменьшении (более чем в 2 раза) или уменьшении исходного уровня до значений, не превышающих 200% на промежуточном этапе и 150% в конце индукции.
Изменения метаболизма костной ткани. Частота выраженных ответов достоверно выше при сохранении на фоне индукции низкого (<350%) уровня накопления изотопа в ранней костной фазе (табл. 13). Более информативной оказалась динамика накопления РФП. Эффект было лучше при снижении уровня более, чем в 2 раза, а также тогда, когда он достигал значений, не превышающих 350%. Чувствительность критериев на данном этапе была низкой. Наиболее специфичным был комбинированный ответ, при котором выраженный эффект достигнут у 80% больных. В конце индукции пороговое значение признака снизилось до 250%. Высокой информативностью в отношении эффекта обладал критерий, отражающий снижение исходного уровня. Его чувствительность составила 74%. Максимальная специфичность вновь была у комбинированного ответа. Аналогичные тенденции отмечены для поздней костной фазы. При пороговом значении 500%
информативность признака оказалась ниже, чем у ранней костной фазы (табл. 14).
Относительное снижение уровня поглощения и снижение накопления до 500% были достоверно взаимосвязано с эффектом химиотерапии, при этом комбинированный ответ обладал максимальной специфичностью (90-95%).
Накопление РФП в костных фазах влияло на прогноз (табл. 15, 16).
Таблица 15.
Изменения уровня накопления РФП в ранней костной фазе и выживаемость
| Признак | После двух курсов | После химиотерапии | ||||
| Уровень накопления | n | БРВ, % | р | n | БРВ, % | р |
| 350% <350% | 33 35 | 16±7 45±9 | 0,03 | 50 37 | 22±6 44±9 | 0,09 |
| Динамика | ||||||
| 50% >50% | 43 22 | 15±6 57±12 | 0,01 | 38 32 | 14±6 43±10 | 0,02 |
| Комбинированный ответ* | ||||||
| Нет Есть | 50 15 | 16±6 71±12 | 0,0025 | 56 18 | 21±6 52±14 | 0,048 |
| ** - уровень < 350%, относительное снижение > 50% | ||||||
Таблица 16.
Изменений уровня накопления РФП в поздней костной фазе и выживаемость
| Признак | После двух курсов | После химиотерапии | ||||
| Уровень накопления | n | БРВ, % | р | n | БРВ, % | р |
| 500% <500% | 32 36 | 19±9 37±9 | 0,2 | 26 49 | 17±8 34±8 | 0,09 |
| Динамика | ||||||
| 50% >50% | 48 17 | 29±8 48±11 | 0,5 | 40 27 | 13±7 41±12 | 0,059 |
| Комбинированный ответ* | ||||||
| Нет Есть | 54 12 | 22±7 57±17 | 0,076 | 46 22 | 14±7 42±13 | 0,098 |
| * - уровень < 500%, относительное снижение > 50% | ||||||
Более благоприятное течение отмечено при сохранении относительно низких показателях метаболической активности, снижении исходного уровня более чем в 2 раза, и достижении при этом низких уровней накопления изотопа. Примечательно, что показатели информативны на ранних этапах лечения.
Изменения ЩФ. При нормальном уровне маркера после 2 курсов и в конце химиотерапии частота выраженных ответов была выше, при этом чувствительность и специфичность критерия не превысили 70% (табл. 17).
Таблица 17.
Изменения активности ЩФ на фоне химиотерапии и локальный ответ.
| Уровень ЩФ | После двух курсов | После химиотерапии | ||||
| n | Ответы# | р | n | Ответы | р | |
| выше нормы норма | 170 134 | 31 (18) 58 (43) | <0,00001 | 165 138 | 28 (17) 60 (43) | <0,00001 |
| Всего | 304 | Ч-65%, С-65% | 303 | Ч-68%, С-64% | ||
| Динамика | ||||||
| <50% 50% | 211 91 | 55 (26) 32 (35) | 0,1 | 200 100 | 48 (24) 40 (60) | 0,004 |
| Всего | 302 | Ч-37%, С-73% | 300 | Ч-45%, С-72% | ||
| Комбинированный ответ* | ||||||
| нет есть | 248 53 | 63 (25) 24 (45) | 0,004 | 246 55 | 61 (25) 26 (47) | 0,0009 |
| Всего | 301 | Ч-28%, С-86% | 301 | Ч-30%, С-86% | ||
| # - патоморфоз III-IV степени; в скобках - %, * - снижение исходной активности > 50% и достижение нормального уровня | ||||||
Специфичнее в отношении эффекта было снижение уровня ЩФ более чем в 2 раза, особенно если при этом достигались нормальные значения. В то же время отсутствие выраженной динамики ЩФ далеко не всегда означало, что химиотерапия неэффективна. Динамика ЩФ на фоне индукции оказалась относительно мало информативной в отношении прогноза. Нормализация ЩФ ассоциировалась с более высокой общей выживаемостью, однако достоверных различий получить не удалось. Нами проанализированы 56 больных, у которых ЩФ на фоне химиотерапии превышала 200%. Безрецидивная выживаемость в этой группе составила лишь 13±6%, что достоверно меньше, чем у остальных пациентов (р=0,04), а вероятность достижения выраженного эффекта минимальна (р<0,00001).
ВОЗМОЖНОСТИ ИНДИВИДУАЛИЗАЦИИ ЛЕЧЕНИЯ
Оценка риска до лечения. Для оценки риска при локализованной остеосар-
коме разработана модель в которую вошли объем (р=0,079), ЩФ (р=0,0043), а также темпа роста (р=0,01), (табл.18). Наиболее благоприятное течение прогнозируются при IIB стадии, объеме <150 см3, низком темпе роста и нормальной ЩФ. Крайне высок риск при опухолях объемом >1000 см3, быстром темпе и нормальной ЩФ, при объеме >150 см3, низком темпе роста и повышенной ЩФ, при высоком темпе роста, повышенной ЩФ, независимо от объема, а также у больных с IIIB стадией. В остальных случаях риск расценивался как высокий.
Таким образом, выделение групп риска возможно на этапе установления диагноза. При стандартном риске возможно лечение согласно протоколам средней интенсивности, например НЕО-2. При высоком и крайне высоком риске рекомендуются трех или четырехкомпонентные схемы химиотерапии.
Прогнозирование на ранних этапах индукционной химиотерапии. Эффективная химиотерапия остеосаркомы характеризуется уменьшением объема опухоли, нарастанием рентгенологических признаков репарации, снижением васкуляризации, уровня метаболических процессов и активности ЩФ. Для предсказания исхода ключевое значение имеет ранняя оценка динамики заболевания. Наиболее специфичны в отношении благоприятного течения уменьшение опухоли или полное исчезновение внекостного компонента, рентгенологический ответ и снижение перфузии. Ангиографический и биохимический ответы более специфичны для выраженного патоморфоза, чем благоприятного исхода.
В модель предсказания безрецидивной выживаемости на промежуточном этапе индукции вошли регрессия до 300 см3 (р=0,03), рентгенологический ответ (р=0,0005) и ЩФ (р=0.049), (табл.18). Более благоприятный прогноз ожидается при регрессии опухоли до 300 см3, рентгенологическом ответе и нормализации ЩФ, когда безрецидивная выживаемость превышает 80%. Удовлетворительные результаты достижимы и при других комбинациях признаков, однако обязательным условием является ранний рентгенологический ответ и регрессия до 300 см3. В данном случае вероятность прожить пятилетний срок без прогрессирования превышает 60%. В отсутствии рентгенологических признаков репарации, даже при регрессии до 300 см3 и нормальной ЩФ, пятилетняя безрецидивная выживаемость была только на уровне 40%. У остальных больных риск появления метастазов или местного рецидива чрезвычайно высок, и этот контингент требует обсуждения альтернативных тактических решений уже на данном этапе терапии. При устойчивости к первоначальной схеме могут обсуждаться режимы второй линии или удаление опухоли. Наш опыт изменения схемы индукционной химиотерапии относительно невелик и касается пациентов со слабо выраженным клинико-рентгенологическим, сцинтиграфическим и биохимическим ответами (16 больных) или системным прогрессированием (4 больных). В целом эффект удалось усилить в 50% наблюдений.
Прогнозирование после завершения индукционной химиотерапии. Оценка эффекта и риска по окончании индукции рассматривается с нескольких позиций. Ответ на химиотерапию учитывается при планировании хирургического этапа. При полной девитализации опухоли больные, отказавшиеся от операции, могут стать кандидатами на лучевую терапию в качестве окончательного метода локального контроля. При нарастающем ответе возможны дополнительные курсы химиотерапии, направленные на достижение максимального эффекта.
Главные факторы, которые должны быть учтены при планировании хирургического вмешательства – это достижение онкологического радикализма и эффект индукционной химиотерапии. Создана модель, которая прогнозировала эффективность локального контроля с учетом вида операции, включающая клинический ответ и степень регрессии опухоли (табл. 19). Калечащие операции обеспечивали удовлетворительный локальный контроль независимо от эффекта. В то же время после органосохраняющих вмешательств безрецидивная выживаемость при слабом эффекте была лишь 42%. Обратим внимание на то, что в группу риска попадают и больные с опухолями до 300 см3, не регрессирующие на фоне индукции.
В модель прогнозирования выживаемости после окончания индукционной
Таблица 19.
Прогнозирование эффективности локального контроля после окончания индукционной химиотерапии (n=159, 2=41,7, p<0,00001).
| Клинический ответ p=0,03 | Регрессия опухоли до 300 см3 p=0,008 | Вид операции р<0,00001 | Пятилетняя выживаемость без рецидива, % |
| Есть | Есть | Калечащая | 99 |
| Нет | Нет | 91 | |
| Есть | Есть | Сохранная | 96 |
| Нет | Нет | 42 |
химиотерапии вошли степень регрессии опухоли (р=0,002), рентгенологический ответ (р=0,0007) и биохимический ответ (р=0,02).
Показатели, соответствующие стандартному риску, ожидались при клинико-рентгенологическом и биохимическом ответах (табл. 18). При сочетании регрессии только с рентгенологическим ответом или с нормализацией ЩФ риск в целом расценивался как стандартный, однако без рентгенологической репарации вероятность прогрессирования была высокой. Крайне высок риск у больных без регрессии, рентгенологического ответа ± нормализации ЩФ, а также при одной регрессии. Остальные комбинации предсказывали высокий риск.
Прогнозирование после локального лечения. Одна из задач, решаемых после удаления опухоли, прогнозирование вероятности появления местного рецидива. Общая частота таких осложнений составила 13% (38/297), при этом она зависела от двух ключевых факторов – радикальности вмешательства (р<0,00001) и эффекта химиотерапии (р=0,0004). После нерадикального удаления химиорезистентной опухоли частота рецидивов была 68%. При выраженном патоморфозе риск рецидива не исключался и был в 2 раза меньше. Радикальное вмешательство обеспечивает удовлетворительный локальный контроль даже при слабом эффекте, а при патоморфозе III-IV степени вероятность рецидива минимальна.
Получившие широкое распространение при остеосаркоме органосохраняющие операции сопряжены с повышенным риском рецидивирования и наша серия подтверждает это (р=0,0004). Такие вмешательства сопряжены с повышенной вероятностью нерадикального удаления опухоли. После калечащих операций радикальность достигалась в 98% случаев (123/126), а после органосохраняющих – только в 75% (126/169), р<0,00001. При неэффективной индукции риск рецидивирования после резекций возрастает. У 8% больных подвергнутых органосохраняющим вмешательствам рецидив возник, несмотря на выраженный эффект.
Модель прогнозирования эффективности локального контроля включала вид и радикальность операции, объем опухоли и патоморфоз (табл.20).
Таблица 20.
Прогнозирование пятилетней выживаемости без местного рецидива больных остеосаркомой после операции (n=202, 2=77.9, p<0.00001)
| Вид операции р=0,009 | Объем < 300 см3 р=0,0047 | Гистологический ответ р=0,0051 | Край резекции# p<0,00001 | Выживаемость, % | |||||||
| Калечащая | да | нет | да | нет | |||||||
| + | + | - | 99* | ||||||||
| + | + | - | 97* | ||||||||
| + | + | - | 97* | ||||||||
| + | + | - | 91* | ||||||||
| + | + | + | 95* | ||||||||
| + | + | + | 86** | ||||||||
| + | + | + | 81** | ||||||||
| + | + | + | 55*** | ||||||||
| Сохранная | + | + | - | 96* | |||||||
| + | + | - | 89** | ||||||||
| + | + | - | 84** | ||||||||
| + | + | - | 62*** | ||||||||
| + | - | + | + | 80** | |||||||
| + | + | + | 55*** | ||||||||
| + | + | + | 42*** | ||||||||
| - | + | + | + | 10*** | |||||||
| # - “-” радикальная резекция, “+” нерадикальная резекция; * - стандартный риск, ** - высокий риск; *** - крайне высокий риск | |||||||||||
После калечащих операций риск рецидива в целом невысок, даже при отно-
сительно больших опухолях, не ответивших на химиотерапию, но удаленных радикально. Удовлетворительный локальный контроль прогнозируется при объеме до 300 см3 и выраженном эффекте, даже если операции были нерадикальными. Максимального риска после калечащих операций следует ожидать при нерадикальном удалении местно-распространенной опухоли, не ответившей на химиотерапию. Органосохраняющие операции сопряжены с низким риском местного рецидивирования только в случае их радикальности и выраженного гистологического ответа. При этих же условиях и объеме более 300 см3 риск несколько повышается. Учет объема опухоли также позволяет выделить среди больных с выраженным патоморфозом и радикальным краем резекции подгруппу с крайне высоким риском местного рецидива. Это пациенты с объемом удаленной опухоли превышающим 300 см3. Пятилетняя безрецидивная выживаемость в этой подгруппе составила лишь 62%, что на 22% меньше, чем в альтернативной группе. Нерадикальные резекции чаще предвещают высокий и крайне высокий риск, при этом максимального уровня (90%) он достигает при местно-распространенных опухолях, не ответивших на химиотерапию. Этот контингент больных требует обсуждения повторных операций, включая ампутации, лучевой терапии, а также более тщательного послеоперационного мониторинга.
Анализ показал, что для более точной оценки риска после удаления опухоли следует учитывать как дотерапевтические факторы, так и критерии, отражающие эффект химиотерапии in vivo. В дополнение к регрессии (р=0,02) и патоморфозу (р=0,003) в модель вошел рентгенологический ответ (р=0,002) (табл. 19). Стандартный риск ожидается у больных с тремя или двумя (обязательна рентгенологическая репарация) видами ответа. Остальные ситуации говорят о крайне высоком риске. При выраженном патоморфозе без регрессии до 300 см3 и рентгенологического ответа риск также был высоким. В этой, традиционно благоприятной в отношении прогноза группе, безрецидивная выживаемость была лишь 32%.
Проведенное исследование демонстрирует современные возможности ком-
бинированного лечения остеосаркомы, которые характеризуются тем, что большинство пациентов могут быть излечены с сохранением функционально полноценной конечности. Перспективы лечения этой опухоли связаны с внедрением методологии дифференцированного лечения с учетом риска как на этапе установления диагноза, так и в процессе неоадъювантной терапии.
ВЫВОДЫ
- Общая и безрецидивная пятилетняя выживаемость больных остеосаркомой IIB стадии после индукционной химиотерапии, хирургического лечения и адъювантной химиотерапии составила 80% и 50% соответственно. Выраженный патоморфоз отмечен в 66% случаев, а органосохраняющее лечение выполнено 91% больных.
- Не влияя на выживаемость, артериальный путь введения цисплатина предпочтительней внутривенного, поскольку патоморфоз III-IV степени отмечен в 81% наблюдений против 49%, а частота местных рецидивов составила 9% против 27%.
- При низкой эффективности индукционной химиотерапии доксорубицином и цисплатином включение в адъювантную химиотерапию комбинации ифосфамид – этопозид позволило повысить общую и безрецидивную пятилетнюю выживаемость до 68% и 29% соответственно.
- Активная хирургическая тактика в отношении отдаленных метастазов в условиях современной многокомпонентной химиотерапии позволила увеличить медиану выживаемости при остеосаркоме IIIB стадии до 24 мес.
- Непосредственные и отдаленные результаты программы НЕО-2 лучше, чем в предыдущих протоколах и соответствуют современным стандартам.
- Факторами, достоверно предсказывающими эффект предоперационного лечения до его начала, являлись стадия, объем и темп роста опухоли, индекс пролиферации опухолевых клеток, зоны некрозов и кровоизлияний и ЩФ.
- Оценка риска прогрессирования при остеосаркоме возможна при уста-
новлении диагноза. При однофакторном анализе достоверно информативными оказались стадия, клиническая картина, объем и темп роста опухоли, индекс пролиферации опухолевых клеток и ЩФ. В многофакторную модель прогнозирования степени риска вошли стадия, объем и темп роста опухоли и ЩФ.
- Прогнозирование гистологического ответа возможно после 2 курсов индукционной химиотерапии и перед операцией. Критериями выраженного эффекта были клинический ответ, регрессия опухоли до 300 см3, исчезновение внекостного компонента, рентгенологический и ангиографический ответы, снижение перфузии, накопления меченых фосфатных соединений, а также нормальная ЩФ.
- Отсутствие рентгенологического ответа (выраженной или полной ассимиляции периостоза, репарации внутрикостной части, отграничения опухоли) после 2 курсов индукционной химиотерапии предсказывает высокий и крайне высокий риск прогрессирования, что требует принятия альтернативных тактических решений уже на этом этапе лечения.
- Органосохраняющее лечение остеосаркомы показано при объеме опухо-
ли до 300 см3, прогнозируемом выраженном патоморфозе и достижимой радикальности операции. В остальных случаях эти вмешательства сопряжены с высоким риском рецидива. Если удаление распространенной опухоли (>300 см3) с резекцией кости и эндопротезированием нерадикально и отсутствует выраженный патоморфоз, следует ставить вопрос об ампутации конечности.
- Критериями оценки риска после удаления опухоли являются степень регрессии, рентгенологический ответ и степень патоморфоза.
Список работ, опубликованных по диссертации
- Ploidy and proliferative activity of tumor cells for predicting response of preoperative chemotherapy in osteosarcoma (preliminary results): Proc. 7th Int. Congress on Anticancer Treatment. - Paris, 1997. - P.109 (co-authors V. Bogatyrev, V. Socolova, B. Tailakov).
- Прогресс и перспективы развития методов лечения злокачественных опухолей костей // Вестник РОНЦ. - 1998. №1, С. 7-12 (соавторы Н.Н. Трапезников, М.Д. Алиев, П.А. Синюков).
- Опыт и современные возможности лечения сарком костей: Материалы Съезда «Актуальные вопросы современной онкологии». - Бишкек, 1998. С. 302-305 (соавт. Н.Н. Трапезников, М.Д. Алиев, П.А. Синюков).
- Tumor cells DNA analysis for prediction of response to inductive chemotherapy in osteosarcoma: Proc. 17th Int. Cancer Congress. - Rio de Janeiro, 1998. - P.61 (co-authors N. Trapeznikov, M. Aliev, V. Bogatyrev).
- Prognostic significance of serum alkaline phosphatase measurements during primary chemotherapy in osteosarcoma: Proc. Combined Meeting of the American and European Musculoskeletal Tumor Societies. - Washington, 1998. - P.16 (co-authors N. Trapeznikov, M. Aliev, P. Sinyukov).
- Tumor cells DNA analysis in osteosarcoma. Correlation with clinical and histologic response after preoperative chemotherapy: Proc. Combined Meeting of the American and European Musculoskeletal Tumor Societies. - Washington, 1998. P.253 (co-authors V. Bogatyrev, V. Sokolova, Yu. Solovyev).
- DNA-flow cytometry parameters for predicting response of preoperative chemotherapy in osteosarcoma: Proc. 5th Int. Conference on the Computerized Cytology and Histology Laboratory. - Chicago, 1998. - P. 21 (co-authors V. Bogatyrev, I. Trofaila, V. Socolova).
- Современные подходы и перспективы в лечении остеосаркомы: Материалы 3 Ежегодной Российской Онкологической Конференции. - Санкт-Петербург, 1999. - С. 118 (соавторы Н.Н. Трапезников, М.Д. Алиев, Ю.Н. Соловьев).
- Chimioterapie preoperatoire adaptee a la response observee precocement dans l’osteosarcome de haut degree de malignite : Proc. Journee Int. de Cancerologie de l’adolescent et de l’adult jeune. - Paris, 1999. - P.18-19 (co-authors P. Sinyukov, V. Teplyakov, T. Charatishvili).
- Новый режим неоадъювантного лечения первичных сарком костей высокой степени злокачественности: Материалы I Съезда Онкологов Молдавии. - Кишинев, 2000. - С. 212 (соавторы Н.Н. Трапезников, М.Д. Алиев).
- Современные взгляды на проблему лечения остеосаркомы конечностей: Материалы 5 Всероссийского съезда онкологов «Высокие технологии в онкологии». - Казань, 2000. - том 1, С. 398-400 (соавторы Н.Н. Трапезников, М.Д. Алиев, В.А. Горбунова).
- Значение ДНК-проточной цитофлуориметрии для прогнозирования безметастатической выживаемости у больных остеосаркомой: Материалы 5 Всероссийского съезда онкологов «Высокие технологии в онкологии». - Казань, 2000. - том 1, С. 343-345 (соавторы В.Н. Богатырев В.К. Соколова П.А. Синюков).
- Комплекс алгоритмов для прогноза выживаемости больных остеогенной саркомой с помощью методов распознавания образов: Материалы 5 Всероссийского съезда онкологов «Высокие технологии в онкологии». - Казань, 2000. - том 1, С. 345-347 (соавторы О. В. Сенько А.В. Кузнецова).
- Прогноз выживаемости при некоторых солидных опухолях, основанный на оптимальном разбиении многомерного пространства иммунологических параметров // Российский журнал иммунологии. – 2000. том 5, №1. - С. 71-82 (соавторы А.В. Кузнецова, О.В. Сенько, Т.А. Федотова)
- Лечение остеосаркомы конечностей на рубеже столетий (полувековой опыт исследований) // Вестник РАМН. – 2001. - №9. - С. 46-49 (соавторы Н.Н. Трапезников, М.Д. Алиев, Ю.Н. Соловьев)
- Химиолучевая терапия локализованной остеосаркомы конечностей. Новое в онкологии: Сб. науч. тр. / Выпуск 5, Воронеж 2001. - С. 307-317 (соавторы П.А. Синюков, В.В. Тепляков, Ю.Н. Соловьев).
- Диагностика остеосарком костей // Медицинская визуализация. – 2001. №1. - С. 98-105 (соавторы Н.В. Кочергина, О.Г. Зимина, А.Б. Лукьянченко)
- Лучевая терапия в лечении костных сарком: Материалы 6 Ежегодной Российской Онкологической Конференции. - Москва, 2002. - С. 36-38 (соавторы С.И. Ткачев, А.В. Назаренко, С.М. Иванов).
- The impact of preoperative chemotherapy intensification on histological response in high-grade bone tumors // Int. Journal of Cancer. - 2002. Suppl. 13. - P.274 (co-authors V. Sokolovsky, T. Charatishvili, M. Aliev)
- Prognostic factors in localized high-grade osteosarcoma. The role of imaging techniques // Sarcoma 2002. - Volume VI, Suppl. 1. May, D49. (co-authors A.B. Lukiancenko, N.V. Kochergina, O.V. Zimina)
- Neoadjuvant chemotherapy and local radiotherapy for high-grade osteosarcoma of the extremities // Mayo Clin Proc. – 2003. – Vol. 78. - 147-155 (co-authors S. I. Tkachev, Y.N. Solovyev, P.A. Sinyukov et al.)
- Prediction of local response to preoperative treatment in osteosarcoma : Proc. EMSOS 2003. - Budapest, Hungary. - P.96-97 (co-authors Yu. Solovyev, A.V. Kuznetsova, O.V. Senko et al).
- Современная химиотерапия локализованной формы остеосаркомы // Вест-
ник РОНЦ.- 2003, №2, (дополн.1).- С. 16-28.
- Опухоли костей. Энциклопедия клинической онкологии / под ред. Акад. РАН и РАМН М.И. Давыдова, 2004.- С. 326-335 (соавторы М.Д. Алиев, Т.К. Харатишвили, С.А Хатырев).
- Сберегательные и органосохраняющие операции при злокачественных опухолях костей и мягких тканей: Пособие для врачей, изд. СПбГМУ, 2004.- С 39. (соавторы Волков О.Н., Тришкин В.А., Семиглазов В.В., Тепляков В.В., Карапетян Р.М. и др).
- Multimodal assessment of tumor response during induction chemotherapy in osteosarcoma. Correlation with tumor necrosis: Proc EMSOS 2004 Meeting. - Oslo, Norway. P.16 - (co-authors A.B. Lukiancenko, N.V. Kochergina, D. Ryjkov).
- Клинико-рентгенологические критерии оценки риска на фоне предоперационной химиотерапии остеосаркомы // Вопросы онкологии.- 2005. том 51 №3.- С. 322-327 (соавторы Кочергина Н.В., Сенько О.В., Кузнецова А.В.)
- Новый режим неоадьювантной терапии остеосаркомы. Предварительная оценка результатов лечения: Материалы VI Всероссийского съезда онкологов «Современные технологии в онкологии». - Ростов-на-Дону 2005. - том II, С. 370 (соавторы Полоцкий Б.Е., Щипахин С.А., Алиев М.Д.).
- Evaluation of risk during preoperative chemotherapy in osteosarcoma //European Journal of Cancer.- 2005 Supplements, Vol. 3.- №2, P. 346 (co-authors N.V. Kochergina, O.V. Senko, A.V. Kuznetsova et al.)
- The role of clinical and imaging criteria in the evaluation of risk during preoperative chemotherapy in osteosarcoma/ Proc. EMSOS 2005 meeting.- Trieste, Italy.- P. 106-107.
- Is it possible to evaluate the risk before and during preoperative chemotherapy in osteosarcoma: Proc. EMSOS 2006 meeting. - Moscow, Russia - P. 30 (co-authors B.I. Dolgushin N.V. Kochergina, A.D. Ryjkov M.D. Aliev A.V. Kuznetsova O.V. Senko)
- Neoadjuvant chemotherapy protocol without high-dose methotrexate in osteosarcoma: Proc. EMSOS 2006 meeting. - Moscow, Russia. - P.34 (co-authors V.A. Sokolovsky E.E. Kovalevsky M.D. Aliev).
- Intravenous versus intra-arterial chemotherapy in osteosarcoma of the extremities: Proc. EMSOS 2006 meeting. - Moscow, Russia.- P. 34 (co-authors Iu. N. Solovyev, V.A. Sokolovsky M.D. Aliev).
- Новые возможности индивидуализации лечения больных остеосаркомой: Материалы IV съезда онкологов и радиологов стран СНГ. - Баку, Азербайджан, 2006. - С. 193 (соавторы Н.В. Кочергина О.В. Сенько А.В. Кузнецова Е.Е. Ковалевский М.Д. Алиев).
- Опыт лечения больных с генерализованной остеосаркомой: Материалы IV
съезда онкологов и радиологов стран СНГ. - Баку, Азербайджан, 2006. - С. 194
(соавторы Б.Е. Полоцкий М.Д. Алиев).
- Факторы риска при хирургических вмешательствах у больных остеосаркомой конечностей: Материалы IV съезда онкологов и радиологов стран СНГ. - Баку, Азербайджан, 2006. - С. 194 (соавторы О.В. Сенько А.В. Кузнецова М.Д. Алиев).
- Сравнительный анализ внутривенной и регионарной химиотерапии в лечении больных остеосаркомой: Материалы IV съезда онкологов и радиологов стран СНГ. - Баку, Азербайджан, 2006. - С. 194 (соавторы Ю.Н. Соловьев Б.И. Долгушин Э.Р. Виршке М.Д. Алиев).
Список сокращений
БРВ – безрецидивная выживаемость
ИДНК – индекс ДНК
ИП – индекс пролиферации
КТ – компьютерная томография
МРТ – магнитно-резонансная томография
ОВ – общая выживаемость
ПЦ – проточная цитофлуорометрия
ПЭ – полный эффект
ПЭТ – позитронная эмиссионная томография
РФП – радиофармпрепарат
С – специфичность
УЗИ – ультразвуковое исследование
Ч – чувствительность
ЧЭ – частичный эффект
ЩФ – щелочная фосфатаза
n – число больных
р – достоверность различий

