Модуляция метастатической активности клеток сирийского хомяка экзогенными онкогенами семейства ras
На правах рукописи
МАРТЫНЮК АННА ВАСИЛЬЕВНА
Модуляция метастатической активности клеток сирийского хомяка экзогенными онкогенами семейства Ras
14.00.14 - онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
МОСКВА - 2006
Работа выполнена в ГУ Российский Онкологический научный центр им.Н.Н.Блохина Российской академии медицинских наук
Научные руководители:
кандидат биологических наук Елена Максимовна Чевкина
доктор биологических наук, профессор
Официальные оппоненты:
доктор биологических наук, профессор,
заслуженный деятель науки РФ Богуш Татьяна Анатольевна
доктор биологических наук Калинина Наталья Олеговна
Ведущая организация:
Институт биоорганической химии им. М.М.Шемякина и Ю.А.Овчинникова РАН
Защита диссертации состоится “__”___ _2006 г.
в часов на заседании Специализированного Совета (К.001.17.01)
ГУ РОНЦ им. Н.Н. Блохина РАМН по адресу 115478, г. Москва, Каширское шоссе, д.24.
С диссертацией можно ознакомиться в библиотеке ГУ РОНЦ им. Н.Н. Блохина РАМН.
Автореферат разослан “ ” 2006 г.
Ученый секретарь
специализированного диссертационного совета
доктор медицинских наук, профессор Ю.А. Барсуков
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
1.1 Актуальность проблемы
Метастазирование – одно из опаснейших свойств злокачественных опухолей, являющееся основной причиной смертности от онкологических заболеваний.
Способность клетки к метастазированию - это результат отбора в популяции опухолевых клеток в процессе опухолевой прогрессии. Клетки должны приобрести способность выжить в условиях гипоксии, прорасти опухолевую массу, кровеносные и/или лимфатические сосуды, выйти в кровеносное русло, избежать гибели от иммунного ответа, прикрепиться к ткани во вторичном очаге и сформировать вторичный опухолевый узел.
На сегодняшний день имеется огромное количество данных о молекулярных механизмах отдельных составляющих этого процесса, однако они в значительной степени противоречивы. В этой связи особенно актуальным представляется использование биологических моделей, позволяющих изучать метастазирование как комплексный физиологический феномен in vivo.
Чрезвычайно перспективным представляется изучение клеточных линий одного происхождения, но с различным метастатическим потенциалом. Одной из таких моделей является коллекция клеточных линий эмбриональных фибробластов сирийского хомяка (Mesocricetus auratus Waterh), трансформированных вирусом cаркомы Рауса и спонтанно трансформированных in vitro. Особенно актуальна возможность исследования метастазирования in vivo на иммунокомпетентных животных.
В изучении метастазирования большую роль играет выявление механизмов, определяющих опухолевую прогрессию.
Гены, кодирующие белки Ras, мутируют в 15% всех типов человеческих опухолей, при этом в большинстве опухолей обнаружены мутации только в одном из генов семейства Ras (Almoguera C. et al., 1988).
В настоящее время накопилось большое число работ, посвященных роли Ha-Ras в злокачественной трансформации клеток. Однако механизм его влияния на метастазирование до сих пор не ясен.
Более того, конкретные механизмы и роль отдельных эффекторов Ha-Ras в метастазировании варьируют в зависимости от используемых моделей. Получение разных результатов в разных моделях может зависеть от тканеспецифичности, видоспецифичности используемых моделей, а также от того, какой именно ген Ras использовался для модуляции метастазирования.
Вместе с тем, согласно литературным данным, среди представителей семейства Ras на метастазирование в наибольшей мере влияет Ha-Ras (Maruyama C. et al., 2001; Moon A. et al., 2000; Schlatter B. et al., 1992).
Настоящее исследование позволило углубить знания о механизмах канцерогенеза, вклада Ha-ras- и Ral- ассоциированных сигнальных путей в формирование метастатического потенциала клетки.
1.2 Цель и задачи исследования
Целью данной работы является анализ влияния Ha-ras на метастатическую активность трансформированных фибробластов сирийского хомяка и идентификация сигнальных путей, осуществляющих это влияние.
В соответствии с указанной целью были поставлены следующие экспериментальные задачи:
1. Трансфекция низкометастазирующих RSV (Rоus Sarcoma Virus)-трансформированных фибробластов сирийского эффекторными хомяка мутантными вариантами активированного Ha-ras (Ha-rasV12, Ha-rasV12G37, Ha-rasV12S35, Ha-rasV12C40) и сравнительный анализ метастатической активности полученных трансфектантов.
2. Трансфекция спонтанно трансформированных и RSV-трансформированных линий фибробластов хомяка активной формой RalA. Трансфекция высокометастазирующих спонтанно трансформированных и RSV-трансформированных линий фибробластов хомяка доминантно негативной формой RalA. Сравнительный анализ метастатической активности полученных линий.
4. Cравнительный анализ молекулярно-биологических характеристик полученных линий: подвижности клеток, скорости пролиферации, способности к инвазии in vitro и колониеобразования.
5. Определение в полученой панели клеточных линий экспрессии белков S100А4, фосфо-паксилина, Erk1/Erk2, циклина D1.
6. Определение уровня секреции матриксных металлопротеиназ в исследуемых клеточных линиях.
7. Определение устойчивости исследуемых клеточных линий к перекиси водорода а также способности катаболизировать перекись водорода.
1.3 Научная новизна
Предыдущие исследования влияния Ha-Ras на метастатический потенциал клеток показали, что в мышиных клетках основным звеном, опосредующим вклад Ha-Ras в метастазирование, является Raf киназа (Cowley S. et al., 1994).
В данной работе впервые показано, что активация онкогена Ha-ras существенно увеличивает метастатическую активность RSV-трансформированных фибробластов сирийского хомяка, причем основной вклад вносит Ha-ras/Ral-GDS/Ral-ассоциированный сигнальный путь.
Показано, что в клетках сирийского хомяка стимуляция Raf-ассоциированного сигнального пути не приводит к увеличению метастатической активности.
Обнаружено, что экспрессия конститутивно активной формы RalA достоверно увеличивает метастатическую активность как вирус-трансформированных, так и спонтанно трансформированных линий эмбриональных фибробластов хомяка.
Впервые показано, что приобретение высокометастатического фенотипа в ходе селекции RSV-трансформированных клеток in vivo ассоциировано с увеличением количества активной формы RalA.
Показано отсутствие зависимости между метастатическим потенциалом исследуемых клеток и уровнем активности матриксных металлопротеиназ 1, 2 и 9 типов. При этом обнаружено, что экспрессия экзогенной активной формы RalA приводит к снижению уровня экспрессии исследуемых металлопротеиназ.
Показано, что метастатическая активность клеток коррелирует с устойчивостью клеток к перекиси водорода.
Получена уникальная модельная система клеточных культур, экспрессирующих экзогенные последовательности различных мутантных вариантов белков Ha-Ras и RalA, и отличающиеся по метастатическим характеристикам in vivo. На данной модели показана возможность обратимой регуляции метастазирования. Дальнейшие эксперименты с полученными линиями позволят пролить свет на механизмы реализации Ha-Ras- и RalA- опосредованной модуляции метастазирования в клетках RSV-трансформированных и спонтанно трансформированных фибробластов сирийского хомяка.
1.4. Научно - практическая значимость работы
Научно - практическая значимость полученных результатов состоит в том, что на экспериментальной модельной системе была определена роль генов Ha-ras и RalA в метастазировании и выявлен ряд механизмов, ассоциированных с опухолевой прогрессией. Лучшее понимание механизмов метастазирования позволит в дельнейшем разработать стратегию производства новых лекарственных препаратов для лечения онкологических заболеваний и выявить специализированные маркеры, ассоциированные с метастазированием.
Кроме того, существенное значение имеет получение экспериментальной модели, позволяющей обратимо регулировать уровень метастатической активности клеток.
1.5. Апробация работы
Диссертационная работа была доложена 30 сентября 2005 года на совместной конференции лабораторий регуляции клеточных и вирусных онкогенов, молекулярной биологии вирусов, иммунологии онкогенных вирусов, цитогенетики, генетики опухолевых клеток НИИ Канцерогенеза ГУ РОНЦ им. Н.Н. Блохина РАМН.
Материалы работы были доложены на симпозиуме «Рак, СПИД и родственные проблемы», Санкт-Петербург, 2003, конференции Molecular Mechanisms in Signal Transduction and Cancer, Greece, 2005.
По теме диссертации опубликовано 3 печатных работы.
1.6. Структура и объем работы
Диссертация состоит из введения, обзора литературы, описания использованных материалов и методов, изложения собственных результатов, обсуждения результатов, выводов и списка литературы. Материалы диссертации изложены на 125 страницах машинописного текста, включают 26 рисунков, 12 таблиц и список литературы из 249 источников.
2. Содержание работы
2.1. Обзор литературы
Обзор литературы посвящен обобщению данных о роли ГТФаз семейства Ras в прогрессии опухолей и метастазировании. Описаны известные молекулярно-генетические механизмы различных процессов, сопряженных с метастазированием.
2.2. Материалы и методы исследования
В работе были использованы следующие методы исследования: трансформация бактериальных клеток, выделение и анализ плазмидной ДНК из бактериальных клеток, электрофорез нуклеиновых кислот, трансфекция, лентивирусная и ретровирусная инфекция клеток млекопитающих, выделение и анализ белковых фракций клеток млекопитающих (иммуноблотинг), иммунопреципитация активной формы ГТФазы RalA, желатиназная зимография в ПААГ, а также определение отдельных свойств клеток в культуре, таких как динамика роста, интенсивность катаболизации перекиси водорода in vitro, устойчивость к перекиси водорода, скорость миграции в рану в монослое (wound healing assay), способность к инвазии in vitro, колониеобразование, анализ туморогенности, спонтанной и экспериментальной метастатической активности (СМА и ЭМА). Статистическая обработка результатов осуществлялась с помощью пакета статистических программ GraphPad Prism ver.4.0. Для сравнения двух групп использовался двухсторонний критерий Стьюдента с поправкой Ньюмана-Кейлса, для сравнения нескольких групп использовался дисперсионный анализ (ANOVA) с поправкой Даннетта.
В качестве экспериментальной модели для данного исследования использовались линии эмбриональных фибробластов сирийского хомяка, трансформированные штаммом Шмидт-Руппин D вируса саркомы Рауса и спонтанно трансформированные in vitro. Эти линии были получены в лаборатории противоопухолевого иммунитета РОНЦ РАМН под руководством д.м.н. Г.И. Дейчман (Deichmann G.I. et al, 1989). В работе были использованы следующие родительские линии:
HET-SR – RSV-трансформированные клетки, высокая ЭМА, низкая СМА.
HET-SR8 - RSV-трансформированные клетки, высокая ЭМА, высокая СМА.
HET-SR2SC – производная линии клеток HET-SR, полученная в процессе селекции in vivo. Высокая ЭМА, высокая СМА. Для ее получения клетки линии HET-SR вводили животным подкожно, после образования первичной опухоли отбирали клетки из метастазов в лимфоузлы, снова вводили подкожно и из метастазов в региональные лимфоузлы получили данную линию.
STHE - спонтанно трансформированные в культуре in vitro клеткиэмбриональных фибробластов хомяка, низкая ЭМА, низкая СМА.
STHE83/20 – производная линии STHE, полученная в процессе селекции in vivo. Получена из легочных метастазов, образовавшихся через 20 дней после внутривенного (внутриорбитального) введения клеток STHE. Высокая ЭМА, высокая СМА.
STHELNM8 – производная линии STHE, полученная из метастаза в легком, образовавшегося через 50 дней после подкожной инъекции клеток STHE. Высокий уровень метастатической активности по тестам ЭМА и СМА.
Метастатическая активность исследуемых клеточных линий оценивалась путём подсчета количества метастазов в легких, возникших после введения исследуемых клеток сирийским хомякам. При этом различали спонтанную и экспериментальную метастатическую активность (СМА и ЭМА). Экспериментальную метастатическую активность оценивали через 24 дня после внутривенного (внутриорбитального) введения клеток путем подсчета количества легочных метастазов. В каждой серии экспериментов для анализа одной клеточной линии использовали 10 животных. Для изучения спонтанной метастатической активности клетки вводили хомякам подкожно. Первичные опухоли появлялись в течение месяца. Через 2 месяца после инъекции подсчитывали количество легочных метастазов. Туморогенную активность опухолевых клеток определяли методом количественного трансплантационного теста.
Для трансфекции клеток и получения новых векторов использовались последовательности мутантных форм онкогена Ha-Ras, любезно предоставленные проф. Дж.Донвардом, (Imperial Cancer Research Fund, UK). Мутантные последовательности гена RalА были любезно предоставлены др. Койде (Kanazawa University, Japan) и др. Ямазаки (Yamazaki Y. et al., 2001).
2.3. Результаты исследования и их обсуждение
2.3.1.1 Ha-Ras - зависимая модуляция метастатической активности RSV-трансформированных фибробластов хомяка
Нами была поставлена задача – исследовать влияние онкогена Ha-Ras на метастатический потенциал клеток данной экспериментальной модели. Для этого мы использовали последовательность Ha-rasV12, которая кодирует конститутивно-активный (постоянно связанный с ГТФ) белок. Мутант Ha-RasV12 способен связываться со всеми эффекторами, в том числе и c тремя основными: Raf, PI3K и Ral-GDS.
Последовательность мутантной формы Ha-rasV12 в ретровирусном векторе pLXSN была трансфицирована в клетки низкометастатической по СМА тесту RSV-трансформированной линии HET-SR.
Клетки HET-SRHa-Ras V12 мы тестировали на уровень СМА. Метастатическая активность здесь и далее приводится в виде среднего значения количества метастазов в легких на одно животное (). Суперэкспрессия Ha-Ras V12 в клетках HET-SR вызвало увеличение СМА с =1,7 (контроль, трансфекция пустого вектора pLXSN) до =107,2. Можно заключить, что активированная форма Ha-Ras значительно усиливает метастатическую активность исследуемой линии.
Полученные в результате контрольной трансфекции пустым вектором клетки HET-SRpLXSN достоверно не отличались от родительских клеток HET-SR по уровню СМА: =1,7 и =7 (p < 0.01).
Для идентификации Ras-ассоциированных сигнальных путей, опосредующих его способность к стимуляции метастазирования, мы использовали так называемые эффекторные мутанты активированного Ha-rasV12. Они обладают свойством избирательного связывания с эффекторами благодаря точечным аминокислотным заменам в эффекторном домене белка Ha-RasV12 (Yamazaki Y. et al., 2001). Такие дефектные белки не способны к связыванию двух из трех основных (Raf, PI3K, RalGDS) эффекторов Ras. Введение в клетки конструктов, экспрессирующих такие последовательности, активирует лишь те сигнальные пути, которые проходят через «неблокированные» эффекторы Ras.
Так, V12Ha-RasS35 взаимодействует только с белком Raf, индуцируя Raf-MAPK-ERK1/2 сигнальный каскад; V12Ha-RasC40 активирует PI3K-PKB сигнальный путь; V12Ha-RasG37 связывается только с RalGDS, активируя RalGDS-Ral зависимый путь.
Последовательности данных мутантных форм Ha-ras были трансфицированы в исходную линию HET-SR с последующим анализом СМА отобранных трансфектантов (см. рис. 1). Введение Ha-rasV12S35, как и введение Ha-rasV12C40, достоверно не повысило СМА, (=1,8 и =1,0 соответственно). В линии HET-SRHa-rasV12G37, как и в линии HET-SRHa-RasV12, метастазирование значимо отличалось от контрольной группы (=107,2 и =111,8 ).

Рисунок 1. СМА Ha-ras-трансфектантов линии HET-SR. – среднее значение количества метастазов в легких на одного хомяка.
Для контроля экспрессии вектора в отобранных клеточных линиях методом Вестерн блот анализа была проверена экспрессия Ha-Ras белка во всех трансфектантах. Наблюдалось увеличение количества соответствующего белкового продукта по сравнению с контрольной линией во всех клетках, содержащих экзогенные Ha-ras последовательности, в том числе и в тех, которые не изменили своей метастатической активности (cм. рис. 2).

1 2 3 4 5
Рисунок 2. Экспрессия белка Ha-Ras в Ha-ras-производных линии HET-SR
Поскольку Ha-rasV12G37 мутант преимущественно активирует Ral-GDS, можно сделать вывод, что в данной модели именно Ral-GDS является ключевым эффектором, опосредующим влияние Ras на метастатическую активность.
2.3.1.2 Супрессия метастатической активности клеток введением доминантно негативной мутантной формы RalА
Ral-GDS является фактором обмена нуклеотидов и, следовательно, положительным регулятором для малых ГТФаз Ral. Мы предположили, что именно RalA является следующим звеном в Ha-ras - Ral-GDS – зависимой цепи передачи сигналов, задействованным в регуляции метастазирования. Для проверки этого предположения была сделана попытка компенсировать повышение метастазирования в линии HET-SR Ha-ras V12G37 введением RalAS28N, доминантно негативной формы RalА.
Полученная в результате лентивирусной инфекции клеточная линия - НET-SRHa-rasV12G37-RalAS28N была протестирована на уровень СМА. Метастатическая активность после введения RalAS28N упала с уровня родительской линии (=111,8) практически до уровня контрольной линии HET-SR (=7). То есть блокирование Ral в Ha-Ras-Ral-DGS сигнальном пути привело к редукции метастазирования до уровня исходных клеток HET-SR. Таким образом, можно заключить, что Ral действительно является основным эффектором Ral-GDS, ассоциированым с метастазированием.
Далее мы предприняли попытку аналогичного подавления метастазирования введением доминантно негативного мутанта RalAS28N в клетки HET-SRHa-rasV12, экспрессирующие конститутивно активный мутант Ha-ras. Тестирование СМА полученной клеточной линии HET-SRHa-RasV12RalAS28N показало, что в этом случае метастатическая активность уменьшилась, с =110 до =61, но статистически значимых различий между группами не было выявлено. То есть, в отличие от полного подавления метастазирования при введении RalAS28N в клетки HET-SRHa-rasV12G37, в которых стимулирован Ha-Ras-Ral-GDS сигнальный путь, в случае аналогичного введения RalAS28N в клетки HET-SRHa-ras V12, значимой супрессии метастазирования не происходит.
Следовательно, повышение метастатического потенциала, обусловленное введением мутанта Ha-rasV12, может быть результатом действия не только RalА. Поскольку введение Ha-RasV12C40 и Ha-rasV12S35 по отдельности не стимулировало СМА линии HET-SR, можно предположить, что эффект стимуляции метастазирования экспрессией Ha-RasV12 может быть вызван также и суммарным кумулятивным эффектом Ha-RasV12C40 и Ha-rasV12S35. Чтобы подтвердить эту гипотезу, мы провели трансфекцию Ha-RasV12C40 в линию HET-SRHa-ras V12S35.
Получившаяся линия HET-SRHa-rasV12S35-С40 обладала уровнем СМА =80, что, с одной стороны, достоверно не отличается от уровня СМА клеточной линии HET-SRHa-rasV12, с другой стороны, достоверно больше уровней линий HET-SR Ha-rasV12S35 и HET-SRHa-rasV12С40.
Таким образом, одновременная стимуляция путей, ведущих от Ha-Ras к Raf1 и PI3K, достоверно повышает метастатическую активность клеток HET-SR – с =1,7 до =80, причем сопоставимо с увеличением СМА (с =1,7 до =111,8), вызванным стимуляцией одного Ral-GDS пути. Следовательно, суммарный эффект стимулированных Raf1 и PI3K- ассоциированных путей вносит ощутимый и сопоставимый с Ral-GDS вклад в положительную регуляцию метастазирования. Существенно отметить, что в данном случае в линии HET-SRHa-rasV12S35-С40 экспрессируется две копии экзогенных активированных мутантов Ha-ras. Возможно, увеличение метастатической активности вызвано в том числе и увеличением общего количества активного продукта Ras, что, предположительно, может увеличивать количество задействованных в метастазировании активных мишеней Ras.
Поскольку линия НET-SR обладает исходно высокими показателями ЭМА, мы проверили, возможна ли супрессия и этого показателя уровня метастазирования введением доминантно негативной формы RalA.
Для этого мы инфицировали клетки линии НET-SR лентивирусом, экспрессирующим RalAS28N. Полученная линия клеток НET-SRRalAS28N была проверена на ЭМА. Значение ЭМА полученной линии НET-SRRalAS28N резко и достоверно понизилась с =350 до =16 (р<0,01). Следовательно, подавление эндогенного RalA критически сказывается на ЭМА клеток.
Следующим этапом было исследование вовлеченности эндогенного RalA в процесс стимуляции метастазирования в ходе селекции клеток in vivo. Для этого мы сравнили количество активной формы RalA в клетках родительской клеточной линии НET-SR и в высокометастазирующей линии HET-SR2SC, полученной путем селекции in vivo. В качестве потенциального контроля была использована высокометастазирующая клеточная линия HET-SRHa-rasV12G37, в которой стимулирован Ral-GDS сигнальный путь и, значит, можно ожидать повышения количества активной формы RalA (см. рис. 3).
1 2 3
Рисунок 3. Анализ экспрессии белка RalA в исследуемых линиях.
А) общий уровень RalA, Б) активная форма RalA
Анализ проводился методом “pull down assay” с использованием коммерческого набора реактивов фирмы “Upstate”. Метод основан на иммунопреципитации активной формы RalA c его эффектором - белком RalBP1. Паралельно был проведен анализ тотального уровня белка RalA в исследуемых клеточных линиях методом Вестерн блот анализа с использованием антител к RalA.
В результате показано, что при равном уровне экспрессии тотального белка RalA, в культурах HET-SRHa-rasV12G37 и HET-SR2SC уровень продукции активного RalA выше, чем в линии HET-SR. Этот факт свидетельствует о том, что, во-первых, введение мутанта Ha-rasV12G37 действительно стимулирует активность RalA в клетках, и, во-вторых, в ходе селекции in vivo в линии HET-SR2SC, параллельно с увеличением метастатической активности, активировался эндогенный RalA.
Чтобы проверить, насколько метастатическая активность клеточной линии HET-SR2SC зависит от эндогенного RalA, мы инфицировали эти клетки стоком лентивирусов, содержащих последовательность доминантно негативного мутанта RalA. Линия HET-SR2SCRalAS28N продемонстрировала существенное снижение обоих показателей ЭМА с =538 до =17,2 (p< 0,01), СМА с =144 до =4,4( р<0.001,) см. рис. 4.
Из этого можно заключить, что RalA играет принципиальную роль в возникновении высокометастатического фенотипа в ходе селекции in vivo.
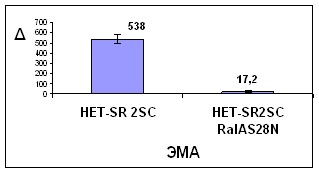

Рисунок 4. Супрессия спонтанной и экспериментальной метастатической активности линии HET-SR2SC после введения доминантно негативного мутанта RalA.
Для выяснения универсальности влияния RalA на метастазирование в рамках данной модели мы провели аналогичные эксперименты на других высокометастазирующих клеточных линиях.
Так, изначально высокометастазирующая RSV-трансформированная клеточная линия HET-SR8 была инфицирована доминантно негативным мутантом RalA. В полученой линии HET-SR8RalAS28N по сравнению с родительской HET-SR8 принципиально снизились как СМА (с =130 до =5), так и ЭМА (с =300 до =5, 6) (см. табл. 1).
Аналогичный опыт был проведен и на спонтанно трансформированных фибробластах. Для этого использовались клетки, приобретшие высокометастатический фенотип в тестах СМА и ЭМА в результате селекции in vivo. STHE83/20 были получены из легочных метастазов, образовавшихся через 20 дней после внутриорбитального введения клеток STHE, а STHELNM8 - из метастаза в легком, образовавшегося через 50 дней после подкожной инъекции STHE, то есть линия STHELNM8 прошла более жесткую селекцию на животных. В производных клеточных линиях метастатическая активность снизилась по сравнению с родительскими линиями. Так, в линии STHE83/20RalAS28N по сравнению с родительской STHE83/20 снизилась и СМА (с =125 до =11,4), и ЭМА (с =100 до =13,8). В то же время, в линии STHELNM8RalAS28N мы обнаружили менее выраженную тенденцию к снижению СМА (с =180 до =15) и ЭМА (с =200 до = 88) (см. табл. 1). Возможно, что частичное снижение метастатической активности в случае STHE-MLN8 после введения RalAS28N связано с тем, что эта линия прошла более глубокий отбор in vivo по сравнению с STHE83/20.
Таблица 1
| Клеточные линии | СМА | ЭМА |
| HET-SR8 | 130 | 300 |
| HET-SR8RalAS28N | 5 | 5, 6 |
| STHE83/20 | 125 | 100 |
| STHE83/20 RalAS28N | 11,4 | 13,8 |
| STHELNM8 | 180 | 200 |
| STHELNM8RalAS28N | 15 | 88 |
Суммируя вышеизложенное, можно заключить, что Ha-Ras значительно увеличивает метастатический потенциал клеток. При этом основным Ha-Ras-ассоциированным сигнальным путем, вовлеченным в стимуляцию метастазирования, является Ral-GDS/RalA путь. Подавление активности RalA сказывается на способности к метастазированию всех исследованных линий. В ходе селекции клеток in vivo, приводящей к увеличению метастатической активности, активность эндогенного RalА увеличивается.
2.3.1.3 RalA зависимая индукция метастазирования
Основываясь на результатах экспериментов по снижению метастатической активности с помощью доминантно негативной формы RalA, мы решили исследовать влияние активности RalA на метастатический потенциал путем прямого эксперимента. Для этого мы использовали активированный (постоянно связанный с ГТФ) мутант - RalAG23V.
Мы провели трансфекцию вектора pLXSN-RalA-G23V в клетки HET-SR. Полученная клеточная линия HET-SRRalAG23V была проверена на уровень СМА. Показано, что введение активной формы RalA достоверно повышает СМА линии НET-SR с =7 до = 145. Аналогичный опыт по введению активированного мутанта RalA был проведен на низкометастазирующей как по СМА, так и по ЭМА линии спонтанно трансформированных фибробластов STHE. Полученная линия STHЕ RalA-G23V была протестирована на ЭМА и СМА. Значение ЭМА существенно выросло (с =6,9 до > 500), показатель СМА также достоверно вырос с =3,8 до =14, 3 (см. табл. 2).
Таблица 2
| Клеточные линии | СМА | ЭМА |
| STHE | 3,8 | 6,9 |
| STHE RalAG23V | 14,3 | > 500 |
Таким образом, мы можем заключить, что RalA усиливает метастатический потенциал как RSV-трансформированных, так и спонтанно трансформированных фибробластов. Все полученные клеточные линии были проверены на туморогенность. Статистических изменений среди полученных производных линий по этому параметру не было зафиксировано (ANOVA, p<0,01).
В результате всех вышеописанных экспериментов изначальная панель клеток, содержащая Раус-трансформированные и спонтанно трансформированные фибробласты с разным уровнем СМА и ЭМА, была существенно расширена за счет Ha-Ras и RalA трансфектантов.
2.3.2.2 Характеристика полученных культур in vitro
2.3.2.2.1 Динамика роста клеток
Скорость пролиферации клеток является важной характеристикой для любой клеточной линии в экспериментальных моделях. Этот показатель может непосредственно влиять на туморогенность и метастатическую активность клеток in vivo.
Анализ проводился путем подсчета клеток в камере Горяева через равные промежутки времени. Линии HET-SRHa-rasV12S35 и HET-SRHa-rasV12SC40 показали большую скорость пролиферации, чем родительская линия. Среди остальных линий достоверных отличий выявлено не было. Мы можем утверждать, что в данной модели метастатическая активность не зависит от скорости пролиферации, так как ни в одной линии, обладающей высоким потенциалом метастазирования, как исходным, так и индуцированным Ha-Ras и RalA, скорость пролиферации по сравнению с контрольными линиями не увеличилась.
2.3.2.2.2. Анализ способности клеток к образованию колоний
Способность к образованию колоний в условиях отсутствия межклеточных взаимодействий - важная характеристика культуры. Таким образом искусственно моделируется процесс некоторых стадий образования метастазов.
Полученная нами панель клеток была тестирована на способность образовывать колонии на чашках Петри (см. табл. 3).
Таблица 3.
| Клеточные линии | Количество колоний | Размер колоний |
| HET-SRрLXSN | 50 | 10 клеток |
| HET-SRHa-Ras V12 | > 50 | > 10 клеток |
| HET-SRHa-ras V12S35 | > 50 | > 40 клеток |
| HET-SRHa-ras V12G37 | >100 | > 40 клеток |
| HET-SRHa-ras V12C40 | > 200 | > 40 клеток |
| HET-SR RalAG23V | >50 | > 10 клеток |
| HET-SRRalAS28N | > 100 | > 10 клеток |
| HET-SR -2SC | 50 | 10 клеток |
| HET-SR -2SC RalAS28N | > 50 | > 10 клеток |
Как видно из таблицы, наиболее значительно увеличила способность к образованию колоний линия Ha-rasV12C40. Стимуляция Ral-ассоциированного сигнального пути в клетках HET-SRHa-ras V12G37 также увеличивает способность к образованию колоний. Введение как активной, так и доминантно негативной формы RalA приводит к незначительному увеличению этого показателя.
Стоит отметить, что отличалось не только количество колоний, но и их размер (см. рис. 5).


1 2
Рисунок 5. Колонии, образованные клеточными линииями HET-SRрLXSN (1), HET-SRHa-ras V12S35 (2).
Так, все мутанты Ha-Ras в той или иной степени вызвали увеличение размера колоний. Линии, трансфицированные мутантами Ha-rasV12C40 и Ha-rasV12C S35, значительно увеличили размер колоний, что возможно связано с повышенной пролиферативной активностью этих клеток. Введение активной формы RalA также приводит к увеличению размера колоний по сравнению с родительской линией. Высокометастазирующие линии HET-SRHa-rasV12G37 и HET-SRRalAG23V, по-видимому, увеличили размер колоний независимо от скорости деления, так как их пролиферативная активность не отличалась от родительской линии HET-SR.
2.3.2.2.3. Анализ подвижности клеток
Скорость миграции клеток в «рану» - важный параметр, позволяющий оценить подвижность клеток и их способность к миграции in vitro. Подвижность клеток определялась скоростью миграции клеток в «рану» в монослое. Эксперимент проводился с добавлением в среду антибиотика митомицина С, который позволяет нивелировать влияние различия в скорости деления клеток на скорость зарастания раны путем блокировки деления клеток.
Среди Ha-Ras трансфектантов линии HET-SR клетки линий HET-SRHa-rasV12S35 и HET-SRHa-rasV12C40 наиболее значительно увеличили скорость зарастания по сравнению с родительской линией. (см. рис. 6). Введение доминантно негативной формы RalA в линию HET-SR существенно усиливало миграцию, в то время как введение конститутивно-активной формы RalA принципиально не влияет на миграцию. Высокометастатическая линия HET-SR2SC не изменила скорость зарастания «раны», будучи трансфицированна доминантно негативной формой RalA.
Таким образом, введение доминантно негативной формы RalA подавляет метастазирование, однако по разному влияет на скорость зарастания раны линий HET-SR и HET-SR2SC, тогда как конститутивно-активная форма этого белка усиливает метастатическую активность, но не влияет на зарастание «раны».


1 2
Рисунок 6. Динамика зарастания раны. Контуром обозначена первоначальная граница раны. 1- HET-SRрLXSN, 2- HET-SRHa-ras V12S35
В исследуемой модели не выявлено прямой связи между метастатической активностью и скоростью миграции клеток в «рану». Предположительно, в данной модели миграция не является сопряженной с метастазированием характеристикой.
2.3.2.2.4. Анализ секреции матриксных металлопротеиназ
В нашей работе был проведен анализ продукции секретируемых металлопротеиназ, способных расщеплять желатин - металлопротеиназ 1, 2 и 9 типов. В первую очередь были протестированы Ha-Ras производные линии HET-SR. Результаты желатиназной зимографии представлены на рис. 7.
1 2 3 4 5

Рисунок 7. Анализ активности секретируемых металлопротеиназ в Ha-Ras производных линии HET-SR.
Как показал эксперимент, активность MMP2 практически не меняется в исследованной панели линий за исключением низкометастазирующих линий HET-SR Ha-rasV12S35 и HET-SR Ha-rasV12С40, в которых ее активность несколько повышена. При этом MMP2 является самой активной из трех выявленных металлопротеиназ. Фактически, ее активность никак не коррелирует с данными по метастазированию. Более интересна ситуация с MMP9. Ее экспрессия не отмечена в низкометастазирующей линии HET-SR, но при этом она появляется во всех Ha-Ras трансфектантах этой линии. Последняя металлопротеиназа, выявленная нами при анализе желатиназной активности, MMP1, практически не меняет уровень экспрессии в Ha-Ras трансфектантах HET-SR. Таким образом, можно проследить корреляцию между активностью MMP9 и введением Ha-Ras в линию HET-SR. Аналогичный опыт был поставлен на RalA трансфектантах, при этом были проанализированы линии HET-SR2SC и HET-SR2SC RalAS28N, HET-SR, HET-SRRalA-G23V и HET-SRRalAS28N, а так же линии STHE83/20 и STHE83/20RalAS28N. Результаты представлены на рис. 8.
1 2 3 4 5 6 7

Рисунок 8. Анализ активности секретируемых металлопротеиназ у RalA трансфектантов.
Согласно полученным данным, введение активной формы RalA в линию HET-SR вызывает редукцию экспрессии всех форм анализируемых ММР, а продукция ММР1 и вовсе прекращается. В RalAS28N-производной линии HET-SR уровень продукции всех ММР, напротив, увеличивается. При введении RalAS28N в линию STHE83/20, в которой отмечается изначальная слабая экспрессии MMP1, уровень продукции ММР не претерпевает существенных изменений. В то же время после введения доминантно негативной формы RalA в высокометастазирующую линию HET-SR2SC изначально высокий уровень продукции всех ММР2 существенно снижается, а продукция ММР1 и 9 полностью подавляется.
Эти данные позволяют заключить, что введение активного RalA понижает уровень экспресии ММР2 и угнетает экспрессию ММР1 и 9. Присутствие доминантно негативного мутанта RalA оказывает различный эффект на продукцию ММР. По-видимому, повышение продукции ММР не вовлечено в RalA индуцированное метастазирование, о чем говорит неизменный уровень продукции в HET-SR Ha-rasV12G37, в то время как в случае RalAV23G производной уровень секреции ММР понижен.
Кроме того, трансфекция доминантно негативной формы RalA оказывает разное влияние на количество секретируемых ММР в отобранных in vivo различными способами вирус-трансформированной линии HET-SR2SC и спонтанно трансформированной линии STHE83/20. Возможно, метастатическая активность линии HET-SR2SC определяется в том числе и усиленной экспрессией металлопротеиназ, и ингибирование их экспрессии коррелирует со снижением метастатической активности у HET-SR2SCRalAS28N.
Суммируя полученные результаты, мы можем утверждать, что среди исследованных нами характеристик лишь некоторые однозначно ассоциированны с метастазированием. Другие характеристики можно сгруппировать в кластеры, составленные из коррелирующих между собой признаков. Например, увеличение подвижности, скорости пролиферации, колониеобразования, наряду с повышением активности ММР, свойственны таким низкометастатическим линиям, как HET-SRHa-RasV12S35, HET-SRHa-ras V12C40, что согласуются с литературными данными о том, что активация Raf1-и PI3K-ассоциированных сигнальных путей индуцирует G(0)-->G(1)-->S этапы клеточного цикла (Mirza A.M. et al., 2004).
Многофакторность процесса метастазирования и определяет большое число сочетаний признаков, которые могут оказаться эффективными в продвижении клетки к обретению высокометастатического фенотипа.
3. ВЫВОДЫ
- Онкоген Ha-ras существенно увеличивает метастатическую активность RSV-трансформированных фибробластов сирийского хомяка. Основной вклад в Ha-ras-зависимую стимуляцию метастазирования вносит Ral-GDS/Ral-ассоциированный сигнальный путь.
- Экспрессия конститутивно активной формы RalA увеличивает спонтанную метастатическую активность низкометастазирующей RSV-трансформированной линии HET-SR, а также спонтанную и экспериментальную метастатическую активность спонтанно трансформированной линии STHE. Экспрессия доминантно негативной формы RalA приводит к подавлению как спонтанной, так и экспериментальной метастатической активности клеток.
- Приобретение высокометастатического фенотипа в ходе селекции RSV-трансформированных клеток in vivo ассоциировано с увеличением продукции активной формы RalA. Введение доминантно негативной формы RalA как в RSV- трансформированные, так и в спонтанно трансформированные клетки, прошедшие селекцию на животных, приводит к супрессии их метастатической активности.
- Отсутствует зависимость между метастатической активностью клеток, экспрессирующих различные последовательности мутантных белков Ha-ras и RalA, со скоростью их пролиферации и подвижностью. Показано, что среди эффекторов Ha-ras наибольший вклад в скорость пролиферации и подвижность клеток вносят киназы Raf1и PI3K.
- Отсутствует связь между метастатическим потенциалом исследуемых клеток и уровнем активности матриксных металлопротеиназ 1, 2 и 9 типов. Показано, что экспрессия экзогенного RalA приводит к снижению активности исследуемых металлопротеиназ.
- Метастатическая активность клеток ассоциирована с уровенем метаболизации перекиси водорода in vitro и с устойчивостью клеток к перекиси водорода.
- Стимуляция RalA сигнального пути ассоциирована со снижением уровня экспрессии S100А4 в RSV-трансформированных клетках. Экспрессия доминантно негативной формы RalA приводит к увеличению уровня фосфорилированной формы паксиллина. Уровень фосфорилирования Erk1/Erk2 не коррелирует с уровнем метастатического потенциала. Уровень экспрессии циклина D1 повышается при стимуляции Raf1и PI3K-зависимых сигнальных путей и понижается при стимуляции RalA-ассоциированного сигнального пути.
- Получена модель обратимого регулирования метастазирования с помощью стимуляции или супрессии малой ГТФазы RalA.
4. СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
1. Tchevkina E., Rodina A., Musatkina E., Martinuk A., Tatosyan A. Modulation of signal transduction protein expression in v-src-transformed cells with different level of metastatic potencial Revista de Oncologia 2002. v. 4/1,p 48-49, 17th Meet of Oncology, Granada, Spain
2. Tchevkina E., Martinuk A., Komelkov A., Tatosyan А. Ha-ras oncogene induces the metastatic ability of transformed cells in vivo through RalGDS downstream signalling pathway.European Journal of Cancer 2003, v.1, Suppl.5, p 180
3. Tchevkina E., Agapova L., Dyakova N., Martinjuk A., Komelkov A., Tatosyan A. The small G-protein RalA stimulates the metastasis of transformed cells. Oncogene, 2005 Jan 13; -24(3):329-35.

