Экспериментальные подходы к повышению эффективности gm-csf-секретирующей цельноклеточной противоопухолевой вакцины
На правах рукописи
МАНИНА ИРИНА ВЛАДИМИРОВНА
Экспериментальные подходы к повышению эффективности GM-CSF-секретирующей цельноклеточной противоопухолевой вакцины
Специальность: 14.01.12 – онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
МОСКВА
2010
Работа выполнена в Учреждении Российской академии медицинских наук Российском Онкологическом Научном Центре имени Н.Н. Блохина РАМН
(директор – академик РАН и РАМН, профессор М.И. Давыдов)
Научные руководители:
доктор медицинских наук
Козлов Алексей Михайлович
кандидат медицинский наук
Михайлова Ирина Николаевна
Официальные оппоненты:
доктор медицинских наук, профессор
Кадагидзе Заира Григорьевна
доктор медицинских наук, профессор
Голенков Анатолий Константинович
Ведущая организация:
ФГУ Московский Научно-Исследовательский Онкологический Институт
им. П.А. Герцена Росмедтехнологий (МНИОИ им. П.А. Герцена)
Защита диссертации состоится «__» ________ 2010 г. в___часов на заседании диссертационного Совета (Д.001.017.02) Российского Онкологического Научного Центра им. Н.Н. Блохина РАМН
по адресу: 115478 Москва, Каширское шоссе, 23.
С диссертацией можно ознакомиться в библиотеке
РОНЦ им. Н.Н. Блохина РАМН.
Автореферат разослан «__» ___________ 2010 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Ю.А. Барсуков
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы
Из методов эффективной иммунотерапии опухолей наиболее перспективным является вакцинотерапия – введение в организм опухолевых антигенов.
Введение инактивированных опухолевых клеток больному сравнимо с введением опухолевых антигенов, так как предполагается, что после инъекции опухолевые клетки будут захвачены антиген-презентирующими клетками (АПК), процессированы и представлены в виде антигенных пептидов в комплексе с молекулами МНС. В настоящее время в научных центрах мира проходят исследования по применению противоопухолевых вакцин на основе опухолевых клеток. Для генерации более мощного иммунологического ответа опухолевые клетки трансфицируют геном, который кодирует тот или иной цитокин. Наибольшей активностью обладает GM-CSF. При использовании аллогенной вакцины решается проблема со временем и трудностью получения клеточной линии. Самый главный вопрос - это адекватность использования аллогенных опухолевых клеток для лечения и профилактики рецидивов онкологических заболеваний. Известно, что опухоль одинакового гистогенеза у одного больного будет отличаться от опухоли другого больного по спектру экспрессируемых опухолевых антигенов. Таким образом, эффективность лечения, при прочих равных условиях, будет зависеть от степени перекрывания опухолевых антигенов, экспрессирующихся на вводимой клеточной линии и опухоли самого больного, то есть повышения иммуногенности вакцины.
Опыт клинического применения GM-CSF-секретирующих вакцин из транзиторно трансфицированных аутологичных опухолевых клеток пациентов подтвердил эффективность такого вида биотерапии опухолей человека. Позитивные клинические изменения были получены у пациентов с III и IV стадией меланомы, недостаточно отвечающих на предшествующие курсы химиотерапии. Дополнительными преимуществами вакцин, секретирующих GM-CSF, оказались: хорошая переносимость и широкий интервал терапевтических доз (в сравнении с IL-2, IL-4, IL-6, IFN-).
В то же время, противоопухолевая вакцинация оказалась недостаточно эффективной в качестве самостоятельного средства терапии злокачественных новообразований. Одной из главных причин низкой эффективности противоопухолевых цельноклеточных вакцин является низкая иммуногенность самих опухолевых клеток. Плохое распознавание опухолевых клеток Т-лимфоцитами происходит вследствие неадекватной презентации антигенов. Это часто происходит по причине утрачивания комплексов МНС I и II классов, необходимых для презентации антигенов. Так, в случае с меланомой показано, что из 11 первичных линий клеток от больных меланомой, антигены HLA I класса были экспрессированы только в 10 случаях, а антигены НLA II - в 1 из клеточных линий.
Таким образом, восстановление экспрессии комплексов МНС имеет принципиальное значение для реализации нормального противоопухолевого иммунного ответа. Сложившаяся ситуация подталкивает исследователей к поиску методов повышения иммуногенности вакцин, подбору более эффективных комбинаций иммунотерапевтических методов с радио- и химиотерапией, а также к сочетанному применению иммунопрепаратов, воздействующих на разные этапы формирования и реализации противоопухолевого иммунного ответа.
Цель работы: экспериментальное обоснование подходов к повышению специфической активности цельноклеточной противоопухолевой вакцины, трансфицированной геном GM-CSF.
Задачи исследования:
- Изучить возможность повышения эффективности противоопухолевой цельноклеточной вакцины, секретирующей GM-CSF, с помощью цитокинов (IFN-, ТNF-) in vitro.
- Изучить возможность повышения эффективности противоопухолевой цельноклеточной вакцины, секретирующей GM-CSF, с помощью модификатора биологических реакций (ингибитора Н2-рецепторов гистамина – циметидина) in vivo.
- Провести сравнительное исследование профилактической эффективности in vivo биотерапии с использованием интактной и модифицированной цитокинами in vitro цельноклеточной противоопухолевой вакцины, секретирующей GM-CSF.
- Провести сравнительное исследование терапевтической эффективности in vivo биотерапии с использованием интактной и модифицированной цитокинами in vitro цельноклеточной противоопухолевой вакцины, секретирующей GM-CSF.
- Изучить возможность повышения эффективности биотерапии путем сочетанного применения вакцинотерапии и других методов противоопухолевой терапии (низко- и высокодозная химиотерапия, хирургическое лечение, трансплантация костного мозга).
Научная новизна
Впервые изучено и показано, что терапевтическая эффективность цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, при воздействии IFN- значительно повышается. Впервые доказано, что увеличение уровня экспрессии МНС I и МНС II на опухолевых клетках в присутствие IFN- приводит к усилению противоопухолевого иммунного ответа. Впервые апробировано в эксперименте применение модифицированных преинкубацией с цитокинами in vitro цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, в различных терапевтических и профилактических режимах. Впервые выялено, что сочетанное применение блокаторов Н2-рецепторов гистамина (циметидина) и цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, приводит к усилению профилактического действия вакцинотерапии.
Практическая значимость
- Разработан метод увеличения уровня экспрессии МНС I и MHC II на поверхности клеток путем культивирования in vitro в среде, содержащей IFN-.
- Получены данные, свидетельствующие о потенциальной способности блокаторов Н2-рецепторов гистамина повышать профилактическое действие цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, при их сочетанном применении.
- Разработаны рациональные схемы сочетанного применения цитостатиков, хирургического лечения и биотерапии цельноклеточными противоопухолевыми вакцинами, секретирующими GM-CSF, модифицированными in vitro с помощью IFN-.
- Полученные экспериментальные данные демонстрируют целесообразность рекомендовать для клинического апробирования способа повышения in vitro иммуногенности цельноклеточных противоопухолевых вакцин, секретирующими GM-CSF, и схемы сочетанного применения такой вакцины, цитостатиков и хирургического лечения.
Апробация работы.
Апробация диссертационной работы состоялась на совместной научной конференции НИИ ЭДиТО РОНЦ им. Н.Н.Блохина РАМН c участием лабораторий: лаборатории экспериментальной диагностики и биотерапии опухолей, лаборатории клеточного иммунитета, лаборатории иммунофармакологии, лаборатории биохимической фармакологии, лаборатории фармакологии и токсикологии, лаборатории лучевых методов лечения опухолей, лаборатории трансгенных препаратов, лаборатории медицинской биотехнологии, лаборатории фармацитокинетики, лаборатории медицинской химии, и отдела биотерапии опухолей НИИ Клинической онкологии РОНЦ им. Н.Н.Блохина РАМН, состоявшейся 6 июля 2010 года.
Публикации
Материалы данной работы представлены на Национальной конференции «Аллергология и клиническая иммунология практическому здравоохранению» (Москва, 2010 г.), на Межрегиональном форуме «Актуальные вопросы аллергологии и иммунологии – междисциплинарные проблемы» (Санкт-Петербург, 2010 г.), на XIV Российском онкологическом конгрессе (Москва, 2010 г.)
По материалам диссертации опубликовано 5 печатных работ, в том числе 2 статьи, и 3 тезисов докладов.
Структура и объем диссертации
Диссертация изложена на 138 страницах машинописного текста, содержит 13 рисунков, 24 таблицы. Состоит из глав: «Введение», «Обзор литературы», «Материалы и методы», «Результаты исследования», «Обсуждение», «Заключение», «Выводы», «Литература». Библиографический указатель включает 47 отечественных и 206 зарубежных источников.
Материалы и методы.
Клеточные линии и их культивирование. Клетки меланомы мышей B16 клон F10 были предоставлены профессором М. Бернстилом (IMP, Вена, Австрия). Клетки линии B16F10 имеют гаплотип H-2b, свойственные линии мышей C57Bl/6, из которых выделены эти клетки. Клетки линии B16-F10 не несут молекул MHC I, MHC II на своей поверхности.
Клетки GM-CSF-секретирующего клона BG получены путем стабильной трансфекции клеток линии B16-F10 генетической конструкцией, кодирующей кДНК GM-CSF мыши. При получении клонов стабильно трансфицированных клеток использовали конструкцию под контролем раннего цитомегаловирусного промотора на базе вектора pBK-CMV, содержащего ген устойчивости к генетицину (G418). Подбор условий трансфекции с использованием липидов Unifectin-56 осуществляли согласно рекомендации производителя. В качестве репортерной конструкции использовали плазмиду p-EGFP-N2 (ClonTech), кодирующей зеленый флюоресцирующий белок (GFP). Клетки всех использованных линий культивировали в стандартных условиях в среде DMEM (ПанЭко, РФ) с добавлением 10% телячьей эмбриональной сыворотки (HyClone, США), 10 мг/мл гентамицина (ПанЭко, РФ) при 37°С и 5% СО2 в инкубаторе. Смену культуральной среды проводили каждые 48 часов.
Приготовление цельноклеточных противоопухолевых вакцин. При достижении монослоя 50% при смене культуральной среды вводили исследуемый цитокин: рекомбинантный мышиный IFN- (kat № 315-05, PetroTech Inc., USA) или рекомбинантный мышиный TNF- (kat № 315-01А, PetroTech Inc., USA). Клетки культивировали в СО2-инкубаторе в стандартных условиях.
Для культивирования клеток в присутствии INF- использовали концентрации 5 нг/мл и 10 нг/мл культуральной среды в двух временных режимах культивирования: 24 и 48 часов. Для культивирования клеток в присутствии TNF- применяли концентрации 25 нг/мл, 50 нг/мл, 100 нг/мл культуральной среды в 3 временных режимах культивирования: 12, 24, 48 часов. В качестве сравнения использовали клетки GM-CSF-секретирующего клона BG, которые культивировали в аналогичных условиях без добавления цитокинов. При завершении сроков инкубации проводили обзорную микроскопию полученных планшетов для визуальной оценки фенотипических признаков клеток после воздействия цитокина и определения жизнеспособности клеток. Следующий этап – снятие инкубированных клеток с подложки при помощи раствора Версена, подсчет и оценка жизнеспособности по стандартной методике. Для приготовления вакцин полученные клетки отмывали трижды культуральной средой с помощью осаждения на центрифуге. Инактивацию клеток проводили путем ионизирующего облучения по общей методике. Клетки помещали в стерильные стеклянные флаконы (с добавлением культуральной среды для поддержания жизнедеятельности) и облучали на источнике -излучения Агат-Р с источником облучения 60Co в клинике экспериментальной терапии РОНЦ им. Н.Н. Блохина РАМН. Суммарная доза облучения, получаемая клетками, используемыми для вакцинации животных, составляла 100 Грей.
Условия криоконсервации и создание банка клеточных культур. Для длительного хранения клетки консервировали путем замораживания в жидком азоте в среде, содержащей питательную среду ДМЕМ (45%), ТЭС(50%), ДМСО(5%). Режим замораживания: снижение температуры на 1С в минуту до минус 25С, затем быстрое замораживание до минус 70С. Размораживание быстрое, при 37С. Клетки разводили в 10 мл среды ДМЕМ и осаждали центрифугированием, ресуспендировали в 5 мл той же среды, содержащей 10% эмбриональной телячьей сыворотки. Жизнеспособность клеток после размораживания составляла 90%. Культуры клеток переносили в культуральный флакон объемом 25 см2 для поддержания их роста.
Определение жизнеспособности и роста клеток. Оценку скорости роста клеток и их подсчет проводили в инвертированном световом микроскопе DMIL (Leica Microsystems, Германия). За монослой принимали слой плотно прилегающих друг к другу клеток, растущих на одной поверхности. Окраску клеток проводили раствором Эозин-синий с последующим подсчетом в камере Горяева общепринятым методом. Допустимым считали 5% гибель клеток. Микрофотосъемку выполняли с помощью оборудования Nikon (Nikon digital camera DXM1200F, инвертированный световой микроскоп Nikon Eclipse TE2000-u, Япония) в культуральной среде при увеличении х40.
Проточно-цитофлуориметрический анализ. Полученные клетки центрифугировали дважды в течение 7 мин при 1000 об/мин в растворе PBS и ресуспензировали. Вводили по 4 мкл необходимых антител. В работе использованы антитела производства Becton Dickinson and Company (BD Biosciences), USA: FITC Mouse-Anti Mouse 1-Ab mouse, клон AF6-120.1, (Balb|c) IgG2, к, кат. номер553551 (для МНС 2) и FITC Mouse-Anti Mouse H-2Db mouse, клон (Balb|c) IgG2b, к, кат. номер 553573 (для МНС1), поставщик: ООО «БиоЛайн». К клеткам негативного контроля добавляли 300 мкл формальдегида. Инкубацию проводили в течение 30 мин при 7С, далее полученные смеси дважды центрифугировали при добавлении 1 мл раствора PBS. Оценку уровня экспрессии антигенов МНС I и МНС II проводили на проточном цитофлуориметре FACSCalibur (Becton Dickinson, CШA), укомплектованном аргоновым лазером (длина волны 488 нм), с использованием программного обеспечения CELLQuest. В каждой пробе анализировали до 5000 событий.
Экспериментальные животные. Эксперименты с трансплантированными опухолями проведены на мышах линии C57Bl/6 (гаплотип H-2b), полученных из питомника лабораторных животных РАМН «Столбовая» с содержанием в стандартных условиях. В работе использовали мышей-самцов 8-12 недельного возраста, массой 20-25 г в количестве до 2000 особей. Для каждого опыта в соответствии со схемой эксперимента мышей разделяли на группы по 8 мышей в каждой. У мышей линии C57Bl/6 отсутствуют локусы H-2Ea и H-2L МНС I и II классов.
Иммунизацию мышей проводили подкожно, в область левой подмышечной впадины по 1х106 клеток в 100 мкл 0,9% раствора натрия хлорида с помощью инсулиновых шприцов. Предварительно заготовленную цельноклеточную GM-CSF секретирующую вакцину после хранения в жидком азоте дважды отмывали путем осаждения на центрифуге (бессывороточной средой ДМЕМ, далее 0,9 % раствором натрия хлорида).
Трансплантация опухолевых клеток и учет динамики роста опухоли. Для индукции опухолей животным линии C57Bl/6 подкожно в область правой подмышечной впадины трансплантировали по 1х105 клеток линии B16F10 в 100 мкл суспензии (что составляет для данных животных 10 TD100). Через 5 дней после трансплантации и далее через каждые 2-3 дня животных обследовали на наличие пальпируемых опухолей в области введения клеток. Отмечали сроки достижения опухолями линейного размера 15 мм в любом измерении, сроки гибели животных. Формирующиеся опухоли измеряли дважды в неделю. Объем опухоли определяли по формуле V=DmaxxD1x(Dmax/2), где Dmax равен максимальному диаметру опухоли, а D1 – диаметру перпендикулярному максимальному.
Торможение роста опухоли (ТРО) рассчитывали по формуле:
ТРО (%) V(контр.)-V(опыт.)х100%
= V (контр.), где V – объем опухоли (мм).
Увеличение продолжительности жизни (УПЖ) рассчитывали по формуле:
УПЖ (%) СПЖ(контр.)-СПЖ(опыт.)х100%
= СПЖ (контр.),
где СПЖ – средняя продолжительность жизни (сут).
Торможение роста метастазов (ТРМ) рассчитывали по формуле:
ТРМ (%) М (контр.)-М (опыт.)х100%
= М (контр.), где М – масса легкого с метастазами (г).
Статистическая обработка результатов. Анализ динамики роста опухолей у экспериментальных животных проводили с расчетом среднего значения объема опухоли у мышей экспериментальной группы и ошибки среднего значения. Статистическую достоверность различий между контрольной и опытной группами определяли по методу ANOVA. Определение шансов возникновения признака и расчет доверительных интервалов проводили с помощью пакета программ STATISTICA.
Результаты исследования и их обсуждение.
По разработанной методике из клеток В16F10 GM-CSF-секретирующего клона BG получено 8 видов цельноклеточной GM-CSF секретирующей противоопухолевой вакцины (Табл.1).
Таблица 1
Виды цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF, модифицированных с помощью преинкубации с цитокинами.
| Цитокин | Время культивирования (час.) | Концентрация цитокина (нг/мл культуральной среды) |
| INF- | 24 | 5 |
| INF- | 24 | 10 |
| INF- | 48 | 5 |
| INF- | 48 | 10 |
| TNF- | 24 | 25 |
| TNF- | 24 | 50 |
| TNF- | 48 | 25 |
| TNF- | 48 | 50 |
Было отмечено, что присутствие INF- в среде в концентрации 5 и 10 нг/мл культуральной среды и времени экспозиции 48 часов значительно повышает способность клеток В16F10 GM-CSF-секретирующего клона BG к дифференцировке. При обзорной микроскопии выявлено выраженное увеличение гиперпигментированных гранулсодержащих клеток, снижение количества делящихся клеток. На Рис.1 представлены результаты обзорной микроскопии клеток GM-CSF-секретирующего клона BG, культивированых 48 часов в присутствии INF- (концентрация 10 нг/мл культуральной среды), по сравнению с клетками той же линии, культивированной без присутствия цитокинов в среде (Рис. 2). Морфологические свойства клеток не менялись при культивировании по описанной ранее методике в присутствии TNF- при концентрации 25, 50, 100 нг/мл культуральной среды в течение 12-, 24-, и 48 часов. При культивировании в присутствии TNF- в концентрации 100 нг/мл культуральной среды в течение 12 часов гибель клеток составила более 30%. Данная концентрация в ходе дальнейших экспериментов не применялась в связи с выраженным цитотоксическим эффектом. Жизнеспособность клеток, культивированных в присутствии TNF- и INF- в течение 24 и 48 часов не отличалась от контроля (составила более 95%).


Показано, что преинкубация клеток в среде с указанными цитокинами повышает экспрессию МНС как I, так и II класса. Более выраженную активность продемонстрировал INF-. Преинкубация клеток В16F10 клон BG в течение 48 час в среде, содержащей INF- в концентрации 5 нг/мл достоверно повышала экспрессию МНС II до 14%, а в концентрации 10 нг/мл – до 16% (по сравнению с контролем более чем в 4 раза и более, чем в 5 раз – соответственно). Экспрессия МНС I достоверно увеличилась на 92% и 97% соответственно (р<0,05), что приблизительно в 100 раз выше соответствующих значений контрольной группы (Рис. 3, 4). Время инкубации имело принципиально важное значение: 24-часовая инкубация была не эффективна.
TNF- оказывал гораздо менее выраженное влияние на экспрессию клетками В16F10 клон BG антигенов МНС I и II класса. При 48-часовой инкубации клеток в присутствии TNF- в концентрации 50 нг/мл среды выявлено увеличение экспрессии МНС I до 13% по сравнению с контрольной группой. Остальные режимы культивирования не выявили существенных изменений. Данные представлены в виде диаграмм на рисунках 5,6.

Рис. 5. Экспрессия МНС II на клетках GM-CSF-секретирующего клона BG, культивированных в присутствии цитокинов в различных режимах.

Рис. 6. Экспрессия МНС I на клетках GM-CSF-секретирующего клона BG, культивированных в присутствии цитокинов в различных режимах.
Дизайн проведенных in vivo экспериментов для изучения экспериментальных подходов к повышению эффективности цельноклеточной GM-CSF секретирующей противоопухолевой вакцины представлен в виде схемы на рисунке 7.

Рис.7. Дизайн исследования.
Эффективность профилактического применения вакцин выражена в значительном увеличении продолжительности жизни вакцинированных животных по сравнению с контрольными. Максимально эффективным для первичной профилактики возникновения меланомы оказался режим вакцинации с использованием цельноклеточной противоопухолевой GM-CSF секретирующей вакцины, модифицированных 48-часовой преинкубацией с INF- в концентрации 10 нг/мл. Показано достоверное увеличение средней продолжительности жизни животных по сравнению с контролем до 53,1± 3,0 суток (р<0,05), при этом у 28,5% мышей отмечено полное торможение опухолевого процесса. На 52 сутки после трансплантации клеток меланомы роста опухоли не наблюдалось у 72% животных (95% ДИ (63,280,8)), достоверность различий с контрольной группой р<0,05.
Сравнительная оценка эффективности интактной, модифицированной с помощью INF- и модифицированной с помощью TNF- цельноклеточной GM-CSF секретирующей противоопухолевой вакцины представлена в виде диаграмм на рисунках 8, 9. Показано достоверное увеличение УПЖ (р<0,05) по сравнению с контрольной группой животных, которым не проводили профилактическую вакцинотерапию. В ходе проведения данных экспериментов было выявлено появление инфильтратов на месте введения вакцины. Данный процесс отражает развитие локальной реакции гипечувствительности замедленного типа (ГЗТ) и степень ее выраженности.
Повышение экспрессии антигенов МНС клетками противоопухолевой вакцины при инкубации их с INF- in vitro может приводить к повышению на поверхности клеток уровня опухоль-ассоциированных антигенов и как следствие, специфической эффективности вакцинотерапии.
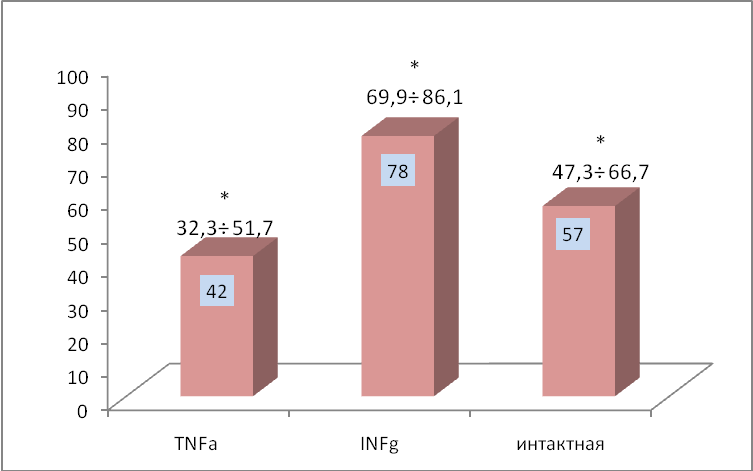

* – р<0,05 по сравнению с контрольной группой.
** – «излечение» – отсутствие роста опухоли на месте трансплантации опухолевых клеток на фоне профилактического применения вакцины.
Исходя из полученных данных в экспериментах по цитотоксичности на основании LD50 для применения в последующих экспериментах в качестве адъювантной терапии при вакцинации GM-CSF секретирующей цельноклеточной противоопухолевой вакциной выбранa доза 25 мг/кг в cутки, режим введения – пятикратный, схема введения – пятикратное введение циметидина до- и пятикратное введение после вакцины.
На фоне 5-кратного введения циметидина значительно усиливается профилактическая активность цельноклеточной GM-CSF секретирующей противоопухолевой вакцины. Выявлено, что циметидин в дозе 25 мг/кг в cутки способен существенно ингибировать развитие опухоли. Показано достоверное увеличение средней продолжительности жизни животных по сравнению с контрольной группой до 46,0±5,7 суток (р<0,05), при этом у 33% мышей отмечено полное торможение роста опухоли (Рис. 10, 11).


* – р<0,05 по сравнению с контрольной группой.
В терапевтическом режиме применение интактной и модифицированной преинкубацией в среде, содержащей цитокины (TNF или INF-) GM-CSF секретирующей вакцины в качестве монотерапии, а также применение ингибитора Н2-рецепторов гистамина циметидина в качестве адьювантной терапии при вакцинации не оказывает влияния на продолжительность жизни мышей с развившимися опухолями. Показано,что применение вакцины на фоне циметидина оказывало стимулирующее влияние на рост первичной опухоли. При этом нельзя исключить, что в данном случае мы имеем дело с «ложной» стимуляцией опухолевого роста, обусловленной повышенной ее инфильтрацией иммунных клеток и клеток стромы, гиперпролиферирующих в зоне опухолевого роста. Об этом свидетельствует появление инфильтратов на месте вакцинации, что указывает на развитии реакции по типу ГЗТ.
Изучение противоопухолевой активности модифицированных in vitro цитокинами цельноклеточных противоопухолевых вакцин in vivo в терапевтическом режиме в комбинации с цитостататическими средствами (высоко- и низкодозовая химиотерапия) через 48 часов после трансплантации опухолевых клеток или отсроченно на 7-е сутки опыта (для лечения развившейся опухоли). В проведенных экспериментах использовали циклофосфамид (в дозах 300, 150, 100 или 30 мг/кг), цисплатин (в дозах 8, 4 и 2,5 мг/кг), доксорубицин (в дозе 7 мг/кг), лизомустин (в дозе 175 мг/кг) внутрибрюшинно.
Применение вакцины не усиливало противоопухолевого действия циклофосфамида в высокой дозе (300 мг/кг) по критерию увеличения продолжительности жизни. Сочетанное применение вакцинотерапии через 7 дней после химиотерапии, не усиливая эффекта терапии в отношении первичного опухолевого узла, достоверно увеличивало среднюю продолжительность жизни животных с развившимися опухолями (Рис. 12).

Рис. 12. Влияние химиотерапии в сочетании с вакцинотерапией цельноклеточной противоопухолевой GM-CSF секретирующей вакциной на продолжительность жизни мышей с меланомой B16F10.
Введение противоопухолевой GM-CSF секретирующей цельноклеточной вакцины при отсроченном начале вакцинотерапии (на 14 сутки эксперимента) не усиливало эффекта терапии в отношении первичного опухолевого узла, однако достоверно увеличивало среднюю продолжительность жизни животных с развившимися опухолями (р<0,05 по сравнению с контрольной группой). Более выраженный терапевтический эффект выявлен при комбинированной терапии цисплатином в дозе 8,0 мг/кг и вакцинотерапии GM-CSF секретирующей цельноклеточной вакцины на 14 сутки эксперимента. Отмечено достоверное увеличение продолжительности жизни на 41% и торможение роста опухоли на 57% к завершению периода наблюдения (19 сутки эксперимента), р<0,05 по сравнению с контрольной группой.
Оценку эффекта вакцинотерапии GM-CSF секретирующей цельноклеточной вакцины при сочетанном применении с циклофосфамидом в низких дозах проводили в терапевтическом режиме спустя 7 дней после трансплантации меланомы В16F10. Циклофосфамид применяли в дозе 30 мг/кг, ежедневно в течение пяти последующих дней до или после вакцинации Результаты представлены на рисунке 13.
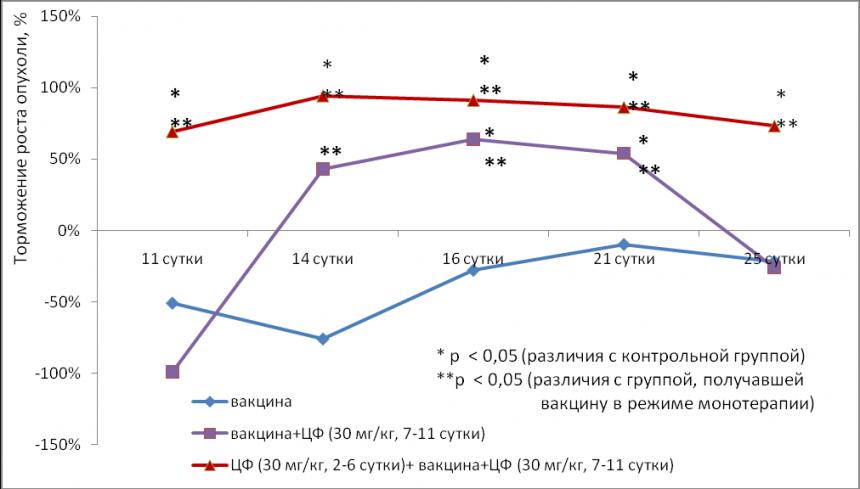
Рис. 13. Влияние низкодозовой химиотерапии циклофосфамидом в комбинации с GM-CSF секретирующей цельноклеточной вакциной на торможение роста первичной опухоли в отсроченный период наблюдения.
На фоне комбинированного применения GM-CSF секретирующей цельноклеточной вакцины и циклофосфамида в режиме до- и после вакцинации отмечено достоверное подавление роста опухоли в динамике более, чем на 60% (р<0,05 по сравнению с контрольной группой). На 25 сутки эксперимента, к моменту начала гибели животных контрольной группы, торможение роста опухоли составило 73% (р<0,05 по сравнению с контрольной группой; р<0,05 по сравнению группой животных, получавших вакцину в режиме монотерапии). Контрольные животные, не получавшие лечения, прожили 24,9±1.2 дня; а животные, получавшие комбинированное лечение (циклофосфамид в дозе 30 мг/кг в режиме до- и после вакцинации) – 37,0±5,1 дней (УПЖ до 49%, р<0,05 по сравнению с контрольной группой). На начальных сроках наблюдения за динамикой развития опухоли отмечена стимуляция её роста в группе животных, получавших вакцину в режиме монотерапии, и группе животных, получавших циклофосфамид после проведения вакцинотерапии. Этот феномен, вероятно, связан с инфильтрированием опухолевого узла активированными в результате вакцинации клетками иммунной системы. Эти результаты совпадают с полученными ранее данными роста опухоли на фоне вакцинации GM-CSF секретирующей цельноклеточной вакциной в режиме монотерапии. В пользу такого предположения свидетельствуют результаты дальнейшего наблюдения за ходом эксперимента, где не выявлено достоверного увеличения размеров опухолевого узла в группе животных, получавших вакцину в режиме монотерапии, по сравнению с контрольной группой.
Сочетанное применение высокодозной химиотерапии, вакцинотерапии с применением цельноклеточной противоопухолевой GM-CSF секретирующей вакцины и биотерапии (трансплантация костного мозга –1х106 клеток костного мозга, выделенных из бедренной кости сингенных животных) по сравнению с проведением высокодозной химиотерапии (циклофосфамид в дозе 350 мг/кг или цисплатин 8 мг/кг однократно) в режиме монотерапии оказывало приблизительно равный терапевтический эффект, достоверно отличающийся от контрольной группы животных, (р<0,05); от группы животных, получавших вакцинацию в режиме монотерапии (р<0,05); от группы животных с проведенной трансплантацией костного мозга в режиме монотерапии (р<0,05). В то же время, воздействие цитостатиков в режиме высокодозной монотерапии было не достаточно эффективным в отношении процесса метастазирования опухоли в легкие.
Результаты типичного эксперимента с использованием циклофосфамида в качестве циторедуктивного агента представлены в таблице 2. Для вакцинотерапии использовали три вида цельноклеточной противоопухолевой GM-CSF секретирующей вакцины: первая - модифицированная преинкубацией in vitro с INF- (в концентрации 10 нг/мл среды), вторая- модифицированная преинкубацией in vitro с TNF- (50 нг/мл среды) в течение 48 часов, по описанной ранее методике, третья- интактная (немодифицированная цитокинами). У 43% мышей, получавших циклофосфамид в режиме монотерапии, развились метастазы. В то же время в группах животных, получавших циклофосфамид совместно с трансплантацией костного мозга и цельноклеточной противоопухолевой GM-CSF секретирующей вакциной, модифицированной преинкубацией in vitro в присутствии INF-, метастазы возникли только у 14% мышей в группе.
Таблица 2
Влияние сочетанного применения циклофосфамида и вакцинотерапии на продолжительность жизни мышей с подкожно привитой меланомой В16F10 и процесс ее метастазирования в легкие.
| № | Воздействие | СПЖ /дни / | УПЖ / % / | Частота метаста- зирования /%/ |
| 1 | Контроль | 22,7 ± 3,5 | - | 0 |
| 2 | вакцина TNF- | 19,5 ± 3,8 | -15 | 0 |
| 3 | вакцина INF- | 27,9 ± 3,7 | 23 95% ДИ (14,831,2) | 14 95% ДИ (7,220,8) |
| 4 | циметидин | 23,4 ± 4,1 | 3 95% ДИ (06,3) | 0 |
| 5 | циметидин + вакцина INF- | 24,2 ± 2,0 | 6 95% ДИ (1,310,7) | 14 |
| 6 | циклофосфамид + костный мозг | 34,6 ± 4,2 | 52 *),**),*** 95% ДИ (42,261,8) | 0 |
| 7 | циклофосфамид + костный мозг + вакцина INF- | 40,9 ± 3,2 | 80 *),**),*** 95% ДИ (72,287,8) | 14 95% ДИ (7,220,8) |
| 8 | циклофосфамид + костный мозг + вакцина TNF- | 29,7 ± 4,3 | 31 *),**),*** 95% ДИ (21,940,1) | 0 |
| 9 | циклофосфамид + циметидин | 32,6 ± 1,5 | 43 *),**),*** 95% ДИ (33,352,7) | 0 |
| 10 | циклофосфамид + костный мозг + вакцина INF- +циметидин | 35,0 ± 4,6 | 54 *),**),*** 95% ДИ (44,263,8) | 16 95% ДИ (8,823,2) |
| 11 | циклофосфамид | 42,4 ± 6,1 | 87 *),**),*** 95% ДИ (80,493,6) | 43 *),**),*** 95% ДИ (33,352,7) |
| 12 | костный мозг | 23,4 ± 4,4 | 3 95% ДИ (06,3) | 0 |
* – р<0,05 по сравнению с контрольной группой
** – р<0,05 по сравнению с группой животных, получавших циметидин в режиме монотерапии
*** – р<0,05 по сравнению с группой животных с проведенной трансплантацией костного мозга в режиме монотерапии
Применение комбинации цельноклеточной GM-CSF секретирующей вакцины, модифицированной INF- in vitro, и дополнительно циметидина в адьювантном режиме снижало эффективность терапии по отношению к росту первичного опухолевого узла. Выявлено увеличение индекса ТРО до 50% (р=0,05 по сравнению с контрольной группой), что совпадает с результатами, полученными в ранее проведенных экспериментах. Вероятно, это обусловлено повышенной инфильтрацией опухоли клетками иммунной системы и клетками стромы, гиперпролиферирующих в зоне опухолевого роста. Применение циметидина приблизительно в 2 раза снижало эффективность сочетанной терапии по сравнению с применением высокодозной химиотерапии в режиме монотерапии. Однако по сравнению с контрольной группой достигнуто достоверно значимое повышение индекса УПЖ.
Изучение противоопухолевой активности модифицированной in vitro цитокинами цельноклеточной GM-CSF секретирующей противоопухолевой вакцины in vivo в терапевтическом режиме в комбинации с хирургическим удалением первичного опухолевого узла проводили по общей схеме. На 0-й день эксперимента каждой мыши в опытной и контрольной группах трансплантировали подкожно по 1х106 клеток меланомы В16F10. В каждой группе было по 7-8 животных. На 9-й день опыта первичные опухоли (достигшие размера 700-1000 мм3) у всех животных удаляли хирургическим способом. Операцию проводили с использованием гексеналового наркоза (100 мг/кг, однократно, внутрибрюшинно). Животным разных групп вакцину вводили до операции (за 5 дней до удаления первичного опухолевого узла), после операции (через 5 дней после операции), а также, до- и после операции (в те же сроки).
Применение модифицированной преинкубацией с INF- in vitro цельноклеточной GM-CSF секретирующей вакцины на фоне хирургического удаления первичного опухолевого узла обладает более выраженной антиметастатической активностью по сравнению с интактной (немодифицированной с помощью INF-) вакциной. В апробированных режимах применение вакцинотерапии на фоне хирургического удаления первичного опухолевого узла отмечено ингибирование процесса метастазирования меланомы в легких на 21-43% (в разных схемах введения). Предоперационная вакцинация животных не показала достоверного снижения интенсивности метастазирования. Наиболее выраженный антиметастатический эффект отмечали в группе животных, получавших вакцину после -, а также в режиме до- и после удаления первичного опухолевого узла. Торможение роста опухоли составило 37% (р<0,05 по сравнению с контрольной группой) в режиме послеоперационной вакцинации, и 43% (р<0,05 по сравнению с контрольной группой) в режиме двукратной вакцинации (до- и после хирургического удаления первичного опухолевого узла. Полученные данные представлены на рисунке 14.
Рис. 14. Антиметастатическая активность цельноклеточной противоопухолевой GM-CSF секретирующей, модифицированной INF- in vitro, вакцины (при разных режимах введения) на фоне хирургического удаления первичного опухолевого узла.
Выводы.
- Повышение экспрессии антигенов МНС клетками противоопухолевой вакцины при их инкубации с INF- in vitro приводит к повышению эффективности цельноклеточной противоопухолевой GM-CSF секретирующей вакцины.
- Для повышения экспрессии МНС необходима инкубация опухолевых клеток в среде, содержащей INF-, в течение длительного времени. Максимальный уровень экспрессии отмечен при концентрации 10 нг/мл среды в течение 48 часов. Менее продолжительная инкубация при той же концентрации не вызывает достаточного увеличения экспрессии МНС.
- Применение ингибитора Н2-рецепторов гистамина (циметидина) дает основания рассматривать его как возможный метод повышения иммуногенности цельноклеточной противоопухолевой вакцины, секретирующей GM-CSF, in vivo.
- Вакцина, полученная на основе модифицированных геном GM-CSF клеток, после их преинкубации в среде, содержащей оптимальную концентрацию INF- и достаточное время экспозиции, оказывает более выраженное профилактическое и терапевтическое действие.
- Наилучший терапевтический эффект отмечен при сочетанном применении биотерапии на основе GM-CSF-секретирующих клеток, инкубированных в присутствии INF- in vitro, и хирургическом удалении первичного опухолевого узла. Эти результаты позволяют оптимизировать режимы проведения вакцинотерапии в клинической практике.
Список опубликованных работ по теме диссертации.
- Манина И.В., Перетолчина Н.М., Сапрыкина Н.С., Козлов А.М., Михайлова И.Н., Барышников А.Ю. Доклинические исследования иммунотерапии меланомы кожи с помощью цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF. // Российский биотерапевтический журнал. – 2010. – №3. – С. 47-50.
- Манина И.В., Перетолчина Н.М., Сапрыкина Н.С., Козлов А.М., Михайлова И.Н., Жорданиа К.И., Барышников А.Ю. Перспективы применения антагониста Н2-гистаминовых рецепторов (Циметидина) в качестве адьюванта биотерапии для лечения меланомы. // Иммунопатология, аллергология, инфектология. – 2010. – №4. – С. 10-17.
- Козлов А.М., Манина И.В. Повышение эффективности биотерапии опухолей путем модификации иммунного ответа с помощью ингибитора Н2-рецепторов гистамина. Материалы Национальной конференции «Аллергология и клиническая иммунология практическому здравоохранению». Москва, 25-26 февраля 2010. // Российский Аллергологический Журнал. – 2010. – №1 (1). – С. 81-82.
- Манина И.В., Сапрыкина Н.С., Козлов А.М., Михайлова И.Н. Экспериментальные исследования иммунотерапии меланомы кожи с помощью цельноклеточных противоопухолевых вакцин, секретирующих GM-CSF. // Материалы Межрегионального форума «Актуальные вопросы аллергологии и иммунологии – междисциплинарные проблемы». Санкт-Петербург 27-30 сентября 2010. // Российский Аллергологический Журнал. – 2010. – №1 (1). – С. 176-177.
- Манина И.В., Сапрыкина Н.С., Перетолчина Н.М., Михайлова И.Н., Козлов А.М. Изучение применения методов комбинированной терапии меланомы кожи в эксперименте. // Материалы XIV Российского онкологического конгресса. Москва 23-25 ноября 2010. – С. 256-257.

