луд анна николаевна значение молекулярно-биологических маркеров при раке желудка онкология – 14.01.12 автореферат диссертации на соискание ученой степени кандидата медицинских наук москва, 2010 ...
На правах рукописи
Луд Анна Николаевна
ЗНАЧЕНИЕ МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИХ
МАРКЕРОВ ПРИ РАКЕ ЖЕЛУДКА
Онкология – 14.01.12
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва, 2010
Работа выполнена в
Учреждении Российской академии медицинских наук
Российском онкологическом научном центре имени Н.Н.Блохина РАМН
(директор академик РАН и РАМН М.И.Давыдов)
Научные руководители:
академик РАН и РАМН,
д.м.н., профессор М.И. Давыдов
д.м.н., профессор А.Ю. Барышников
Официальные оппоненты:
Доктор медицинских наук, профессор В.И. Борисов
Доктор медицинских наук, профессор И.В. Поддубная
Ведущее научное учреждение:
ФГУ Московский научно-исследовательский онкологический институт имени П.А. Герцена МЗ СР РФ.
Защита состоится «____»_______________2010 г. в ____ часов на
заседании Диссертационного совета Д.001.017.02 при Российском онкологическом научном центре им. Н.Н.Блохина РАМН (115478, г. Москва, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке Российского онкологического научного центра им. Н.Н.Блохина РАМН.
Автореферат разослан «____»_______________2010 г.
Ученый секретарь
Диссертационного совета Д.001.017.02.
доктор медицинских наук, профессор Ю.А. Барсуков
Актуальность проблемы.
Рак желудка во всем мире продолжает оставаться в центре внимания медицинской науки и практики и является одной из важнейших медицинских и социально-экономических проблем.
В России рак желудка занимает второе место в структуре онкологической заболеваемости у мужчин (10,8%) и третье – у женщин (7,5%). Ежегодно выявляется 41 930 новых случаев заболевания. В структуре смертности от злокачественных новообразований рак желудка стоит на втором месте, составляя среди мужского и женского населения соответственно 13,9% и 12,4%.
Отдаленные результаты хирургического лечения больных раком желудка, за исключением ранних стадий, остаются малоутешительными, так как радикальность большинства операций носит условный характер. Это связано с тем, что большая часть больных поступает на лечение с местно-распространенными или генерализованными формами опухолевого процесса. Причиной неудовлетворительных результатов лечения данной категории пациентов является высокая частота возникновения отдаленных метастазов в ближайшие годы наблюдения.
Исходя из изложенного, очевидно, что для улучшения результатов лечения больных раком желудка необходимо разрабатывать методы профилактики развития местных рецидивов и отдаленных метастазов после удаления первичной опухоли.
Химиотерапия является единственным методом лечения пациентов с неоперабельным, местно-распространенным или метастатическим раком желудка. Однако выбор целого ряда схем химиотерапии основывается на их интуитивном подборе, без достаточного учета объективных показателей прогноза заболевания, молекулярно-генетических особенностей опухоли.
В связи с этим большой интерес представляет изучение молекулярно-биологических маркеров, т.е. белков и генов, изменения которых находят в опухолевой клетке. Они несут дополнительную информацию о способности опухоли к пролиферации, инвазии, метастазированию, а также могут предсказывать индивидуальную чувствительность к химиотерапии.
Особое внимание привлекает прогностическое значение молекулярно-биологических маркеров, характеризующих апоптоз, ангиогенез, пролиферацию, а также некоторых ферментов, участвующих в метаболизме противоопухолевых препаратов. В ряде случаев их структурно-функциональные изменения могут служить специфическими маркерами, имеющими диагностическое и/или прогностическое значение.
При раке желудка комплексное изучение молекулярных маркеров прежде не проводилось.
Цель исследования.
Основной целью исследования явилась оценка экспрессии молекулярно-биологических маркеров и характеристика клинического течения и эффективности лечения больных раком желудка в зависимости от показателей апоптоза, ангиогенеза, пролиферации и других молекулярных опухолевых маркеров.
Задачи исследования.
- Оценить экспрессию молекулярно-биологических маркеров (Р53, Bcl-2, Bax, Тимидин фосфорилаза, Тимидилат синтетаза, HER-2/neu, Ki-67, VEGF, Fas-лиганд, AGT, COX-2, Топоизомераза-1, Топоизомераза-2, ERCC-1, XRCC-1, S100A4) у больных раком желудка и их корреляцию с клинико-морфологическими характеристиками опухоли.
- Определить прогностическую роль молекулярно-биологических маркеров у больных раком желудка.
- Оценить эффективность химиотерапии первой линии в лечении больных метастатическим раком желудка.
- Определить корреляцию эффективности химиотерапии первой линии в лечении больных метастатическим раком желудка и экспрессии молекулярных маркеров.
Научная новизна и практическая значимость.
Впервые изучена широкая панель молекулярно-биологических маркеров (Р53, Bcl-2, Bax, Тимидин фосфорилаза, Тимидилат синтетаза, HER-2/neu, Ki-67, VEGF, Fas-лиганд, AGT, COX-2, Топоизомераза-1, Топоизомераза-2, ERCC-1, XRCC-1, S100A4) при раке желудка. Изучены особенности экспрессии, корреляции с клинико-морфологическими характеристиками опухоли и взаимного влияния маркеров на прогрессирование болезни.
Впервые изучено прогностическое значение экспрессии и совместного влияния различных молекулярно-биологических маркеров на выживаемость больных и резистентность к современным типам химиотерапии. Предложены новые подходы к таргетной терапии при раке желудка. Проведен анализ наиболее информативных критериев прогноза течения заболевания и риска резистентности к химиотерапии. Результаты настоящего исследования будут способствовать внедрению в клиническую практику индивидуального подхода к диагностике и лечению больных раком желудка, повышению эффективности проводимой химиотерапии.
Публикации.
По теме диссертации опубликовано 9 научных работ.
Апробация работы.
Апробация диссертационной работы состоялась на совместной научной конференции с участием отделения химиотерапии и комбинированного лечения злокачественных опухолей, отделения химиотерапии, отделения клинической фармакологии и химиотерапии, хирургического отделения диагностики опухолей, хирургического отделения абдоминальной онкологии, хирургического торакального отделения, отделения патологической анатомии опухолей человека НИИ КО и лаборатории экспериментальной диагностики и биотерапии опухолей НИИ ЭДиТО РОНЦ им. Н.Н. Блохина РАМН.
Структура и объем диссертации
Диссертация изложена на 123 страницах машинописного текста, содержит 30 таблиц, 28 рисунков и состоит из введения, обзора литературы, главы «Материалы и методы», изложения собственных результатов, обсуждения и выводов. Список литературы включает 168 источников, в том числе 24 отечественных и 144 иностранных.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В исследование включен 101 больной раком желудка (РЖ), у которых иммуногистохимическим методом была оценена экспрессия различных молекулярных маркеров. Среди них 67 пациентов, радикально оперированных по поводу рака желудка, и 34 больных метастатическим раком желудка (мРЖ), получавших химиотерапию в отделении химиотерапии и комбинированного лечения злокачественных опухолей РОНЦ им. Н.Н.Блохина РАМН.
Пациенты, радикально оперированные по поводу рака желудка.
В исследовании приняли участие 67 больных, которые в период с 1998 по 2003 гг. перенесли радикальную операцию по поводу рака желудка (IB-IV(M0) стадии). Клинико-морфологическая характеристика представлена в таблице 1.
На первом этапе лечения всем пациентам выполнена радикальная операция в объеме гастрэктомии (n=30; 44,8%) или радикальной (дистальная или проксимальная) субтотальной резекции желудка (n=37; 55,2%). Лимфодиссекция в объеме D1 выполнена у 10 больных (14,9%), а D2 – у 57 (85,1%).
Таблица 1.
Клинико-морфологическая характеристика пациентов, радикально оперированных по поводу рака желудка (n=67)
| Характеристики | Количество больных (%) |
| Пол мужчины женщины | 40 (59,7) 27 (40,3) |
| Возраст менее 45 лет 45 – 60 лет более 60 лет медиана – годы диапазон – годы | 3 (4,5) 27 (40,3) 37 (55,2) 62 27 – 73 |
| Глубина опухолевой инвазии (Т) Т1-2 Т3-4 | 27 (40,3) 40 (59,7) |
| Количество пораженных регионарных лимфатических узлов (N) N N+ | 33 (49,3) 34 (50,7) |
| Стадия болезни IB II IIIA IIIB IV (M0) | 10 (14,9) 16 (23,9) 17 (25,5) 2 (2,9) 22 (32,8) |
| Классификация Borrmann: I тип (полиповидные или грибовидные опухоли) II тип (блюдцеобразные опухоли) III тип (инфильтративно-язвенные опухоли) IV тип (диффузно-инфильтративные опухоли) | 6 (8,9) 25 (37,3) 29 (43,3) 7 (10,5) |
| Гистологическая классификация ВОЗ: папиллярная аденокарцинома тубулярная аденокарцинома муцинозная аденокарцинома перстневидноклеточная аденокарцинома недифференцированный рак низкодифференцированная аденокарцинома | 7 (10,5) 13 (19,4) 4 (5,9) 12 (17,9) 4 (5,9) 27 (40,4) |
| Классификация Lauren: кишечный тип диффузный тип смешанный тип | 29 (43,3) 23 (34,3) 15 (22,4) |
Учитывая сомнительный прогноз при местно-распространенных формах РЖ, выделена группа больных (n=39), в которой проведено комплексное лечение, включающее, наряду с оперативным вмешательством, адъювантную химиотерапию в режиме: 5-Фторурацил 425 мг/м2/сутки в/в 30-минутная инфузия день 1-5, Лейковорин 20 мг/м2/сутки в/в день 1-5, каждые 4 недели, общим числом курсов 6. У 10 из 39 пациентов этой группы проведен курс адъювантной химиолучевой терапии.
После выполнения радикальной операции (n=67, 100%) и проведения адъювантной химиолучевой терапии (n=39, 58%) больные находились под наблюдением с проведением ежегодного контрольного обследования.
Медиана времени наблюдения за больными составила 68,5 месяцев (от 6 до 120). На момент анализа смерть от прогрессирования основного заболевания зарегистрирована у 42% пациентов (28/67). Медиана времени до прогрессирования составила 13 месяцев. При прогрессировании процесса больные не получали химиотерапию.
На срезах с парафиновых блоков первичной опухоли, предназначенных для стандартного морфологического исследования, ретроспективно проведен иммуногистохимический анализ с целью оценки уровня экспрессии молекулярных маркеров.
Пациенты с метастатическим раком желудка.
В период с 2004 по 2010 гг. в условиях отделения химиотерапии и комбинированного лечения злокачественных опухолей РОНЦ имени Н.Н.Блохина РАМН проведено лечение 34 пациентов с гистологически верифицированным метастатическим раком желудка (TлюбоеNлюбоеM1). Клиническая характеристика представлена в таблице 2.
При морфологическом исследовании были диагностированы низкодифференцированная аденокарцинома (61,8%, n=21) и перстневидноклеточный рак (38,2%, n=13).
Таблица 2.
Клиническая характеристика пациентов
с метастатическим раком желудка (n=34)
| Характеристики | Количество больных (%) |
| Пол мужчины женщины | 19 (55,9) 15 (44,1) |
| Возраст моложе 40 лет 40 65 лет старше 65 лет медиана – годы диапазон – годы | 3 (8,8) 22 (64,7) 9 (26,5) 57,5 34 – 75 |
| Статус ECOG 0–1 2 | 33 (97,1) 1 (2,9) |
| Локализация отдаленных метастазов печень лимфатические узлы брюшина легкие кости яичники | 19 (55,9) 24 (70,6) 13 (38,2) 8 (23,6) 2 (5,9) 1 (2,9) |
| Первичная опухоль удалена не удалена | 9 (26,5) 25 (73,5) |
| Количество зон метастазирования 1 2 3 и более медиана - количество зон диапазон – количество зон | 9 (26,5) 15 (44,1) 10 (29,4) 2 1 4 |
| Вторая линия химиотерапии не проводилась проводилась | 21 (61,8) 13 (38,2) |
20,6% больных имели отдаленные метастазы только в висцеральные органы, 8,8% - метастазы в лимфатические узлы (надключичная и/или забрюшинная локализации) и висцеральные метастазы, и 14,7% только метастатическое поражение брюшины.
Всем пациентам до начала лечения выполнена компьютерная томография органов грудной клетки, брюшной полости и малого таза. В процессе лечения с целью оценки эффективности химиотерапии и исключения прогрессирования заболевания контрольное обследование повторялось каждые 2 цикла. Оценка эффекта проведена согласно критериям RECIST. Обязательными условиями включения были удовлетворительная функция костномозгового кроветворения, печени и почек (гемоглобин 10 г/дл, абсолютное число нейтрофилов 1500109, абсолютное число тромбоцитов 100000109, уровень билирубина – 1,5 верхняя граница нормы, уровни щелочной фосфатазы, АЛТ и АСТ 3 верхняя граница нормы при отсутствии метастатического поражения печени и 5 верхняя граница нормы при наличии метастазов в печень). В случае прогрессирования болезни или развития неприемлемой токсичности лечение пациентам прекращалось. После окончания терапии пациенты наблюдались до конца жизни.
В первой линии лечения больные мРЖ получали режимы химиотерапии, включающие препараты платины и фторпроизводные пиримидина: 1) режим I (n=4): Цисплатин 100 мг/м2 в/в день 1, 5-ФУ 1000 мг/м2/день в/в 120 часов, каждые 4 недели; 2) режим II (n=22): Цисплатин 80 мг/м2 в/в день 1, Кселода 2000 мг/м2/день р.о. в 2 приема, день 1-14, каждые 3 недели; 3) режим III (n=8): Цисплатин 75 мг/м2 в/в день 1, S-1 25 мг/м2 р.о. 2 раза в день, день 1-21, каждые 4 недели, общим числом курсов 6; затем продолжался прием S-1 в монотерапии.
Иммуногистохимическое исследование.
Для иммуногистохимического исследования использовались фиксированные в формалине и заключенные в парафин опухолевые блоки, полученные в рутинной патологоанатомической работе. Характеристика изученных молекулярно-биологических маркеров дана в таблице 3.
Оценку результатов окрашивания проводили с применением светового микроскопа «Leica» (Германия) под увеличением 10, 20, 40. Для всех маркеров оценивали локализацию окрашивания в клетке (ядро, цитоплазма, мембрана). Количество положительных клеток оценивали в зонах, содержащих их максимальное количество.
Таблица 3.
Панель изученных молекулярно-биологических маркеров
| Специфичность | Клон | Фирма | Разведе-ние | Буфер |
| Ki-67 | Ki-S5 | DAKO | 1:50 | 10 мМ Tris, 1 мМ EDTA (рН 9,0) |
| HER-2/neu | поликлон. | DAKO | 1:500 | 10 мМ цитратный буфер (рН 6,0) |
| Нормальный и мутантный тип р53 | DO-7 | DAKO | 1:200 | 10 мМ Tris, 1 мМ EDTA (рН 9,0) |
| Bсl-2 | 124 | DAKO | 1:50 | 10 мМ Tris, 1 мМ EDTA (рН 9,0) |
| Bах | поликлон. | DAKO | 1:500 | 10 мМ цитратный буфер (рН 6,0) |
| CD95L(Fas/APO1) лиганд | поликлон. | Santa Cruz Biotech | 1:500 | 10 мМ цитратный буфер (рН 6,0) |
| VEGFа | С-1 | Santa Cruz Biotech | 1:500 | 10 мМ цитратный буфер (рН 6,0) |
| Циклооксигеназа-2 (ЦОГ-2) | поликлон. | Santa Cruz Biotech | 1:300 | 10 мМ цитратный буфер (рН 6,0) |
| Тимидин фосфо-рилаза (ТФ) | P0GF.44C | Calbiochem | 1:100 | 10 мМ цитратный буфер (рН 6,0) |
| Тимидилат синтетаза (ТС) | TS106 | Chemicon | 1:50 | 10 мМ цитратный буфер (рН 6,0) |
| Алкилгуанин алкилтрансфераза (АГТ) | поликлон. | DAKO | 1:100 | 10 мМ цитратный буфер (рН 6,0) |
Иммуногистохимические исследования и консультация морфологических препаратов проведены в лаборатории экспериментальной диагностики и биотерапии опухолей (с.н.с., к.м.н. Степанова Е.В.) и в отделении патоморфологии (с.н.с., к.м.н. Вишневская Я.В.).
Статистический анализ
Статистический анализ проводили на персональном компьютере с использованием программы “SPSS” (v13.0. for Windows). Для проверки достоверности различий значений признаков в группах использовали тесты «хи-квадрат» (2) и точный критерий Фишера. Различия считались статистически достоверными при р<0,05 (95% точности). Корреляция проводилась с помощью коэффициента корреляции Пирсона и коэффициента ранговой корреляции Спирмена. Расчет выживаемости проводили методом Каплана-Мейера. Сравнение двух кривых выживаемости выполняли с помощью логранкового критерия. Для оценки независимости признаков и расчета сравнительного риска (HR) использовалась модель пропорционального регрессионного анализа Кокса.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Особенности экспрессии молекулярно-биологических маркеров у больных, радикально оперированных по поводу рака желудка.
Анализ экспрессии молекулярных маркеров (P53, Ki-67, Bcl-2, Bax, HER-2/neu, Fas-лиганд в опухоли и лимфоцитах, VEGF, Тимидин фосфорилаза в клетках опухоли и стромы, Тимидилат синтетаза, AGT и COX-2), их ассоциации с различными клинико-морфологическими особенностями опухоли и прогнозом течения заболевания проведен у 67 больных, радикально оперированных по поводу рака желудка IBIV(M0) стадий.
Анализ корреляции экспрессии молекулярных маркеров и клинико-морфологических характеристик выявил следующие особенности.
Опухоли, локализованные в средней трети тела желудка, по сравнению с другими локализациями, чаще характеризовались высокой экспрессией Bcl-2 (р=0,039; r,rs=0,569), ТФ в опухолевых клетках (р=0,037; r,rs=0,535) и высоким индексом пролиферативной активности Ki-67 (более 25%) (р=0,041; r,rs=0,673). При массивном опухолевом поражении желудка (тотальном и субтотальном) экспрессия VEGF в опухолевых клетках наблюдалась реже, чем при менее распространенном процессе (р=0,029; r,rs=0,300).
Прогностически неблагоприятные типы РЖ (перстневидноклеточная, слизистая аденокарцинома и недифференцированный рак), в сравнении с благоприятными, реже сопровождались гиперэкспрессией ТФ в опухолевых (40% и 89,4% соответственно; р=0,0001; r,rs=0,519) и стромальных клетках (70% и 91,5% соответственно; р=0,05; r,rs=0,276), гиперэкспрессией ТС (4% и 70,2% соответственно; р=0,029; r,rs=0,284) и COX-2 (55% и 80,9% соответственно; р=0,038; r,rs=0,267).
Экзофитно растущие опухоли, по сравнению с эндофитными, чаще имели высокую пролиферативную активность (Ki-67 более 25%) (89,5% и 58,6% соответственно; р=0,002; r,rs=0,387), гиперэкспрессию Тимидин фосфорилазы в опухолевых (86,7% и 64,9% соответственно; р=0,05; r,rs=0,249) и стромальных клетках (96,7% и 75,5% соответственно; р=0,019; r,rs=0,293).
Кишечный тип опухоли, в сравнении с диффузным, чаще сопровождался гиперэкспрессией Bax (58,6% и 30,4% соответственно; р=0,04; r,rs=0,287) и ТФ в опухолевых клетках (93,1% и 43,5% соответственно; р<0,0001; r,rs=0,544).
Установлена прямая корреляция экспрессии Fas-лиганда в клетках опухоли и стадии опухолевого процесса: 7,7% при IB-II стадиях, 26,3% – при III стадии и 31,8% – при IV (M0) стадии заболевания (р=0,03 для групп IB-II и III-IV; r,rs=0,436).
Отмечено, что опухоли с высокой митотической активностью, по сравнению с опухолями с низкой митотической активностью, чаще характеризовались гиперэкспрессией Bax (55,2% и 31,6% соответственно; р=0,024; r,rs=0,275) и ТФ в опухолевых (89,7% и 63,2% соответственно; р=0,013; r,rs=0,302) и стромальных клетках (96,% и 76,3% соответственно; р=0,021; r,rs=0,281).
Для оценки прогностической роли молекулярно-биологических маркеров больные были прослежены не менее 5 лет после удаления первичной опухоли, либо до появления метастазов.
Проведен анализ экспрессии маркеров в двух прогностических группах: благоприятной группе А (прогрессирования болезни не произошло в 5-летний период после удаления первичной опухоли) и неблагоприятной группе Б (прогрессирование болезни произошло в 5-летний период после удаления первичной опухоли). Установлено, что достоверными показателями прогноза являются высокая экспрессия Р53, низкая экспрессия Bax и низкая экспрессия Тимидин фосфорилазы в опухолевых клетках (таблица 4).
Таблица 4.
Характеристики прогностических групп
| Маркер | Группа А, n=43 | Группа Б, n=24 | Достоверность, р |
| Р53 (n=43) | 33 | 10 | 0,005 |
| Р53 + (n=24) | 10 | 14 | |
| Bax (n=38) | 22 | 16 | 0,028 |
| Bax + (n=29) | 21 | 8 | |
| ТФоп (n=17) | 8 | 9 | 0,037 |
| ТФоп +(n=50) | 35 | 15 |
Метастазы после удаления первичной опухоли появились у 58,3% больных, положительных по Р53, и 32,6% - отрицательных по Р53, у 25% пациентов, положительных по Bax, и 51,4% - отрицательных по Bax, у 38% больных, положительных по ТФоп, и 62,9% - отрицательных по ТФоп.
Анализ экспрессии молекулярно-биологических маркеров и общей выживаемости больных РЖ представлен в таблице 5.
Таблица 5.
Экспрессия молекулярно-биологических маркеров и
общая выживаемость больных раком желудка (n=67)
| Показатель | Средняя общая выживаемость, мес. | Медиана ОВ, мес. | Р |
| P53 P53 (n=43) P53+ (n=24) | 101±7,6 (95%ДИ 86,3-115,9) 64,8±11,3 (95%ДИ 42,6-86,9) | не достигнута 33 | 0,0131 |
| Ki-67 Ki-67 (n=17) Ki-67+ (n=50) | 61,4±11,7 (95%ДИ 38,2-84,5) 93,9±7,3 (95%ДИ 79,6-108,1) | не достигнута не достигнута | 0,193 |
| Bcl-2 Bcl-2 (n=61) Bcl-2+ (n=6) | 87,4±7,2 (95%ДИ 73,4-101,4) 97,3±16,4 (95%ДИ 65,2-129) | не достигнута не достигнута | 0,498 |
| Bax Bax (n=38) Bax+ (n=29) | 80,1±8,9 (95%ДИ 63-98) 103,9±9,9 (95%ДИ 84-123) | 76 не достигнута | 0,0123 |
| Her-2/neu Her-2/neu (n=64) Her-2/neu+ (n=3) | 90,4±6,8 (95%ДИ 77-104) 42,3±24,8 (95%ДИ 0-90) | не достигнута 13 | 0,174 |
| Fas-лиганд (опухоль) (n=53) + (n=14) | 89,4±7,5 (95%ДИ 75-104) 86,1±14,9 (95%ДИ 57-115) | не достигнута не достигнута | 0,927 |
| Fas-лиганд (лимф.) (n=51) + (n=16) | 87,8±7,7 (95%ДИ 73-103) 89,1±13,3 (95%ДИ 63-115) | не достигнута не достигнута | 0,777 |
| VEGF в клетках опухоли VEGF (n=31) VEGF+ (n=36) | 88,4±10,0 (95%ДИ 68-108) 88,9±9,0 (95%ДИ 71-106) | не достигнута не достигнута | 0,991 |
| ТФ в клетках опухоли ТФоп (n=17) ТФоп+ (n=50) | 61,7±14,9 (95%ДИ 32-91) 95,1±6,5 (95%ДИ 82-107) | не достигнута не достигнута | 0,019 |
| ТФ в строме опухоли ТФстр (n=10) ТФстр+ (n=57) | 56,3±16,6 (95%ДИ 23-88) 92,4±6,8 (95%ДИ 79-105) | 16 не достигнута | 0,032 |
| COX-2 COX-2 (n=18) COX-2+ (n=49) | 77,4±13,1 (95%ДИ 52-103) 91,8±7,7 (95%ДИ 77-107) | 76 не достигнута | 0,367 |
| ТС ТС (n=26) ТС+ (n=41) | 76,2±10,5 (95%ДИ 55,6-96,8) 92,9±8,2 (95%ДИ 76,9-108,9) | 76 не достигнута | 0,152 |
| AGT AGT (n=16) AGT+ (n=51) | 94,6±11,6 (95%ДИ 71-117) 84,1±7,9 (95%ДИ 69-99) | не достигнута 78 | 0,267 |
Выявлены маркеры, прогнозирующие общую выживаемость больных, радикально оперированных по поводу рака желудка.
Установлена статистически значимая корреляция экспрессии P53 и общей выживаемости больных РЖ. Медиана общей выживаемости в группе Р53+ составила 33 месяца, тогда как в группе Р53 медиана не достигнута. (р=0,013) (табл. 7 и рис. 1).
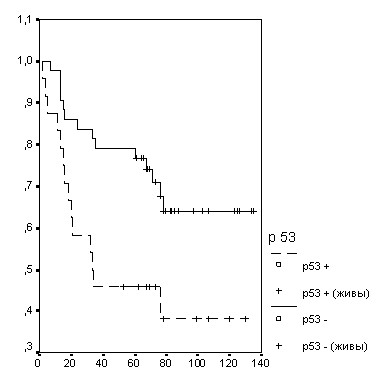
Рисунок 1. Экспрессия P53 и общая выживаемость больных раком желудка.
Получено статистически значимое улучшение общей выживаемости при гиперэкспрессии Тимидин фосфорилазы в опухолевых и стромальных клетках (табл. 7, рис. 2). В группе ТФоп+ средняя общая выживаемость составила 95,1 месяцев, а в группе ТФоп - 61,7 месяц (р=0,019). Медиана общей выживаемости в обеих группах не достигнута. В группе ТФстр+ средняя общая выживаемость составила 92,4 месяца, а в группе ТФстр - 56,3 месяцев (р=0,032). Медиана общей выживаемости в группе ТФстр равнялась 16 месяцам, тогда как в группе ТФстр+ медиана не достигнута.
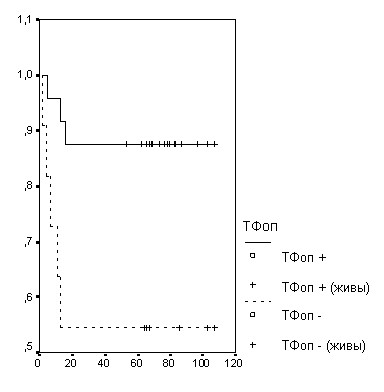

Рисунок 2. Экспрессия ТФ в опухолевых (А) и стромальных (Б) клетках и общая выживаемость больных раком желудка.
Выявлено достоверное увеличение общей выживаемости в группе с гиперэкспрессией Bax (р=0,0123) (табл. 7, рис. 3). При опухолях Bax медиана общей выживаемости составила 76 месяцев, а при опухолях Bax+ медиана не достигнута.
При многофакторном анализе установлено, что независимыми прогностическими факторами высокого риска прогрессирования и низкой общей выживаемости больных, радикально оперированных по поводу рака желудка с IB-IV(M0) стадиями, являются высокая экспрессия р53 (р<0,05) и низкая экспрессия ТФ в опухолевых клетках (р<0,05).
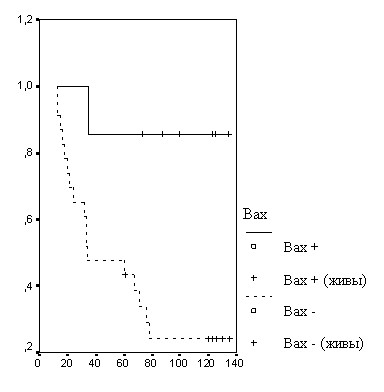
Рисунок 3. Экспрессия Bax и общая выживаемость больных раком желудка.
При стратификации по поражению регионарных лимфатических узлов (N+ и N) в группе N статистически значимое улучшение общей выживаемости отмечено при гиперэкспрессии ТС (р=0,003) и COX-2 (р=0,007) (таблица 6).
Таблица 6.
Экспрессия молекулярных маркеров и общая выживаемость больных РЖ в зависимости от поражения регионарных лимфатических узлов
| Показатель | Средняя ОВ, мес. | Медиана ОВ, мес. | Р |
| N ТС (n=12) ТС+ (n=21) | 69,8±13,9 (95%ДИ 42-97) 116,1±7,6 (95%ДИ 101-131) | 76 не достигнута | 0,003 |
| N+ ТС (n=14) ТС+ (n=20) | 88,4±14,7 (95%ДИ 59-117) 58,2±9,9 (95%ДИ 38-77) | не достигнута 32 | 0,39 |
| N COX-2 (n=9) COX-2+ (n=24) | 56,2±9,31 (95%ДИ 38-74) 112,4±8,96 (95%ДИ 95-130) | 71 не достигнута | 0,007 |
| N+ COX-2 (n=9) COX-2+ (n=25) | 93,6±19,2 (95%ДИ 55-132) 60,2±8,5 (95%ДИ 44-77) | не достигнута 35 | 0,42 |
ОВ общая выживаемость.
В группе N гиперэкспрессия ТС коррелировала с увеличением общей выживаемости (116 месяцев), в отличие от группы, в которой гиперэкспрессия ТС отсутствовала (69 месяцев).
Медиана общей выживаемости достигнута только в группе ТС (76 месяцев). Гиперэкспрессия COX-2 также коррелировала с увеличением общей выживаемости (112 месяцев), в отличие от группы, в которой гиперэкспрессия COX-2 не определялась (56 месяцев). Медиана общей выживаемость достигнута только в группе COX-2 (71 месяц).
Анализ совместного влияния экспрессии маркеров на общую выживаемость показал, что сочетание экспрессии ТФ в опухолевых клетках и экспрессии Р53 дает наибольшую прогностическую информацию (таблица 7). Опухоли, обладающие фенотипом Р53+/ТФоп, имели наихудший прогноз в виде 100% метастазирования и медианы общей выживаемости 11 мес.
Таблица 7.
Влияние на прогноз заболевания экспрессии Р53 и ТФ
в опухолевых клетках
| Прогностические признаки | Метастазирование (%) | Средняя ОВ (мес.) | Медиана ОВ (мес.) |
| Р53/ТФоп+ (n=31) | 32,3 | 102,8 | |
| Р53/ТФоп (n=12) | 33,3 | 89,8 | |
| Р53+/ТФоп+ (n=19) | 52,4 | 78,2 | 76 |
| Р53+/ТФоп (n=5) | 100 | 14,2 | 11 |
ОВ общая выживаемость.
Таким образом, среди больных раком желудка IB-IV(М0) стадий после выполнения радикальной операции, наименее прогностически благоприятной, характеризующейся высоким риском раннего метастазирования, явилась группа с фенотипом Р53+/ТФоп.
Клиническое изучение эффективности химиотерапии первой линии в лечении больных метастатическим раком желудка и оценка экспрессии молекулярно-биологических маркеров.
Изучена эффективность химиотерапии первой линии в лечении 34 больных метастатическим раком желудка (табл. 8). На момент анализа 2 (5,9%) из 34 больных живы и продолжают лечение.
В связи с тем, что все пациенты получали химиотерапию с включением Цисплатина и фторпроизводных пиримидина (5-Фторурацил, Капецитабин, S-1), а также в связи с отсутствием статистически значимой разницы в эффективности химиотерапии в трех лечебных группах, в дальнейшем анализ эффективности и экспрессия молекулярных маркеров проводится в общей группе больных мРЖ (n=34).
Таблица 8.
Эффективность химиотерапии первой линии в лечении больных метастатическим раком желудка (n=34)
| Показатель | Эффективность | |
| n | % | |
| Объективный ответ (ЧР + ПР) | 18 | 52,9 |
| Стабилизация ( 4 месяцев) | 4 | 11,8 |
| Прогрессирование болезни | 12 | 35,3 |
| Медиана времени до прогрессирования, мес. | 6,0 | |
| Медиана общей выживаемости, мес. | 14,0 | |
| 1-годичная выживаемость | 18 | 52,9 |
| 1,5-годичная выживаемость | 10 | 29,4 |
ЧР – частичная регрессия, ПР – полная регрессия
На непосредственную эффективность, т.е. достижение полной и частичной регрессии, оказало статистически значимое влияние количество зон метастазирования и наличие первичной опухоли. У 24 пациентов с минимальным количеством зон метастазирования (1-2) объективный ответ достигнут чаще (59,2%), чем у 10 больных с 3 и более зонами метастатического поражения (33,4%) (р=0,021; r,rs= 0,578). При отсутствии первичной опухоли (n=9), удаленной как с паллиативной целью, так и при радикальной операции, объективный эффект достигнут чаще, чем при ее сохранении (n=25): 66,5% и 40,2% соответственно (р=0,017; r,rs= 0,445).
На медиану времени до прогрессирования и медиану общей выживаемости больных мРЖ оказали статистически значимое влияние количество зон метастазирование, наличие первичной опухоли и непосредственная эффективность химиотерапии. У 24 пациентов с 1-2 зонами метастазирования медиана общей выживаемости составила 9 месяцев, а у 10 больных с 3 и более зонами 5,8 месяцев (р=0,04). Медиана времени до прогрессирования в этих группах равнялась 5,0 и 2,0 месяцам соответственно (р=0,5). У 9 пациентов с удаленной первичной опухолью медиана общей выживаемости составила 21,1 месяц, а у 25 больных, у которых опухоль не была удалена –8,2 месяца (р=0,0017). Медиана времени до прогрессирования в этих группах составила 7,9 и 4,4 месяца соответственно (р=0,037). При достижении частичной и полной регрессии опухоли медиана общей выживаемости составила 12,2 месяцев, а при стабилизации болезни 4 месяцев и при прогрессировании 4,0 мес. (р=0,001).
13 (38,2%) из 34 анализируемых пациентов получили химиотерапию второй линии, на момент начала лечения ECOG их статус не превышал 1. Медиана общей выживаемости в этой группе больных составила 6,0 месяцев (от 3,5 до 22,0), медиана времени до прогрессирования - 4,5 месяца (от 2,0 до 20,0). Частичная регрессия или стабилизация болезни 4 месяцев достигнута у 4 больных (30,8%). Проведение эффективной химиотерапии второй линии увеличило медиану общей выживаемости: при прогрессировании болезни (n=9) 3,2 месяца, при стабилизации болезни 4 месяцев (n=2) 5,7 месяцев, при частичной регрессии опухоли (n=2) 9,5 месяцев.
При многофакторном анализе установлено, что независимыми прогностическими факторами, влияющими на выживаемость, явились отсутствие первичной опухоли к моменту начала лечения (p<0,05) и достижение объективного эффекта (ПР + ЧР) (p<0,05).
Анализ экспрессии молекулярных маркеров в группе больных мРЖ показал, что гиперэкспрессия Топоизомеразы-1, выявленная в 55,9% случаев, прямо коррелировала с экспрессией ТС (р=0,017; r,rs=0,668) и S100А4 (р=0,044; r,rs=0,436). Гиперэкспрессия ТС отмечена у 42,1% мужчин (8/19) и у 100% женщин (15/15) (р=0,001; r,rs=0,600). При низкодифференцированной аденокарциноме экспрессия Топоизомеразы-2 определялась в 61,9% случаев (13/21), а при перстневидноклеточном раке – в 23,1% (3/13) (p=0,02; r,rs=0,683).
Изучена корреляция экспрессии молекулярных маркеров и непосредственной эффективности химиотерапии (таблица 9).
Таблица 9.
Корреляция экспрессии молекулярных маркеров и непосредственной эффективности химиотерапии у больных мРЖ
| Показатель | ЧР + ПР, n (%) (n = 18) | СБ + ПБ, n (%) (n = 16) |
| Ki-67 (более 25%) | 8 (44,4) | 12 (75,0) |
| ТФ в опухолевых клетках | 6 (33,3) | 8 (50,0) |
| ТФ в стромальных клетках | 7 (38,9) | 7 (43,8) |
| ТС | 9 (50,0) | 7 (43,8) |
| ERCC-1 | 2 (11,1) | 5 (31,3) |
| XRCC-1 | 14 (77,8) | 13 (81,3) |
| S100A4 в опухолевых клетках | 11 (61,1) | 12 (75,0) |
| S100A4 в стромальных клетках | 11 (61,1) | 11 (68,8) |
| Топоизомераза 2- | 8 (44,4) | 8 (50,0) |
| Топоизомераза 1 | 11 (61,1) | 8 (50,0) |
| VEGF | 8 (44,4) | 9 (56,3) |
| Р53 | 7 (38,9) | 7 (43,8) |
| Bax | 1 (5,6) | 2 (12,5) |
Установлено, что в группе больных с достигнутым эффектом (ПР + ЧР) реже, чем при отсутствии эффекта (СБ + ПБ), встречались опухоли с высоким индексом пролиферативной активности (Ki-67>25%): 44,4% и 75% соответственно (р=0,05; r,rs= 0,400). Кроме того, в этой группе была ниже частота экспрессии ERCC-1: 11,1% и 31,3% соответственно (р=0,05; r,rs= 0,755).
Наиболее благоприятными в плане эффективности химиотерапии оказались фенотипы ERCC-1/Ki-67 и ERCC-1/Ki-67+, которые характеризовались высокой частотой достижения непосредственного эффекта (66,7 - 72,2%) в сравнении с группами ERCC-1+/Ki-67+ и ERCC-1+/Ki-67 (27,8 - 33,3%) (таблица 10).
Таблица 10.
Эффективность химиотерапии и экспрессия ERCC-1 и Ki-67
| Маркеры | Количество случаев | ПР+ЧР (%) |
| ERCC-1+/Ki-67+ ERCC-1+/Ki-67 ERCC-1/Ki-67+ ERCC-1/Ki-67 | 5 6 11 12 | 27,8 33,3 66,7 72,2 |
Установлено, что при гиперэкспрессии ERCC-1 наблюдалась меньшая, чем при отсутствии экспрессии, медиана времени до прогрессирования (3,0 и 5,0 месяцев соответственно, р=0,048) и медиана общей выживаемости (7,0 и 10,0 месяцев соответственно, р=0,035).
Анализ совместной экспрессии молекулярных маркеров показал наличие модуляции медианы времени до прогрессирования и медианы общей выживаемости в группе опухолей, имеющих экспрессию ТФоп в сравнении с опухолями, не имеющими данной экспрессии (таблица 11). Таким образом, из всех анализируемых групп (ERCC-1+/ТФоп+, ERCC-1/ТФоп+, ERCC-1+/ТФоп и ERCC-1/ТФоп) наименее прогностически благоприятной оказалась группа опухолей с фенотипом ERCC-1+/ТФоп+.
Таблица 11.
Медиана общей выживаемости больных мРЖ и
экспрессия ERCC-1 и ТФ в опухолевых клетках
| Фенотип | Медиана ВДП, мес. | р | Медиана ОВ, мес. | р |
| ERCC-1+/ТФоп+ ERCC-1/ТФоп+ | 2,0 6,0 | 0,053 | 4,0 12,0 | 0,012 |
| ERCC-1+/ТФоп ERCC-1/ТФоп | 4,0 4,0 | 7,0 7,0 |
Опыт применения Герцептина в комбинации с химиотерапией в 1-й линии лечения больных мРЖ с гиперэкспрессией/амплификацией HER-2/neu.
С 2006 по 2010 гг. в отделении химиотерапии и комбинированного лечения злокачественных опухолей РОНЦ им. Н.Н.Блохина РАМН лечение получили 6 больных, имеющих HER-2позитивный статус опухоли, который подтвержден ИГХ методом (3+, n=6) и FISH реакцией (выявлена амплификация гена, n=6).
В первой линии лечения использовались следующие режимы химиотерапии: 1) Цисплатин 80 мг/м2 день 1, Капецитабин 2000 мг/м2/сутки день 1-14, каждые 3 недели, общим числом курсов 6; 2) Таксотер 35 мг/м2 день 1 и 8, Оксалиплатин 70 мг/м2 день 1 и 8, Кселода 1600 мг/м2/сутки в два приема день 1-14, каждые 3 недели, общим числом курсов 6. У 3 из 6 больных проведен курс химиотерапии с включением Трастузумаба, который назначался в трехнедельном режиме (8 мг/кг (нагрузочная доза), затем 6 мг/кг в/в 90-минутная инфузия день 1) в комбинации с химиотерапией и после ее завершения до прогрессирования болезни. Больным, получавшим Трастузумаб, до начала участия в исследовании выполнялась эхокардиография (критерий включения уровень фракции выброса левого желудочка 55%). В исследование не включались пациенты с отягощенным кардиологическим анамнезом (инфаркт миокарда в течение 6 месяцев до начала лечения, неконтролируемая артериальная гипертензия, сердечная недостаточность, стенокардия, требующая медикаментозной терапии). Кардиологический мониторинг осуществлялся у всех больных перед началом участия в исследовании и каждые 12 недель после.
Всем пациентам до начала лечения выполнена компьютерная томография органов грудной клетки, брюшной полости и малого таза. В процессе лечения с целью оценки эффективности химиотерапии контрольное обследование повторялось каждые 2 цикла. Оценка эффекта проводилась согласно критериям RECIST.
На момент анализа 2 из 6 пациентов живы и продолжают лечение. Анализ эффективности химиотерапии представлен в таблице 12.
Таблица 12.
Эффективность химиотерапии ± Герцептин у больных мРЖ с гиперэкспрессией/амплификацией HER-2/neu
| Показатель | Химиотерапия + Трастузумаб (n=3) | Химиотерапия (n=3) |
| Медиана времени до прогрессирования, мес. | 17,0 | 5,0 |
| Общая выживаемость, мес. | 24,0+ | 7,0 |
В группе больных, получавших Трастузумаб (n=3), у 1 удалось достичь полной регрессии опухоли, у 2 – частичной регрессии. В группе не получавших Трастузумаб, у 2 из 3 пациентов получена частичная регрессия опухоли, у 1 - наступило прогрессирование болезни после 2-х курсов химиотерапии. Медиана времени до прогрессирования заболевания составила соответственно 5,0 и 17,0 месяцев в группах Трастузумаб и Трастузумаб+. Медиана общей выживаемости в группе Трастузумаб составила 7,0 месяцев, а в группе Трастузумаб+ не достигнута. Средняя общая выживаемость в группе получавших Трастузумаб пациентов достигла 24,0+ месяцев.
Согласно проведенному анализу, добавление Герцептина увеличивало медиану времени до прогрессирования и среднюю общую выживаемость больных мРЖ с гиперэкспрессией/амплификацией HER-2/neu.
ВЫВОДЫ
- Факторами неблагоприятного прогноза и высокого риска метастазирования у больных, радикально оперированных по поводу рака желудка, явились наличие экспрессии Р53 (р=0,013), отсутствие экспрессии Bax (р=0,012) и ТФ в опухолевых (р=0,019) и стромальных клетках (р=0,032).
- При отсутствии поражения регионарных лимфатических узлов факторами неблагоприятного прогноза у больных, радикально оперированных по поводу рака желудка, явились отсутствие экспрессии ТС (р=0,003) или COX-2 (р=0,007).
- При многофакторном анализе установлено, что независимыми прогностическими факторами низкой общей выживаемости больных, радикально оперированных по поводу рака желудка, явились высокая экспрессия Р53 (р<0,05) и низкая экспрессия ТФ в опухолевых клетках (р<0,05).
- Наименее благоприятный прогноз у больных раком желудка с IB-IV(М0) стадиями после выполнения радикальной операции отмечен при фенотипе первичной опухоли Р53+/ТФоп (медиана общей выживаемости у данной группы составляет 11 месяцев).
- Эффективность новых режимов химиотерапии с включением Цисплатина и фторпроизводных пиримидина (капецитабин, S-1) в первой линии лечения больных метастатическим раком желудка составила 52,9% (ПР + ЧР), медиана времени до прогрессирования 6,0 месяцев, а медиана общей выживаемости 14,0 месяцев. 1-годичная общая выживаемость составила 52,9%, а 1,5-годичная 29,4%.
- Наличие первичной опухоли (р=0,017), 3 и более зоны метастатического поражения (р=0,021), присутствие экспрессии ERCC-1 (p=0,05) и высокая пролиферативная активность опухоли (Ki-67 более 25%) (р=0,05) явились факторами, отрицательно влияющими на частоту достижения частичной и полной регрессии, для комбинации Цисплатина и фторпроизводных пиримидина в первой линии лечения больных мРЖ.
- Независимыми прогностическими факторами, характеризующими высокую медиану общей выживаемости больных мРЖ оказались: отсутствие первичной опухоли к моменту начала лечения (p<0,05), достижение объективного эффекта (ПР + ЧР) (p<0,05) и отсутствие экспрессии ERCC-1 (р=0,035).
- При изучении эффективности Герцептина в комбинации с химиотерапией первой линии в лечении больных метастатическим раком желудка с гиперэкспрессией/амплификацией HER-2/neu установлено, что добавление Герцептина увеличивало медиану времени до прогрессирования c 5,0 до 17,0 месяцев. Медиана общей выживаемости в группе больных, не получавших Трастузумаб, составила 7,0 месяцев, а в группе больных, получавших Трастузумаб, медиана не достигнута, а средняя общая выживаемость составила 24,0+ месяца.
Список работ, опубликованных по теме диссертации.
- Луд, А.Н. Капецитабин в лечении больных раком желудка / А.Н. Луд // Фарматека. 2009. № 18. С. 53-56.
- Луд, А.Н. Применение Авастина в лечении злокачественных опухолей желудочно-кишечного тракта / А.Н. Луд, И.П. Ганьшина // Фарматека. 2008. № 19. С.15-21.
- Луд, А.Н. Экспрессия тимидилат синтетазы и тимидин фосфорилазы в ткани опухоли у больных раком желудка, получавших адъювантную химиотерапию с включением фторурацила / А.Н. Луд, Е.В. Степанова, Я.В. Вишневская, А.И. Шмак, В.В. Жарков, А.Ю. Барышников // Российский биотерапевтический журнал. 2007. № 4. С. 1-7.
- Луд, А.Н. Применение Элоксатина в лечении больных раком толстой кишки и желудка / А.Н. Луд // Фарматека. 2007. № 18. С. 17-22.
- Луд, А.Н. Значение молекулярно-биологических маркеров при раке желудка и пищевода / А.Н. Луд / Российский биотерапевтический журнал. 2007. № 3. С. 38-42.
- Луд, А.Н. Молекулярно-биологические маркеры при раке желудка: эффективность химиотерапии, факторы прогноза / А.Н. Луд // Достижения фундаментальной, клинической медицины и фармации. Материалы 62-й научной сессии сотрудников ВГМУ, Витебск, Беларусь, 15 20 нояб. 2007. С. 255-257.
- Луд, А.Н. Новые возможности использования молекулярно-биологических маркеров в прогнозировании эффективности химиотерапии с включением фторпиримидинов / А.Н. Луд, Е.В. Степанова // Достижения фундаментальной, клинической медицины 63-й научной сессии сотрудников ВГМУ, Витебск, Беларусь, 12 16 нояб. 2008. С. 217-220.
- Lud, H. Expression for thymidylate synthase and thymidine phosphorylase intumour tissue for gastric cancer patients treated with adjuvant 5-fluorouraciland leucovorin chemotherapy / H. Lud, E. Stepanova, Y. Vyshnevskaya, A. Baryshnikov // 19th International Congress on Anti-Cancer Treatment (ICACT), Paris, France. 5 8 Febr. 2008. P. 125.
- Луд, А.Н. Факторы прогноза при раке желудка / А.Н. Луд // Достижения фундаментальной, клинической медицины и фармации. Материалы 64-й юбилейной научной сессии ВГМУ, посвященной 75-летию его образования, Витебск, Беларусь, 17 21 нояб. 2009. С. 37-40.

