Влияние белка сrabp1 на биологические характеристики трансформированных клеток мезенхимального происхождения, ассоциированные с опухолевой прогрессией
На правах рукописи
КАИНОВ Ярослав Андреевич
ВЛИЯНИЕ БЕЛКА СRABP1 НА БИОЛОГИЧЕСКИЕ
ХАРАКТЕРИСТИКИ ТРАНСФОРМИРОВАННЫХ КЛЕТОК
МЕЗЕНХИМАЛЬНОГО ПРОИСХОЖДЕНИЯ, АССОЦИИРОВАННЫЕ С ОПУХОЛЕВОЙ ПРОГРЕССИЕЙ
Специальность 14.01.12 – онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата биологических наук
Москва
2011
Работа выполнена в Учреждении Российской академии медицинских наук
Российском онкологическом научном центре имени Н.Н.Блохина РАМН
(директор – академик РАН и РАМН, д.м.н., проф. М.И.Давыдов)
Научные руководители:
Кандидат биологических наук Чевкина Елена Максимовна
Доктор медицинских наук Харатишвили Теймураз Кобаевич
Официальные оппоненты:
Доктор биологических наук Карпухин Александр Васильевич
Доктор биологических наук Красильников Михаил Александрович
Ведущая организация: Учреждение Российской академии наук Институт молекулярной биологии им. В.А.Энгельгардта РАН
Защита диссертации состоится «_12_» __мая_____ 2011 года в 14.00 часов
на заседании диссертационного совета (Д.001.017.01) РОНЦ имени Н.Н.Блохина РАМН по адресу: 115478, Москва, Каширское шоссе, 24.
С текстом диссертации можно ознакомиться в библиотеке РОНЦ имени Н.Н.Блохина РАМН
Автореферат разослан «29» ___марта_ 2011 года.

Ученый секретарь
диссертационного совета
д.м.н., профессор Ю.В. Шишкин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Опухолевая прогрессия – сложный и многоступенчатый процесс, включающий в себя развитие первичной опухоли и распространение опухолевых клеток по организму, что приводит к образованию очагов вторичного роста в отдаленных органах. Именно этот процесс, называемый метастазированием, является основной причиной гибели пациентов с онкологическими заболеваниями. Безусловно, идентификация и функциональный анализ ключевых белков и сигнальных каскадов, задействованных в регуляции опухолевой прогрессии и метастазирования, является одной из важнейших фундаментальных задач молекулярной биологии и экспериментальной онкологии. При этом основные знания о механизмах опухолевой прогрессии касаются, в основном, трансформированных клеток и опухолей эпителиального происхождения. В этой ситуации особо актуальными являются исследование особенностей прогрессии опухолей мезенхимальной природы (в частности мягкотканных сарком) и механизмов, обеспечивающих их высокий метастатический потенциал.
Одним из основных подходов к изучению механизмов опухолевой прогрессии являются исследования на экспериментальных моделях. Одной из таких моделей является панель клеточных линий мезенхимального происхождения - фибробластов сирийского хомяка, трансформированных вирусом саркомы Рауса, принципиально отличающихся между собой по уровню органоспецифического метастазирования в легкие при введении экспериментальным животным. Основным достоинством этой модели является возможность проведения теста на спонтанную метастатическую активность (СМА) на иммунокомпетентных животных, который позволяет смоделировать все этапы прогрессии от возникновения первичной подкожной опухоли до пролиферации ее клеток в очаге вторичного роста в условиях активного противоопухолевого иммунитета. Таким образом, данная модель представляется чрезвычайно перспективной для изучения механизмов опухолевой прогрессии и обнаружения потенциальных маркеров метастазирования.
Ранее Зуевой Э. Ш. при сравнении профилей экспрессии двух клеточных линий из описанной выше панели - низкометастазной HET-SR и высокометастазной HET-SR1 c помощью двумерного гель-электрофореза были получены первичные данные, свидетельствующие о принципиальном различии в уровне продукции клеточного белка CRABP1. Данный белок локализуется в цитоплазме, его основная функция заключается в связывании ретиноевой кислоты (РК) и, предположительно, снижении ее транскрипционной активности. В последнее время значительно возрос интерес к изучению механизмов регуляции РК в процессе возникновения и роста солидных опухолей. Стимуляция метаболизма ретиноевой кислоты может снижать уровень клеточной дифференцировки, что является одним из показателей опухолевой прогрессии на клеточных моделях, а также служит клиническим признаком агрессивности новообразований и часто коррелирует с неблагоприятным медицинским прогнозом.
Изменение экспрессии CRABP1 характерно для ряда новообразований человека, таких как опухоли молочной железы, аденокарциномы эндометрия, немелкоклеточный рак легкого, рак яичников и нейрогенные опухоли, и, по некоторым немногочисленным наблюдениям, может коррелировать с неблагоприятным медицинским прогнозом. При этом молекулярные механизмы участия данного белка в процессах канцерогенеза практически не изучены. Данные о роли CRABP1 в процессе метастазирования на сегодняшний день в научной литературе отсутствуют.
Данная работа посвящена изучению влияния белка CRABP1 на процесс опухолевой прогрессии и метастазирования на экспериментальной модели клеточных линий мезенхимального происхождения. Также в работе впервые проведен первичный анализ экспрессии данного гена в коллекции образцов мягкотканных сарком человека.
Таким образом, данное исследование представляется чрезвычайно актуальным, поскольку позволяет выявить роль CRABP1 в формировании злокачественного фенотипа опухолевых клеток и обнаружить ряд связанных с этим процессом молекулярных изменений, а также сопоставить эти данные с результатами, полученными при исследовании клинического материала.
Цель и задачи исследования
Целью данной работы было изучение роли белка CRABP1 в регуляции ключевых биологических характеристик трансформированных клеток мезенхимального происхождения, ассоциированных с опухолевой прогрессией in vitro и in vivo.
В соответствии с указанной целью были поставлены следующие экспериментальные задачи:
- Выявить корреляцию между экспрессией CRABP1 и уровнем спонтанной метастатической активности клеточных линий панели RSV -трансформированных фибробластов сирийского хомяка;
- Гиперэкспрессировать кодирующую последовательность мРНК CRABP1 хомяка в низкометастазной клеточной линии HET-SR; исследовать влияние экзогенного CRABP1 на туморогенность и спонтанную метастатическую активность клеток данной линии;
- Получить производные высокометастазной клеточной линии HET-SR1 с подавленной экспрессией CRABP1 и изучить их туморогенность, а также экспериментальную и спонтанную метастатическую активность;
- Провести сравнительный анализ основных клеточных характеристик полученных линий in vitro: динамики пролиферации, миграционной активности, клоногенности и способности к неприкрепленному росту, а также экспрессии ряда протеаз, разрушающих внеклеточный матрикс (uPA, MMP-2, MMP-9, MMP-13) и маркеров клеточной дифференцировки (CD24, RALDH1, RAR и CYP26A1);
- Получить мутантную форму CRABP1, не связывающую ретиноевую кислоту, и изучить влияние экспрессии данной конструкции на туморогенность низкометастазной клеточной линии HET-SR;
- Провести анализ экспрессии CRABP1 в образцах злокачественных опухолей мягких тканей человека.
Научная новизна и практическая значимость исследования
Одним из важнейших результатов данной работы является тот факт, что экспрессия CRABP1 важна для формирования метастатического фенотипа ряда клеточных линий мезенхимального происхождения. Это является первым экспериментальным доказательством промотирующего влияния CRABP1 на процесс опухолевой прогрессии, что делает полученные в представленной работе данные уникальными. Также полученные в работе результаты расширяют представления о роли CRABP1 в канцерогенезе. В результате проведенных исследований получены приоритетные данные о влиянии CRABP1 на многие характеристики неопластических клеток. В частности, впервые показано, что экспрессия CRABP1 стимулирует туморогенность клеточных линий HET-SR и HET-SR1. Также продемонстрировано влияние CRABP1 на экспрессию MMP-13 и MMP-14. Впервые показана гиперэкспрессия CRABP1 в образцах злокачественных фиброзных гистиоцитом человека.
Работа имеет в первую очередь фундаментальное теоретическое значение. Полученные данные о роли CRABP1 в опухолевой прогрессии и процессе метастазирования могут быть использованы при дальнейшем его изучении, как на модельных системах, так и в клинических исследованиях. Возможно, что такие исследования приведут к открытию новых диагностических маркеров и мишеней для таргетной терапии опухолей.
Публикации и апробация работы
Диссертация апробирована и рекомендована к защите 24 февраля 2011 года на совместной научной конференции лабораторий регуляции клеточных и вирусных онкогенов, молекулярной биологии вирусов, механизмов прогрессии эпителиальных опухолей, механизмов канцерогенеза и генетики опухолевых клеток НИИ Канцерогенеза РОНЦ им. Н.Н. Блохина РАМН. Материалы работы докладывались на конференциях: «Cancer Degradome Symposium» в 2008 г. (Лондон, Англия), «Molecular Mechanism in Signal Transduction and Cancer» в 2009 г (Греция, Спецес), «Методы культивирования клеток» в 2009 г. (Санкт-Петербург), Beatson international cancer conference “Microenvironment, motility and metastasis” в 2009 г. (Глазго, Шотландия). По результатам диссертационной работы опубликованы 3 научные статьи и 6 тезисов докладов.
Структура и объём диссертации
Диссертация изложена на 134 страницах машинописного текста, содержит 34 рисунка, 6 таблиц. Состоит из глав: «Ведение», «Обзор литературы», «Материалы и методы», «Результаты», «Обсуждение», «Выводы». Глава «Список использованной литературы» содержит 178 источников.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы
В работе использованы следующие методы исследования: трансформация бактериальных клеток, выделение плазмидной ДНК из бактериальных клеток, электрофорез нуклеиновых кислот, молекулярное клонирование, сайт-направленный мутагенез, трансфекция эукариотических клеток, инфицирование клеток псевдовирусными частицами, подавление экспрессии генов с помощью малых шпилечных РНК, анализ количества мРНК методом ОТ-ПЦР, ПЦР в реальном времени, выделение и анализ белковых фракций с помощью вестерн-блот гибридизации, анализ ферментативной активности протеиназ внеклеточного матрикса (субстрат-специфическая зимография в ПААГ), анализ динамики роста клеток, анализ «зарастания раны» in vitro (wound healing assay), тест на образование колоний в условиях разреженной популяции (клоногенность), тест на образование колоний в полужидкой среде, тест на миграцию клеток по градиенту концентраций факторов роста, определение туморогенности клеточных линий, экспериментальной метастатической активности (ЭМА) и спонтанной метастатическоей активности (СМА) клеток на лабораторных животных, а также статистическая обработка данных.
Результаты исследования и обсуждение
1. Исследование экспрессии CRABP1 в линиях с различным метастатическим потенциалом
Одной из моделей для поиска новых сигнальных путей и конкретных белков, вовлеченных в процесс опухолевой прогрессии и метастазирования, является панель эмбриональных фибробластов сирийского хомяка, трансформированных вирусом саркомы Рауса (рис. 1А). Все линии данной панели характеризуются высоким уровнем туморогенности, но принципиально различаются по уровню органоспецифического метастазирования в легкие в тесте на спонтанную метастатическую активность (СМА) при подкожном введении клеток (рис. 1Б). В тесте на СМА исследуемые клетки проходят все этапы процесса метастазирования - возникновение первичной подкожной опухоли, интравазию и распространение опухолевых клеток по кровотоку, выживание в кровотоке, экстравазию в органы-мишени и пролиферацию в очаге вторичного роста в условиях активного противоопухолевого иммунитета. Используемая модель позволяет исследовать метастатическую активность клеток на иммунокомпетентных животных, что наиболее адекватно отражает процесс метастазирования, происходящий в естественных условиях. Поскольку все линии имеют общее происхождение и достаточно схожие профили экспрессии большинства генов, изучение различий между высоко- и низкометастазными клеточными линиями весьма перспективно с точки зрения изучения молекулярных механизмов метастазирования.
В данной работе использовались низкометастазная (Н/М) линия HET-SR, исходно высокометастазные (В/М) линии HET-SR1 и HET-SR8 и В/М линия HET-SR-2SC, полученная в ходе селекции клеток HET-SR in vivo (после двух последовательных подкожных введений животным и последующего отбора клеток из метастазов в лимфоузлы). Описываемая панель линий получена в лаборатории противоопухолевого иммунитета НИИ Канцерогенеза РОНЦ РАМН им. Н.Н.Блохина и ранее была подробно охарактеризована.

Рисунок 1. А – панель исходных клеточных линий RSV-трансформированных фибробластов сирийского хомяка с разным уровнем спонтанной метастатической активности; Б – Схема эксперимента по изучению спонтанной метастатической активности (СМА) клеток in vivo.
Ранее при сравнении профилей экспрессии белков в высоко- и низкометастазных линиях методом двумерного гель-электрофореза Зуевой Э.Ш (Институт Кюри, Париж, Франция) обнаружено отсутствие продукции CRABP1 в Н/М линии HET-SR и высокий уровень данного белка в В/М линии HET-SR1. Этот факт поставил вопрос о возможном участии CRABP1 в приобретении трансформированными клетками агрессивного фенотипа.
На первом этапе исследования мы подтвердили данные двумерного гель-электрофореза. Для этого в линиях HET-SR и HET-SR1 экспрессия CRABP1 была проанализирована с помощью ОТ-ПЦР и вестерн-блот анализа (рис. 2). Из представленных данных мы заключили, что экспрессия CRABP1 характерна только для высокометастазной линии HET-SR1, при этом отличия наблюдаются как на уровне мРНК, так и на уровне продукции белка CRABP1.

Рисунок 2. Сравнение экпрессии CRABP1 в линиях HET-SR и HET-SR1. Данные полуколичественного ОТ-ПЦР (А) и Вестерн-блот анализа (Б).
Для подтверждения возможной корреляции между продукцией белка CRABP1 и уровнем метастатической активности был проведен анализ экпрессии данного белка в других высокометастазных линиях трансформированных фибро-бластов хомяка (рис. 3).

Рисунок 3. Экспрессия CRABP1 в высокометастазных линиях исследуемой панели. А – Cпонтанная метастатическая активность изучаемых линий (указано среднее число метастазов на животное); Б – Вестерн-блот анализ продукции белка CRABP1.
Оказалось, что CRABP1 экпрессируется на высоком уровне во всех высокометастазных линиях данной панели. Важно отметить, что повышение продукции этого белка характерно для линии HET-SR-2SC, полученной из низкометастазной линии HET-SR методом селекции in vivo. Полученные данные свидетельствуют о корреляции между экпрессией CRABP1 и уровнем спонтанной метастатической активности исследуемых клеточных линий и позволяют предположить, что белок СRABP1 функционально участвует в формировании злокачественного клеточного фенотипа в данной модели.
2. Получение линии HET-SR c гиперэкспрессией CRABP1 и изучение ее свойств in vivo
Для изучения влияния CRABP1 на свойства клеток, ассоциированные с опухолевой рогрессией, ген был гиперэкспрессирован в клетках низкометастазной линии HET-SR, где его экспрессия отсутствует. Для этого получен ретровирусный вектор pLXSN, несущий кодирующую последовательность мРНК CRABP1 хомяка. Поскольку геном сирийского хомяка не секвенирован, амплификация и молекулярное клонирование проводилось в двух независимых повторах. Полученная последовательность была секвенирована и опубликована в открытой базе последователностей GenBank (регистрационный номер GQ139546.1). Далее, с помощью ретровирусной инфекции была получена линия HET-SR CRABP1, характеризующаяся стабильной продукцией изучаемого белка (рис.4).

В данной работе проведен анализ in vivo двух основных клеточных характеристик линии HET-SR CRABP1 – туморогенности и спонтанной метастатической активности. Для изучения туморогенности суспензия исследуемой клеточной линии в четырех последовательных разведениях (использовались «дозы» в 2х104, 2х103, 2х102 и 2х101 клеток) прививалась подкожно каждому экспериментальному животному в места сочленения лап с туловищем (рис.5А). Затем, по прошествии двух месяцев в исследуемых группах анализировалось наличие сформировавшихся в местах введения клеток опухолей. В каждом эксперименте использовали не менее 10 животных для каждой группы. Как видно из рисунка 5Б, линия HET-SR СRABP1 характеризуется статитистически достоверным повышением туморогенности по сравнению с линией HET-SR pLXSN. Так, у всех животных с подкожно введенной линией HET-SR СRABP1 на месте введения максимальной дозы - 2х104 клеток развивались опухолевые узлы, в то время как в контрольной группе обнаруживались животные без опухолей, что свидетельствует о том, что даже максимальные количества вводимых клеток контрольной линии не прививались. Опухоли после введения 2x103 клеток линии HET-SR CRABP1 также развивались у хомяков гораздо чаще. Опухоли на месте введения животным дозы в 2х102 клеток развивались только в случае подкожного введения линии HET-SR CRABP1 и отсутствовали у хомяков с введенными клетками HET-SR pLXSN.

Рисунок 5. A – Схема эксперимента по оценке уровня туморогенности клеток исследуемых линий, Б – Туморогенность производной линии HET-SR с гиперэкспрессией CRABP1. (здесь и далее * - p<0,05)
Анализ СМА для каждой линии также проводили на 10 экспериментальных животных не менее чем в трех повторах. Для определения количества метастазов животных усыпляли, легкие фиксировали в формалине. Далее легочную ткань заливали в парафин и готовили гистологические срезы толщиной 5-6 мкм. Определение количества метастазов проводилось микроскопически посредством гистологического исследования ткани легкого (90 срезов на каждый образец). На рисунке 6А представлен пример микроскопического анализа среза ткани легкого, окрашенного гематоксилином и эозином, с метастатическим поражением.
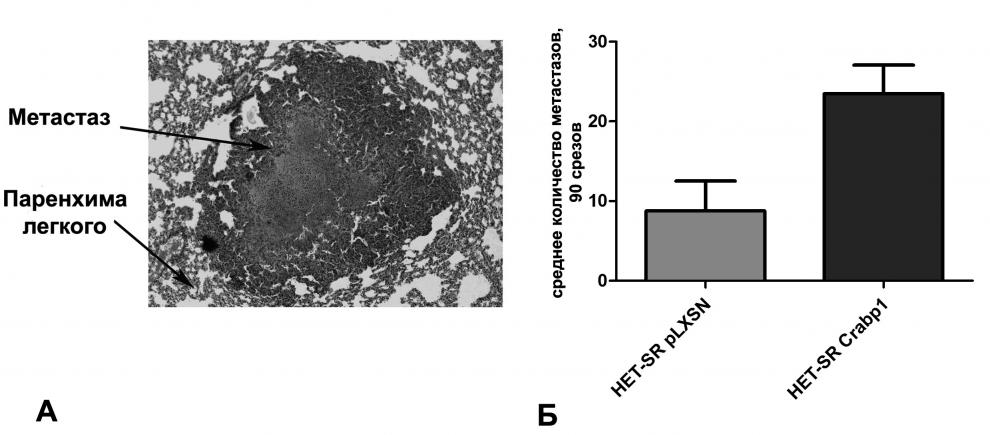
Рисунок 6. A – Срез ткани легкого с метастатическим поражением, окрашенный гематоксилином и эозином, Б – Спонтанная метастатическая активность производных линии HET-SR с гиперэкспрессией CRABP1. Указано число гистологически верифицированных метастазов на 90 срезов.
Клетки низкометастазной линии HET-SR с гиперэкспрессией CRABP1 образуют большее количество легочных метастазов после подкожного введения, чем контрольная линия (Рис. 6Б). Однако только в трех экспериментах из пяти это отличие было статистически достоверно (p<0,05), в двух других экспериментах исследуемые выборки значимо не отличались (p<0.1). Таким образом, можно говорить лишь о тенденции к повышению СМА при гиперэкспрессии CRABP1 в линии HET-SR.
3. Получение производных линии HET-SR1 c подавленной экспрессией CRABP1 и изучение их свойств in vivo
На следующем этапе исследования в высокометастазной линии HET-SR1 была подавлена экспрессия эндогенного CRABP1. Для этого нами были получены лентивирусные конструкции на основе вектора pLKO.1 puro, кодирующие предшественники малых шпилечных РНК к кодирующей последовательности мРНК CRABP1 хомяка. В качестве контроля использовался вектор pLKO.1 puro, кодирующий малую шпилечную РНК к последовательности eGFP (pLKO.1 shGFP). Далее с помощью лентивирусной инфекции были получены три поликлональные клеточные линии, производные HET-SR1, со сниженной продукцией белка CRABP1. Наибольшая эффективность подавления экспрессии CRABP1 наблюдалась для шпилечной конструкции shB. В дальнейших экспериментах были использованы клеточные линии HET-SR1 shA и HET-SR1 shB, так как в них эффект подавления экспрессии был наиболее выражен (Рис. 7).
Клеточные линии HET-SR1 shA и HET-SR1 shB были охарактеризованы с точки зрения их туморогенности и СМА. Обе линии оказались менее туморогенны по сравнению с контролем, и это отличие статистически достоверно (рис. 8А). Так, подавляющее число животных в контрольной группе характеризовались наличием опухолей, образовавшихся после подкожного введения 2x102 клеток. В то же время, в группах животных, которым вводились клетки со сниженной экспрессией CRABP1, опухоли на месте введения 2x102 опухолевых клеток образовывались у значительно меньшего количества животных, а при введении 2x101 клеток рост подкожных опухолей не наблюдался.

Рисунок 7. Анализ экспрессии CRABP1 в производных линии HET-SR1. A- Вестерн-блот. В качестве положительного котроля использовали лизат линии HET-SR1. Б – Результаты денситометрического обсчета.
Сравнение СМА исследуемых линий показало, что линии HET-SR1 shA и HET-SR1 shB характеризуются сниженным уровнем метастазирования в легкие. При этом уровень такого снижения был выраженнее в случае линии HET-SR1 shB и коррелировал со степенью подавления экспрессии CRABP1 (Рис. 8Б). Таким образом, в линии HET-SR1 экспрессия CRABP1 функционально связана с высокометастазным фенотипом. Направленное подавление продукции белка CRABP1 приводит к статистически достоверному снижению туморогенности и спонтанной метастатической активности данной клеточной линии.
Поскольку литературные данные об участии CRABP1 в процессе метастазирования на сегодняшний день отсутствуют, данное исследование является первым экспериментальным свидетельством подобной функции этого белка.

Рисунок 8. A – Туморогенность производных линии HET-SR1 со сниженной экспрессией CRABP1. Б – Спонтанная метастатическая активность производных линии HET-SR1 со сниженной экспрессией CRABP1. Указано число гистологически верифицированных метастазов на 90 срезов.
4. Изучение активности и экспрессии протеаз, разрушающих внеклеточный матрикс
Поскольку способность расщеплять компоненты внеклеточного матрикса является важной характеристикой опухолевых клеток, коррелирующей с процессом метастазирования, мы провели анализ активности и экспрессии ряда секретируемых протеаз, участвующих в разрушении внеклеточного матрикса. Анализ желатиназной активности в кондиционированных средах показал, что изучаемые клеточные линии характеризуются сходным уровнем активности MMP-2, а активность MMP-9 наблюдается только в производных линии HET-SR (Рис. 9). Однако активность этой металлопротеиназы низка и не зависит от статуса экспрессии CRABP1. Наиболее интересным результатом, полученным в ходе данного эксперимента, является снижение коллагеназной активности в производных линии HET-SR1 c подавленной экспрессией CRABP1.
К сожалению, метод желатиназной зимографии не позволяет идентифицировать, какая именно коллагеназа – MMP-1, MMP-8 или MMP-13 - активна в линии HET-SR1 из-за сходной молекулярной массы данных ферментов. Для идентификации конкретной коллагеназы мы исследовали экспрессию мРНК всех трех ферментов и установили, что, вероятнее всего, это MMP-13, поскольку она экспрессируется в линии HET-SR1 и во всех ее производных на высоком уровне, в то время, как экспрессия MMP-1 и MMP-8 не детектируется (Рис. 10). Следует отметить, что высокая экспрессия и активность MMP-13 коррелирует с высоким уровнем инвазивности опухолей и является фактором неблагоприятного медицинского прогноза при опухолях головы и шеи, раке молочной железы и толстой кишки. Таким образом, полученные данные об активности ММР-13 в изучаемых линиях согласуются с литературными данными.

Парадоксально, но уровень экспрессии мРНК MMP-13 в линиях HET-SR1 shA и HET-SR1 shB несколько выше, чем в контрольной линии, что не соотносится с данными об активности данной протеазы в желатиназной зимографии. Для объяснения этого факта, мы изучили экспрессию MMP-14, другой матриксной металлопротеиназы, которая, согласно литературным данным, играет ключевую роль в активации MMP-13, за счет протеолиза ее неактивного предшественника. Анализ экспрессии методом ОТ-ПЦР выявил выраженное снижение количества мРНК MMP-14 в линиях с подавленной экспрессией CRABP1 (Рис. 10).
Известно, что экспрессия MMP-13 и MMP-14 может активно регулироваться ретиноевой кислотой. При этом экспрессия MMP-13 позитивно регулируется РК и ее производными, в то время как для MMP-14 характерна негативная регуляция. Подавление продукции CRABP1 может приводить к снижению метаболизма РК и, соответственно, усилению транскрипции гена MMP-13 и подавлению MMP-14. Снижение экспрессии MMP-14, в свою очередь, препятствует протеолитической активации предшественника MMP-13, что и приводит к уменьшению активности данной протеазы в желатиназной зимографии. Этот механизм, безусловно, является гипотетическим и требует экспериментального подтверждения.

Важно отметить, что изначально в линиях HET-SR и HET-SR1 экспрессия MMP-14 коррелирует с их метастатической активностью. Кроме того, по литературным данным, экспрессия этой металлопротеиназы высока в линии HET-SR-2SC, что позволяет предположить ее функциональный вклад в формирование метастатического фенотипа изучаемых линий.
5. Исследование характеристик полученных клеточных линий в культуре in vitro
Для выявления потенциальных механизмов участия белка CRABP1 в формировании злокачественного фенотипа мы исследовали ряд ассоциированных с метастатическим потенциалом характеристик полученных клеточных линий in vitro. Перечень исследованных клеточных характеристик и суммарные данные об их изменении in vivo и in vitro схематически представлены в таблице 1.
В случае производных низкометастазной линии HET-SR не удалось установить значимых изменений в основных исследуемых клеточных свойствах.
Подавление экспрессии CRABP1 в высокометастазной линии HET-SR1 также не привело к изменению динамики пролиферации и способности к колониеобразованию в тесте на клоногенность, однако усиливало способность линии HET-SR1 к формированию колоний в полужидкой среде. Этот результат представляется сложно интерпретируемым, поскольку в подавляющем числе работ эта характеристика коррелирует с более злокачественным фенотипом различных опухолевых клеток. При этом, феноменологически, в нашей модельной системе наблюдается обратная корреляция между данной клеточной характеристикой и спонтанной метастатической активностью изучаемых линий: способность к формированию колоний в метилцеллюлозе высока у исходной низкометастазной линии HET-SR и низка у HET-SR1. Соответственно, снижение экспрессии CRABP1 в высокометастазной клеточной линии приводит к стимуляции данной характеристики до уровня низкометастазной клеточной линии, что коррелирует с уровнем снижения спонтанной метастатической активности.
Таблица 1. Сравнительный анализ изменений клеточных характеристик изучаемых линий.
| HET-SR pLXSN | HET-SR CRABP1 | HET-SR1 shGFP | HET-SR1 ShA | HET-SR1 shB | |||||
| Экспрессия CRABP1 | (-) | (+) | (+) | (-) | (-) | ||||
| Туморогенность | (-) | (+) | (+) | (-) | (-) | ||||
| СМА | (-) | (+)? | (+) | (-) | (-) | ||||
| ЭМА количество метастазов | Н/Д | Н/Д | (+) | (+) | (+) | ||||
| ЭМА размер метастазов | Н/Д | Н/Д | (+) | (-) | (-) | ||||
| Клоногенность | (-) | (-) | (+) | (+) | (+) | ||||
| Рост в полужидкой среде | (+) | (+) | (-) | (+) | (+) | ||||
| Миграция в «ране в монослое» | (-) | (-) | (+) | (+) | (+) | ||||
| Миграция в камерах Бойдена | (-) | (-) | (+) | (++) | (++) | ||||
| Активность коллагеназ | (-) | (-) | (+) | (-) | (-) | ||||
| Экспрессия MMP-13 | (-) | (-) | (+) | (++) | (++) | ||||
| Экспрессия MMP-14 | (-) | (-) | (+) | (-) | (-) | ||||
| (+) | (++) | (-) | Н/Д | ||||||
| Высокая выраженность признака | Усиление выраженности по сравнению с контролем | Низкая выраженность признака | Данные отсутсвуют | ||||||
Снижение экспрессии CRABP1 вызывает усиление миграционной активности линии HET-SR1 в камерах Бойдена по градиенту ростовых факторов, однако не приводит к изменению миграционных свойств в тесте на «зарастание раны» in vitro. Исходя из этих данных, можно предположить, что подавление CRABP1 не влияет непосредственно на миграционные свойства линии HET-SR1, а повышает ее чувствительность к факторам роста, что и опосредует усиленную миграцию по градиенту сыворотки в камерах Бойдена, однако это предположение носит гипотетический характер и требует дальнейшего экспериментального подтверждения.
6. Изучение экспрессии отдельных ретиноид-респонсивых генов и маркеров клеточной дифференцировки
Единственной известной на сегодняшний день функцией белка CRABP1 является связывание ретиноевой кислоты (РК) и регуляция ее метаболизма. Поскольку РК – выраженный дифференцировочный агент, мы предположили, что изменение экспрессии CRABP1 в изучаемых линиях должно влиять на экспрессию РК-респонсивных генов и, как результат, на уровень клеточной дифференцировки, и именно этот механизм может являться основным в CRABP1-опосредованной стимуляции туморогенности и метастазирования. Для проверки этой гипотезы на первом этапе мы проанализировали экспрессию ряда РК-респонсивных генов и маркеров дифференцировки в полученных линиях (Рис. 11).
 В первую очередь, мы исследовали экспрессию широко известного маркера дифференцировки CD24. Этот поверхностный антиген экспрессируется в различных опухолях человека и зачастую ассоциирован с низким уровнем дифференцировки и агрессивным фенотипом опухолей, а также низким уровнем пятилетней выживаемости онкологических больных. Мы установили, что в нашей экспериментальной модели экспрессия данного антигена коррелирует с высокометастазным фенотипом, и уровень мРНК CD24 существенно выше во всех производных линии HET-SR1. Однако подавление экспрессии CRABP1 в линии HET-SR1, равно как и гиперэкспрессия СRABP1 в линии HET-SR, не приводило к изменению количества мРНК CD24.
В первую очередь, мы исследовали экспрессию широко известного маркера дифференцировки CD24. Этот поверхностный антиген экспрессируется в различных опухолях человека и зачастую ассоциирован с низким уровнем дифференцировки и агрессивным фенотипом опухолей, а также низким уровнем пятилетней выживаемости онкологических больных. Мы установили, что в нашей экспериментальной модели экспрессия данного антигена коррелирует с высокометастазным фенотипом, и уровень мРНК CD24 существенно выше во всех производных линии HET-SR1. Однако подавление экспрессии CRABP1 в линии HET-SR1, равно как и гиперэкспрессия СRABP1 в линии HET-SR, не приводило к изменению количества мРНК CD24.
В данных линиях мы также не обнаружили изменения экспрессии таких первичных РК-респонсивных генов, как RAR и CYP26A1. RAR является рецептором ретиноевой кислоты, уровень его экспрессии является одним из факторов, опосредующих клеточный ответ на действие РК. Промотор гена RAR несет RARE (РК-зависимый респонсивный элемент), и поэтому транскрипция мРНК RAR усиливается по принципу положительной обратной связи в ответ на попадание в клетку ретиноевой кислоты. CYP26A1 – это белок семейства цитохромов P450, основной функцией которого является метаболическая инактивация ретиноевой кислоты. Его экспрессия стимулируется в ответ на аппликацию РК за счет наличия целого ансамбля RARE-элементов в промоторе гена. В производных клеточных линий HET-SR и HET-SR1 экспрессия гена RAR обнаруживается на низком уровне, а экспрессии CYP26A1 отсутствует, при этом как подавление, так и гиперэкспрессия CRABP1 не приводит к достоверному изменению количества мРНК как RAR, так и CYP26A1
Модуляция экспрессии CRABP1 в линиях HET-SR и HET-SR1 также не сказалась на количестве мРНК RALDH1, клеточного фермента, участвующего в синтезе РК из ее предшественников. Экспрессия данного гена характерна для производных линии HET-SR и отсутствует в производных линии HET-SR1. Поскольку из литературы известно, что РК негативно регулирует транскрипцию данного гена, мы ожидали увидеть повышение количества мРНК RALDH1 в ответ на гиперэкспрессию CRABP1, однако, экспрессия RALDH1 оказалась одинакова в линиях HET-SR pLXSN и HET-SR CRABP1.
Таким образом, нам не удалось обнаружить зависимых от CRABP1 изменений в экспрессии генов, регулируемых ретиноевой кислотой. Безусловно, нами проанализирована лишь небольшая группа подобных генов, что не позволяет сделать однозначных выводов о вляиния CRABP1 на метаболизм и транскрипционные функции РК. Однако подобные результаты поставили вопрос о том, насколько функции белка CRABP1, связанные с ретиноевой кислотой, важны для стимулирования туморогенности и метастатической активности изучаемых линий.
7. Получение мутантной формы CRABP1, неспособной связывать РК и изучение ее туморогенности in vivo
В связи с тем, что на сегодняшний день единственной достоверно известной функцией белка CRABP1 является связывание ретиноевой кислоты, нами было решено исследовать важность данной белковой активности для формирования злокачественного фенотипа опухолевых клеток в нашей модели. Для этого была получена мутантная форма данного белка, связывающая РК с низкой аффиностью. Показано, что замена аргинина на аланин в 131 положении (активном центре) CRABP1 вызывает более чем двадцатикратное повышение Kd комплекса CRABP1-РК, что, по сути, приводит к полной потере ее связывания. С помощью сайт-направленного мутагенеза нами получена последовательность, кодирующая мутантный белок CRABP1 R131A. Эта последовательность была клонирована в ретровирусный вектор pLXSN, после чего с помощью ретровирусной инфекции получены поликлональные клеточные линии, стабильно экспрессирующие мутантный белок CRABP1 R131A и CRABP1 дикого типа (wt) (Рис. 12А). Далее мы проверили, насколько повышение туморогенности клеток низкометастазной линии HET-SR зависит от способности CRABP1 взаимодействовать с РК.

Рисунок 12. А - Вестерн-блот анализ экспрессии CRABP1 в производных линии HET-SR. Б - Сравнение туморогенности производных линии HET-SR.
Анализ показал, что обе исследуемые линии оказались значимо более туморогенны по сравнению с контролем (Рис.12Б). Так, при подкожном введении клеток контрольной линии HET-SR pLXSN опухоли развиваются менее чем у половины экспериментальных животных, тогда как в случае линий HET-SR CRABP1 wt и HET-SR CRABP1 R131A опухоли развиваются у подавляющего числа животных. При этом туморогенность линии HET-SR с гиперэкпрессией мутантной формы CRABP1 R131A статистически не отличалась от таковой в случае гиперэкпрессии CRABP1 дикого типа. На основании этих данных можно утверждать, что способность белка СRABP1 связывать РК не является необходимой для стимуляции туморогеннности низкометастазной клеточной линии HET-SR. Этот факт имеет важное теоретическое значение, поскольку позволяет предположить наличие у белка СRABP1 неких биологических функций, не требующих взаимодействия с РК. Важно отметить, что на сегодняшний день в литературе отсутствуют данные о подобных внутриклеточных функциях данного белка.
8. Изучение экспрессии СRABP1 в образцах мезенхимальных опухолей мягких тканей человека
Поскольку в предыдущих экспериментах нами была установлена активная роль белка CRABP1 в формировании высокометастазного фенотипа трансформированных фибробластов хомяка, мы решили исследовать характер изменений экпрессии данного гена при развитии мягкотканых сарком человека. В данной работе впервые проведен анализ экспрессии гена CRABP1 в образцах мезенхимальных опухолей мягких тканей с помощью метода ПЦР в реальном времени с использованием TaqMan-зондов. Всего проанализировано 28 образцов, 10 из которых представляли собой липосаркомы, 7 – злокачественные фиброзные гистиоцитомы (ЗФГ), 6 - синовиальные саркомы и 5 - злокачественные шванномы.
В изучаемой выборке мезенхимальных опухолей мы зафиксировали все возможные варианты изменения относительной экспрессии гена CRABP1 (Рис. 13). В целом, изменения в экспрессии CRABP1 по сравнению с нормальными тканями характерно для 60% злокачественных опухолей мягких тканей человека. При этом характер выявленных изменений был связан с гистологическим типом новообразования. Так, повышение экспрессии CRABP1 характерно только для синовиальных сарком и злокачественных фиброзных гистиоцитом, в то время как в образцах липосарком и злокачественных шванном нами обнаружено только снижение относительной экспрессии данного гена по сравнению с условной нормой. Из данных научной литературы известно, что экспрессия CRABP1 характерна для синовиальных сарком, данные о повышенной относительной экспрессии данного гена в тканях ЗФГ в литературе отсутствуют.
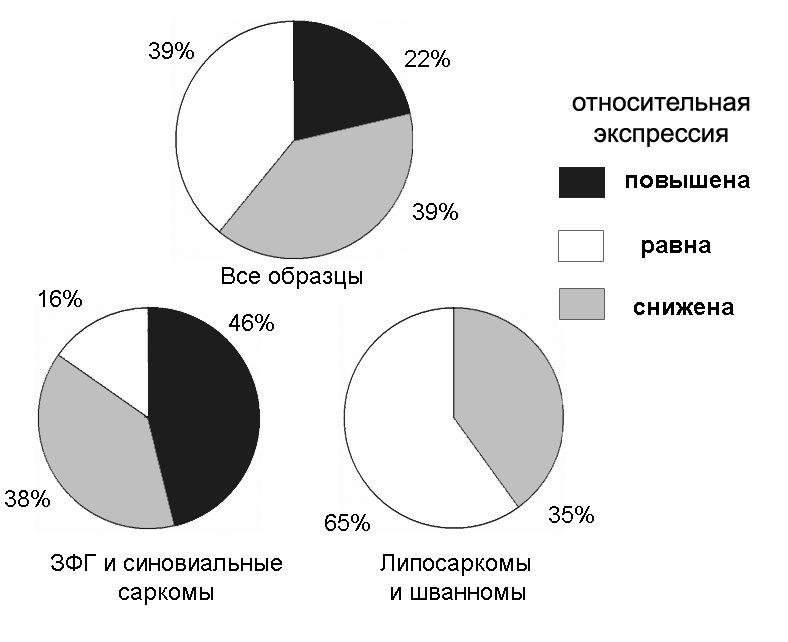
Рисунок 13. Анализ экспрессии CRABP1 в образцах опухолей мезенхимального происхождения.
Следует отметить, что практически все случаи повышения экспрессии CRABP1 относились к быстрорастущим и рецидивирующим опухолям. К сожалению, размер выборки не позволил нам установить достоверных корреляций между характером изменений экспрессии CRABP1 и клинико-морфологическими параметрами опухолей. Проведенный анализ является первичным и, несмотря на то, что полученные данные представляют определенный интерес, для получения более достоверных результатов необходимы дополнительные исследования с использованием больших выборок клинических образцов.
***
В заключение можно сказать, что белок CRABP1 оказывает существенное влияние на такие важнейшие биологические характеристики трансформированных клеток, как туморогенность и метастатическая активность. Данное исследование является одним из первых экспериментальных подтверждений функциональной роли данного белка в процессах опухолевой прогрессии. Дальнейшее изучение механизмов участия данного белка в формировании злокачественного фенотипа опухолевых клеток может быть перспективным с теоретической точки зрения, поскольку позволит охарактеризовать положение данного белка во внутриклеточных сигнальных каскадах, а также, возможно, приведет к обнаружению новых функциональных свойств CRABP1, не опосредованных его способностью связывать ретиноевую кислоту. Дальнейшие исследования в этой области также могут помочь в обнаружении новых прогностических факторов, важных для медицинской онкодиагностики, или же выявить новые потенциальные мишени для лекарственной терапии злокачественных новообразований.
ВЫВОДЫ
- Обнаружена прямая корреляция между экспрессией CRABP1 и уровнем спонтанной метастатической активности RSV-трансформированных фибробластов сирийского хомяка;
- Гиперэкспрессия CRABP1 в низкометастазной клеточной линии HET-SR вызывает значительное повышение ее туморогенности;
- Подавление экспрессии эндогенного CRABP1 в высокометастазной клеточной линии HET-SR1 приводит к достоверному снижению туморогенности и спонтанной метастатической активности, а также к уменьшению количества легочных макрометастазов при внутривенном введении клеток;
- Снижение экспрессии CRABP1 в линии HET-SR1 стимулирует направленную миграционную активность клеток в камерах Бойдена и их способность к колониеобразованию в полужидкой среде;
- Производные линии HET-SR1 c подавленной экспрессией CRABP1 характеризуются уменьшением экспрессии MMP-14 и снижением активности секретируемых коллагеназ;
- Гиперэкспрессия мутантной формы CRABP1 R131A, неспособной связывать ретиноевую кислоту, повышает туморогенность низкометастазной клеточной линии HET-SR наравне с гиперэкспрессией CRABP1 дикого типа;
- Показано изменение экспрессии CRABP1 в 60% исследованных образцов злокачественных опухолей мягких тканей человека; повышение экспрессии CRABP1 наблюдается в 46% случаях синовиальных сарком и ЗФГ.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Рыбко В.А. Активность протеиназ внеклеточного матрикса в экспериментальной модели опухолевой прогрессии /Книжник А.В., Каинов Я.А., Комельков А.В., Чевкина Е.М. // Вестник РОНЦ. – 2008.- Т. 19. - № 4. – С. 16-32.
- Я.А. Каинов. Роль белка CRABP1 в формировании высокометастазного фенотипа RSV-трансформированных фибробластов сирийского хомяка /И.А. Фаворская, Е.Е. Антошина, Т.Г. Горькова, А.В. Комельков, Е.М.Чевкина. //Российский Биотерапевтический журнал. – 2011. - Т. 10. – № 2. – С. 37-44.
- Каинов Я. А. Белок, связывающий ретиноевую кислоту (CRABPI) в патогенезе острого промиелоцитарного лейкоза и других неопластических процессов /Зборовская И. Б. //Технологии живых систем. – 2011. – Т.8. - №3. – С. 28-35.
- А.В. Книжник. Модуляторы активности фосфолипазы D белки RalA и Arf6: влияние на различные характеристики трансформированных клеток /В.А. Рыбко, Я.А. Каинов, А.В. Комельков, Е.М. Чевкина. //Цитология. - 2008. – Т. 50. - №9. – С. 807.
- Kainov Y. Modulation of extracellular matrix remodelling system associated with different metastatic phenotype of v-src transformed cells /Rybko V., Tchevkina E., Knizhnik A., Komelkov A. //abstracts of EACR/FEBS advanced lecture course “Molecular Mechanism in Signal Transduction and Cancer”, 16-24 August, Greece. – 2009. - P.43.
- Knizhnik A. Arf6-dependent signaling contributes to cancer progression in in vivo animal model and lung cancer /Rybko V., Kovaleva O., Kainov Y., Komelkov A., Tchevkina E. //abstracts of Beatson international cancer conference “Microenvironment, motility and metastasis”, Scotland, 5-8 July. -2009. - P. 98.
- Tchevkina E.M. Extracellular Proteases Activity In Tumor Progression Experimental Model /Knizhnik A.V., Rybko V.A., Kainov Y.A., Komelkov A.V. // Аnticancer Research. – 2008. - 28, 5C. - P. 3513.
- Knizhnik A.V. ARF6 and EСМ protease activity in hamster tumor progression experimental model /Rybko V.A., Kainov Y.A., Komelkov A.V. and Tchevkina E.M. //abstracts of Cancer Degradome Symposium, London, UK, 8-9 October 2008. - P. 28.
- Knizhnik A. Arf6 participates in modulation of cell metastatic activity in vivo /Rybko V., Aushev V., Kainov Y., Komelkov A., Tchevkina E. //abstracts of European Small GTPase meeting,, Umea, Sweden, 29-31 August. - 2007. - P. 59.

