Коррекция опухолевого процесса низкоинтенсивным излучением крайне высокой частоты
На правах рукописи
Зиновьев Сергей Васильевич
КОРРЕКЦИЯ ОПУХОЛЕВОГО ПРОЦЕССА
НИЗКОИНТЕНСИВНЫМ ИЗЛУЧЕНИЕМ
КРАЙНЕ ВЫСОКОЙ ЧАСТОТЫ
14.00.14. - онкология
Автореферат
диссертации на соискание учёной степени
кандидата медицинских наук
Москва - 2008
Работа выполнена в ГУ Российский онкологический научный центр им. Н.Н. Блохина
Российской академии медицинских наук.
Научные руководители:
Доктор медицинских наук, Трещалина Елена Михайловна
Доктор физико-математических наук, Иванов Андрей Валентинович
Официальные оппоненты:
Доктор медицинских наук, Балакирев Сергей Александрович
Доктор физико-математических наук, профессор Гапеев Андрей Брониславович
Ведущая организация:
ФГУ «НИИ онкологии им. проф. Н.Н.Петрова Росмедтехнологий»,
Санкт-Петербург
Защита диссертации состоится «_____»_____________2009 г.
на заседании диссертационного cовета (Д.001.017.02)
ГУ Российского онкологического научного центра им. Н.Н. Блохина РАМН
(115478, Москва, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке ГУ Российского онкологического
научного центра им. Н.Н. Блохина РАМН.
Автореферат разослан « _____» _____________ 2008 года
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Ю.А. Барсуков
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
1.1. Актуальность темы исследования
В последнее время в различных отраслях биологических наук и медицине широкое распространение получило использование электромагнитных излучений радиочастотного и микроволнового диапазонов, как средств воздействия на биологические объекты и системы с целью необходимой коррекции процессов функционирования биоструктур. Благодаря широким экспериментальным и клиническим исследованиям накоплена значительная информация о высокой чувствительности живых систем, в том числе и человека, к слабым электромагнитным полям.
Удельный вес работ по действию электромагнитного излучения крайне высоко частотного (КВЧ) диапазона на биологические объекты в общем объеме исследований по изучению биологического действия неионизирующих излучений в последние годы непрерывно возрастает [Rojavin M.A. et al. 1997; Horne J.,1999; О.В. Бецкий и др., 2005 г.; Е.А. Рябов, 2005 г.; А.Б. Гапеев, 2006 г.; Ю.В Шумилина, 2006 г; Г.В. Жукова, 2006 г; А.А Ковалев, 2006 г.; С.В. Зиновьев, 2006 г., А.Б. Гапеев, Н.К. Чемерис, 2007 г.].
Исследования на животных, показавшие положительные результаты от применения КВЧ
излучения при лечении ряда хронических заболеваний, послужили основанием для их клинического использования [Rojavin M.A., Ziskin M.С., 1998; Rakovic D. et al., 2000; С.И. Анисимов и др., 2003; К.В. Лушников и др., 2004; Е.Н. Чуян, 2006]. Описаны попытки применить КВЧ-излучения низкой интенсивности онкологическим больным с целью повышения эффективности терапии [Ситько С.П., 1993; И.Н. Фасахов, 1997; Chekhun V.F et al., 1997; Р.К Кабисов, 1998; С.Д. Плетнёв, 2001; М.В. Теппоне, 2003; Logani M.K. et al., 2006]. Эти немногочисленные клинические исследования не имеют достаточной экспериментальной базы и не позволяют в должной мере оценить влияния данного физического фактора на опухолевый процесс и эффективность противоопухолевого лечения. Тем не менее, в последнее время интенсифицирован интерес к физическим воздействиям, которые могут модифицировать эффективность лучевой и, особенно, химиотерапии. Экспериментальное изучение таких модификаторов позволяет определить их место в онкологической практике.
В связи с этим изучение влияния КВЧ электромагнитного излучения низкой интенсивности на опухолевый рост, метастазирование, состояние кровоснабжения, результаты специфической противоопухолевой химиотерапии является актуальным. Развитие исследований в этой области имеет не только практическое значение, но и важно для более глубокого понимания системных закономерностей действия слабых физических факторов на биологические объекты.
1.2. Цель работы
Цель работы – экспериментальная оценка действия крайне высокочастотного электромагнитного излучения на рост солидных опухолей, характер метастазирования, микроциркуляции и эффективность химиотерапии.
1.3 Задачи:
1. Изучение кинетики роста первичного узла перевивной опухоли у лабораторных животных при действии КВЧ-излучения низкой интенсивности;
2. Оценка влияния КВЧ-излучения на характер процесса метастазирования у лабораторных животных на модели перевиваемой опухоли высоко метастазирующего рака (ВМР);
3. Изучение сочетанного действия КВЧ-излучения и противоопухолевых препаратов на лабораторных животных с перевиваемыми солидными метастазирующими опухолями;
4. Исследование возможности применения электромагнитного излучения КВЧ-диапазона в качестве модификатора фармакокинетики противоопухолевого препарата у лабораторных животных;
5. Изучение интенсивности кровотока в тканях перевиваемых опухолей, подвергавшихся действию КВЧ-излучения
1.4 Научная новизна
Установлено достоверное влияние КВЧ-излучения с заданными характеристиками (несущая частота 42,19 ГГц, частотная модуляция с частотой 50 Гц, ППМ=12 мВт/см2, время воздействия 60 мин) на основные кинетические параметры роста перевиваемых солидных опухолей мышей: скорость роста на момент окончания курсового воздействия электромагнитного излучения крайне высокой частоты (ЭМИ КВЧ), максимальную скорость роста, максимально достижимый размер опухоли.
Впервые при применении ЭМИ КВЧ низкой интенсивности показано достоверное (p=0,002) уменьшение максимальной скорости роста первичного узла полиорганно высоко метастазирующего рака (ВМР) молочной железы мышей на 30% и разнонаправленное действие на метастазирование: в 75% случаев КВЧ вызывает частичное блокирование процесса метастазирования за счет уменьшения числа пораженных органов, в 25% случаев – не влияет на метастазирование или увеличивает зону поражения.
Впервые показана взаимосвязь между влиянием ЭМИ КВЧ диапазона на метастазирование и флуктуациями геомагнитного поля. Коэффициент линейной корреляции между величиной разнонаправленного изменения интенсивности метастазирования при КВЧ-воздействии и значениями геомагнитного индекса Ар составляет более 0,8.
Впервые при КВЧ-воздействии указанных выше характеристик обнаружено замедление накопления и выведения сарколизина (максимум концентрации радиоактивной метки сдвинут на 5 часов относительно контроля) в ткани перевививаемого рака шейки матки мышей РШМ-5.
Впервые показана достоверная (p<0,02) модификация КВЧ-излучением терапевтической эффективности сарколизина и циклофосфамида при их действии на метастазирование у лабораторных животных.
Впервые при КВЧ-воздействии показано снижение в 2-4 раза интенсивности кровотока в инвазивно растущих узлах ВМР и тератокарциномы-36 (Т-36).
1.5 Научно-практическая значимость
Проведенные исследования дают основания считать, что найденные в результате экспериментов характеристики КВЧ-воздействия (несущая частота 42,19 ГГц, ППМ=12 мВт/см2, режим частотной модуляции, время воздействия 60 мин) могут быть положены в основу изучения практических аспектов применения этого физического фактора в качестве адъюванта эффективности специфического противоопухолевого лечения. Выявленный риск стимуляции метастазирования при КВЧ-воздействии является ограничением для его практической реализации при диссеминированном процессе.
1.6 Апробация работы
Основные положения диссертации доложены на:
- IV Международном конгрессе «Слабые и сверхслабые поля и излучения в биологии и медицине»., Санкт-Петербург, (2006 г.)
- Интеллектуальном форуме «Открытая дверь» (Новые концепции естествознания - применение в медицине ), Санкт-Петербург, (2007 г.)
- 2-й Международной конференции «Математическая биология и биоинформатика», г.Пущино,
(2008г.)
- на межлабораторной конференции НИИ ЭДиТО ГУ РОНЦ им. Н.Н. Блохина РАМН
1.7 Публикации по теме диссертации
По теме диссертации опубликовано 7 научных работ.
Объём и структура работы
Диссертация изложена на 164 страницах машинописного текста, включая иллюстрации и библиографию. Состоит из введения, обзора литературы, общей характеристики материалов и методов исследования, 3-х глав результатов собственных исследований, главы обсуждения результатов и выводов. Указатель литературы включает 175 источников (111 отечественных и 63 иностранных авторов). Диссертация иллюстрирована 23 рисунками, 3 таблицами и 2 фотографиями.
2. МАТЕРИАЛЫ И МЕТОДЫ
Аппаратура, дозиметрия и облучение лабораторных животных
а) аппаратура:
В качестве генератора электромагнитных волн крайне высоких частот при облучении лабораторных животных использовали лампы обратной волны ЛОВ-612 и ЛОВ-647 с электронной перестройкой частоты от 37,5 ГГц до 53,57 ГГц ( = 5,6 - 8,0 мм) и максимальным уровнем выходной мощности 50х10-3Вт. Источник питания обеспечивал стабильное напряжение сеточного электрода, замедляющей системы и напряжения накала.
Волноводный тракт сечением 2,6х5,2 мм включал в себя необходимые элементы установки и контроля значений несущей частоты КВЧ-излучения. В схему установки входил также электронный блок частотной модуляции электромагнитного излучения.
б) дозиметрия:
Величина плотности потока энергии регистрировалась на выходе из волноводного тракта при состыковке волноводного тракта с контрольно-измерительной системой. Контрольно-измерительная система плотности потока энергии электромагнитной волны состояла из следующих элементов: участка волнового тракта, детектерного диода, расположенного в конце участка, системы усиления постоянного тока, (эти элементы были оформлены в единый блок) и ваттметра. Также проводили контрольные эксперименты моделирующие интегральный нагрев конечности лабораторного животного при локальном воздействии КВЧ-излучения.
в) облучение лабораторных животных:
Геометрия системы была фиксирована и оставалась стандартной на протяжении всего периода исследований. КВЧ-излучение через калиброванный поляризационный ослабитель и антенную систему подавали на облучаемый образец. Облучение животных производили из пирамидальной рупорной антенны, состыкованной с волноводным трактом. В течении всего времени облучения животные были иммобилизированы и закреплены на специальной подставке.
Параметры облучения животных электромагнитными волнами крайне высокочастотного диапазона, в большинстве выполненных экспериментов, были следующие: время облучения -1час ежедневно в течение 5 дней, ППМ-12,5 мВт/см2. Площадь торцевого сечения рупорной антенны- 2 см2, - соответствовала площади облучаемого пятна на поверхности бедра лабораторного животного с учетом пространственного распределения поля и расстояния до облучаемого объекта. Облучение проводили в режиме частотной модуляции (интервал модуляции 180 МГц, частота модуляции 50 Гц), несущая частота составляла 42,19 Ггц. Воздействие осуществляли локально на левую заднюю конечность животного. Облучение электромагнитными волнами происходило в ближней зоне излучателя: нижний край рупорной антенны располагался на расстоянии 2-3 мм от участка поверхности кожных покровов животного. Параметры воздействия ЭМИ КВЧ-диапазона были выбраны на основе предыдущих результатов [Н.Д. Девятков др., 1983; Л.А. Севастьянова и др., 1985] по действию КВЧ-излучения на лабораторных животных.
В ряде экспериментов с целью достижения лучшего терапевтического эффекта проводили низкочастотную модуляцию гауссовым шумом КВЧ-излучения. Обоснование данного режима и конкретные его параметры представлены в соответствующем разделе работы.
Воздействие электромагнитных волн осуществляли на заднюю конечность иммобилизованного животного. Иммобилизацию животных проводили на специальных деревянных дощечках, как в опытных так и в контрольной группе в течение всего времени проведения экспериментов. Во время облучения лабораторного животного контролировали несущую частоту КВЧ-излучения, а перед началом облучения и после его окончания- плотность потока мощности электромагнитной волны.
Животные и методы работы с перевиваемыми опухолями
Лабораторные животные
Исследование реакции опухолей на сочетанное действие КВЧ-излучения и сарколизина осуществляли на мышах-самках линии СВА 2,5-3 мес. возраста с перевитой опухолью РШМ-5. Все опыты по изучению действия КВЧ-излучения на процесс метастазирования проводили на мышах-самках линии А/Sn 2-3 месячного возраста массой тела 20-22 гр. с опухолью ВМР. Эксперименты по изучению действия данного физического фактора на фармакокинетику сарколизина и интенсивность кровотока выполнены на мышах линии СВА с РШМ-5 и на мышах линии А/Sn с перевивными опухолями ВМР и Т-36.
Рак шейки матки (РШМ-5)
Опухоль прививали подкожно клеточной взвесью в объеме 0,2 мл. Перевивка опухолей осуществлялась по общепринятой методике. В опыт отбирали животных с развившимися одиночными хорошо пальпируемыми опухолевыми узлами, имевшими средний объем приблизительно 200-300 мм3.
Сарколизин вводили внутрибрюшинно, фракционированно, по 4 мг/кг ежедневно в течение 2-х курсов комбинированной терапии на 1-5 день и 11-15 день от начала воздействия. Суммарная доза препарата за один курс - 20 мг/кг, за два курса- 40 мг/кг.
Изучали кинетику роста опухолей на протяжении всего опыта. В качестве исходного измеряемого параметра брали объем опухоли. Измерение объема привитых опухолей проводили один раз в три дня во всех группах.
Высоко метастазирующий рак молочной железы (ВМР)
Базовый штамм происходит от спонтанной аденокарциномы молочной железы и в настоящее время является гистологически анаплазированным солидным раком. Перед началом эксперимента животных рандомизировали (случайное распределение по группам), а затем делили на опытную и контрольную группу, которые на протяжении всего эксперимента находились в разных стандартных пластиковых контейнерах. Условия содержания и кормления животных контрольной и опытных групп были идентичны; во время сеансов облучения животных опытной группы, животные контрольной группы также находились в иммобилизованном состоянии.
Прививку опухоли выполняли внутримышечно, в мышцу бедра. Прививочная доза составляла 0,5106 живых клеток на мышь. После отработки способа прививки и прививочной дозы штамма ВМР-мг были выбраны ранние сроки развития метастатического процесса (с 6-го по 9 день) в качестве точки приложения действия электромагнитного излучения.
Регистрировали интенсивность метастазирования штамма ВМР в различные локализации (лёгкие, почки, надпочечники, печень, матка, яичники, поджелудочковая и вилочковые железы; лимфоузлы: поясничные, паховые, подмышечные, параренальные, паратрахеальные, подчелюстные) и продолжительность жизни животных с данной опухолью как интегральный показатель развития процесса метастазирования. В серии опытов, где определяли развитие метастазирования штамма ВМР, забой животных опытной и контрольной групп проводили одновременно на момент гибели первого животного. Трупы животных вскрывали и фиксировали наличие макроскопических метастазов. Результаты оформляли в виде таблиц.
Постановку экспериментов по изучению продолжительности жизни животных с перевиваемой опухолью ВМР проводили при действии КВЧ излучения и комбинаций КВЧ- излучения с химиопрепаратами, как на ранние, так и на поздние сроки процесса метастазирования. Результаты регистрировали в форме кривых выживаемости контрольной и опытных групп. В ряде экспериментов использовали лабораторных животных с удалённым первичным узлом опухоли: приготовленную густую суспензию клеток штамма ВМР вводили тонкой иглой под кожу хвоста в объёме 0,05 мл на мышь; после появления первичных узлов, на 14 – 15 день, часть хвоста с первичным узлом удаляли.
Воздействовали электромагнитными волнами КВЧ-диапазона на протяжении 60 мин., ежедневно, в течение 5 дней.
В экспериментах были использованы противоопухолевые препараты сарколизин и циклофосфамид. Препараты вводили внутрибрюшинно, многократно, в течение пяти дней. Для каждого цитостатика экспериментально была определена оптимальная разовая терапевтическая доза, которая составила для сарколизина – 4 мг/кг, для циклофосфамида- 70 мг/кг.
Экспериментальное изучение фармакокинетики сарколизина под влиянием КВЧ-воздействия.
В экспериментах по изучению фармакокинетики сарколизина у мышей с опухолью РШМ-5 использовали радиоизотопный метод. Опытным и контрольным животным вводили смесь меченого и немеченого сарколизина в суммарной концентрации 4 мг/кг, что соответствует стандартной противоопухолевой концентрации сарколизина.
Активность вводимого препарата составляла 0,5 мкКю/гр, что ниже предельно допустимой дозы. Параметры облучения мышей опытных групп те же, что и в экспериментах по изучению кинетики роста опухоли РШМ-5.
Вскрытие животных и взятие материала для дальнейших исследований осуществляли в динамике в течение суток. Образцы тканей, помещенные в закрытые пластиковые чашечки хранили в морозильнике. Осуществляли взятие образцов следующих тканей и органов: крови; костного мозга; печени; почки; селезенки; мышц; легких; мозга; кожи; кишечника; опухоли, а также кала. Приготовление образцов для последующего счета их активности на сцинтилляционном бета-счетчике осуществляли по общепринятой методике на приборе "Oximat"(фирма Intertechnique,Франция). После получения данных по бета-счету образцов, для каждого из них проводили расчет коэффициента дифференциального накопления метки (DPM/g). Из количественных данных о величинах DPM на грамм взятых образцов выводили коэффициент дифференциального накопления метки для всех исследованных тканей /КДНМ/.
Строили фармакокинетические кривые с поправкой на приборный коэффициент потери метки, определяемый из калибровочный данных для взятого препарата.
Изучение интенсивности кровотока в тканях перевиваемых опухолей мышей под воздействием КВЧ-излучения.
Проводили сравнительное определение интенсивности кровотока в ткани перевивных опухолей линейных мышей, предварительно подвергавшихся воздействию КВЧ-излучения низкой интенсивности, и у линейных мышей, не облучавшихся электромагнитными волнами.
Для оценки интенсивности кровотока в тканях опухолей использовали методику клиренса ксенона Хе133. Мышей линии СВА, с развившейся опухолью РШМ-5, привитой п/к в область спины, и мыши линии А/Sn с опухолью ВМР, привитой в мышцу бедра, подвергали действию КВЧ излучения. Параметры электромагнитного излучения были те же, что и в экспериментах по изучению модифицирующего действия данного фактора на кинетику роста перевивных солидных опухолей. Через 5 минут после окончания облучения иммобилизованным животным вводили в центр опухоли насыщенный данным гамма-активным изотопом 133Хе физиологический раствор в объеме 0,05 мл (активностью порядка 1 МБк).
Кинетику клиренса 133Хе из опухолевой ткани регистрировали на радиометрической установке состоящей из датчика типа ND-310 со сцинтилляционным кристаллом NAL(T1) и одноканального спектрометра типа NK-350 c самописцем. Кинетику клиренса из опухолевой ткани Хе133 записывали на самописце в течение 15 минут. Аналогичное измерение выполняли и для животного из контрольной группы.
Математического моделирования кинетики роста опухоли и статистическая обработка полученных данных.
Измерение первичного узла привитой подкожно опухоли проводили в трёх координатах (a, b, c) и объём опухоли (G) приближённо рассчитывали по формуле G = 4/3 (d/2)3 = /6d3~ /6 (a b c ) мм3. Измерение первичного узла опухоли, привитой внутримышечно в мышцу бедра проводили в двух координатах (d1, d2 ) и объём опухоли (аппроксимируя его объёмом вытянутого элипсоида вращения) расчитывали по формуле G = /12 A (D2 – D02 ), где A- длина бедра, D = (d1 + d2)/2 – усреднённый диаметр бедра с опухолью, D0 – диаметр бедра без опухоли.
Первичный материал, полученный в виде таблиц, подвергали дальнейшей математической обработке. Данные для каждого лабораторного животного аппроксимировали нелинейной регрессионной зависимостью; проводили расчёт параметров регрессионных кривых.
На основании полученных регрессионных моделей для каждого лабораторного животного проводили расчёт биологически значимых показателей кинетики роста первичного узла опухоли: скорость роста на момент окончания курсового воздействия ЭМИ КВЧ; максимальной скорости роста; времени достижения максимальной скорости роста опухоли; предельно достижимого размера опухоли.
Различия между распределениями в целом оценивали по 2 критерию; критерию Вилкоксона; критерию Клотца; критерию Колмогорова – Смирнова. Сравнение параметров распределений для контрольных и опытных групп проводили по критериям Стъюдента (сравнение средних) и Фишера (сравнение дисперсий). В случае невыполнимости условий для применения параметрических критериев использовали непараметрические методы статистики: критерий знаков, критерий Вилкоксона для сопряжённых пар, U-критерий Манна-Уитни и критерий Краскела-Уоллиса. В работе использовали методы корреляционного анализа (коэффициенты линейной корреляции рассчитывали по Спирмену и Пирсону).
Статистическую обработку экспериментальных результатов проводили с помощью статистических программных пакетов.
3. РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИ Е
3.1.. Кинетика роста первичного узла, особенности метастазирования и кровотока в перевиваемой солидной высоко метастазирующей опухоли ВМР мышей при действии КВЧ- излучения низкой интенсивности
3.1.1. Анализ кинетических кривых роста опухоли при внутримышечной трансплантации
Представляется, что наиболее адекватной математической моделью развития опухоли является модель, относящаяся к классу нестационарных случайных процессов.
При анализе случайных процессов видимую их изменчивость стараются разделить на закономерную и случайную составляющую. Детерминированную составляющую (тренд) в данном случае, целесообразно представить в виде S- образной зависимости:
![]() , где G- растущий объём новообразования;
, где G- растущий объём новообразования; ![]() - его конечный ( асимптотический) объём при t =
- его конечный ( асимптотический) объём при t = ![]() ;
; ![]() и
и![]() - параметры уравнения. Типичные графики регрессионных зависимостей приведены на рис. 1
- параметры уравнения. Типичные графики регрессионных зависимостей приведены на рис. 1
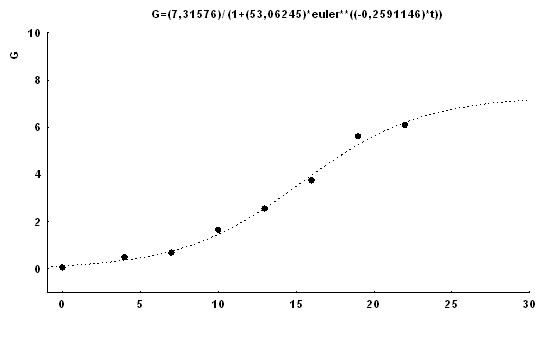
Рис. 1. Примеры построения кривых регрессии по экспериментальным точкам кинетики роста опухоли ВМР у отдельных мышей A/SN. Уравнения регрессионных кривых приведены вверху графиков. По оси абсцисс - время с момента перевивки опухоли (в сутках); по оси ординат - объём первичного узла опухоли (в мм3).
Вычисление основных показателей кинетики роста первичного узла опухоли ВМР, обобщённо для всех экспериментов, позволило сделать следующие выводы:
-среднее время достижения максимальной скорости роста практически одинаково
(13,5±0,7 суток) для животных опытной и контрольной групп (нет различий по непараметрическим критериям), однако характер распределения данного параметра в контрольной и опытной группе существенно различен: аппроксимация нормальным распределением статистически адекватна только для опытной группы, но не для контрольной (![]() критерий);
критерий);
-средняя величина максимальной скорость роста в группе животных подвергавшихся действию КВЧ на 30 % достоверно ниже ( р=0,002 по критериям Вандер-Вардена, Колмогорова-Смирнова и Вилкоксона ) чем в контрольной группе;
-максимально возможный размер опухолей в опытной группе незначительно ( 15 %) но достоверно ( р=0,01 - критерий Вилкоксона; р=0,02 - критерий Вандер-Вандера; р=0,035 – критерий Колмогорова-Смирнова) ниже чем в контроле, но дисперсия этого показателя в опытной группе почти вдвое выше чем ( в 1,8 раза),чем в контроле ( р=0,02- критерий Вандер-Вардена, р=0,03 - критерий Фишера).
Необходимо отметить еще один, важный результат: скорость роста опухоли в момент окончания курсового воздействия ЭМИ КВЧ в 1,5 раза выше чем в контроле (р = 0,01 - критерий Колмогорова-Смирнова). Таким образом, влияние данного фактора вызывает сначала некоторую кратковременную интенсификацию роста уже сформировавшегося первичного узла опухоли, обуславливая, тем самым, завышенные значения первых регистрационных точек и кривые аппроксимации, следовательно, будут иметь для животных опытной группы более крутой наклон, чем в контроле.
Таким образом, ход кинетических кривых роста первичного узла перевивных опухолей, при их внутримышечной перевивке, у животных, подвергавшихся действию КВЧ-излучения слабой интенсивности, изменён. Кривая становится менее “сигмоидной”, несколько растягиваясь вдоль временной оси. Изменение кинетики роста первичного узла опухоли, вызванное действием электромагнитного излучения крайне высокочастотного диапазона, может обуславливать её последующую реакцию на воздействие других агентов физической или химической природы.
3.1.2. Частота и локализация метастазирования
В данной части представляемой работы проведено 15 экспериментов, в которых использовано более четырёхсот лабораторных животных.
Изучение органотропности метастатического процесса осуществлялось с момента гибели первой мыши в контрольной или опытной группе. Проводилось вскрытие мышей и осуществлялся подсчёт метастазов по 15 локализациям (9 органам и 6 лимфоузлам). Полученные результаты в обобщённом виде представлены в виде распределения количества лабораторных животных с определённым числом локализаций метастазов штамма ВМР (рис. 2). Кривые распределения для контрольной и опытной групп статистически существенно различны (критерий 2; 2 = 172). Хотя средние величины распределений близки друг к другу (8.125 и 7.875 соответственно), но моды распределений сильно отличаются: 5 - для контроля и 1 - для опытной группы. Резкий сдвиг статистического распределения в сторону животных с малым числом локализаций метастазов и увеличение их удельного веса в общей структуре популяции отличает опытную группу от контрольной.

Рис. 2. Количество лабораторных животных с определённым числом локализаций метастазов штамма ВМР. Сплошная кривая - контрольная группа животных; пунктирная - животные, подвергавшиеся действию КВЧ- излучения. По оси абсцисс - количество локализаций метастазов у одной мыши; по оси ординат – число мышей с данным количеством метастазов.
В каждом эксперименте вычисляли также количество метастатических локализаций, приходящихся в среднем на одно животное. Результаты (суммарно по всем экспериментам) представлены на рис 3.
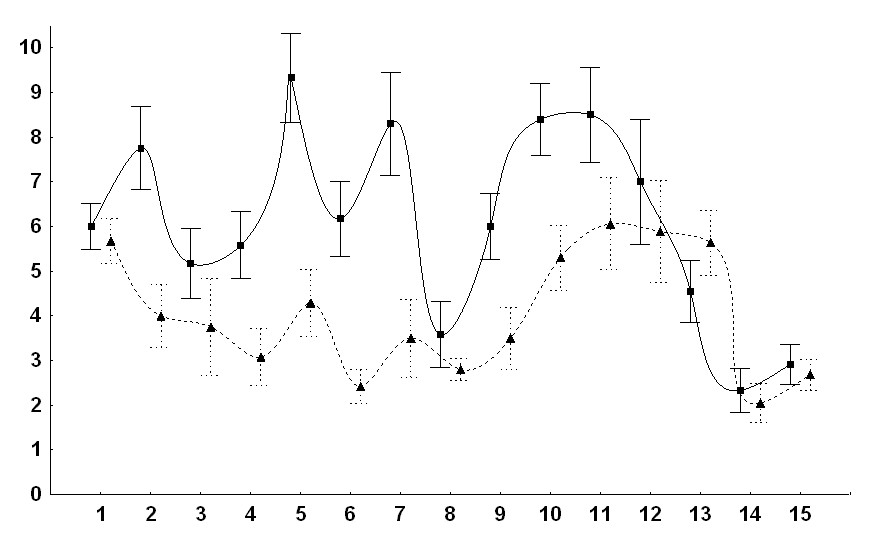
Рис. 3. Интенсивность метастазирования штамма ВМР у мышей линии А/Sn. Сплошная кривая - контрольные животные; пунктирная - животные подвергавшиеся действию КВЧ излучения. По оси абсцисс - номер опыта, по оси ординат - среднее число локализаций метастазов на одну мышь;
Средняя величина данного показателя по совокупности всех пятнадцати экспериментов для контроля - 6.1 ± 0.54; для животных, подвергавшихся действию КВЧ излучения - 4.0 ± 0.34. Сопоставление средних по непараметрическим критериям( критерий знаков, критерий Вилкоксона для сопряжённых пар) показывает достоверную статистическую разницу (р<0.02) по совокупности экспериментов для опытной (n=126) и контрольной (n=132) групп животных.
Таким образом, можно сделать заключение, что воздействие КВЧ излучения слабой интенсивности на мышей линии A/Sn с перевитой им опухолью ВМР, как правило, вызывает снижение интенсивности метатазирования ( в среднем в 1,5 раза), если её оценивать по количеству метастатических локализаций, приходящихся в среднем на одно животное.
Хотя, необходимо отметить, что в ряде экспериментов не наблюдалось достоверной разницы данного показателя в контрольной и опытной группе (см. рис. 5 – эксперименты № 1, 8, 14, 15) и даже наблюдалась тенденция (эксперимент № 13 ) к стимуляции процесса.
В таблице 1 представлена интенсивность метастазирования штамма ВМР по отдельным органам и лимфоузлам.
Таблица 1
Метастазирование штамма ВМР у мышей линии A/SN при воздействии КВЧ излучения.
| Локализации метастазов | Процент метастазирования в контроле | Процент метастазирования в опыте |
| лёгкие яичники брыжейка поджелудочная железа вилочковая железа надпочечники почки матка печень Лимфоузлы: поясничные паратрахеальные паховые подчелюстные подмышечные параренальные | 70 ± 6,0 48 ± 4,0 45 ± 4,0 43 ± 4,3 39 ± 3,8 38 ± 4,6 35 ± 5,0 27 ± 4,5 10 ± 4,0 60 ± 3,0 41 ± 2,0 40 ± 8,0 40 ± 4,6 33 ± 9,2 28 ± 2,0 | 29 ± 4,0* 29 ± 7,0* 27 ± 3,7* 30 ± 4,6* 25 ± 3,0* 17 ± 4,5* 17 ± 3,8* 20 ± 4,8 1 ± 0,9* 53 ± 6,5 24 ± 5,0* 29 ± 6,6 21 ± 3,5* 17 ± 3,6* 18 ± 5,0* |
*- разница между опытом и контролем статистически достоверна (p< 0.05)
Данные обобщены по совокупности экспериментов, в которых имелась достоверная разница между контрольной и опытной группой по количеству метастатических локализаций, приходящихся в среднем на одно животное. Для этой группы экспериментов анализ распределения метастазов по органам показал, что воздействие КВЧ-излучения вызывает ослабление процесса метастазирования ( по Т- критерию, р < 0.001; по критерию знаков, р< 0.01). Уровень интенсивности процесса метастазирования в опытной группе животных практически одинаков для ряда органов (тимус, яичники, матка, поджелудочная железа, брыжейка) и составляет, в среднем, 59 % от величины этого показателя у контрольной группы животных. Метастазирование в некоторые органы оказалось наиболее чувствительно к действию КВЧ излучения: в лёгких, почках и надпочечниках этот показатель составлял примерно 38 % от контрольного уровня.
3.1.3. Продолжительность жизни мышей как интегральный показатель процесса метастазирования при заданных характеристиках КВЧ воздействия
Действие КВЧ-излучения на развитие метастазов у животных с сохранённым первичным узлом опухоли.
Динамика гибели животных контрольной и опытной групп представлена на рис. 4. В контрольной группе животных распределение времён гибели имеет полимодальный характер с тремя выраженными максимумами: на интервалах 20-25 дней, 35-40 дней, 55-60 дней. В группе животных, подвергавшихся действию КВЧ излучения картина иная: гибель лабораторных животных, как и в контроле, начинается в относительно ранние сроки после перевивки опухоли, затем следует заметный лаг-период (с 25 по 40 день), в течении которого гибели экспериментальных животных не наблюдалось. В дальнейшем, в этой группе отмечено увеличение гибели мышей (40-45 день и 65-70 день) между которыми гибель животных происходит равномерно. Выборки достоверно различаются по непараметрическим критериям (критерий Вилкоксона: р = 0.02, критерий Клотца: р = 0.016, критерий Колмогорова-Смирнова: р = 0.05).
Средняя продолжительность жизни в группе животных, подвергавшихся действию КВЧ излучения на 37 % больше, чем в контрольной группе (62,1 дня и 45,3 дня соответственно). Различия достоверны по Т-критерию Стьюдента (0.01 < p < 0.02).
Действие КВЧ на развитие метастазов у животных с удалённым первичным узлом опухоли.
Характер гибели в контрольной группе заметно отличается от аналогичных данных, полученных в предыдущем случае: гибель животных наступает в более ранние сроки и в картине гибели нет столь выраженной полимодальности. Данный факт можно объяснить следующим образом. В выбранной модели развития метастатического процесса в гибель конкретного животного вносит вклад не только рост метастазов в жизненно-важных локализациях, но и патогенетическое влияние роста первичного узла опухоли и некротических процессов в нем. Хирургическое удаление первичного узла может в ряде случаев приводить к интенсификации роста отдалённых метастазов. В нашем случае, данный механизм может объяснять более раннее начало гибели животных и отсутствие полимодальности этого процесса. Средняя продолжительность жизни при этом в контрольной группе составляла 35 дней. Распределение павших животных, подвергавшихся КВЧ-воздействию близко к нормальному. Средняя продолжительность жизни в этой группе составляла 43,6 дня. Различия между средними в контроле и опыте достоверны (Т-критерий: р <0,01); различия также существуют между распределениями в целом, - по 2 критерию: p <0,1; критерию Вилкоксона: р < 0.014; критерию Клотца: р < 0.01; критерию Колмогорова - Смирнова: р < 0.03). Данные обобщены по всем экспериментам данного раздела исследований.
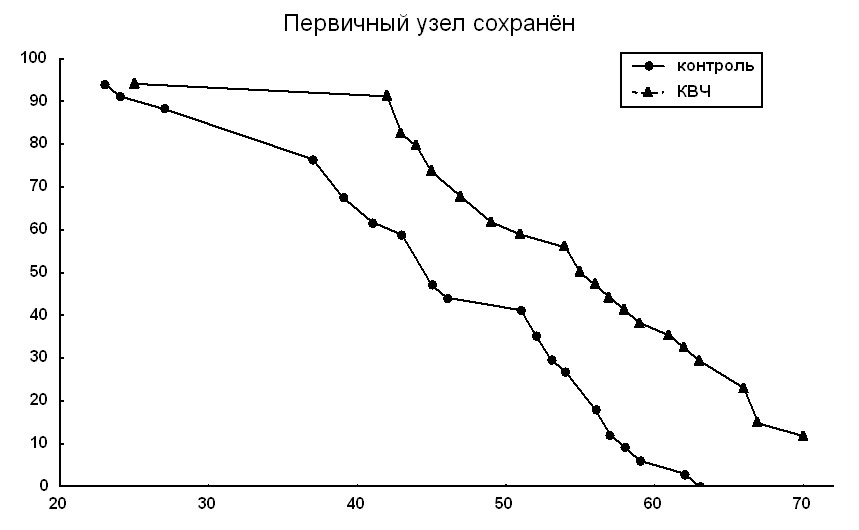

Рис. 4.Гибель мышей линии А/Sn с опухолью ВМР. Левый график- мыши с сохранённым первичным узлом опухоли ( в/м перевивка). Правый график - мыши с удалённым (на 14 – 15 сутки после перевивки) первичным узлом. Абсцисса- день после перевивки, ордината - % выживших;.
3.1.4. Вариабельность частоты метастазирования и продолжительности жизни животных с ВМР при КВЧ-воздействии и их корреляция с флуктуациями геомагнитного поля
Необходимо отметить, что в наших экспериментах имела место вариабельность выраженности антиметастатического эффекта от опыта к опыту (рис. 5). Более того, в одном из экспериментов на штамме высоко метастазирующего рака наблюдалось увеличение интенсивности метастазирования под действием КВЧ-излучения, что было выявлено как по числу животных с метастазами в определённые локализации / в среднем в 1,4 раза /, так и по числу метастазов на одно животное. (0.05< p >0,01). Достоверное увеличение числа метастазов в легкие наблюдалось в одном из экспериментов также и на другой экспериментальной модели.
Мы предположили, что на результаты экспериментов может воздействовать в определённой мере некоторый, не учитываемый нами фактор, например, электромагнитный фон среды. Проведённый корреляционный анализ показал, что наблюдается высокая линейная корреляция между величиной эффекта от облучения электромагнитными волнами сверхвысокой частоты и планетарным индексе геомагнитной активности для средних широт (Ар-индекс) на первые и вторые сутки после перевивки опухоли.
Коэффициент линейной корреляции (по Спирмену) составил порядка 0,8-0,85 и является статистически значимым. Заметим, что коэффициент линейной корреляции на другие сроки после перевивки опухоли был менее 0.4 и не являлся статистически значимым.
Данный факт, на наш взгляд представляет интерес не только в рамках этого исследования, но и имеет отношение к общебиологическим закономерностям опухолевого роста.
Корреляционные зависимости между геомагнитной обстановкой, физиологическим состоянием организма, параметрами опухолевого роста несомненно должны быть приняты во внимание как при изучении механизмов действия слабых электромагнитных полей, так и для коррекции методик с целью увеличения их терапевтической эффективности.
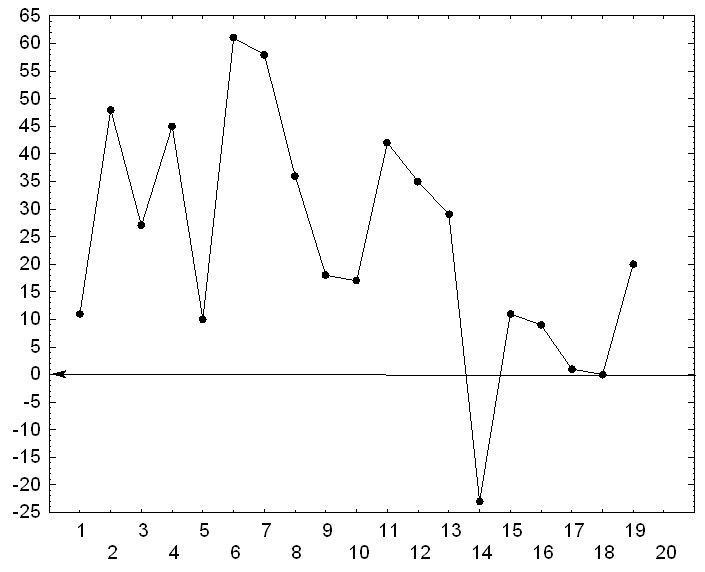
Рис. 5. Вариабельность эффекта действия КВЧ-излучения на процесс метастазирова- ния у лабораторных животных.
По оси ординат - величина «эффекта» в процентах; по оси абсцисс - порядковый номер эксперимента. Стрелка показывает «нулевой уровень», т.е. отсутствие какого-либо эффекта.
3.1.5 Модификация интенсивности кровотока в тканях перевиваемых опухолей мышей под воздействием КВЧ излучения.
Одной из возможных причин изменения интенсивности метастазирования и кинетики роста первичного узла опухоли могло быть общее или локальное изменение микроциркуляции в нормальных тканях организма и злокачественных новообразованиях у лабораторных животных, подвергавшихся действию КВЧ-излучения. С целью проверки данной гипотезы использовали три экспериментальные модели: мыши линии СВА с перививной опухолью РШМ-5 и мыши линии А/Sn с метастазирующей опухолью ВМР, дающей широкий органный спектр метастазов, а также с опухолью Т-36, гематогенно метастазирующей в лёгкие.
Фиксировали кинетику изменения концентрации радиоактивной метки в области первичного узла опухоли. Вычислялись коэффициенты регрессии для каждого лабораторного животного и строились регрессионные кривые для контрольных и опытных групп.
Из полученных данных можно сделать следующие выводы:
- интенсивность кровотока в ткани опухолей у животных, находившихся в состоянии стресса (иммобилизация) была несколько выше, чем у интактных животных, и не подвергавшихся каким либо стрессорным воздействиям. Разница составляла 15 – 20% для всех типов опухолей, и была вероятно, связана с общей интенсификацией кровообращения, обусловленной общестресcорными механизмами;
- интенсивность кровотока в ткани опухоли ВМР ( рис. 6) у животных, подвергавшихся действию КВЧ излучения, по клиренсу 133Xe была почти в 4 раза меньше, чем у животных контрольной группы ( р < 0.001);
- не обнаружено достоверных различий интенсивности кровотока у мышей линии СВА с перевивной опухолью РШМ-5 в контрольной и опытной группах.
Обобщая полученные данные можно заключить, что КВЧ излучение слабой интенсивности оказывает воздействие на процессы микроциркуляции в первичном узле экспериментальных опухолей при их внутримышечной перевивке. Опухоли в этом случае растут инвазивно в окружающую их мышечную ткань. Если же в процессе роста опухоли формируется обособленный узел (как в случае подкожной перевивки) эффекта действия КВЧ излучения на интенсивность кровотока в ткани опухоли не наблюдается.
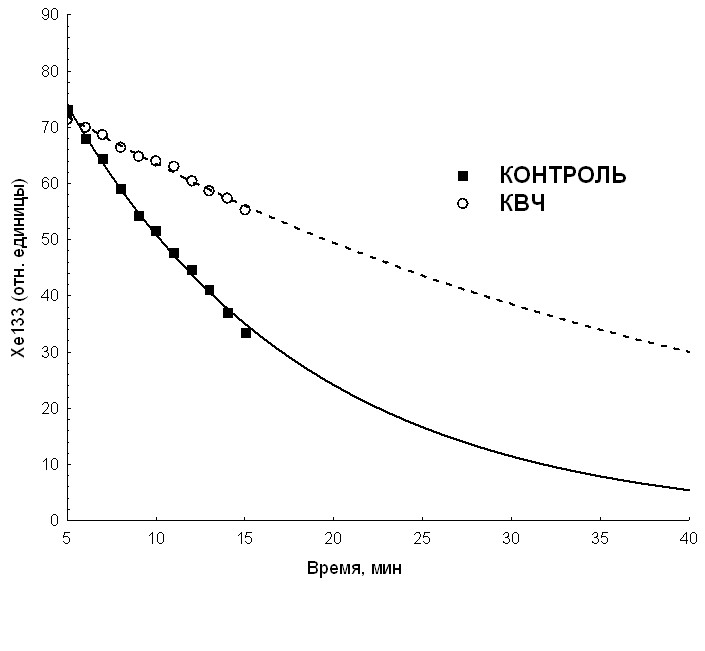
Рис. 6. Элиминация радиоактивной метки из ткани опухоли ВМР.
По оси ординат- концентрация 133Хе в ткани опухоли (в относительных единицах); по оси абсцисс - время с момента введения РМ (мин.)
3.2.. Особенности метастазирования штамма ВМР при сочетании КВЧ-воздействия и химиотерапевтических препаратов.
В работе изучалось сочетанное действие КВЧ излучения низкой интенсивности с двумя различными химиотерапевтическими препаратами. В качестве цитостатических агентов были выбраны циклофосфамид и сарколизин.
Результаты исследований приведены в сводной таблице (Таблица 2). Наблюдается определённая органотропная избирательность антиметастатического сочетанного действия КВЧ-излучения низкой интенсивности и цитостатиков, что в свою очередь, возможно, зависит как от параметров облучения, так и от свойств конкретного препарата.
Для данной модели метастазирующей опухоли терапевтический эффект действия циклофосфамида был выше, чем сарколизина. Для циклофосфамида наиболее сильный антиметастатический эффект имел место для таких локализаций как почки, брыжейка, поясничные лимфоузлы. Частота метастазирования в эти локализации была в 6 – 12 раз меньше, чем в контроле, а в матке, подмышечных и параренальных лимфоузлах метастазы обнаружены не были. Для ряда локализаций (лёгкие, вилочковая железа, яичники, надпочечники, поджелудочная железа) интенсивность метастазирования в результате действия препарата была снижена в 2-2.5 раза (p<0.01).
В группах животных, подвергавшихся комбинированному воздействию, ситуация иная. При сочетанном воздействии электромагнитного излучения и циклофосфамида частота метастазирования была заметно снижена по сравнению с частотой метастазирования в группе животных, получавших один препарат, только для некоторых локализаций (лёгкие, яичники, подчелюстные лимфоузлы ). Для всех же остальных органов и лимфоузлов величина данного параметра достоверно не отличалась в этих двух группах.
Применение сарколизина вызвало снижение частоты метастазирования в 3-3.5 раза в почки, поджелудочную железу, подмышечные и подчелюстные узлы. Почти для половины рассмотренных локализаций метастазов (вилочковая железа, яичники, матка, паховые, параренальные и паратрахеальные лимфоузлы ) интенсивность этого процесса в результате действия сарколизина была в 2-2.5 раза меньше контрольного уровня. Надо заметить, что для некоторых локализаций метастазов (лёгкие, надпочечники, поясничные лимфоузлы) действие препарата было менее эффективно и снижало частоту метастазирования лишь 1.5 – 2 раза.
Применение комбинированной терапии привело, в среднем, к дальнейшему ослаблению процесса метастазирования. Однако для различных локализаций метастазов конечный эффект совместного терапевтического действия препарата и КВЧ излучения низкой интенсивности был неоднозначен. Не наблюдалось полной аддитивности при сочетании цитостатик+КВЧ, которую можно было бы иметь в случае неперекрывающихся механизмов влияния каждого из агентов на процесс метастазирования. В ряде случаев (для метастазирования в лёгкие, почки, надпочечники, брыжейку, паховые, подмышечные и поясничные лимфоузлы) частота метастазирования была в 2 раза меньше, чем в случае одного цитостатика (p=0,02).
Для отдельных локализаций (вилочковая железа, матка, подчелюстные лимфоузлы) синергизм действия сарколизина и миллиметровых волн был более выраженным, что привело к снижению частоты метастазирования в 7 – 9 раз по отношению к уровню контроля, а метастазы в матку в этой группе животных вообще не были обнаружены. Вместе с тем, существовали и такие локализации, для которых усиление антиметастатического действия препарата не наблюдалось (яичники, поджелудочная железа).
Различие между контрольной и всеми опытными группами были значимы по критерию Вилкоксона (р< 0,001) и критерию знаков (р=0,01). Достоверно различаются также средне групповые значения частот метастазирования у животных, получавших только препарат, и у животных, получавших сочетанное воздействие. Интересно также отметить, что вариация величин интенсивности метастазирования в отдельные органы и лимфоузлы в случае применения циклофосфамид + КВЧ вдвое больше, чем при использовании комбинации сарколизин + КВЧ (p=0.01).
Таблица 2
Метастазирование штамма ВМР у мышей линии A/Sn при воздействии циклофосфамида (ЦФ), сарколизина (СН) и их сочетанного действия с КВЧ излучением.
| Локализации метастазов | Процент метастазирования по отношению к контролю | |||
| ЦФ | ЦФ + КВЧ | СН | СН + КВЧ | |
| лёгкие | 46 ± 3,9 | 21 ± 3,5 | 60 ± 4,3 | 27 ± 1,0 |
| яичники | 49 ± 4,1 | 26 ± 3,3 | 47 ± 0,6 | 47 ± 0,6* |
| брыжейка | 13 ± 2,8 | 0 | 35 ± 0,6 | 0 |
| поджелудочная железа | 38 ± 1,9 | 49 ± 2,0 | 27± 1,6 | 27± 1,6* |
| вилочковая железа | 38 ± 3,2 | 38 ± 3,2 | 51 ± 0,8 | 11± 1,3 |
| надпочечники | 45 ± 3,3 | 38 ± 2,7* | 55 ± 1,6 | 29 ± 2,0 |
| почки | 8 ± 0,6 | 8 ± 0,6* | 29 ± 3,9 | 15 ± 2,5 |
| матка | 0 | 0 | 38 ± 3,4 | 19 ± 3,3 |
/*- разница между группами (препарат и препарат+КВЧ) отсутствует или статистически недостоверна/
3.3. Особенности фармакокинетики сарколизина при сочетании с КВЧ-воздействием у мышей с РШМ-5
3.3.1 Динамика распределения сарколизина в органах и тканях.
Всасывание меченого препарата из брюшной полости происходит быстро; максимум концентрации метки в нормальных тканях и органах (кроме костного мозга и кишечника) достигался менее чем через 15 минут после введения препарата. Через сутки после введения концентрация метки для большинства органов и тканей составляла 10-15 единиц DPM/g. В органах выведения - почки, кишечник - порядка 20 единиц DPM/g. Для таких органов как легкие и печень концентрация метки выходила на плато к трем часам после введения, а для головного мозга - через 6 часов после введения. Динамика концентрации метки в крови, а также в мышечной ткани, носит биэкстремальный характер (второй экстремум в районе 12 часов), что может быть обусловлено появлением метаболитов вводимого препарата (рис. 7).
У животных, подвергавшихся действию КВЧ-излучения, наиболее выраженные отличия от контроля во временах накопления и выведения препарата наблюдаются для тканей с медленной кинетикой препарата (рис. 8). Интенсивность выведения препарата через почки, если о ней судить косвенно по величине дифференциального накопления метки в почечной ткани, через 4-5 часов с момента введения становится несколько выше у животных опытной группы по сравнению с животными контрольной группы.
Величина коэффициента дифференциального накопления метки (КДМН) в содержимом толстого кишечника у мышей опытной группы после окончания сеанса КВЧ-воздействия была в шесть раз ниже, чем у животных контрольной группы, но в последующем наблюдалось ее резкое (в 10 раз) увеличение и к третьему часу после введения меченого препарата величина КДМН у животных опытной группы была в 4 раза выше, чем в группе контрольных животных. После третьего часа концентрация метки в выделениях толстого кишечника начинает падать и становится равной контрольному уровню к 12-му часу. Данный эффект возможно связан с изменением характера перистальтики кишечника, играющей важную роль в формировании каловых масс. Кинетика накопления и выведения препарата из ткани кишечника качественно повторяет в контрольной и опытной группах ход кривой для кала.

Рис.7 Изменение концентрации сарколизина-3Н в крови у мышей линии СВА при внутрибрюшинном введении препарата. Сплошная кривая - контрольные животные; пунктирная кривая - животные, подвергавшиеся действию КВЧ излучения. По ординате - коэффициент дифференциального накопления метки; по абсциссе – время с момента введения препарата (ч.)
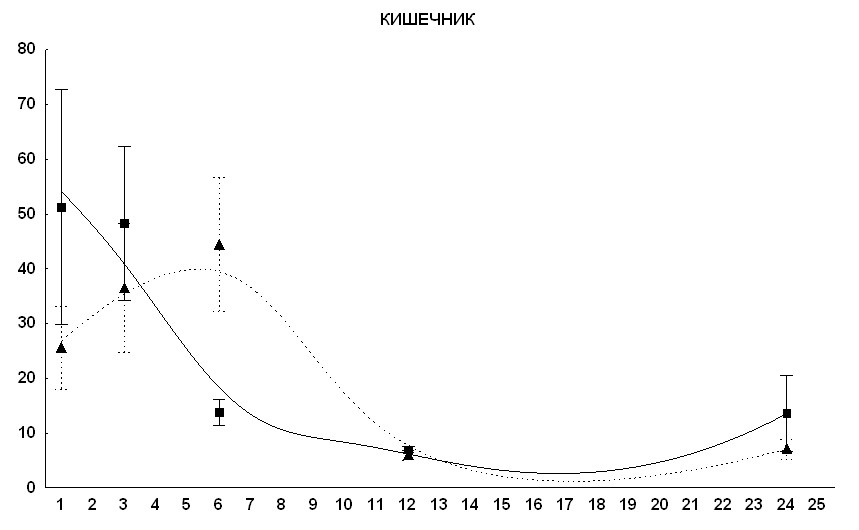
Рис. 8. Изменение концентрации сарколизина-3Н в тканях кишечника у мышей линии СВА при внутрибрюшинном введении препарата.
Выведение препарата из других органов у животных, подвергавшихся действию КВЧ излучения, имеет общую особенность: биэкстремальный характер кривой. Второй экстремум приходится на 6 часов и может являться отражением процессов реабсорбции препарата из кишечника, хотя не исключено депонирование части препарата или его метаболитов у животных этой группы в брюшной полости, особенно в клеточных элементах ретикуло-эндотелиальной системы (например, макрофагов) и последующего поступления его в организм вследствие их гибели.
3.3.2 Анализ накопления и выведения препарата в ткани опухоли
В контроле концентрация препарата достигала максимума в опухоли примерно через час после его введения и к 24 часам снижалась примерно на 40%. В опыте (положение максимума концентрации метки сдвинуто на 5 часов относительно контроля) и несколько более медленное его выведение (рис. 9). По нашему мнению, медленное накопление препарата может привести к тому, что небольшие его концентрации, в первое время не обладая достаточно сильным цитостатическим действием, будут активизировать переход клеток из стадии покоя в стадию пролиферации, что является характерным для действия данного препарата. Увеличившийся пул пролиферирующих опухолевых клеток будет в дальнейшем подвергаться действию данного цитостатика в более высокой концентрации, вызывающей эффект задержки роста опухоли, что и наблюдалось нами в вышеописанных экспериментах.
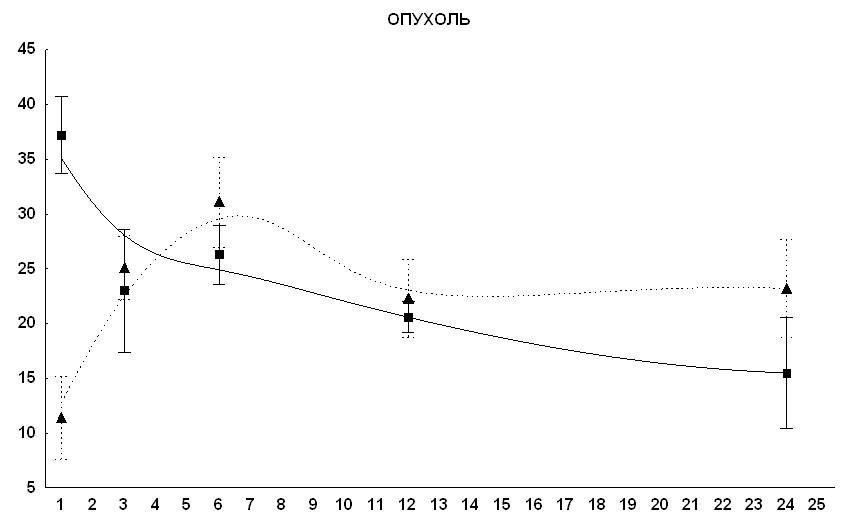
Рис. 9 Изменение концентрации сарколизина-3Н в ткани опухоли РШМ-5 у мышей линии СВА при внутрибрюшинном введении препарата.
ВЫВОДЫ
1. КВЧ-воздействие с заданными характеристиками (несущая частота 42,19 ГГц, ППЭ=12 мВт/см2, режим частотной модуляции, время воздействия 60 мин.) изменяет параметры биологически значимых показателей кинетики роста первичного узла высокометастазирующей солидной опухоли молочной железы мышей ВМР. Максимальная скорость роста опухоли при КВЧ воздействии на 30% достоверно ниже (p=0,002) чем в контрольной группе.
2. КВЧ-воздействие указанных выше характеристик меняет интенсивность метастазирования полиорганно метастазирующей опухоли ВМР. В 75% экспериментов число органов с метастазами достоверно уменьшается (p=0,005), в 25 % случае – изменения отсутствуют или происходит стимуляция показателя.
3. Коэффициент линейной корреляции между величиной изменения интенсивности метастазирования под действием КВЧ-излучения и значениями геомагнитного индекса Ар составляет более 0.8. Таким образом, вариабельность действия КВЧ излучения может в значительной степени определяться флуктуациями напряжённости геомагнитного поля в средних широтах.
4.. Воздействие КВЧ-излучения вызывает органотропную избирательность подавления процесса метастазирования. Интенсивность метастазирования, в среднем, в опытной группе животных составляет 59 % от величины этого показателя у контрольной группы (р< 0.01); в лёгких, почках и надпочечниках этот показатель - 38 % от контрольного уровня.(р<0,001).
5. КВЧ-излучение усиливает антиметастатическое действие циклофосфамида (для некоторых локализаций - лёгкие, яичники, подчелюстные лимфоузлы) и сарколизина (более чем в 2 раза для различных локализаций ) на полиорганно метастазирующую опухоль ВМР. (р<0,02)
6. Выраженные отличия от контроля во временах накопления и выведения сарколизина-3Н у животных, подвергавшихся действию КВЧ-излучения наблюдаются для тканей и органов выделения (кишечник, лёгкие) - в опытной группе имеется выраженный максимум через 6 часов после введения препарата (р<0,001). Для тканей с быстрой кинетикой данного препарата (кровь, мышцы) сохраняется биэкстремальная форма кинетической кривой, но второй экстремум сдвинут на 6 часов ранее.
7. КВЧ-воздействие заданных характеристик вызывает достоверное пролонгированное накопление сарколизина в ткани РШМ-5 (максимум концентрации радиоактивной метки сдвинут на 5 часов относительно контроля (p <0,01) и замедлено его выведение).
8. КВЧ-воздействие не вызывает изменения интенсивности кровотока в подкожно трансплантированной опухоли РШМ-5 и достоверно снижает интенсивность кровотока в 2-4 раза (p<0,001) в ткани внутримышечно трансплантированных инвазивно растущих опухолей мышей ВМР и Т-36.
Список работ, опубликованных по теме диссертации
1..Зиновьев С.В. Радиоизотопные исследования биологического действия
электромагнитного КВЧ-излучения низкой интенсивности на моделях перевивных опухолей. Российский Биотерапевтический Журнал.,№3, том 5, 2006г., стр 35-42.
2 Зиновьев С.В. Кинетика роста опухоли высокометастазирующего рака мышей при действии КВЧ-излучения слабой интенсивности. Журнал научных публикаций аспирантов и докторантов., №2, 2008г, стр 160-163.
3. Зиновьев С.В., Смирнов А.Ю., Боголюбов В.М. Экспериментальное изучение действия сверхвысокочастотного электромагнитного излучения миллиметрового диапазона слабой интенсивности на процесс метастазирования злокачественных новообразований. Вопросы курортологии, физиотерапии и лечебной физкультуры., №4, 1991г., стр 23-26.
4. Зиновьев С.В. Экспериментальное изучение системных реакций, вызванных
низкоинтенсивным электромагнитным излучением крайне высокой частоты. Материалы
I Международного конгресса «Слабые и сверхслабые поля и излучения в биологии и
медицине», Санкт-Петербург, 1998, стр.63
5. Зиновьев С.В., Смирнов А.Ю. Вариабельность системных реакций, индуцированных
КВЧ-излучением низкой интенсивности. Материалы первого международного
симпозиума «Фундаментальные науки и альтернативная медицина», Пущино, 1998,
стр. 13-14.
6. Зиновьев С.В. Нелинейные взаимодействия слабого электромагнитного
излучения с биообъектами : физические механизмы. В кн. «Интеллектуальный форум-Открытая дверь». Материалы научно-творческой встречи., 2007г., стр33-38.
7. Зиновьев С.В., Машалов А. А. Биофизические аспекты взаимодействия низко- интенсивного лазерного излучения с биообъектами. В сб. научных трудов XVIII Между-
народной научно-технической конференции «Лазеры в науке, технике,медицине»., М., 2007г., стр 72-74.

