Механизмы гибели опухолевых клеток при действии новых модифицированных порфиринов
На правах рукописи
Дутикова Юлия Вячеславовна
МЕХАНИЗМЫ ГИБЕЛИ ОПУХОЛЕВЫХ КЛЕТОК ПРИ ДЕЙСТВИИ НОВЫХ МОДИФИЦИРОВАННЫХ ПОРФИРИНОВ
14.01.12 - онкология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва 2011
Работа выполнена в Учреждении Российской академии медицинских наук Российском онкологическом научном центре
имени Н. Н. Блохина РАМН, Москва
Научные руководители:
доктор медицинских наук А. А. Штиль
кандидат физико-математических наук Д.Н. Калюжный
Официальные оппоненты:
доктор биологических наук профессор Богуш Т.А.,
доктор биологических наук профессор Горбачева Л.Б.
Ведущее учреждение: Первый Московский государственный медицинский университет имени И.М. Сеченова.
Защита диссертации состоится 13 октября 2011 г. на заседании Диссертационного Совета Д.001.017.01 при РОНЦ им. Н.Н.Блохина РАМН по адресу: 115478, Москва, Каширское шоссе, 24.
С диссертацией можно ознакомиться в библиотеке
РОНЦ им. Н.Н.Блохина РАМН.
Автореферат разослан ____ сентября 2011 г.
Ученый секретарь Диссертационного Совета
доктор медицинских наук профессор Ю.В. Шишкин
Общая характеристика работы
Актуальность проблемы
Улучшение результатов химиотерапии больных с злокачественными новообразованиями продолжает оставаться актуальной проблемой, решение которой выходит за рамки клинической онкологии и требует усилий специалистов в химии, биофизике, фармакологии, биотехнологии и других фундаментальных дисциплинах. Разрабатываемая в последние годы стратегия мишень-направленной (таргетной) терапии предусматривает выбор внутриклеточных мишеней (белков), воздействие на которые приводит к необратимому нарушению жизнедеятельности опухолевых клеток при минимальном повреждении неопухолевых клеток. Такими мишенями могут быть компоненты путей передачи внутриклеточных сигналов, контролирующих выживание и пролиферацию опухолевых клеток - факторы роста и их рецепторы, механизмы клеточной адгезии, инвазии, ангиогенеза. Новыми и перспективными являются попытки непосредственного лекарственного воздействия на аппарат экспрессии генов, в частности, на ДНК теломер и регуляторные области онкогенов. Важнейшая задача направленного противоопухолевого воздействия – создание новых молекул-прототипов лекарств и исследование механизмов их цитотоксичности. Для этого широко изучаются многочисленные классы низкомолекулярных химических соединений. Преимуществом малых молекул является способность проникать в опухолевые клетки путем простой диффузии и взаимодействовать с внутриклеточными мишенями c аффинностью, достаточно высокой для нарушения структуры и функций указанных мишеней.
Достоинствами порфиринов в качестве противоопухолевых препаратов направленного действия является их способность с высокой селективностью накапливаться в опухолевых клетках, что позволяет снизить побочные эффекты терапии. В настоящее время порфирины и их производные широко применяются в качестве агентов для фотодинамической терапии опухолей. Особенностью таких соединений является отсутствие темновой токсичности по отношению к опухолевым клеткам.
В настоящей работе в качестве объекта исследования выбраны производные порфиринов, обладающие самостоятельной токсичностью для опухолевых клеток. Токсичные соединения в указанном химическом классе составляют небольшую и недостаточно изученную часть. Как правило, токсичны синтетические производные порфиринов, не имеющие природных аналогов, или модифицированные природные порфирины.
Различные порфирины неодинаково взаимодействуют с мишенями в опухолевых клетках. В основе наиболее часто встречающихся механизмов гибели лежит взаимодействие порфиринового лиганда с ДНК. Дуплексы, а также сложные структуры ДНК – квадруплексы, важные для пролиферации клеток, являются перспективными мишенями для порфиринов. Известны и ДНК-независимые внутриклеточные мишени порфиринов, взаимодействие с которыми вызывает гибель опухолевых клеток.
Таким образом, актуальность проблемы, поставленной в диссертации, обусловлена необходимостью изучения молекулярных механизмов самостоятельной цитотоксичности порфиринов и их производных для создания новых мишень-направленных противоопухолевых препаратов.
Цель исследования – установить механизмы гибели опухолевых клеток человека при действии новых модифицированных порфиринов.
Задачи:
1. создать новые цитотоксические производные порфиринов и изучить их физико-химические и противоопухолевые свойства;
2. исследовать взаимодействие наиболее активных соединений с внутриклеточной мишенью – ДНК: определить тип связывания, константу равновесия комплексообразованиия;
3. установить связь между физическими характеристиками порфиринового лиганда (по взаимодействию с различными структурами ДНК) и его цитотоксичностью для культивируемых опухолевых клеток;
4. изучить механизмы гибели клеток при действии наиболее активных производных порфиринов.
Новизна исследования
- Синтезированы новые производные порфиринов, обладающие самостоятельной токсичностью по отношению к опухолевым клеткам, в том числе к клеткам с молекулярной детерминантой лекарственной устойчивости – нефункционирующим р53.
- Впервые изучены количественные параметры взаимодействия новых соединений с различными структурами ДНК.
- Впервые идентифицирована внутриклеточная мишень наиболее активного нового производного хлорофилла – палладиевого комплекса пурпурина-18.
- Установлен механизм взаимодействия палладиевого комплекса пурпурина-18 с модельной мембраной, по структуре схожей с клеточными мембранами.
- Выявлен механизм гибели опухолевых клеток при действии палладиевого комплекса пурпурина-18.
Научно-практическая значимость исследования
Изучение механизмов цитотоксического действия новых производных порфиринов позволит обосновать использование этого класса противоопухолевых препаратов для лечения онкологических заболеваний.
Апробация работы
Диссертация обсуждена 14 июня 2011 г. на совместной конференции лабораторий механизмов гибели опухолевых клеток, молекулярной эндокринологии, регуляции клеточных и вирусных онкогенов, механизмов регуляции иммунитета, биохимии опухолей, канцерогенных веществ, вирусного канцерогенеза, механизмов прогрессии эпителиальных опухолей, биохимической фармакологии, медицинской химии Российского онкологического научного центра имени Н.Н.Блохина РАМН.
Публикации по теме диссертации
По материалам диссертации опубликованы 4 журнальных статьи и тезисы четырех международных и российских конференций.
Структура и объем диссертации
Диссертация изложена на __ страницах машинописи и состоит из введения, глав “Обзор литературы”, “Материалы и методы исследования”, “Результаты исследования”, заключения и выводов. Работа содержит __ рисунков и __ таблиц. Библиографический материал включает ссылки на ___ источников литературы.
Материалы и методы исследования
Реактивы получены из фирмы Sigma, США, кроме специально оговоренных случаев.
Получение металлокомплексов пурпурина-18
Для получения пурпурина-18 хлорофилл экстрагировали из биомассы и окисляли в щелочной среде кислородом воздуха. Последующая обработка соляной кислотой привела к образованию ангидридного цикла и получению пурпурина-18. Индивидуальность соединений контролировали с помощью тонкослойной хроматографии. Структуры новых соединений подтверждены инфракрасной и масс-спектроскопией и методом ядерного магнитного резонанса. Синтез проводился совместно с к.х.н. В.А.Ольшевской (Институт элементоорганических соединений имени А.Н. Несмеянова РАН).
Реагенты и условия экспериментов в бесклеточных системах
Олигонуклеотиды d(AC)8, d(GT)8, d(TTAGGG)4 (tel-Q), d(TTAGGGTTAGAG(TTAGGG)2) (tel-M) синтезированы фирмой “Литех”, Москва. 5,10,15,20-Тетра-(N-метил-3-пиридил)порфирин (ТМРуР3) приобретен в Porphyrin Products, Inc. (США). Порфириновые производные хлортиазола синтезированы и предоставлены к.х.н. Д.В.Белых (Институт химии Коми научного центра Уральского отделения РАН). Измерения проводили при 20С в растворе, содержащем 0,1 M NaCl и 10 мM фосфатного буфера, рН=8. Концентрацию олигонуклеотидов определяли спектрофотометрически по поглощению в длине волны 260 нм при 90°С в воде. Коэффициенты молярных экстинкций: d(AC)8=150666 М-1·см-1, d(GT)8=140667 М-1·см-1, tel-Q=224333 М-1·см-1, tel-M=225833 М-1·см-1. Концентрацию порфиринов определяли по поглощению в полосе Соре.
Изучение связывания порфиринов с ДНК
Для изучения взаимодействия модифицированных порфиринов с ДНК использовали нативную ДНК из тимуса теленка (“Reanal”, Венгрия). ДНК растворяли в буфере, содержащем 0.1 M NaCl, 10 мM фосфатный буфер (рН 8). Измерения проводили при 370С. Спектры поглощения и кривые плавления комплексов ТМРуР3:ДНК определяли на спектрофотометре Jasco V-550. Концентрацию порфирина, связанного с ДНК, определяли по спектрам его поглощения в ближней УФ-области, используя уравнение:
С2/C0 = [A1 – A]/[A1 – A2], где А, А1, А2 – абсорбция исследуемого образца в полосе Соре и поглощение контрольных образцов со свободным и полностью связанным порфирином, соответственно; C0 = C1 + C2 – сумма концентраций свободного (С1) и связанного (С2) порфирина в растворе.
Для плавления теломерного квадруплекса и его комплексов с лигандом использовали термостатируемую ячейку Пельтье. Плавление наблюдали по изменению поглощения в области 295 нм (диапазон 15-90°С), скорость нагрева 1°С/мин.
Миграцию энергии с нуклеотидов ДНК на лиганд изучали по спектрам возбуждения флуоресценции (=650 нм) в интервале 220-350 нм. Спектры кругового дихроизма (КД) измеряли на спектрофотометре Jasco V-715. Величины сигнала КД () приведены в единицах молярной экстинкции нуклеотидов.
Построение изотерм адсорбции
Изотермы адсорбции порфиринов на ДНК построены спектрофотометрическим методом по поглощению лиганда в полосе Соре. Концентрацию связаного лиганда C2 определяли по формуле:
![]() , где С0 – общая концентрация лиганда в растворе, A – поглощение исследуемого образца, A1 - поглощение полностью свободного лиганда, A2 - поглощение полностью связанного лиганда. Среднее заполнение r = С2/СДНК рассчитывали на концентрацию олигонуклеотида или дуплекса. Эффективную константу связывания оценивали по уравнению, описывающему модель независимого связывания лигандов на ДНК:
, где С0 – общая концентрация лиганда в растворе, A – поглощение исследуемого образца, A1 - поглощение полностью свободного лиганда, A2 - поглощение полностью связанного лиганда. Среднее заполнение r = С2/СДНК рассчитывали на концентрацию олигонуклеотида или дуплекса. Эффективную константу связывания оценивали по уравнению, описывающему модель независимого связывания лигандов на ДНК:
![]() , где K – эффективная константа связывания, n – число молекул лиганда, образующих комплекс одного типа.
, где K – эффективная константа связывания, n – число молекул лиганда, образующих комплекс одного типа.
Приготовление липосом и анализ целостности искусственных мембран
Диоктаноилфосфатидилхолин и дипальмитилфосфатидилхолин упаривали в токе азота из растворов в хлороформе, добавляли 1 мл буфера (10 мМ Трис-основания, 10 мМ морфолинэтансульфоната, 100 мМ КСl, 100 мМ карбоксифлуоресцеина (КФ)), встряхивали и подвергали замораживанию-оттаиванию. Смесь мультиламеллярных липосом продавливали через поликарбонатный фильтр с порами диаметром 0,1 мкм. Heвключившийся в липосомы КФ отделяли гель-хроматографией на сефадексе G-50. Липосомы инкубировали с исследуемым производным пурпурина-18, затем несвязавшийся лиганд отделяли гель-фильтрацией. Флуоресценцию карбоксифлуоресцеина возбуждали в области 490 нм, регистрировали при 520 нм. Долю вышедшего из липосом красителя в конкретный момент времени рассчитывали по формуле:
= (Ff - F0)/(Fm - F0), где F0 и Ff - уровни флуоресценции до и после добавления пурпурина, соответственно; Fm - значение флуоресценции после полного разрушения липосом детергентом Тритон X-100 (конечная концентрация 2,4%).
Линии клеток и условия культивирования
Использованы линии трансформированных клеток человека: HCT116 (рак толстой кишки) с диким типом p53; НСТ116р53КО - сублиния HCT116 с делецией обоих аллелей гена р53 (р53-/-) (получена в лаборатории B.Vogelstein, Johns Hopkins University, США), лейкоз K562. Клетки HCT116 и HCT116р53КО культивировали в модифицированной Дульбекко среде Игла (DMEM) с добавлением 2 мМ L-глутамина, 5% эмбриональной телячьей сыворотки, 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина. Для линии K562 использовали среду RPMI-1640 c вышеуказанными добавками. Культуры инкубировали при 370С, 5% СО2. Эксперименты проводили с культурами в логарифмической фазе роста.
Исследование цитотоксичности модифицированных порфиринов
В лунки 96-луночного планшета вносили 190 мкл клеточной взвеси (~4 тыс.клеток) и инкубировали 16-24 часа. В день экспериментов приготавливали серийные разведения исследуемых порфиринов. Клетки инкубировали с препаратами 72 ч. После окончания инкубации в лунки вносили 20 мкл водного раствора бромида 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия (МТТ; 5 мг/мл). Клетки инкубировали 2 ч. до развития темно-фиолетовой окраски клеток (формазан), удаляли культуральную среду. К клеткам добавляли 100 мкл диметилсульфоксида (ДМСО) и суспендировали. Оптическую плотность измеряли на спектрофотометре при длине волны 570 нм, вычитая оптическую плотность при 690 нм.
Внутриклеточное распределение Pd-пурпурина
Клетки линии HCT116 рассеивали на круглые покровные стекла диаметром 24 мм в 60 мм чашки Петри (60 тыс. клеток на чашку). Клетки инкубировали 48 ч. для распластывания. Палладиевый металлокомплекс пурпурина-18 – вносили в конечной концентрации 10 мкМ. Объем вносимого раствора соединения составлял 0,1% объема культуральной среды. Для визуализации лизосом использовался pH-чувствительный маркер LysoTracker Green DND-26 (Molecular Probes, США; конечная концентрация 1 мкМ). Цифровые изображения получены на лазерном конфокальном микроскопе Axiovert 200M LSM 510 Meta (Carl Zeiss, Германия). Флуоресценцию Pd-пурпурина возбуждали 633 нм He-Ne лазером, эмиссию регистрировали с помощью 650-710 фильтра. Для возбуждения LysoTracker Green использовали 488 нм аргоновый лазер и фильтр 500-530 нм. Для обработки изображений использовали поставляемую производителем компьютерную программу Zeiss LSM 510 Meta Software 3.2.
Исследование фаз клеточного цикла
Клетки линии HCT116 рассеивали на 35 мм чашки Петри. Через 16 часов в среду добавляли исследуемые порфирины в концентрациях 0,1-5 мкМ. По окончании инкубации клетки лизировали в буфере (0,1% цитрата натрия, 0,3% NP-40, 50 мкг/мл РНКазы А и 50 мкг/мл пропидия иодида. Распределение фаз клеточного цикла (по плоидности ДНК) анализировали на проточном цитофлуориметре Becton Dickinson (США). Накапливали 30000 событий для каждого образца. Фрагментацию ДНК выражали как процент событий слева от G1-пика (суб-G1 область) по отношению к общему числу событий.
Электрофоретический анализ целостности ДНК.
Клетки линии HCT116 (1,5х106 в 3 мл культуральной среды) рассеивали на 35 мм чашки Петри. Через 16 ч. добавляли Pd-пурпурин, и культуры инкубировали 24-72 ч. После окончания инкубации необработанные (контроль) и обработанные металлокомплексом клетки открепляли трипсином и лизировали в буфере (0,35 M NaCl; 20 мM Tрис-HCl pH=7.4; 2 мM MgCl2, 1 мM дитиотрейтола; 0,5% NP-40) 30 мин. на льду. ДНК выделяли фенол-хлороформной экстракцией, обрабатывали РНКазой А и проводили электрофорез в 1% агарозном геле.
Анализ белков методом иммуноблоттинга.
Клетки линии НСТ116 рассеивали на 60 мм чашки Петри (300 000 клеток на чашку). Pd-пурпурин добавляли на 24-48 ч., клетки открепляли и лизировали на льду 30 мин. в буфере (50 мМ Tрис-HСl, pH 7,4; 150 мМ NaCl; 1% NP-40; 0,25% дезоксихолата натрия) с добавлением 2 мМ фенилметилсульфонилфторида. Лизаты центрифугировали 15 мин. при 10000хg, 4°C. Общую концентрацию белков в лизатах определяли по Брэдфорду. Электрофорез белков проводили в 8% полиакриламидном геле с 0,1% додецилсульфата натрия. После электрофореза белки переносили на нитроцеллюлозную мембрану. Использовали антитела к поли(АДФ-рибоза)-полимеразе (Cell Signaling, США; 1:1000). В качестве внутреннего контроля иммуноблоттинга использовали антитела к гамма-актину (1:1000). Для визуализации белков использовали вторичные антитела к IgG мыши или кролика (1:5000), конъюгированные с пероксидазой хрена, и метод хемилюминесценции.
Количественную обработку результатов проводили с использованием методов параметрической статистики.
Результаты исследования
 Рис. 1. Структурные формулы исследуемых порфиринов и их производных.
Рис. 1. Структурные формулы исследуемых порфиринов и их производных.
Исследовали комплексообразование производных порфиринов с ДНК для выявления наиболее предпочтительного ДНК-лиганда. Наиболее аффинным лигандом оказался 5,10,15,20-тетра-(N-метил-3-пиридил)порфирин 5 (TMPyP3; табл. 1). Изучены комплексы 5 с антипараллельным теломерным G-квадруплексом d(TTAGGG)4 (tel-Q), tel-М - олигонуклеотидом d(TTAGGGTTAGAG(TTAGGG)2), не образующим квадруплексную структуру, одноцепочечными молекулами ДНК d(AC)8, d(GT)8 и дуплексом d(AC)8·d(GT)8.
Адсорбцию молекул 5 на различных структурах ДНК изучали по изменению спектров поглощения соединения в полосе Соре, 380<< 480 нм, (рис. 2).
Смещение максимумов полосы Соре (на 13-17 нм) комплексов 5 с олигонуклеотидами и гипохромизм свидетельствуют о стэкинг-контактах лиганда с основаниями исследуемых ДНК.
Таблица 1. Параметры связывания модифицированных порфиринов с двухцепочечной ДНК
| Порфирин | Полоса Соре, нм | Константа связывания, М-1 |
| Цинковый комплекс пурпурина-18 1 | 420 | 1105 |
| Палладиевый комплекс пурпурина-18 2 | 420 | 8104 |
| Никелевый комплекс пурпурина-18 3 | 421 | 1105 |
| Пурпурин-18 4 | 418 | 1,6105 |
| 5,10,15,20-тетра-(N-метил-3-пиридил)порфирин 5 | 417 | 3,5106 |
| 5-(N-метилпиридил)-10,15,20-трифенил порфирин 6 | 448 | 1105 |
| 5-[4-(o-карборан-1-ил)метил]пиридил-10,15,20-трифенилпорфирин 7 | 420 | 1105 |
| Хлорин е6 13-N-(2-( N'- 2)-аминоэтил)-амид 15,17-диметиловый эфир 8 | 395 | 1105 |
| Хлорин е6 13,17-N,N-бис-(2-( N'- 2)-аминоэтил)-диамид 15-метиловый эфир 9 | 395 | 1105 |


 Рис. 2. Спектры поглощения 5 при связывании с ДНК (А). Изотермы адсорбции комплексов 5 с ДНК (Б, В).
Рис. 2. Спектры поглощения 5 при связывании с ДНК (А). Изотермы адсорбции комплексов 5 с ДНК (Б, В).
Таблица 2. Параметры связывания TMPyP3 со структурами, образованными олигонуклеотидами
| Олигонуклеотид | K, М-1 106 | n |
| tel-Q | 4,7±1 | 3,3±0.3 |
| tel-М | 13 ±2 | 4,6±0.2 |
| d(GT)8 | 4,4±0.5 | 3,0±0.1 |
| d(AC)8 | 2,3±0.3 | 2,2±0.2 |
| d(GT)8·d(AC)8 | 5,0±0.5 | 4,5±0.2 |
Анализ данных, приведенных в табл. 2, позволяет утверждать, что соединение 5 обладает наиболее высоким сродством к развернутой нити ДНК. Различие в константах связывания соединения 5 с G-квадруплексом и с его развернутой нитью может говорить о сдвиге равновесия в сторону развернутой нити при взаимодействии с порфирином. Сравнение связывания TMPyP3 с tel-M, d(GT)8 и d(AC)8 позволяет считать, что высокое сродство 5 к развернутой нити tel-М обусловлено блочным расположением остатков гуанина в цепи.
Для подтверждения нарушения упорядоченной структуры G-квадруплекса, соединением 5 проведено термическое изменение G-квадруплекса и его комплексов с 5 методом УФ-плавления (=295 нм; рис. 3).

Рис. 3. Плавление () tel-Q и () его комплексов с соединением 5
Показаны первые производные кривых плавления (- -) tel-Q и () комплексов с соединением 5.
Сравнение кривых плавления подтверждает некоторую дестабилизацию квадруплексной структуры адсорбированными молекулами 5 и согласуется с более высоким сродством соединения 5 к развернутой нити tel-М (К= 1,3х107 М-1), а не к G-квадруплексу tel-Q (К=4,7х106 М-1). Различие констант связывания ТМРуР3 с этими олигонуклеотидами обусловливает сдвиг равновесия от квадруплексной структуры к развернутой нити.
Влияние соединения 5 на структуру tel-Q изучали, анализируя спектры КД. Изменения спектров КД свидетельствуют о нарушении G-квадруплексной структуры, что согласуется с результатами УФ-плавления - понижением термостабильности G-квадруплекса в комплексе с 5 и данными о предпочтительном связывании порфирина с tel-M по сравнению с tel-Q.
Исследование цитотоксичности производных порфиринов показало, что наиболее токсичны пурпурин-18, а также его цинковый, никелевый и палладиевый комплексы, синтезированные нами впервые (рис. 4). На кривых выживаемости клеток концентрации соединений, при которых установлена гибель 50% клеток, оказались в субмикромолярном и микромолярном диапазонах. Такие значения цитотоксичности выявлены для современных эффективных противоопухолевых химиопрепаратов, например, ДНК-лигандов доксорубицина (адриамицина) и митоксантрона. Дальнейшие исследования механизмов цитотоксичности модифицированных порфиринов выполнены с Pd-пурпурином (соединение 2).


Рис. 4. Цитотоксичность модифицированных порфиринов для линии рака толстой кишки НСТ116.
Представлены усредненные данные 3 независимых экспериментов.
Дисфункция р53 ограничивает действие ДНК-связывающих химиопрепаратов, в частности, доксорубицина. Мы сравнили способность Pd-пурпурина (соединение 2) вызывать гибель сублинии рака толстой кишки с делецией гена р53. На рис.5 показано, что сублиния НСТ116р53КО лучше выживает в ответ на действие доксорубицина, чем исходная линия, тогда как 2 одинаково активно для клеток с диким типом р53 и для сублинии с нефункционирующим р53. Такое свойство дает палладиевому пурпурину важное преимущество как перспективному противоопухолевому агенту.

Рис. 5. Сравнение цитотоксичности 2 и доксорубицина для клеток рака толстой кишки НСТ116 с диким типом и делецией р53
С помощью лазерной конфокальной микроскопии изучено внутриклеточное распределение Pd-пурпурина 2. Чтобы выявить, где именно локализуется соединение, применяли одновременную окраску клеток веществами, избирательно накапливающимися в конкретных областях клетки. Из всех флуоресцентных маркеров органелл мы отметили колокализацию 2 только с лизосомами. В других органеллах соединение не обнаружено.
Данные проточной цитофлуориметрии показали, что при воздействии соединения 2 на клетки НСТ116 (1 мкМ, 24 ч.) выявлены признаки гибели, а именно, выраженное снижение количества клеток в фазе G1, увеличение области G2/M – продвижение клеток по циклу задержано в этой фазе. Выявлено также большое количество деградированной ДНК (рис. 6).

Рис. 6. Нарушения клеточного цикла при действии Pd-пурпурина 2 на клетки линии НСТ116
А, контроль; Б, соединение 2 (1 мкМ, 24 час).
Наряду с фрагментацией ДНК, установлено уменьшение количества нерасщепленной поли(АДФ-рибоза)-полимеразы при действии 2 (рис.7).
В совокупности эти результаты свидетельствуют об апоптозе как механизме гибели клеток при действии Pd-пурпурина.
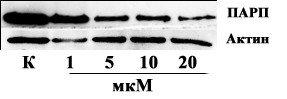

К, контроль (необработанные клетки).
Рис. 7. Расщепление поли(АДФ-рибоза)-полимеразы (ПАРП) в клетках линии НСТ116 при действии соединения 2
Для выяснения возможности непосредственного повреждения плазматической мембраны соединением 2 (индукции некроза) изучен механизм взаимодействия 2 с модельными липидными мембранами - липосомами из цвиттер-ионных фосфолипидов, содержащих непредельные (диолеилфосфатидилхолин) и предельные (дипальмитоилфосфатидилхолин) ацильные цепи. Липосомы нагружали карбоксифлуоресцеином (КФ), инкубировали с 2 и регистрировали флуоресценцию КФ, вытекавшего из поврежденных липосом в окружающий буфер. На рис. 8А показано, что в концентрации, в которой пурпурин 2 вызывал апоптоз клеток рака толстой кишки (см. выше), соединение индуцировало повреждение липосом. Указанный эффект не зависел от степени насыщенности липида; следовательно, повреждение не связано с образованием свободных форм кислорода в мембране. Соединение 2 вызывало репарируемые повреждения модельной мембраны, т.к. после удаления Pd-пурпурина вытекание КФ из липосом прекращалось (рис.8Б). Таким образом, 2 не вызывает некроз, что согласуется с данными исследований в культурах опухолевых клеток.


Рис. 8. Повреждение модельных мембран соединением 2
А, зависимость кинетики вытекания КФ из липосом от концентрации 2; Б, удаление 2 приостанавливает вытекание КФ из липосом.
Полученные результаты позволяют утверждать, что порфирины и их производные перспективны как самостоятельные цитотоксические агенты. Соединения этого химического класса могут связываться с двух- и четырехцепочечными участками ДНК, изменять конформацию макромолекулы и нарушать функцию ДНК-зависимого фермента теломеразы. Отдельные порфирины вызывают гибель культивируемых клеток. Требуются углубление знаний о взаимосвязи “структура-противоопухолевая активность” для создания самостоятельных противоопухолевых лекарств на основе порфиринов. “Оптимальное” соединение должно накапливаться преимущественно в злокачественных клетках, проникать в ядро, образовывать высокоаффинные комплексы с ДНК, ингибировать функции ДНК-зависимых ферментов в низких концентрациях. Совместить в одном соединении эти важнейшие требования – задача дальнейших исследований. Изучение биораспределения и фармакокинетики порфиринов облегчается предшествующим опытом таких исследований в фотобиологии и разработкой методов выявления порфиринов в крови и тканях, однако данных о самостоятельной противоопухолевой активности мало. Это не удивительно: требования к препаратам для фотодинамической терапии обусловливают отбор именно соединений, не вызывающих темновую токсичность. Представляется необходимым расширить возможности использования порфиринов в онкологии: наряду с нетоксичными фотосенсибилизаторами на основе этих соединений могут быть получены эффективные индукторы гибели опухолевых клеток - прототипы химиопрепаратов. ДНК – одна из внутриклеточных мишеней таких соединений; не исключено, что и другие мишени окажутся важными для самостоятельной цитотоксичности порфиринов.
Автор выражает благодарность к.х.н. В.А. Ольшевской за подготовку в химии порфиринов и помощь в синтезе новых соединений, проф. О.Ф. Борисовой и д.ф-м.н. А.К. Щелкиной за консультации по изучению комплексообразования порфиринов с ДНК, Татарскому за критические замечания при выполнении диссертационной работы.
Выводы
1. Порфирины и их производные проявляют важнейшее свойство, обусловливающее перспективность этого химического класса как источника противоопухолевых препаратов – способность вызывать гибель опухолевых клеток, в том числе клеток, устойчивых к лекарственным воздействиям.
2. Новые и известные производные порфиринов являются ДНК-лигандами, образующими высокоаффинные комплексы с нативной макромолекулой и сложными структурами – квадруплексами. Установлена связь между структурой ДНК-связывающих порфиринов, количественными параметрами комплексообразования, способностью взаимодействовать с различными структурами ДНК и нарушать конформацию макромолекулы, и индукцией гибели опухолевых клеток.
3. Создана серия металлокомплексов пурпурина-18 и установлена высокая цитотоксичность (в микромолярном диапазоне концентраций) новых соединений для культивируемых опухолевых клеток человека при меньшем повреждении неопухолевых клеток. Новые металлокомплексы пурпурина-18 вызывают гибель клеток с нефункционирующим р53.
4. Палладиевый комплекс пурпурина-18 накапливается в лизосомах клеток, вызывает задержку клеточного цикла в фазе G2/M и апоптоз, сопровождающийся расщеплением поли(АДФ-рибоза)-полимеразы и межнуклеосомной фрагментацией ДНК.
5. Разработана модель взаимодействия палладиевого комплекса пурпурина-18 с искусственными мембранами, состоящими из фосфолипидов различной насыщенности. Палладиевый комплекс пурпурина-18 нарушает проницаемость модельной мембраны; целостность мембраны восстанавливается с отменой воздействия. Репарируемое нарушение целостности мембраны отличает действие палладиевого комплекса пурпурина-18 от некрозиндуцирующих воздействий.
Публикации по теме диссертации
1.Ol'shevskaya V.A., Dutikova Yu.V., Tyutyunov A.A., Kononova E.G., Petrovsky P.V., Sung D. D., Kalinin V.N. An efficient synthesis of carborane amines via one stage reaction of carborane triflates with N-nucleophiles. // Synlett.- 2010.-№ 8.- P. 1265-1267.
2. Дутикова Ю. В., Борисова О.Ф., Щелкина А.К., Лин Д., Хуанг С., Штиль А.А., Калюжный Д.Н. 5,10,15,20-Тетра-(N-метил-3-пиридил)- порфирин дестабилизирует антипараллельный теломерный квадруплекс d(TTAGGG)4. // Молекулярная биология. - 2010.-Т.44.-№ 5.-С. 929-937.
3. Ольшевская В. А., Зайцев А. В., Дутикова Ю. В., Лузгина В. Н., Кононова Е. Г., Петровский П. В., Калинин В. Н. Одностадийный синтез борированных мезо-тетрафенилпорфиринов. // Макрогетероциклы. - 2009.- Т.2. -№ 3-4. - С. 221-227.
4. Lyubimov S.E., Kalinin V.N., Olshevskaya V.A., Tyutyunov A.A., Dutikova Yu. V., Cheong C.S., Petrovskii P.V., Safronov A.S., Davankov V.A. Chiral phosphites derived from carboranes: electronic effect in catalytic asymmetric hydrogenation. // Chirality. - 2009. - V. 21. - P. 2–5.
5. Дутикова Ю.В., Ольшевская В.А., Мойсенович М.М., Рамонова А.А., Головина Г.В., Кузьмин В.А., Штиль А.А. Пурпурин-18 и его металлокомплексы как потенциальные противоопухолевые агенты. Материалы конференции “Фундаментальная онкология. Чтения им. проф. Н.Н.Петрова". Санкт-Петербург. 2011. - С. 18.
6. Dutikova Yu. V., Shchyolkina A.K., Borisova O.F., A.A.Shtil, Kaluzhny D.N. Interactions of 5,10,15,20-tetra-(N-methyl-3-pyridyl)porphyrin with guanine quadruplexes in telomeric DNA and c-Myc oncogene: parameters important for anticancer drug design. Proc. 3d International Meeting on Quadruplex DNA. Sorrento, Italy. - 2011. - P. 71.
7. Dutikova Yu. V., Savchenko A.N., Tatarsky V.V. Jr., Kalinin V.N., Ol'shevskaya V. A., Moisenovich M.M., Ramonova A.A., Shtil A.A. Modified purpurins as novel anticancer drug scaffolds. Proc. 5th Summer School "Medical Chemistry". 2010. Regensburg, Germany. - P.214.
8. Dutikova Yu.V., Ol'shevskaya V.A., Kalinin V.N., Borisova O.F., Shtil A.A., Kaluzhny D.N. Boronation confers preferential binding of porphyrin to telomeric G-quadruplex. Proc. 2nd International Meeting on Quadruplex DNA. Louisville, USA. - 2009. - P. 51.
9. Дутикова Ю.В., Ольшевская В.А., Калинин В.Н., Борисова О.Ф., Калюжный Д.Н., Штиль А.А. Новые производные порфиринов и их взаимодействие с различными структурами ДНК. Материалы 10-й международной конференции по физической и координационной химии порфиринов и их аналогов (ICPC-10). 2009. - Иваново. - С. 111.

