Современные возможности внутритканевой лучевой терапии в комбинированном и комплексном лечении рака молочной железы центральной и медиальной локализации.
На правах рукописи
Геворкян Вартан Самвелович
Современные возможности внутритканевой лучевой терапии в комбинированном и комплексном лечении рака молочной железы центральной и медиальной локализации.
14.00.14 – Онкология
14.00.19 – лучевая диагностика, лучевая терапия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2008
Работа выполнена на базе отделения радиохирургии ГУ Российский онкологический научный центр им. Н.Н. Блохина РАМН
Научный руководитель: профессор,
доктор медицинских наук Михаил Иванович Нечушкин
Официальные оппоненты: доктор медицинских наук, профессор Вера Андреевна Титова
доктор медицинских наук, профессор
Дмитрий Владимирович Комов
Ведущая организация: ГУ Медицинский радиологический научный центр РАМН
Защита состоится « » _____________ 2008 года в 14.00 на заседании диссертационного совета Д -001.017.01 в ГУ Российского Онкологического Научного центра им. Н.Н. Блохина РАМН
по адресу: 115478, Москва, Каширское шоссе, д 24.
С диссертацией можно ознакомиться в библиотеке ГУ Российского Онкологического Научного центра им. Н.Н. Блохина РАМН (115478, Москва, Каширское шоссе, д. 24).
Автореферат диссертации разослан «__» _______ 2008 года
Ученый секретарь диссертационного совета
доктор медицинских наук, профессор Ю.В. Шишкин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы:
Ежегодно в мире регистрируется более 8 млн новых случаев злокачественных новообразований и более 5,2 млн смертей от них. В России в 2004 г. выявлено 468,6 тыс. больных с впервые в жизни установленным диагнозом злокачественного новообразования.
Ежегодно в мире выявляют более 1 млн новых случаев рака молочной железы, прогнозируя рост заболеваемости к 2010 году до 1,45 млн. На протяжении жизни 1 из 7 женщин в США страдает этим заболеванием. Вероятность заболеть раком молочной железы в России на протяжении предстоящей жизни для новорожденной девочки составляет 3,5%, умереть от него – 1,8%. В структуре онкозаболеваемости женщин доля этой локализации в России составила в 2004 году 20,4% (Давыдов М.И., Аксель Е.М. – 2005).
Давно известно, что одним из очагов поражения при лимфогенном метастазировании рака молочной железы являются парастернальные лимфатические узлы. По данным литературы метастазы во внутренних грудных лимфоузлах выявляются в 15,7-60,0%, а в 4 - 8 % это поражение встречается при отсутствии метастазов в аксиллярный коллектор [Холдин С.А., Дымарский Л.Ю. – 1975; Caceres E. – 1966; Margattini M.- 1954]. Известные методы диагностики поражения парастернальных лимфоузлов, такие как чрезгрудинная флебография, лимфосцинтиграфия, ультразвуковая, компьютерная, магниторезонансная и позитронно-эмиссионная томография, несовершенны. Частота ошибочных результатов может достигать 30% и выше (Kinoshita T. et al. – 1999; Scheijmans L.J. et al. – 2002; Scrimger R.A. et al. – 2000; Wahl R.L. – 2001.). А комбинированное использование вышеназванных методов чрезвычайно дорого, и потому экономически нецелесообразно. В связи с этим, большинство авторов предлагает в план комбинированного и комплексного лечения включить облучение парастернальной зоны. Таким образом, показания для проведения пред- или послеоперационного лучевого лечения на парастернальную зону чаше всего основываются лишь на локализации первичного очага и поражении аксиллярного лимфатического коллектора (Баженова А.П. и др. – 1985.).
При применении дистанционной лучевой терапии парастернальной лимфатической цепочки в зону облучения неизбежно попадают органы средостения, легкие, спинной мозг, которые получают значительную дозу облучения (от 25 до 30% СОД). Постоянно появляющиеся сообщения о возникновении в различные сроки серьезных осложнений после проведения дистанционной гамма-терапии на парастернальную зону со стороны органов, попадающих в зону облучения (Johansson S. – 2002.), ведет к постоянному поиску новых методик облучения на зоны регионарного метастазирования при раке молочной железы.
Методики внутритканевой лучевой терапии парастернальной зоны обладают рядом неоспоримых преимуществ перед дистанционным облучением: создание высокой, равномерной, непрерывной дозы непосредственно в лимфоколлекторе с минимальным лучевым повреждением окружающих органов и тканей (Нечушкин М.И. – 1985). Использование контактных методик лучевой терапии или их сочетание с дистанционной лучевой терапией существенно уменьшает негативные последствия, наблюдаемые при проведении дистанционной лучевой терапии в чистом виде. Кроме того, значительно снижаются лучевые нагрузки на медицинский персонал.
Появление на рынке аппаратов для проведения контактной лучевой терапии (Микроселектрон-HDR) открывает новые возможности в лечении рака молочной железы.
Целью настоящей работы является уменьшение частоты местных рецидивов и постлучевых повреждений на здоровых органах и тканях, а также снижение лучевой нагрузки на медицинский персонал при использовании различных методик внутритканевой лучевой терапии у больных раком молочной железы центральной и медиальной локализации.
В связи с этим поставлены следующие задачи:
- Изучить и отработать технические приемы введения радиоактивного источника во внутреннюю грудную артерию для последующего проведения внутритканевой лучевой терапии с помощью аппарата «Микроселектрон-HDR».
- Проанализировать группы лечения больных с различными методиками внутритканевого облучения парастернальной лимфатической цепочки.
- Провести сравнительную оценку дозного распределения и эффективности комбинированного лечения рака молочной железы в зависимости от методики лучевой терапии на парастернальную зону — дистанционная, внутритканевая источниками 60Со и 252Cf по сравнению с 192Ir на аппарате «Микроселектрон-HDR».
- Изучить отдаленные 5 и 10-летние результаты лечения больных раком молочной железы, перенесших внутритканевое облучение парастернальной зоны, оценить возможные интра- и послеоперационные осложнения, связанные с введением радиоактивных источников.
Научная новизна
Отработаны технические приемы введения радиоактивного источника во внутреннюю грудную артерию для последующего проведения внутритканевой лучевой терапии с помощью аппарата «Микроселектрон-HDR».
Выявлено отсутствие специфических осложнений в интра- и послеоперационном периоде у больных раком молочной железы, связанных с введением радиоактивных источников.
Показано, что выживаемость больных раком молочной перенесших внутритканевое облучение парастернальной зоны с использованием аппарата «Микроселектрон-HDR» не отличается от таковой при использовании методик с ручным введением источников.
Более низкая доза облучения на персонал за счета автоматизации процесса введения источника в катетер, установленный в парастернальной области, позволяет считать эту методику предпочтительной.
Практическая значимость:
Результаты работы показывают, что внутритканевое облучение парастернальной зоны с использованием аппарата «Микроселектрон-HDR».может быть использовано в комбинированном и комплексном лечении рака молочной железы. Благодаря автоматизации введения источников, снижения лучевой нагрузки на персонал, эта методика может быть рекомендована для использования в лечебных учреждениях, занимающихся внутритканевой терапией рака молочной железы и является предпочтительной альтернативой проведения дистанционной лучевой терапии на эту зону у больных с центральной и медиальной локализацией опухолевого узла.
Реализация результатов исследования.
Основные положения, результаты и выводы диссертации внедрены в лечебную практику отделения радиохирургии ГУ РОНЦ им. Н.Н. Блохина РАМН.
Апробация работы.
Материалы работы доложены на: III Съезде онкологов стран СНГ, Баку, 2006 год.
Публикация результатов исследования.
По теме диссертации опубликовано восемь печатных работ.
Объем и структура диссертации.
Диссертационная работа содержит 148 страниц машинописного текста, состоит из введения, пяти глав, выводов, практических рекомендаций и списка литературы, который включает в себя 229 источников, в том числе 135 отечественных и 94 иностранных. Содержит 40 таблиц, 14 графиков и 28 рисунков.
Основные положения, выносимые на защиту:
- Внутренняя грудная артерия является оптимальным естественным проводником для проведения контактной лучевой терапии, обеспечивающим равномерное облучение парастернального лимфатического коллектора.
- Внутритканевое облучение парастернальной зоны не только позволяет значительно уменьшить лучевые нагрузки на жизненно важные органы и ткани грудной клетки, и легко переносится больными, но и улучшает результаты лечения.
- Использование аппарата «Микроселектрон-HDR» с системой автоматического afterloading по сравнению с ручным введением источников 60Co и 252Сf позволяет снизить лучевую нагрузку на персонал при схожих показателях общей и безрецидивной выживаемости.
СОДЕРЖАНИЕ РАБОТЫ
В основу работы лег анализ лечения по 868 больных с центральной и медиальной локализацией рака молочной железы, прошедших лечение с использованием различных методик внутритканевой лучевой терапии на парастернальную зону в отделении радиохирургии ГУ Российский Онкологический Научный Центр им. Н.Н. Блохина Российской Академии Медицинских Наук в период с 1982 по январь 1993 г.г.
Из них 575 женщин (66,2%) облучались с использованием источников 60Со, 194 (22,4%) – с использованием источников 252Cf, а 99 (11,4%) проходили лечение на аппарате «Микроселектрон-HDR» с использованием источника 192Ir.
Средний возраст пациенток первой группы составил 48,2 (± 15,8) лет, второй – 50,8 (±12,6) лет, третьей – 49,7 (±9,8) лет.
Всем больным выполнены радикальные вмешательства на молочной железе в адекватном объеме. Большинство пациенток имело внутреннюю локализацию опухоли – 593 женщины, что составило 68,3% от общего числа больных. В 144 наблюдениях (16,7%) – в центральном квадранте, а по границам верхних и нижних квадрантов – 115 (13,2%) и 16 (1,8%) соответственно. Кроме того, у 31 пациентки (3,6%) наблюдался мультицентричный рост рака молочной железы.
I стадия установлена у 98 пациенток, что составило 11,3% от всей группы наблюдения, IIА – у 388 (44,7%), IIБ – у 202 (23,3%), IIIА – у 121 (13,9%), IIIБ – 59 (6,8). Все больные (62 – 19,8%) с Т3 и Т4 стадиями опухолевого процесса в предоперационном периоде подверглись лучевому лечению по стандартной схеме без облучения парастернальной области.
Гистологические формы опухоли были представлены преимущественно (66,7%) инфильтративно-протоковым раком. Так же часто встречались инфильтративно-дольковый и смешанный раки молочной железы. Все остальные морфологические формы первичной опухоли были обнаружены менее чем в 6% случаев от общего числа наблюдений.
Биопсия парастернальных лимфатических узлов была произведена в общей сложности 440 (50,7%) пациенткам, у 49 из которых (11,3%) выявлены метастазы. Полученные данные несколько ниже литературных, что вероятно обусловлено методикой биопсии. В некоторых случаях клетчатка парастернальной области настолько мала, что получить биопсийный материал из одного межреберья не всегда представляется возможность, а проведения биопсии во всех межреберьях чревато повреждением внутренних грудных сосудов, что привело бы к невозможности проведения внутритканевой лучевой терапии. Тем не менее пациенты с выявленным поражением внутренних грудных лимфатических узлов являются хорошим контролем эффективности проведения внутритканевой лучевой терапии на парастернальную область.
Под эндотрахеальным наркозом на первом этапе операции выполняется типичная радикальная мастэктомия с сохранением грудных мышц или радикальная резекция молочной железы. По окончании основного этапа тупым путем вдоль волокон расслаивается большая грудная мышца в каждом межреберье, разводится ассистентом малыми четырехзубыми крючками в разные стороны, и электроножом пересекаются I межреберные мышцы по краю грудины на стороне поражения. Возникающее кровотечение из мелких сосудов останавливается электрокоагуляцией. После рассечения межреберных мышц становится видна внутренняя грудная фасция, покрывающая парастернальную клетчатку, после вскрытия которой диссектором обнажаются внутренние грудные сосуды. На передней поверхности сосудов, или сбоку от них, непосредственно прилегая к стенке, располагаются парастернальные лимфоузлы. Далее приступали к катетеризации внутренней грудной артерии. Внутреннюю грудную артерию выделяют в I или II межреберье. Выбор межреберья определяется анатомическими особенностями больных. Первый межреберный промежуток у некоторых больных бывает очень узким, что не позволяет проводить манипуляции по выделению артерии и ее катетеризации. При грубом выделении артерии может возникнуть отрыв артериальных веточек, отходящих от основного ствола, что сопровождается кровотечением, которое не всегда легко остановить. При повреждении основных стволов внутренних грудных сосудов необходимо выполнить резекцию II реберного хряща и остановить кровотечение. На передней поверхности сосудов, или сбоку от них, непосредственно прилегая к стенке, располагаются парастернальные лимфоузлы. Внутренние грудные сосуды поднимаются на диссекторе, выделенные сосуды берутся отдельно на лигатуры. Окружающая сосуды клетчатка c лимфатическими узлами при помощи диссектора удаляется и направляется на гистологическое исследование. На уровне нижнего края I ребра перевязывается центральный конец артерии, надсекается передняя стенка сосуда и в периферический конец вводится полихлорвиниловый катетер с запаянным концом на глубину 12-13 см. Второй лигатурой фиксируется периферический конец артерии к катетеру. Катетер проводится под большой грудной мышцей на протяжении 5-6 см с выведением на кожу под тупым углом. Дефект межреберья укрывается большой грудной мышцей, которая ушивается, производится тщательный гемостаз раны. Для катетеризации использовался полихлорвиниловый катетер длиной 22 см. Внутренний диаметр катетера 1,1 мм. Дистальный конец катетера был запаян. Жесткость катетеру придавал гибкий металлический мандрен, вводимый в его просвет. Использование жесткого мандрена позволяло избежать катетеризации сосудистых коллатералей, а также перегибов катетера в I межреберье при изменении положения больной. Кроме того, металлический гибкий мандрен делал полихлорвиниловый катетер рентгеноконтрастным, что очень важно для контроля за положением катетера в послеоперационном периоде. Внутренние грудные сосуды были выделены в I межреберье у 773 (89,1%), во II — у 95 (10,9%) больных. Выделение сосудов во II межреберье проводилось при узком I межреберном промежутке у больных с астенической конституцией. При этом после катетеризации во II межреберном промежутке катетер с помощью диссектора укладывался под ребром и выводился в I межреберье.
В целом при отработанной технике оперативное вмешательство удлиняется на 10-15 минут.
При накоплении опыта работы и отработке методических приемов катетеризации и введения источников излучения в просвет катетеризованной внутренней грудной артерии или одноименной вены осложнения и неудачи могут быть сведены к минимуму.
В целом количество интра- и послеоперационных осложнений (3,8% и 1,2% соответственно) можно считать невысоким, в связи с чем катетеризацию внутренней грудной артерии и последующее введение в нее источников следует признать малотравматичной процедурой.
На следующий день после операции перед введением источников излучения проводился рентгенологический контроль положения катетера с рентгеноконтрастным мандреном во внутренней грудной артерии. Рентгенографию проводили в двух проекциях: передней и боковой. С помощью планирующей системы определялась степень соответствия реального имплантата планируемой идеальной схеме. При необходимости, если катетер находился в одной из концевых ветвей артерии, его положение корректировали.
Внутритканевое облучение парастернальной лимфатической цепочки радиоактивными источниками 60Со, 252Cf или 192Ir проводилось в «активной палате» блока закрытых источников излучения, куда больная поступала из отделения интенсивной терапии.
На каждую больную составлялась технологическая карта, в которой регистрировался объем облучаемых тканей, тип источника, его активность, мощность и предполагаемая СОД. Инженер-физик на основании этих данных определял время облучения.
Методика введения источников заключалась в следующем.
- Из катетера извлекался металлический мандрен, затем с его помощью катетер изнутри смазывается стерильным вазелиновым маслом. Выполнение этой процедуры необходимо для свободного скольжения источника по катетеру, так как внутренний диаметр катетера 1,1 мм, а наружный диаметр источника 1 мм.
- Источник излучения извлекался из транспортного контейнера и с помощью пинцета вставлялся в катетер. Затем металлическим мандреном он досылался до запаянного дистального конца катетера. Аналогичным образом вводился второй источник. Введение источников излучения производилось с соблюдением правил радиационной безопасности, принятых при работе с радиоактивными препаратами.
В случае облучения на аппарате «Микроселектрон-HDR» интрастат, введенный во внутреннюю грудную артерию, присоединялся к одному из каналов аппарата. Введение в катетер и извлечение из него источника 192Ir производится автоматически с использованием системы «afterloading» аппарата «Микроселектрон-HDR». Дистанционное управление аппаратом осуществляется с пульта, путем программирования, с определением активной позиции источника, времени нахождения источника в активной позиции. Аппарат «Микроселектрон-HDR» оснащен специальной системой, контролирующей путь, который должен пройти источник. При появлении какого-либо препятствия при прохождении контрольной пробы, источник не покидает исходное положение в аппарате, и подается предупредительный сигнал.
В «активной палате» больная находилась в течение всего времени облучения, необходимого для достижения планируемой СОД. Наблюдение за больной осуществлялось путем прямого контакта с ней и с помощью телевизионно-переговорочного устройства. Больной разрешалось передвижение по палате. По истечении запланированного времени облучения врач извлекал катетер с источниками, затем салфеткой, смоченной спиртом, придавливал ткани передней грудной стенки в области извлечения катетера для предотвращения кровотечения.
Доза облучения в ТД составляла 80 Гр по изоэффекту, при этом по краю планируемого облучаемого объема 20х100 мм СОД равнялась не менее 36 Гр по изоэффекту. При подобном планировании при наличии лимфатического узла размерами до 1 см вблизи стенки сосуда весь узел получал лечебную дозу облучения.
Клинически каких-либо изменений со стороны прилежащих к зоне облучения жизненно важных органов и тканей выявлено не было. Экспозиция при этом составляла 48 часов, что согласно радиобиологическим исследованиям по контактной лучевой терапии является благоприятным фактором .
Средняя продолжительность послеоперационного периода составила 14,3 ± 2,2 дня, что соответствует среднему послеоперационному периоду у больных раком молочной железы в отделении радиохирургии. Таким образом внутритканевая лучевая терапия на парастернальную зону не утяжеляла течение послеоперационного периода и не увеличивала его продолжительности.
Исходя из типа оперативного вмешательства все больные были разделены на 2 группы: перенесшие различные варианты радикальной мастэктомии (743 пациентки) и перенесшие радикальную резекцию молочной железы (125 пациенток).
Дистанционная лучевая терапия проводилась всем 125 (14,4%) больным перенесшим радикальную резекцию молочной железы на молочную железу и, по показаниям, на подмышечно-подключично-подлопаточную область. Дистанционная лучевая терапия на парастернальную зону не проводилась.
У 93 из 125 больных (74,4%) не были обнаружены метастатически-измененные лимфатические узлы, в связи с чем проведение системной лекарственной терапии им не было показано. Остальным 32 пациенткам (25,6%) по поводу распространенного опухолевого процесса, метастазов рака молочной железы в регионарные лимфатические узлы или при наличии раковых эмболов в лимфатических сосудах и щелях в плане комплесного лечения наряду с ДЛТ проводилась также системная лекарственная терапия. В качестве стандартного лечения проводилось введение 6-ти курсов адъювантной химиотерапии по схеме CMF, которое представляет собой болюсное внутривенное введение метотрексат 30 мг/м2 в/в в 1-й и 8-й дни, 5-фторурацил 500 мг/м2 в/в в 1-й и 8-й дни, циклофосфан 100 мг/м2 в/м с 1-го по 14-й дни с интервалом 4 недели.
У пациенток с гормонозависимыми опухолями и сохранной менструальной функцией проводилось выключение функции яичников. Из 125 больных 4 пациенткам (3,2%) в плане комплексного лечения была выполнена овариэктомия, 1 женщине (0,8%) проведена лучевая кастрация.
По окончании химиолучевой терапии всем пациенткам с гормонозависимыми опухолями (83 – 66,4%) назначалось антигормональное лечение препаратом тамоксифен в дозе 20 мг в сутки в течение 5 лет.
Триста девяносто три пациентки (52,9%), перенесшие радикальную мастэктомию (743), не имели метастазов в лимфатических узлах. Однако у 38 из них местная распространенность процесса соответствовала критериям Т3-Т4, а еще у 39 больных были обнаружены раковые эмболы в лимфатических сосудах клетчатки и ткани молочной железы. Таким образом в послеоперационном периоде 316 пациенток (42,5% - 36,4% от общего числа больных) не получали химиолучевой терапии. Остальным 427 пациенткам (74,6%) были назначены различные комбинации адьювантного лечения. Стандартные схемы системной лекарственной терапии были рекомендованы всем этим больным.
Показанием к проведению дистанционной лучевой терапии на подмышечно-поключично-подлопаточную область и на зону послеоперационного рубца пациенткам после радикальной мастэктомии явилось наличие Т1-2N2-3 Т3N1-3 и Т4N0-3 стадий заболевания. Облучение проводилось по традиционной методике в режиме классического фракционирования дозы. При опухолях Т4N0 послеоперационное облучение зон регионарного метастазирования не проводилось. Подобная лучевая терапия в послеоперационном периоде была проведена 127 пациенткам (46,7%).
Наличие рецепторов стероидных гормонов в опухоли молочной железы диктует необходимость проведения антиэстрогенной терапии. У 507 из 743 больных перенесших мастэктомию (68,2%) опухоль содержала рецепторы эстрогена или прогестерона. Все они получали терапию тамоксифеном на протяжении 5 лет после операции. Выключение функции яичников было произведено 77 больным, причем в 65 случаях была произведена овариэктомия. Лучевую кастрацию перенесли 12 пациенток. В последующем им был назначен тамоксифен по принятой схеме.
Все пациентки были прослежены в сроки от 6 до 210 месяцев. За это время прогрессирование заболевания выявлено у 294 (34,1%) пациенток. Дальнейшее развитие заболевания выявлено у 87 пациентов, что составило 30,0%. В группе прогрессирования (294 пациентки) отдаленное метастазирование превалировало над локальными рецидивами – 272 (93,2%) против 18 (6,1%) соответственно. Еще у 4 пациенток (1,4%) был диагностирован первичный рак второй молочной железы. У 1 больной (0,3%) был зарегистрирован рак шейки матки. Все пациентки получили полный спектр необходимого комбинированного и комплексного лечения в связи с вновь возникшим заболеванием.
Нами проанализирована общая и безрецидивная 5- и 10-летняя выживаемость больных, перенесших внутритканевую лучевую терапию на парастернальную зону. Общая 5-летняя выживаемость пациентов, перенесших лечение с использованием источников 60Co составила 80,5±1,6%, безрецидивная - 72,5±1,8%; с использованием источников 252Сf – 67,7±3,4% и 64,4±3,5%, а с использованием источников 192Ir на аппарате «МикроСелектрон-HDR» 82,6±4,8% и 73,8±5,3% соответственно. При этом как общая, так и безрецидивная выживаемость достоверно ниже в группе больных, получавших лечение на парастернальную зону источниками 252Сf. Это объясняется большим процентом пациенток с распространенными стадиями опухолевого процесса в этой группе: IIIa и IIIb стадии составляли 32,5%, в то время как в 2-х других группах 21,7% и 25,3% соответственно. Схожие тенденции наблюдаются и при оценке общей и безрецидивной 10-летней выживаемости, которые в 1-ой группе были 68,7±2,3% и 64,4±2,3%, во второй - 57,7±4,4% и 51,6±5,4%, а в третьей 69,6±5,2% и 63,2±6,2% соответственно (Графики 1, 2). Достоверно худшие показатели 10-летней выживаемости в группе больных получавших лечение с использованием источников 52Сf объясняется теми же причинами.
График 1.
Общая выживаемость больных, перенесших внутритканевую лучевую терапию на парастернальную зону
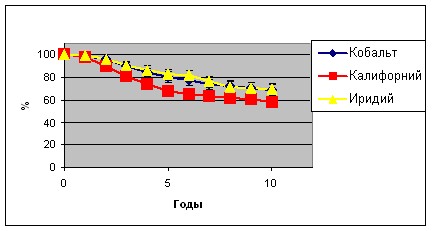
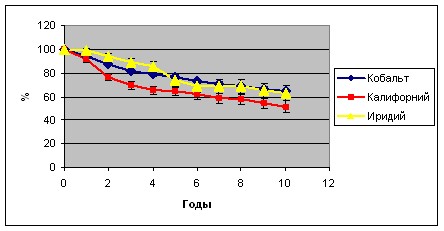
График 2.
Безрецидивная выживаемость больных, перенесших внутритканевую лучевую терапию на парастернальную зону
При оценке влияния размеров первичной опухоли молочной железы наблюдается закономерное увеличение частоты прогрессирования заболевания при возрастании критерия Т. При этом в группе больных получавших лечение с использованием источников 60Co показатель общей 10-летней выживаемости колебались от 76,0±2,4% при Т1 стадии опухолевого процесса до 40±9,1% при Т4. Показатели безрецидивной выживаемости составляли от 74,3±2,4 при Т1 до 38,6±9,2% при Т4. В группе больных получавших лечение с использованием источников 252Cf общая 10-летняя выживаемость при Т1 составила 76,3±4,3% при Т2 - 63,0±3,4%, Т3 - 34,2±6,2%, а при Т4 - 26,1±5,1%. Показатели безрецидивной 10-летней выживаемости при Т1 равнялись 75,2±4,6%, при Т2 - 61,9±3,7%, при Т3 - 30,6±6,8% а при Т4 - 26,1±5,1%. У больных, получавших внутритканевую лучевую терапию на парастернальную область с использованием источников 192Ir наблюдалась схожая закономерность: 10-летняя общая выживаемость при Т1 – 84,5±4,7%, при Т2 - 72,3±4,6%, при Т3 - 41,6±6,8, при Т4 - 39,2±8,1; 10-летняя безрецидивная выживаемость при Т1 – 77,5±5,6%, при Т2 - 62,0±5,5%, при Т3 - 36,2±7,7%, при Т4 - 36,6±8,2% (Графики 3, 4). Отмечается статистически достоверный в всех группах лучший прогноз у пациенток с опухолью соответствующей критериям Т1-2 по сравнению с Т3-4 (р<0,05). Все различия в между группами внутри одной стадии статистически недостоверны и объясняются относительно небольшим числом больных с опухолями соответствующими критериям Т3 и Т4.
График 3.
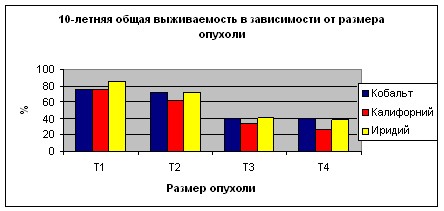
График 4.
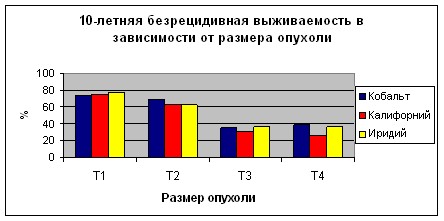
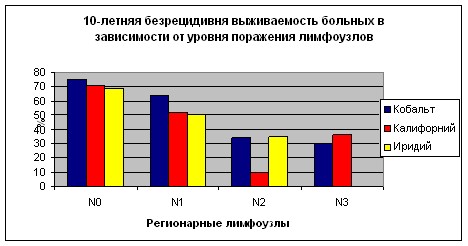
Схожая закономерность прослеживается и для групп с различной степенью поражения регионарных лимфатических узлов. Так в первой группе при N0 показатель общей 10-летней выживаемости составил 77,4±1,8%, при N1 - 66,7±2,4%, при N2 - 37,9±3,3%, при N3 - 32,6±3,4%. Безрецидивная 10-летняя выживаемость при N0 равнялась 75,1±1,9%, при N1 - 64,2±2,7%, при N2 - 34,2±3,4%, при N3 - 30,5±3,8%. Во второй группе при N0 показатель общей 10-летней выживаемости составил 71,6±2,5%, при N1 - 53,6±4,1%, при N2 - 10,1±6,0%, при N3 - 38,0±5,0%. Безрецидивная 10-летняя выживаемость при N0 равнялась 70,9±3,2%, при N1 - 52,1±5,0%, при N2 - 10,1±7,0%, при N3 - 36,2±6,6%. Парадоксальная ситуация с больными N2 и N3 в группе пациентов, перенесших контактную лучевую терапию на парастернальную зону с использованием источников 252Сf объясняется, вероятно, небольшим числом больных данной стадией и невозможностью проследить в течение всего срока судьбу всех женщин этих групп. В третьей группе при N0 показатель общей 10-летней выживаемости составил 76,5±3,6%, при N1 - 56,5±6,9%, при N2 - 39,8±7,4%, при N3 - 0%. Безрецидивная 10-летняя 34,5±8,1%, при N3 - 0% (Графики 5, 6). Статистически достоверной разницы между больными с критерием N0, также как и N1 по группам не получено. Рассчитать достоверно данные по больным с критериями N2 и, особенно, N3, невозможно из-за малого числа больных.
График 5.

График 6.
Обобщая вышеизложенное, можно утверждать, что применение внутритканевой лучевой терапии для облучения парастернальных лимфатических узлов представляется наиболее перспективным. При этом достигается высокая концентрация дозы в облучаемом объеме тканей. При планировании внутритканевой лучевой терапии возможно моделирование положения источников излучения и создание такой их геометрии, при которой достаточное дозное распределение будет охватывать весь облучаемый объем, а лучевое воздействие на окружающие органы и ткани будет минимальным. Применение различных методик внутритканевой лучевой терапии значительно снижает воздействие на соседние органы и ткани. Использование в качестве источника облучения аппарата «МикроСелектрон-HDR» более перспективно, так как при схожих результатах лечения снижается воздействие ионизирующего излучения на медицинский персонал в связи с отсутствием прямого контакта врача с источником облучения.
Выводы.
- Анатомо-топографические и дозиметрические исследования показали, что внутренняя грудная артерия является оптимальным естественным проводником для введения радиоактивных источников 60Со, 252Cf и проведения контактной лучевой терапии аппаратом «Микроселектрон-HDR» с использованием источника 192Ir, обеспечивающим равномерное облучение парастернального лимфатического коллектора.
- Изучены и отработаны технические приемы введения радиоактивных источников во внутреннюю грудную артерию для последующего проведения внутритканевой лучевой терапии с помощью аппарата «Микроселектрон-HDR» после радикальных операций у больных раком молочной железы.
- Невысокое количество интра- и послеоперационных осложений (3,8% и 1,2% соответственно) позволяет признать катетеризацию внутренней грудной артерии малотравматичной процедурой.
- Анализ отдаленных результатов лечения больных прошедших внутритканевую лучевую терапию на парастернальную зону с исполь-
зованиеми источников 60Co (группа 1), 252Сf (группа 2) и на аппарате «Микроселектрон-HDR» с использованием источника 192Ir (группа 3) показал достоверно лучшие показатели 10-летней общей (68,7±2,3%, 69,6±5,2%) и безрецидивной (64,4±2,3%, 63,2±6,2%) выживаемости в 1 и 3 группах по сравнению со 2 группой (57,7±4,4% и 51,6±5,4%), что связано с большим числом местнораспространенных форм опухолей у этих пациентов (32,5%, против 21,7% и 25,3% соответственно). - Внутритканевое облучение парастернальной зоны не только позволяет значительно уменьшить лучевые нагрузки на жизненно важные органы и ткани грудной клетки, и легко переносится больными, но и улучшает результаты лечения. Оно может быть использовано в онкологических диспансерах, имеющих в своей структуре радиологическое отделение с блоком закрытых источников.
- Использование аппарата «Микроселектрон-HDR» с системой автоматического afterloading позволяет снизить лучевую нагрузку на персонал при схожих показателях общей и безрецидивной выживаемости.
- Наличие метастазов в парастернальных лимфатических узлах указывает на наименее благоприятный прогноз у данных больных и требует обязательного адъювантного воздействия с целью улучшения отдаленных результатов лечения.
Практические рекомендации.
Результаты работы показывают, что внутренняя грудная артерия является естественным футляром для проведения внутритканевой лучевой терапии на парастернальную область. Результаты лечения больных раком молочной железы центральной и медиальной локализации практически равнозначны при различных методиках внутритканевой лучевой терапии на парастернальную область. Меньшие лучевые нагрузки на медицинский персонал позволяют считать облучение на аппарате «Микроселектрон-HDR» с системой автоматичес-
кого afterloading более предпочтительным перед другими методами.
Коммерческая доступность аппаратов «Микроселектрон-HDR» с системой автоматического afterloading и совместимых планирующих систем позволяет рекомендовать методику внутритканевого облучения парастернальной области у больных раком молочной железы в специализированных лечебных учреждениях, оснащенных палатами с блоком закрытых источников.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ:
- Триголосов А.В., Нечушкин М.И., Уйманов В.А., Геворкян В.С., Барковская С.Н., Молодикова Н.Р., Гегамян В.Н. Частота поражения парастернального лимфоколлектора при раке молочной железы I клинической стадии // Вестник РГМУ. – 2008. – №6. – С. 66-69.
- Геворкян В.С., Нечушкин М.И., Петровский А.В., Васильев И.С. Контактная лучевая терапия на парастернальную область у больных раком молочной железы: отдаленные результаты лечения // Иероглиф. – 2006. – Том 10, № 33. – С.1343-1354.
- Геворкян В.С., Нечушкин М.И., Петровский А.В. Отдаленные результаты различных методов контактной лучевой терапии на парастернальную область у больных раком молочной железы // Материалы конференции, посвящённой 60-летию Национального Центра Онкологии. - Ереван. - 2006. - С. 101-103.
- Триголосов А.В., Нечушкин М.И., Нисневич Л.А., Уйманов В.А., Геворкян В.С., Лукьянова Е.В., Барковская С.Н. Опыт проведения видеоторакоскопической парастернальной лимфаденэкотмии при рецидивах и контралатеральном опухолевом поражении молочной железы // Материалы конференции, посвящённой 60-летию Национального Центра Онкологии. - Ереван. - 2006. - С. 189-191.
- Пынзарь В.А., Емельянов С.И., Нечушкин М.И., Уйманов В.А, Геворкян В.С. Отличительные особенности лечения рака молочной железы у пациенток пожилого и старческого возраста // Материалы конференции, посвящённой 60-летию Национального Центра Онкологии. - Ереван. - 2006. - С. 167-168.
- Стельмах О.К., Нечушкин М.И., Тюляндин С.А., Пынзарь В.А., Геворкян В.С. Адъювантное химиолучевое лечение больных раком молочной железы после органосохранных операций // Материалы Российской научно-практической конференции с международным участием «Новые технологии в онкологической практике». - Барнаул. - 2005. - С. 105-106.
- Пынзарь В.А., Емельянов С.И., Нечушкин М.И, Геворкян В.С. Рак молочной железы у женщин в возрасте старше 70 лет. Особенности лечения // Материалы Российской научно-практической конференции с международным участием «Новые технологии в онкологической практике». - Барнаул. - 2005. -
С. 162-163. - Сихарулидзе И.Ю., Нечушкин М.И., Тюляндин С.А., Геворкян В.С., Вишневская Я.В. Результаты различных методов лечения больных раком молочной железы // Материалы III конгресса онкологов закавказских государств. – Ереван. – 2004 г. – С.215.

