Клинико-морфоиммунологические особенности неходжкинских лимфом у детей
На правах рукописи
ВАЛИЕВ
Тимур Теймуразович
КЛИНИКО-МОРФОИММУНОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НЕХОДЖКИНСКИХ ЛИМФОМ У ДЕТЕЙ
14.00.14. - онкология
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва 2009
Работа выполнена в НИИ детской онкологии и гематологии
(директор – академик РАМН, профессор М.Д.Алиев)
Российского Онкологического Научного Центра им.Н.Н.Блохина РАМН (директор – академик РАН и РАМН, профессор М.И.Давыдов)
Научные руководители:
Доктор медицинских наук, профессор Г.Л.Менткевич
Доктор медицинских наук, профессор Н.Н.Тупицын
Официальные оппоненты:
Член-корреспондент РАМН, доктор медицинских наук, профессор И.В.Поддубная
Доктор медицинских наук, профессор Н.А.Пробатова
Ведущая организация:
ФГУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии» Росздрава
Защита состоится «18» сентября 2009 г. в ____ час. На заседании Специализированного Совета (Д.001.17.02) при Российском Онкологическом Научном Центре им.Н.Н.Блохина РАМН (115478, Москва, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке Российского Онкологического Научного Центра им.Н.Н.Блохина РАМН (115478, Москва, Каширское шоссе, 24).
Автореферат разослан «____»______________ 2009 г.
Ученый секретарь Специализированного Совета,
доктор медицинских наук, профессор Ю.А.Барсуков
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы
Неходжкинские лимфомы (НХЛ) – гетерогенная группа опухолей системы крови, характеризующаяся различным клиническим течением, локализацией, морфологическими, иммунологическими, цитогенетическими особенностями и результатами терапии. НХЛ составляют 5-8% среди злокачественных новообразований в детском возрасте (Л.А.Дурнов, 2003 г, Bliss A., 2008 г). В последние годы заболеваемость НХЛ у детей возросла (Bhurgri Y., 2005 г). Мальчики болеют, примерно, в 3 раза чаще, чем девочки (Е.М.Аксель, И.А.Горбачева, 2006 г). Средний возраст заболевших – 5-14 лет.
Субстратом НХЛ являются клетки различных морфоиммунологических характеристик, современные представления о которых позволяют по-новому осмыслить основы выделения и систематизации различных вариантов НХЛ. Последние годы развития онкогематологии ознаменовались появлением новых методов исследования: иммунофенотипирования, иммуногистохимии, молекулярной генетики, которые наряду с морфологическими исследованиями способствовали более глубокому пониманию патогенетических механизмов формирования НХЛ. Это нашло отражение в современных классификациях лимфом (классификация Европейско-Американской группы по изучению лимфом 1994 г, классификация опухолей гемопоэтической и лимфоидной тканей ВОЗ, 2001г, 2008 г). Применение методов иммунодиагностики привело к выделению Т-, В- и NK-клеточных НХЛ, а в рамках каждой группы - нескольких вариантов (из иммунологически незрелых и зрелых клеток). Позднее, с учетом экспрессии определенных кластеров клеточной дифференцировки некоторые варианты были трансформированы в отдельные нозологические единицы: первичная медиастинальная (тимическая) В-крупноклеточная лимфома (ПМВККЛ), анапластическая крупноклеточная лимфома (АККЛ) ALK-позитивная и ALK-негативная. В детском возрасте наиболее часто диагностируются лимфобластные лимфомы из клеток-предшественников (ЛБЛ), а из зрелоклеточных НХЛ – лимфома Беркитта (ЛБ), АККЛ и диффузная В-крупноклеточная лимфома (ДВККЛ).
Диагностика НХЛ традиционно сопряжена со сложностями, продиктованными сходными цитологическими и гистологическими характеристиками опухоли, в частности, группа ЛБЛ. При ЛБ и ДВККЛ обнаруживается экспрессия зрелоклеточных маркеров В-клеток. Только комплексный подход, учитывающий особенности морфологической картины и использующий расширенную диагностическую иммунологическую панель антител, которая направлена на выявление не только маркеров зрелых Т- и В-клеток, но и антигенов клеток-предшественников, дает возможность правильной диагностики.
Основными методами лечения НХЛ у детей всегда оставались полихимиотерапия (ПХТ) и лучевая терапия. Выделение новых нозологических форм в группе НХЛ привело к появлению различных программ ПХТ с последующей постепенной их интенсификацией (СOP, СОМР, LMB-81,84,86,89, NHL-BFM90/95). На основании иммунологических особенностей опухолевых клеток с лечебной целью в настоящее время стали применяться таргетные препараты - моноклональные антитела (анти-CD20 – ритуксимаб, зевалин, анти-CD22 – епратузумаб). В результате применения современных программ терапии улучшились показатели общей (ОВ), бессобытийной (БСВ) и безрецидивной (БРВ) выживаемости детей с НХЛ, достигнув к настоящему времени 85-91% (Л.А.Махонова, 2006 г, Kavan P., 1999 г). Использование таргетной терапии позволило улучшить результаты лечения В-НХЛ. Однако, актуальной остается проблема совершенствования лечения в зависимости от морфоиммунологического варианта НХЛ, не решены вопросы терапии рецидивов и резистентных форм.
Таким образом, НХЛ в детском возрасте представляют собой разнообразную группу самостоятельных опухолевых заболеваний лимфоидной природы. В зависимости от факторов прогноза больные НХЛ делятся на различные прогностические группы, критерии включения в которые постоянно уточняются с учетом современных знаний о биологических особенностях опухолевых клеток. В связи с этим важное значение имеют данные иммунофенотипирования. Научный интерес к НХЛ связан с многообразием морфологических, иммунологических вариантов и их клинических проявлений, требующих разработки высокоэффективных дифференцированных программ лечения.
В настоящее время число работ, посвященных сопоставлению клинико-морфологических и иммунологических данных у детей с НХЛ, мало и они, как правило, основаны на небольшом количестве наблюдений. Достоверные данные можно получить только при анализе достаточно большого клинического материала, дающего возможность изучения частоты встречаемости различных вариантов НХЛ, сопоставления клинико-морфологических и иммунологических данных, а также результатов лечения Т- и В-клеточных лимфом у детей, что открывает возможности совершенствования диагностики и индивидуализации программ химиотерапии в зависимости от иммунофенотипических характеристик опухолевых клеток.
Цель исследования
На основании морфологических, иммунологических особенностей Т- и В-клеточных НХЛ у детей дать характеристику клинического течения и оценить эффективность современных программ лечения.
Задачи исследования
- Выявить морфологические, иммунологические и клинические особенности Т- и В-клеточных лимфобластных лимфом из клеток-предшественников у детей.
- Определить морфологические, иммунологические и клинические особенности анапластической крупноклеточной лимфомы у детей.
- Дать характеристику морфологических, иммунологических и клинических особенностей зрелоклеточных В-клеточных лимфом в детском возрасте.
- Оценить результаты лечения детей с НХЛ при проведении современных программ полихимиотерапии.
- Выявить факторы неблагоприятного прогноза при НХЛ у детей.
Научная новизна
Впервые в России на большом клиническом материале представлена клинико-морфологическая и иммунологическая характеристика Т- и В-клеточных лимфом у детей. Проведен сравнительный анализ лимфобластных лимфом из клеток-предшественников и зрелоклеточных В-клеточных опухолей. Представлена характеристика локализации и распространенности опухоли при различных вариантах НХЛ. Особое внимание уделено выявлению морфоиммунологических и клинических особенностей крупноклеточных лимфом у детей (ДВККЛ и АККЛ), определению главных критериев иммуноморфологической характеристики опухолевых клеток, систематизации и совершенствованию диагностики НХЛ у детей.
Анализ результатов лечения по современным программам (B-NHL-BFM90/95, ALL IC-BFM 2002) дает основание для оптимизации терапии в зависимости от иммунологических вариантов НХЛ и прогностических групп риска. Эти программы доказали свою эффективность у подавляющего большинства больных. Однако существование резистентных форм и возможность рецидивов обосновывают необходимость совершенствования программ ПХТ с включением таргетных препаратов.
Практическая значимость
Определена важность морфологического и иммунологического исследований для диагностики различных вариантов Т- и В-клеточных НХЛ. Показаны особенности клинического течения НХЛ у детей в зависимости от цитологической, гистологической и иммунологической характеристики опухоли. Уточнены диагностические критерии (клинические, морфологические и иммунологические) наиболее часто встречающихся вариантов НХЛ в детском возрасте. Для оценки локализации поражения и распространенности опухолевого процесса показана необходимость применения комплекса методов инструментальной визуализации (РКТ, УЗИ, РИД, по показаниям – эндоскопические методы и МРТ). Выделены неблагоприятные иммунологические факторы риска, которые могут быть использованы для уточнения прогностических групп. На основании результатов исследования показано значение иммунологических вариантов НХЛ в выборе программ терапии и необходимость их интенсификации для улучшения результатов лечения в детском возрасте. С учетом высоких результатов терапии по программам B-NHL-BFM90/95 и ALL IC-BFM 2002 показана эффективность ПХТ для различных вариантов НХЛ в детском возрасте.
Апробация диссертации
Диссертация апробирована 19 мая 2009 г на совместной научной конференции отделения химиотерапии гемобластозов, отдела общей онкологии, отделения трансплантации костного мозга, отделения анестезиологии и реанимации, отделения амбулаторных методов диагностики и лечения, лаборатории гемоцитологии, рентгенодиагностического отделения НИИ детской онкологии и гематологии РОНЦ им.Н.Н.Блохина РАМН; отделения химиотерапии гемобластозов, централизованного клинико-лабораторного отдела, отделения патологической анатомии опухолей человека НИИ клинической онкологии РОНЦ им.Н.Н.Блохина РАМН; кафедры детской онкологии Российской медицинской академии последипломного образования Росздрава.
Публикации
По теме диссертации опубликовано 10 научных работ.
Объем и структура диссертации
Работа изложена на 215 страницах машинописного текста, состоит из введения, обзора литературы, характеристики больных и методов исследований, 3 глав собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы. Диссертация содержит 64 таблицы и 66 рисунков. Список литературы представлен 38 отечественными и 201 зарубежной публикациями.
СОДЕРЖАНИЕ РАБОТЫ
Характеристика больных и методы исследования
Для решения задач исследования нами были проанализированы клинические и морфоиммунологические характеристики НХЛ у 157 детей, наблюдавшихся в отделении химиотерапии гемобластозов (зав.отд. – д.м.н. А.В.Попа) отдела химиотерапии (зав.отделом – д.м.н., проф. Г.Л.Менткевич) НИИ ДОГ РОНЦ им.Н.Н.Блохина РАМН (директор — академик РАМН, проф. М.Д.Алиев) за период с 01.01.1993 по 01.01.2009 гг. При первичной диагностике и во время ремиссии больные наблюдались в отделении амбулаторных методов диагностики и лечения НИИ ДОГ РОНЦ им.Н.Н.Блохина РАМН (зав.отд. - д.м.н. Е.И.Моисеенко).
Среди обследованных детей, примерно, в 2,5 раза преобладали мальчики над девочками (71,3% против 28,7%). Возраст больных составлял от 1 года до 15 лет. Наибольшее число случаев НХЛ было отмечено в возрастной группе от 7 до 11 лет (38,8%) и от 11 до 15 лет (31,85%), т.е в препубертатном и пубертатном возрасте.
Всем больным НХЛ проводилось комплексное обследование, которое состояло из сбора анамнеза, объективного клинического и лабораторного обследования: гематологического, цитологического, гистологического, иммунологического и биохимического. Также выполнялось электрокардиографическое, рентгенологическое обследование костной системы и органов грудной клетки, РКТ, МРТ, УЗИ, радиоизотопные исследования с 67Ga и 99Tc, пункция опухолевых образований с цитологическим исследованием.
Цитологические препараты 136 больных (86,6%) были пересмотрены зав. лаб. клинико-диагностической централизованного клинико-лабораторного отдела НИИ КО РОНЦ им.Н.Н.Блохина РАМН д.м.н. И.И.Матвеевой.
Гистологическое исследование опухолевой ткани было проведено у 96 (61,1%) детей в отделе патологической анатомии опухолей человека НИИ КО РОНЦ им.Н.Н.Блохина РАМН (зав.отделом – д.м.н., проф. А.И.Карселадзе).
Иммунофенотипирование было выполнено у всех (100%) больных в лаборатории иммунологии гемопоэза централизованного клинико-лабораторного отдела НИИ КО РОНЦ им.Н.Н.Блохина РАМН (зав.лаб. – д.м.н., проф. Н.Н.Тупицын). В 31 (19,7%) случае иммунофенотип опухолевых клеток исследован методом проточной цитофлуориметрии, ст.науч.сотр., к.м.н. Л.Ю.Андреевой. У 106 (67,5%) детей иммунологическая верификация опухоли была проведена методом иммунофлуоресценции на криостатных срезах вед.науч.сотр., к.м.н. Е.Н.Шолоховой.
В 20 (12,7%) случаях для верификации диагноза было выполнено стандартное иммуногистохимическое исследование по парафиновым блокам вед.науч.сотр., д.м.н. А.М.Ковригиной в отделе патологической анатомии опухолей человека НИИ КО РОНЦ им.Н.Н.Блохина РАМН (зав.отделом – д.м.н., проф. А.И.Карселадзе).
В нашей работе использовались следующие моноклональные антитела для диагностики НХЛ у детей: общелейкоцитарные (CD45), маркеры клеток-предшественников (CD34, TdT), Т-клеточные антигены (CD1a, CD2, CD3, CD4, CD5, CD7, CD8), В-клеточные маркеры (CD10, CD19, CD20, CD21, CD22, CD23, CD37), маркеры NK-клеток (CD56, CD57), гистиоцитарные антигены (CD68, CD163), активационные маркеры: CD30, CD38), маркер пролиферативной активности (Ki-67) и дополнительные (HLA-DR, BCL-2, BCL-6, sIgM, cIg, ALK, TCL1, PAX5, MuM1, EMA, CD45RO).
В результате исследования цитологических, гистологических и иммунологических особенностей НХЛ у детей распределение больных согласно классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ (2008 г) представлено на рис.1.
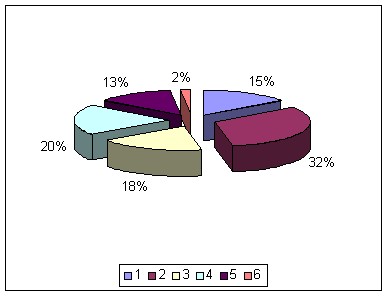
Рис.1. Распределение детей с НХЛ согласно классификации ВОЗ 2008 г (n=157).
Исходя из полученных данных, в детском возрасте преобладали лимфобластные лимфомы из клеток-предшественников (47%), ЛБ (20%) и АККЛ (18%).
Для определения локализации опухоли на момент начала специального лечения использовались лучевые (рентгенография, РКТ, УЗИ) и радиоизотопные (радиосцинтиграфия с 67Ga и 99Tc) методы исследования.
Рентгенологические и ультразвуковые исследования проводились в отделении лучевых методов диагностики НИИ ДОГ РОНЦ им.Н.Н.Блохина РАМН (зав. отд. - д.м.н., проф. Н.А.Кошечкина).Рентгенография органов грудной клетки в прямой и боковой проекциях осуществлялась всем (100%) больным. РКТ была выполнена 81 (51,6%) пациенту, УЗИ - 84 (53,5%) детям. По данным методов инструментальной визуализации было установлено, что при НХЛ в детском возрасте характерно формирование опухолевых конгломератов размером 5-10 см (43,9%) и более 10 см в диаметре (31,2%).
РИД была проведена в отделении радионуклидных методов диагностики НИИ КО РОНЦ им.Н.Н.Блохина РАМН (зав.отд – д.м.н., проф. С.В.Ширяев) 42 (26,7%) детям с НХЛ. РИД выполнялась в диагностически сложных случаях для уточнения характера и распространенности опухолевого процесса, а также при динамическом наблюдении в периоде ремиссии.
Эндоскопические исследования осуществлялись в отделении эндоскопии НИИ КО РОНЦ им.Н.Н.Блохина РАМН (зав. отд. – д.м.н., проф. Б.К.Поддубный) д.м.н. А.Н.Губиным. Фиброэзофагогастродуоденоскопия проведена 14 (8,9%) детям с НХЛ. Колоноскопия была сделана 10 (6,4%) больным. Лапароскопия выполнена 32 (20,4%) пациентам. Показаниями для этого исследования послужили отсутствие возможности получения морфологического материала другими методами, уточнение состояния кишечника и предоперационная оценка степени распространения опухолевого процесса по брюшной полости.
НХЛ у детей в зависимости от иммуноморфологического варианта характеризовались значительной гетерогенностью клинических проявлений (табл.1).
Таблица 1
Локализация поражений при различных вариантах НХЛ у детей (n=154)
| Локализация опухоли | В-ЛБЛ (n=23) | Т-ЛБЛ (n=50) | АККЛ (n=29) | ЛБ (n=31) | ДВККЛ (n=21) |
| Периферические лимфатические узлы | 52% | 68% | 55,2% | 22,6% | 47,6% |
| Лимфатические узлы брюшной полости | 9% | 10% | 17,2% | 61,3% | 23,8% |
| Забрюшинные лимфатические узлы | 23% | 16% | 34,5% | 32,2% | 28,6% |
| Миндалины | 4% | 0% | 0% | 12,9% | 9,5% |
| Средостение | 13% | 92% | 13,4% | 3% | 19% |
| Легкие | 4% | 6% | 10,3% | 0% | 9,5% |
| Плевра | 4% | 22% | 0% | 3% | 9,5% |
| Печень | 4% | 0% | 3,4% | 35,5% | 0% |
| Кишечник | 4% | 0% | 3,4% | 41,9% | 9,5% |
| Желудок | 4% | 0% | 3,4% | 6,4% | 9,5% |
| Поджелудочная железа | 4% | 0% | 3,4% | 6,4% | 4,8% |
| Селезенка | 0% | 0% | 10,3% | 9,7% | 4,8% |
| Почки | 17% | 14% | 0% | 16,1% | 4,8% |
| Кости | 26% | 0% | 24,1% | 19,3% | 38,1% |
| Мягкие ткани | 26% | 0% | 55,2% | 0% | 4,8% |
| Кожа | 9% | 6% | 34,5% | 0% | 0% |
| Костный мозг | 43% | 62% | 0% | 32,2% | 4,8% |
| ЦНС | 13% | 6% | 3,4% | 6,4% | 0% |
| Яички | 4% | 0% | 3,4% | 6,4% | 4,8% |
Примечание. Не включены в таблицу 3-е больных с ПМВККЛ
При стадировании НХЛ у детей мы использовали систему, предложенную S.Murphy в 1980 г и дополненную исследователями группы BFM (1995 г). Поражение костного мозга было диагностировано в 52 (33,1%), яичек - в 3 (1,9%), ЦНС - в 8 (5,1%) случаях.
В наблюдаемой группе больных преобладающее большинство имело распространенные стадии НХЛ. Пациенты с III-IV стадиями составили 84,7%, что свидетельствовало о достаточно поздней диагностике заболеваний у детей (табл.2).
Таблица 2
Распределение детей с НХЛ по стадиям (S.Murphy, 1980 г)
| Стадия | В-ЛБЛ (n=23) | Т-ЛБЛ (n=50) | АККЛ (n=29) | ЛБ (n=31) | ДВККЛ (n=21) | ПМВККЛ (n=3) | Всего (n=157) | |||||||
| абс | % | абс | % | абс | % | абс | % | абс | % | абс | % | абс | % | |
| I | 2 | 8,7 | 0 | 0 | 0 | 0 | 4 | 12,9 | 5 | 23,8 | 0 | - | 11 | 7,0 |
| II | 2 | 8,7 | 1 | 2 | 2 | 6,9 | 3 | 9,7 | 5 | 23,8 | 0 | - | 13 | 8,3 |
| III | 2 | 8,7 | 17 | 34 | 9 | 31,0 | 14 | 45,2 | 6 | 28,6 | 1 | - | 49 | 31,2 |
| IV | 17 | 73,9 | 32 | 64 | 18 | 62,1 | 10 | 32,2 | 5 | 23,8 | 2 | - | 84 | 53,5 |
При ЛБЛ на основании стадии заболевания, ответа на 33 день терапии выделяли 3 группы риска (стандартная, средняя, высокая). Тогда, как при АККЛ распределение больных по 3 группам риска основывалось на стадии и распространении опухоли на легочную ткань, кожу и кости. При зрелоклеточных В-клеточных НХЛ больные разделялись на 4 прогностические группы риска в зависимости от стадии заболевания, наличия/отсутствия радикальной операции, активности ЛДГ, а также поражения ЦНС (критерии BFM 95) (табл.3).
Таблица 3
Распределение детей с НХЛ в зависимости от прогностических групп риска
| Группа риска | В-ЛБЛ (n=23) | Т-ЛБЛ (n=50) | АККЛ (n=29) | ЛБ (n=31) | ДВККЛ (n=21) | ПМВККЛ (n=3) | Всего (n=157) | |||||||
| абс | % | абс | % | абс | % | абс | % | абс | % | абс | % | абс. | % | |
| 1 | 1 | 4,3 | 0 | 0 | 0 | 0 | 1 | 3,2 | 3 | 14,3 | 0 | - | 5 | 3,2 |
| 2 | 19 | 82,6 | 45 | 90,0 | 27 | 93,1 | 7 | 22,6 | 6 | 28,6 | 0 | - | 104 | 66,2 |
| 3 | 3 | 13,1 | 5 | 10,0 | 2 | 6,9 | 13 | 41,9 | 9 | 42,8 | 2 | - | 34 | 21,7 |
| 4 | - | - | - | - | - | - | 10 | 32,2 | 3 | 14,3 | 1 | - | 14 | 8,9 |
Примечание. Данные о больных ПМВККЛ статистически не обрабатывались (n=3)
Табл.3 демонстрирует, что больные, включенные в наше исследование, имели преимущественно 2-3 прогностические группы риска (87,9%).
Лечение детей с НХЛ осуществлялось по программам, включающим высокоинтенсивную ПХТ, а также лучевую терапию НИИ ДОГ РОНЦ им.Н.Н.Блохина РАМН с 01.01.1993 г по 01.01.2009 г. Основной группе больных – 155 (98,7%), были применены программы BFM90/95/2002. Программа ALL IC-BFM 2002 проводилась 71 ребенку с лимфобластными лимфомами, 55 детям со зрелоклеточными В-клеточными НХЛ – программа B-NHL-BFM90/95, 29 больным АККЛ применена программа BFM 95 для крупноклеточных лимфом.
Лучевая терапия в комплексном лечении проведена 50 (31,8%) больным Т-ЛБЛ с целью профилактики поражения ЦНС в отделении радиологии НИИ КО РОНЦ РАМН (зав.отд. – д.м.н., проф. С.И.Ткачев). СОД составляла 12 Гр, РОД – 2 Гр. Облучение головного мозга осуществлялась с двух встречных полей.
В нашем исследовании 12 больным был применен таргетный препарат ритуксимаб (Мабтера), который представляет собой химерное антитело, состоящее из последовательностей константного участка человеческого иммуноглобулина и вариабельного участка иммуноглобулина мыши, специфически связывающееся с антигеном CD20 на поверхности В-клеток. Ритуксимаб (Мабтера) был включен в программу B-NHL-BFM95 лечения больных ЛБ, ДВККЛ и ПМВККЛ с 3-4 прогностическими группами риска в 0 день каждого блока в дозе 375 мг/м2 внутривенно.
Критерии оценки терапии
Полная ремиссия (ПР) — отсутствие признаков опухолевого роста в течение 4 нед после достижения полного эффекта (ПЭ — отсутствие признаков опухоли по данным УЗИ/РКТ в зонах на момент диагностики, при изначальном поражении костного мозга — его полная санация);
Безрецидивная выживаемость (БРВ) – от момента наступления ремиссии до момента возникновения рецидива оценивалась у больных с ПР;
Бессобытийная выживаемость (БСВ) – от начала лечения до момента прекращения ремиссии независимо от причины приведшей к ней, кроме того к «событию» относили отсутствие ПР, смерть в индукции ремиссии или в ПР от любой причины, а так же отказ родителей от лечения;
Общая выживаемость (ОВ) – от начала лечения до окончания исследования (01.01.2009 г) или смерти больного.
Статистическая обработка материала проведена с помощью компьютерной программы статистических исследований SPSS v. 10.0.5. Достоверность параметрических данных оценивалась по критерию Стъюдента, непараметрических - по критерию 2. Результаты считались достоверными при конфиденциальном интервале более 95%, р < 0,05. Оценка выживаемости проведена с помощью построения графиков по методу Kaplan-Meier, сравнение кривых выживаемости - по методу log-rank.
Результаты исследования
Лимфобластные лимфомы из клеток-предшественников
В нашем исследовании ЛБЛ были представлены Т- и В-клеточными иммунологическими вариантами. Диагноз Т-ЛБЛ был установлен у 50 детей, В-ЛБЛ – у 23 пациентов.
В-лимфобластная лимфома из клеток-предшественников. При микроскопии пунктатов пораженной В-ЛБЛ ткани определялись бластные клетки лимфоидной природы, которые были отнесены к лимфобластам типа L2 по FAB-классификации. Гистологически рисунок пораженного лимфатического узла оказывался полностью стертым, в препаратах отмечался диффузный рост мономорфной популяции лимфоидных опухолевых клеток с крупными ядрами, в части из которых визуализировались единичные нуклеолы. Для бластов было характерным высокое ядерно-цитоплазматическое соотношение. Опухолевый пролиферат распространялся на капсулу с прорастанием последней
Иммунологически клетки В-ЛБЛ экспрессировали CD19, CD10, CD38, HLA-DR, СD45 (слабо) и CD22, реже CD34 и CD20 антигены. Экспрессия cIg не определялась в клетках В-ЛБЛ у детей.
В клинической картине В-ЛБЛ у детей преобладало поражение периферических и забрюшинных лимфатических узлов (52 и 23% соответственно), костного мозга (43%), костей (25%) и мягких тканей (25%). Реже поражались почки, средостение, лимфатические узлы брюшной полости. Крайне редко происходило вовлечение в опухолевый процесс легких, плевры и органов брюшной полости (желудка, двенадцатиперстной кишки, поджелудочной железы и др.). У 43% больных был поражен костный мозг. У 3 (13%) детей с В-ЛБЛ отмечен бластоз в периферической крови. Вовлечение в опухолевый процесс ЦНС обнаруживалось у 13% пациентов.
Т-лимфобластная лимфома из клеток-предшественников цитологически была представлена бластами лимфоидной природы, которые соответствовали лимфобластам типа L2. Гистологическая картина Т-ЛБЛ была не отличима от таковой при В-ЛБЛ.
Специфическими для Т-ЛБЛ являлись маркеры CD1а, CD2, CD5, CD7, TdT, CD45, CD3, реже CD4, CD8, CD10. Менее чем в 1/3 случаев клетки Т-ЛБЛ были положительными при реакции с антителами к CD34 и HLA-DR.
В клинической картине Т-ЛБЛ преобладало поражение средостения, что было диагностировано у 46 (92%) детей. Синдром компрессии органов средостения на момент постановки диагноза был отмечен у 27 (54%) детей и характеризовался кашлем, одышкой, усилением сосудистого рисунка на передней поверхности грудной стенки. Плеврит, как правило, двусторонний, был диагностирован у 21 (42%) ребенка на основании клинических и лучевых методов исследования. У 31 (62%) ребенка был поражен костный мозг, из них бластоз менее 25% отмечен в 8 (54%) и более 25% - в 23 (46%) случаях. Лимфобласты периферической крови в количестве от 6 до 34% были обнаружены у 12 (24%) детей. Поражение ЦНС было отмечено у 2% больных.
Сравнительная характеристика Т- и В-ЛБЛ. Идентичная цитологическая и гистологическая картина не позволяли верифицировать клеточную природу ЛБЛ, а, следовательно, назначать адекватную программу терапии. Для определения иммунологической принадлежности клеток опухоли, степени их дифференцировки, а также дифференциальной диагностики с лимфомами из периферических Т- и В-клеток проводилось иммунофенотипирование.
С целью сравнительного анализа нами был изучен ИФТ лимфобластов при Т- и В-ЛБЛ. Опухолевые клетки В-ЛБЛ экспрессировали CD19, CD20, CD10, CD38, HLA-DR, реже CD45 и CD34. Экспрессия cIg не определялась в клетках В-ЛБЛ у детей. Специфическими для Т-ЛБЛ являлись маркеры CD1а, CD2, CD5, CD7, TdT, CD45, реже CD4, CD8, CD3, CD10. Менее, чем в 1/3 случаев клетки Т-ЛБЛ были положительными при реакции с антителами к CD34 и HLA-DR. Нами было выявлено, что с разной частотой как при В-, так и при Т-ЛБЛ на клетках опухоли определялись следующие маркеры: CD10, CD34, CD45.
В нашем исследовании CD10 почти в 2 раза чаще экспрессировался при В-ЛБЛ (85,0%), чем при Т-ЛБЛ (41,5%) (полученные данные статистически достоверны, р=0,03). Антиген CD10 представляет собой внеклеточную цинк-связывающую металлопротеиназу, способную катализировать расщепление брадикинина, ангиотензина I и II, эндотелина, вещества Р и таким образом поддерживать гомеостаз клетки. Данный антиген не является строго специфичным для В-клеток, он определяется на стромальных клетках, незрелых В- и Т-клетках костного мозга, а также на клетках зародышевого центра во вторичных лимфоидных органах.
Как при В-ЛБЛ, так и при Т-ЛБЛ, примерно, в 1/3 случаев (36,8% и 29,6%, соответственно) определялась экспрессия стволовоклеточного антигена CD34, который обычно выявляется на гемопоэтических клетках-предшественниках и свидетельствует о самых ранних этапах клеточной дифференцировки.
Выраженная экспрессия общего лейкоцитарного антигена CD45 встречалась в 4 раза чаще на клетках Т-ЛБЛ, по сравнению с В-ЛБЛ (71,4% и 18,2% соответственно, р=0,02).
При сравнении клинической картины В- и Т-ЛБЛ было установлено, что В-ЛБЛ представлена локализацией лимфомы в периферических лимфатических узлах (52%) с частым поражением костного мозга (43%). В 21,7% случаев отмечалась экстранодальная локализация В-ЛБЛ (в костях и мягких тканях). В то же время при Т-ЛБЛ преобладало поражение средостения (92%) с частым вовлечением в процесс периферических лимфатических узлов (68%) и костного мозга (62%). Экстранодальных локализаций (исключая тимус) при Т-ЛБЛ мы не наблюдали.
Представленные данные демонстрируют частое поражение при В- и Т-ЛБЛ у детей периферических лимфатических узлов и костного мозга. Опухолевый конгломерат Т-ЛБЛ располагался в средостении (с частым развитием плеврита) и был образован увеличенными лимфатическими узлами и тимусом. При В-ЛБЛ расширение тени средостения по данным РКТ отмечалось только у 13% больных и было представлено увеличенными лимфатическими узлами (случаев вовлечения в опухолевый процесс тимуса не отмечено). В-ЛБЛ характеризовалась поражением костей и мягких тканей, реже - лимфатических узлов брюшной полости, забрюшинного пространства и почек.
Наиболее точным показателем, отражающим биологическую активность опухоли при НХЛ у детей, являлся уровень ЛДГ в сыворотке крови, который оказался достаточно высоким при ЛБЛ. Так, при В-ЛБЛ показатель ЛДГ более 500 ЕД/л был отмечен у 78,3% детей, тогда как при Т-ЛБЛ – в 92,0% случаев.
Современная терапия ЛБЛ по протоколам, разработанным группой BFM (BFM90/95, ALL IC-BFM 2002), позволила добиться высоких показателей выживаемости пациентов. Так ОВ (OS) при В-ЛБЛ и Т-ЛБЛ составляла 86,96+/-8,13% и 87,04+/10,71% соответственно (медиана наблюдения 12 лет). БСВ (EFS) при В-ЛБЛ и Т-ЛБЛ была 81,82+/-6,43% и 78,71+/-9,07% соответственно (рис.2-3). БРВ (RFS) при В- и Т-ЛБЛ оказалась практически одинаковой – 84,42+/-9,05% и 81,08+/-7,89% соответственно. Рецидивы заболевания отмечены в 10% случаев при Т-ЛБЛ и 13% - при В-ЛБЛ и, как правило, возникали в течение 6 мес. - 2 лет после достижения первой полной ремиссии. В группе детей с В-ЛБЛ было 2 костномозговых рецидива и 1 рецидив с поражением мягких тканей лица. Рецидивы с локализацией в ЦНС при В-ЛБЛ не были отмечены, в то время как при Т-ЛБЛ рецидивы локализовались в костном мозге (2) и в ЦНС (3).
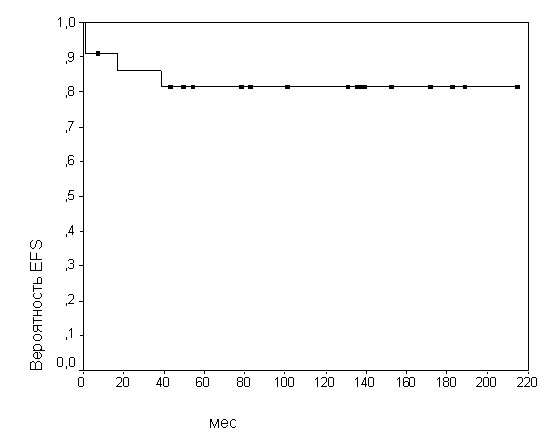
Рис.2. Бессобытийная выживаемость (EFS) детей с В- ЛБЛ
Рис.3. Бессобытийная выживаемость (EFS) детей с Т-ЛБЛ
Следует отметить, что показатель БСВ больных ниже при экспрессии CD34 на опухолевых клетках. Так, при обнаружении CD34 на лимфобластах БСВ при В-ЛБЛ оказалась в 1,3 раза ниже по сравнению с аналогичным показателем у детей с Т-ЛБЛ (58,33+/-7,64% против 75,0+/-11,09%, р=0,41). В то же время в случаях отсутствия экспрессии CD34 на опухолевых клетках БСВ как при В-ЛБЛ, так и при Т-ЛБЛ оказалась практически одинаковой (90,0+/-4,58% и 88,54+/-4,99% соответственно).
Проводимые программы терапии при ЛБЛ у детей являлись риск-адаптированными, что означало выбор тактики лечения, ориентированный на стадию заболевания и прогностическую группу риска. Так, среди наблюдаемых пациентов с ЛБЛ при 3 прогностической группе высокого риска показатель БСВ был хуже, чем этот показатель среди больных 2 группы среднего риска как при В-ЛБЛ (88,89+/-7,41% против 33,33+/-19,76%, р=0,02), так и при Т-ЛБЛ (80,94+/-8,37% против 60,0+/-20,17%, р=0,19). 1 группа стандартного риска была только у 1 ребенка с В-ЛБЛ, который жив на момент окончания исследования (01.01.2009 г), срок наблюдения 96 мес.
При диагностике ЛБЛ у большинства больных имел место весьма распространенный процесс, преобладали III и IV стадии (I и II стадии были отмечены у 4 детей В-ЛБЛ и у 1 пациента с Т-ЛБЛ), что влияло на уровень БСВ детей с В- и Т-ЛБЛ. Так, при В-ЛБЛ IV стадии БСВ больных была в 1,6 раза хуже, чем при аналогичной стадии Т-ЛБЛ (50,0+/-12,36% против 81,25+/-9,32%), тогда как при III стадии БСВ детей при обоих иммунологических вариантах ЛБЛ была достаточно высока и практически одинаковой (80,36+/-11,02% и 83,33+/-6,71% соответственно).
Размеры опухоли (до 10 см в диаметре) при В- и Т-ЛБЛ существенно не влияли на БСВ, тогда как при размере опухоли более 10 см БСВ составила 50,0+/-9,81% при В-ЛБЛ и 75,0+/-13,01% при Т-ЛБЛ (р=0,36).
Вовлечение в опухолевый процесс костного мозга, примерно, на 12% ухудшало показатели БСВ как при В-ЛБЛ, так и при Т-ЛБЛ. Поражение костного мозга наблюдалось у 43% пациентов с В-ЛБЛ, у 62% - с Т-ЛБЛ и в большинстве случаев носило не тотальный характер (<25% бластов в пунктате костного мозга отмечено у 60% пациентов с В-ЛБЛ и 54% у больных Т-ЛБЛ).
Исходя из вышеизложенного, можно определить факторы неблагоприятного прогноза при В- и Т-ЛБЛ у детей. Оценка результатов лечения не выявила достоверных различий в показателях выживаемости (OВ, БРВ, БСВ) больных В- и Т-ЛБЛ. Однако отмечено неблагоприятное прогностическое значение экспрессии некоторых антигенов на опухолевых клетках: CD34+ (В- и Т-ЛБЛ), СD1a+ и СD10+ (Т-ЛБЛ). Из клинических параметров на плохой исход ЛБЛ указывали поражение костного мозга и большой размер опухоли (более 10 см в диаметре), а также 3 прогностическая группа высокого риска.
Анапластическая крупноклеточная лимфома
Диагноз АККЛ был установлен у 29 детей, что составило 18,5% от всех НХЛ. Морфологический субстрат АККЛ представлен крупными лимфоидными клетками с базофильной цитоплазмой и одним или несколькими ядрами. Клетки АККЛ характеризовались атипией и полиморфизмом. Гистологически у детей преобладали мелкоклеточный (45,45%) и лимфогистиоцитарный варианты АККЛ (36,36%), реже встречался классический вариант (18,20%).
АККЛ у детей гетерогенна не только морфологически, но и иммунологически. Помимо экспрессии CD30, CD45, были отмечены два варианта: при одном из них на клетках опухоли определялись Т-клеточные антигены (CD2, CD3, CD4, CD8, CD7, CD5), а при другом - иммунологические маркеры Т-клеток не выявлялись.
В ряде случаев при АККЛ определялась киназа анапластической лимфомы (ALK). Среди наших больных ALK-позитивная АККЛ встречались в детском возрасте чаще (81,8%), чем ALK-негативный вариант (18,2%).
АККЛ в детском возрасте практически с одинаковой частотой встречалась у мальчиков и девочек препубертатного возраста. Заболевание характеризовалось первичным поражением мягких тканей (55,2%), периферических лимфатических узлов (55,2%), реже костей (34,5%) и лимфатических узлов забрюшинного пространства (34,5%). Достаточно часто (41%) при АККЛ отмечена первично экстранодальная локализация опухоли с поражением мягких тканей, костей скелета, черепа, легких, плевры и кожи. На момент диагностики у детей преобладали IV и III стадии заболевания (62,1% и 31,0% соответственно). При АККЛ не наблюдалось формирования больших опухолевых конгломератов (более 10 см в диаметре). У подавляющего большинства пациентов - 25 (86,21%) детей, размеры опухоли были менее 10 см и только у 4 (13,79%) больных размеры опухоли превышали 10 см.
Активность ЛДГ при АККЛ у детей была ниже 1000 ЕД/л (у 58,6% пациентов составляла 500-1000 ЕД/л). Среди больных преобладали пациенты со 2 прогностической группой риска (93,1%).
ПХТ по программам BFM90/95 позволила получить достаточно хорошие показатели выживаемости детей с АККЛ: ОВ - 85,67+/-11,15%, БРВ – 76,48+/-13,49% и БСВ – у 64,17+/-15,91% (медиана наблюдения 11 лет) (рис.4).
Рис.4. Бессобытийная выживаемость (EFS) детей с АККЛ
При анализе значения клинических и морфоиммунологических факторов для прогноза АККЛ у детей оказалось, что только экспрессия Т-клеточных маркеров на опухолевых клетках статистически достоверно влияла на показатели выживаемости. Так, при наличии Т-клеточных антигенов БСВ была низкой и составляла 44,44+/-9,53%, тогда как при их отсутствии этот показатель был в 2 раза выше - 89,47+/-8,16% (р=0,02). Вне зависимости от экспрессии HLA-DR уровень БСВ у больных был практически одинаков (при наличии HLA-DR — 75,76+/-14,55%, при его отсутствии — 83,33+/-7,94%).
БСВ у детей со 2 прогностической группой риска составила 68,34+/-10,04%, в то время как у 2 пациентов с 3 группой риска были отмечены рецидивы заболевания, при которых после ПХТ получена ПР. В нашем исследовании не было больных с 1 группой риска.
Не было обнаружено достоверного влияния на БСВ при АККЛ у детей таких факторов, как гистологического варианта заболевания, размера опухоли и клинической стадии процесса.
В целом, АККЛ являлась особым вариантом НХЛ, который характеризовался частой экстранодальной локализацией (41%), отсутствием поражения костного мозга среди исследованных нами пациентов, невысокими показателями ЛДГ. У детей чаще встречался вариант АККЛ, при котором Т-клеточные маркеры не определялись (87,50%), и БСВ в этой группе больных составляла 89,47+/-8,16%, что достоверно выше, чем среди пациентов, у которых Т-клеточные антигены присутствовали (44,44+/-9,53%)(р=0,02).
С учетом представленных данных АККЛ в детском возрасте неоднородна по морфологическим и иммунологическим характеристикам, что влияет на прогноз заболевания. Полученные результаты БСВ позволяют рекомендовать использование дифференцированного подхода в лечении для увеличения выживаемости больных.
Зрелоклеточные В-клеточные опухоли
Зрелоклеточная природа В-НХЛ (ЛБ, ДВККЛ и ПМВККЛ) в нашем исследовании была диагностирована у 55 детей, что составило 35,03% от всех НХЛ. ЛБ была верифицирована у 56,4% детей, ДВККЛ – у 38,2%, ПМВККЛ – у 5,4% пациентов.
Лимфома Беркитта. Цитологическая картина при ЛБ была представлена мономорфной популяцией лимфоидных клеток среднего размера с интенсивно-базофильной цитоплазмой, в которой обращало внимание обилие вакуолей. Ядро с нежной структурой хроматина содержало 2-3 нуклеолы. Часто встречались фигуры митоза и макрофаги. На основании вышеуказанных признаков клетки ЛБ можно было отнести к лимфобластам типа L3 (по FAB-классификации). По данным гистологического исследования отмечалось полное стирание рисунка нормальной ткани и диффузный рост мономорфной популяции лимфоидных клеток одинакового размера и формы с округлым или овальным ядром. В ядре присутствовали нуклеолы. Обилие макрофагов создавало картину «звездного неба», а многочисленные фигуры митоза свидетельствовали о высокой пролиферативной активности опухоли.
Опухолевые клетки ЛБ экспрессировали HLA-DR, CD45, CD37, CD19, CD20, CD10, sIgM, BCL-6, TCL1, а также Ki-67 (90-100% клеток).
В клинической картине ЛБ преобладало поражение лимфатических узлов брюшной полости и забрюшинного пространства (64,3% и 32,2%, соответственно), кишечника (41,9%), печени (35,5%) и костного мозга (32,2%). Реже в опухолевый процесс вовлекались периферические лимфатические узлы (22,6%) и кости черепа: твердое небо, верхняя и нижняя челюсть (19,3%). С одинаковой частотой у детей с ЛБ опухоль локализовалась в большом сальнике и почках (по 16,1%). Крайне редко опухолевый процесс распространялся на лимфатические узлы малого таза, селезенку и миндалины (менее 10%). При локализации опухоли в брюшной полости асцит был отмечен у 13 (41,9%), опухолевый плеврит – у 6 (19,3%) детей.
Вовлечение в опухолевый процесс ЦНС было у 2 (6,4%) пациентов и характеризовалось бластным цитозом при цитологическом исследовании ликвора. Яички были поражены у 2 (6,4%) детей.
Клиника заболевания дебютировала с явлений «острого живота» у 11 (35,5%) больных и характеризовалась острыми постоянными или периодическими болями в животе, задержкой стула и газов, рвотой, отсутствием аппетита, слабостью, субфебрилитетом. Так, с подозрением на острый аппендицит было госпитализировано в стационар 4 (36,4%) детей, диагноз острой кишечной непроходимости был установлен 7 (63,6%) пациентам. Всем больным была выполнена по месту жительства лапаротомия, которая у 6 (54,5%) завершилась аппендэктомией или резекцией участка кишки с наложением межкишечного анастомоза. У 5 (45,4%) детей при лапаротомии была произведена биопсия опухоли
Диффузная В-крупноклеточная лимфома. При ДВККЛ цитологическая картина была неоднородной и представлена центробластами/иммунобластами, крупными анапластическими клетками, кроме того, у 19% детей обращало внимание преобладание лимфоцитов/гистиоцитов.
В случаях, когда опухолевый субстрат формировался центробластами/иммунобластами, цитологически определялись многочисленные лимфоидные клетки с мелко-дисперсной структурой хроматина, ядром правильной округлой формы, несколькими нуклеолами. Слабо-базофильная цитоплазма была выражена умеренно и распределена в виде тонкого ободка вокруг ядра, что позволило отнести клетки к центробластам. Иммунобласты характеризовались округло-овальной формой ядра, в котором визуализировался гиперконденсированный хроматин. Нуклеолы темно-бордовые были расположены, как правило, в центре клетки. Цитоплазма базофильная, нередко вакуолизированная.
Для анапластического варианта ДВККЛ был характерен полиморфный состав популяции опухолевых клеток. Ядра многодольчатые, округлые, овальные, полигональные с тонко-дисперстным хроматином. Иногда встречались клетки, напоминавшие клетки Ходжкина, с крупными ядрышками.
В случае варианта, богатого Т-клетками/гистиоцитами, отмечено небольшое количество опухолевых клеток на фоне мелких Т-лимфоцитов и гистиоцитов.
При гистологическом исследовании определялось диффузное разрастание опухолевых клеток, стирание рисунка пораженной ткани. Опухолевые клетки были крупными с выраженными ядрышками, базофильной цитоплазмой. Клетки в большинстве случаев (69,4%) напоминали центробласты (крупные клетки с нерасщепленными ядрами) или иммунобласты. Часть клеток представляли крупные центроциты, которые имели малое количество слабобазофильной цитоплазмы, многодольчатые клетки или их сочетание. У 11,6% больных опухоль состояла из анаплазированных клеток. В 19,0% случаях количество опухолевых клеток было небольшое, они располагались разрозненно на фоне выраженной реактивной популяции Т-лимфоцитов и пролиферации сосудов типа посткапиллярных венул. Выраженное Т-клеточное/гистиоцитарное микроокружение создавало впечатление сходства с Т-клеточными НХЛ или вариантом лимфоидного преобладания лимфомы Ходжкина.
При иммунологическом исследовании ДВККЛ опухолевые клетки экспрессировали CD19, CD20, CD45, СD37, HLA-DR. Пролиферативная активность опухоли, анализируемая по маркеру Ki-67, составляла 30-90%.
В клинической картине ДВККЛ преобладало поражение периферических лимфатических узлов (47,6%) и костей (38,1%). Реже отмечалось увеличение лимфатических узлов брюшной полости и забрюшинного пространства (23,8% и 28,6% соответственно). Поражение средостения было представлено в виде вовлечения в опухолевый процесс лимфатических узлов в 19,0% случаев (вилочковая железа не была изменена по данным РКТ). С одинаковой частотой у детей с ДВККЛ опухолевый процесс распространялся на миндалины, легкие, кишечник (9,5%). Костный мозг и ЦНС поражались в 4,8% случаях.
Первичная медиастинальная (тимическая) В-крупноклеточная лимфома. На основании нашего небольшого опыта (3 больных) и литературных данных при ПМВККЛ болели чаще девочки пубертатного возраста, по данным РКТ опухоль, как правило, располагалась в переднем средостении, формируя большой конгломерат, вовлекавший в процесс вилочковую железу. Гистологически обращало внимание преобладание фиброза, реже отмечался реактивный компонент, представленный гистиоцитами и плазматическими клетками. Иммунологически опухоль характеризовалась зрело-В-клеточным фенотипом, экспрессией CD23 (который не обнаруживался при ДВККЛ), MuM1, чаще, чем при ДВККЛ, отмечалась экспрессия CD30 и реже - BCL-6 (менее 50% случаев).
Сравнительная характеристика зрелоклеточных В-клеточных опухолей. В детском возрасте НХЛ из периферических В-клеток были представлены ЛБ (56,4%), ДВККЛ (38,2%) и ПМВККЛ (5,4%). До 2001 г, согласно классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ, ПМВККЛ была подвариантом ДВККЛ и в настоящее время происходит накопление клинических, морфоиммунологических данных об особенностях данного варианта НХЛ у детей. Встречаемость ПМВККЛ в детском возрасте весьма редкая и составила 2% от всех НХЛ и 5,4% в группе зрелоклеточных В-клеточных лимфом, что не позволило провести нам сравнительного анализа между ДВККЛ с поражением средостения и ПМВККЛ.
Учитывая экспрессию общих В-клеточных маркеров (CD19, CD20) и варианты ДВККЛ с высокой пролиферативной активностью, сближающие ее с ЛБ, нам представилось важным провести сравнительный анализ ДВККЛ и ЛБ.
Цитологически при ДВККЛ преобладали клетки типа центробластов/иммунобластов, реже – крупные клетки с признаками атипии и полиморфизма, тогда как при ЛБ клеточный субстрат был достаточно однороден и представлен лимфобластами типа L3 (по FAB-классификации). В гистологических препаратах при ЛБ обращала внимание высокая пролиферативная активность, морфологические признаки апоптоза, макрофаги, фагоцитирующие апоптотические тельца, что создавало картину «звездного неба». Гистологически ДВККЛ в детском возрасте представлена следующими вариантами: центробластным/иммунобластным (69,4%), богатым Т-клетками/гистиоцитами (19,0%) и анапластическим (11,6%). Опухолевые клетки ЛБ экспрессировали CD19, CD20, CD10, CD38, CD37, sIgM, HLA-DR, TCL1, а также Ki-67 (90-100%), тогда как при ДВККЛ на клетках опухоли, как правило, не определялись sIgM, CD10 и пролиферативная активность опухолевых клеток, анализируемая по маркеру Ki-67, была ниже (30-90%).
При сравнении клинической картины ЛБ и ДВККЛ было установлено, что ЛБ представлена первичной локализацией лимфомы в брюшной полости (64,5%) с частым поражением костного мозга (32,2%), развитием плеврита и асцита. Клиническая картина в 35,5% случаев дебютировала с явлений «острого живота». У 32,2% пациентов отмечалась экстранодальная (кости черепа, печень) локализация ЛБ. Кишечник был поражен в 41,9% случаев. В то же время при ДВККЛ первичная локализация опухоли определялась в периферических лимфатических узлах (42,8%) с последующим вовлечением в процесс лимфатических узлов брюшной полости (23,8%), забрюшинного пространства (28,6%) и костей скелета (38,1%). Экстранодальная локализация ДВККЛ отмечалась в 9,5% и была представлена поражением яичек, костей и мягких тканей.
Отдельно стоит отметить, что костный мозг при ЛБ вовлекался в процесс, примерно, в 6 раз чаще, чем при ДВККЛ (32,2% против 4,8%). Также несколько чаще при ЛБ имелось поражение ЦНС и яичек (6,4% против 4,8%). Крайне редко при ЛБ происходило метастазирование опухоли во внутригрудные лимфатические узлы (3,2%), в то время как при ДВККЛ опухолевое поражение лимфатических узлов этой локализации встречалось значительно чаще (19,0%).
Активность ЛДГ при ДВККЛ у 47,6% больных оказалась менее 500 ЕД/л, тогда как при ЛБ ЛДГ была более 1000 ЕД/л в 58,1% случаев, что отражало большую биологическую активность ЛБ по сравнению с ДВККЛ.
Терапия ЛБ и ДВККЛ проводилась по одним и тем же программам В-NHL-BFM90/95. Показатель ОВ при ЛБ оказался несколько лучше, чем при ДВККЛ, и составил 82,99+/-6,96% против 77,01+/-13,59% (медиана наблюдения 8 лет), но различия были статистически недостоверными (р=0,76) (рис.5-6.). Для клинического течения ЛБ следует отметить отсутствие рецидивов, все случаи не эффективности терапии (16,1%) характеризовались прогрессией опухоли в период проведения ПХТ, т.е были первично рефрактерными. Вместе с тем, при ДВККЛ было отмечено 3 (14,3%) случая рецидивов после достижения полной ремиссии.
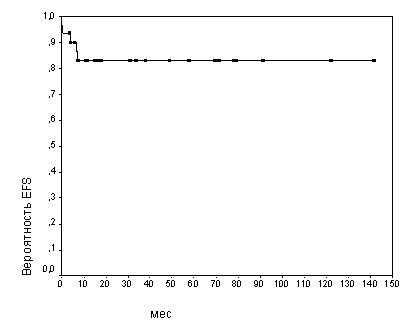
Рис.5. Бессобытийная выживаемость (EFS) детей с ЛБ
Рис.6. Бессобытийная выживаемость (EFS) детей с ДВККЛ
Проводимая ПХТ при В-НХЛ у детей являлась риск-адаптированной. В зависимости от прогностических групп риска, стадии заболевания, а также наличия/отсутствия поражения костного мозга и размеров первичного опухолевого очага, мы исследовали показатель БСВ больных ЛБ и ДВККЛ при лечении по программам B-NHL-BFM90/95. Следует отметить, что среди наблюдаемых детей с ЛБ и ДВККЛ все больные, имевшие I-II стадии и относящиеся к 1-2 прогностическим группам риска, живы на момент окончания исследования (01.01.2009г), срок наблюдения 54 мес. Размеры опухоли более 10 см в диаметре, поздние стадии и прогностически неблагоприятные группы риска отрицательно влияли на показатели БСВ, но различия оказались незначительными и статистически недостоверными. При изучении показателей БСВ больных в зависимости от поражения средостения при ДВККЛ оказалось, она была в 2,5 раза хуже при поражении средостения, составляя 33,33+/-8,34%, а при отсутствии опухоли в средостении – 83,33+/-6,15% (р=0,11).
В нашем исследовании детям со зрелоклеточными В-клеточными лимфомами 3-4 прогностическими группами риска, а также всем больным с ПМВККЛ мы включали ритуксимаб (Мабтеру) в стандартные блоки ПХТ программы В-NHL-BFM95. Под наблюдением было 12 больных с впервые установленным диагнозом зрелоклеточной В-клеточной НХЛ (ЛБ - 7 детей, ДВККЛ — 2 и ПМВККЛ — 3). При иммунологическом исследовании во всех случаях клетки опухоли экспрессировали антиген CD20, что послужило основанием для в программу лечения таргетного препарата - анти-CD20 моноклонального антитела — ритуксимаба (Мабтеры).
У всех больных, которым в программу ПХТ был добавлен ритуксимаб (Мабтера), удалось получить ПР. БСВ составила 90,0+/-3,02% (медиана наблюдения 29 мес)(рис.7.).
Рис.7. Бессобытийная выживаемость (EFS) детей со зрелоклеточными В-клеточными НХЛ при включении в программу ПХТ ритуксимаба (Мабтеры).
Следовательно, добавление ритуксимаба (Мабтеры) к терапии первой линии (B-NHL-BFM95) улучшает показатель БСВ у детей с неблагоприятными группами риска (3-4) зрелоклеточных В-клеточных лимфом (90,0+/-3,02% против 71,43+/-10,84%, р=0,29) по сравнению со стандартной программой B-NHL-BFM95, но наш опыт пока еще не достаточный, чтобы дать окончательную оценку эффективности применения препарата у детей и требуется дальнейшее исследование в этом направлении.
Таким образом, НХЛ в детском возрасте представлены преимущественно высокозлокачественными вариантами, которые гетерогенны клинически, морфологически и иммунологически. С учетом этих особенностей строятся современные программы терапии, позволяющие получить достаточно высокие показатели выживаемости у большинства пациентов (табл.4). Особого внимания заслуживает оптимизация лечебных подходов при рецидивах и резистентных формах НХЛ.
Таблица 4
Результаты терапии детей с НХЛ по программам ПХТ
| Показатель | В-ЛБЛ (n=23) | Т-ЛБЛ (n=50) | АККЛ (n=29) | ЛБ (n=31) | ДВККЛ (n=21) |
| ПР,% | 95,6 | 98,0 | 86,2 | 84,0 | 90,4 |
| ОВ (OS),% | 86,96+/-8,13 | 87,04+/-10,71 | 85,67+/-11,15 | 82,99+/-6,96 | 77,01+/-12,37 |
| БРВ (RFS),% | 84,42+/-9,05 | 81,08+/-7,89 | 76,48+/-13,49 | 82,99+/-6,96 | 76,91+/-14,25 |
| БСВ (EFS),% | 81,82+/-6,43 | 78,71+/-9,07 | 64,17+/-15,91 | 82,99+/-6,96 | 75,47+/13,59 |
ВЫВОДЫ
- НХЛ у детей представлены следующими вариантами: Т- и В-ЛБЛ (47%), АККЛ (18%), ЛБ (20%), ДВККЛ (13%) и ПМВККЛ (2%). На момент диагностики преобладали III-IV стадии заболевания (84,7%) и 2-3 прогностические группы риска (87,9%).
- Отличительные особенности В- и Т-ЛБЛ заключались в иммунологической характеристике опухолевых клеток. При В-ЛБЛ наблюдалась экспрессия CD19, CD20, CD10, CD38, тогда как при Т-ЛБЛ - CD1a, CD3, CD5, CD7, TdT, CD4, CD8. Клинически при В-ЛБЛ поражались периферические лимфатические узлы (52%), часто костный мозг (43%) и реже ЦНС (13%). У 21,7% детей отмечалась экстранодальная локализация (кости, мягкие ткани). При Т-ЛБЛ преобладало поражение средостения (92%). Вовлечение в процесс периферических лимфатических узлов, костного мозга и ЦНС наблюдалось у 68%, 62% и 6% детей, соответственно.
- Морфологически при АККЛ у детей преобладал мелкоклеточный (45,45%) и лимфогистиоцитарный (36,36%) варианты, реже встречался классический вариант (18,20%). Иммунологически опухолевые клетки экспрессировали CD30, а В-клеточные и гистиоцитарные маркеры отсутствовали, преобладал ALK-позитивный вариант АККЛ (81,8%). Клинически преобладало поражение периферических лимфатических узлов (55,2%). Экстранодальная локализация (мягкие ткани, кости, легкие, плевра и кожа) АККЛ отмечена в 41% случаев.
- ЛБ в детском возрасте представлена «классическим» гистологическим вариантом. Опухолевые клетки экспрессировали HLA-DR, CD45, CD37, CD19, CD20, CD10, sIgM, BCL-6, Ki-67~100%. ЛБ характеризовалась первичной локализацией в лимфатических узлах брюшной полости (64,5%), кишечнике (41,9%). У 32,2% пациентов отмечалась экстранодальная локализация (кости черепа, печень, почки). Костный мозг вовлекался в процесс в 32,2% случаев, реже ЦНС (6,4%) и яички (6,4%).
- Гистологически ДВККЛ представлена центробластным/иммунобластным (69,4%), анапластическим (11,6%) вариантами и вариантом, богатым Т-клетками/гистиоцитами (19,0%). Клетки ДВККЛ экспрессировали CD19, CD20, CD37, HLA-DR, CD45, а также Ki-67 (30-90%). Наблюдалось поражение лимфатических узлов: периферических (47,6%), брюшной полости (23,8%), забрюшинного пространства (28,6%). Экстранодально (яички, кости и мягкие ткани) ДВККЛ локализовалась в 9,5% случаев. Костный мозг при ДВККЛ был поражен у 4,8% детей.
- Современная ПХТ по протоколам B-NHL-BFM90/95 и ALL IC-BFM2002 позволила добиться наиболее высоких показателей БСВ (EFS) у детей с ЛБ и В-ЛБЛ (82,99+/-6,96% и 81,82+/-6,43% соответственно). БСВ при Т-ЛБЛ и ДВККЛ была несколько ниже (78,71+/-9,07% и 75,47+/-13,59% соответственно). Наиболее низкая БСВ отмечена при АККЛ (64,17+/-15,91%).
- Показатели БСВ детей с НХЛ были ниже при 3-4 прогностических группах риска, размерах опухоли более 10 см и поражении костного мозга. Ухудшали прогноз экспрессия CD34 на опухолевых клетках при ЛБЛ, экспрессия Т-клеточных антигенов при АККЛ. БСВ при ДВККЛ была ниже в случаях поражения средостения.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Диагностика НХЛ у детей должна быть комплексной и включать цитологические, гистологические и иммунологические исследования опухоли, что позволяет верифицировать вариант НХЛ согласно современной классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ 2008 г. Лучевые (рентгенография, РКТ, УЗИ), радионуклидные и по показаниям эндоскопические (ФЭГДС, колоноскопия, лапароскопия, торакоскопия) методы диагностики необходимы для оценки распространенности опухоли и установления стадии НХЛ.
- При иммунологическом анализе опухолевого субстрата в диагностическую панель необходимо включение антител к клеткам-предшественникам (CD34, TdT), зрелым В- и Т-клеткам (CD19, CD20, CD23, CD38, CD10, CD1а, CD2, CD3, CD4, CD5, CD7, CD8), а также при подозрении на крупноклеточный характер НХЛ исследование активационного антигена CD30, ALK, ряда белков и транскрипционных факторов (BCL-2, BCL-6, MuM1), а также TCL1, Ki-67 при морфологических признаках зрелоклеточной пролиферации опухоли.
- Основным методом лечения НХЛ у детей является интенсивная ПХТ. Свою эффективность доказали программы, разработанные группой BFM. Проведение ЛТ показано больным Т-ЛБЛ с целью профилактики поражения ЦНС.
- Выбор программы ПХТ должен основываться на морфоиммунологическом варианте НХЛ, согласно классификации опухолей гемопоэтической и лимфоидной тканей ВОЗ, 2008 г.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Лимфомы (классификация, диагностика, лечение): Учебно-методическое пособие / Т.Т.Валиев, Т.Я.Тарарак. – Ульяновск: Издательский центр Ульяновского государственного университета, 2004. – 101 с.
- Т- и NK-клеточные лимфомы кожи: Учебно-методическое пособие / Т.Т.Валиев, Т.Я.Тарарак. – Ульяновск: Издательский центр Ульяновского государственного университета, 2006. – 48 с.
- Клинико-патогенетические особенности фолликулярной лимфомы у детей (обзор литературы) / Т.Т.Валиев, Т.Я.Тарарак // Детская онкология. – 2006. - №1. – С. 3-10.
- Диагностика неходжкинских лимфом у детей: современный взгляд на проблему (обзор литературы) / Т.Т.Валиев // Детская онкология. – 2008. - №1.- С. 22-35.
- Характеристика Т- и В-клеточных неходжкинских лимфом в детском возрасте / Т.Т.Валиев, О.В. Морозова, А.И. Слугин, Л.А. Махонова, И.Н. Серебрякова, А.М. Ковригина, Н.Н. Тупицын, Г.Л. Менткевич // Детская онкология. – 2008. - №2. - С. 4-7.
- Диагностика лимфомы из предшественников В-клеток в детском возрасте / Т.Т.Валиев, О.В. Морозова, А.И. Слугин, Л.А. Махонова, И.Н. Серебрякова, Н.Н. Тупицын, Г.Л. Менткевич // Материалы 4-го съезда детских онкологов России с международным участием «Настоящее и будущее детской онкологии».-М., 2008. –
С. 64-65 - Характеристика Т-лимфобластного лейкоза/лимфомы из предшественников Т-клеток у детей / Т.Т.Валиев, Н.Н.Тупицын, А.М.Ковригина, И.Н.Серебрякова, О.В.Морозова, А.И.Слугин, С.А.Маякова, Л.А.Махонова, Г.Л.Менткевич // Материалы XII Российского онкологического конгресса. – М, 18-20 ноября 2008. –
С. 135 - Экстранодальная NK/T-клеточная лимфома назального типа в детском возрасте / Т.Т.Валиев, А.И.Слугин, Т.Л.Ушакова, Л.А.Махонова, О.В.Морозова, М.Н.Синицына, Н.А.Кошечкина, Е.Н.Шолохова, А.М.Ковригина, Н.Н.Тупицын, Г.Л.Менткевич // Детская онкология. – 2008. - №4.- 2009. - №1.- С. 13-18.
- Применение ритуксимаба (Мабтеры) у детей с гематологическими заболеваниями / Т.Т.Валиев // Клиническая онкогематология. – 2009. - №1. – С. 38-40.
- Pediatric extranodal NK/T-cell lymphoma, nasal type / T.Valiev, A.Kovrigina, N.Sholokhova, N.Tupitcin, G.L.Mentkevich // 14th Congress of the European Hematology Association. – Berlin, Germany, June 4-7 2009. – p. 659.
Список сокращений
АККЛ анапластическая крупноклеточная лимфома
БСВ (EFS) бессобытийная выживаемость (Event-free survival)
БРВ (RFS) безрецидивная выживаемость (Relapse-free survival)
ВОЗ Всемирная организация здравоохранения
ДВККЛ диффузная В-крупноклеточная лимфома
НХЛ неходжкинские лимфомы
ЛБ лимфома Беркитта
ЛБЛ лимфобластные лимфомы из клеток-предшественников
В-ЛБЛ - В-лимфобластная лимфома из клеток-предшественников
Т-ЛБЛ - Т-лимфобластная лимфома из клеток-предшественников
ЛДГ лактатдегидрогеназа
МРТ магнитно-резонансная томография
ОВ (OS) общая выживаемость (Overall survival)
ПМВККЛ первичная медиастинальная (тимическая) В-крупноклеточная лимфома
ПР полная ремиссия
ПХТ полихимиотерапия
ПЭ полный эффект
РИД радиоизотопная диагностика
РКТ рентгеновская компьютерная томография
УЗИ ультразвуковое исследование
ЦНС центральная нервная система
ALK anaplastic lymphoma kinase (киназа анапластической лимфомы)
BFM Berlin-Frankfurt-Munster
FAB (ФАБ)-классификация Франко-Американо-Британская классификация
cIg, sIg цитоплазматические (cytoplasmic), мембранные (surface) иммуноглобулины

