Влияние фактора некроза опухоли на цитотоксичность и индукцию апоптоза противоопухолевыми препаратами на клеточных линиях меланом. экспериментальное исследование.
На правах рукописи
БИГВАВА ХЬЫБЛА АМЕРАНОВНА
Влияние фактора некроза опухоли на
цитотоксичность и индукцию апоптоза
противоопухолевыми препаратами
на клеточных линиях меланом.
Экспериментальное исследование.
14.01.12 – онкология
Автореферат
диссертации на соискание ученой степени
кандидата биологических наук
Москва – 2012
Работа выполнена в Федеральном государственном бюджетном учреждении «Российском онкологическом научном центре имени Н.Н. Блохина» Российской академии медицинских наук (директор – академик РАН и РАМН, профессор М.И. Давыдов).
Научный руководитель: доктор медицинских наук Славина Елена Григорьевна
Официальные оппоненты:
доктор медицинских наук, профессор Бухман Владимир Михайлович
доктор биологических наук, профессор Галегов Георгий Артемьевич
Ведущее научное учреждение: Федеральное государственное бюджетное учреждение «Государственный научный центр «Институт иммунологии» Федерального медико-биологического агентства России.
Защита диссертации состоится 26 апреля 2012 г. в 10:00 часов
на заседании диссертационного Совета Д.001.017.01. ФБГУ «Российского онкологического научного центра им. Н.Н.Блохина» РАМН (115478, Москва, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке ФБГУ «РОНЦ им. Н.Н.Блохина» РАМН.
Автореферат разослан 28 февраля 2012 г.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Шишкин Юрий Владимирович
ВВЕДЕНИЕ
Актуальность темы. Меланома кожи является одной из агрессивных форм злокачественных опухолей, обладающей высокой потенцией местного роста, регионарного метастазирования, способностью к диссеминации по коже, множественному метастазированию. Развитие метастазов в лимфатической системе наблюдается в 70% случаев меланомы. Обычно поражаются печень, легкие, мозг и костная ткань. Именно метастазирование на ранних стадиях обусловливают высокую смертность и неэффективность терапии данного заболевания.
Несмотря на достижения последних десятилетий, лечение меланомы кожи остается крайне трудной проблемой. У каждого десятого больного меланому выявляют в IV стадии, когда уже имеет место инвазия и метастазирование, и методом лечения является химиотерапия с использованием дакарбазина, производных нитрозомочевины и платины. Эффективность такой терапии остается низкой из-за высокой резистентности клеток меланомы и/или быстрой индукции множественной лекарственной устойчивости при воздействии противоопухолевых препаратов.
Среднегодовой темп прироста заболеваемости меланомой в мире составляет около 5% (в США – 4%, в России – 3,9%) и может считаться одним из самых высоких среди всех злокачественных опухолей, после рака легкого. Ежегодно в нашей стране выявляется около 8000 пациентов с диагнозом меланома кожа.
Диссеминированная меланома кожи считается практически инкурабельным заболеванием. При использовании химиотерапии выживаемость больных с метастазами меланомы варьирует от 6 до 12 мес., а 5-летняя выживаемость составляет только 5%
Небольшие успехи химиотерапии послужили стимулом к созданию и изучению комбинирования ее с цитокинами. В клинических исследованиях лечебную активность показали интерлейкин-2 (ИЛ-2), -интерферон (-ИФН), фактор некроза опухоли альфа (ФНО-). Изучение роли цитокинов в лечении злокачественных новообразований является одним из современных направлений в онкологии.
Среди новых препаратов ФНО большой интерес представляет отечественный рекомбинантный человеческий препарат фактора некроза опухоли альфа – альнорин.
Таким образом, представляет интерес углубления знаний о механизмах гибели опухолевых клеток in vitro при комбинировании химиотерапии с цитокинами, получение экспериментальных доказательств свидетельствующих о повышении эффективности терапии.
Целью работы является изучение in vitro эффективности комбинирования альнорина с химиопрепаратами в усилении цитотоксического действия противоопухолевых препаратов и индукции ими апоптоза в клеточных линиях меланом.
Задачи исследования:
- Определить чувствительность клеточных линий меланом к цитотоксическому действию химиопрепаратов in vitro.
- Оценить эффективность комбинирования альнорина с химиопрепаратами в клетках меланом.
- Оценить лекарственно-индуцированный апоптоз в сочетании с альнорином на клеточных линиях меланом с применением современных методов регистрации апоптоза.
- Исследовать влияние фактора некроза опухоли- (альнорин) на экспрессию в клетках меланом маркера апоптоза СD95 и белков – продуктов генов, регулирующих апоптоз: bcl-2 и bax.
Научная новизна. Впервые установлена in vitro различная чувствительность клеток меланом, происходящих от различных больных, к цитотоксическому и апоптозиндуцирующему действию противоопухолевых препаратов, применяемых в терапии меланомы – дакарбазину (DTIC), кармустину (BCNU), нидрану (ACNU) и аранозе. Впервые продемонстрировано усиление фактором некроза опухоли- – отечественным препаратом альнорином - чувствительности клеток меланом к цитотоксичности этих препаратов. Показана способность фактора некроза опухоли- в сочетании с противоопухолевыми препаратами усиливать индукцию ими апоптоза в клетках меланом. Впервые показано, что противоопухолевое действие химиопрепаратов in vitro осуществляется в два этапа: при начальном контакте клеток с препаратами в течение первых 24 часов от 40 до 80% клеток погибает без признаков апоптоза, и лишь в последующие 24-48 часов выявляется апоптотичская гибель оставшихся клеток. Получены данные о различной экспрессии в клетках белков генов - регуляторов апоптоза.
Научно-практическая значимость. Полученные экспериментальные данные могут лечь в основу повышения эффективности противоопухолевой химиотерапии меланомы фактором некроза опухоли (альнорином).
За время выполнения работы в отделении химиотерапии и комбинированного лечения злокачественных опухолей уже получены первые результаты об увеличении безрецидивной и общей выживаемости больных, получавших стандартную терапию после предварительного лечения альнорином.
Апробация работы. Апробация диссертационной работы состоялось 27 января 2012г. на совместной научной конференции лаборатории клинической иммунологии опухолей, лаборатории иммунологии гемопоэза, отделения химиотерапии и комбинированного лечения злокачественных опухолей, отделения биотерапии опухолей НИИ клинической онкологии, лаборатории экспериментальной диагностики и биотерапии опухолей НИИ экспериментальной диагностики и терапии опухолей ФБГУ «РОНЦ имени Н. Н. Блохина» РАМН.
Материалы работы были представлены на 19-м Международном противораковом конгрессе ICACT (Париж, 2008г.), на V съезде онкологов и радиологов СНГ (Ташкент, 2008 г.), на 20-м Международном противораковом конгрессе ICACT (Париж, 2009г.), на XIV Всероссийском научном форуме с международным участием имени академика В.И.Иоффе (Санкт-Петербург, 2011), на 9-м совместном заседании международного общества по исследованию интерферона и цитокинов ICS/ISICR (Флоренция, 2011 г.).
Публикации. По материалам работы опубликовано 12 печатных работ.
Объем и структура диссертации. Диссертационная работа состоит из введения, обзора литературы, результатов собственных исследований, заключения, выводов и списка литературы, включающего 129 источников, из которых 15 отечественных и 114 зарубежных авторов. Работа изложена на 128 страницах машинописного текста, иллюстрирована 16 таблицами и 35 рисунками.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
1.1. Клеточные линии меланом.
Исследования выполнены на восьми клеточных линиях меланом человека, полученных из образцов хирургически удаленной опухолевой ткани пациентов с диссеминированной меланомой, предоставленные Л.Ф.Морозовой, научным сотрудником лаборатории экспериментальной диагностики и биотерапии опухолей НИИ ЭДиТо РОНЦ им. Н.Н. Блохина.
1.2. Препараты.
1. Альнорин (ГНЦ «Вектор», Россия) - препарат на основе рекомбинантного фактора некроза опухолей - альфа человека, представляет собой белок, состоящий из 153 аминокислотных остатков, выделенный из трансформированного штамма Е. соli, очищенный методом ионообменной и абсорбционной хроматографии, стерилизованный фильтрацией через мембраны.
2. Противоопухолевые препараты: нидран (ACNU, Sankyo Co, Япония); араноза (ООО «Глесс», Россия); кармустин (BCNU, BristolMyers Squibb, США); дакарбазин (DTIC, Lachema, Чехия).
3. Для исследования экспрессии биологических маркеров на поверхностной мембране и в клетках меланом человека использовали моноклональные антитела, конъюгированные различными флюорохромами, характеристика которых представлена в таблице 1.
Таблица 1. Характеристика использованных в работе МКА.
| Название МКА | Клон | Флюорохром | Изотип Ig | Фирма-производитель |
| CD95 (Fas\Apo-1) | DX2 | PE | IgG1 | DAKO, Дания |
| CD95 (Fas\Apo-1) | ICO160 | FITC | IgG2a | НПЦ «МедБиоСпектр», Россия |
| Bcl-2 | 100 | FITC | IgG1 | Ancell, США |
| Bax | 2D2 | PE | IgG1 | Santa Cruz Biotechnology, США |
| Isotype Control | FITC, PE | Mouse IgG1 IgG2a | Becton-Dickinson, США |
1.3. Определение цитотоксической активности - МТТ-тест.
Клетки в концентрации 2х104 клеток/мл засевали по 200 мкл/лунку в 96-луночные планшеты с плоским дном (Corning Costar, USA) и инкубировали 1 сутки в термостате при 37°С в атмосфере с 5% СО2. Затем заменяли ростовую среду такой же средой, содержащей различные концентрации препарата, ФНО- (альнорин) или смеси препарата с ФНО- (альнорин), или чистой средой (контроль) и инкубировали 24, 48 и 72 часа при тех же условиях. По окончании инкубации во все лунки вносили по 10 мкл раствора МТТ в исходной концентрации 5мг/мл. После 4 часов инкубации в термостате планшеты центрифугированием при 1000 об/мин в течение 5 мин. Супернатант осторожно удаляли, вносили в каждую лунку по 100 мкл ДМСО, клетки встряхивали на шейкере в течении 15 мин, после чего определяли оптическую плотность (ОП) на спектрофотометре Labsystems Multiscan MS при длине волны 540 нм.
1.4. Метод фиксированного окрашивания ДНК пропидий йодидом (PI) для определения апоптотических клеток.
Клетки выращивали в лунках 6-луночных планшетов (Сorning Costar, USA), засевая их по 2 мл клеточной суспензии, содержащей 5104 клеток/мл. После 1 суток культивирования в них так же, как и в опытах по цитотоксичности, вносили ростовую среду, содержащую различные концентрации препарата, цитокина или смесь препарата с цитокином, инкубировали 24, 48 и 72 часа при 37°С в атмосфере с 5% СО2. Затем клетки снимали с поверхности пластика обработкой раствором Версена, фиксировали ледяным 70°С этанолом и хранили при 4оС. Перед окрашиванием пропидий иодидом клетки осаждали центрифугированием 5 мин, при 1000 об/мин, осадок осторожно ресуспендировали в 0,5 мл гипотонического раствора, содержащего 5 мкг/мл PI, 0,1% цитрата натрия, 0,1% Тритона Х-100 и инкубировали в течение 30 мин при 4оС. Суспензию клеток, окрашенных PI, без дальнейшей отмывки анализировали методом проточной цитофлюориметрии.
1.5. Метод двойного прижизненного окрашивания ДНК с использованием Аннексина V-FITC в комбинации с PI.
Клетки выращивали в лунках 6-луночных планшетов (Costar), засевая их по 2 мл клеточной суспензии, содержащей 5104 клеток/мл. После инкубации клеток с препаратом, ФНО- и их сочетанием, а также интактные клетки собирали раствором Версена без фиксации, осаждали центрифугированием 5 минут при 1000 оборотов/минуту. Клетки дважды отмывали в фосфатном буфере (PBS), а затем добавляли 100 мкл связывающего буфера, 5 мкл Аннексин V и 5 мкл пропидий йодид (PI - 5 мкг/мл). Образцы встряхивали на вортексе и инкубировали в темноте 15 минут при комнатной температуре. Затем к пробам добавляли 400 мкл связывающего буфера и производили анализ на проточном цитофлюориметре.
1.6. Реакция прямой иммунофлюоресценции.
1.6.1. Окрашивание поверхностных антигенов.
Экспрессию CD95 антигена исследовали в реакции поверхностной иммунофлюоресценции. Для этого 100 мкл 5х105 клеток с 20 мкл МКА, конъюгированных с PE, инкубировали в течение 30 мин при 4°С. По окончании инкубации к клеткам добавляли 2 мл PBS, отмывали 5 мин. при 1000 оборотах/минуту. После этого осадок клеток ресуспендировали в 300 мкл 1% раствора формалина и анализировали на проточном цитофлюориметре.
1.6.2. Окрашивание внутриклеточных маркеров.
Для выявления экспрессии внутриклеточных маркеров Bcl-2 и Bax к 1х106клеток в объеме 100 мкл добавляли 100 мкл фиксирующего раствора и инкубировали в течение 15 мин при комнатной температуре в темноте. Затем к клеткам добавляли 2 мл PBS, с 2% ЭТС и отмывали в течение 3 мин. при 1000 оборотах/минуту. После этого к осадку добавляли 100 мкл пермеабилизирующего раствора и необходимое количество прямомеченых антител (Bcl-2 FITC – 80 мкл или Bax PE – 20 мкл) инкубировали в течение 30 минут при комнатной температуре в темноте. По окончании инкубации к осадку клеток добавляли 2мл PBS, с 2%ЭТС и отмывали в течение 3 мин при 1000 оборотах/минуту, ресуспендировали в 1% растворе формалина и анализировали на проточном цитофлюориметре.
1.7. Проточно-цитофлюориметрический анализ.
Анализ клеточных суспензии (фиксированных и живых клеток) выполняли на проточном цитофлюориметре FACSCalibur (Becton Dickinson, США). Сбор и анализ материала проводили с использованием коммерческого программного обеспечения BD CellQuest™PRO software и LYSIS II software. В каждой пробе анализировалось от 5000 (при фиксации клеток) до 10000 событий.
1.8. Статистическая обработка результатов.
Статистическую обработку результатов проводили по определению 50% цитотоксической дозы (ЦД50), 50% апоптозиндуцирующей дозы (АД50) противоопухолевых препаратов с использованием компьютерной программы Sigma Plot for Windows (Jandel Scientific, USA) и пакета программ Statistica 7.0. Достоверность различий оценивали по критерию Стьюдента. Различия считали статистически достоверными при p<0,05. Результаты экспериментов представлены в виде среднего значения данных, полученных как минимум из 3-независимых экспериментов.
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ
Исследование воздействия альнорина на цитотоксический эффект противоопухолевых препаратов в отношении клеточных линий меланом.
В экспериментальных исследованиях с помощью МТТ-теста проведено исследование цитотоксической активности противоопухолевых препаратов нидрана, аранозы, кармустина и дакарбазина на клеточных линиях меланом человека in vitro. Мы исследовали изменение цитотоксичности химиопрепаратов в сочетании с различными дозами альнорина – 500МЕ/мл, 50МЕ/мл, 5МЕ/мл, 2,5МЕ/мл и при различных сроках экспозиции с клетками. При исследовании цитотоксической активности нидрана на четырех клеточных линиях меланом оказалось, что они в различной степени чувствительны к действию химиопрепарата. Одна из четырех линий mel Rac была высокорезистентна к цитотоксическому действию нидрана, а остальные три линии были в равной степени чувствительны к нему (рис. 1). Для изучения влияния альнорина на цитотоксичность нидрана использовали две концентрации альнорина, при которых он сам не был цитотоксичен – 500 и 50 МЕ/мл. Альнорин усиливал цитотоксичность нидрана только на резистентной линии. Эффекта от комбинирования с альнорином на чувствительных линия не было.
Рисунок 1. Цитотоксичность нидрана АCNU в сочетании с альнорином (А) на клеточных линиях меланом.
Цитотоксическое действие отечественного противоопухолевого препарата аранозы в исследованных клеточных линиях меланом была различной – одни линии отличались высокой резистентностью, а другие были более чувствительными. Альнорин значительно усиливал цитотоксическое действие аранозы в отношении двух из семи клеточных линий (рис. 2).
Рисунок 2. Цитотоксичность аранозы А в сочетании с альнорином (А) на клеточных линиях меланом.
Цитотоксичность кармустина исследовали на восьми клеточных линиях меланом. Из них две линии mel Mtp и mel IL были чувствительны к химиопрепарату, две линии mel Is и mel Ibr высокорезистентны, а остальные четыре оказались менее резистентными (рис. 3). Для изучения влияния альнорина на цитотоксичность кармустина использовали четыре концентрации альнорина 500, 50, 5 и 2,5 МЕ/мл. Для каждой клеточной линии меланом выявлены дозы альнорина наиболее эффективно усиливающее цитотоксическое действие кармустина. Однако на двух высокорозистентных линиях mel Is и mel Ibr ни одна доза альнорина не была эффективна.
Рисунок 3. Цитотоксичность кармустина BCNU в сочетании с альнорином (А) на клеточных линиях меланом.
К цитотоксическому действию дакарбазина две линии из восьми оказались чувствительны, остальные шесть относительно резистентны. Усиление альнорином цитотоксичности дакарбазина в большей или меньшей степени наблюдается на всех линиях меланом (рис. 4).
Рисунок 4. Цитотоксичность дакарбазина DTIC в сочетании с альнорином (А) на клеточных линиях меланом.
Кроме того, мы выявили, что цитотоксическое действие химиопрепарата усиливается по мере увеличения продолжительности экспозиции с клетками. Влияние альнорина на цитотоксичность кармустина изменяется при различных сроках экспозиции. Например, на клеточных линия mel P и mel Cher добавление альнорина повышает цитотоксичность кармустина, и это повышение проявляется в большей степени по мере увеличения срока экспозиции (рис. 5).
Рисунок 5. Влияние альнорина (А) на цитотоксичность кармустина BCNU на клеточных линиях меланом при различных сроках экспозиции.
Усиливающееся цитотоксическое действие дакарбазина альнорином также связано с увеличением срока экспозиции. Как видно на рис. 6 при увеличении продолжительности экспозиции усиливалось как цитотоксичность препарата, так и усиливающее его действие альнорина.
Рисунок 6. Влияние альнорина (А) на цитотоксичность дакарбазина DTIC на клеточных линиях меланом при различных сроках экспозиции.
Таким образом, полученные данные свидетельствуют о том, что чувствительность клеточных линий меланом различна к цитотоксической активности противоопухолевых препаратов. Клетки одних линий меланом могут быть резистентны к одному препарату, но чувствительны к другому. Мы выявили эффективность влияния альнорина на цитотоксическую активность противоопухолевых препаратов. Альнорин в различной степени усиливал их цитотоксичность в отношении клеточных линий меланом in vitro. И, кроме того, показано, что при увеличении продолжительности экспозиции усиливалось как цитотоксичность химиопрепарата, так и усиливающее ее действие альнорина.
Исследование индукции апоптоза противоопухолевыми препаратами на клеточных линиях меланом и влияние на нее альнорина.
а) изучение апоптоза методом фиксированного окрашивания клеток
пропидий иодидом
На следующем этапе мы исследовали индукцию апоптоза противоопухолевыми препаратами и влияние на них альнорина. Определение апоптотических клеток проводили с помощью метода фиксированного окрашивания ДНК пропидий йодидом. Влияние альнорина на индукцию апоптоза кармустином исследовали на четырех клеточных линиях, полученные данные в виде 50% апоптозиндуцирующей дозы (АД50) кармустина и эффект от комбинирования кармустина c альнорином представлены в таблице 1.
Таблица 1. Индукция апоптоза кармустином и в сочетании с альнорином на клеточных линиях меланом методом фиксированного окрашивания ДНК.
| Препарат | Log2 АД50 (мкг/мл) BCNU на клеточных линиях меланом | ||||
| Mel Mtp | Mel IL | Mel P | Mel Rac | ||
| 24 часа | BCNU | 5,3 ± 0,2 | 5,8 ± 0,2 | 17,6 ± 0,1 | 21,8 ± 0,2 |
| BCNU + A500 | 1,9 ± 1,6* | 5,7 ± 0,1 | 13,0 ± 0,1* | 17,7 ± 0,5* | |
| BCNU + A50 | 3,2 ± 0,9 | 5,76 ± 0,1 | 15,8 ± 0,2 | 22,1 ± 0,1 | |
| 48 часов | BCNU | 7,2 ± 0,1 | 7,1 ± 0,2 | ||
| BCNU + A500 | 7,0 ± 0,2 | 7,0 ± 0,3 | |||
*p0,05
Как видно из таблицы, клетки линий mel Mtp и mel IL проявляют наибольшую чувствительность к апоптозиндуцирующему действию кармустина так же, как и к его цитотоксическому эффекту, а в клетках линий mel P и mel Rac, как следует из рис. 7 (Е, С), кармустин очень слабо или вовсе не индуцирует апоптоза в течение 24 часов даже при концентрации альнорина 500 МЕ/мл. В то же время цитотоксический эффект этой дозы кармустина на клетках mel P превышает 40%. Это, по-видимому, свидетельствует о том, что гибель клеток меланомы этой линии под действием кармустина в первые 24 часа экспозиции с ним происходит не по механизму апоптоза. Добавление альнорина лишь очень слабо или вовсе не усиливает их чувствительность как к цитотоксическому, так и к апоптозиндуцирующему действию кармустина. При увеличении экспозиции клеток этой линии с кармустином до 48 часов появляется апоптоз, однако добавление альнорина его не усиливает.
Рисунок 7. Влияние альнорина на индукцию апоптоза BCNU на клеточных линиях меланом.
В таблице 2 представлены данные о 50% апоптозиндуцирующей дозе (АД50) противоопухолевого препарата дакарбазина, в сочетании с альнорином и при различной продолжительности экспозиции клеток. Из восьми исследованных клеточных линий меланом при 24-часовой экспозиции к индукции апоптоза дакарбазином чувствительной оказалась только линия mel IL, пять клеточных линий оказались значительно менее чувствительными – mel Mtp, mel P, mel Rac, mel Is и mel Ibr, и две линии были резистентны – Mel-Cher и mel Kor. При сочетанном применении альнорина с дакарбазином мы использовали концентрации альнорина, которые вызывали усиление цитотоксической активности химиопрепарата, но самп гн вызывали апоптоза. На клетках
Таблица 2. Индукция апоптоза дакарбазином и в сочетании с альнорином на клеточных линиях меланом методом
фиксированного окрашивания ДНК.
| Препарат | Log2 АД50 (мкг/мл) DTIC на клеточных линиях меланом. | ||||||||
| Mel Mtp | Mel IL | Mel P | Mel Rac | Mel Is | Mel Ibr | Mel Kor | Mel Cher | ||
| 24 часа | DTIC | 24,9± 3,5 | 9,8 ± 0,2 | 20,7 ± 1,0 | 18,1± 1,6 | 27,7±2,1 | 19,0±2,0 | 43,3±3,1 | 33,4±0,4 |
| DTIC +A500 | 8,1 ± 0,1* | 8,3 ±0,1* | 17,0 ± 1,7 | 16,0± 0,4 | |||||
| DTIC +A50 | 7,3 ± 0,2* | 8,6 ± 0,1 | |||||||
| DTIC +A5 | 21,1±1,6 | 13,3±0,1* | |||||||
| DTIC+A2,5 | 31,2±3,2* | 30,9±0,4* | |||||||
| 48 часов | DTIC | 14,5± 0,5 | 10,7±0,8 | 13,2± 0,3 | 13,9±0,1 | 10,5±0,2 | 14,0±0,3 | ||
| DTIC +A500 | 13,1± 0,2* | 9,7±0,3 | |||||||
| DTIC + A5 | 11,5±0,3* | 11,7±0,1* | |||||||
| DTIC + A2,5 | 10,4±0,3 | 13,4±0,6 | |||||||
| 72 часа | DTIC | 10,5± 0,3 | 10,1±0,1 | 10,6±0,4 | 7,3 ± 0,1 | 11,7±0,3 | |||
| DTIC +A500 | 10,0± 0,1 | ||||||||
| DTIC + A5 | 9,7±0,2* | 9,6±0,1 | |||||||
| DTIC + A2,5 | 7,7 ± 0,2 | 10,5± 0,1 | |||||||
*p0,
линии mel IL добавление альнорина усиливает апоптоз только при меньших концентрациях дакарбазина – 125 и 250 мкг/мл и не усиливает при высоких дозах – 500 и 1000 мкг/мл. При этом эффективность 500 и 50 МЕ/мл альнорина практически одинакова. На линии mel Mtp дакарбазин очень слабо индуцирует апоптоз. При высокой дозе химиопрепарата процент апоптотических клеток составляет лишь 12%, а при низкой дозе дакарбазина – 2,8%. Сам же альнорин, как и в опытах с кармустином, индуцирует апоптоз в клетках этой линии. В то же время цитотоксичность дакарбазина, проявляющаяся после 24-часовой экспозиции с клетками этой линии существенно выше, чем апоптоз – от 13% при концентрации препарата 125 мкг/мл до 80% при 1000мкг/мл. Альнорин и в опытах по цитотоксичности сам вызывает гибель клеток линии mel Mtp и усиливает, вызванную дакарбазином цитотоксичность.
На рис. 8 приведены примеры одного из экспериментов на пяти резистентных клеточных линиях меланом по индукции апоптоза дакарбазина и в сочетании с альнорином при различных сроках экспозиции. При 24-часовой экспозиции дакарбазин не индуцировал апоптоз. При высокой дозе химиопрепарата 1000 мкг/мл процент апоптотических клеток составил 8,5% mel P, 14,9% mel Ibr; 11,4% mel Is; 9,1% mel Kor; 12,8% mel Cher (рис. 8, A-Е). Индукция апоптоза дакарбазином усиливалась альнорином на линии mel Ibr - процент апоптотической гибели клеток при дозе 1000мкг/мл DTIC + 5МЕ/мл альнорин составил 25,7%. На остальных линиях альнорин не усиливал индукцию апоптоза дакарбазином. Индукция апоптоза дакарбазином при увеличении времени экспозиции до 48-часов немного возрастала на клетках Mel-Ibr до 26%, Mel-Kor до 41,9%, Mel-P до 19,2%, Mel Is до 31,9% и mel Cher до 15,6% (рис. 8, F-J). Более значительно она возрастала под действием дакарбазина после 72-часой экспозиции, однако альнорин усиливал ее лишь в слабой степени и только при максимальной дозе дакарбазина (рис.8, К-О).
Таким образом, индукция апоптоза дакарбазином наблюдается на всех клеточных линиях меланом, но при различных сроках экспозиции. Комбинация противоопухолевого химиопрепарата дакарбазина с альнорином слабо усиливает, индуцирует процесс гибели клеток меланом человека по механизму апоптоза в отличие от высокой эффективности альнорина в отношении цитотоксического действия дакарбазина, что свидетельствует о большей эффективности фактора некроза опухоли в противоопухолевом действии дакарбазина по механизму, отличному от апоптоза.
Рисунок 8. Влияние альнорина на индукцию апоптоза DTIC на 5 клеточных линиях меланом при различной продолжительности экспозиции.
б) изучение индукции раннего и позднего апоптоза методом прижизненного окрашивания клеток Аннексином V-FITC и пропидий иодидом.
Далее мы исследовали индукцию апоптоза методом прижизненного окрашивания клеток Аннексином V-FITC в комбинации с PI для выявления популяции клеток на ранней стадии апоптоза. Исследовали одну чувствительную к кармустину линию mel IL и две резистентные к нему линии mel P и mel Rac. На чувствительной линии наблюдается индукция позднего апоптоза кармустином, а на резистентных линиях – индукция раннего апоптоза химиопрепаратом при увеличении продолжительности экспозиции. Альнорин не усиливал индукцию апоптоза кармустином при сочетанном применении. На рис. 9 представлены полученные данные по индукции апоптоза кармустином и в сочетании с альнорином на трех клеточных линиях.
Рисунок 9. Индукция апоптоза кармустином и в сочетании с альнорином на клеточных линиях меланом методом двойного прижизненного окрашивания ДНК.
При исследовании индукции апоптоза противоопухолевым препаратом дакарбазином методом прижизненного окрашивания клеток мы выявили только индукцию позднего апоптоза. При увеличении срока экспозиции клеток с препаратом усиливается индукции позднего апоптоза дакарбазином. Добавление альнорина усиливает апоптозиндуцирующее действие химиопрепарата. Процент поздних апоптотических клеток возрастает при сочетании дакарбазина с альнорином и с увеличением срока экспозиции. На рис. 10 и рис. 11 представлены полученные данные по индукции апоптоза дакарбазином и в сочетании с альнорином на трех клеточных линиях меланом
Рисунок 10. Индукция апоптоза дакарбазином и в сочетании с альнорином на трех клеточных линиях меланом методом двойного прижизненного окрашивания ДНК.
Рисунок 11. Индукция апоптоза дакарбазином и в сочетании с альнорином на двух клеточных линиях меланом методом двойного прижизненного окрашивания ДНК.
Таким образом, анализ популяций клеток после инкубации с химиопрепаратами в исследуемых концентрациях показал, что количество интактных живых клеток значительно уменьшается с увеличением концентраций химиопрепаратов и срока экспозиции. При этом соотношение ранних и поздних апоптотических или некротических клеток также зависит от этих параметров.
Кроме того, нами показано, что противоопухолевые препараты, применяемые в терапии меланомы, эффективно индуцируют процесс гибели клеточных линий по механизму апоптоза в зависимости от концентрации и времени воздействия.
Изучение экспрессии белков – продуктов генов, контролирующих апоптоз на клеточных линиях меланом.
Процесс апоптоза в клетке контролируется целым рядом белков, одни из которых индуцируют программированную клеточную гибель, тогда как другие – ингибируют её. Немаловажная роль в апоптозе принадлежит белкам семейства bcl-2 и антигену CD95. Методом иммунофлюоресценции мы исследовали на клеточных линиях меланом экспрессию СD95, bcl-2 и bax. На рис. 12 представлены средние значения из трех опытов, полученные на восьми клеточных линиях меланом с использованием коммерческих моноклональных антител CD95 DAKO. Маркер апоптоза антиген CD95 экспрессируется на всех восьми исследованных клеточных линиях меланом, кроме одной - mel Mtp.
Рисунок 12. Экспрессия CD95 на клеточных линиях меланом.
Кроме того, мы исследовали экспрессию CD95 на поверхности клеток меланом, инкубированных с противоопухолевыми препаратами и альнорином. На рис. 13 и рис. 14 показаны данные, полученные на двух клеточных линиях mel Mtp и mel Cher соответственно. CD95 был экспрессирован на поверхности 6,8% интактных клеток линии mel Mtp (рис. 13, А). После инкубации клеток с альнорином процент клеток, экспрессирующих CD95, увеличивается до 29,2% (рис. 13, B); напомним, что именно на клеточной линии mel Mtp альнорин сам вызывает индукцию апоптоза. После 24-часовой инкубации культуры клеток mel Mtp с дакарбазином экспрессия CD95 составляет 41% (рис. 13, C), а при совместной инкубации клеток с дакарбазинаом и альнорином количество CD95-экспрессирующих клеток снижается до 31,2% (рис. 13, D). Инкубация клеток этой линии c кармустином повышает количество CD95+-клеток до 76,2% (рис. 13, Е), а при сочетании кармустина с альнорином, оно снижается до 69,1%.
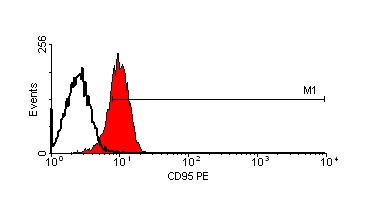



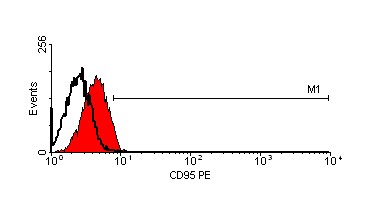
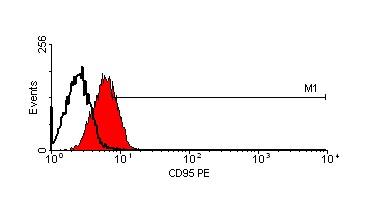
Рисунок 13. Экспрессия CD95 на клеточной линии mel MTP после инкубации с противоопухолевыми препаратами и в сочетании с альнорином.
По оси абсцисс интенсивность окрашивания клеток антителами к маркеру,
по оси ординат – количество событий.
А – контроль клеток;
B – клетки, обработанные альнорином;
C – клетки, обработанные DTIC;
D – клетки, обработанные DTIC + альнорин;
E – клетки, обработанные BCNU;
F – клетки, обработанные BCNU + альнорин.
На клеточной лини mel Сher экспрессия CD95 в интактных клетках составляет 92,1% (рис. 14, А); при инкубации с альнорином - 91,9% (рис. 14, B); при инкубации с дакарбазином количество CD95+- клеток составляет 90,6% (рис. 14, C), а при инкубации дакарбазина в сочетании с альнорином снижается до 87,9% (рис. 14, D). При инкубации клеточной линии mel Cher c кармустином экспрессия CD95 составляет 83,2% (рис. 14, Е) и при сочетании кармустина с альнорином - 83,0% (рис. 14, F).






Рисунок 14. Экспрессия CD95 на клеточной линии mel Cher после инкубации с противоопухолевыми препаратами и в сочетании с альнорином.
По оси абсцисс интенсивность окрашивания клеток антителами к маркеру,
по оси ординат – количество событий.
А – контроль клеток;
B – клетки, обработанные альнорином;
C – клетки, обработанные DTIC;
D – клетки, обработанные DTIC + альнорин;
E – клетки, обработанные BCNU;
F – клетки, обработанные BCNU + альнорин.
На рис. 15. приведены средние значения по трем опытам, об экспрессии внутриклеточных маркеров bcl-2 и bax на восьми клеточных линиях меланом с использованием соответствующих моноклональных антител.
Рисунок 15. Экспрессия bcl-2 и bax на клеточных линиях меланом.
Экспрессия bcl-2 и bax на различных клеточных линиях варьирует от 12,0±1,4% до 39,1±0,9% и от 23,4±1,1% до 94,4±2,6% соответственно. Как следует из приведенных данных, mel Mtp содержит менее всех других линий клеток, экспрессирующих антиапоптотический белок bcl-2 – 1,7±0,2%, а также и проапоптотический bax – 18,5±0,5%. Это обстоятельство так же, как и отсутствие CD95-позитивных клеток и индукция альнорином апоптоза в клетках этой меланомы может свидетельствовать об особенностях механизмов гибели этих клеток, чувствительных к цитотоксическому и апоптозиндуцирующему действию альнорина (ФНО-).
ВЫВОДЫ
- Клеточные линии меланом различаются между собой по чувствительности к цитотоксическому и апоптозиндуцирующему действию противоопухолевых препаратов. Клетки одних и тех же линий меланом обладают различной чувствительностью к разным химиопрепаратам.
- Чувствительность различных линий меланом к цитотоксическому действию противоопухолевых препаратов не совпадает с их чувствительностью к апоптозиндуцирующему действию.
- На большинстве клеточных линий меланом цитотоксическое действие кармустина и дакарбазина предшествует индукции этими химиопрепаратами апоптоза, что свидетельствует о том, что в основе начального противоопухолевого действия этих препаратов лежат неапопототические механизмы гибели опухолевых клеток.
- Чувствительность и/или резистентность клеточных линий меланом к цитотоксическому и апоптозиндуцирующему действию кармустина и дакарбазина не коррелирует с количеством клеток, позитивных по экспрессии белков CD95, bcl-2 и bax.
- Нецитотоксичные концентрации альнорина усиливают цитотоксическое действие противоопухолевых химиопрепаратов: нидрана, аранозы, кармустина и дакарбазина на клеточных линиях меланом.
- Альнорин на чувствительных линиях меланом усиливает индукцию апоптоза кармустином и дакарбазином только при низких концентрациях этих препаратов. Он не вызывает апоптозиндуцирующее действие данными препаратами на клеточных линиях, нечувствительных к индукции ими апоптоза.
- Добавление к кармустину и дакарбазину альнорина более эффективно в отношении прямого цитотоксического действия лекарств, чем в отношении индукции ими апоптоза.
Список научных трудов, опубликованных по теме диссертации.
1. Bigvava H.A. IFN and TNF enhance the cytotoxicity of antitumor drugs and apoptosis induction on melanoma cell lines / E.G.Slavina, A.I.Chertkova, O.V.Korotkova, H.A.Bigvava, A.A.Borunova, N.N.Petenko, Z.G.Kadagidze // J of Interferon and Cytokine Research. – 2007. – V. 27, №8, - P. 717-718.
2. Bigvava H.A. Cytotoxycity and apoptosis induction in melanoma cell lines by antitumor drugs: the effects of cytokines / E.G.Slavina, A.I.Chertkova, O.V.Korotkova, H.A.Bigvava, A.A.Borunova, S.L.Gutorov, L.F.Morozova, N.N.Petenko, Z.G.Kadagidze // 19th International Congress on Anti-Cancer Treatment Paris, France. – 2008. - February 5-8. - P. 352.
3. Бигвава Х.А. Цитотоксичность и индукция апоптоза в клеточных линиях меланом человека противоопухолевыми лекарствами: эффект цитокинов / Е.Г.Славина, А.И.Черткова, О.В. Короткова, Х.А.Бигвава, А.А.Борунова, С.Л.Гуторов, Л.Ф.Морозова, Н.Н.Петенко, З.Г.Кадагидзе // V-съезд онкологов и радиологов СНГ. Ташкент. – 2008. – 14 - 16 мая. – С. 63.
4. Bigvava H.A. Combination of chemotherapy and TNF- in melanoma treatment / S.L.Gutorov, M.E.Abramov, E.G.Slavina, H.A.Bigvava, A.I.Chertkova, T.N.Zabotina, A.A.Borunova, V.A.Nurtdinova // 20th International Congress on Anti-Cancer Treatment Paris, France. – 2009. - February 3-6. - P. 390-391.
5. Бигвава Х.А. Модуляция цитокинами эффективности противоопухолевых препаратов / Е.Г.Славина, А.И.Черткова, С.Л.Гуторов, М.Е.Абрамов, Х.А.Бигвава, В.А.Нуртдинова, Т.Н.Заботина, А.А.Борунова // Российский аллергологический журнал. Сборник трудов X международного конгресса «Современные проблемы аллергологии, иммунологии и иммунофармакологии», Казань. – 2009. - №3. – С. 208.
6. Бигвава Х.А.. Модификация фактором некроза опухоли (ФНО-) цитотоксического и апоптотического действия противоопухолевых лекарств в клетках меланомы человека / Е.Г.Славина, Х.А.Бигвава, Т.Н.Заботина, А.А.Борунова, Л.Ф.Морозова, А.И.Черткова, В.А.Нуртдинова, З.Г.Кадагидзе // Российский биотерапевтический журнал. – 2009. – Том 8, №4. – С. 37- 44.
7. Бигвава Х.А. Индукция цитотоксичности и апоптоза в клеточных линиях меланом при комбинировании фактора некроза опухоли (альнорин) с противоопухолевыми препаратами // Е.Г.Славина, Х.А.Бигвава, А.И.Черткова, Т.Н.Заботина, А.А.Борунова, З.Г.Кадагидзе // Российский биотерапевтический журнал. – 2010. – Том 9, №3. – С. 99-100.
8. Бигвава Х.А. Эффективность комбинирования фактора некроза опухоли (Альнорин) с противоопухолевыми препаратами на клеточных линиях меланом / Е.Г.Славина, Х.А.Бигвава, А.И.Черткова, Т.Н.Заботина, А.А.Борунова, З.Г.Кадагидзе // Российский биотерапевтический журнал. – 2011. – Том 10, №1. – С. 9-10.
9. Бигвава Х. А. Эффективность сочетания in vitro фактора некроза опухоли альфа (альнорин) с противоопухолевыми препаратами на клеточных линиях меланом / Х.А.Бигвава, А.И.Черткова, Т.Н.Заботина, А.А.Борунова, Е.Г.Славина // Медицинская иммунология. Материалы XIV Всероссийского научного форума с международным участием им. Академика В.И.Иоффе. Дни иммунологии в Санкт-Петербурге. – 2011. – Том 13, №4. - С. 306.
10. Bigvava H.A. The interaction of antitumor drugs and Tumor Necrosis Factor in cytotoxicity and apoptosis induction in melanoma cell lines / E.G.Slavina, H.A.Bigvava, A.A.Borunova, T.N.Zabotina, L.F.Morozova, Z.G.Kadagidze // Cytokine. 9th joint meeting of international cytokine society and international society for interferon and cytokine research. Florence, Italy. – 2011. – October 9-12. –V.56. Issue 1. – P. 97.
11. Бигвава Х.А. Цитотоксичность и индукция апоптоза в клеточных линиях меланом при комбинировании фактора некроза опухоли- (альнорин) с противоопухолевыми химиопрепаратами / Х.А.Бигвава, Т.Н.Заботина, А.А.Борунова, Л.Ф.Морозова, З.Г.Кадагидзе, Е.Г.Славина // Иммунология. – 2012. – Том 33. №2. – С. 72-75
12. Бигвава Х.А. Экспрессия маркеров апоптоза – СD95, Bcl-2, Bax на клеточных линиях меланом / Российский аллергологический журнал. – 2012. – №1. Вып. 1. – С. 53-54.

