Хирургическое лечение больных немелкоклеточным раком легкого с размером первичной опухоли до 3 см (т1-4): результаты, факторы прогноза
На правах рукописи
АРДЗИНБА МЕРАБ СЕРГЕЕВИЧ
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ БОЛЬНЫХ
НЕМЕЛКОКЛЕТОЧНЫМ РАКОМ ЛЕГКОГО С РАЗМЕРОМ
ПЕРВИЧНОЙ ОПУХОЛИ ДО 3 СМ (Т1-4):
РЕЗУЛЬТАТЫ, ФАКТОРЫ ПРОГНОЗА
14.01.12 – онкология
А В Т О Р Е Ф Е Р А Т
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2011
Работа выполнена в Учреждении Российской академии медицинских наук Российском онкологическом научном центре им. Н.Н.Блохина РАМН (директор – академик РАН и РАМН, профессор М.И. Давыдов).
Научный руководитель:
доктор медицинских наук, профессор Б.Е. ПОЛОЦКИЙ
Официальные оппоненты:
доктор медицинских наук, профессор В.С. МАЗУРИН
доктор медицинских наук, профессор А.С. ЯГУБОВ
Ведущее учреждение:
Московский государственный медико-стоматологический университет МЗ СР РФ
Защита диссертации состоится « » 2011 года в 14 часов
на заседании диссертационного совета (Д. 001.017.01) РОНЦ им. Н.Н.Блохина РАМН (Москва 115478, Каширское шоссе, 24).
С диссертацией можно ознакомиться в библиотеке Российского онкологического центра им. Н.Н.Блохина РАМН.
Автореферат разослан « » 2011 г.
Ученый секретарь Диссертационного совета,
Доктор медицинских наук, профессор Ю.В.ШИШКИН
Общая характеристика работы
Актуальность темы. Заболеваемость и смертность от рака легкого продолжает неуклонно расти, а результаты, основного радикального метода лечения – хирургического, в целом остаются малоудовлетворительными.
Интегрирующими факторами группового прогноза хирургического лечения являются распространенность опухоли (оценка первичного очага, лимфогенное и отдаленное метастазирование), сведения о гистологической форме опухоли, степени дифференцировки ее клеток. Однако сегодня изучение только этих характеристик новообразования, и в частности немелкоклеточного рака легкого, не удовлетворяет онкологов, поскольку не обеспечивает должный уровень индивидуального прогнозирования и, следовательно, адекватный послеоперационный мониторинг и последующее лечение. Именно поэтому актуальность изучения молекулярно-биологических и генетических особенностей опухоли не вызывает сомнений.
В настоящее время, очевидно, что результаты лечения больных немелкоклеточным раком легкого можно прогнозировать с большей степенью вероятности. Эта возможность появилась благодаря развитию новых экспериментальных методик, позволяющих исследовать факторы, влияющие на рост опухоли, ее метастатический потенциал и степень дифференцировки.
Вышеизложенное подчеркивает актуальность проблемы, а полученные данные позволяют определить научно обоснованные показания к выбору тактики лечения и как следствие – повысить его эффективность.
Цель исследования – улучшение и совершенствование индивидуального прогнозирования результатов хирургического лечения больных НМРЛ с размером первичного очага до 3 см на основе изучения его морфологических и молекулярно-биологических особенностей.
Для достижения цели были поставлены следующие задачи:
1. Изучить закономерность лимфогенного внутригрудного метастазирования у больных НМРЛ с размером первичного очага до 3 см в зависимости от гистогенеза и размера опухоли.
2. Проанализировать общую выживаемость радикально оперированных больных НМРЛ с размером первичного очага до 3 см.
3. Оценить наличие индивидуальных молекулярно-генетических характеристик опухоли у больных НМРЛ с размером первичного очага до 3 см.
4. Определить влияние экспрессии биомолекулярных и генетических маркеров у больных НМРЛ с размером первичного очага до 3 см: факторов апоптоза (p53, Bcl2, Bax), фактора роста эндотелия сосудов (VEGF), плоидности опухоли, количества клеток в S-фазе клеточного цикла на прогноз течения заболевания.
5. Разработать рекомендаций по индивидуализации лечебной тактики больных НМРЛ с размером первичного очага до 3 см с учетом клинических и биологических особенностей первичной опухоли.
Научная новизна
1. Анализ частоты и характера метастазирования НМРЛ до 3 см позволил констатировать биологическую предопределенность агрессивности метастатического потенциала опухоли.
2. Оценена значимость наличия внутригрудного лимфогенного метастазирования для выживаемости больных НМРЛ с размерами опухоли до 3 см: наиболее неблагоприятным фактором является поражение медиастинальных лимфатических узлов.
3. На основе изучения корреляции между частотой определения онкомаркеров p53, VEGF, Bcl-2, Bax, плоидностью опухоли и числом клеток в s-фазе клеточного цикла с течением немелкоклеточного рака легкого у больных с размером первичного очага до 3 см после радикального лечения обозначены молекулярно-генетические критерии индивидуальной злокачественности опухоли.
4. Оптимизирована лечебная тактика послеоперационного мониторинга радикально оперированных больных НМРЛ с размером первичного очага до 3 см и созданы предпосылки для рационального выбора послеоперационного лечения.
Практическая значимость исследования
В результате проведенного исследования изучены отдельные молекулярно-генетические факторы прогноза течения НМРЛ у больных с размерами опухоли до 3 см и определена их значимость в индивидуальном прогнозировании течения заболевания. Возможно их поэтапное исследование у больных без регионарных лимфогенных метастазов для выделения групп пациентов с неблагоприятным биологическим прогнозом. Проведено сравнение аденогенного и плоскоклеточного рака по вышеперечисленным факторам.
В работе доказано, что с учетом высокого метастатического потенциала немелкоклеточного рака легкого, даже при относительно малых размерах опухоли, необходимо выполнение адекватной систематической медиастинальной лимфодиссекции, так, частота выявления лимфогенных метастазов в группе пациентов с опухолью до 1см составила 36,8%. Полученные данные позволили улучшить послеоперационный мониторинг и оптимизировать подходы к неоадъювантной и адъювантной терапии больных НМРЛ.
Апробация диссертации состоялась 4 декабря 2009 года на совместной научной конференции с участием хирургического торакального отделения торако-абдоминального отдела, отделения диагностики опухолей, отделения абдоминальной онкологии, патологоанатомического отделения, поликлинического отделения РОНЦ им. Н.Н.Блохина РАМН, кафедры онкологии лечебного факультета ММА им. И.М.Сеченова.
Публикации. По теме диссертации опубликовано 11 печатных работ.
Объем и структура диссертации
Диссертация построена по традиционному стилю и состоит из введения, четырех глав, включающих литературный обзор, материалы и методы, две главы по результатам исследования, а также заключение, выводы и список литературы, содержащий 187 источников, из которых 44 — отечественных и 143 — зарубежных авторов. Работа представлена на 155 страницах машинописного текста, иллюстрирована 46 таблицами и 37 рисунками.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы. Материалом для наших исследований послужили наблюдения за 611 больными немелкоклеточным раком легкого с размером первичного очага до 3 см, оперированными в хирургическом торакальном отделении РОНЦ им. Н.Н. Блохина РАМН за период 1970–2005 г.
Гистологическая структура опухоли определялась при исследовании операционного материала на основе общепринятой классификации, рекомендованной Всемирной Организацией Здравоохранения (2004 г.).
Таблица 1
Сравнительная оценка локализации и частоты метастазирования в регионарные лимфатические узлы у больных ПРЛ, АК и БАР легкого
| Гистологическая форма | Всего | Регионарное метастазирование | |||
| без mts (N0) | mts в л/у корня легкого (N1) | mts в л/у средостения (N2) | N3 | ||
| ПРЛ | 373 (100%) | 231 (61,9%) | 87 (23,4%) | 54 (14,5%) | 1 (0,2%) |
| АК | 198 (100%) | 124 (52,7%) | 34 (17,1%) | 40 (20,2%) | |
| БАР | 22 (100%) | 19 (86,5%) | 1 (4,5%) | 2 (9,0%) | |
| ВСЕГО | 593 (100%) | 374 (63,2%) | 122 (20,5%) | 96 (16,1%) | 1 (0,2%) |
Из 611 пациентов, мужчин было 497 (81,4%), женщин – 114 (18,6%), соотношение – 4,3: 1. Возраст пациентов варьировал от 28 до 78 лет.
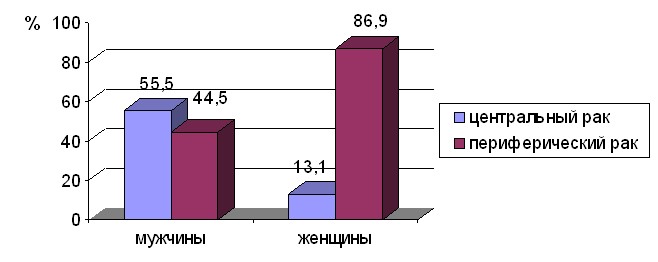
Рис. 1. Распределение по клинико-анатомической форме НМРЛ
в зависимости от пола пациентов
Центральный рак выявлен у 291 (47,6%), периферический – у 320 (52,4%) человек. У мужчин центральный рак встречался в 55,5% наблюдений (276 больных), периферический – в 44,5% (221 человек), у женщин центральный рак составил 13,1% (15 пациенток), периферический рак – 86,9% (99 человек).
Высоко-, умеренно- и низкодифференцированные формы плоскоклеточного рака легкого отмечены в исследуемой группе пациентов в соотношении: 3,9 : 8,9 : 1. При аденокарциномах данное соотношение составило 1,3 : 26 : 1. При центральной локализации опухолевого поражения: аденогенный рак составил 10,1%, а при периферической – 59,4% наблюдений.
Распространенность опухолевого поражения соответствующая
Т1-3N0M0 имели 374 пациента (63,2%); Т1-3N1M0 – 122 (20,5%); Т1-3N2M0 – 96 (16,1%), Т1-3N3M0 – 1 (0,2%).
Объем оперативного вмешательства планировался в зависимости от распространенности опухолевого процесса. В анализе не учитывались оперативные вмешательства в объеме краевой резекции и сегментэктомии легкого. Таким образом из 544 радикальных операций лоб- и билобэктомии составили 357 (65,6%), пневмонэктомии – 187 (34,4%).
Основным источником информации о дальнейшем развитии заболевания являлись амбулаторные карты, в которых содержатся сведения о результатах периодических осмотров, и сведения из компьютерного банка данных организационного методического отдела РОНЦ им. Н.Н. Блохина РАМН.
ХАРАКТЕРИСТИКА РЕГИОНАРНОГО МЕТАСТАЗИРОВАНИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Уровень метастатического поражения внутрилегочных, корневых и медиастинальных лимфатических узлов позволяет стадировать опухолевый процесс, определить объем хирургического вмешательства, в ряде случаев пересмотреть лечебную тактику в пользу комбинированного или комплексного лечения.
Особенности лимфодинамики центральных и периферических отделов легкого очевидны, а пути метастазирования при различных клинико-анатомических формах своеобразны. Это заставляет рассматривать регионарное метастазирование раздельно для центрального и периферического рака легкого.
Центральный рак
Таблица 2
Регионарное метастазирование центрального НМРЛ
в зависимости от размера первичной опухоли
| Регионарное метастазирование | Размер опухоли | Всего | ||
| < 1 см | 1–1,9 см | 2–3 см | ||
| N0 | 8 (53,4%) | 31 (60,7%) | 37 (53,6%) | 76 (56,3%) |
| N+ | 7 (46,6%) | 20 (39,3%) | 32 (46,4%) | 59 (43,7%) |
| N1 | 5 (33,3%) | 8 (15,7%) | 17 (24,6%) | 30 (22,2%) |
| N2 | 2 (13,3%) | 12 (23,6%) | 15 (21,8%) | 29 (21,7%) |
| Всего (N0;N1;N2) | 15 (100%) | 51 (100%) | 69 (100%) | 135 (100%) |
В результате анализа характера и структуры регионарного лимфогенного метастазирования центрального НМРЛ с размерами первичного очага до 3 см, выявлены следующие закономерности:
- частота поражения внутригрудных лимфатических узлов в целом не зависит от стороны опухолевого поражения;
- правосторонняя верхнедолевая локализация характеризуется наиболее частым метастатическим поражением внутригрудных лимфоколлекторов (55,9%);
- наименьшая реализация метастатического потенциала отмечалась при нижнедолевой локализации, независимо от стороны поражения (37,5% справа и 39,9% слева);
- поражение более крупного бронха (от сегментарного к главному) коррелирует с повышением метастатической активности опухоли;
- лишь при локализации опухоли в главном бронхе выявляется преобладание поражения медиастинальных лимфатических узлов над изолированным поражением N1.
- с увеличением значения символа «Т» возрастает частота метастазирования во внутригрудные лимфоузлы;
- первичная опухоль, соответствующая символу «Т3» достоверно чаще метастазирует в медиастинальные лимфоколлекторы;
- в целом, умеренно дифференцированные опухоли характеризуется более высоким метастатическим потенциалом, чем опухоли с высокой и низкой дифференцировкой, независимо от гистогенеза;
- опухоли до 1см характеризуются наименьшим метастатическим поражением медиастинальных лимфатических узлов (13,3%);
Периферический рак
Таблица 3
Регионарное метастазирование периферического рака
в зависимости от размера первичного опухолевого очага
| Регионарное метастазирование | Размер опухоли | Всего | ||
| До 1 см | 1–2 см | 2–3 см | ||
| N0 | 7 (77,8%) | 54 (75%) | 47 (55,9%) | 108 (65,5%) |
| N+ | 2 (22,2%) | 18 (25%) | 37 (44%) | 57 (34,5%) |
| N1 | - | 8 (11,1%) | 21 (25%) | 29 (17,6%) |
| N2 | 2 (22,2%) | 10 (13,9%) | 16 (19%) | 28 (16,9%) |
| Всего (N0;N1;N2) | 9 (100%) | 72 (100%) | 84 (100%) | 165 (100%) |
В результате анализа характера и структуры лимфогенного метастазирования периферического рака легкого с размером опухоли до 3 см выявлены следующие закономерности:
- сторона опухолевого поражения не влияет в целом на частоту метастазирования в регионарные лимфоколлекторы, однако при правосторонней локализации достоверно чаще выявляются метастазы в медиастинальные лимфатические узлы (N2);
- при правосторонней верхнедолевой локализации метастазы N2 выявляются достоверно чаще (23,9%);
- первичная опухоль, соответствующая символу «Т3» достоверно чаще метастазирует в медиастинальный лимфоколлектор (33,3%);
- при размере первичной опухоли 2–3 см. достоверно чаще выявлялось метастатическое поражение внутригрудных лимфоколлекторов (44%), в большей степени за счет N1 (25% общего числа наблюдений);
- низкодифференцированные аденокарциномы характеризуются более высоким метастатическим потенциалом, чем высоко- и умереннодифференцированные.
Сравнивая внутригрудное лимфогенное метастазирование при периферическом и центральном НМРЛ с размером первичной опухоли до 3 см, необходимо отметить:
- при центральном раке частота N+ не зависела от размера первичного очага, а при периферическом только опухоли от 2 до 3 см были сопоставимы по частоте метастазирования с центральным;
- при периферическом раке размером до 2 см метастазирование во внутригрудные лимфатические узлы выявлялось в 1,8 раза реже, сем при центральном;
- при центральном и периферическом раке частота выявления метастазов в лимфоколлекторы первого и второго порядка была сопоставима.
Сравнительная оценка регионарного метастазирования аденогенного и плоскоклеточного рака с размером первичной опухоли до 3 см
Оценены ретроспективные данные о 271 больном аденокарциномой и плоскоклеточным раком легкого, получивших хирургическое лечение в хирургическом торакальном отделении РОНЦ им. Н.Н. Блохина РАМН с 1985 г. по 2005 г. Соотношение центрального (135 пациентов) и периферического (165 человек) рака составило – 1:1,2.
- при периферическом раке отсутствие поражения регионарных лимфатических узлов встречается с сопоставимой частотой при плоскоклеточной и аденогенной форме – в 59,6% и 55,3% случаев соответственно (р<0,5), тогда как при центральной локализации этот показатель почти в 2 раза выше при плоскоклеточной форме – 73,1% (р<0,01);
- метастазирование в лимфоколлекторы уровня N1 при периферическом плоскоклеточном раке и аденогенной форме сопоставимо, тогда как при центральной аденокарциноме легкого бронхопульмональные и лимфоузлы корня легкого поражаются в 2 раза чаще (р<0,05);
Таблица 4
Регионарное метастазирование центрального и периферического рака
| Регионарное метастазирование (N) | Плоскоклеточный рак | Аденогенный рак | ||
| периферический | центральный | периферический | центральный | |
| N0 | 42 (59,6%) | 68 (73,1%) | 47 (55,3%) | 5 (38,5%) |
| N+ | 16 (40,45) | 47 (26,9%) | 38 (44,7%) | 8 (61,5%) |
| N1 | 11 (14,9%) | 26 (14,2%) | 16 (18,8%) | 1 (7,7%) |
| N2 | 5 (25,5%) | 21 (12,7%) | 22 (25,9%) | 7 (53,8%) |
| Всего (N0;N1;N2) | 58 (100%) | 115 (100%) | 85 (100%) | 13 (100%) |
- при периферической локализации метастазирование в медиастинальные лимфатические узлы выявляется у четверти больных независимо от гистологической формы;
- анализ метастазирования рака центральной локализации в лимфоколлекторы второго уровня показал, что при аденогенном раке поражение медиастинальных лимфатических узлов отмечается в 4,2 раза чаще, чем при плоскоклеточном (р<0,01);
- частота метастазирования во внутригрудные лимфатические узлы при плоскоклеточном раке не зависит от размера первичного очага.
- при аденокарциноме в случаях, когда первичная опухоль была до 1 см. и 1–2 см. частота метастазирования достоверно ниже 37% и 33% соответственно, чем при опухолях 2–3 см — 66% (р<0,02);
- при сопоставлении агрессивности метастазирования в зависимости от гистогенеза умереннодифференцированных опухолей выявлено: метастатическое поражение внутригрудных лимфатических узлов при аденокарциноме выявлено в 46% случаев, а при плоскоклеточном в 40,3% наблюдении (разница статистически недостоверна). Однако, если при плоскоклеточном раке превалировало поражение лимфоузлов уровня N1 над N2: 26,1% к 14,2% (р<0,02) соответственно, то при аденокарциноме картина оказалась прямо противоположной, хотя и не носила достоверного характера 19,5% к 26,8% соответственно (р<0,2).
ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО
ЛЕЧЕНИЯ НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
С РАЗМЕРОМ ПЕРВИЧНОЙ ОПУХОЛИ ДО 3 СМ
Для получения достоверных результатов хирургического лечения рассмотрено значение наиболее важных параметров первичной опухоли (размер, дифференцировка, значение символа «Т», локализация в легком, клинико-анатомическая форма) и местно-регионарной распространенности опухолевого процесса (прежде всего, поражение внутригрудных лимфатических узлов и соседних анатомических структур).
Из анализа исключены случаи послеоперационной летальности, смерти от неизвестной причины, от сопутствующего заболевания, от ПМЗО другой локализации. Изучено 491 клиническое наблюдение за больными немелкоклеточным раком легкого, радикально оперированными в хирургическом торакальном отделении РОНЦ им. Н.Н. Блохина РАМН и прослеженными в отдаленные сроки наблюдения.
По нашим данным более 1 года после радикального хирургического лечения прожили 89,8%, более 3 лет – 58,6% и 5 лет – 48,9% больных немелкоклеточным раком легкого. Таким образом, первые 3 года после операции являются критическим сроком, поскольку 76,6% пациентов, переживших этот срок, живут более 5 лет.
Отдаленные результаты: НМРЛ до 3 см (общая выживаемость)
Анализ наших наблюдений подтвердил влияние выхода опухолевого процесса на висцеральную плевру (IВ стадия) на результаты общей выживаемости. В группах наблюдения с IА стадией показатели 5-летней выживаемости были выше, в сравнении с аналогичным показателем у пациентов с IВ стадией 69,7% и 51,1% соответственно (р<0,05).
Оценка влияния уровня поражения регионарных лимфатических узлов без учета значения символа «Т» на результаты лечения выявила, что максимальная 5-летняя выживаемость отмечалась в группе N0 и составила 52,6%. По мере возрастания значения символа «N» данный показатель прогрессивно падал при N1 до 28,7%, а при N2 – до 26,7% (разница статистически достоверная для N0 к N1 и N2 р<0,05). Полученный результат позволяет считать уровень метастазирования во внутригрудные лимфатические узлы независимым, значимым фактором прогноза результатов радикального хирургического лечения больных НМРЛ.
Констатировано отсутствие статистических различий в показателях общей выживаемости больных в зависимости от локализации опухоли и стороны поражения. При анализе выживаемости с учетом стадии процесса, эти клинические параметры прогнозирования теряют свою актуальность.
Изучено влияние размера первичной опухоли на результаты лечения. Полученные данные позволили выявить достоверные различия в показателях общей выживаемости лишь при сравнении больных с опухолями 2–3 см и
0–1 см (40,6% и 55,8% соответственно р<0,05) при сравнении других групп достоверных различий не получено, вероятно в связи с неоднородностью групп по характеристикам метастазирования. Необходимо отметить отсутствие достоверных различий в общей 5-летней выживаемости у пациентов с опухолью до 2 см – 46,1% и 2–3 см – 40,6% (р>0,5). Однако разница медианы в этих подгруппах составила 11 месяцев.
При сопоставимой распространенности НМРЛ по лимфатическим узлам оказалось, что при N0 сохраняются достоверные различия в показателях 5-летней выживаемости у пациентов с размером первичной опухоли до 1 см по отношению к группе с максимальным размером опухоли 2–3 см – 69,2:49,7%% соответственно (р<0,05). В тоже время общая выживаемость при N+ не зависела от размера первичной опухоли, и 5-летняя выживаемость составила 31,6: 28,1: 28,1%% соответственно. Внутри всех групп, с одинаковым максимальным размером опухоли, показатели 5-летней выживаемости у больных с N0 и N+ оказались достоверно различны.
Таблица 5
Общая выживаемость больных НМРЛ в зависимости от размера опухоли
и значения символа N
| Размер опухоли | N (число больных) | Выживаемость (%) | Медиана (мес.) | ||||
| 3 года | 5 лет | ||||||
| 0–1 | N0 (26) | 80,3(%) | 69,2(%) | 117 | |||
| N+ (13) | 57,2(%) | 31,6(%) | 49 | ||||
| 1,1–2 | N0 (126) | 72,1(%) | 52,3(%) | 65 | |||
| N+ (58) | 47,4(%) | 28,1(%) | 33 | ||||
| 2,1–3 | N0 (160) | 61,2(%) | 49,7(%) | 56 | |||
| N+ (105) | 37,3(%) | 28,1(%) | 25 | ||||
Степень дифференцировки опухолевого процесса является значимым прогностическим фактором только при наличии лимфогенных метастазов. При N0 степень дифференцировки утрачивает свое прогностическое значение.
Не менее важным прогностическим фактором является гистогенез первичной опухоли. Изучено его влияние в сочетании с размером и регионарным метастатическим статусом. Оказалось, что при аденокарциноме пациенты без регионарных лимфатических метастазов демонстрируют приблизительно одинаковую общую 5-летную выживаемость в подгруппах от 1 до 2 см и от 2 до 3 см – 50,7% и 46,2% соответственно. Аналогичные показатели в данных подгруппах зарегистрированы и для плоскоклеточного рака – 51,3% и 50,6% соответственно. Обращает на себя внимание лучшая общая 5-летняя выживаемость у пациентов плоскоклеточным раком легкого без регионарных метастазов с размером первичной опухоли менее 1 см – 65,3% (р<0,5) При лимфогенном метастазировании (N+) показатель общей выживаемости внутри подгрупп с одинаковой гистологической формой достоверно не различался. Однако N+ при аденокарциноме был значимо худшим прогностическим фактором, чем при плоскоклеточном раке.
Таблица 6
Общая выживаемость больных НМРЛ в зависимости от
распространенности опухолевого процесса и гистологической формы
| Размер | Гистологическая форма | N (число больных) | Выживаемость (%) | Медиана (мес.) | |
| 3 года | 5 лет | ||||
| 0–1 | Плоскоклеточный (29) | N0 (20) | 78,4% | 65,3% | 170 |
| N+ (9) | 66,7% | 44% | 59 | ||
| Аденокарцинома (8) | N0 (4) | 100% | 100% | - | |
| N+ (4) | 50% | - | 34 | ||
| 1,1–2 | Плоскоклеточный (96) | N0 (64) | 71,8% | 51,3% | 67 |
| N+(33) | 52,7% | 35,5% | 36 | ||
| Аденокарцинома (73) | N0 (50) | 70,3% | 50,7% | 67 | |
| N+ (23) | 37,8% | 9,4 | 50 | ||
| 2,1–3 | Плоскоклеточный (172) | N0 (101) | 58,8% | 50,6% | 64 |
| N+ (71) | 40,1% | 34,3% | 31 | ||
| Аденокарцинома (75) | N0 (47) | 59,8% | 46,2% | 52 | |
| N+ (28) | 37% | 18% | 20 | ||
Оценка результатов лечения больных НМРЛ после лоб- и пневмонэктомий со сходной распространенностью опухолевого процесса не выявила статистически значимых различий в выживаемости. Данный факт может служить весомым аргументом в пользу выполнения лобэктомий, как более функциональных вмешательств, при условии их радикальности.
Одним из определяющих факторов, влияющих на результаты лечения, является объем хирургического вмешательства на путях лимфооттока. Операции с систематической лимфодиссекцией (указаны как «СМЛ») позволяют повысить радикализм хирургического вмешательства, а также адекватно стадировать опухолевый процесс по лимфатическим узлам.
Анализ влияния объема хирургического вмешательства при сопоставимой распространенности опухоли на общую выживаемость выявил, что достоверными оказались различия в 5-летней выживаемости больных с N0 (49,3% – без СМЛ и 62,8% – с СМЛ р<0,02) и N1 (24,1% – без СМЛ и 41,7% – с СМЛ; р<0,05).
Таблица 7
Общая выживаемость больных НМРЛ в зависимости от
характера хирургического вмешательства и символа N
| Стадия | Характер и количество операций | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| N0 | без СМЛ(208) | 93,9% | 65,6% | 49,3% |
| СМЛ (104) | 93,6% | 71% | 62,8% | |
| N1 | без СМЛ (59) | 84,6% | 40,4% | 24,1% |
| СМЛ (41) | 78,4% | 40,4% | 41,7% | |
| N2 | без СМЛ (20) | 84,6% | 63,2% | 27,6% |
| СМЛ (55) | 82% | 39,7% | 28,9% | |
| N+ | без СМЛ (79) | 84,6% | 46% | 27,4% |
| СМЛ (96) | 80,6% | 39,6% | 32% | |
У больных с N2 достоверных различий в показателях 5-летней выживаемости при выполнении операции без СМЛ и с СМЛ не было, однако объем вмешательств с СМЛ позволяет адекватно стадировать опухолевый процесс и избежать ошибок в прогнозе течения заболевания и выборе лечебной тактики.
Таким образом, выполнение операции с СМЛ у больных раком легкого не только целесообразно, но и необходимо, поскольку определение стадии опухолевого процесса в этом случае основывается на фактическом материале, а не на методе допущения. Это дает возможность не только правильно оценить распространенность опухолевого процесса, выбрать верную тактику лечения, провести профилактику местного метастазирования, но и повысить точность прогнозирования результатов хирургического лечения.
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ НМРЛ И ИХ ИСПОЛЬЗОВАНИЕ В ПРОГНОЗИРОВАНИИ РЕЗУЛЬТАТОВ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
Материалом для исследования послужили наблюдения за 66 больными немелкоклеточным раком легкого, оперированными в хирургическом торакальном отделении РОНЦ им. Н.Н. Блохина РАМН, и результаты изучения молекулярно-генетических факторов в клетках опухоли: экспрессии мутантного р53, bcl-2, bax, VEGF, плоидности клеток опухоли, количества клеток опухоли в S-фазе клеточного цикла.
При оценке общей пятилетней выживаемости были выделены две группы: I – 34 человека, переживших 5 лет, II – 32 человека, умерших от прогрессирования в течение этого срока наблюдения. Анализ клинико-морфологических характеристик выявил отсутствие достоверных различий как в когорте без учета распространенности опухолевого процесса, так и подгруппах без метастазов и с поражением внутригрудных лимфатических узлов, что позволило адекватно оценить значимость молекулярно-биологических маркеров в прогнозировании течения рака легкого.
Экспрессия мутантного р53 в клетках опухоли
Экспрессия мутантного р53 изучена иммуногистохимическим методом (использовали антитела, специфичные только к мутантному белку). Экспрессия была выявлена в 60,6% случаев (р53(+)), а отсутствие — в 39,4% (р53(-)).
Нарушение механизмов апоптоза благоприятствует прогрессированию опухолевого процесса, поэтому пациенты, не имевшие мутантного р53, были выделены в группу с благоприятным прогнозом, а с наличием мутантного р53 – в группу с неблагоприятным прогнозом.
Экспрессия мутантного р53 является неблагоприятным фактором прогноза независимо от значения символа «N». Так при экспрессии этого маркера в группе пациентов с N0 5-летняя выживаемость составила – 51,9%, а с «N+» – 33,3% (р<0,2).
В тоже время в наблюдениях, когда экспрессия р53 не выявлялась, факт поражения внутригрудных лимфатических узлов приобретал приоритетное значение. Выживаемость в группе N0 была достоверно выше, чем у пациентов с метастазами в регионарных лимфоузлах 76,7% и 31,4% соответственно (р<0,05).
Анализ наблюдений без метастазов во внутригрудных лимфатических узлах выявил следующую закономерность: пациенты с экспрессией мутантного р53 имели достоверно худший показатель 5-летней выживаемости (51,9%), чем больные без экспрессии (76,7%) – р<0,05.

Рис. 2. Выживаемость больных НМРЛ без метастазов после хирургического лечения в зависимости от экспрессии р53
Изучение экспрессии мутантного р53 можно рекомендовать:
- в группе пациентов без метастазов в регионарные лимфоколлекторы (по материалам гистологического исследования удаленного препарата – рTNM) для решения вопроса о целесообразности проведения адъювантной терапии (экспрессия мутантного р53).
Экспрессия bcl-2 и Bax на клетках опухоли
Иммуногистохимическим методом изучена экспрессия bcl-2 и Вах на клетках немелкоклеточного рака легкого. Экспрессия bcl-2 была выявлена в 22,7% случаев (15 их 66 наблюдений), а экспрессия Вах — в 57,6% наблюдений.
По материалам нашего исследования в настоящее время определение экспрессии bcl-2 и Вах нельзя рекомендовать для проведения монофакторного прогнозирования результатов лечения НМРЛ при любой распространенности опухолевого процесса.
Экспрессия VEGF в клетках опухоли
Иммуногистохимическим методом изучена экспрессия VEGF на клетках немелкоклеточного рака легкого. Экспрессия была выявлена в 45,5% случаев. Выраженный ангиогенез способствует быстрому росту опухоли и более активному метастазированию. Изучена 5-летняя выживаемость в группах больных с экспрессией сосудистого фактора роста эндотелия и без неё.
Экспрессия VEGF является неблагоприятным фактором прогноза независимо от значения символа «N». Так при экспрессии этого маркера в группе пациентов с N0 5-летняя выживаемость составила – 41,8%, а с «N+» – 8,9%.

Рис. 3. Выживаемость больных НМРЛ без метастазов
после хирургического лечения в зависимости от экспрессии VEGF
Анализ наблюдений без метастазов во внутригрудные лимфатические узлы выявил следующую закономерность: пациенты с экспрессией VEGF имели достоверно худший показатель 5-летней выживаемости (41,8%), чем больные без экспрессии (75,4%) – р<0,05.
Определение экспрессии VEGF можно рекомендовать:
- в группе пациентов без метастазов в регионарных лимфоколлекторах (по материалам гистологического исследования удаленного препарата – рTNM) для решения вопроса о необходимости проведения адъювантной терапии (экспрессия VEGF);
- по биопсийному бронхоскопическому материалу до операции – целесообразность неоадъювантного лечения (экспрессия VEGF) даже в случае отсутствия поражения внутригрудных лимфоузлов по клинико-рентгенологическим данным (сTNM).
Плоидность клеток опухоли
С помощью ДНК-проточной цитофлуорометрии определена плоидность
опухоли у 55 больных немелкоклеточным раком легкого: 38,2% – диплоидные опухоли, 61,8% – анеуплоидные опухоли. Отмечено приблизительно одинаковое распределение больных по локализации, клинико-анатомической форме и объему оперативного вмешательства и т.д.
Анеуплоидия клеток опухоли является неблагоприятным фактором прогноза независимо от значения символа «N». Так, в случаях анеуплоидной опухоли в группе пациентов с N0 5-летняя выживаемость составила – 38,8%, а с «N+» – 27,2% (р<0,5).

Рис. 4. Выживаемость больных НМРЛ без метастазов после
хирургического лечения в зависимости от плоидности опухоли
Анализ группы больных без метастазов во внутригрудных лимфатических узлах выявил следующую закономерность: у пациентов с диплоидными опухолями достоверно лучший показатель 5-летней выживаемости (93,7%), чем с анеуплоидными (38,8%), р<0,01.
Изучение плоидности в клетках опухоли можно рекомендовать:
- в группе пациентов без метастазов в регионарных лимфоколлекторах (по материалам гистологического исследования удаленного препарата – рTNM) для решения вопроса о необходимости проведения адъювантной терапии (анеуплоидные опухоли);
- по биопсийному бронхоскопическому материалу (до операции) – целесообразность неоадъювантного лечения (анеуплоидия опухоли) даже в случае отсутствия поражения внутригрудных лимфоузлов по клинико-рентгенологическим данным (сTNM).
Определение процента клеток опухоли в S-фазе клеточного цикла
В работе подсчет процента клеток опухоли в S-фазе клеточного цикла выполнялся с помощью специальной компьютерной программы MultiCycle (Phoenix Flow Systems, США) и по методике определения содержания ДНК методом лазерной проточной цитофлуорометрии.

Рис. 5. Выживаемость больных НМРЛ без метастазов после
хирургического лечения в зависимости от процента клеток в S-фазе
Определение процента клеток в S-фазе клеточного цикла является значимым фактором прогноза течения НМРЛ. Превышение пороговой величины 10% коррелирует с худшими показателями выживаемости больных.
Определение процента клеток в S-фазе митотического цикла целесообразно выполнять:
- по биопсийному бронхоскопическому материалу до операции – для решения вопроса о проведении неоадъювантной терапии у больных с опухолями, имеющими более 10% клеток в S-фазе;
- всем больным, независимо от стадии опухолевого процесса, по материалам гистологического исследования удаленного препарата (рTNM) для решения вопроса о проведения адъювантной терапии у пациентов, имеющих более 10% клеток опухоли в S-фазе клеточного цикла.
С учетом полученных данных больным с наличием даже одного неблагоприятного биологического фактора прогноза целесообразно проведение комбинированного лечения даже при отсутствии лимфогенного метастазирования.
ВЫВОДЫ
1. Немелкоклеточный рак легкого до 3 см обладает высоким метастатическим потенциалом. Внутригрудные лимфогенные метастазы выявлены у 38,7% оперированных, из них у половины наблюдалось метастатическое поражение медиастинальных лимфатических узлов (N2).
2. Опухоли размером до 3 см при центральном и периферическом НМРЛ метастазировали в лимфатические узлы уровня N1 и N2 одинаково часто (22,2 и 21,5%% соответственно – центральная локализация, 17,6 и 16,9%% соответственно – периферическая локализация).
3. Метастазирование при периферическом плоскоклеточном и аденогенном раке выявляется с сопоставимой частотой в 40,4% и 44,7% случаев. Соответственно, для центрального рака этот показатель при плоскоклеточной форме почти в 2 раза ниже (26,9%), чем при аденокарциноме (61,5%) (р<0,01).
4. При выполнении радикальных операций с систематической медиастинальной лимфодиссекцией (СМЛ) 5-летняя выживаемость больных НМРЛ с размером первичной опухоли до 3 см. составила: при N0 – 62,8%; N1 – 41,7%; N2 – 28,9%.
5. Сравнение результатов хирургического лечения «СМЛ» вмешательств с операциями без «СМЛ» выявило достоверные различия в общей 5-летней выживаемости больных с N0 (62,8% к 49,3% р <0,02) и N1(41,7% к 24,1% р<0,05).
6. При НМРЛ до 3 см частота неблагоприятных молекулярно-генетических факторов составила: экспрессия мутантного р53 — 60,6% и VEGF — 45,5%, отсутствие экспрессии Вах — 42,4%, анеуплоидия клеток опухоли — 61,8% и более 10% клеток в S-фазе — 29,3%.
7. В монофакторном анализе наличие благоприятных молекулярно-генетических факторов коррелирует с достоверным улучшением показателя общей 5-летней выживаемости только у больных без метастазов:
– отсутствие экспрессии мутантного р53 (с 51,9 до 76,7%%);
– отсутствие экспрессии VEGF (с 41,8 до 75,4%%);
– диплоидия клеток опухоли (с 38,8 до 93,7%%);
– низкий процент клеток в S-фазе (с 16,6 до 78,7%%).
8. При наличии одного и более неблагоприятных биологических факторов прогноза (экспрессия мутантного р53, VEGF, анеуплоидия опухоли, более 10% клеток в S-фазе) целесообразно проведение комбинированного лечения даже при отсутствии лимфогенного метастазирования.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
1. Стандартом хирургического лечения на путях лимфооттока при операциях по поводу рака легкого даже с размером опухоли до 3 см должна являться систематическая медиастинальная лимфодиссекция.
2. «Расширенными» следует считать операции с контралатеральной и более (шейно-медиастинальной) лимфодиссекцией, выполнение систематической медиастинальной лимфодиссекции является «стандартным» объемом оперативного вмешательства.
3. При условии соблюдения радикальности вмешательства и адекватности внутригрудной лимфодиссекции целесообразно выполнение лобэктомии, как более функциональной операций, характеризующейся аналогичными с пневмонэктомией отдаленными результатами.
4. Адекватное, индивидуальное прогнозирование результатов хирургического лечения у больных НМРЛ с размером опухоли до 3 см возможно лишь с привлечением в анализ биологических параметров опухоли.
5. У больных НМРЛ без метастазов оправданно поэтапное изучение молекулярно-генетических факторов.
6. Индивидуальное биологическое прогнозирование должно базироваться на адекватном послеоперационном стадировании, которое достигается систематической медиастинальной лимфодиссекцией.
Список работ, опубликованных по теме диссертации
1. Лактионов К.К., Давыдов М. И., Полоцкий Б.Е., Зборовская И.Б., Богаты
рев В.Н., Никуличев Л.А., Степанова Е.В., Аллахвердиев А.К., Pайхлин Н.Т., Букаева И.А., Смиpнова Е.А., Гуpевич Л.Е., Делектоpская В.В., Аpдзинба М.С. Прогностические и предсказывающие факторы у больных немелкоклеточным раком легкого// Практическая онкология №27 –2006.–с. 145–153.
2. Pайхлин Н.Т., Букаева И.А., Смиpнова Е.А., Гуpевич Л.Е., Делектоpская В.В., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Значение экспрессии ядpышковых аргиpофильных белков и антигена Ki-67 в определении пpолифеpативной активности клеток и прогноза "малого" (T1) рака легкого.// Архив Патологии –2008– №3 с. 15–19.
3. Лактионов К.К., Полоцкий Б.Е., Юдин Д.И., Аpдзинба М.С., Аллахвердиев А.К., Зборовская И.Б., Богатырев В.Н., Степанова Е.В, Давыдов М. И.
Клинико-морфологические и молекулярно-генетические факторы прогноза при немелкоклеточном раке легкого I стадии.// Тез. докладов VI Всероссийского съезда онкологов. (Ростов–на–Дону, 9-14 октября 2005 г.). –Р. – 2005. – с. 357–358.
4. Pайхлин Н.Т., Смиpнова Е.А., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Ультраструктурные особенности рака легкого различного гистогенеза, влияющие на течение заболевания.// Тез. докладов ХХI Российской конференции по электронной микроскопии (Черноголовка., 2006) –2006.– с. 260.
5. Аллахвердиев А.К., Давыдов М. И., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Роль систематической медиастинальной лимфатической диссекции в хирургическом лечении больных немелкоклеточным раком легкого I и II стадии. // Тез. докладов IV съезда онкологов и радиологов СНГ (Баку 28 сентября – 1 октября 2006 г.) – Баку–2006 с.52.
6. Лактионов К.К., Полоцкий Б.Е., Зборовская И.Б., Богатырев В.Н., Никуличев Л.А., Аpдзинба М.С. Давыдов М. И. Биологические факторы прогноза при немелкоклеточном раке легкого Т1-2N0M0. // Тез. докладов IV съезда онкологов и радиологов СНГ (Баку 28 сентября – 1 октября 2006 г.) – Баку–2006. с.58.
7. Pайхлин Н.Т., Смиpнова Е.А., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Морфологические факторы прогноза немелкоклеточного рака легкого (Т1) // Тез. докладов IV съезда онкологов и радиологов СНГ (Баку 28 сентября – 1 октября 2006 г.) – Баку–2006. с.66.
8. Букаева И.А., Pайхлин Н.Т., Смиpнова Е.А., Гуpевич Л.Е., Делектоpская В.В., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Аргирофильные белки областей ядрышковых организаторов (Ag-ОЯОР – белки) и антиген Кi-67 как фактор прогноза при малом (Т1) раке легкого. // Тез. докладов международной конференции «Фундаментальные и прикладные проблемы медицины и биологии в опытах на обезьянах» (Сочи 19-22 сентября 2007г.) –Сочи – 2007. с.86-87.
9. Pайхлин Н.Т., Букаева И.А., Смиpнова Е.А., Гуpевич Л.Е., Делектоpская В.В., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Роль ядрышковых аргирофильных белков (Аg- ОЯОР-белков) в регуляции пролиферативной активности клеток.// Тез. докладов симпозиума «Нейроиммуноэндокринология и молекулярная медицина» (Москва 17-19 октября 2007 г.) – М –2007 с.129-130.
10. Лактионов К.К., Полоцкий Б.Е., Богатырев В.Н., Степанова Е.В., Аpдзинба М.С., Давыдов М.И. Индивидуализация лечебной тактики у больных немелкоклеточным раком легкого I-II стадии на основе изучения биологических особенностей опухоли. // Тез. докладов ХII Российского онкологического конгресса (Москва 18-20 ноября 2008 г.). – М – 2008 - с.93-94.
11. Pайхлин Н.Т., Букаева И.А., Смиpнова Е.А., Делектоpская В.В., Полоцкий Б.Е., Лактионов К.К., Аpдзинба М.С. Значение экспрессии ядрышковых аргирофильных белков (Ag-) ОЯОР-белки и антигена Ki-67 в определении пролиферативного потенциала «малого» (T1) рака легкого.// Тез. докладов ХII Российского онкологического конгресса (Москва 18-20 ноября 2008 г.). – М – 2008 – с.105-106.

