Опыт применения гипертермической интраперитонеальной химиотерапии при раке желудка, псевдомиксоме и перитонеальной мезотелиоме (
На правах рукописи
АБДУЛЛАЕВ АМИР ГУСЕЙНОВИЧ
Опыт применения гипертермической интраперитонеальной химиотерапии при раке желудка, псевдомиксоме и перитонеальной мезотелиоме
(14.01.12 — онкология)
АВТОРЕФЕРАТ
диссертации на соискание ученой степени
кандидата медицинских наук
Москва — 2010 г.
Работа выполнена в Учреждении Российской академии медицинских наук Российском онкологическом научном центре им. Н.Н.Блохина РАМН (директор — академик РАН и РАМН, профессор М.И. Давыдов).
Научные руководители:
Доктор медицинских наук Тер-Ованесов Михаил Дмитриевич
Доктор медицинских наук, профессор Горбунова Вера Андреевна
Официальные оппоненты:
Доктор медицинских наук, профессор В.С. Мазурин
Доктор медицинских наук И.С. Базин
Ведущее учреждение:
ФГУ Российский научный центр рентгенорадиологии МЗ и СР РФ
Защита диссертации состоится «24» июня 2010 г. в «____» часов на заседании диссертационного совета (Д.001.017.01) Российского онкологического научного центра им. Н.Н.Блохина РАМН.
Адрес: 115478, г. Москва, Каширское шоссе, 24.
С диссертацией можно ознакомиться в библиотеке ГУ РОНЦ им. Н.Н.Блохина РАМН.
Автореферат разослан «____» ___________2010 г.
Учёный секретарь Диссертационного совета
Доктор медицинских наук, профессор Ю.В. Шишкин
Общая характеристика диссертации
Актуальность проблемы. В настоящее время продолжается поиск наиболее оптимальных вариантов лечения больных раком желудка. Применение адъювантной и неоадъювантной системной химиотерапии в сочетании с оперативным вмешательством у больных местнораспространенным раком желудка не привело к улучшению показателей выживаемости по сравнению с использованием только хирургического лечения (Ван де Велде К. 1999, Nakajima T. 1999, Mari E. 2000, Di Bartolomeo M. 2000). Наряду с этим частота интраперитонеального рецидива, являющегося одной из ведущих причин смерти данных пациентов, после оперативного вмешательства достигает 40-50% (Cunningham D. 2006, Cascinu S. 2007). Кроме того, существует достаточно большая группа больных раком желудка с интраперитонеальной диссеминацией, у которых определение тактики лечения затруднительно в связи с неудовлетворительными результатами системной химиотерапии и угрозой осложнений в течение опухолевого процесса (Yonemura Y. 1996, Sadeghi B. 2000, Elias D. 2001).
Другую достаточно неблагоприятную в прогностическом отношении группу составляют пациенты с редкими опухолями брюшной локализации — псевдомиксомой и мезотелиомой. И если течение болезни при псевдомиксоме является зачастую торпидным, то перитонеальная мезотелиома характеризуется быстрым прогрессирующим ростом. Медиана выживаемости больных мезотелиомой брюшины после паллиативного вмешательства и системной химиотерапии составляет по данным различных авторов от 9 до 15 месяцев (Antman K. 1998, Chailleux E. 1988, Eltabbakh G.H. 1999, Markman M. 1992, Sridhar K.S. 1992, Sugarbaker P.H. 2006).
Возможной причиной неудовлетворительных результатов системной химиотерапии, используемой с целью профилактики и лечения канцероматоза, является плохое проникновение противоопухолевых препаратов в брюшную полость из-за наличия гематоперитонеального плазматического барьера (Y.Yonemura, 2001), представляющего собой комплекс барьеров для диффузии веществ, состоящих из эндотелия, мезотелия и интерстициальных тканей. С другой стороны, гематоперитонеальный плазматический барьер ограничивает резорбцию цитостатиков из брюшной полости в кровь, позволяя увеличивать дозу цитостатика в сравнении с системной химиотерапией.
По данным литературы одним из возможных методов профилактики и лечения канцероматоза брюшины является гипертермическая интраперитонеальная химиоперфузия (ГИХ) (Sugarbaker P. 1998, Yonemura Y 2004, Hirono Y. 2005, Yan T. 2007, Spiliotis J. 2008).
Использование ГИХ опирается на известные сведения о том, что гипертермия способствует повышению цитотоксичности химиопрепаратов и усиливает их пенетрацию в ткани, так как нагревание снижает интерстициальное давление в опухоли (Barlogie В., Cony P.M., Drewinko В., 1987, Paul H. Sugarbaker, 1998). Кроме того, одним из определяющих моментов эффективности интраперитонеального введения химиопрепаратов с высокой молекулярной массой является длительное нахождение препарата в полости брюшины.
Неудовлетворительные результаты лечения больных местнораспространенным и диссеминированным раком желудка, а также редкими опухолями брюшной локализации определяют необходимость поиска методов лечения, способных улучшить показатели выживаемости. Комбинацию хирургического метода с последующей интраперитонеальной гипертермической химиоперфузией можно рассматривать как одно из направлений лечения данной категории больных.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Разработка и внедрение в клиническую практику методики гипертермической интраперитонеальной химиоперфузии при раке желудка, псевдомиксоме и перитонеальной мезотелиоме.
ЗАДАЧИ ИССЛЕДОВАНИЯ
1. Разработать и апробировать методику ГИХ с учетом хирургических и анестезиологических особенностей проведения процедуры.
2. Разработать схему политермометрии и изучить состояние термобаланса при выполнении ГИХ.
3. Оценить непосредственные и отдаленные результаты комбинированного лечения с применением ГИХ у больных раком желудка и редкими формами опухолей брюшной полости.
4. Выработать показания к проведению ГИХ у больных раком желудка с учетом результатов комбинированного лечения.
5. Изучить фармакокинетику цисплатина при ГИХ путем оценки концентрации препарата в перфузате и сыворотке крови в процессе проведения процедуры и раннем послеоперационном периоде.
НАУЧНАЯ НОВИЗНА
Впервые в России представлена модифицированная методика ГИХ, разработана оригинальная техника операции перитонэктомии при псевдомиксоме и перитонеальной мезотелиоме.
На основании анализа применения методики ГИХ у 44 пациентов определен характер возможных осложнений в послеоперационном периоде, выявлены специфические осложнения.
Выработан алгоритм ведения пациентов раком желудка с использованием ГИХ.
Изучена клиническая фармакокинетика цисплатина при проведении ГИХ.
ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ.
Показана безопасность и целесообразность включения методики ГИХ в лечение больных раком желудка и редкими опухолями брюшной полости.
Определены показания к использованию ГИХ у некоторых подгрупп больных раком желудка и редкими опухолями брюшной полости.
Оценена возможность побочных эффектов ГИХ и выработаны способы их профилактики.
Результаты изучения клинической фармакокинетики цисплатина позволяют модифицировать дозы цитостатика при интраперитонеальном введении.
ВНЕДРЕНИЕ РЕЗУЛЬТАТОВ ИССЛЕДОВАНИЯ
Выводы, практические рекомендации, основные положения данного исследования внедрены и используются в торакальном отделении РОНЦ им. Н.Н.Блохина РАМН.
АПРОБАЦИЯ РАБОТЫ
Апробация диссертации состоялась 19 марта 2010 г. на совместной научной конференции с участием отделений: хирургического торакального, химиотерапии, абдоминальной онкологии, клинической фармакологии и химиотерапии, химиотерапии и комбинированного лечения злокачественных опухолей, изучения новых противоопухолевых лекарств, гинекологического отделения, отделения опухолей женской репродуктивной системы НИИ КО, лаборатории клеточного иммунитета, лаборатории комбинированной терапии опухолей НИИ ЭД и ТО и лаборатории молекулярно-биологических методов исследования НИИ канцерогенеза РОНЦ им. Н.Н. Блохина РАМН.
ПУБЛИКАЦИИ
По теме диссертации опубликовано 6 научных работ.
СТРУКТУРА И ОБЪЕМ ДИССЕРТАЦИИ
Диссертационная работа изложена на 130 страницах, состоит из введения, глав: «Обзор литературы», «Материалы и методы исследования», трех глав собственных исследований, заключения, выводов, списка литературы (6 работ отечественных и 156 зарубежных авторов), иллюстрирована 30 таблицами и 31 рисунком.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования
В основу исследования положен анализ результатов лечения 44 пациентов: 30 больных местнораспространенным и диссеминированным раком желудка, 10 — псевдомиксомой брюшины и 4 — злокачественной перитонеальной мезотелиомой, которым проводилось лечение с применением ГИХ в торако-абдоминальном отделе РОНЦ им. Н.Н. Блохина РАМН в период с 2003 по 2009 гг.
В зависимости от типа опухоли все пациенты были разделены на 2 группы:
1) больные местнораспространенным и диссеминированным раком желудка — 30 (68.2%).
2) больные редкими опухолями брюшной локализации — 14 (31.8%).
В свою очередь пациенты 1 группы были разделены на 2 подгруппы в зависимости от цели использования ГИХ: «профилактическая» подгруппа (№1) — 12 пациентов (27.3%) и «паллиативная» (№2) — 18 пациентов (40.9%).
Критерием разделения больных раком желудка на две дополнительные подгруппы явилось определение интраперитонеальной диссеминации при лапароскопии и по данным интраоперационной ревизии. В паллиативную группу также вошли пациенты, у которых в смывах с брюшины были определены свободные опухолевые клетки (Cy «+»).

Рисунок 1. Характеристика больных раком желудка и объем проведенного лечения. (ИПС — предоперационная интраперитонеальная и системная химиотерапия, Cy — свободные опухолевые клетки в смывах с брюшины, Р — степень канцероматоза брюшины (JGCA, 1998)).
Степень канцероматоза брюшины оценивалась по классификации Японской Ассоциации по изучению рака желудка (JGCA, 1998), согласно которой наличие отсевов по брюшине (P) имеет 3 градации в зависимости от количества и локализации метастазов (P1— ограниченное поражение брюшины, P2 — несколько отсевов, разделенных неизмененной брюшиной, P3 — множественные поражение брюшины).
К профилактической группе были отнесены больные местнораспространенным раком желудка без признаков интраперитонеальной диссеминации. Перитонеальные смывы были отрицательными во всех наблюдениях и всем больным произведен сходный объем оперативных вмешательств — радикальные операции в объеме гастрэктомии у 11 больных и дистальная субтотальная резекция желудка у одного.
В паллиативной группе объема лечения зависел от степени интраперитонеальной диссеминации. Свободные опухолевые клетки без канцероматоза выявлены у 5 пациентов, макроскопически определяемая диссеминация определена в 13 наблюдениях, из них 5 больным с P3 диссеминацией проводилась комбинированная интраперитонеальная и системная химиотерапия (ИПС) с последующей оценкой эффекта, в остальных случаях (n=13), объем лечения подразумевал выполнение паллиативной гастрэктомии в комбинации с ГИХ.
Для оценки полноты циторедукции была использована классификация, предложенная P. Sugarbaker (1998) (СС — Соmpleteness of Cytoreduction), включающая 4 степени:
СС-0 — очаги перитонеального канцероматоза после операции визуально не определяются;
СС-1 — определяются опухолевые очаги менее 2.5 мм в диаметре;
СС-2 — наличие остаточных опухолевых узлов от 2.5 мм до 2.5 см;
СС-3 — подразумевает наличие, после хирургического этапа, опухолевых очагов более 2.5 см в диаметре.
В таблице 1 представлены данные о степени интраперитонеальной диссеминации (Р) и резидуальной опухоли (R) в зависимости от полноты циторедукции (CC) в подгруппе больных паллиативного лечения, оперированных в объеме гастрэктомии (n=13).
Таблица 1
Характеристика больных паллиативной подгруппы по степени интраперитонеальной диссеминации, полноте циторедукции и резидуальной опухоли
| Степень интраперитонеальной диссеминации | Число больных |
| Cy+ | 5 |
| P1 | 7 |
| P2 | 1 |
| P3 | - |
| Полнота циторедукции (СС0-3)ВСЕГО | |
| CC-0 | 12 |
| CC-1 | 1 |
| CC-2 | - |
| CC-3 | - |
| Резидуальная опухоль (R0-2) | |
| R0 | - |
| R1 | 12 |
| R2 | 1 |
| ВСЕГО | 13 |
При макроскопически определяемой интраперитонеальной диссеминации (n=8), резекцию R1 удалось выполнить в 7 наблюдениях. У пациентов со свободными опухолевыми клетками в смывах (n=5, Cy+) операции носили паллиативный характер с оставлением микроскопической резидуальной опухоли (R1).
Пациенты редкими опухолями брюшной локализации
В эту группу вошло 10 больных псевдомиксомой и 4 мезотелиомой брюшины.
Источником псевдомиксомы у 4 пациентов являлись яичники, у 4 — аппендикс и у 2 — источник не был найден (табл. 2).
Объем лечения в этой группе пациентов подразумевал выполнение операции перитонэктомии в сочетании с ГИХ.
Таблица 2
Морфологические типы редких опухолей
| Гистологический тип | Число пациентов |
| Муцинозная цистаденома яичников | 4 |
| Муцинозная цистаденома червеобразного отростка | 2 |
| Слизеобразующая аденокарцинома, источник не определен | 2 |
| Аденокарцинома червеобразного отростка | 2 |
| Эпителиоклеточная мезотелиома | 4 |
| ВСЕГО | 14 |
Техника операции перитонэктомии
За основу перитонэктомии был взят способ, предложенный P. Sugarbaker в 1998 году. Операция включает в себя несколько этапов:
1) перитонэктомия в правом квадранте брюшной полости (резекция связочного аппарата печени, перитонэктомия правого купола диафрагмы, перитонэктомия правого латерального канала);
2) перитонэктомия в левом квадранте брюшной полости (перитонэктомия левого купола диафрагмы, перитонэктомия левого латерального канала);
3) бурсоментэктомия с удалением малого и большого сальников, брюшины сальниковой сумки с возможным удалением селезенки;
4) тазовая перитонэктомия.
В 93% случаев (n=13) перитонэктомия носила комбинированный характер и наиболее часто включала спленэктомию (n=10), холецистэктомию, резекцию поперечно-ободочной кишки (табл. 3).
Столь разный объем вмешательств объяснялся данными интраоперационной ревизии и стремлением к выполнению максимальной циторедукции. У 2 пациентов перитонэктомия сочеталась с пластикой передней брюшной стенки в связи с выявленными при первичном осмотре послеоперационными вентральными грыжами.
Таблица 3
Характер выполненных оперативных вмешательств в группе больных редкими опухолями
| Вид операции | Число пациентов | ||
| Перитонэктомия | 1 | ||
| Комбинированные операции ПЕРИТОНЭКТОМИЯ + | спленэктомия | 3 | |
| правосторонняя гемиколэктомия | 1 | ||
| спленэктомия + аппендэктомия | 1 | ||
| спленэктомия + аппендэктомия + холецистэктомия | 4 | ||
| резекция брыжейки поперечно-ободочной кишки + холецистэктомия | 1 | ||
| спленэктомия + холецистэктомия + пластика передней брюшной стенки сеткой on-lay | 1 | ||
| пластика передней брюшной стенки по Mayo с укреплением сеткой on-lay | 1 | ||
| резекция тонкой кишки + спленэктомия | 1 | ||
| ВСЕГО | 14 | ||
Полноту циторедукции у больных редкими опухолями брюшной локализации также оценивали по индексу, предложенному P. Sugarbaker (1998). СС-0 и СС-1 были достигнуты у 7 (50%) и у 7 пациентов (50%) соответственно.
Описание методики гипертермической интраперитонеальной химиотерапии (ГИХ)
Гипертермическая интраперитонеальная химиотерапия проводилась 44 пациентам. У 39 (88.6%) она следовала за хирургическим этапом, 5 больным химиоперфузия была проведена в плане предоперационной химиотерапии. Одному пациенту с мезотелиомой брюшины, ГИХ проводилась дважды с интервалом в 1 год.
За основу проведения ГИХ нами была взята модель, разработанная в Вашингтонском университете (Вашингтонский Противораковый Институт) под руководством P. Sugarbaker — методика ‘Coliseum’. Ее основой является выполнение перфузии брюшной полости в открытом контуре с использованием экспандера.
После окончания лаважа в брюшную полость вводится четыре дренажа для притока и оттока жидкости. Один ирригатор устанавливается в зоне резецированной опухоли с целью повышения непосредственного воздействия химиопрепарата на зону наиболее вероятного возникновения рецидива заболевания. Брюшная полость герметизируется на экспандере с формированием резервуара. На коже передней брюшной стенки фиксируется полиэтиленовая изоляция с целью предотвращения выпаривания химиопрепаратов во время процедуры (рис. 2).

Рисунок 2. Схема гипертермической интраперитонеальной химиоперфузии
Все элементы установки для осуществления ГИХ были выполнены на базе современных медицинских приборов и аппаратов производства передовых зарубежных и отечественных фирм. Отдельные элементы потребовали переработки, которая была выполнена на заводе производителе медицинского оборудования. Такой подход к созданию аппарата был продиктован требованиями безопасности больного и персонала при выполнении процедуры гипертермии. Вся система работает в полуавтоматическом режиме, что позволяет выдерживать точное поддержание температуры и скорости перфузии.
Принцип работы аппарата для ГИХ заключается в повышении температуры перфузионной жидкости, которая циркулирует в стерильном контуре и поступает через брюшные дренажи для «притока». Это достигается путем прохождения «стерильного» контура через теплообменник, который нагревается за счет «нестерильного» контура, напрямую связанного с термостатом.
Существующую установку можно разделить на несколько блоков (выделены жирным шрифтом), которые схематично представлены на рисунке 3.
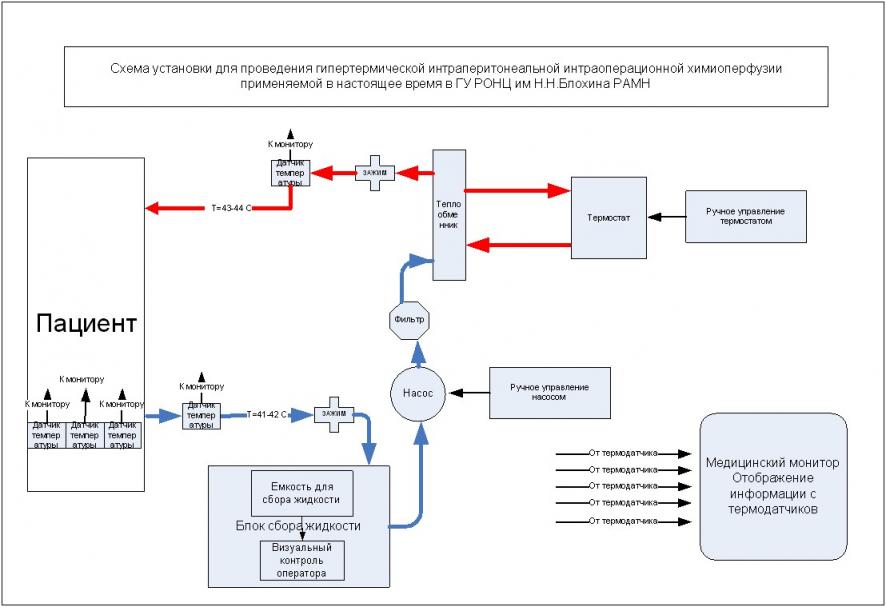 Рисунок 3. Схема установки для проведения ГИХ,
Рисунок 3. Схема установки для проведения ГИХ,
применяемой в РОНЦ им. Н.Н. Блохина РАМН
Рассмотрим работу установки на представленной схеме. Перфузионная жидкость, состоящая из физиологического раствора и химиопрепарата приготавливается в блоке сбора жидкости, который представлен в существующей модели в виде емкости объемом 2 литра, уровень в ней контролируется визуально оператором и регулируется с помощью ручных зажимов.
Из блока сбора жидкости перфузат с помощью насоса, конструкция которого основана на перистальтическом принципе перекачки жидкости по трубке, подается через фильтр в блок термостатирования, где жидкость подогревается до температуры 43-44C и поступает в брюшную полость больного. По мере наполнения брюшной полости происходит перелив избыточного перфузата в блок сбора жидкости с его последующей рециркуляцией и подогревом. На определенном этапе устанавливается стационарный ток жидкости, который при оптимальном режиме составляет 2-3 литра в минуту. Процесс температурной подготовки перфузата контролируется температурными датчиками, установленными на входных и выходных дренажах. Информация с этих температурных датчиков и с температурных датчиков на теле больного отображается на экране медицинского монитора, что позволяет оператору выводить аппарат на необходимый температурный режим. В связи с этим процесс ГИХ требует напряженного участия оператора.
С целью перфузии мы использовали изотонический 0.9% раствор NaCl в объеме 5 л, что при скорости 2-3 л/мин позволяло снизить градиент температуры на входящей и исходящей магистралях до 1-1.5°С.
В 79.5% наблюдений (n=35) продолжительность перфузии составляла 90 мин., у остальных пациентов — 20.5% (n=9) в интервале от 60 до 80 мин. Лимитирующим фактором времени процедуры являлось снижение скорости перфузии ниже 500 мл/мин и увеличение градиента температуры на входной и выходной магистралях термостата в связи с нарушением оттока по дренажам.
Дозы цитостатиков, использовавшихся для интраперитонеального введения, рассчитывались по площади поверхности тела пациента и составляли для цисплатина и митомицина С 100 мг/м2 и 10 мг/м2 соответственно.
С 2007 г. нами начато использование «закрытой» методики, при которой после окончания хирургического этапа операции и установки дренажей для перфузии лапаротомная рана ушивается. При этом все параметры перфузии: продолжительность, дозы цитостатиков, температуры раствора оставались прежними.
Состояние термобаланса во время процедуры исследовали при помощи температурных датчиков, установленных на входной и выходной магистралях термостата, а также у пациента полипозиционно (ротоглотка, прямая кишка, кожные покровы). Средние показатели температуры раствора для перфузии составили — 43.6 ±0.5С.
На рисунке 4 представлена динамика температуры с входной и выходной магистралей, ротоглотки и кожных покровов во время ГИХ (1-ое наблюдение).
 Рисунок 4. 1-ое наблюдение
Рисунок 4. 1-ое наблюдение
В начале перфузии (1-7 мин.) разница между температурой жидкости во входящей и исходящей магистрали составляет 15-17°С и связана с поступлением изоосмолярного раствора в необходимом для процедуры объеме и теплопроводностью брюшины. В течение последующего времени происходит равномерное увеличение температуры со снижением градиента между этими показателями до 1.5-2 С. При абсорбции части изотонического раствора происходит уменьшение объема перфузата, что требует увеличения объема жидкости. При этом возникает уменьшение температуры на «входе» и «выходе» с увеличением градиента температур (75-85 мин.).
Анализ динамики показателей температуры у другого пациента представлен на рисунке 5, (2-ое наблюдение).

Рисунок 5. 2-ое наблюдение.
В начале перфузии (1-8 мин.) также определяется широкий интервал между температурами во входящей и исходящей магистралях, в дальнейшем (15-90 мин) устанавливается устойчивый градиент температур в пределах 3-4°С при меньшей скорости перфузии, чем в первом случае. При уменьшении скорости перфузии по ходу процедуры в связи с уменьшением объема жидкости за счет абсорбции возможно продолжение ГИХ, однако при этом увеличивается разница температур во входящей и исходящей магистралях. Уровень температуры в ротоглотке в течение всей процедуры не превышал нормальных показателей.
Анализ динамики температуры во время ГИХ показал, что для поддержания необходимой интраперитонеальной температуры в 43-44 градуса необходима высокая скорость перфузии — 2-3 л/мин, при снижении скорости перфузии ниже 1 л/мин возникает увеличение разницы между температурой жидкости, которая поступает в брюшную полость (входящая магистраль) и оттекает из нее (исходящая магистраль). В последнем случае, для поддержания необходимой температуры в брюшной полости требуется ее повышение в приводящей магистрали, либо завершение перфузии.
Изучение клинической фармакокинетики цисплатина при проведении гипертермической интраоперационной химиоперфузии (ГИХ)
ГИХ применяли стандартно по описанной ранее методике. Цисплатин («Bayer», Германия) вводили внутрибрюшинно путем 90-минутной инфузии в 5,0 л физиологического раствора (перфузат) с проведением адекватной внутривенной инфузии на фоне применения диуретических (почечных) доз допамина и лазикса. Затем в различные сроки (0 мин., 30 мин., 1, 2, 3, 4, 5, 24, 48, 72, 96 и 120 часов) были взяты образцы проб крови и жидкости из брюшной полости (перфузат).
Разработка метода определения цисплатина в биоптатах брюшины пациента после оперативного вмешательства и проведения ГИХ
Поскольку прямое определение содержания цисплатина в биоптатах невозможно, нами разработан метод, заключающийся в дериватизации производных платины диэтилдитиокарбаматом натрия (ДТИК). При этом образуется комплекс платины с 2 молекулами диэтилдитиокарбамата Pt(ДТИК)2, который очень хорошо поглощается в ультрафиолетовом диапазоне на длине волны 254 нм (коэффициент молярной экстинкции равен 45000). Последующее количественное определение этого комплекса проводится методом высокоэффективной жидкостной хроматографии (ВЭЖХ).
Хроматографический анализ. Осуществляли на хроматографе Gilson с ультрафиолетовым детектором на длине волны 254 нм. Хроматографическая колонка Partisil5-С8, 250х4,6 мм, чувствительность 0,05 AUFS, объем вводимой для анализа пробы 20 мкл, скорость потока 1 мл/мин, длительность анализа 30 мин. При отработке метода оценивали возможность использования в качестве внутреннего стандарта раствора NiCl2 (содержание никеля 2 мкг), имеющего коэффициент молярной экстинкции Ni(ДТИК)2, равный 43000, одинаковый с Pt(ДТИК)2. Время удерживания («Retention Time», RT) составляло 16-17 мин для Pt(ДТИК)2 и 18,5-19,8 мин для Ni(ДТИК)2. Предел обнаружения 10 нг.
Фармакокинетический анализ проведен с применением программы PCNONLIN.
Статистическая обработка материала
Для регистрации информации была создана универсальная электронная база данных с помощью программы Microsoft Excel 2000. Статистический анализ полученных результатов проводился по стандартным методикам с использованием программы Statistica 6 for Windows.
Результаты собственных исследований
Непосредственные результаты комбинированного лечения пациентов раком желудка и редкими опухолями брюшной локализации с гипертермической интраперитонеальной химиоперфузией
Анализ непосредственных результатов лечения больных раком желудка и редкими опухолями брюшной локализации показал, что частота хирургических осложнений составила 36% и 28.6% соответственно (табл. 4).
Таблица 4
Структура послеоперационных хирургических осложнений
| Осложнение | Рак желудка n=25 | Редкие опухоли n=14 |
| Поддиафрагмальный абсцесс | 1 | |
| Внутрибрюшное кровотечение | 1 | |
| Перфорация эпифренального дивертикула, диффузный перитонит, сепсис | 1* | |
| Абсцесс печени | 1 | |
| Панкреатит | 4 | 3 |
| Желудочно-кишечное кровотечение | 1 | |
| Нагноение послеоперационной раны | 1 | |
| ВСЕГО | 9(36%) | 4(28.6%) |
| * — осложнение, связанное с внутригоспитальной летальностью | ||
Наиболее частым осложнением в обеих группах являлся послеоперационный панкреатит: 16% (n=4) — у пациентов раком желудка и 21.4% (n=3) — у больных редкими опухолями. Необходимо заметить, что диагноз послеоперационного панкреатита основывался на результатах лабораторно-инструментальных исследований и проявлялся нарастанием уровня амилазы в крови до 3-4-х суток с последующим снижением на фоне антисекреторной и антибактериальной терапии. Внутригоспитальная летальность в первой группе пациентов составила 4% (n=1), во второй ее не было.
Частота легочных осложнений в 2 группах была равной 28% и 28.6%, однако их характер различался (табл. 5). В группе больных раком желудка пневмония в послеоперационном периоде диагностирована у 4 больных, и у 3 выявлен плеврит, в 2 случаях он сочетался с пневмонией. Необходимо заметить, что плевральный выпот у этих пациентов имел воспалительную природу и был связан с пневмонией в 2 случаях и с поддиафрагмальным абсцессом в 1 наблюдении. В отличие от этого, у 2 больных из группы пациентов с редкими опухолями было отмечено сочетание пневмоторакса и гидроторакса и еще у двух — только пневмоторакс или гидроторакс. Нами отмечено, что развитие легочных осложнений в этой группе было связано с вскрытием диафрагмы после выполнения перитонэктомии и диагностировалось в первые сутки послеоперационного периода.
Таблица 5
Структура послеоперационных легочных осложнений
| Осложнение | Рак желудка n=25 | Редкие опухоли n=14 |
| Пневмония | 4 | |
| Плеврит | 1 | |
| Сочетание плеврита и пневмонии | 2 | |
| Пневмоторакс | 1 | |
| Гидроторакс | 1 | |
| Сочетание пневмо- и гидроторакса | 2 | |
| ВСЕГО | 7(28%) | 4(28.6%) |
Осложнения химиотерапии оценивались по шкале токсичности (критерии CTC-NCIC, Clinical Trial Centre National Cancer Institute Canada) и учитывались раздельно в обеих группах (табл. 6, 7) Третья степень токсичности у больных раком желудка была отмечена в одном наблюдении и проявлялась нарастанием креатинина в сыворотке крови до 665 мкмоль/л. Гематологической токсичности не было.
Таблица 6
Характеристика химиотерапевтических осложнений
в группе больных раком желудка (n=30)
| Токсичность | Степень токсичности | ВСЕГО | |||
| 1 | 2 | 3 | 4 | ||
| Гематологическая | - | - | - | - | 0 |
| Гастроинтестинальная | - | - | - | - | 0 |
| Нефротоксичность (по уровню креатинина) | 2 | 1 | 1 | - | 4 (13.3%) |
| Гепатотоксичность (по уровню АЛТ, АСТ) | 2 | - | - | - | 2 (6.7%) |
| ВСЕГО | 4 | 1 | 1 | - | 6/30 (20%) |
Во второй группе токсичность третьей или большей степени оказалась выше — 14%, и в одном из наблюдений проявилась анемией, потребовавшей гемотрансфузии.
Таблица 7
Характеристика химиотерапевтических осложнений
в группе больных редкими опухолями брюшной полости
| Токсичность | Степень токичности | ВСЕГО | |||
| 1 | 2 | 3 | 4 | ||
| Гематологическая (по уровню гемоглобина) | - | - | 1 | - | 1 (7%) |
| Гастроинтестинальная (диарея) | - | - | 1 | - | 1 (7%) |
| Нефротоксичность (по уровню креатинина) | 3 | - | - | - | 3 (21%) |
| Гепатотоксичность | - | - | - | - | - |
| ВСЕГО | 3 | - | 2 | - | 5/14 (35%) |
Комбинация циторедуктивных вмешательств в сочетании с гипертермической химиоперфузией в ряде случаев ассоциировалась со специфическими, на наш взгляд, осложнениями, которые невозможно было отнести к хирургическим, либо к химиотерапевтическим (табл. 8).
Таблица 8
Характеристика специфических осложнений комбинированного лечения
| Осложнение | Число больных | |
| 1 группа (n=25) | 2 группа (n=14) | |
| Интраоперационная тотальная гипертермия | 4 (16%) | - |
| Послеоперационная лихорадка неясного генеза | 1 (4%) | 2 (14%) |
| Тромбоцитоз более 500х109/л | 9 (36%) | 5 (35.7%) |
| Увеличение уровня трансаминаз, АЛТ, АСТ | - | 7 (50%) |
Интраоперационная тотальная гипертермия, повышение температуры тела более 38.5°С, отмечена у 4 (16%) пациентов из 1 группы и развивалась через 40-50 мин от начала перфузии при температуре перфузата 43.5-44°С, что потребовало общего охлаждения с применением гипотермического матраца. Развитие данного осложнения является достаточно редким наблюдением, и причина его возникновения остается не до конца понятной.
Послеоперационная лихорадка неясного генеза с подъемами температуры в течение дня до 38°С без ознобов продолжительностью более 3 дней наблюдалась у одного больного из 1 группы и у 2 пациентов из второй, и диагностировалась нами после исключения наличия какого-либо источника инфекции.
В подавляющем большинстве случаев тромбоцитоз ассоциировался со спленэктомией и выявлялся более чем у 30% пациентов каждой группы, однако тромбогеморрагических осложнений мы не наблюдали ни у одного больного.
Увеличение уровня трансаминаз носило избирательный характер, максимальные значения АЛТ и АСТ определялись на 1-3 сутки с последующим снижением до нормальных показателей у больных после перитонэктомии в зоне печеночной сумки с удалением капсулы Глиссона и не требовало гепатотропной терапии.
Отдаленные результаты комбинированного лечения рака желудка и редких опухолей брюшной локализации с применением ГИХ
Анализ отдаленных результатов комбинированного лечения с применением ГИХ проводился раздельно в обеих группах, кроме того, больные раком желудка анализировались в зависимости от подгруппы — профилактическая или паллиативная.
Показатели общей выживаемости в профилактической группе составили: 1-летняя — 90±9.4%, 3-летняя — 56±16.5%, 5-летняя — 56±16.5%. Медиана не достигнута (рис. 6).

Рисунок 6. Кривая выживаемости больных «профилактической подгруппы»
Медиана безрецидивной выживаемости в профилактической подгруппе пациентов также не достигнута (см. рис. 7), показатели 1-летней, 3-летней и 5-летней выживаемости составили: 82±11.2%, 52±15.8% и 52±15.8% соответственно.

Рисунок 7. Кривая безрецидивной выживаемости больных
«профилактической» подгруппы
В расчет выживаемости в паллиативной подгруппе вошли больные, получившие комбинированное лечение в объеме гастрэктомии+ГИХ (n=12). Исключение составили пациенты, получившие лечение по программе ИПС (интраперитонеальная и системная химиотерапия, n=5). В анализ выживаемости также не был включен один случай внутригоспитальной летальности в связи с тем, что ее причиной явилась перфорация эпифренального дивертикула пищевода, который не был диагностирован на дооперационном этапе и, по сути, данное осложнение не могло быть связано с характером комбинированного лечения.
Медиана общей выживаемости в этой подгруппе составила 7 месяцев. 1-летняя выживаемость — 33.3±13.6 (рис. 8).

Рисунок 8. Кривая выживаемости больных «паллиативной» подгруппы
Комбинированное лечение — ИПС (интраперитонеальная и системная химиотерапия) получили 5 пациентов при P3 степени диссеминации с индукционной целью. Суть терапии заключалась в лапароскопии с проведением ГИХ со стандартным параметрам продолжительности (90 мин.), средней температуры перфузата (43.5С) и доз цитостатиков для интраперитонеального введения (цисплатин 100 мг/м2, митомицин С 10 мг/м2) с последующим проведением системной химиотерапии по схеме ELF и интраперитонеальной нормотермической химиотерапии, через лапаропорт цисплатином в дозе 100 мг. Однако ни один из пациентов в дальнейшем не был оперирован в связи с прогрессированием на фоне проводимого лечения.
На рисунке 9 мы попытались отразить алгоритм ведения больных раком желудка с использованием ГИХ.

Рисунок 9. Алгоритм ведения пациентов раком желудка с использованием ГИХ
Таким образом, по нашему мнению, использованием ГИХ при раке желудка целесообразно у больных местнораспространенным раком желудка, в том числе со свободными опухолевыми клетками, без забрюшинных лимфогенных метастазов и у пациентов с локализованным канцероматозом (P1 — диссеминация) при возможности удаления всей опухоли и отсевов. В последнем случае необходимо обсуждение вопроса о проведении послеоперационной системной химиотерапии.
Анализ отдаленных результатов у пациентов с псевдомиксомой брюшины показал, что общая 1-, 2-летняя выживаемость составила 100%, безрецидивная 1-летняя — 86±13.2%, 2-летняя — 86±13.2%, медиана не достигнута.
Изучение клинической фармакокинетики цисплатина при проведении гипертермической интраоперационной химиоперфузии (ГИХ)
Исследование проведено у 10 пациентов. В каждом наблюдении проводился анализ образцов крови и перфузата для изучения фармакокинетики цисплатина в возрастающих дозах. Цисплатин вводили в дозах 100, 150 и 200 мг внутрибрюшинно путем 1,5-часовой инфузии в 5 л физиологического раствора с предшествующей и последующей внутривенной гипергидратацией. Затем в различные сроки (0 мин., 30 мин., 1, 2, 3, 4, 5, 24, 48, 72, 96 и 120 часов) были взяты образцы проб крови и жидкости из брюшной полости.
На рисунках 10-12 и в таблице 9 представлены фармакокинетические параметры цисплатина в крови и перфузате при его использовании в возрастающих дозах 100 и 200 мг.
Таблица 9
Максимальная концентрация цисплатина в сыворотке крови и перфузате
| Среда | Доза цисплатина, Cmax (мкг/мл) | |
| 200 мг | 100 мг | |
| Перфузат | 25.8 | 9.00 |
| Сыворотка крови | 0.72 | 0.15 |
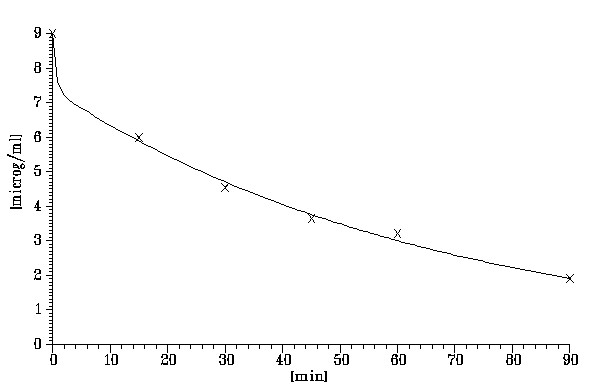

Рисунок 10. Динамика содержания цисплатина в перфузате
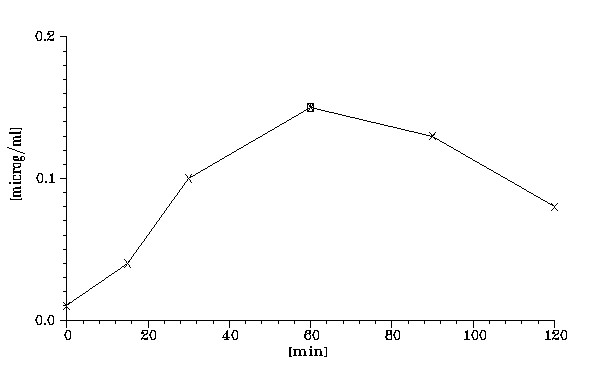

Рисунок11. Динамика содержания цисплатина в сыворотке крови,
Цисплатин 100 мг.


Рисунок 12. Динамика содержания цисплатина в сыворотке крови,
Цисплатин 200 мг.
У пациентов, получивших цисплатин в отмеченных дозах, выявлены близкие фармакокинетические параметры препарата в крови и перфузате. Эти данные свидетельствуют о том, что в перфузате цисплатин удерживается в течение 1-1.5 часов в достаточно высокой концентрации. Затем препарат относительно быстро поступает в кровь, где определяется в чрезвычайно низкой концентрации. Таким образом, в кровь поступает на несколько порядков меньше цисплатина, чем его содержится в перфузате. Полученные данные подтверждают избирательное накопление цисплатина в брюшной полости при ГИХ и существенное снижение поступления его в кровь даже при применении относительно высоких терапевтических доз.
Это может явиться предпосылкой значительного усиления местного эффекта цисплатина в отношении метастазов в брюшной полости, а также позволяет рассматривать вопрос о модификации доз цитостатиков.
Выводы
1. Опыт использования гипертермической интраперитонеальной химиотерапии при лечении 44 пациентов раком желудка и редкими опухолями брюшной полости (псевдомиксома, мезотелиома брюшины) позволяет рассматривать ГИХ как метод, не увеличивающий частоту интраоперационных и ранних послеоперационных осложнений.
2. Общая частота хирургических осложнений у больных раком желудка и редкими опухолями брюшной локализации, получивших комбинированное лечение с ГИХ составляет 36,0% и 28,6% соответственно. Наиболее частым осложнением в обеих группах больных является послеоперационный панкреатит: 16% пациентов раком желудка и 21,4% больных редкими опухолями.
3. Проведение гипертермической интраперитонеальной химиоперфузии не сопровождается высокой частотой химиотерапевтических осложнений. Третья степень токсичности у пациентов раком желудка была отмечена в одном наблюдении (3.3%). В группе пациентов редкими опухолями токсичность третьей или большей степени составила 14,0%.
4. Комбинация циторедуктивных вмешательств в сочетании с гипертермической химиоперфузией ассоциируется со специфическими осложнениями: интраоперационная тотальная гипертермия — 10,0%, лихорадка неясного генеза в послеоперационном периоде — 7,7%, тромбоцитоз более 500х109/л — 36% и увеличение уровня трансаминаз — 50,0% после перитонэктомии.
5. Показатели общей выживаемости в профилактической подгруппе больных раком желудка составили: 1-летняя — 90,0±9,4%, 3-летняя — 56,0±16,5%, 5-летняя — 56,0±16,5%. Медиана не достигнута.
Общая 1-летняя выживаемость в паллиативной подгруппе составила 33,3±13,6%. Медиана — 7 месяцев, 2-летней выживаемости нет.
6. Показанием к использованию ГИХ при раке желудка является местнораспространенный процесс (T3, T4), в том числе со свободными опухолевыми клетками, без забрюшинных лимфогенных метастазов. У больных с локализованным канцероматозом (P1-диссеминация) проведение ГИХ целесообразно при возможности удаления всей опухоли и отсевов.
7. Разработанная методика политермометрии во время проведения ГИХ позволяет мониторировать состояние температурного баланса и регулировать параметры ГИХ с использованием дополнительных методов охлаждения пациентов.
8. Изучение клинической фармакокинетики цисплатина при проведении гипертермической интраоперационной химиоперфузии демонстрирует избирательное накопление цисплатина в брюшной полости и существенное снижение поступления его в кровь даже при применении относительно высоких терапевтических доз.
Список научных трудов, опубликованных по теме диссертации
- Интраоперационная химиотерапия: оценка эффективности воздействия на интраперитонеальные местастазы /М.Д. Тер-Ованесов, Б.Е. Полоцкий, Ю.В. Буйденок, С.Н. Неред, С.П. Свиридова, А.Н. Губин, В.А. Марчук, А.Г. Абдуллаев//Вестник Московского Онкологического Общества. — 2006. — № 6-8. — С. 5.
- Гипертермическая интраперитонеальная химиоперфузия (ГИИХ — HIPEC) в комбинированном лечении местнораспространенного и интраперитонеально диссеминированного рака желудка и других форм опухолей/М.Д. Тер-Ованесов, Ю.В. Буйденок, Б.Е. Полоцкий, С.Н. Неред, Е.М. Трещалина, С.П. Свиридова, Ю.А. Лабутин, А.Н. Губин, О.В.Чистякова, Н.Н. Тупицин, А.Г. Абдуллаев//Материалы XI Российского онкологического конгресса — Москва. — 2007. — С. 40-44.
- The Hyperthermic Intraperitoneal Chemoperfusion (HIC) in the combined treatment of locally advanced and disseminated gastric cancer/M.D. Ter-Ovanesov, U.V. Buydenok, S.P. Sviridova, A.N. Gubin, V.A. Marchuk, E.M. Treschalina, A.G. Abdullaev, B.E. Polotsky, M.I. Davydov//7th International Gastric Cancer Congress, Suppl. Journal of the Brazilian Medical Association. — 2007. — P. 126.
- The Hyperthermic Intraperitoneal Chemoperfusion (HIPEC) in the combined treatment of locally advanced and disseminated gastric cancer and other types of tumours/M.D. Ter-Ovanesov, U.V. Buydenok, S.P. Sviridova, E.M. Treschalina, A.G. Abdullaev, B.E. Polotsky, M.I. Davydov//19th International Congress on AntiCancer Treatment. — Paris, France. — 2008. — P. 234.
- Гипертермическая интраоперационная интраперитонеальная химиоперфузия (ГИИХ — HIPEC) в комбинированном лечении местнораспространенных и диссеминированных опухолей — реальный шанс изменить неблагоприятный прогноз/М.Д. Тер-Ованесов, М.И. Давыдов, Ю.В. Буйденок, Е.М. Трещалина, А.Г. Абдуллаев, Э.Э. Леснидзе, Б.Е. Полоцкий//Материалы I Международного конгресса по торако-абдоминальной хирургии, посвященный 100-летию со дня рождения Б.В.Петровского — Москва. — 2008. -С. 247.
- Гипертермическая интраоперационная интраперитонеальная химиотерапия при раке желудка: существует ли реальная возможность изменить прогноз?/М.И. Давыдов, М.Д. Тер-Ованесов, Ю.В. Буйденок, Б.Е. Полоцкий, В.А. Горбунова, А.Г. Абдуллаев//Вестник РОНЦ им. Н. Н. Блохина РАМН. — 2010. — Т. 21. — №1. — С. 11-20.

