Использование поверхностно - активных веществ в профилактике образования спаек после внутрибрюшных операций (экспериментальное исследование)
На правах рукописи
Кызласов Павел Сергеевич
ИСПОЛЬЗОВАНИЕ ПОВЕРХНОСТНО-АКТИВНЫХ ВЕЩЕСТВ В ПРОФИЛАКТИКЕ ОБРАЗОВАНИЯ СПАЕК ПОСЛЕ ВНУТРИБРЮШНЫХ ОПЕРАЦИЙ
(экспериментальное исследование)
14.01.17. – хирургия
Автореферат
диссертации на соискание ученой степени
кандидата медицинских наук
Москва – 2013
Работа выполнена в ФГБУ «Государственный научный центр Российской Федерации – Федеральный медицинский биофизический центр им. А.И. Бурназяна» ФМБА России
Научный руководитель:
кандидат медицинских наук Восканян Сергей Эдуардович
Научный консультант:
доктор медицинских наук Паклина Оксана Владимировна
Официальные оппоненты:
доктор медицинских наук,
профессор, заведующий кафедрой
хирургических болезней и клинической
ангиологии ГБОУ ВПО МГМСУ им.
А.И. Евдокимова Минздрава России
Дибиров Магомедбег Дибирмагомедович
доктор медицинских наук, профессор
кафедры хирургии ФГБОУ ВПО МГУ
им. М.В. Ломоносова
Ковалев Александр Иванович
Ведущая организация:
ФГБОУ ВПО «Российский Университет дружбы народов» Минздрава России.
Защита состоится «____»____________ 2013 г. в __.__ часов на заседании диссертационного совета Д.208.040.03 при ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова (119991, г. Москва, ул. Трубецкая, д. 8, стр.2).
С диссертацией можно ознакомиться в ГЦНМБ ГБОУ ВПО Первый Московский государственный медицинский университет им. И.М. Сеченова (117998, г. Москва, Нахимовский проспект, 49).
Автореферат разослан «____»___________ 2013 г.
Ученый секретарь
диссертационного совета
доктор медицинских наук
профессор Шулутко Александр Михайлович
Актуальность проблемы. Спаечная болезнь брюшной полости (СББП) является самым частым осложнением операций на органах брюшной полости (В.А.Липатов, 2004; Б.С.Суковатых и соавт., 2008; А.А.Дубонос, 2009). Заболевание характеризуется наличием внутрибрюшных сращений, образовавшихся в результате перенесенной ранее полостной операции или травмы, воспаления органов брюшной полости и малого таза (Л.В.Адамян, О.А.Мынбаев,1997; В.И.Ишанкулов, 2000; И.А.Мокряков, 2006; С.Р.Алиев, 2009). По поводу спаечной болезни ежегодно, в хирургических отделениях, лечится около 1% прооперированных ранее больных, у 50-75% этой категории больных развивается кишечная непроходимость, с летальностью от 13% до 55% (А.А.Воробьев, А.Г.Бебуришвили, 2001; Д.А.Вербицкий, 2004; Б.С.Суковатых и соавт., 2008; T.Liokakos et al., 2001). Частота развития СББП после оперативных вмешательств по данным разных авторов составляет от 67 до 93% (А.Г.Кригер, 2005; А.С.Ермолов, 2006, Н.Л.Матвеев и соавт., 2007; П.Б.Кремер, 2010; В.В.Маншетов, 2012; C.N.Gutt, 2004).
Число больных СББП прогрессивно увеличивается пропорционально количеству оперативных вмешательств (В.А.Липатов, 2004). СББП поражает преимущественно пациентов молодого, трудоспособного возраста от 20 до 50 лет, что представляет собой значительную медицинскую и социальную проблему (В.И.Ишанкулов, 2000; Д.А.Вербицкий, 2004; В.А.Липатов, 2004; P.Jacquet et al., 1996).
Развитие спаечной болезни является наиболее частой причиной кишечной непроходимости и составляет 60-87% от всех видов илеуса (А.М.Нечипай, 2002; С.Р.Алиев, 2009; П.Б.Кремер, 2010; А.П.Радзиховский, 2010; В.В.Маншетов, 2012; М.А.Мендель, 2012; M.C.Parker et al., 2001; C.Cartanese, 2009).
СББП нередко приводит к значительным техническим трудностям при необходимости выполнения повторных операций на органах брюшной полости, значительно увеличивая при этом длительность оперативного вмешательства и наркоза (В.И.Ишанкулов, 2000; А.И.Шаров, 2004; С.Р.Алиев, 2009; G.S.DiZerega, 1997).
Консервативное лечение СББП малоэффективно, а после оперативного лечения рецидивы заболевания составляют 32-71% (А.Е.Смирнова, 2006; С.Р.Алиев, 2009; В.В.Маншетов, 2012; H.Sulaiman et al., 2002; M.L.Freeman et al., 2003).
Показания к назначению противоспаечных средств четко не определены, в связи с чем, такие средства часто не используются вовсе (Д.А.Вербицкий, 2004; В.В.Плачев, С.А.Пашков, 2004; Н.А.Мендель, 2012; F.Catena et al., 2011).
Приоритет в профилактике СББП отдается применению антиадгезивных барьерных средств (В.А.Липатов, 2004; Б.С.Суковатых и соавт., 2008; А.А.Дубонос, 2009; G.S.DiZerega, 2001; V.W.Fazio et al., 2006; G.Ahmad et al., 2008; S.Kumar et al., 2009). Однако, результаты их применения противоречивы, а эти методы недостаточно эффективны (Б.С.Суковатых и соавт., 2008; П.Б.Кремер, 2010; М.А.Мендель, 2012). Кроме того, существующие «барьерные» средства дорогостоящи и труднодоступны отечественному потребителю (В.А.Липатов, 2004).
Таким образом, проблема СББП остается одной из актуальных в абдоминальной хирургии. С точки зрения роста числа оперативных вмешательств, высокой частоты встречаемости СББП и частоты рецидивов спаечной кишечной непроходимости предотвращение или уменьшение послеоперационных спаек является значимым приоритетом (С.Р.Алиев, 2009; В.В.Маншетов, 2012; A.Hackethal et al., 2010), а любая стратегия профилактики спаек должна быть безопасной, эффективной, практической и экономически оправданной (B.Schnuriger et al., 2011).
Цель исследования: снижение частоты и выраженности спаечной болезни брюшной полости после внутрибрюшных операций путем использования поверхностно-активных веществ.
Задачи исследования:
- Разработать эффективную и воспроизводимую экспериментальную модель спаечной болезни брюшной полости.
- Оценить выраженность спаечной болезни брюшной полости и структуру сформировавшихся спаек морфологическими и иммуногистохимическими методами в эксперименте.
- Изучить влияние внутрибрюшного введения поверхностно-активного вещества на изменения сывороточной концентрации факторов ангиогенеза, активности медиаторов, продуцируемых перитонеальными макрофагами и нейтрофилами, активности медиаторов, продуцируемых эндотелием сосудов и белков острой фазы в эксперименте.
- Разработать новый способ профилактики спаечной болезни брюшной полости после внутрибрюшных операций, основанный на внутрибрюшном введении поверхностно-активного вещества и изучить его эффективность в профилактике спаечной болезни брюшной полости в эксперименте.
- Провести сравнительный анализ эффективности нового способа профилактики спаечной болезни брюшной полости с традиционным методом.
Новизна результатов исследования:
- Впервые предложена новая экспериментальная модель спаечной болезни брюшной полости, отличающаяся высокой эффективностью осуществления и воспроизводимостью.
- Впервые исследовано влияние внутрибрюшного введения поверхностно-активного вещества на процесс внутрибрюшного спайкообразования, обосновано применение данного метода в профилактике спаечной болезни брюшной полости после внутрибрюшных операций.
- Впервые исследовано комплексное действие внутрибрюшного введения поверхностно-активного вещества на основные звенья патогенеза спаечной болезни брюшной полости.
Теоретическая значимость исследования. Использование новой модели СББП позволило существенно углубить имеющиеся представления о патогенезе СББП, что будет способствовать поиску новых методов профилактики данного осложнения.
Выявлены особенности влияния внутрибрюшного введения поверхностно-активного антисептического вещества на основные звенья патогенеза внутрибрюшного спайкообразования, что позволило обосновать применение данного метода в профилактике спаечной болезни брюшной полости.
Практическая значимость работы. Разработан новый способ профилактики спаечной болезни брюшной полости после внутрибрюшных операций, который позволил существенно уменьшить частоту и выраженность спаечного процесса в брюшной полости после внутрибрюшных операций в сравнении с традиционным методом. Разработана новая модель формирования спаечной болезни брюшной полости, позволяющая изучать патогенез внутрибрюшного спайкообразования после внутрибрюшных операций.
Основные положения, выносимые на защиту
- Внутрибрюшное введение препаратов, улучшающих метаболизм, газообмен и микроциркуляцию (перфторуглероды) приводит к увеличению частоты и выраженности спаечной болезни брюшной полости после внутрибрюшных операций, может приводить к развитию острой послеоперационной спаечной кишечной непроходимости и позволяет изучать патогенез внутрибрюшного спайкообразования, являясь таким образом адекватной моделью спаечной болезни брюшной полости.
- Внутрибрюшное введение поверхностно-активных веществ, обладающих антисептическим действием, препятствует процессу «склеивания» поврежденных поверхностей брюшины, нивелирует воспалительный процесс в брюшной полости, что способствует снижению частоты и выраженности спаечного процесса в брюшной полости, уменьшению толщины грануляционного вала, снижению VEGF, TIMP, FGF и PAL.
- Внутрибрюшное введение поверхностно-активных веществ, обладающих антисептическим действием, является эффективным способом профилактики спаечной болезни брюшной полости и может быть рекомендовано для клинического применения.
Апробация работы. Апробация работы проведена на межкафедральном заседании кафедры хирургии с курсами онкологии, эндоскопии и хирургической патологии, кафедры восстановительной медицины, спортивной медицины, курортологии и физиотерапии с курсом сестринского дела, кафедры урологии и андрологии ИППО ФГБУ «ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА» протокол №3 от 22.03.2013 года.
Личный вклад автора. Автор непосредственно участвовал в выборе направления исследования и анализе его результатов. Все экспериментальные исследования (120 животных), а также разработка методики интраабдоминального введения препаратов выполнены автором. Автором самостоятельно проведены забор и обработка гистологического материала, а так же иммуноферментный анализ плазмы исследуемых животных. Анализ литературных данных, материалов исследования и обработка полученных данных проведены лично Кызласовым П.С. Вклад автора является определяющим и заключается в участии на всех этапах исследования, написании научных работ, отражающих результаты исследования.
Основные положения работы доложены и обсуждены на Межрегиональной научно-практической конференции молодых ученых и студентов с международным участием «проблемы медицины и биологии», Кемерово, Россия, 2013; 23-м Всемирном Конгрессе Международной ассоциации хирургов, гастроэнтерологов и онкологов (IASGO), Бухарест, Румыния, 2013; III съезде хирургов Юга России с международным участием, Астрахань, Россия, 2013; межкафедральном заседании кафедры хирургии с курсами онкологии, эндоскопии и хирургической патологии, кафедры восстановительной медицины, спортивной медицины, курортологии и физиотерапии с курсом сестринского дела, кафедры урологии и андрологии ИППО ФГБУ «ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА» 22.03.2013 года.
Публикации. По теме диссертации опубликовано 9 печатных работ, из них 3 в ведущих рецензируемых научных журналах.
Структура и объем работы. Диссертация изложена на 178 страницах и состоит из введения, обзора литературы, 4 глав с описанием методики, результатов исследования и обсуждения результатов исследования, выводов, библиографии (183 источников на русском и 126 на иностранных языках) и приложений. Работа содержит 41рисунок и 18 таблиц.
СОДЕРЖАНИЕ РАБОТЫ
Характеристика материала и методов исследования
Экспериментальное исследование выполнено на 120 здоровых половозрелых самцах крыс породы Вистар, массой 170-200 г. Эксперименты были разбиты на 4 группы (по 30 животных), в каждой из которых было выделено 3 подгруппы – по 10 животных в каждой (таблица 1).
Таблица 1
Распределение животных по группам
| Группа | Задачи исследования | Кол-во ж-х |
| Группа 1 | Изучение наличия и выраженности спаечной болезни, ее морфологическая оценка, определение экспрессии факторов ангиогенеза, функциональной активности медиаторов, продуцируемых перитонеальными макрофагами и нейтрофилами, медиаторов, продуцируемых эндотелием сосудов и С-реактивного белка в сыворотке крови после моделирования спаечной болезни брюшной полости без применения противоспаечных средств на третьи, седьмые и четырнадцатые сутки моделирования спаечного процесса | 30 |
| Группа 2 | Изучение наличия и выраженности спаечной болезни, ее морфологическая оценка, определение экспрессии факторов ангиогенеза, функциональной активности медиаторов, продуцируемых перитонеальными макрофагами и нейтрофилами, медиаторов, продуцируемых эндотелием сосудов и уровень С-реактивного белка в сыворотке крови после моделирования спаечной болезни брюшной полости и интраперитонеального введения препарата «Перфторан» на третьи, седьмые и четырнадцатые сутки моделирования спаечного процесса | 30 |
| Группа 3 | Изучение наличия и выраженности спаечной болезни, ее морфологическая оценка, определение экспрессии факторов ангиогенеза, функциональной активности медиаторов, продуцируемых перитонеальными макрофагами и нейтрофилами, медиаторов, продуцируемых эндотелием сосудов и уровень С-реактивного белка в сыворотке крови после моделирования спаечной болезни брюшной полости и интраперитонеального введения противоспаечного геля «Мезогель» на третьи, седьмые и четырнадцатые сутки моделирования спаечного процесса | 30 |
| Группа 4 | Изучение наличия и выраженности спаечной болезни, ее морфологическая оценка, определение экспрессии факторов ангиогенеза, функциональной активности медиаторов, продуцируемых перитонеальными макрофагами и нейтрофилами, медиаторов, продуцируемых эндотелием сосудов и уровень С-реактивного белка в сыворотке крови после моделирования спаечной болезни брюшной полости и интраперитонеального введения поверхностно-активного и антисептического препарата «Мирамистин» на третьи, седьмые и четырнадцатые сутки моделирования спаечного процесса | 30 |
Все исследования выполнены на животных, содержащихся в условиях отсутствия пищи не менее 24 часов до выполнения эксперимента при свободном доступе к воде. C целью обезболивания, анестезии и седации внутримышечно вводили препарат «Золетил 100» (S. Virbac, Франция), в дозе 2 мг/100 г в соответствии с инструкцией по применению препарата.
Спаечный процесс брюшной полости воспроизводили асептическим травматическим способом, который включал травматизацию париетальной и висцеральной брюшины (В.А.Липатов, 2004). В правой подвздошной области после предварительной гидравлической препаровки с помощью 3 мл 0,9% раствора NaCl, проводилась десерозирование передней брюшной стенки марлевым тампоном на зажиме типа «Москит», на площади 1 см2. Конечные отделы тонкой кишки и слепая кишка на всей поверхности с помощью марлевого тампона подвергались скарификации на протяжении 4 см, до появления на поверхности «кровавой росы». После чего в группе 1 проводили послойное ушивание раны. В группе 2 в брюшную полость вводили раствор Перфторана, в правую и левую подвздошные области устанавливались дренажи, послеоперационная рана послойно ушивалась. Через пять часов после внутрибрюшного введения Перфторана производилась пассивная (через дренажи) эвакуация раствора из брюшной полости. В группе 3 в брюшную полость вводили противоспаечное средство Мезогель, осуществляя равномерное распределение препарата по всей висцеральной брюшине и брюшной полости, послеоперационная рана послойно ушивалась. В группе 4 в брюшную полость вводили поверхностно-активное вещество Мирамистин, в правую и левую подвздошные области устанавливались дренажи, послеоперационная рана послойно ушивалась. Через пять часов после внутрибрюшного введения Мирамистина производилась пассивная (через дренажи) эвакуация раствора из брюшной полости.
Объем вводимых в брюшную полость препаратов был равнозначным, составил 1,7 мл/100 г веса и был вычислен по таблице расчета объема брюшной полости у экспериментальных животных, предложенной G.S.DiZerega (1999).
Таблица 2
Оценка распространенности спаечной болезни брюшной полости
| Баллы | Характеристика |
| 0 | Спайки отсутствуют |
| 1 | Единичные спайки (без вовлечения в процесс внутренних органов) |
| 2 | Единичные висцеро-висцеральные и/или висцеро-париетальные спайки (с вовлечением в процесс внутренних органов) |
| 3 | Множественные спайки, спаечный процесс, ограниченный одной анатомической областью |
| 4 | Множественные распространенные спайки, спаечный процесс выходит за пределы одной анатомической области, но захватывает не более 1/2 брюшной полости |
| 5 | Множественные распространенные спайки, спаечный процесс захватывает более 1/2 брюшной полости или носит характер тотального спайкообразования |
Оценка спаечной болезни брюшной полости проводилась с помощью шкал, предложенных В.А.Липатовым, 2004. Оценивались распространенность спаечной болезни (табл. 2), а также деформация внутренних органов, вовлеченных в спаечный процесс (табл. 3).
Таблица 3
Оценка деформации органов, вовлеченных в спаечный процесс
| Баллы | Характеристика |
| 0 | Деформация органов отсутствует |
| 1 | Деформация выявляется лишь при применении специальных методов исследования или при нагрузке: перистальтика и т.д. (функциональная деформация) |
| 2 | Незначительная, едва заметная деформация органов |
| 3 | Заметная деформация внутренних органов |
| 4 | Выраженная деформация внутренних органов |
| 5 | Выраженная деформация внутренних органов с нарушением пассажа |
После этого производилась оценка спаечной болезни брюшной полости методом семантического дифференциала (В.А.Липатов, 2004).
Наличие спаечной болезни надежно верифицировали при постмортальном гистологическом исследовании. Послеоперационный материал фиксировали в 10% забуференном растворе формалина, после чего заливали в парафин. Серийные парафиновые срезы толщиной 3 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином и исследовали при помощи микроскопа Axio Jmager A1 фирмы Zeiss (Германия). Для сканирования препаратов использовали гистологический сканер Miraxdesk фирмы Zeiss (Германия), полученное изображение обрабатывалось и переводилось в режим фотографии при помощи программ Miraxscan и Miraxviewer фирмы Zeiss (Германия).
При помощи иммуногистохимического исследования (ИГХ) в соответствии со стандартным протоколом образовавшихся спаек брюшной полости определяли гладкомышечный актин, коллаген I типа и коллаген II типа с использованием специфических антител. Для проведения ИГХ материал фиксировали в 10%-ном забуференном формалине (рН=7,2), проводили по батарее спиртов и ксилолов, заливали в парафин по стандартной методике. Серийные парафиновые срезы толщиной 1-2 мкм депарафинировали по стандартному протоколу. Далее срезы по 5 минут промывали в деионизированной дистиллированной воде и фосфатном буфере (рН-7,4). Интенсивность реакций оценивали полуколичественным методом: (-/0) – отрицательная, (+/1) – слабая, (++/2) – средняя, (+++/3) – интенсивная. Долю занимаемой соединительной ткани рассчитывали с помощью программы WCIF ImageJ, при одинаковых настройках камеры и микроскопа.
Сыворотка крови подвергалась иммуноферментному анализу (ИФА). Результат ИФА оценивался спектрофотометрически. Проводилось определение в сыворотке крови фактора роста фибробластов (FGF) с помощью иммуноферментного набора для количественного определения фактора роста фибробластов (R&D Systems, Inc, USA), фактора роста сосудистого эндотелия (VEGF-A) с помощью иммуноферментного набора для количественного определения васкулоэндотелиального фактора роста А (Bender Med Systems GmbH, Vienna, Austria), миелопероксидазы (MPO) с помощью иммуноферментного набора для количественного определения миелопероксидазы (Bender Med Systems GmbH, Vienna, Austria), тканевого ингибитора металлопротеиназы (TIMP-1) с помощью иммуноферментного набора для количественного определения тканевого ингибитора металлопротеиназы (Bender Med Systems GmbH, Vienna, Austria), ингибитора активатора плазминогена (PAI-1) с помощью иммуноферментного набора для определения количества ингибитора активатора плазминогена (Technoclone GmbH, Vienna, Austria) и индуцибельной синтазы оксида азота (iNOS) с помощью иммуноферментного набора для количественного in vitro определения iNOS в образцах сыворотки крови, плазмы крови и других биологических жидкостях (Uscn Life Science, Inc., USA).
При помощи метода иммунотурбедиметрии производилось количественное определение концентрации С-реактивного белка (СРБ) в сыворотке крови
Значения количественных признаков представлялись в виде «Медиана (Межквартильный интервал)». Статистическая значимость различий между сравниваемыми группами определялась с помощью непараметрических критериев (ANOVA Краскела-Уоллиса, U-критерий Манна-Уитни, критерий 2), при уровне значимости p<0,05. Математическая обработка результатов производилась с использованием пакета прикладных программ Windows “Statistica 6.0” (StatSoft Inc. США) с учетом рекомендаций специальных руководств по медицинской и биологической статистике.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Моделирование спаечной болезни брюшной полости (контрольная группа) приводила к формированию интраабдоминальных спаек у 7 животных (70%) на третьи сутки после вмешательства, у 6 животных (60%) на седьмые сутки и у 8 животных (80%) на четырнадцатые сутки (рис. 1). Внутрибрюшное введение перфторана после формирования модели спаечной болезни брюшной полости приводило к формированию интраабдоминальных спаек у всех исследуемых животных (100%) на всех сроках исследования (рис. 1). Внутрибрюшное введение противоспаечного средства мезогеля после моделирования спаечной болезни брюшной полости снижало процесс спайкообразования. На третьи сутки после вмешательства спаечная болезнь была выявлена у 3 животных (30%), на седьмые сутки – у 2 животных (20%), а на четырнадцатые сутки – у 4 животных (40%) (рис. 1). При интраперитонеальном введении поверхностно-активного вещества мирамистин после моделирования спаечной болезни брюшной полости спайки брюшной полости были выявлены у 10% животных (1 особь) на третьи сутки после операции, а также на седьмые и на четырнадцатые сутки (рис. 1).
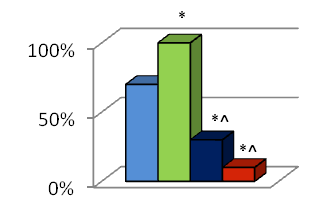
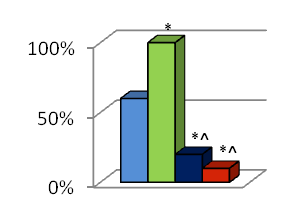

Рисунок 1. Частота спайкообразования на третьи, седьмые и четырнадцатые сутки после моделирования спаечной болезни брюшной полости и внутрибрюшного введения различных противоспаечных средств. 1 – контрольная группа; 2 – группа животных после внутрибрюшного введения Перфторана; 3 – группа животных после внутрибрюшного введения Мезогеля; 4 – групппа животных после внутрибрюшного введения Мирамистина; * - различия статистически значимы (p<0,05) по сравнению с контрольной группой (критерий 2); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Перфторана (критерий 2), # - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Мезогеля (критерий 2).
При оценке выраженности и распространенности спаечного процесса было выявлено, что у животных контрольной группы и у животных после внутрибрюшного введения Перфторана спаечный процесс протекал наиболее тяжело, по сравнению с животными контрольной группы, а также с животными после внутрибрюшного введения Мезогеля и поверхностно-активного вещества Мирамистина (табл. 4).
Таблица 4
Характеристика распространенности спаечного процесса в различные сроки после моделирования спаечной болезни брюшной полости в различных группах
| Группы животных | Баллы | |||||
| 0 | 1 | 2 | 3 | 4 | 5 | |
| Количество животных, (Абс. (%)) | ||||||
| Третьи послеоперационные сутки | ||||||
| 1 (n=10) | 3 (30%) | - | 1 (10%) | 3 (30%) | 3 (30%) | - |
| 2 (n=10)* | - | - | - | - | 3 (30%) | 7 (70%) |
| 3 (n=10)*^ | 7 (70%) | - | 1 (10%) | 2 (20%) | - | - |
| 4 (n=10)*^# | 9 (90%) | 1 (10%) | - | - | - | - |
| Седьмые послеоперационные сутки | ||||||
| 1 (n=10) | 4 (40%) | - | 1 (10%) | 3 (30%) | 2 (20%) | - |
| 2 (n=10)* | - | - | - | - | 2 (20%) | 8 (80%) |
| 3 (n=10)*^ | 8 (80%) | 2 (20%) | - | - | - | - |
| 4 (n=10)*^ | 9 (90%) | 1 (10%) | - | - | - | - |
| Четырнадцатые послеоперационные сутки | ||||||
| 1 (n=10) | 2 (20%) | 0 | 1 (10%) | 3 (30%) | 4 (40%) | - |
| 2 (n=10)* | - | - | - | - | 2 (20%) | 8 (80%) |
| 3 (n=10)*^ | 6 (60%) | 1 (10%) | 3 (30%) | - | - | - |
| 4 (n=10)*^# | 9 (90%) | 1 (10%) | - | - | - | - |
Примечание: *- различия статистически значимы (p<0,05) по сравнению с контрольной группой (ANOVA Краскела-Уоллиса); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Перфторана (ANOVA Краскела-Уоллиса); # - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Мезогеля (ANOVA Краскела-Уоллиса).
Спаечный процесс у животных после внутрибрюшного введения Перфторана на всех сроках исследования был представлен распространенными множественными интраабдоминальными спайками и у большинства животных носил характер тотального спайкообразования (табл. 4). Внутрибрюшное введение Мирамистина после моделирования спаечной болезни брюшной полости приводило к тому, что спаечный процесс, развившийся у одного животного был представлен единичными межпетельными спайками на всех сроках исследования (p<0,05 по сравнению со всеми группами животных) (табл. 4).
При оценке спаечной деформации внутренних органов было выявлено, что у всех животных после внутрибрюшного введения Перфторана спаечный процесс выражено деформировал тонкую и толстую кишку, что в большинстве случаев приводило к нарушению пассажа по кишке и развитию спаечной кишечной непроходимости (табл. 5).
Таблица 5
Характеристика деформации внутренних органов при развитии спаечной болезни в разные сроки после моделирования спаечной болезни брюшной полости в различных группах животных
| Группы животных | Баллы | |||||
| 0 | 1 | 2 | 3 | 4 | 5 | |
| Количество животных, (Абс. (%)) | ||||||
| Третьи послеоперационные сутки | ||||||
| 1 (n=7) | - | 1 (14,2%) | 3 (42,9%) | 3 (42,9%) | - | - |
| 2 (n=10)* | - | - | - | - | 3 (30%) | 7 (70%) |
| 3 (n=3)*^ | - | - | 2 (66,7%) | 1 (33,3%) | - | - |
| 4 (n=1)*^# | - | 1 (100%) | - | - | - | - |
| Седьмые послеоперационные сутки | ||||||
| 1 (n=6) | - | - | 2 (33,3%) | 3 (50%) | 1 (16,7%) | - |
| 2 (n=10)* | - | - | - | 1 (10%) | 4 (40%) | 5 (50%) |
| 3 (n=2)*^ | - | - | 2 (100%) | - | - | - |
| 4 (n=1)*^# | - | 1 (100%) | - | - | - | - |
| Четырнадцатые послеоперационные сутки | ||||||
| 1.3 (n=8) | - | - | 1 (12,5%) | 5 (62,5%) | 2 (25%) | - |
| 2.3 (n=10)* | - | - | - | - | - | 10 (100%) |
| 3.3 (n=4)*^ | - | - | 3 (75%) | 1 (25%) | - | - |
| 4.3 (n=1)*^# | 1 (100%) | - | - | - | - | - |
Примечание: *- различия статистически значимы (p<0,05) по сравнению с контрольной группой (ANOVA Краскела-Уоллиса); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Перфторана (ANOVA Краскела-Уоллиса); # - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Мезогеля (ANOVA Краскела-Уоллиса).
Внутрибрюшное введение Мирамистина после моделирования спаечной болезни приводило к формированию внутрибрюшных спаек у одного животного без деформации толстой и тонкой кишки на всех сроках исследования (p<0,05 по сравнению со всеми группами животных) (табл. 5).
На четырнадцатые сутки после формирования модели спаечной болезни брюшной полости у животных контрольной группы наблюдались рубцово-деформированные поврежденные участки висцеральной и париетальной брюшины, в спаечный процесс были вовлечены паренхиматозные органы, а также участки десерозированной висцеральной и париетальной брюшины (рис. 2).


Рисунок 2. А. Спаечный процесс брюшной полости на четырнадцатые сутки после моделирования спаечной болезни у животных контрольной группы. 1 – париетальная брюшина; 2 – спайки; 3 – тонкая кишка. Б (микро). Спаечный конгломерат с вовлечением в спаечный процесс печени (1), селезенки (2), поджелудочной железы (3), париетальной брюшины (4) на четырнадцатые сутки после моделирования спаечной болезни брюшной полости. Окраска гематоксилином и эозином, 50.
Внутрибрюшное введение Перфторана после моделирования спаечного процесса брюшной полости, приводило к тому, что к четырнадцатым суткам после операции все животные были истощены, отказывались от питания. Спаечный процесс был распространенным с вовлечением десерозированных участков висцеральной и париетальной брюшины, выраженной деформацией внутренних органов, формированием спаечного конгломерата дилятированных кишечных петель, которые при вскрытии содержали застойное отделяемое (рис. 3).
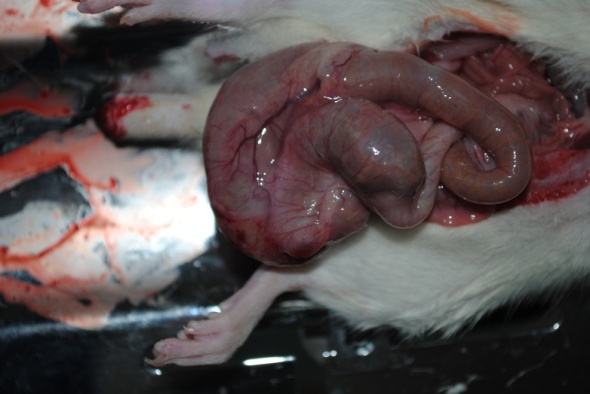

Рисунок 3. А. Спаечный конгломерат дилятированных петель кишки на четырнадцатые сутки после моделирования спаечной болезни брюшной полости и внутрибрюшного введения Перфторана. 1 – дилятированные петли кишки; 2 – спаечный конгломерат. Б (микро). Сдавление и дилятация петель кишки при спаечной непроходимости. 1 – париетальная брюшина; 2 – дилятированные петли кишок; 3 – спайки; 4 – сдавленная кишка. Окраска гематоксилином и эозином, 50.
На четырнадцатые сутки после моделирования спаечной болезни брюшной полости и внутрибрюшного введения Мезогеля наблюдались рубцово-деформированные десерозированные участки висцеральной и париетальной брюшины, выявленные спайки были сформированы между кишкой и послеоперационным рубцом (рис. 4).



Рисунок 4. А. Тракционные спайки на четырнадцатые сутки после моделирования спаечной болезни брюшной полости и внутрибрюшного введения Мезогеля. 1 – париетальная брюшина; 2 – тракционные спайки между кишкой и послеоперационным рубцом. Б (микро). Фиксация слепой кишки посредством образования спаек в области десерозированных париетальной и висцеральной брюшины у животных на третьи сутки после моделирования спаечной болезни брюшной полости и внутрибрюшного введения Мезогеля. 1 – париетальная брюшина; 2 – спайки; 3 – слепая кишка. Окраска Гематоксилином и эозином, 100. В (микро). «Свежие» фиброзные спайки между париетальной и висцеральной брюшиной у животных на третьи сутки после формирования модели спаечной болезни брюшной полости и последующим внутрибрюшным введением Мезогеля. 1 – тонкая кишка; 2 – спайка. Окраска гематоксилином и эозином, 200.
Через четырнадцать суток после формирования модели спаечной болезни брюшной полости и последующего внутрибрюшного введения Мирамистина были выявлены гладкие, блестящие десерозированные участки висцеральной и париетальной брюшины, без рубцовых изменений, париетальная брюшина и кишка были интактны (рис. 5).

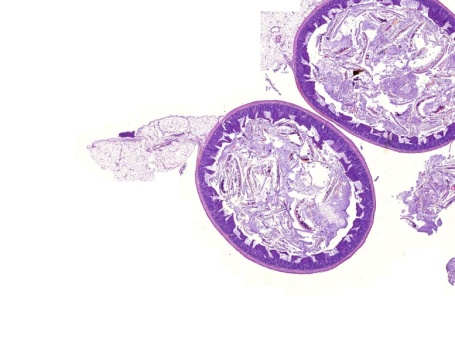

Рисунок 5. А. Неизмененные петли кишечника (указаны стрелками) на 14-е сутки после моделирования спаечной болезни брюшной полости и интраперитонеального введения Мирамистина. Б (микро). Отсутствие спаечного процесса в брюшной полости на четырнадцатые сутки после моделирования спаечной болезни брюшной полости и последующим интраперитонеальным введением Мирамистина. 1 – петли тонкой кишки; 2 – брыжейка тонкой кишки. Окраска Гематоксилином и эозином, 50. В (микро). Межпетельные тонкие спайки на четырнадцатые сутки после моделирования спаечной болезни брюшной полости и последующим интраперитонеальным введением Мирамистина. 1 – петли тонкой кишки; 2 – спайки. Окраска гематоксилином и эозином, 50.
Таким образом, у всех животных, которым после моделирования спаечной болезни брюшной полости интраперитонеально вводили Перфторан спаечный процесс носил характер тотального спайкообразования с формированием спаечного конгломерата кишок, с деформацией внутренних органов и развитием тонко- и толстокишечной непроходимости на всех сроках наблюдения. После внутрибрюшного введения Мезогеля после моделирования спаечного процесса брюшной полости у животных с развившимся спаечным процессом в большинстве случаев наблюдались висцеропариетальные спайки, вовлекающие и деформирующие внутренние органы, но не приводящие к нарушению их функции и пассажа содерживого. Наиболее мягко спаечный процесс протекал у животных, которым после формирования модели спаечной болезни брюшной полости интраперитонеально вводили поверхностно-активное вещество Мирамистин – у животных с формировавшимся спаечным процессом брюшной полости наблюдались единичные внутрибрюшные спайки без вовлечения и деформации внутренних органов на всех сроках исследования. Данные результаты подтверждались также при гистологическом исследовании постмортального материала.
При оценке выраженности спаечного процесса брюшной полости методом семантического дифференциала было выявлено, что наиболее тяжело спаечный процесс протекал у животных, которым интраперитонеально вводили Перфторан, а наименее тяжело – у животных, которым интарперитонеально вводили поверхностно-активное вещество Мирамистин (табл. 6).
Таблица 6
Выраженность спаечного процесса в группах животных в различные сроки после вмешательства оцененная методом семантического дифференциала
| Группы животных | Животные со спаечной болезнью (Абс. (%)) | Выраженность спаечной болезни в баллах методом семантического дифференциала |
| Третьи сутки после вмешательства | ||
| 1.1 (n=10) | 7 (70%) | 2,45±0,21 |
| 2.1 (n=10) | 10 (100%) | 4,12±0,11* |
| 3.1 (n=10) | 3 (30%) | 0,97±0,18*^ |
| 4.1 (n=10) | 1 (10%) | 0,21±0,08*^ # |
| Седьмые сутки после вмешательства | ||
| 1.2 (n=10) | 6 (60%) | 1,92±0,16 |
| 2.2 (n=10) | 10 (100%) | 3,98±0,14* |
| 3.2 (n=10) | 2 (20%) | 0,56±0,13*^ |
| 4.2 (n=10) | 1 (10%) | 0,17±0,11*^ # |
| 1.2 (n=10) | 8 (80%) | 2,32±0,12 |
| 2.2 (n=10) | 10 (100%) | 4,10±0,11* |
| 3.2 (n=10) | 4 (40%) | 0,81±0,15*^ |
| 4.2 (n=10) | 1 (10%) | 0,19±0,09*^ # |
Примечание: *- различия статистически значимы (p<0,05) по сравнению с контрольной группой (ANOVA Краскела-Уоллиса); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Перфторана (ANOVA Краскела-Уоллиса); # - различия статистически значимы (p<0,05) по сравнению с группой животных с интраперитонеальным применением Мезогеля (ANOVA Краскела-Уоллиса).
Внутрибрюшное введение Перфторана после моделирования спаечной болезни брюшной полости статистически значимо (p<0,05) увеличивало интенсивность и выраженность спаечного процесса по сравнению с контрольной группой в различные сроки исследования (табл. 6). Внутрибрюшное введение Мезогеля и Мирамистина после моделирования СББП приводило к статистически значимому снижению выраженности спаечного процесса по сравнению с контрольной группой (p<0,05) и группой животных после внутрибрюшного введения Перфторана (p<0,05), причем внутрибрюшное введение Мирамистина приводило к статистически значимому (p<0,05) снижению выраженности спаечного процесса по сравнению с группой животных, которым выполнялось интраперитонеальное введение Мезогеля во все сроки исследования (таблица 6).
После моделирования спаечной болезни брюшной полости было выявлено, что толщина грануляционного вала на десерозированных участках париетальной брюшины уменьшается с течением времени (рис. 6).

Рисунок 6. Толщина грануляционного вала на поверхности десерозированных участков париетальной и висцеральной брюшины в различные сроки после моделирования спаечной болезни и применения различных противоспаечных средств. * - различия статистически значимы (p<0,05) по сравнению с контрольной группой (U-критерий Манна-Уитни); ° - различия статистически значимы (p<0,05) по сравнению с группой животных с применением Перфторана (U-критерий Манна-Уитни); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с применением Мезогеля (U-критерий Манна-Уитни); v - различия статистически значимы (p<0,05) по сравнению с аналогичным показателем на 3-и сутки после вмешательства (U-критерий Манна-Уитни); # - различия статистически значимы (p<0,05) по сравнению с аналогичным показателем на 7-е сутки после вмешательства (U-критерий Манна-Уитни).
У животных после внутрибрюшного введения Перфторана и Мезогеля после моделирования СББП было выявлено, что грануляционный вал на десерозированных участках брюшины имел большую толщину (367 (337-554) мкм в группе 2 и 401 (135-457) мкм в группе 3) по сравнению с животными контрольной группы (228 (193-359) мкм) на третьи сутки после операции (p<0,05). На седьмые сутки после моделирования СББП толщина грануляционного вала во 2 группе (409 (354-505) мкм) и 3 группе (442 (193-580) мкм) еще больше превышала показатель в контрольной группе (172 (93-421) мкм) (p<0,05). К четырнадцатым суткам после моделирования СББП наблюдалось уменьшение толщины грануляционного вала в контрольной группе (115 (21-235) мкм), во 2 группе животных (212 (199-250) мкм) (p<0,05 по сравнению с контрольной группой) и в 3 группе животных (105 (53-192) мкм) (p<0,05 по сравнению с группой животных после внутрибрюшного введения Перфторана) (рис. 6).
В группе животных которым в брюшную полость вводили поверхностно-активное вещество Мирамистин после формирования модели спаечной болезни толщина грануляционного вала на десерозированных поверхностях брюшины была наименьшей на третьи сутки после вмешательства (192 (112-324) мкм) по сравнению с контрольной группой, группой животных после внутрибрюшного введения Перфторана (p<0,05) и группой животных после внутрибрюшного введения противоспаечного вещества Мезогель (p<0,05). С течением времени наблюдалось уменьшение толщины грануляционного вала на десерозированных участках париетальной и висцеральной брюшины и на седьмые сутки после вмешательства составила 150 (82-402) мкм (p<0,05 по сравнению с группами 2 и 3), а на четырнадцатые сутки – 99 (17-192) мкм (p<0,05 по сравнению с группой 2) (рис. 6).
При исследовании активности фибробластов и состава коллагеновой матрицы на 14-е сутки после операции было выявлено, что во всех исследованных группах образовавшиеся спайки активно продуцировали гладкомышечный актин, а структура спаек была представлена преимущественно коллагеном III-го типа.
При иммуногистохимическом исследовании (ИГХ) фиброзных спаек на четырнадцатые сутки после моделирования спаечной болезни брюшной полости была выявлена диффузная экспрессия гладкомышечного актина (+++/3), и умеренная экспрессия макрофагов (рис. 7), что свидетельствовало о наличии секреторных миофибробластов в составе спайки, вырабатывающих экстрацеллюлярный коллаген и способствующих образованию более плотных спаек.

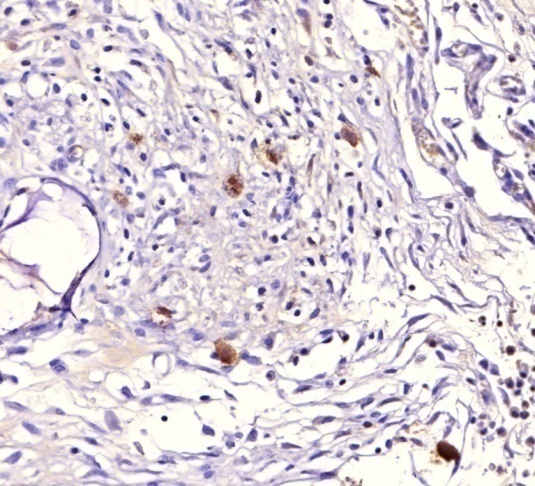
Рисунок 7. А. Экспрессия гладкомышечного актина при спаечной болезни брюшной полости. 1 – петли кишки; 2 – спайка. ИГХ 200. Б. Экспрессия макрофагами CD 68 при спаечной болезни брюшной полости. ИГХ 200.
При изучении фибриллярных коллагенов во всех экспериментальных группах животных, у которых были выявлены спайки, мы обнаружили усиление экспрессии коллагена III типа (+++/3) (рис. 8), коллаген I типа определялся в следовых значениях и не подлежал оценке.

Рисунок 8. Экспрессия коллагена III типа в фиброзной спайке на четырнадцатые сутки после моделирования спаечной болезни брюшной полости. 1 – тонкая кишка; 2 – спайка. Иммуногистохимия. 200.
Моделирование СББП (контрольная группа) приводило к росту сывороточной концентрации васкулоэндотелиального фактора роста – VEGF (163,86 (131,23-205,83) пг/мл), тканевого ингибитора металлопротеиназы 1 – TIMP-1 (23,10 (15,32-28,43) пг/мл) и фактора роста фибробластов – FGF (21,85 (20,78-22,17) пг/мл) к четырнадцатым суткам после вмешательства. Не выявлено различий (p>0,05) между изменениями сывороточного уровня ингибитора активатора плазминогена – PAI-1 (39 (38-41) нг/мл) в контрольной группе животных в течение всего периода наблюдений. Концентрация миелопероксидазы – МРО имела незначительный рост к седьмым суткам (38,62 (34,78-43,76) пг/мл) после вмешательства по сравнению с третьими сутками (29,98 (27,10-35,71) пг/мл) с последующим снижением к четырнадцатым суткам наблюдения (31,27 (27,64-34,31) пг/мл), не достигая статистической значимости (p>0,05) по сравнению с показателем на третьи сутки. Выявлено статистически значимое (p<0,05) снижение концентрации С-реактивного белка на седьмые сутки исследования (0,9 (0,6-1,0) мг/мл) по сравнению с третьими сутками (5,3 (5,0-5,8) мг/мл) и на четырнадцатые сутки (0,4 (0,3-0,5) мг/мл) (рис. 9).
Внутрибрюшное введение Перфторана после моделирования спаечной болезни брюшной полости приводило к увеличению концентрации TIMP-1 (12,57 (8,41-13,42) пг/мл), MPO (67,81 (48,91-76,16) пг/мл), PAI-1 (55 (53-56) нг/мл), FGF (45,55 (41,25-46,36) пг/мл), снижало концентрацию VEGF (71,04 (68,59-76,62) пг/мл) и не влияло на концентрацию СРБ (5,3 (5,0-5,8) мг/мл) на третьи сутки после вмешательства по сравнению с контрольной группой (рис. 9).



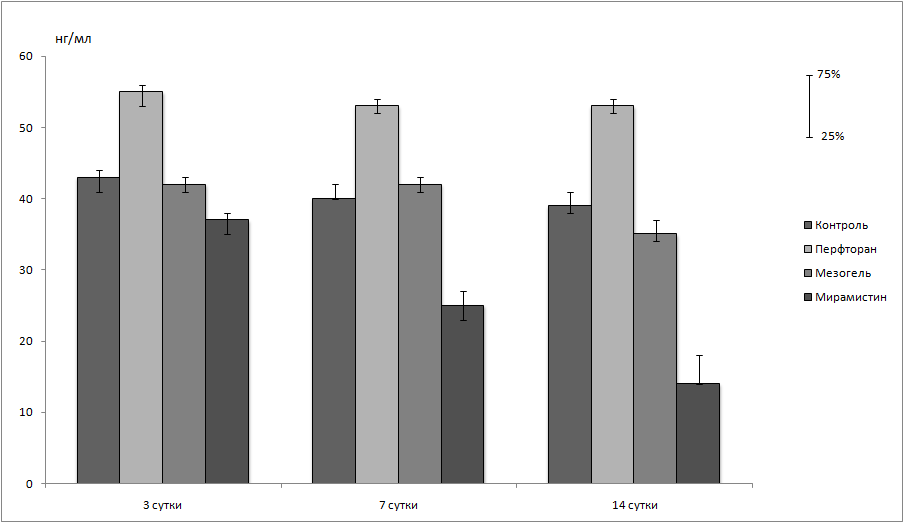


Рисунок 9. Уровень сывороточной концентрации VEGF (А), TIMP-1 (Б), MPO (В), PAI-1 (Г), FGF (Д) и СРБ (Е) в различные сроки после моделирования спаечной болезни брюшной полости и применения различных противоспаечных средств. * - различия статистически значимы (p<0,05) по сравнению с контрольной группой (U-критерий Манна-Уитни); ° - различия статистически значимы (p<0,05) по сравнению с группой животных с применением Перфторана (U-критерий Манна-Уитни); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с применением Мезогеля (U-критерий Манна-Уитни); v - различия статистически значимы (p<0,05) по сравнению с аналогичным показателем на 3-и сутки после вмешательства (U-критерий Манна-Уитни); # - различия статистически значимы (p<0,05) по сравнению с аналогичным показателем на 7-е сутки после вмешательства (U-критерий Манна-Уитни).
К седьмым суткам после внутрибрюшного введения Перфторана отмечен статистически значимый (p<0,05) рост сывороточной концентрации VEGF (160,27 (113,48-208,12) пг/мл), PAI-1 (53 (52-54) нг/мл), FGF (22,32 (21,20-22,96) пг/мл) и СРБ (5,5 (4,9-5,7) мг/мл), снижение концентрации MPO (38,13 (30,31-40,15) пг/мл) и не выявлено различий (p>0,05) в концентрации TIMP-1 (13,04 (7,90-14,01) пг/мл) по сравнению с третьими сутками после вмешательства. Отмечено, что сывороточная концентрация VEGF, TIMP-1, PAI-1, FGF и СРБ была статистически значимо (p<0,05) выше по сравнению с контрольной группой на третьи и седьмые сутки. На четырнадцатые сутки после внутрибрюшного введения Перфторана выявлено снижение концентрации TIMP-1 (13,57 (7,58-14,78) пг/мл) и MPO (30,14 (26,45-61,23) пг/мл), и не выявлено различий (p>0,05) между концентрациями VEGF (165,29 (119,74-214,46) пг/мл), PAI-1 (53 (52-54) нг/мл), FGF (55,91 (53,16-56,67) пг/мл) и СРБ (5,3 (4,9-5,7) мг/мл) по сравнению с седьмыми сутками после вмешательства (рис. 9).
Внутрибрюшное введение противоспаечного препарата Мезогель приводило к увеличению концентрации VEGF (104,59 (92.34-132,82) пг/мл), к уменьшению концентрации PAI-1 (42 (41-44) нг/мл), FGF (22,32 (21,20-22,96) пг/мл) и СРБ (2,3 (1,9-2,4) мг/мл) и не влияло на концентрацию TIMP-1 (12,43 (6,45-15,87) пг/мл), MPO (64,55 (55,91-79,61) пг/мл) на третьи сутки после операции по сравнению с внутрибрюшным введением Перфторана, причем концентрации TIMP-1 и MPO были выше по сравнению с контрольной группой. На седьмые сутки после внутрибрюшного введения Мезогеля выявлен рост концентрации VEGF (157,78 (115,76-197,37) пг/мл), TIMP-1 (23,30 (6,45-15,87) пг/мл), снижение концентрации MPO (39,45 (30,31-40,15) пг/мл) и не наблюдалось различий (p>0,05) между значениями концентрации PAI-1 (42 (41-43) нг/мл), FGF (17,43 (16,95-18,01) пг/мл) и СРБ (1,2 (0,7-1,3) мг/мл) по сравнению с показателями на третьи сутки, причем концентрации VEGF и TIMP-1 были статистически значимо (p<0,05) выше по сравнению с контрольной группой, концентрация TIMP-1 была статистически значимо выше, а концентрации PAI-1, FGF и СРБ были статистически значимо ниже по сравнению с группой животных после внутрибрюшного введения Перфторана. К четырнадцатым суткам после внутрибрюшного введения Мезогеля отмечалось снижение концентрации VEGF (165,29 (119,74-214,46) пг/мл), TIMP-1 (11,68 (9,67-20,43) пг/мл), MPO (31,29 (26,45-37,94) пг/мл) и СРБ (0,3 (0,2-0,5) мг/мл), но не отмечено различий в концентрации FGF (17,43 (16,95-18,01) пг/мл) по сравнению с седьмыми сутками. Концентрации VEGF и TIMP-1 были статистически значимо (p<0,05) ниже по сравнению с контрольной группой, а концентрации VEGF, PAI-1, FGF и СРБ были статистически значимо (p<0,05) ниже по сравнению с группой животных после внутрибрюшного введения Перфторана (рис. 9).
Интраперитонельное введение поверхностно-активного вещества Мирамистина приводило к снижению концентрации PAI-1 (37 (35-38) нг/мл), FGF (17,47 (17,12-19,03) пг/мл) и СРБ (0,9 (0,7-1,0) мг/мл) по сравнению со всеми исследованными группами животных, снижению концентрации (VEGF 71,06 (68,74-93,23) пг/мл) по сравнению с контрольной группой и группой животных после внутрибрюшного введения Перфторана, снижению концентрации MPO (26,79 (24,29-37,13) пг/мл) по сравнению с группами животных после внутрибрюшного введения Перфторана и Мезогеля на третьи сутки после вмешательства (p<0,05). На седьмые сутки после внутрибрюшного введения Мирамистина выявлено снижение концентрации TIMP-1 (7,01 (5,0-15,67) пг/мл), MPO (30,14 (26,17-40,76) пг/мл), PAI-1 (25 (23-27) нг/мл) и СРБ (0,5 (0,4-0,6) мг/мл), а также рост концентрации VEGF (159,02 (139,48-187,23) пг/мл) и не выявлено изменений в концентрации FGF (15,43 (14,88-16,11) пг/мл) по сравнению с третьими сутками после вмешательства. Концентрации MPO (30,14 (26,17-40,76) пг/мл), PAI-1 и СРБ были статистически значимо (p<0,05) ниже по сравнению со всеми группами животных, концентрация VEGF была статистически значимо выше по сравнению с контрольной группой, а концентрация TIMP-1 была статистически значимо (p<0,05) ниже по сравнению группами животных после внутрибрюшного введения Перфторана и Мезогеля. На четырнадцатые сутки после интраперитонеального введения Мирамистина наблюдалось снижение концентрации PAI-1 (14 (14-18)) по сравнению с седьмыми сутками после вмешательства, когда концентрация PAI-1 была статистически значимо (p<0,05) ниже по сравнению со всеми группами животных. Не наблюдалось различий (p>0,05) в показателях концентрации VEGF (162,45 (125,40-188,55) пг/мл) по сравнению с данной группой животных на седьмые сутки после вмешательства, а также по сравнению с контрольной группой и группой животных после внутрибрюшного введения Перфторана, но концентрация VEGF была статистически значимо (p<0,05) выше по сравнению с группой животных после внутрибрюшного введения Мезогеля. Не выявлено различий (p>0,05) в концентрации MPO (29,84 (26,25-36,15) пг/мл) на четырнадцатые сутки по сравнению со всеми группами животных. Концентрации TIMP-1 (6,45 (4,84-17,34) пг/мл) и FGF (15,76 (14,72-16,05) пг/мл) были статистически значимо (p<0,05) ниже по сравнению со всеми группами животных на четырнадцатые сутки после вмешательства, а концентрация СРБ (0,3 (0,2-0,4) мг/мл) была статистически значимо ниже по сравнению с группой животных после внутрибрюшного введения Перфторана (рис. 9).
При изучении концентрации iNOS в различные сроки после моделирования спаечной болезни брюшной полости, не было выявлено различий во всех группах животных на третьи, седьмые сутки после вмешательства (рис. 10).

Рисунок 10. Уровень сывороточной концентрации iNOS в различные сроки после моделирования спаечной болезни брюшной полости и применения различных противоспаечных средств. * - различия статистически значимы (p<0,05) по сравнению с контрольной группой (U-критерий Манна-Уитни); ° - различия статистически значимы (p<0,05) по сравнению с группой животных с применением Перфторана (U-критерий Манна-Уитни); ^ - различия статистически значимы (p<0,05) по сравнению с группой животных с применением Мезогеля (U-критерий Манна-Уитни); # - различия статистически значимы (p<0,05) по сравнению с аналогичным показателем на 7-е сутки после вмешательства (U-критерий Манна-Уитни).
Однако на четырнадцатые сутки в группе животных с интраперитонеальным введением Мирамистина выявлено статистически значимое увеличение концентрации iNOS на четырнадцатые сутки после операции по сравнению со всеми группами животных (рис. 10).
ВЫВОДЫ
- Внутрибрюшное введение Перфторана при моделировании образования спаек после внутрибрюшных операций позволяет вызвать спаечный процесс брюшной полости в 100% случаев, и является надежным и воспроизводимым способом моделирования спаечной болезни в эксперименте.
- Внутрибрюшное введение Мирамистина статистически значимо уменьшает частоту и выраженность образования спаек брюшной полости после внутрибрюшных операций и сопровождается уменьшением толщины грануляционного вала, по сравнению с контролем (p<0,05), морфологически спайки представлены соединительной тканью обладающей диффузной экспрессией гладкомышечного актина с экспрессией коллагена III типа и отсутствием экспрессии коллагена I типа.
- Внутрибрюшное введение поверхностно-активного вещества способствует уменьшению концентрации TIMP-1, MPO, PAL-1, СРБ на протяжении всего исследования и увеличению концентрации iNOS к 14 суткам постоперационного периода (p<0,05).
- Внутрибрюшное применение Мирамистина является эффективным методом профилактики СББП после внутрибрюшных операций (частота образовавшихся спаек составила 10%).
- Внутрибрюшное применение Мирамистина статистически значимо уменьшает частоту и выраженность СББП по сравнению с препаратом Мезогель (p<0,05) и является более эффективным противоспаечным средством.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ
- Уровень TIMP-1 плазмы крови необходимо использовать для прогнозирования развития образования спаек брюшной полости после внутрибрюшных операций и оценки эффективности противоспаечной терапии.
- Провести клиническое испытание препарата Мирамистин как профилактического средства против образования спаек брюшной полости после внутрибрюшных операций.
- Разработанный способ моделирования спаечной болезни брюшной полости целесообразно использовать в экспериментах по изучению послеоперационной спаечной непроходимости.
Список работ, опубликованных по теме диссертации
- С.Э.Восканян, П.С.Кызласов Патогенез образования спаек после внутрибрюшных операций // Патологическая Физиология и экспериментальная терапия. – 2011. – №4. – С. 17-21.
- С.Э.Восканян, П.С.Кызласов Профилактика спаечной болезни брюшной полости – современное состояние проблемы // Вестник хирургии им. Грекова. – 2011. – №5. – С 93-96.
- С.Э.Восканян, П.С.Кызласов Новое в профилактике спайкообразования после внутрибрюшных операций // Материалы XI съезда хирургов российской федерации. – Волгоград, 2011. – С. 79.
- S.E.Voskanyan, P.S.Kyzlasov New in the prevention of adhesions formation after intra-abdominal operations // Hepato-gastroenterology/ – Supplement 1. – 2011. – Vol. 58. – P. 199.
- S.E.Voskanyan, P.S.Kyzlasov The use of surface-active substances in the prevention of adhesive disease // Hepato-gastroenterology. Supplement 1. – 2012. – Vol. 59. – P. 158.
- П.С.Кызласов, С.Э.Восканян, О.В.Паклина Реакция тканей брюшины при экспериментальном повреждении на фоне применения мирамистина // Клеточная трансплантология и тканевая инженерия. – 2013. – Т. 8. - №1. – С. 72-75.
- П.С.Кызласов, С.Э. Восканян Применение мирамистина в профилактике спайкообразования после внутрибрюшных операций // Материалы II конгресса урологов Сибири с международным участием. – Томск, 2013. – С. 88-89.
- П.С.Кызласов, С.Э.Восканян Мирамистин в профилактике спайкообразования после внутрибрюшных операций // Материалы III съезда хирургов Юга России с международным участием. – Астрахань, 2013. – С. 58-59.
Заявка на изобретение
- Котенко К.В., Восканян С.Э., Кызласов П.С. Способ профилактики спаечной болезни брюшной полости после внутрибрюшных операций. Приоритетная справка №20121139471 от 17.09.2012.
Список сокращений
ИГХ – иммуногистохимия
ИФА – иммуноферментный анализ
СББП – спаечная болезнь брюшной полости
СРБ – С-реактивный белок
FGF – фактор роста фибробластов
VEGF – фактор роста сосудистого эндотелия
PAI – ингибитор активатора плазминогена
iNOS – индуцибельная синтаза оксида азота
TIMP – тканевой ингибитор металлопротеиназы
tPA – тканевой активатор профибринолиза
MMP – металлопротеиназа
MPO – миелопероксидаза

